ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 10, с. 1056-1062
УДК 547.239
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ
МОЧЕВИН И ИХ ИЗОСТЕРИЧЕСКИХ АНАЛОГОВ,
СОДЕРЖАЩИХ ПОЛИЦИКЛИЧЕСКИЕ ФРАГМЕНТЫ:
XV.1 1,1'-(АЛКИЛ-1,N-ДИИЛ)БИС[3-(АДАМАНТАН-
1-ИЛ)]СЕЛЕНОМОЧЕВИНЫ
© 2022 г. Я. П. Кузнецовa, Д. А. Питушкинb, В. В. Бурмистровa, Г. М. Бутовa, b, *
a ФГБОУ ВО «Волгоградский государственный технический университет» ВолгГТУ,
Россия, 400005 Волгоград, просп. Ленина, 28
b ФГБОУ ВО «Волжский политехнический институт» (филиал) ВолгГТУ,
Россия, 404121 Волжский, ул. Энгельса, 42а
*e-mail: butov@post.volpi.ru
Поступила в редакцию 07.12.2021 г.
После доработки 18.12.2021 г.
Принята к публикации 27.12.2021 г.
Реакцией (адамантан-1-ил)изоселеноцианата с алифатическими диаминами синтезирована серия
1,1'-(алкил-1,n-диил)бис[3-(адамантан-1-ил)]селеномочевин c выходом 27-84%. Температура плавления
полученных соединений составляет 105-164°C, что на ~ 80°C ниже уровня их изостерических аналогов
с уреидной группой. 1,1'-(Алкил-1,n-диил)бис[3-(адамантан-1-ил)]селеномочевины являются перспек-
тивными ингибиторами растворимой эпоксидгидролазы человека hsEH.
Ключевые слова: адамантил, изоселеноцианат, селеномочевина, селен, растворимая эпоксидгидролаза,
hsEH
DOI: 10.31857/S0514749222100020, EDN: JVCAGQ
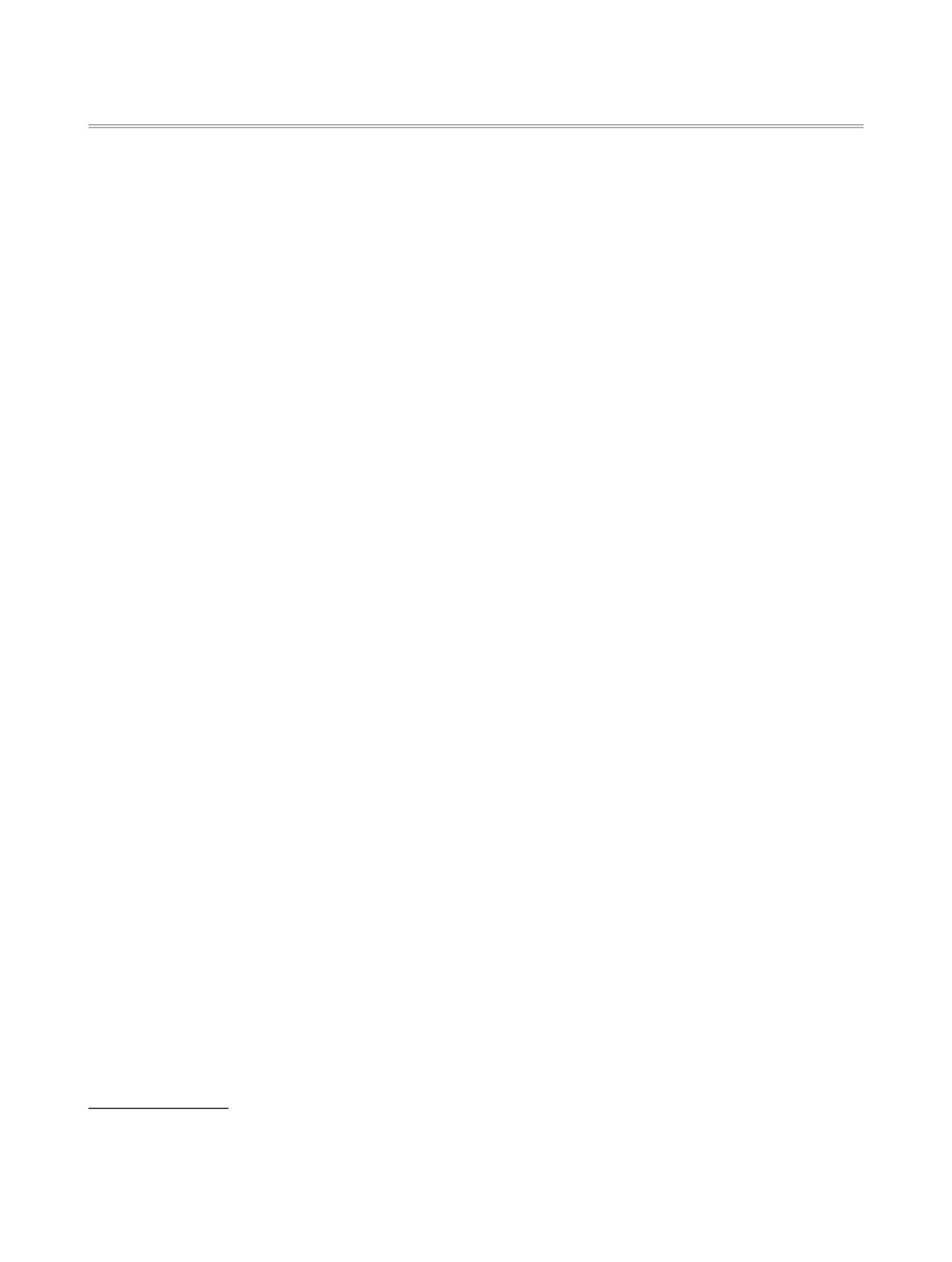
ВВЕДЕНИЕ
(рис. 1, d) и ее производные находят приме-
нение как противораковые препараты
[9,
10].
Селеномочевины, как и их кислородсодержа-
Соединения, содержащие сразу 2 селеноуреидные
щие аналоги, находят применение в медицинской
группы (рис. 1, b), испытываются в качестве хи-
химии. Так 4-[3-(4-фторфенил)селеноуреидо]бен-
ральных сенсоров [11].
золсульфамид (рис. 1, а) и его производные из-
учаются как ингибиторы карбоангидразы-IX
1,3-Дизамещенные мочевины и тиомочевины,
[2-4] и как средство против лейшманиоза [5].
содержащие фрагменты адамантана, являются
Аналогичную активность проявляют и дисе-
мощными ингибиторами растворимой эпоксидги-
лениды, содержащие селеноуреидную группу
дролазы (hsEH) [12]. Ингибирование sEH в свою
(рис. 1, b) [6, 7]. N-(Фенилкарбамоселеноил)фу-
очередь позволяет проводить успешную терапию
ран-2-карбоксамид (рис. 1, c) проявил активность
ряда социально значимых заболеваний почек,
в отношении клеток аденокарциномы шейки мат-
сердечно-сосудистой системы и сахарного диабе-
ки человека (HeLa S3) [8]. 1-(3-Фторбензоил)-
та [13-15]. В связи с этим представляет интерес
3-(4-ферроценил-3-метилфенил)селеномочевина
синтез и исследование биологической активности
1,3-дизамещенных диселеномочевин, содержащих
1 Сообщение XIV см. [1].
фрагмент адамантана.
1056
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : XV
1057
a
b
H
H
N
N
H
H
R
N
N
Se
Se
R
Se
Se
Se
SO
2NH2
R
N
N
H
H
R = ɩ-F, ɨ-F, ɨ-Cl.
R = ɧ-Bu, Ph, ɩ-Ph-CH3.
c
d
Se
O
O Se
N
H N
O
H
F
N
N
Fe
H
H
e
X
X
(CH2)n
N
N
N
N
H
H
H
H
n = 2-10; X = O, S.
Рис. 1. Известные селеномочевины и 1,1'-(алкил-1,n-диил)бис[3-(адамантан-1-ил)]мочевины и тиомочевины, обладающие
биологической активностью
Ранее нами были получены 1,1'-(алкил-1,n-ди-
К образовавшемуся на первой стадии промежу-
ил)бис[3-(адамантан-1-ил)]мочевины
[16] и их
точному адамантилизонитрилу in situ прибавля-
тиоаналоги (рис. 1, e) [17], проявившие высокую
ли элементарный селен. После фильтрации через
активность при ингибировании hsEH. В этой связи
слой силикагеля органический слой отделяли и
несомненный интерес представляет изостериче-
упаривали. Изоселеноцианат 2 очищали перекри-
ская замена атома халькогена на атом Se в указан-
сталлизацией из этанола.
ной серии, как с точки зрения оценки их актив-
Проведение реакции с выделением изонитрила
ности ингибирования, в том числе фосфатазного
приводит к снижению выхода целевого изоселено-
домена hsEH, так и изменения важных физико-хи-
цианата на ~ 20-30%.
мических свойств.
Изонитрил был выделен в чистом виде и оха-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
рактеризованы методом ГХ-МС {Ad-NC [m/z (I,
%): 161 (38); 135 (100); 119 (10); 104 (18); 91 (31);
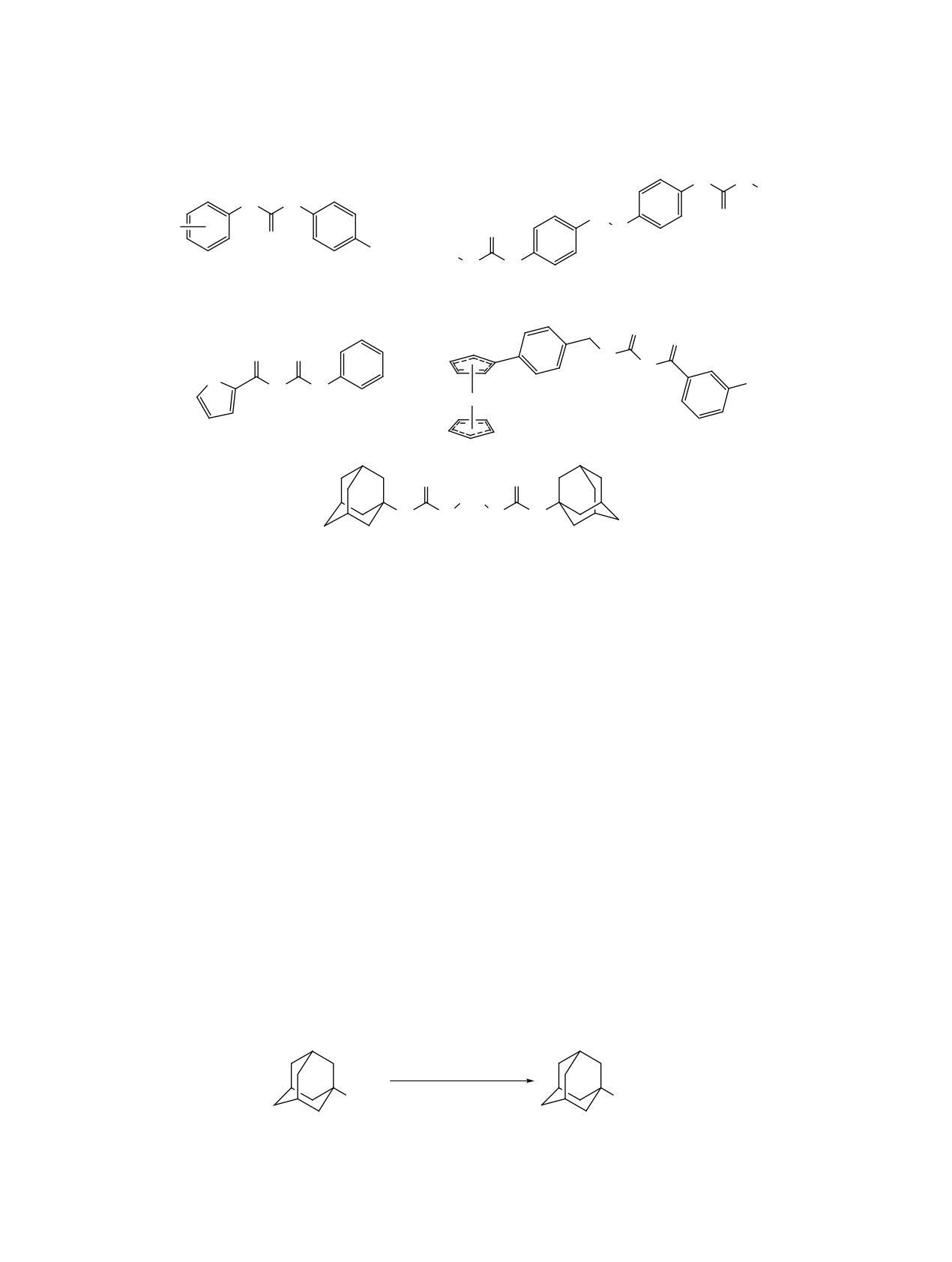
Адамантилизоселеноцианат
(2) был синте-
79 (50); 67 (10); 53 (9); 41 (14); τудерж = 9.338 мин]}.
зирован из адамантиламина (1) one-pot методом
(схема 1), включающим 2 стадии [18]. На пер-
Изоселеноцианат 2 вводили в реакцию с диами-
вой стадии воздействовали на амин 1 в CH2Cl2
нами 3a-i для получения серии 1,1'-(алкил-1,n-ди-
50%-ным раствором NaOH и CHCl3 в присутствии
ил)бис[3-(адамантан-1-ил)]селеномочевин
4a-i
катализатора межфазного переноса Aliquat 336.
(схема 2). Реакцию проводили в среде диэтилового
Схема 1
1. CHCl3, 50% NaOH
CH2Cl2, Aliquat 336
2. Se
NH2
NCSe
1
2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
1058
КУЗНЕЦОВ и др.
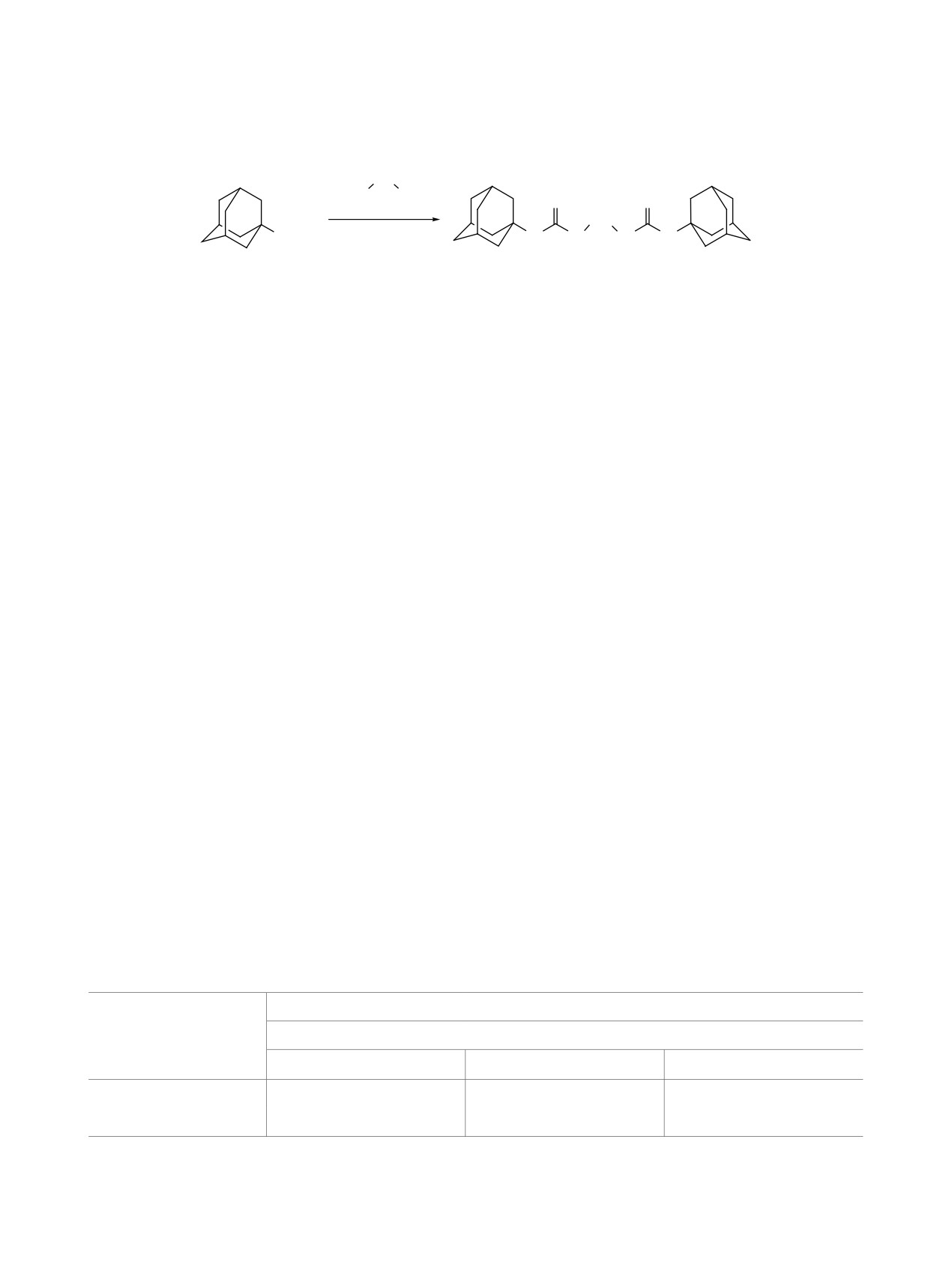
Схема 2
(CH2)n
H2N
NH2
Se
Se
3a-i
(CH2)n
Et2O, Et3N
NCSe
N
N
N
N
H
H
H
H
2
4a-i
n = 2 (4a, 57%, log P 6.35); 3 (4b, 81%, log P 6.62); 4 (4c, 64%, log P 6.89);
5 (4d, 44%, log P 7.39); 6 (4e, 67%, log P 7.90); 7 (4f, 27%, log P 8.34);
8 (4g, 28%, log P 8.65); 9 (4h, 53%, log P 8.88); 10 (4i, 84%, log P 9.07).
эфира в присутствии эквимолярного количества
ма кислорода халькогена на атом селена способ-
триэтиламина при комнатной температуре в тече-
ствует повышению липофильности (log P).
ние 8 ч.
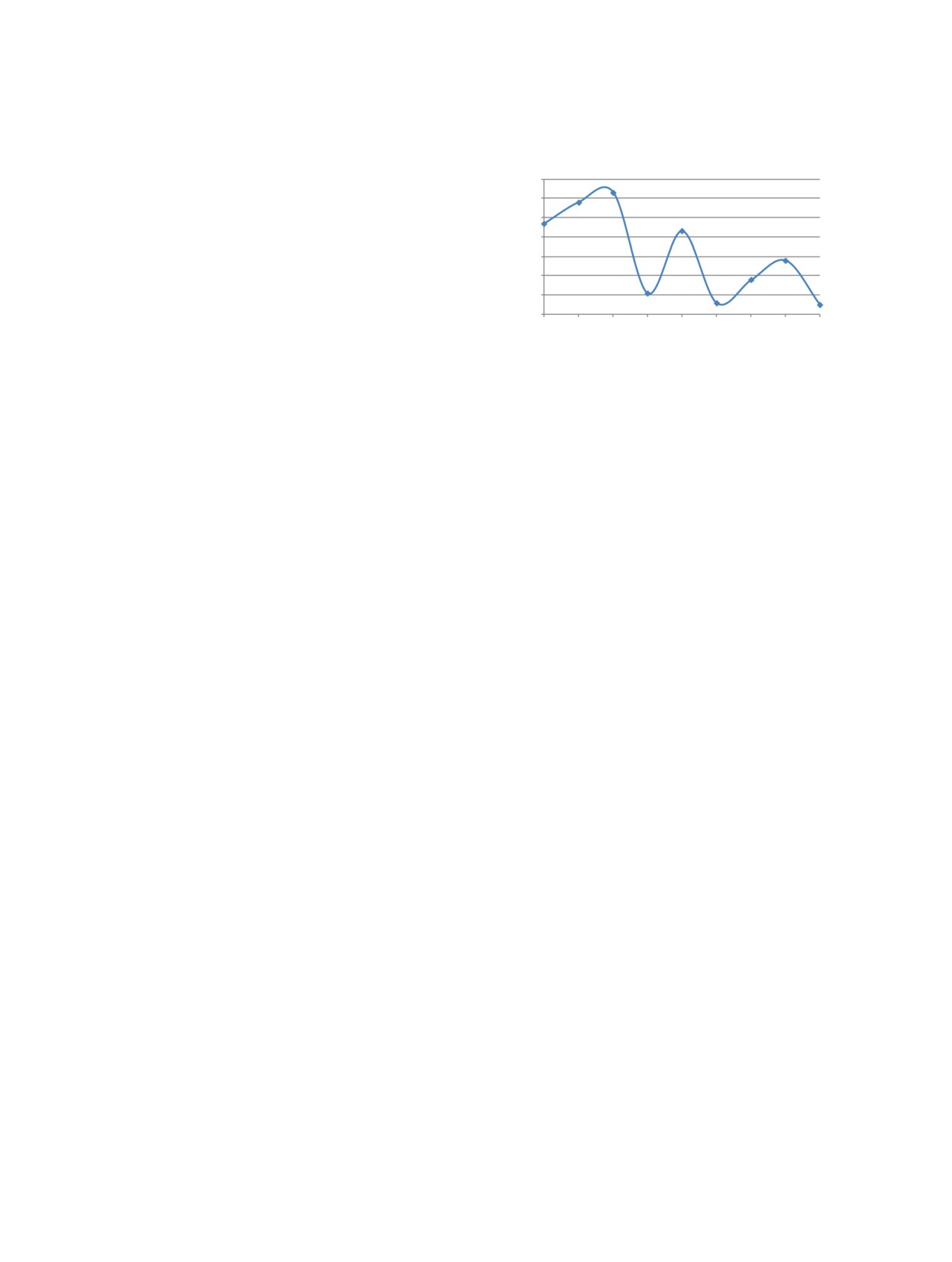
Зависимость температуры плавления диселено-
После перемешивания эфир упаривали. К
мочевин от числа n представлена на рис. 2.
остатку прибавляли 0.1 н HCl и перемешивали в
Температура плавления диселеномочевин 4a-i
течение 30 мин. Образовавшийся осадок отфиль-
находится в пределах 105-164°C с зигзагообраз-
тровывали и сушили в вакууме.
ной тенденцией к снижению температуры с ро-
Структуру полученных соединений подтвер-
стом метиленового спейсера, соединяющего 2 се-
ждали методом ЯМР-спектроскопии 1H и 13C (со-
леноуреидные группы. Подобное явление ранее
единение 4е). В спектрах ЯМР 1H соединений 4a-i
наблюдалось в серии О- и S-димочевин анало-
присутствует 2 характерных сигнала протонов
гичного строения. Температура плавления соеди-
NH мочевинной группы. Сигнал в области 7.25-
нения 4с на 88°C ниже, чем O-аналога [16], и на
7.42 м.д. соответствует протону NH-группы,
56°C выше, чем S-аналога [17].
ближней к адамантильному фрагменту. Сигнал в
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
области 7.53-7.65 м.д. соответствует протону NH-
группы, связанной с метиленовым мостиком. С
Исходные триэтиламин (BioUltra ≥ 99.5%, CAS
увеличением длины мостика оба сигнала незначи-
121-44-8), 1,2-диаминоэтан (≥ 99%, CAS 107-15-3),
тельно смещаются в более сильное поле.
1,3-диаминопропан (≥ 99%, CAS 109-76-2), 1,4-ди-
аминобутан (99%, CAS 110-60-1), 1,5-диамино-
Изостерическая замена атома O или S на атом
Se в структурных аналогах соединения 4с сме-
пентан (≥ 97%, CAS 462-94-2), 1,6-диаминогексан
щает сдвиги протонов NH в более слабое поле
(98%, CAS 124-09-4), 1,7-диаминогептан (98%,
(см. таблицу).
CAS 646-19-5), 1,8-диаминооктан (98%, CAS 373-
44-4), 1,10-диаминодекан (97%, CAS 646-25-3)
Рассчитанный коэффициент липофильности
производства фирмы «Sigma-Aldrich»; 1,9-диами-
log P для соединений 4a-i находится в пределах
нононан (98%, CAS 646-24-2) производства фир-
6.35-9.07. По сравнению с аналогичными соеди-
мы «Alfa Aesar» использовали без очистки.
нениями, содержащими уреидную группу, коэф-
фициент липофильности полученных соединений
Синтез всей серии диселеномочевин проводи-
выше на 1.32 единицы. Таким образом, замена ато-
ли одновременно на шейкере Heidolph Multi Reax,
Химические сдвиги протонов NH в зависимости от атома халькогена в группе NH-C(X)-NH
Химический сдвиг 1Н, м.д.
Связь
Атом халькогена Х
O [16]
S [17]
Se
Н-N1
5.42
5.95
7.27
Н-N2
5.61
6.04
7.56
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : XV
1059
снабженном насадкой для установки 26 пробирок,
ɬ ɩɥ
°C
в полипропиленовых пробирках (типа Фалькон)
170
объемом 10 мл.
160
150
Коэффициент липофильности (log P) рас-
140
считан с помощью программы Molinspiration
130
© Molinspiration
120
Cheminformatics.
110
Строение полученных соединений подтвер-
100
2
3
4
5
6
7
8
9
10
n
ждали с помощью ЯМР 1Н и 13C спектроскопии,
Рис. 2. Зависимость температуры плавления т.пл. ди-
хроматомасс-спектрометрии и элементного ана-
селеномочевин от числа метиленовых групп n
лиза. Масс-спектры регистрировали на хромато-
10.07. C25H40N4Se2. Вычислено, %: С 54.15; Н
масс-спектрометре «Agilent GC 7820A/MSD 5975»
7.27; N 10.10. М 554.54.
(Agilent Technologies, США). Спектры ЯМР 1Н
и 13C выполнены на Bruker Avance 600 (Bruker
1,1'-(Бутан-1,4-диил)бис[3-(адамантан-1-ил)-
Corporation, США) в растворителе ДМСО-d6; хи-
селеномочевина] (4c). Получена аналогично со-
мические сдвиги
1H приведены относительно
единению 4a из 0.2 г соединения 2 и 0.036 г 1,4-ди-
SiMe4. Элементный анализ выполнен на приборе
аминобутана (3c). Выход 0.1503 г (64%), т.пл.
«Perkin-Elmer Series II 2400» (Perkin-Elmer, США).
163-164°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
Температуры плавления определены на прибо-
1.47-1.63 м (4H, CH2-CH2-CH2-CH2), 1.56-1.66 м
ре OptiMelt MPA100 (Stanford Research Systems,
(12H, Ad), 2.03 c (6H, Ad), 2.13 с (12H, Ad), 3.50
США).
уш.с (4H, 2NH-CH2), 7.27 уш.с (2H, 2NH), 7.56
уш.с (2H, 2NH). Найдено, %: С 54.90; Н 7.48; N
1,1'-(Этан-1,2-диил)бис[3-(адамантан-1-ил)-
9.90. C26H42N4Se2. Вычислено, %: С 54.92; Н 7.45;
селеномочевина] (4a). К 0.2 г (0.83 ммоль) ада-
N 9.85. М 568.57.
мантилизоселеноцианата (2) в 5 мл безводного ди-
этилового эфира прибавляли 0.025 г (0.416 ммоль)
1,1'-(Пентан-1,5-диил)бис[3-(адамантан-1-
1,2-диаминоэтана (3a) и 0.1 мл триэтиламина.
ил)селеномочевина] (4d). Получена аналогично
Реакционную смесь перемешивали на шейкере в
соединению 4a из 0.2 г соединения 2 и 0.0425 г
течение 8 ч, после чего эфир упаривали. К остатку
1,5-диаминопентана (3d). Выход 0.105 г (44%),
прибавляли 10 мл 0.1 н HCl и перемешивали в те-
т.пл. 111-112°C. Спектр ЯМР 1Н (ДМСО-d6), δ,
чение 30 мин. Образовавшийся осадок отфильтро-
м.д.: 1.30 с (2H, CH2-CH2-CH2-CH2-CH2), 1.47-
вывали и сушили в вакууме. Выход 0.127 г (57%),
1.63 м (4H, CH2-CH2-CH2-CH2-CH2), 1.56-1.66 м
т.пл. 147-148°C. Спектр ЯМР 1Н (ДМСО-d6), δ,
(12H, Ad), 2.03 c (6H, Ad), 2.13 с (12H, Ad), 3.50
м.д.: 1.59-1.65 м (12H, Ad), 1.99-2.09 м (12H, Ad),
уш.с (4H, 2NH-CH2), 7.26 уш.с (2H, 2NH), 7.54
2.16 с (6H, Ad), 3.60 уш.с (4H, 2NH-CH2), 7.42
уш.с (2H, 2NH). Найдено, %: С 55.70; Н 7.57; N
уш.с (2H, 2NH), 7.65 уш.с (2H, 2NH). Найдено, %:
9.60. C27H44N4Se2. Вычислено, %: С 55.66; Н 7.61;
С 53.35; Н 7.10; N 10.40. C24H38N4Se2. Вычислено,
N 9.62. М 582.60.
%: С 53.33; Н 7.09; N 10.37. М 540.52.
1,1'-(Гексан-1,6-диил)бис[3-(адамантан-1-
1,1'-(Пропан-1,3-диил)бис[3-(адамантан-1-
ил)селеномочевина] (4e). Получена аналогично
ил)селеномочевина] (4b). Получена аналогично
соединению 4a из 0.2 г соединения 2 и 0.0483 г
соединению 4a из 0.2 г соединения 2 и 0.0308 г
1,6-диаминогексана (3e). Выход 0.167 г (67%),
1,3-диаминопропана (3b). Выход 0.186 г (81%),
т.пл. 143-144°C. Спектр ЯМР 1Н (ДМСО-d6), δ,
т.пл. 158-159°C. Спектр ЯМР 1Н (ДМСО-d6), δ,
м.д.: 1.26 с (4H, CH2-CH2-CH2-CH2-CH2-CH2),
м.д.: 1.56-1.66 м (12H, Ad), 1.67-1.74 м (2H, CH2-
1.47-1.63 м (4H, CH2-CH2-CH2-CH2-CH2-CH2),
CH2-CH2), 2.03 c (6H, Ad), 2.13 с (12H, Ad), 3.51
1.56-1.66 м (12H, Ad), 2.01 c (6H, Ad), 2.12 с
уш.с (4H, 2NH-CH2), 7.28 уш.с (2H, 2NH), 7.58
(12H, Ad), 3.50 уш.с (4H, 2NH-CH2), 7.22 уш.с
уш.с (2H, 2NH). Найдено, %: С 54.18; Н 7.30; N
(2H, 2NH), 7.50 уш.с (2H, 2NH). Спектр ЯМР 13C
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
1060
КУЗНЕЦОВ и др.
(ДМСО-d6), δ, м.д.: 15.62 (2C, 2CH2), 29.52 с (2C,
1,10-диаминодекана (3i). Выход 0.229 г (84%), т.пл.
Ad), 26.62 (2C, 2CH2), 29.67 c (Ad), 31.29 c (2C,
105-106°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
Ad), 36.61 c (2C, Ad), 41.60 c (2C, Ad), 44.88 c (Ad),
1.26 с (12H, CH2-CH2-CH2-CH2-CH2-CH2-CH2-
46.36 (2C, 2CH2). Найдено, %: С 56.35; Н 7.80; N
CH2-CH2-CH2), 1.47-1.63 м (4H, CH2-CH2-CH2-
9.35. C28H46N4Se2. Вычислено, %: С 56.37; Н 7.77;
CH2-CH2-CH2-CH2-CH2-CH2-CH2), 1.56-1.66 м
N 9.39. М 596.62.
(12H, Ad), 2.03 c (6H, Ad), 2.13 с (12H, Ad), 3.50
уш.с (4H, 2NH-CH2), 7.25 уш.с (2H, 2NH), 7.53
1,1'-(Гептан-1,7-диил)бис[3-(адамантан-1-
уш.с (2H, 2NH). Найдено, %: С 58.90; Н 8.30; N
ил)селеномочевина] (4f). Получена аналогично
8.55. C32H54N4Se2. Вычислено, %: С 58.88; Н 8.34;
соединению 4a из 0.2 г соединения 2 и 0.0542 г
N 8.58. М 652.73.
1,7-диаминогептана (3f). Выход 0.069 г (27%), т.пл.
106-107°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
ЗАКЛЮЧЕНИЕ
1.30 с (6H, CH2-CH2-CH2-CH2-CH2-CH2-CH2),
В мягких условиях получена серия 1,1'-(ал-
1.47-1.63 м (4H, CH2-CH2-CH2-CH2-CH2-CH2-
кил-1,n-диил)бис[3-(адамантан-1-ил)селеномоче-
CH2), 1.56-1.66 м (12H, Ad), 2.03 c (6H, Ad), 2.13 с
вин]. Температура плавления синтезированных
(12H, Ad), 3.50 уш.с (4H, 2NH-CH2), 7.24 уш.с (2H,
соединений находится ниже уровня температуры
2NH), 7.51 уш.с (2H, 2NH). Найдено, %: С 57.00; Н
плавления их изостерических аналогов с уреидной
7.92; N 9.15. C29H48N4Se2. Вычислено, %: С 57.04;
группой на ~ 80°C. Полученные соединения будут
Н 7.92; N 9.18. М 610.65.
исследованы в качестве ингибиторов эпоксидги-
1,1'-(Октан-1,8-диил)бис[3-(адамантан-1-
дролазного и фосфатазного доменов растворимой
ил)селеномочевина]
(4g). Получена аналогич-
эпоксидгидролазы человека.
но соединению 4a из 0.2 г соединения 2 и 0.06 г
ФОНДОВАЯ ПОДДЕРЖКА
1,8-диаминооктана (3g). Выход 0.073 г (28%),
т.пл. 118-119°C. Спектр ЯМР 1Н (ДМСО-d6), δ,
Исследование выполнено при финансовой под-
м.д.: 1.27 с (8H, CH2-CH2-CH2-CH2-CH2-CH2-
держке РФФИ в рамках научного проекта № 20-
CH2-CH2), 1.47-1.63 м (4H, CH2-CH2-CH2-CH2-
03-00298.
CH2-CH2-CH2-CH2), 1.56-1.66 м (12H, Ad), 2.03
ИНФОРМАЦИЯ ОБ АВТОРАХ
c (6H, Ad), 2.13 с (12H, Ad), 3.50 уш.с (4H, 2NH-
CH2), 7.22 уш.с (2H, 2NH), 7.49 уш.с (2H, 2NH).
Ярослав Петрович Кузнецов, ORCID: https://
Найдено, %: С 57.65; Н 8.10; N 9.00. C30H50N4Se2.
orcid.org/0000-0002-1933-2684
Вычислено, %: С 57.68; Н 8.07; N 8.97. М 624.68.
Дмитрий Андреевич Питушкин, ORCID: https://
1,1'-(Нонан-1,9-диил)бис[3-(адамантан-1-
orcid.org/0000-0002-5441-9291
ил)селеномочевина] (4h). Получена аналогично
Владимир Владимирович Бурмистров, ORCID:
соединению 4a из 0.2 г соединения 2 и 0.0658 г
1,9-диаминононана (3h). Выход 0.139 г (53%),
т.пл. 128-129°C. Спектр ЯМР 1Н (ДМСО-d6), δ,
Геннадий Михайлович Бутов, ORCID: https://
м.д.: 1.25 с (10H, CH2-CH2-CH2-CH2-CH2-CH2-
orcid.org/0000-0002-0839-4513
CH2-CH2-CH2), 1.47-1.63 м (4H, CH2-CH2-CH2-
КОНФЛИКТ ИНТЕРЕСОВ
CH2-CH2-CH2-CH2-CH2-CH2), 1.56-1.66 м (12H,
Ad), 2.03 c (6H, Ad), 2.13 с (12H, Ad), 3.50 уш.с
Авторы заявляют об отсутствие конфликта ин-
(4H, 2NH-CH2), 7.23 уш.с (2H, 2NH), 7.50 уш.с
тересов.
(2H, 2NH). Найдено, %: С 58.33; Н 8.25; N 8.75.
СПИСОК ЛИТЕРАТУРЫ
C31H52N4Se2. Вычислено, %: С 58.30; Н 8.21; N
1. Бурмистров В.В., Мохов В.М., Данилов Д.В., Фай-
8.77. М 638.71.
зуллин Р.Р., Бутов Г.М. ЖОрХ. 2022, 58, 235-247.
1,1'-(Декан-1,10-диил)бис[3-(адамантан-1-
[Burmistrov V.V., Mokhov V.M., Danilov D.V.,
ил)селеномочевина] (4i). Получена аналогично
Fayzullin R.R., Butov G.M. Russ. J. Org. Chem. 2022,
соединению 4a из 0.2 г соединения 2 и 0.0716 г
58, 259-267.] doi 10.1134/S1070428022030022
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : XV
1061
2. Angeli A., Ferraroni M., Da’dara A.A., Selleri S.,
Photobiol. B.
2015,
148,
197-208. doi
10.1016/
Pinteala M., Carta F., Skelly P.J., Supuran C.T.
j.jphotobiol.2015.04.024
J. Med. Chem. 2021, 64, 10418-10428. doi 10.1021/
11. Bian G., Yang S., Huang H., Zong H., Song L., Fan H.,
acs.jmedchem.1c00840
Sun X. Chem. Sci. 2016, 7, 932-938. doi 10.1039/
3. Ciccone V., Filippelli A., Angeli A., Supuran C.T.,
C5SC03780H
Morbidelli L. Int. J. Mol. Sci. 2020, 21, 2983. doi
12. Hwang S.H., Wecksler A.T., Zhang G., Morisseau C.,
10.3390/ijms21082983
Nguyen L.V., Fu S.H., Hammock B.D. Bioorg. Med.
4. Genah S., Angeli A., Supuran C.T., Morbidelli L.
Chem. Lett.
2013,
23,
3732-3737. doi
10.1016/
Pharmacol. Res. 2020, 159, 104964. doi 10.1016/
j.bmcl.2013.05.011
j.phrs.2020.104964
13. Wagner K.M., McReynolds C.B., Schmidt W.K.,
5. Al-Tamimia A.M.S., Etxebeste-Mitxeltorena M.,
Hammock B.D. Pharmacol. Ther. 2017, 180, 62-76.
Sanmartín C., Jiménez-Ruiz A., Syrjänen L., Parkkil-
doi 10.1016/j.pharmthera.2017.06.006
a S., Selleri S., Carta F., Angeli A., Supuran C.T.
14. Inceoglu B., Jinks S.L., Ulu A., Hegedus C.M., Geor-
Bioorg. Chem.
2019,
86,
339-345. doi
10.1016/
gi K., Schmelzer K.R., Wagner K., Jones P.D., Moris-
j.bioorg.2019.01.069
seau C., Hammock B.D. Proc. Natl. Acad. Sci. 2008,
6. Díaz M., Palop J.A., Sanmartín C., Lizarraga E. J.
105, 18901-18906. doi 10.1073/pnas.0809765105
Therm. Anal. Calorim. 2017, 127, 1663-1674. doi
15. Fleming I., Rueben A., Popp R., Fisslthaler B., Sch-
10.1007/s10973-016-5645-x
rodt S., Sander A., Haendeler J., Falck J.R., Moris-
7. Díaz M., de Lucio H., Moreno E., Espuelas S., Aydil-
seau C., Hammock B.D., Busse R. Arterioscler.
lo C., Jiménez-Ruiz A., Toro M.Á., Gutiérrez K.J.,
Thromb Vasc. Biol. 2007, 27, 2612-2618. doi 10.1161/
Martínez-Merino V., Cornejo A., Palop J.A., Sanmar-
ATVBAHA.107.152074
tín C., Plano D. Antimicrob. Agents Chemother. 2019,
63. doi 10.1128/AAC.02200-18
16. Burmistrov V., Morisseau C., Harris T.R., Butov G.,
8. Musthafa M., Konakanchi R., Ganguly R., Balachand-
Hammock B.D. Bioorg. Chem. 2018, 76, 510-527. doi
10.1016/j.bioorg.2017.12.024
ran C.,Aoki S., SreekanthA. J. Biomol. Struct. Dyn. 2021,
39, 4346-4361. doi 10.1080/07391102.2020.1778531
17. Burmistrov V., Morisseau C., Pitushkin D., Karlov D.,
9. Hussain R.A., Badshah A., Tahir M.N., Lal B.,
Fayzullin R.R., Butov G.M., Hammock B.D. Bioorg.
Khan I.A. Austral. J. Chem. 2013, 66, 626-634. doi
Med. Chem. Lett. 2018, 28, 2302-2313. doi 10.1016/
10.1071/CH12570
j.bmcl.2018.05.024
10. Hussain R.A., Badshah A., Pezzuto J.M., Ah-
18. Zakrzewski J., Huras B., Kiekzewska A. Synthesis.
med N., Kondratyuk T.P., Park E.J. J. Photochem.
2016, 48, 85-96. doi 10.1055/s-0035-1560481
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
1062
КУЗНЕЦОВ и др.
Synthesis and Properties of 1,3-Disubstituted Ureas
and its Isosteric Analogs Containing Polycyclic Fragments:
XV. Synthesis and Properties
of 1,1'-(Alkyl-1,n-diyl)bis(3-(adamantan-1-yl)selenoureas
Y. P. Kuznetsova, D. A. Pitushkinb, V. V. Burmistrova, and G. M. Butova, b, *
a Volgograd state technical university (VSTU), prosp. Lenina, 28, Volgograd, 400005 Russia
b Volzhsky polytechnic institute (branch) VSTU, ul. Engelsa, 42a, Volzhsky, 404121 Russia
*e-mail: butov@post.volpi.ru
Received December 7, 2021; revised December 18, 2021; accepted December 27, 2021
The reaction of (adamantan-1-yl) isoselenocyanate with aliphatic diamines led to a series of 1,1'-(alkyl-1,n-diyl)-
bis[3-(adamantan-1-yl)] selenoureas in 27-84% yield. Compounds mp are 105-164°C, which is ~ 80°C lower
than the mp of their isosteric analogs with a urea group. 1,1'-(Alkyl-1,n-diyl)bis[3-(adamantan-1-yl)] selenoureas
are promising soluble human epoxide hydrolase (hsEH) inhibitors.
Keywords: isoselenocyanate, selenourea, selenium, soluble epoxide hydrolase, sEH
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022