ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 10, с. 1071-1079
УДК 547.833 + 547.59
СИНТЕЗ И АНТИМОНОАМИНОКСИДАЗНАЯ
АКТИВНОСТЬ 2-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ
4,4-ДИМЕТИЛ-1,2,3,4-ТЕТРАГИДРОИЗОХИНОЛИНА
© 2022 г. А. А. Агекян*, Ж. С. Арустамян, Р. Э. Маркарян, Г. А. Паносян,
A. С. Григорян, Г. В. Гаспарян
Научно-технологический центр органической и фармацевтической химии НАН Республики Армения,
Армения, 0014 Ереван, просп. Азатутян, 26
*е-mail: aaghekyan@mail.ru
Поступила в редакцию 28.12.2021 г.
После доработки 25.03.2022 г.
Принята к публикации 26.03.2022 г.
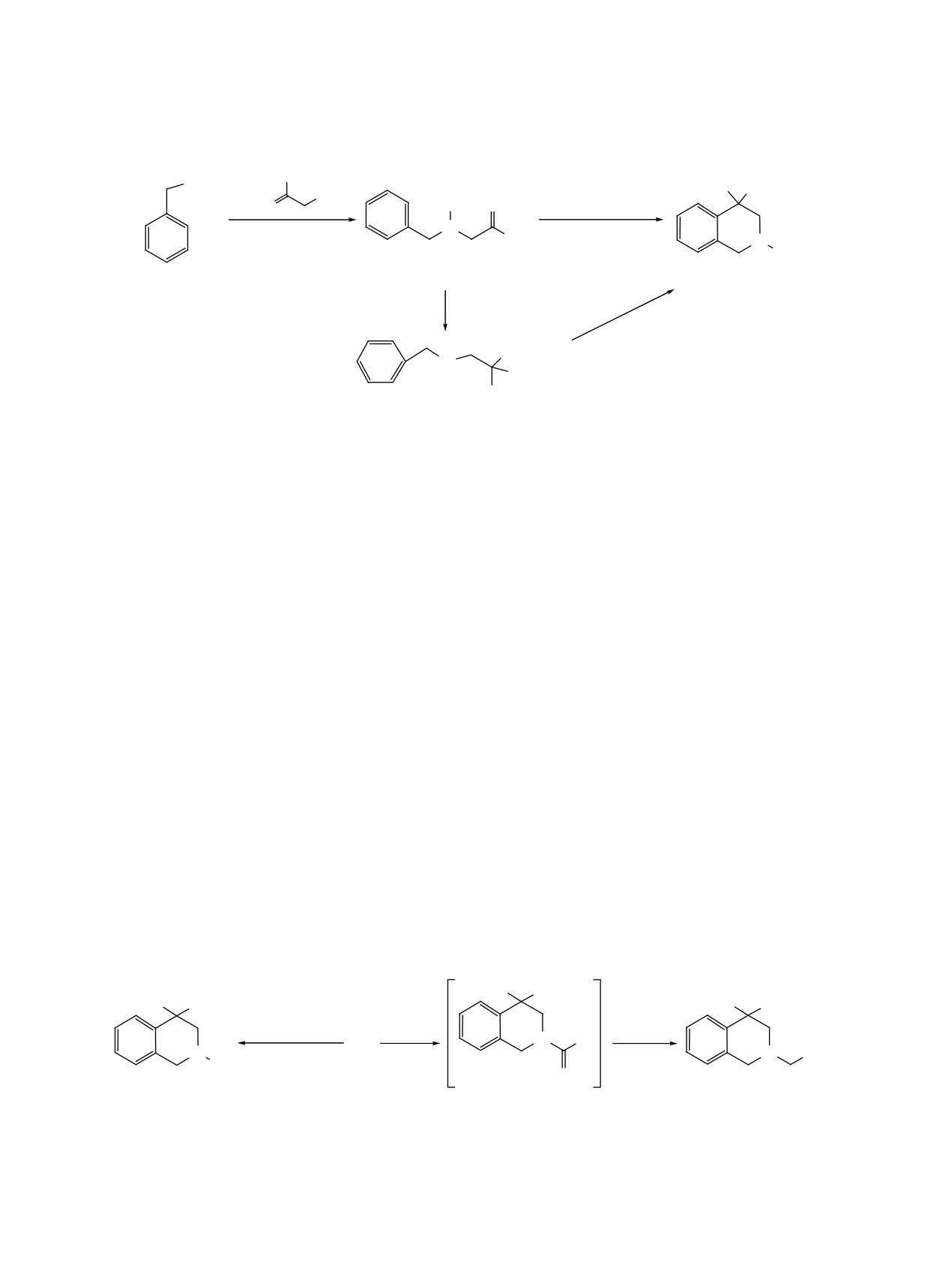
Действием на N-бензил-2-метилпроп-2-ен-1-амин смесью концентрированной серной и 85%-ной фос-
форной кислот синтезирован 4,4-диметил-1,2,3,4-тетрагидроизохинолин. Взаимодействием последнего с
хлорангидридами ароматических кислот и последующим восстановлением амидов получены N-арилал-
килзамещенные тетрагидроизохинолины. Реакцией присоединения 4,4-диметилтетрагидроизохинолинa
по двойной связи акрилонитрила и акриламида выделены производные тетрагидроизохинолин-2-ил-
пропионовой кислоты. N-Метилаллилпроизводные 3-(бензиламино)пропанамида и 1-бензил-3-фенил-
тиомочевины действием смеси кислот переведены в соответствующие 2-функционально замещенные
тетрагидроизохинолины.
Ключевые слова: бензиламин, 3-хлор-2-метилпроп-1-ен, тетрагидроизохинолин, пропионовая кислота,
дигидроизохинолинкарботиоамид
DOI: 10.31857/S0514749222100044, EDN: JVPRRS
ВВЕДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Большой интерес к медицинской химии
Настоящая работа относится к синтезу но-
изохинолиновых алкалоидов и их производ-
вых замещенных по атому азота производных те-
ных в первую очередь обусловлен высокой био-
трагидроизохинолина, содержащих 2 метильные
логической активностью этого класса гетеро-
группы в положении 4. Классический путь пост-
циклов и их повсеместным распространением в
роения структуры тетрагидроизохинолина осно-
природе [1, 2]. Структура тетрагидроизохинолина
ван на использовании арилэтиламинов, содер-
составляет основу многих биологически актив-
жащих электронодонорные заместители, - это
ных соединений и синтетических лекарствен-
реакции Померанца-Фрича, Пикте-Шпенглера,
ных препаратов, обладающих спазмолитиче-
Бишлера-Напиральского [10]. В литературе опи-
скими, анальгетическими,
противовоспали-
саны методы синтеза
4,4-диметилтетрагидрои-
тельными, противосудорожными, антибактери-
зохинолина восстановлением либо 4,4-диметил-
альными, противогрибковыми, противоопухо-
дигидроизохинолина, либо
4,4-диметилизохи-
левыми и другими свойствами [3-7]. Поэтому
нолин-3-она, полученных на основе 2-метил-2-
интерес к подобным структурам продолжает
фенилпропионитрила [11-13]. Нами для синте-
оставаться в сфере внимания и по сей день [8,
за
4,4-диметил-1,2,3,4-тетрагидроизохинолина в
9].
качестве исходнoго использован бензиламин 1а,
1071
1072
АГЕКЯН и др.
Схема 1
Me
NHR
Me Me
Cl
H2C
R
CH2
85% H3PO4, H2SO4
N
Me
N
R
1a, b
2a, b
4a, b
H2SO4, 0°C
70% H3PO4, H2SO4
Me
N
H
OH
Me
3
R = H (a), Me (b).
конденсацией которого с
3-хлор-2-метилпроп-
очередь при обработке концентрированной серной
1-еном (металлилхлоридом) получен металлил-
кислотой при 0°C также образует тетрагидроизо-
замещенный бензиламин 2a. Наряду с монозаме-
хинолин 4а (схема 1).
щенным производным, в результате реакции ал-
Изучены реакции метилирования и ацили-
килирования образуется также диаллилзамещен-
рования соединения 4а. Метилированием в ус-
ный продукт, присутствие которого обнаружено в
ловиях реакции Эшвейлера-Кларка получено
спектре ЯМР. Трехкратная перегонка реакционной
N-метильное производное, охарактеризованное в
смеси позволяет получить целевое соединение 2a
виде гидрохлорида 5, а взаимодействием с хло-
с выходом 60%. При использовании в качестве ис-
рангидридами карбоновых кислот (бензойной,
ходного амина N-метилбензиламина (1b) выход
п-фторбензойной, фенилуксусной) выделены мас-
алкилированного производного 2b достигает 90%.
лообразные амиды 6, которые без дополнительной
Далее определены оптимальные условия реак-
очистки были восстановлены алюмогидридом ли-
тия до соответствующих аминов, переведенных в
ции внутримолекулярной циклизации аминов 2а,
гидрохлориды 7a-c (схема 2).
b под действием смеси серной и фосфорной кис-
лот. При изучении продуктов реакции оказалось,
С целью синтеза новых производных тетра-
что лишь использование смеси концeнтрирован-
гидроизохинолина, содержащих фармакофор-
ной серной и 85%-ной фосфорной кислот приво-
ные группы в положении 2 гетероциклического
дит к тетрагидроизохинолинам 4а, b с высокими
кольца, реакцией присоединения тетрагидроизо-
выходами. На примере соединения 2a было пока-
хинолина 4a по двойной связи акрилонитрила и
зано, что при применении в смеси кислот более
акриламида выделены нитрил и амид 4,4-диме-
разбавленной фосфорной кислоты (65-70%) ос-
тил-1,2,3,4-тетрагидроизохинолин-2-илпропионо-
новным продуктом реакции является 1-(бензил-
вой кислоты 8a, b, причем аминоамид 8b удалось
амино)-2-метилпропан-2-ол (3), который в свою
получить только при внесении в реакционную
Схема 2
Me Me
Me Me
Me Me
1.HCOOH,CH2O
1.LiAlH4
2.HCl
RCOCl
2.HCl
4a
N R
N
N R
Me
HCl
O
HCl
5
6
7a-c
R = C6H5 (a), 4-FC6H4 (b), CH2C6H5 (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
СИНТЕЗ И АНТИМОНОАМИНОКСИДАЗНАЯ АКТИВНОСТЬ 2-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ 1073
Схема 3
Me Me
HCl
N
COOH
Me Me
HCl
R
4a
9
N
R
Me Me
8
LiAlH4
N
NH2
10
R = CN (a), CONH2 (b).
смесь нескольких кристаллов гидрохлорида исход-
2а с фенилизотиоцианатом. Циклизацией полу-
ного амина 4a. Амид 8b - белое кристаллическое
ченного 1,1,3-тризамещенного производного тио-
вещество, тогда как аминонитрил 8a - маслообраз-
мочевины 13 выделен 4,4-диметил-N-фенил-3,4-
ное соединение, которое было очищено на колонке
дигидроизохинолин-2(1Н)-карботиоамид
(14),
с окисью алюминия. Далее гидролизом в соляной
структура которого доказана как спектром ЯМР
кислоте соединений 8а и b получен гидрохлорид
1Н, так и встречным синтезом - взаимодействием
4,4-диметил-1,2,3,4-тетрагидроизохинолин-2-ил-
тетрагидроизохинолинa 4а с фенилизотиоциана-
пропионовой кислоты
(9), а восстановлением
том (схема 5).
нитрила 8a алюмогидридом лития - диамин 10
Строение и чистота полученных веществ под-
(схема 3).
тверждены физико-химическими методами и ТСХ.
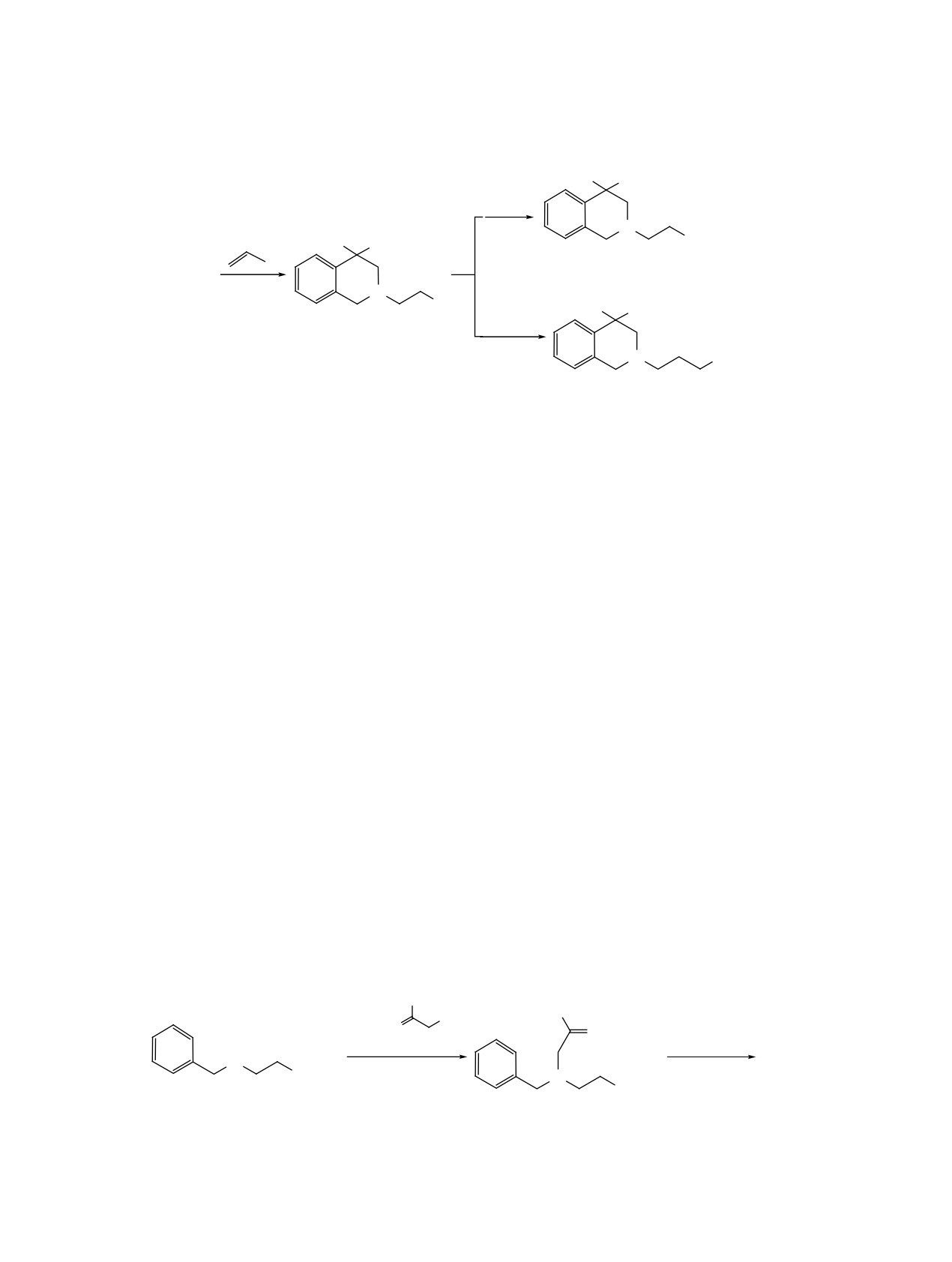
Нами изучен также путь синтеза N-замещенно-
Исследовано влияние синтезированных соеди-
го тетрагидроизохинолина на основе металлил-
нений на дезаминирование серотонина (5-окси-
замещенного бензиламина, уже содержащего фар-
триптамина) под действием моноаминоксидазы
макофорную группу. С этой целью взаимодействи-
(МАО) бычьего мозга in vitro. В качестве контроля
ем амида 3-(бензиламино)пропионовой кислоты
использован ингибитор МАО - индопан, актив-
(11), полученного присоединением бензиламина
ность которого составляет 86% [14]. Вещества
по двойной связи акриламида, с металлилхлори-
были испытаны в 3 дозах - 0.5, 1 и 5 мкмоль/мл.
дом синтезировано N-металлилпроизводное
12.
Исследования показали, что все соединения в той
При действии на него вышеуказанной смесью кис-
или иной мере влияют на дезаминирование серо-
лот при температуре 40°C в результате внутримо-
тонина. Наиболее активные из них 4а, 5а, с и 6b в
лекулярной циклизации также был выделен тетра-
концентрации 1 мкмоль/мл по сравнению с контро-
гидроизохинолин 8b (схема 4).
лем проявляют значительную активность, угнетая
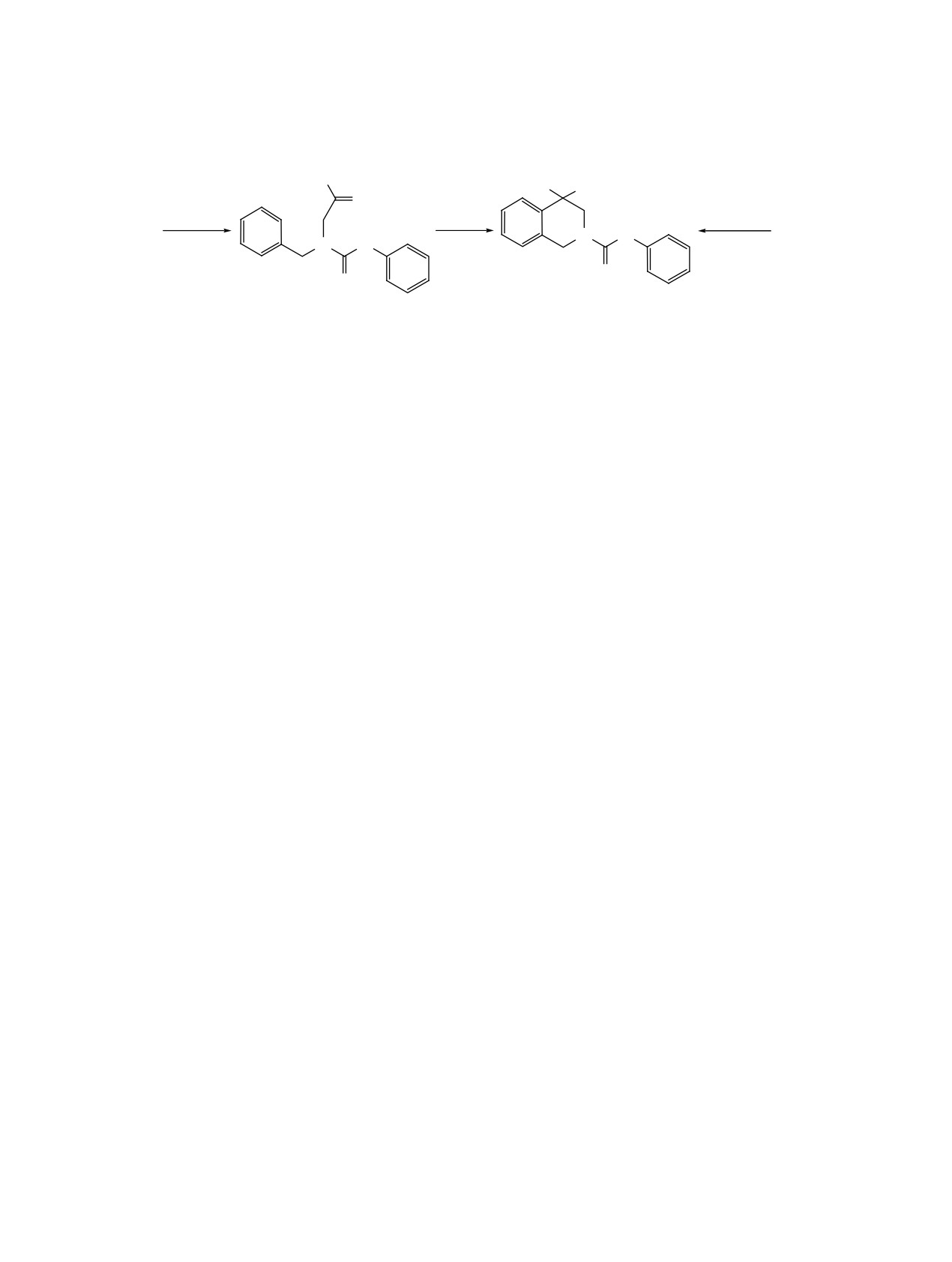
С целью исследования возможности синтеза
МАО на 70, 72, 87, 86%. Почти аналогичная кар-
новых 2-замещенных производных тетрагидроизо-
тина наблюдается в концентрации 5 мкмоль/мл -
хинолина проведена реакция N-аллилбензиламина
указанные соединения проявляют антимоноами-
Схема 4
Me
Me
Cl
1.
H2C
CH2
2. HCl
H2SO4, H3PO4
H
8b
N
CONH2
N
CONH2
HCl
11
12
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
1074
АГЕКЯН и др.
Схема 5
Me
Me Me
CH2
C6H5NCS
C6H5NCS
H
2a
H
4a
N
N
N
N
S
S
13
14
ноксидазную активность на 85, 86, 84 и 94% соот-
(20 мм рт.ст.), Rf 0.56 (метанол). Спектр ЯМР 1Н, δ,
ветственно.
м.д.: 1.74 с (3Н, СН3), 3.08 с (2Н, СН2), 3.24 с (3H,
CH3), 3.66 с (2Н, СН2), 4.76-4.79 м (1Н, =СН2),
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
4.83-4.86 м (1Н, =СН2), 7.36-7.45 м (5H, С6Н5).
ИК спектры сняты на спектрометре Nicolet
Найдено, %: С 82.56; Н 9.69; N 7.78. С12Н17N.
Avatar 330 FT-IR (США) в вазелиновом масле,
Вычислено, %: С 82.23; Н 9.78; N 7.99.
спектры ЯМР 1Н и 13С - на спектрометре Varian
1-(Бензиламино)-2-метилпропан-2-ол (3). К
Mercury-300 (США) в ДМСО-d6, рабочая частота
60 мл смеси концентрированной серной и 70%-
300 МГц, внутренний стандарт ТМС. Температуры
ной фосфорной кислот (1:1) при температуре 20-
плавления определены на микронагревательном
25°C порциями прибавляли 8.0 г (0.05 моль) амина
столике «Boëtius» (Германия). ТСХ проведена на
1a, оставляли при этой температуре в течение 2 ч.
пластинах Silufol UV-254, подвижная фаза для
Выливали на лед, нейтрализовали 10%-ным рас-
гидрохлоридов бутанол-уксусная кислота-вода
твором едкого натра и экстрагировали бензолом
(10:1:3), проявитель - пары иода. Все использо-
(3×50 мл). Бензольный экстракт промывали водой,
ванные реактивы соответствуют стандарту «х.ч.».
сушили, отгоняли растворитель и остаток кри-
N-Бензил-2-метилпроп-2-ен-1-амин
(2а). K
сталлизовали в гексане. Выход 8.1 г (67.1%), т.пл.
смеси 21.5 г (0.2 моль) бензиламина 1а и 20.0 г
42-43°C, Rf 0.48 (метанол). ИК спектр, ν, см-1:
(0.14 моль) карбоната калия в 50 мл ДМФА при
3300-3600 (NH, OH ассоц.), 1594, 1572 (аром.).
температуре 20°С по каплям прибавляли 18.1 г
Спектр ЯМР 1Н, δ, м.д.: 1.23 с (6Н, СН3), 1.77 уш.с
(0.2 моль) металлилхлорида с такой скоростью,
(1Н, NН), 2.76 с (2Н, СН2), 4.16 с (2Н, СН2), 5.04
чтобы температура смеси не превышала 26-28°С.
уш.с (1Н, ОН), 7.31-7.42 м (3Н) и 7.61-7.70 м (2Н,
Оставляли на ночь, отфильтровывали и осадок
С6Н5). Спектр ЯМР 13С, δ, м.д.: 27.4 (Me2), 50.5
промывали ДМФА. Фильтрат выливали в воду,
(СН2), 55.8 (СН2), 67.1 (C-OH), 128.0 (2CH), 128.3
выделившееся масло экстрагировали бензолом
(CH), 130.2 (2CH), 131.1. Найдено, %: С 73.47; Н
(3×100 мл), бензольный экстракт промывали во-
9.72; N 7.98. С11Н17NО. Вычислено, %: С 73.70; Н
дой, сушили, отгоняли растворитель и маслоо-
9.56; N 7.81. Т.пл. гидрохлорида 167-168°С (изо-
бразный остаток трижды перегоняли в вакууме.
пропиловый спирт).
Выход 20 г (62%), т.кип. 130-137°C (20 мм рт.ст.),
4,4-Диметил-1,2,3,4-тетрагидроизохинолин
Rf 0.51 (метанол). Спектр ЯМР 1Н, δ, м.д.: 1.56
(4a). a. К 200 мл смеси концентрированной сер-
уш.с (1Н, NН), 1.78 с (3Н, СН3), 3.08 с (2Н, СН2),
ной и 85%-ной фосфорной кислот (1:1) при тем-
3.68 с (2Н, СН2), 4.78-4.81 м (1Н, =СН2), 4.84-4.89
пературе 20-25°С порциями прибавляли 24.2 г
м (1Н, =СН2), 7.21-7.30 м (5H, С6Н5). Найдено, %:
(0.15 моль) амина 2a, оставляли при этой темпе-
С 81.67; Н 9.56; N 8.78. С11Н15N. Вычислено, %: С
ратуре в течение 2 ч. Выливали на лед, нейтрали-
81.94; Н 9.38; N 8.69.
зовали 10%-ным раствором едкого натра и экстра-
N-Бензил-N,2-диметилпроп-2-ен-1-амин (2b).
гировали бензолом (3×100 мл). Бензольный экс-
Получали аналогично из
4.8 г
(0.04 моль)
тракт промывали водой, сушили, отгоняли раство-
N-метилбензиламина 1b и 3.6 г (0.04 моль) метал-
ритель и остаток перегоняли. Выход 18.0 г (74%),
лилхлорида. Выход 6.2 г (90%), т.кип. 145-148°C
т.кип. 134-137°C (3 мм рт.ст.), Rf 0.53 (метанол).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
СИНТЕЗ И АНТИМОНОАМИНОКСИДАЗНАЯ АКТИВНОСТЬ 2-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ 1075
Спектр ЯМР 1Н, δ, м.д.: 1.24 с (6Н, СН3), 2.66 уш.с
15.0 Гц), 7.13 уш.д (1Н, J 7.7 Гц), 7.19-7.33 м (2Н)
(1Н, NН), 2.74 с (2Н, СН2), 3.88 с (2Н, СН2), 6.88
и 7.39 д.д (1Н, C6H4, J 7.9, 1.2 Гц), 12.01 уш.с (1Н,
уш.д (1Н, J 7.5 Гц), 6.98 т.д (1Н, J 7.4, 1.6 Гц), 7.06
НCl). Найдено, %: С 68.35; Н 8.68; Cl 16.57; N 6.79.
т.д (1Н, J 7.4, 1.4 Гц) и 7.23 д.д (1Н, С6Н4, J 7.5,
С12Н17N·HCl. Вычислено, %: С 68.07; Н 8.57; Cl
1.4 Гц). Найдено, %: С 81.70; Н 9.51; N 8.79.
16.74; N 6.62.
С11Н15N. Вычислено, %: С 81.94; Н 9.38; N 8.69.
Гидрохлориды аминов 7а-с (общая методи-
Т.пл. гидрохлорида 184-185°C (спирт) (182-183°C
ка). К раствору 1.6 г (0.01 моль) тетрагидроизохи-
[15]).
нолина 4а и 1.0 г (0.01 моль) триэтиламина в 50 мл
b. К 15 мл охлажденной до 0°С концентриро-
абсолютного бензола прибавляли по каплям при
ванной серной кислоты небольшими порциями
перемешивании раствор 0.01 моль хлорангидрида
прибавляли 4.5 г (0.025 моль) аминоспирта 3 так,
соответствующей кислоты в 30 мл абсолютного
чтобы температура сохранялась на уровне 0-2°С.
бензола и кипятили 5 ч. После охлаждения реак-
Перемешивали при этой температуре еще 2 ч и
ционную смесь подкисляли разбавленной соляной
оставляли на ночь при комнатной температуре.
кислотой до pH 2.0. Слои отделяли, бензольный
Смесь выливали на лед, кислый раствор при ох-
слой промывали водой, 5%-ным раствором NaOH,
лаждении подщелачивали 10%-ным раствором ед-
водой, сушили сульфатом магния. Растворитель
кого натра и экстрагировали бензолом (3×50 мл).
отгоняли, остаток растворяли в 50 мл абсолютно-
Бензольный экстракт промывали водой, сушили,
го бензола и по каплям прибавляли к суспензии
отгоняли растворитель и маслообразный остаток
1.9 г (0.05 моль) алюмогидрида лития в 100 мл
перегоняли. Выход 2.6 г (65.0%), т.кип. 134-137°C
абсолютного эфира. Реакционную смесь кипяти-
(3 мм рт.ст.), Rf 0.53 (метанол).
ли 20 ч, комплекс разлагали водой, отфильтровы-
2,4,4-Tриметил-1,2,3,4-тетрагидроизохино-
вали, фильтрат сушили, отгоняли растворитель.
лин (4b). Получен аналогично соединению 4а по
Маслообразный остаток растворяли в абсолютном
методу a из 7.0 г (0.04 моль) амина 2b. Выход 5.0 г
эфире, действием эфирного раствора хлористого
(71.4%), т.кип. 155-160°C (3 мм рт.ст.), Rf 0.56 (ме-
водорода получали гидрохлориды 7a-с и перекри-
танол). Спектр ЯМР 1Н, δ, м.д.: 1.26 с (6Н, СН3),
сталлизовывали из изопропилового спирта.
2.76 с (2Н, СН2), 2.81 с (3Н, СН3), 3.90 с (2Н, СН2),
Гидрохлорид2-бензил-4,4-диметил-1,2,3,4-те-
6.91 уш.д (1Н, J 7.5 Гц), 7.01 т.д (1Н, J 7.4, 1.6 Гц),
трагидроизохинолина (7а). Получен из амина 4а
7.09 т.д (1Н, J 7.4, 1.4 Гц) и 7.26 д.д (1Н, С6Н4, J
и 1.4 г хлорангидрида бензойной кислоты. Выход
7.5, 1.4 Гц). Найдено, %: С 82.51; Н 9.63; N 7.82.
1.4 г (49%), т.пл.185-187°C, Rf 0.52. Спектр ЯМР
С12Н17N. Вычислено, %: С 82.23; Н 9.78; N 7.99.
), 3.15
1Н, δ, м.д.: 1.36 с (3Н, СН3), 1.60 с (3Н, СН3
Гидрохлорид 2,4,4-триметил-1,2,3,4-тетраги-
с (2Н, СН2), 4.20-4.44 м (2Н, СН2), 4.47-4.68 м
дроизохинолина (5). Смесь 1.6 г (0.01 моль) ами-
(2Н, СН2), 7.15-7.39 м (3Н) и 7.30-7.34 м (6Наром),
на 4а, 5 мл 30%-ного формалина и 5 мл 85%-ной
12.11 уш.с (1Н, HCl). Найдено, %: С 75.34; Н 7.58;
муравьиной кислоты нагревали на масляной бане
Cl 12.49; N 4.68. С18Н21N.HCl. Вычислено, %: С
(140°С) 2 ч. После охлаждения добавляли 20 мл
75.11; Н 7.70; Cl 12.32; N 4.87.
воды и экстрагировали бензолом, экстракт промы-
Гидрохлорид 4,4-диметил-2-(4-фторбензил)-
вали водой, сушили сернокислым магнием и от-
гоняли растворитель. Остаток растворяли в абсо-
1,2,3,4-тетрагидроизохинолина (7b). Получен из
амина 4а и 1.6 г хлорангидрида фторбензойной
лютном эфире, действием эфирного раствора хло-
ристого водорода получали гидрохлорид, отфиль-
кислоты. Выход 1.5 г (49.5%) т.пл.172-173°C, Rf
тровывали и перекристаллизовывали из ацетона.
0.50. Спектр ЯМР 1Н, δ, м.д.: 1.32 с (3Н, СН3), 1.51
Выход 1.3 г (62%), т.пл. 189-191°C, Rf 0.55. Спектр
с (3Н, СН3), 3.11 с (2Н, СН2), 4.18-4.42 м (2Н, СН2),
ЯМР 1Н, δ, м.д.: 1.39 с (3Н, СН3), 1.61 с (3Н, СН3),
4.45-4.65 м (2Н, СН2), 7.11-7.38 м (6Н) и 7.86-
2.92 д (3Н, NСН3, J 4.2 Гц), 3.22 д.д (1Н, СН2, J
7.95 м (2Наром), 11.96 уш.с (1Н, HCl). Найдено, %:
12.4, 10.2 Гц), 3.43 уш.д (1Н, СН2, J 12.4 Гц), 4.18
С 70.87; Н 6.75; Cl 11.72; N 4.39. С18Н20FN.HCl.
д.д (1Н, СН2, J 15.0, 9.0 Гц), 4.44 уш.д (1Н, СН2, J
Вычислено, %: С 70.69; Н 6.92; Cl 11.59; N 4.58.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
1076
АГЕКЯН и др.
Гидрохлорид 4,4-диметил-2-фенэтил-1,2,3,4-
1.6 г (0.006 моль) гидрохлорида 3-[бензил(2-ме-
тетрагидроизохинолина (7c). Получен из амина
тилаллил)амино]пропионамида
(12), нагревали
4а и 1.54 г хлорангидрида фенилуксусной кисло-
при 40°C до прозрачности (20-25 мин.) и остав-
ты. Выход 1.4 г (46.7%), т.пл. 190-192°C, Rf 0.49.
ляли при комнатной температуре в течение 2 ч.
Спектр ЯМР 1Н, δ, м.д.: 1.41 с (3Н, СН3), 1.65 с
Смесь выливали на лед, кислый раствор при ох-
(3Н, СН3), 3.14-3.24 м (1Н), 3.28-3.46 м (4Н) и
лаждении подщелачивали 10%-ным раствором ед-
3.52 уш.д [1Н, (СН2)3, J 12.4 Гц,], 4.25 д.д (1Н, J
кого натра и экстрагировали бензолом (3×50 мл).
14.8, 8.9 Гц) и 4.56 уш.д (1Н, СН2, J 14.8 Гц), 7.14-
Бензольный экстракт промывали водой, сушили,
7.25 м (3Н) и 7.28-7.42 м (6Наром), 12.13 уш.с (1Н,
отгоняли растворитель, маслообразный остаток
HCl). Найдено, %: С 75.81; Н 8.17; Cl 11.61; N 4.49.
кристаллизовали и перекристаллизовывали из
С19Н23N·НCl. Вычислено, %: С 75.60; Н 8.01; Cl
гексана. Выход 0.8 г (57%), т.пл. 93-94°С, Rf 0.47
11.75; N 4.64.
(бензол-ацетон, 2:1).
3-(4,4-Диметил)-3,4-дигидроизохинолин-
Гидрохлорид 3-[4,4-диметил-3,4-дигидроизо-
2(1Н)-пропионитрил (8a). Смесь 4.8 г (0.03 моль)
хинолин-2(1Н)-ил]пропионовой кислоты (9). a.
изохинолина 4a и 1.7 г (0.032 моль) акрилонитри-
Смесь 1.0 г (0.005 моль) нитрила 8a и 10 мл кон-
ла выдерживали 48 ч при температуре 30-35°C.
центрированной соляной кислоты кипятили 10 ч.
Затем смесь хроматографировали на колонке с
Растворитель отгоняли, кристаллический остаток
окисью алюминия II степени активности (элюент
промывали ацетоном и перекристаллизовывали из
бензол-этилацетат, 5:1). Выход 3.6 г (56.4%), Rf
спирта. Выход 0.9 г (71%), т.пл.220-222°C, Rf 0.46.
0.50. ИК спектр, ν, см-1: 2230 (СN). Спектр ЯМР
Спектр ЯМР 1Н, δ, м.д.: 1.39 уш.с (6Н, СН3), 2.98
1Н, δ, м.д.: 1.26 с (6Н, СН3), 2.30-2.35 м (2Н, СН2),
уш.с (2Н, СН2), 3.27-3.36 м (2Н, СН2), 3.44 уш.т
2.42 с (2Н, СН2), 2.68 т (2Н, СН2, J 6.9 Гц), 3.57 с
(2Н, СН2, J 7.6 Гц), 4.37 уш.с (2Н, СН2), 7.16 д.д
(2Н, СН2), 6.93 д.д (1Н, J 7.5, 1.3 Гц), 7.02 д.д.д
(1Н, J 7.8, 1.3 Гц), 7.25 д.д.д (1Н, J 7.8, 7.5, 1.2 Гц),
(1Н, J 7.5, 7.3, 1.3 Гц), 7.09 д.д.д (1Н, J 7.8, 7.3,
7.34 д.д.д (1Н, J 7.8, 7.5, 1.3 Гц) и 7.49 уш.д (1Н,
1.5 Гц) и 7.22 д.д (1Н, C6H4, J 7.8, 1.5 Гц). Найде-
C6H4, J 7.8 Гц), 10.31 уш.с (1Н, СООН), 12.69 уш.с
но, %: С 78.28; Н 8.32; N 13.25. С14Н18N2. Вычис-
(1H, HCl). Найдено, %: С 62.58; Н 7.34; Cl 13.28;
лено, %: С 78.46; Н 8.47; N 13.07. Т.пл. гидрохло-
N 5.31. С14Н19NO2·HCl. Вычислено, %: С 62.33; Н
рида 201-202°С (спирт).
7.47; Cl 13.14; N 5.19.
3-[4,4-Диметил-3,4-дигидроизохинолин-
b. Получали аналогично из 1.3 г (0.005 моль)
2(1Н)-ил]пропанамид
(8b). a. Смесь
3.2 г
амида 8b. Выход 1.0 г (66.7%), т.пл. 220-222°С.
(0.02 моль) изохинолина 4a, нескольких кристал-
3-[4,4-Диметил-3,4-дигидроизохинолин-
лов гидрохлорида 4a и 1.6 г (0.022 моль) акрила-
2(1Н)-ил]пропан-1-амин (10). К суспензии 0.6 г
мида выдерживали 72 ч при температуре 35-40°C,
(0.016 моль) алюмогидрида лития в 50 мл аб-
прибавляли пентан, образовавшиеся кристаллы
солютного эфира по каплям прибавляли 1.7 г
отфильтровывали и перекристаллизовывали из
(0.008 моль) нитрила 8a в 50 мл абсолютного
гексана. Выход 2.7 г (65.8%), т.пл. 93-94°С, Rf
бензола и реакционную смесь кипятили 10 ч.
0.47 (бензол-ацетон, 2:1). ИК спектр, ν, см-1: 3380,
Комплекс разлагали водой, отфильтровывали,
3320, (NH2), 1640 (СО). Спектр ЯМР 1Н, δ, м.д.:
фильтрат сушили, отгоняли растворитель и оста-
1.28 с (6Н, СН3), 2.32 т (2Н, СН2, J 6.9 Гц), 2.44
ток хроматографировали на колонке с окисью алю-
с (2Н, СН2), 2.70 т (2Н, СН2, J 6.9 Гц), 3.59 с (2Н,
миния II степени активности (элюент - бензол-
СН2), 6.41 уш.с (1Н) и 7.19 уш.с (1Н, NH2), 6.94 д.д
этилацетат-метанол, 5:1:1). Выход 1.0 г (60%), Rf
(1Н, J 7.5, 1.3 Гц), 7.01 д.д.д (1Н, J 7.5, 7.3, 1.3 Гц),
0.45. Спектр ЯМР 1Н, δ, м.д.: 1.32 уш.с (6H, CH3),
7.08 д.д.д (1Н, J 7.8, 7.3, 1.5 Гц), 7.22 д.д (1Н, C6H4,
1.60-1.79 м (4Н, СН2, NН2), 2.57-2.65 м (2Н, СН2),
J 7.8, 1.5 Гц). Найдено, %: С 72.51; Н 8.49; N 12.18.
2.82 уш.с (2Н, СН2), 2.90 т (2Н, СН2, J 7.3 Гц), 3.63
С14Н20N2. Вычислено, %: С 72.38; Н 8.68; N 12.06.
с (2Н, СН2), 6.98-7.10 м (4Наром). Найдено, %: С
Т.пл. гидрохлорида 230-231°C (спирт).
77.34; Н 10.28; N 12.65. С14Н22N2. Вычислено, %:
b. К 20 мл смеси (1:1) концентрированной сер-
С 77.01; Н 10.16; N 12.83. Т.пл. дигидрохлорида
ной и 85%-ной фосфорной кислот прибавляли
165-167°С (ацетон).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
СИНТЕЗ И АНТИМОНОАМИНОКСИДАЗНАЯ АКТИВНОСТЬ 2-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ 1077
Гидрохлорид
3-[бензил(2-метилаллил)ами-
N 9.70. С18Н20N2S. Вычислено, %: С 72.93; Н 6.80;
но]пропанамида
(12). Получали аналогично
N 9.45.
амину 2а из 3.5 г (0.02 моль) 3-(бензиламино)-
b. Смесь 1.3 г (0.008 моль) тетрагидроизохи-
пропанамида (11). После отгонки растворителя
нолина 4а и 1.0 г (0.008 моль) фенилизотиоциана-
маслообразный остаток растворяли в абсолютном
та в 30 мл этилового спирта нагревали в течение
эфире и действием эфирного раствора хлористо-
4 ч. Образовавшиеся кристаллы отфильтровыва-
го водорода получали гидрохлорид. Выход 3.2 г
ли, промывали спиртом и перекристаллизовывали
(60%), т.пл. 166-167°С (изопропиловый спирт),
из метанола. Выход 1.9 г (79%), т.пл. 166-168°С.
Rf 0.51. ИК спектр, ν, см-1: 3360, 3300 (NH2), 1635
(СО). Спектр ЯМР 1Н, δ, м.д.: 1.96 с (3Н, СН3),
ЗАКЛЮЧЕНИЕ
2.86 уш.с (2Н, СН2), 3.24 уш.с (2Н, СН2), 3.52 уш.с
Разработаны оптимальные условия синтеза
(2Н, СН2), 4.16-4.40 м (2Н, СН2), 5.20 уш.с (1Н,
производных
4,4-диметил-1,2,3,4-тетрагидрои-
=СН2), 5.29 уш.с (1Н, = СН2), 6.73 уш.с (1Н) и 7.59
зохинолина, не содержащих электронодонорные
уш.с (1Н, CONH2), 7.36-7.45 м (3Н) и 7.71-7.78 м
заместители в бензольном кольце. Изучены реак-
(2Н, C6H5), 11.84 уш.с (1Н, HCl). Найдено, %: С
ции присоединения тетрагидроизохинолина по
62.78; Н 7.69; Cl 13.32; N 10.29. С14Н20N2O·HCl.
двойной связи амида и нитрила акриловой кисло-
Вычислено, %: С 62.56; Н 7.88; Cl 13.19; N 10.42.
ты и возможности синтеза производных тетраги-
1-Бензил-1-(2-метилаллил)-3-фенилтиомо-
дроизохинолина с фармакофорными заместителя-
чевина (13). Смесь 2.8 г (0.016 моль) амина 2а
ми у атома азота из функциональнозамещенных
и 2.2 г (0.016 моль) фенилизотиоцианата в толу-
N-бензил-2-метилпроп-2-ен-1-аминов.
оле нагревали 4 ч. Образовавшиеся кристаллы
ИНФОРМАЦИЯ ОБ АВТОРАХ
отфильтровывали и перекристаллизовывали из
спирта. Выход 4.0 г (77.7%), т.пл.112-114°C, Rf
0.54 (бензол-ацетон, 4:1). ИК спектр, ν, см-1: 3445,
orcid.org/0000-0001-6151-4951
3300 (NH), 1250 (C=S). Спектр ЯМР 1Н, δ, м.д.:
Арустамян Жасмина Саркисовна, ORCID:
1.80 с (3Н, СН3), 4.25 уш.с (2Н, СН2), 4.89 уш.с
(1Н, =СН2), 4.98 уш.с (1Н, =СН2), 5.28 уш.с (2Н,
Маркарян Рузанна Эдуардовна, ORCID: https://
СН2), 7.29-7.34 м (1Н) и 7.36-7.41 м (9Наром), 8.95
orcid.org/0000-0002-5066-0870
с (1Н, NH). Спектр ЯМР 13С, δ, м.д.: 19.6 (Me), 52.9
(СН2), 53.9 (СН2), 110.6, 124.3 (СН), 126.2 (2CH),
Паносян Генрих Агавардович, ORCID: https://
126.6 (2CH), 126.9 (2СН), 127.2 (2CH), 127.9 (СН),
orcid.org/0000-0001-8311-6276
136.9 (CH), 139.4 (CH), 140.6 (CH), 182.1. Найдено,
Григорян Анаит Суреновна, ORCID: https://
%: С 72.77; Н 6.69; N 9.68. С18Н20N2S. Вычислено,
orcid.org/0000-0002-3834-3338
%: С 72.93; Н 6.80; N 9.45.
Гаспарян Грачик Ваграмович, ORCID: https://
4,4-Диметил-N-фенил-3,4-дигидроизо-
orcid.org/0000-0002-8555-3733
хинолин-2(1Н)-карботиоамид (14). a. К 20 мл
смеси концентрированной серной и 85%-ной фос-
КОНФЛИКТ ИНТЕРЕСОВ
форной кислот (1:1) при температуре 25-30°C пор-
Авторы заявляют об отсутствии конфликта ин-
циями прибавляли 1.8 г (0.005 моль) замещенной
тересов.
тиомочевины 13, оставляли при этой температуре
в течение 4 ч. Выливали на лед, образовавшиеся
СПИСОК ЛИТЕРАТУРЫ
кристаллы отфильтровывали, перекристаллизо-
1. Shamma M., Moniot J.L. The isoquinoline alkaloids,
вывали из метанола. Выход 1.1 г (61%), т.пл. 166-
Chemistry and Pharmacology. New York and London:
168°С, Rf 0.52 (бензол-ацетон, 2:1). Спектр ЯМР
Academic Press, 1972.
1Н, δ, м.д.: 1.36 с (6Н, СН3), 3.98 с (2Н, СН2), 5.10 с
2. Wu L., Ling H., Li L., Jiang L., He M. J. Pharm.
(2Н, СН2), 7.07-7.21 м (4Н) и 7.25-7.36 м (5Наром),
Pharmacol.
2007,
59,
695-701. doi
10.1211/
9.10 уш.с (1Н, NH). Найдено, %: С 72.72; Н 6.62;
jpp.59.5.0010
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
1078
АГЕКЯН и др.
3. Pingaew R., Worachartcheewan A., Nantasenamat C.,
Gruzd Yu.A., Kulemina S.V., Baimuratov M.R., Kli-
Prachayasittikul S., Ruchirawat S., Prachayasittikul V.
mochkin Yu.N. Russ. J. Org. Chem. 2021, 57, 793-
Arch. Pharm. Res. 2013, 36, 1066-1077. doi 10.1007/
800.] doi 10.1134/S1070428021050055
s12272-013-0111-9
9. Glas C., Wirawan R., Bracher F. Synthesis. 2021, 53,
4. Akinboye E.S., Rosen M.D., Bakare O., Denmea-
1943-1954. doi 10.1055/s-0040-1706002
de S.R. Bioorg. Med. Chem. 2017, 25, 6707-6717. doi
10. Horváth D., Domonyi F., Palkу R., Lomoschitz A.,
10.1016/j.bmc.2017.11.01
Soуs T. Synthesis. 2018, 50, 2181-2190. doi 10.1055/
5. Fang X., Yin Y., Chen Y.T., Yao L., Wang B., Came-
s-0037-1609153
ron M.D., Lin L., Khan S., Ruiz C., Schröter T.,
11. Johnson Ch.N., Stemp G. Пат. US 6358974, B1 (2002).
Grant W., Weiser A., Pocas J., Pachori A., Schürer S.,
США.
Lograsso P., Feng Y. J. Med. Chem. 2010, 53, 5727-
12. Govindan C.K., Taylor G. J. Org. Chem. 1983, 48,
5737. doi 10.1021/jm100579r
5348-5354. doi 10.1021/jo00174a036
6. Kairuki M., Qiu Q., Pan M., Li Q., Zhou J., Ghaleb H.,
Jiang C. Bioorg. Med. Chem. 2019, 27, 3347-3357. doi
13. Caron S., Vasquez E., Wojcik J.M. J. Am. Chem. Soc.
10.1016/j.bmc.2019.06.013
2000, 122, 712-713. doi 10.1021/ja9933846
7. Scott J.D., Williams R.M. Chem. Rev. 2002, 102,
14. Машковский М.Д. Лекарственные средства. М.:
1669-1730. doi 10.1021/cr010212u
Новая волна, 2010.
8. Земцова М.Н., Головко Ю.А., Грузд Ю.А., Кулеми-
15. Bailey D., DeGrazia C.G., Lape H.E., Frering R.,
на С.В., Баймуратов М.Р., Климочкин Ю.Н. ЖОрХ.
Fort D., Skulan T. J. Med. Chem. 1973, 16, 151-156.
2021, 57, 728-736. [Zemtsova M.N., Golovko Yu.A.,
doi 10.1021/jm0026a015
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022
СИНТЕЗ И АНТИМОНОАМИНОКСИДАЗНАЯ АКТИВНОСТЬ 2-ЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ 1079
Synthesis and Antimonoaminoxidase Activity of 2-Substituted
Derivatives of 4,4-Dimethyl-1,2,3,4-tetrahydroisoquinoline
А. А. Aghekyan*, Zh. S. Arustamyan, R. E. Margaryan, H. A. Panosyan,
A. S. Grigoryan, and H. V. Gasparyan
Scientific Technological Centre of Organic and Pharmaceutical Chemistry NAS RA,
prosp. Azatutyana, 26, Yerevan, 0014 Armenia
*е-mail: aaghekyan@mail.ru
Received December 28, 2021; revised March 25, 2022; accepted March 26, 2022
By the action on N-benzyl-2-methylprop-2-en-1-amine with a mixture of concentrated sulfuric and 85% phos-
phoric acids was synthesized 4,4-dimethyl-1,2,3,4-tetrahydroisoquinoline. By interaction of the latter with aro-
matic acid chlorides and the subsequent reduction of the amides N-arylalkylsubstituted tetrahydroisoquinolines
were obtained. By addition of tetrahydroisoquinoline at the double bond of acrylonitrile and acrylamide the
derivatives of tetrahydroisoquinoline-2-yl-propionic acid were isolated. N-Methylallyl derivatives of 3-(ben-
zylamino)propanamide and 1-benzyl-3-phenylthiourea by the action of a mixture of acids were converted into
corresponding 2-functionallysubstituted tetrahydroisoquinolines.
Keywords: benzylamine, 3-chloro-2-methylprop-1-ene, tetrahydroisoquinoline, propionic acide, dihydroiso-
quinolinecarbothioamide
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 10 2022