ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 11, с. 1145-1151
УДК 547.831
СИНТЕЗ 3-R-6-R'-ХИНОЛИН-4-КАРБОКСИЛАТОВ
И ИХ РЕАКЦИИ С ГИДРАЗИН ГИДРАТОМ
© 2022 г. М. Н. Земцова, А. О. Савостина, М. Р. Баймуратов*, Ю. Н. Климочкин
ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*е-mail: baymuratovmr@yandex.ru
Поступила в редакцию 18.01.2022 г.
После доработки 14.02.2022 г.
Принята к публикации 16.02.2022 г.
Разработан метод синтеза 3-замещенных хинолин-4-карбоксилатов взаимодействием 3-морфолино-
1-R-проп-2-ен-1-онов с изатинами в присутствии триметилхлорсилана в водном спирте. Показана
возможность циклизации 3-бензоил-6R-4-хинолинкарбоксилатов с гидразин-гидратом с образованием
9-R-4-фенилпиридазино[4,5-c]хинолин-1(2Н)-онов.
Ключевые слова: хинолин, изатины, кетоны, 4-хинолинкарбоновые кислоты, циклизация, пиридази-
нохинолины
DOI: 10.31857/S0514749222110027, EDN: LRILEQ
ВВЕДЕНИЕ
карбоксилаты
[15]. Нами осуществлен синтез
новых 3-R-6-R'-4-хинолинкарбоксилатов и пред-
Производные хинолина чрезвычайно интерес-
принята попытка получить на их основе 9-R-4-R'-
ны в качестве биологически активных соедине-
пиридазино[4,5-c]хинолин-1(2H)-оны в качестве
ний. Фрагмент хинолина - основа многих при-
потенциальных биологически активных соедине-
родных алкалоидов и лекарственных препаратов,
ний.
обладающих различными видами биологической
активности: противовирусной, анальгетической,
Для синтеза 3-R-6-R'-4-хинолинкарбоксилатов
в качестве исходных соединений взяты 3-морфо-
противомалярийной, противогельминтной, проти-
лино-1-R-проп-2-ен-1-оны 1a, b. Соединение 1а
воопухолевой и другими [1-5]. Одним из приме-
получали реакцией ацетофенона с этилформиатом
ров служит пентациклический алкалоид кампоте-
в присутствии гидрида натрия и последующим до-
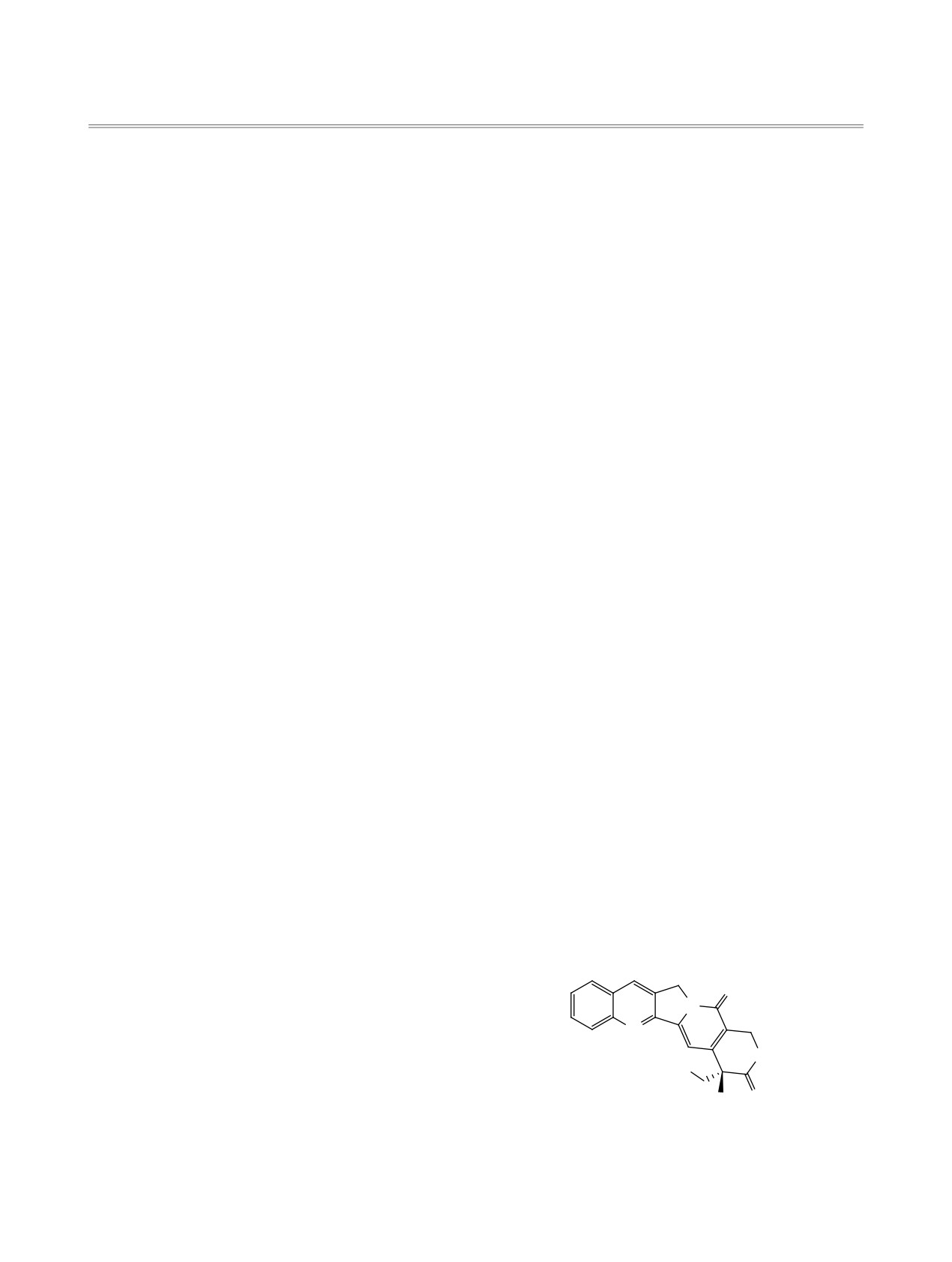
цин (рис. 1), выделенный из растения Camptotheca
бавлением морфолина [16]. 1-(Адамантан-1-ил)-
acuminate и проявляющий противоопухолевую ак-
3-морфолинопроп-2-ен-1-он
(1b) синтезировали
тивность [6].
реакцией натриевого енолята 1-(адамантан-1-ил)-
На сегодняшний день весьма интересны хино-
проп-2-ен-1-она с гидробромидом морфолина в
лины, аннелированные с другими гетероцикличе-
этаноле [17].
скими соединениями [7-12]. Так, противораковой
O
активностью обладают 6-арилиндено[1,2-с]хино-
N
лины и TAS-103 (рис. 2) [13, 14].
N
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
O
H3C
Для получения производных хинолина, анне-
O
лированных с гетероциклическими фрагментами,
HO
могут быть использованы 3-карбонил-4-хинолин-
Рис. 1. Структура кампотецина
1145
1146
ЗЕМЦОВА и др.
R2
O
R1
O
N
NMe2
HO
N N
H
R3
Ⱥɪɢɥɢɧɞɟɧɨ> c@ɯɢɧɨɥɢɧɵ
TAS-103
Рис. 2. Структуры 6-арилиндено[1,2-с]хинолинов и TAS-103
Взаимодействием
3-морфолино-1-фенилпроп-
веден гидролиз в присутствии гидроксида натрия
2-ен-1-она (1a) с 5-R-изатинами 2а-с и обработкой
и синтезированы 3-бензоил-6-R-4-хинолинкарбо-
триметилхлорсиланом в смеси спирт-вода, 2:1,
новые кислоты 4a-c (схема 2).
при температуре 80°С в течение 6 ч осуществлен
В продолжение изучения химических свойств
синтез этил-3-бензоил-6-R-4-хинолинкарбоксила-
проведена реакция этил-3-бензоил-6-R-4-хино-
тов 3a-с (схема 1). В случае 1-(адамантан-1-ил)-
линкарбоксилатов 3a-c с гидразин-гидратом в эта-
3-морфолинопроп-2-ен-1-она (1b) реакцию прово-
ноле и выделены 9-R-4-фенилпиридазино[4,5-c]-
дили с изатином в аналогичных условиях и выде-
ляли 4-карбокси-3-(1-адамантаноил)хинолин (3d)
хинолин-1(2Н)-оны 5a-c с умеренными выходами
(схема 1).
(схема 3).
Данный метод является модификацией реакции
Структуры полученных соединений 5а-с под-
Пфитцингера и механизм подобных превращений,
тверждены данными ИК и ЯМР спектров. В ИК
включающий стадию этерификации, присоедине-
спектрах наблюдаются полосы поглощения ва-
ние по Михаэлю и циклизацию с элиминировани-
лентных колебаний NH в области 3093-3130 см-1
ем, подробно описан [18, 19].
и С=О в области 1643-1670 см-1, характерные для
Для изучения свойств полученных этил-3-бен-
данных структур. В спектрах ЯМР 1H соединений
зоил-6-R-4-хинолинкарбоксилатов 3a-c был про-
5а-с сигналы протонов метиновых атомов угле-
Схема 1
R3O O
O
O
TMSCl
O
R2
EtOH/H2O
R2
+
R1
N
O
R1
80°C, 6 ɱ
O
N
H
N
1a, b
2a-c
3a-d
R1 = Ph (1a), Ad (1b); R2 = H (2a), Br (2b), Me (2c);
R1 = Ph, R2 = H, R3 = Et (3a, 73%); R1 = Ph, R2 = Br, R3 = Et (3b, 58%);
R1 = Ph, R2 = Me, R3 = Et (3c, 81%); R1 = Ad, R2 = R3 = H (3d, 57%).
Схема 2
EtO
O
HO O
O
O
NaOH (10%)
R
R
N
N
3a-c
4a-c
R = H (4a, 89%), Br (4b, 57%); Me (4c, 68%).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ 3-R-6-R'-ХИНОЛИН-4-КАРБОКСИЛАТОВ
1147
Схема 3
H
EtO
O
O
N
O
N
N2H4 . H2O
R
R
EtOH (50%), ', 1 ɱ
N
N
3a-c
5a-c
R = H (5a, 73%), Br (5b, 54%); Me (5c, 47%).
рода, связанных с азотом, наблюдаются при 9.10-
Смесь изатина
2a-c и
3-морфолино-1-фенил-
9.64 м.д. в виде синглетов, а протоны NH групп
проп-2-ен-1-она (1а) обрабатывали триметилхлор-
в виде уширенных синглетов в области 13.17-
силаном в 5 мл смеси спирт-вода в соотношении
13.65 м.д.
2:1. Смесь перемешивали при 80°C в течение 6 ч.
Затем реакционную массу охлаждали до комнат-
ЭКСПРИМЕНТАЛЬНАЯ ЧАСТЬ
ной температуры, нейтрализовали насыщенным
ИК спектры записаны на спектрофотометре
раствором карбоната натрия до рН 8.0-9.0, а затем
Shimadzu IR Affinity-1 (Япония), оснащенном при-
экстрагировали этилацетатом (5×15 мл) и сушили
ставкой НПВО Specac Quest (Великобритания).
над безводным сульфатом натрия. Растворитель
Спектры ЯМР 1Н и 13С (400 и 100 МГц соответ-
отгоняли под вакуумом, а продукт очищали коло-
ственно) зарегистрированы на спектрометре JEOL
ночной хроматографией. В качестве элюента ис-
JNM ECX-400 (Япония) в ДМСО-d6 (внутренний
пользовали смесь хлороформ-метанол в соотно-
стандарт
- остаточные сигналы растворителя
шении 10:1.
2.50 м.д. для ядер 1Н и 39.5 м.д. для ядер 13С) и в
Этиловый эфир 3-бензоил-4-хинолинкарбо-
CDCl3 (внутренний стандарт - остаточные сигна-
новой кислоты (3а) получен из 0.7 г (0.005 моль)
лы растворителя 7.26 м.д. для ядер 1Н и 77.2 м.д.
изатина (2а), 1.1 г (0.005 моль) 3-морфолино-1-фе-
для ядер 13С). Масс-спектры получены на хромато-
нилпроп-2-ен-1-она (1а), 0.3 мл триметилхлорси-
масс-спектрометре Thermo Finnigan DSQ (США) с
лана в 7 мл смеси этиловый спирт-вода. Выход
масс-селективным детектором в режиме электрон-
1.1 г (73%), маслообразное вещество желтого цве-
ной ионизации (70 эВ), кварцевая колонка DB-
та. ИК спектр, ν, см-1: 1728 (С=О), 1662 (С=О).
5MS 30 м×0.32 мм, температура колонки 80-340°С
(скорость нагрева 20°С/мин), температура испа-
Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.01 т (3H,
СН3, 3J 7.1 Гц), 4.06 к (2H, СН2, 3J 7.1 Гц), 7.49-
рителя 250°С, газ-носитель - гелий. Элементный
7.54 м (2Наром), 7.63-7.68 м (1Наром), 7.72-7.76 м
анализ выполнен на CHNS элементом анализато-
ре Euro Vector EA-3000 (Италия) с использовани-
(3Наром), 7.88-7.92 м (1Наром), 8.13-8.16 м (2Наром),
ем в качестве стандарта L-цистина. Температуры
9.05 с (1Н, CHN). Спектр ЯМР 13С (ДМСО-d6), δ,
плавления определены на приборе SRS OptiMelt
м.д.: 13.8 (CH3), 62.7 (CН2), 123.1, 126.2 (CH), 129.3
MPA100 (США). Контроль за ходом реакций осу-
(2CH), 129.4 (CH), 130.1 (CН), 130.2 (2CН), 130.4,
ществлен методом ТСХ на пластинах Merck TLC
132.2 (CН), 134.4 (CН), 136.8, 138.2, 149.1, 149.4
Silicagel 60, проявление в парах йода. Для коло-
(CН), 165.8, 194.7. Масс-спектр (ЭУ, 70 эВ), m/z
ночной хроматографии использован силикагель
(Iотн, %): 305 (3) [М]+, 231 (10), 105 (78), 77 (100).
Merck М-60. Все растворители предварительно
Найдено, %: C 74.68; H 4.89; N 4.53. С19Н15NO3.
высушены и перегнаны согласно стандартным
Вычислено, %: C 74.74; H 4.95; N 4.59.
методикам. 3-Морфолино-1-фенилпроп-2-ен-1-он
Этиловый эфир
3-бензоил-6-бром-4-хино-
(1а) получали по методике [16], 1-(адамантан-1-
линкарбоновой кислоты (3b) получен из 1.1 г
ил)-3-морфолинопроп-2-ен-1-он (1b) синтезирова-
(0.005 моль) 5-бромизатина (2b), 1.1 г (0.005 моль)
ли по методике [17].
3-морфолино-1-фенилпроп-2-ен-1-она (1а), 0.3 мл
Этиловые эфиры 3-бензоил-6-R-4-хинолин-
триметилхлорсилана в 7 мл смеси этиловый спирт-
карбоновых кислот
3a-с (общая методика).
вода. Выход 1.1 г (58%), маслообразное вещество
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1148
ЗЕМЦОВА и др.
темно-желтого цвета. ИК спектр, ν, см-1: 1726
отгоняли под вакуумом. Выход 0.52 г (57%), бес-
(С=О), 1660 (С=О). Спектр ЯМР 1H (ДМСО-d6), δ,
цветные кристаллы, т.пл. 243-245°С. ИК спектр, ν,
м.д.: 0.96 т (3H, CH3, 3J 7.1 Гц), 4.02 к (2H, СН2, 3J
см-1: 3066 (О-Н), 1755 (C=O), 1629 (C=O). Спектр
7.1 Гц), 7.54 т (2Наром, 3J 7.5 Гц), 7.69 т (1Наром, 3J
ЯМР 1H (ДМСО-d6), δ, м.д.: 1.49-1.66 м (12Н,
7.5 Гц), 7.75 д (2Наром, 3J 7.5 Гц), 8.07 д.д (1Н, Н7,
6СН2Ad), 1.81-1.99 м (3Н, 3CHAd), 7.84 д.д (1Н, Н6,
3J 8.9, 4J 2.0 Гц), 8.12 д (1Н, Н8, 3J 8.9 Гц), 8.40 д
3J 8.2, 7.6 Гц), 7.92 д.д (1Н, Н7, 3J 7.6, 7.3 Гц), 8.03
(1Н, Н5, 4J 2.0 Гц), 9.08 с (1Н, Н2). Спектр ЯМР 13С
уш.с (1Н, ОН), 8.21 д (1Н, Н5, 3J 8.2 Гц), 8.71 д
(ДМСО-d6), δ, м.д.: 13.6 (CH3), 62.9 (CН2), 122.9
(1Н, Н8, 3J 7.6 Гц), 9.22 с (1Н, Н2). Спектр ЯМР
(С-Br), 124.3, 128.2 (CH), 129.5 (2CН), 130.1 (2CH),
13С (ДМСО-d6), δ, м.д.: 28.0 (3СН), 36.4 (3СН2),
131.9, 132.3 (CН), 134.7 (CН), 135.3 (CН), 136.3,
36.7 (3СН2), 40.7, 112.2, 122.1, 123.5 (СН), 130.1
136.6, 147.7, 149.8 (CН), 165.1, 194.5. Масс-спектр
(СН), 130.3 (СН), 131.5 (СН), 142.8, 146.6 (СН),
(ЭУ, 70 эВ), m/z (Iотн, %): 385 (30) [М + 2]+, 383 (29)
148.6, 167.9, 188.0. Найдено, %: C 75.27; H 6.26; N
[M]+, 308 (40), 105 (89), 77 (100). Найдено, %: C
4.22. С21Н21NO3. Вычислено, %: C 75.20; H 6.31; N
59.43; H 3.73; N 3.68. С19Н14BrNO3.Вычислено, %:
4.18.
C 59.39; H 3.67; N 3.65.
3-Бензоил-6-R-4-хинолинкарбоновые кисло-
Этиловый эфир 3-бензоил-6-метил-4-хино-
ты 4a-c (общая методика). Эфиры 3a-c растворя-
линкарбоновой кислоты (3с) получен из 0.8 г
ли в 10 мл 10%-ного раствора NaOH. Реакционную
(0.005 моль) 5-метилизатина (2c), 1.1 г (0.005 моль)
массу перемешивали при комнатной температуре
3-морфолино-1-фенилпроп-2-ен-1-она (1а), 0.3 мл
в течение 2 ч. К раствору по каплям прибавляли
триметилхлорсилана в
7 мл смеси этиловый
концентрированную соляную кислоту до кислой
спирт-вода. Выход 1.3 г (81%), маслообразное
реакции среды. Выпавший осадок отфильтровы-
вещество темно-желтого цвета. ИК спектр, ν,
вали, промывали водой и сушили.
см-1: 1718 (С=О), 1668 (С=О). Спектр ЯМР 1H
3-Бензоил-4-хинолинкарбоновая кислота
(ДМСО-d6), δ, м.д.: 1.15 т (3H, CH3, 3J 7.1 Гц), 2.58
(4a) получена из 0.3 г (0.001 моль) этилового эфи-
с (3H, CH3), 4.16 к (2H, CH2О, 3J 7.1 Гц), 7.48 т
ра 3-бензоил-4-хинолинкарбоновой кислоты (3a).
(2Наром, 3J 7.3 Гц), 7.62 т (1Наром, 3J 7.3 Гц), 7.68
Выход 0.24 г (89%), бесцветные кристаллы, т.пл.
д.д (1Н, Н7, 3J 8.5, 4J 1.4 Гц), 7.82 д (2Наром, 3J
228-230°С [19]. ИК спектр, ν, см-1: 3061 (O-H),
7.3 Гц), 7.98 д (1Н, Н5, 4J 1.4 Гц), 8.09 д (1Н,
1708 (C=O), 1666 (C=O). Найдено, %: C 73.69; H
Н8, 3J 8.5 Гц), 8.97 с (1Н, Н2). Спектр ЯМР 13С
4.03; N 5.02. С17Н11NO3. Вычислено, %: C 73.64;
(ДМСО-d6), δ, м.д.: 13.6 (CH3), 22.1 (CH3), 62.4
H 4.00; N 5.05.
(CН2), 123.6, 124.7 (CН), 128.8 (2CH), 129.6 (CН),
129.9 (2CH), 130.2, 133.8 (CН), 133.9 (CН), 136.8,
3-Бензоил-6-бром-4-хинолинкарбоновая
137.7, 139.1, 148.0, 148.1 (CH), 166.1, 194.8. Масс-
кислота (4b) получена из 0.39 г (0.001 моль) эти-
спектр (ЭУ, 70 эВ), m/z (Iотн, %): 319 (40) [М]+, 245
лового эфира 3-бензоил-6-бром-4-хинолинкарбо-
(88), 214 (100). Найдено, %: C 75.30; H 5.43; N 4.32.
новой кислоты (3b). Выход 0.21 г (57%), бесцвет-
С20Н17NO3. Вычислено, %: C 75.22; H 5.37; N 4.39.
ные кристаллы, т.пл. 253-257°С. ИК спектр, ν,
4-Карбокси-3-(1-адамантаноил)хинолин
см-1: 3064 (O-H), 1699 (C=O), 1668 (C=O). Спектр
(3d). Смесь 0.4 г (0.002 моль) изатина (2a) и 0.6 г
ЯМР 1H (ДМСО-d6), δ, м.д.: 7.50 т (2Наром, 3J
(0.002 моль)
1-(адамантан-1-ил)-3-морфолино-
7.1 Гц), 7.64 т (1Наром, 3J 7.1 Гц), 7.71 д (2Наром,
проп-2-ен-1-она (1b) обрабатывали 0.3 мл три-
3J 7.1 Гц), 7.92 уш.с (1Н, ОН), 8.03 д (1Н, Н7, 3J
метилхлорсилана в 6 мл смеси спирт-вода в со-
8.2 Гц), 8.09 д (1Н, Н8, 3J 8.2 Гц), 8.50 с (1Н, Н5),
отношении 2:1. Смесь перемешивали при 80°C
8.98 с (1Н, Н2). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.:
в течение 6 ч. Затем реакционную массу охлаж-
102.2 (СН), 122.4, 124.6, 128.5, 129.3 (2СН), 129.4
дали до комнатной температуры, нейтрализова-
(2СН), 129.9 (СН), 132.2 (СН), 134.1, 134.7 (СН),
ли насыщенным раствором карбоната натрия до
136.9, 147.6 (СН), 149.5, 167.0, 194.9. Найдено, %:
рН 8.0-9.0, а затем экстрагировали этилацетатом
C 57.28; H 2.89; N 3.98. С17Н10BrNO3. Вычислено,
(5×15 мл) и сушили сульфатом натрия. Растворить
%: C 57.33; H 2.83; N 3.93.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ 3-R-6-R'-ХИНОЛИН-4-КАРБОКСИЛАТОВ
1149
3-Бензоил-6-метил-4-хинолинкарбоновая
Н8, 4J 1.6 Гц), 13.65 уш.с (1Н, NH). Спектр ЯМР
кислота (4с) получена из 0.32 г (0.001 моль) эти-
13С (ДМСО-d6), δ, м.д.: 123.3, 123.4, 124.1, 126.9,
лового эфира-3-бензоил-6-метил-4-хинолинкарбо-
129.3 (2CH), 129.7 (CН), 129.9 (CH), 130.3 (2CH),
новой кислоты (3с). Выход 0.2 г (68%), бесцветные
132.0 (CН), 134.6, 134.9 (CН), 145.9, 146.3, 150.2
кристаллы, т.пл. 250-252°С. ИК спектр, ν, см-1:
(CН), 160.0. Найдено, %: C 57.91; H 2.80; N 11.99.
3062 (O-H), 1697 (C=O), 1668 (C=O). Спектр ЯМР
С17Н10BrN3O. Вычислено, %: C 57.98; H 2.86; N
1H (ДМСО-d6), δ, м.д.: 2.53 с (3Н, СН3), 7.47-7.56
11.93.
м (2Наром), 7.63-7.79 м (4Наром), 7.97 с (1Н, Н5),
9-Метил-4-фенилпиридазино[4,5-c]хинолин-
8.06 д (1Н, Н8, 3J 8.2 Гц), 8.90 с (1Н, Н2), 14.13 уш.с
1(2Н)-он (5c) получен из 0.63 г (0.002 моль) эти-
(1Н, ОН). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.:
лового эфира
3-бензоил-6-метил-4-хинолинкар-
22.0 (СН3), 123.1, 124.9 (СН), 129.3 (2СН), 129.4
боновой кислоты (3c) в 3 мл гидразин-гидрата и
(2СН), 129.8 (СН), 130.2 (СН), 130.3, 134.2 (СН),
6 мл этанола. Выход 0.27 г (47%), бесцветные кри-
139.1, 147.7, 148.2 (СН), 156.1, 157.4, 167.7, 180.2.
сталлы, т.пл. 278-280°С. ИК спектр, ν, см-1: 3124
Найдено, %: C 74.25; H 4.41; N 4.86. С18Н13NO3.
(N-H), 1643 (С=О). Спектр ЯМР 1H (ДМСО-d6), δ,
Вычислено, %: C 74.22; H 4.50; N 4.81.
), 7.76 д
м.д.: 2.56 с (3H, CH3),7.52-7.68 м (5H, СНРh
9-R-4-Фенилпиридазино[4,5-c]хинолин-
(1Н, Н10, 3J 8.5 Гц), 8.01 д (1Н, Н11, 3J 8.5 Гц), 8.97
1(2H)-оны 5a-c (общая методика). Смесь этило-
с (1Н, Н8), 9.64 с (1Н, Н2), 13.17 уш.с (1Н, NH).
вого эфира 3-бензоил-6-R-4-хинолинкарбоновой
Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 22.4 (CH3),
кислоты 3a-c, 2 мл гидразин-гидрата и 10 мл 50%-
123.0, 123.1, 126.7 (СН), 127.5, 129.2 (2CH), 129.7
ного этанола нагревали при кипении в течение
(CН), 129.8 (CH), 130.3 (2CH), 133.8 (CН), 134.8,
1 ч. Выпавший осадок отфильтровывали и суши-
139.8, 146.0, 146.3, 148.5 (CН), 160.3. Найдено, %:
ли.
C 75.18; H 4.61; N 14.70. С18Н13N3O. Вычислено,
4-Фенилпиридазино[4,5-c]хинолин-1(2H)-он
%: C 75.25; H 4.56; N 14.63.
(5а) получен из 0.6 г (0.002 моль) этилового эфи-
ЗАКЛЮЧЕНИЕ
ра 3-бензоил-4-хинолинкарбоновой кислоты (3а) в
3 мл гидразин-гидрата и 6 мл этанола. Выход
На основе реакции 3-морфолино-1-R-проп-2-
0.39 г (73%), бесцветные кристаллы, т.пл. 293-
ен-1-онов с изатинами в присутствии триме-
295°С. ИК спектр, ν, см-1: 3130 (N-H), 1653 (C=O).
тилхлорсилана получены неописанные ранее 3-за-
Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 7.49-7.72 м
мещенные 4-хинолинкарбоксилаты. Обнаружено,
(5H, CHPh), 7.88 т (1Н, H9, 3J 8.0 Гц), 7.98 т (1Н,
что в случае реакции 1-(адамантан-1-ил)-3-мор-
H10, 3J 8.0 Гц), 8.18 д (1Н, H11, 3J 8.0 Гц), 9.10 с
фолинопроп-2-ен-1-она с изатином в аналогич-
(1Н, H2), 9.90 д (1Н, H8, 3J 8.0 Гц), 13.51 уш.с (1Н,
ных условиях образуется
4-карбокси-3-(1-ада-
NН). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 122.9,
мантаноил)хинолин. Показана возможность
123.0, 127.8 (СН), 127.9, 129.2 (2CH), 129.8 (CН),
циклизации
3-бензоил-6R-4-хинолинкарбоксила-
129.9 (CH), 130.0 (CH), 130.3 (2CH), 131.9 (CH),
тов с гидразин-гидратом с образованием 9-R-4-
134.8, 145.9, 147.6, 149.6 (CH), 160.2. Найдено, %:
фенилпиридазино[4,5-c]хинолин-1(2Н)-онов.
C 74.77; H 4.12; N 15.32. С17Н11N3O. Вычислено,
%: C 74.71; H 4.06; N 15.38.
БЛАГОДАРНОСТИ
9-Бром-4-фенилпиридазино[4,5-c]хинолин-
Работа выполнена с использованием научно-
1(2Н)-он (5b) получен из 0.76 г (1.5 ммоль) эти-
го оборудования центра коллективного пользова-
лового эфира
3-бензоил-6-бром-4-хинолинкар-
ния СамГТУ «Исследование физико-химических
боновой кислоты (3b) в 3 мл гидразин-гидрата и
свойств веществ и материалов».
6 мл этанола. Выход 0.3 г (54%), бесцветные кри-
ФОНДОВАЯ ПОДДЕРЖКА
сталлы, т.пл. 285-287°С. ИК спектр, ν, см-1: 3093
(N-H), 1670 (C=O), 688 (C-Br). Спектр ЯМР 1H
Работа выполнена при финансовой поддержке
(ДМСО-d6), δ, м.д.: 7.56-7.68 м (5H, СНРh), 8.14-
Минобрнауки РФ в рамках проектной части госу-
8.16 м (2Н, Н10, Н11), 9.14 с (1Н, Н2), 10.14 д (1Н,
дарственного задания № 0778-2020-0005.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1150
ЗЕМЦОВА и др.
ИНФОРМАЦИЯ ОБ АВТОРАХ
рятников В.Н., Малиновская Ю.А., Левина А.С.,
Журавлев О.Е., Ворончихина Л.И., Фисюк А.С.,
Земцова Маргарита Николаевна, ORCID:
Аксенов А.В., Аксенов Н.А., Аксенова И.В. ЖОрХ.
2017, 53, 1257-1408. [Antipin I.S., Kazymova M.A.,
Kuznetsov M.A., Vasilyev A.V., Ishchenko M.A.,
Савостина Анна Олеговна, ORCID: https://
Kiryushkin A.A., Kuznetsova L.M., Makarenko S.V.,
orcid.org/0000-0002-6573-7156
Ostrovskii V.A., Petrov M.L., Solod O.V., Trishin Yu.G.,
Баймуратов Марат Рамильевич, ORCID: https://
Yakovlev I.P., Nenaidenko V.G., Beloglazkina E.K.,
orcid.org/0000-0002-3326-5561
Beletskaya I.P., Ustynyuk Yu.A., Solov’ev P.A., Iva-
nov I.V., Malina E.V., Sivova N.V., Negrebetskii V.V.,
Климочкин Юрий Николаевич, ORCID: https://
Baukov Yu.I., Pozharskaya N.A., Traven’ V.F.,
orcid.org/0000-0002-7335-4040
Shchekotikhin A.E., Varlamov A.V., Borisova T.N.,
Lesina Yu.A., Krasnokutskaya E.A., Rogozhnikov S.I.,
КОНФЛИКТ ИНТЕРЕСОВ
Shurov S.N., Kustova T.P., Klyuev M.V., Khelevi-
Авторы заявляют об отсутствии конфликта ин-
na O.G., Stuzhin P.A., Fedorov A.Yu., Gushchin A.V.,
тересов.
Dodonov V.A., Kolobov A.V., Plakhtinskii V.V., Or-
lov V.Yu., Kriven’ko A.P., Fedotova O.V., Pchelintse-
СПИСОК ЛИТЕРАТУРЫ
va N.V., Charushin V.N., Chupakhin O.N., Klimoch-
1. Matada B.S., Pattanashettar R., Yernale N.G.
kin Yu.N., Klimochkina A.Yu., Kuryatnikov V.N.,
Bioorg. Med. Chem. 2021, 32, 1-25. doi 10.1016/
Malinovskaya Yu.A., Levina A.S., Zhuravlev O.E., Vo-
j.bmc.2020.115973
ronchikhina L.I., Fisyuk A.S., Aksenov A.V., Akse-
nov N.A., Aksenova, I.V. Russ. J. Org. Chem. 2017, 53,
2. Nainwal L.M., Tasneem S., Akhtar W., Verma G.,
1275-1437.] doi 10.1134/S1070428017090019
Khan M.F., Parvez S., Shaquiquzzaman M., Akhter M.,
Alam M.M. Eur. J. Med. Chem. 2019, 164, 121-170.
6. Zalkow L.H., Nabors J.B., French K., Bisarya S.C.
doi 10.1016/j.ejmech.2018.11.026
J. Chem. Soc. C: Org. 1971, 21, 3551-3554. doi
10.1039/J39710003551
3. Fu H-G., Li Z-W., Hu X-X., Si S-Y., You X-F., Tang S.,
7. Новичихина Н.П., Шестаков А.С., Скопцова А.А.,
Wang Y-X., Song D-Q. Molecules. 2019, 24, 548-558.
Ашрафова З.Э., Столповская Н.В., Кошелева Е.А.,
doi 10.3390/molecules24030548
Шаталов Г.В., Леденева И.В., Шихалиев Х.С. ЖОрХ.
4. Земцова М.Н., Зимичев А.В., Трахтенберг П.Л.,
2021, 57, 1393-1402. [Novichikhina N.P., Shesta-
Климочкин Ю.Н., Леонова М.В., Балахнин С.М.,
kov A.S., Skoptsova A.A., Ashrafova Z.E., Stolpovs-
Бормотов Н.И., Серова О.А., Беланов Е.Ф. Хим.-
kaya N.V., Kosheleva E.A., Shatalov G.V., Ledenyo-
фарм. ж. 2011, 45, 9-11. [Zemtsova M.N., Zimi-
va I.V., Shikhaliev Kh.S. Russ. J. Org. Chem. 2021, 57,
chev A.V., Trakhtenberg P.L., Klimochkin Yu.N.,
1592-1599.] doi 10.1134/S1070428021100043
Leonova M.V., Balakhnin S.M., Bormotov N.I., Sero-
8. Новичихина Н.П., Скопцова А.А., Шестаков А.С.,
va O.A., Belanov E.F. Pharm. Chem. J. 2011, 45,
Потапов А.Ю., Кошелева Е.А., Козадеров О.А., Ле-
267-269.] doi 10.1007/s11094-011-0613-z
денева И.В., Подоплелова Н.А., Пантелеев М.А.,
5. Антипин И.С., Казымова М.А., Кузнецов М.А., Ва-
Шихалиев Х.С. ЖОрХ.
2020,
56,
1376-1384.
сильев А.В., Ищенко М.А., Кирюшкин А.А., Куз-
[Novichikhina N.P., Skoptsova A.A., Shestakov A.S.,
нецова Л.М., Макаренко С.В., Островский В.А.,
Potapov A.Yu., Kosheleva E.A., Kozaderov O.A.,
Петров М.Л., Солод О.В., Тришин Ю.Г., Яков-
Ledenyova I.V., Podoplelova N.A., Panteleev M.A.,
лев И.П., Ненайденко В.Г., Белоглазкина Е.К., Бе-
Shikhaliev Kh.S. Russ. J. Org. Chem. 2020, 56, 1550-
лецкая И.П., Устынюк Ю.А., Соловьев П.А., Ива-
1556.] doi 10.1134/S1070428020090080
нов И.В., Малина Е.В., Сивова Н.В., Негребец-
9. Wang B., Li Q., Shi W., Chen L., Sun J. Chem. Biol.
кий В.В., Бауков Ю.И., Пожарская Н.А., Тра-
Drug Des. 2018, 91, 957-961. doi 10.1111/cbdd.13154
вень В.Ф., Щекотихин А.Е., Варламов А.В., Борисо-
ва Т.Н., Лесина Ю.А., Краснокутская Е.А., Рогожни-
10. Kumar K.S., Siddaiah V., Lilakar J.D., Sunanda K.,
ков С.И., Шуров С.Н., Кустова Т.П., Клюев М.В.,
Ganesh A. Russ. J. Org. Chem. 2020, 56, 2014-2021.
Хелевина О.Г., Стужин П.А., Федоров А.Ю., Гу-
doi 10.1134/S1070428020110160
щин А.В., Додонов В.А., Колобов А.В., Плахтин-
11. Земцова М.Н., Головко Ю.А., Грузд Ю.А., Куле-
ский В.В., Орлов В.Ю., Кривенько А.П., Федото-
мина С.В., Баймуратов М.Р., Климочкин Ю.Н.
ва О.В., Пчелинцева Н.В., Чарушин В.Н., Чупа-
ЖОрХ. 2021, 57, 728-736. [Zemtsova M.N., Golov-
хин О.Н., Климочкин Ю.Н., Климочкина А.Ю., Ку-
ko Yu.A, Gruzd Yu.A., Kulemina S.V., Baimura-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ 3-R-6-R'-ХИНОЛИН-4-КАРБОКСИЛАТОВ
1151
tov M.R., Klimochkin Yu.N. Russ. J. Org. Chem. 2021,
16. Mestres R. J. Chem. Soc., Perkin Trans. 1. 1972, 6,
57, 793-800.] doi 10.1134/S1070428021050055
805-809. doi 10.1039/p19720000805
12. Журавлева Ю.А., Зимичев А.В., Земцова М.Н., Кли-
17. Макарова Н.В., Пименов А.А., Земцова М.Н., Мо-
мочкин Ю.Н. ЖОрХ. 2011, 47, 610-611. [Zhuravle-
исеев И.К. ЖОрХ. 2001, 37, 1158-1160. [Makaro-
va Yu.A., Zimichev A.V., Zemtsova M.N., Klimoch-
kin Yu.N. Russ. J. Org. Chem. 2011, 47, 617-618.] doi
va N.V., Pimenov A.A., Zemtsova M.N., Moiseev I.K.
10.1134/S1070428011040270
Russ. J. Org. Chem. 2001, 37, 1158-1160.] doi
13. Yu F., Yan S., Hu L., Wang Y., Lin J. Org. Lett. 2011,
10.1023/A:1013128027975
13, 4782-4785. doi 10.1021/ol201783d
18. Zhou P., Hu B., Zhao S., Zhang Q., Wang Y., Li X.,
14. Padget K., Stewart A., Charlton P., Tilby M.J., Aus-
Yu F. Tetrahedron Lett. 2018, 59, 3116-3119. doi
tin C.A. Biochem. Pharmacol. 2000, 60, 817-821. doi
10.1016/j.tetlet.2018.07.006
10.1016/S0006-2952(00)00402-0
15. Godard A., Quéguiner G. J. Heterocycl. Chem. 1984,
19. Elghamry I., Al-Faiyz Y. Tetrahedron Lett. 2016, 57,
21, 27-32. doi 10.1002/jhet.5570210107
110-112. doi 10.1016/j.tetlet.2015.11.070
Synthesis of 3-R-6-R'-Quinoline-4-carboxylates
and their Reactions with Hydrazine Hydrate
M. N. Zemtsova, A. O. Savostina, M. R. Baimuratov*, and Yu. N. Klimochkin
Samara State Technical University, ul. Molodogvardeiskaya, 244, Samara, 443100 Russia
*е-mail: baymuratovmr@yandex.ru
Received January 18, 2022; revised February 14, 2022; accepted February 16, 2022
A method has been developed for the synthesis of 3-substituted quinoline-4-carboxylates by the reaction of
3-morpholino-1-R-prop-2-en-1-ones with isatins in the presence of trimethylchlorosilane in aqueous alcohol. The
possibility of cyclization of 3-benzoyl-6R-quinoline-4-carboxylates with hydrazine hydrate with the formation
of 9-R-4-phenylpyridazino[4,5-c]quinolin-1(2H)-ones has been shown.
Keywords: quinoline, isatins, ketones, 4-quinolinecarboxylic acids, cyclization, pyridazinoquinolines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022