ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 11, с. 1159-1167
УДК 547.833
СИНТЕЗ И НЕКОТОРЫЕ ПРЕВРАЩЕНИЯ
ЭТИЛОВОГО ЭФИРА 6,7-ДИМЕТОКСИ-
2',3',5',6'-ТЕТРАГИДРО-3Н-СПИРО[ИЗОХИНОЛИН-
4,4'-ПИРАН]-1-КАРБОНОВОЙ КИСЛОТЫ
© 2022 г. А. А. Агекян*, Г. А. Паносян
Научно-технологический центр органической и фармацевтической химии НАН Республики Армения,
0014, Ереван, просп. Азатутяна, 26
*е-mail: aaghekyan@mail.ru
Поступила в редакцию 28.12.2021 г.
После доработки 11.01.2022 г.
Принята к публикации 13.01.2022 г.
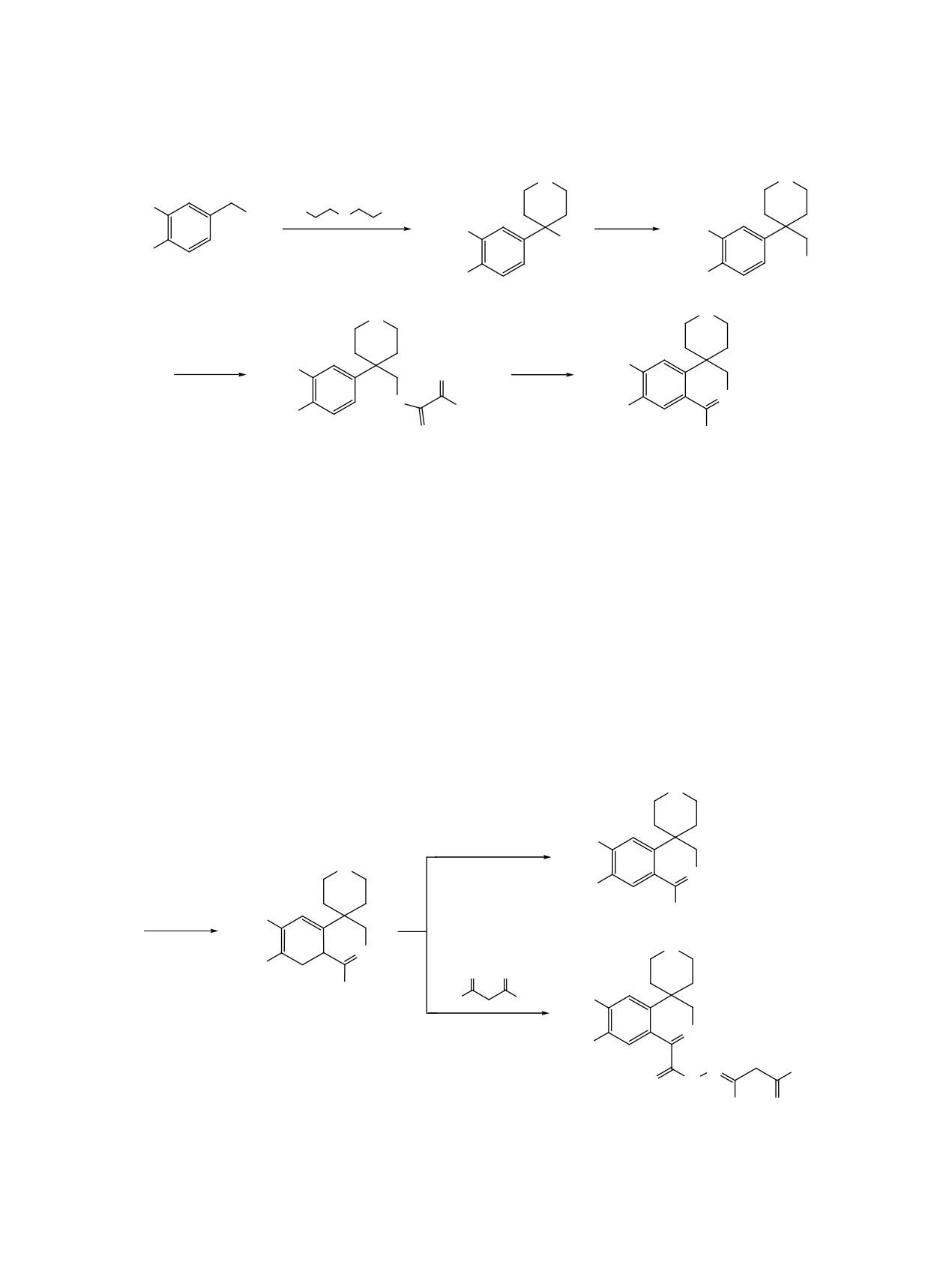
Реакцией [4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-4-ил]метиламина с диэтилоксалатом синтези-
рован этилoвый эфир N-[4-(3,4-диметоксифенил)тетрагидропиран-4-метил]амида щавелевой кислоты,
циклизацией которого хлорокисью фосфора в условиях реакции Бишлера-Напиральского получен
1-карбэтоксизамещенный дигидроизохинолин. Последний действием метиламина переведен в соответ-
ствующее N-метилкарбоксамидное производное, при восстановлении которого выделен 6,7-диметок-
си-N-метил-2,2',3,3',5',6'-гексагидро-1Н-спиро[изохинолин-4,4'-пиран]-1-карбоксамид. Рядом химических
реакций получены новые производные 4-спиротетрагидропиранзамещенных дигидро- и тетрагидроизо-
хинолинов, содержащие различные заместители в положениях 1 и 2 гетероциклического кольца.
Ключевые слова: тетрагидропиран, диэтилоксалат, карбоксамид, тетрагидроизохинолин, восстановле-
ние, реакция Бишлера-Напиральского
DOI: 10.31857/S0514749222110040, EDN: LRNAIG
ВВЕДЕНИЕ
новый фрагмент, a в положениях 1 и 2 - различные
фармакофорные группы (эфирную, амидную, кар-
Многие алкалоиды содержат в своих струк-
боксильную и др.).
турах ядро
1,2,3,4-тетрагидроизохинолина
[1].
Производные изохинолина играют важную роль
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
в медицинской химии благодаря их значительной
В качестве ключевого соединения для синтеза
биологической активности. Диапазон их физиоло-
целевых продуктов использован [4-(3,4-диметок-
гического действия весьма широк, среди них выяв-
сифенил)тетрагидро-2Н-пиран-4-ил]метиламин,
лены спазмолитики, симпатомиметики, антикон-
синтез которого описан в литературе [15]: восста-
вульсанты, антикоагулянты, антибактериальные и
новлением либо в автоклаве, либо гидразин-ги-
противоопухолевые препараты, а также средства,
дратом в присутствии катализатора Ni/Re нитри-
действующие на сердечный ритм [2-8]. Поэтому
ла
4-(3,4-диметоксифенил)тетрагидро-2Н-пиран-
синтез соединений, включающих замещенное в
4-карбоновой кислоты (1), в свою очередь по-
различных положениях тетрагидроизохинолино-
лученного реакцией нитрила
3,4-диметоксифе-
вое кольцо, продолжает представлять большой
нилуксусной кислоты с 2,2'-дихлордиэтиловым
интерес [9-14]. Настоящая работа посвящена син-
эфиром в толуоле в присутствии амида натрия.
тезу новых производных тетрагидроизохинолина,
Нами разработан метод получения вышеуказан-
содержащих в положении 4 спиротетрагидропира-
ного нитрила 1 с использованием тех же реаген-
1159
1160
АГЕКЯН, ПАНОСЯН
Схема 1
O
O
H3CO
Cl
Cl
CN
O
LiAlH4
H3CO
H3CO
CN
H3CO
NH
2
H3CO
H3CO
1
2
O
O
(COOEt)2
POCl3
H3CO
H3CO
O
N
HN
OC2H5
H3CO
H3CO
O
COOC2H5
3
4
тов, но в среде ДМФА и в присутствии едкого
Наличие в положении 1 дигидроизохинолина
натра. Последующим восстановлением нитрила 1
4 карбэтоксильнoй группы позволяет провести
алюмогидридом лития в среде тетрагидрофурана
ряд реакций, приводящих к новым производным
изохинолина с различными заместителями в поло-
с выходом 75% выделен ключевой амин 2, взаи-
жении 1. Взаимодействием соединения 4 с гидра-
модействием которого с диэтилоксалатом в среде
зин-гидратом получен гидразид 5, однако попытка
хлороформа получен моноэтиловый эфир амида
провести по методике [16] циклизацию гидразида
щавелевой кислоты 3. Последний циклизациeй в
ортомуравьиным эфиром в замещенный 1,3,4-ок-
условиях реакции Бишлера-Напиральского пере-
садиазол или действием ацетилацетона по мето-
веден в спирозамещенный 1-карбэтокси-3,4-диги-
дике [17] в замещенный 3,5-диметилпиразол не
дроизохинолин 4, что подтверждено наличием в
удалась, в результате были выделены лишь проме-
спектре ЯМР 1Н сигналов 2 ароматических прото-
жуточные линейные продукты присоединения 6 и
нов вместо 3 в исходном амидоэфире 3 (схема 1).
7 (схема 2).
Схема 2
O
CH(OC2H5)3
H3CO
O
N
H3CO
CONHN=CHOC2H5
N2H4.H2O
H3CO
4
6
O
N
H3CO
O O
CONHNH2
H3C
CH3
H3CO
5
N
H3CO
N
CH3
O N
H
CH3
O
7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ И НЕКОТОРЫЕ ПРЕВР
АЩЕНИЯ ЭТИЛОВОГО ЭФИРА
1161
Схема 3
O
O
O
CH3NH2
H3CO
NaBH4
H3CO
HCOOH, CH2O
H3CO
4
N
NH
NCH3
H3CO
H3CO
H3CO
CONHCH3
CONHCH3
CONHCH3
8
9
10
ClC(O)OCH3
Cl
Ht
O
O
H3CO
O
H3CO
N
OCH3
H3CO
N
Ht
H3CO
CONHCH
3
CONHCH3
11
12a, b
CH3
Ht =
COOCH3
(a),
(b).
N
O
N O
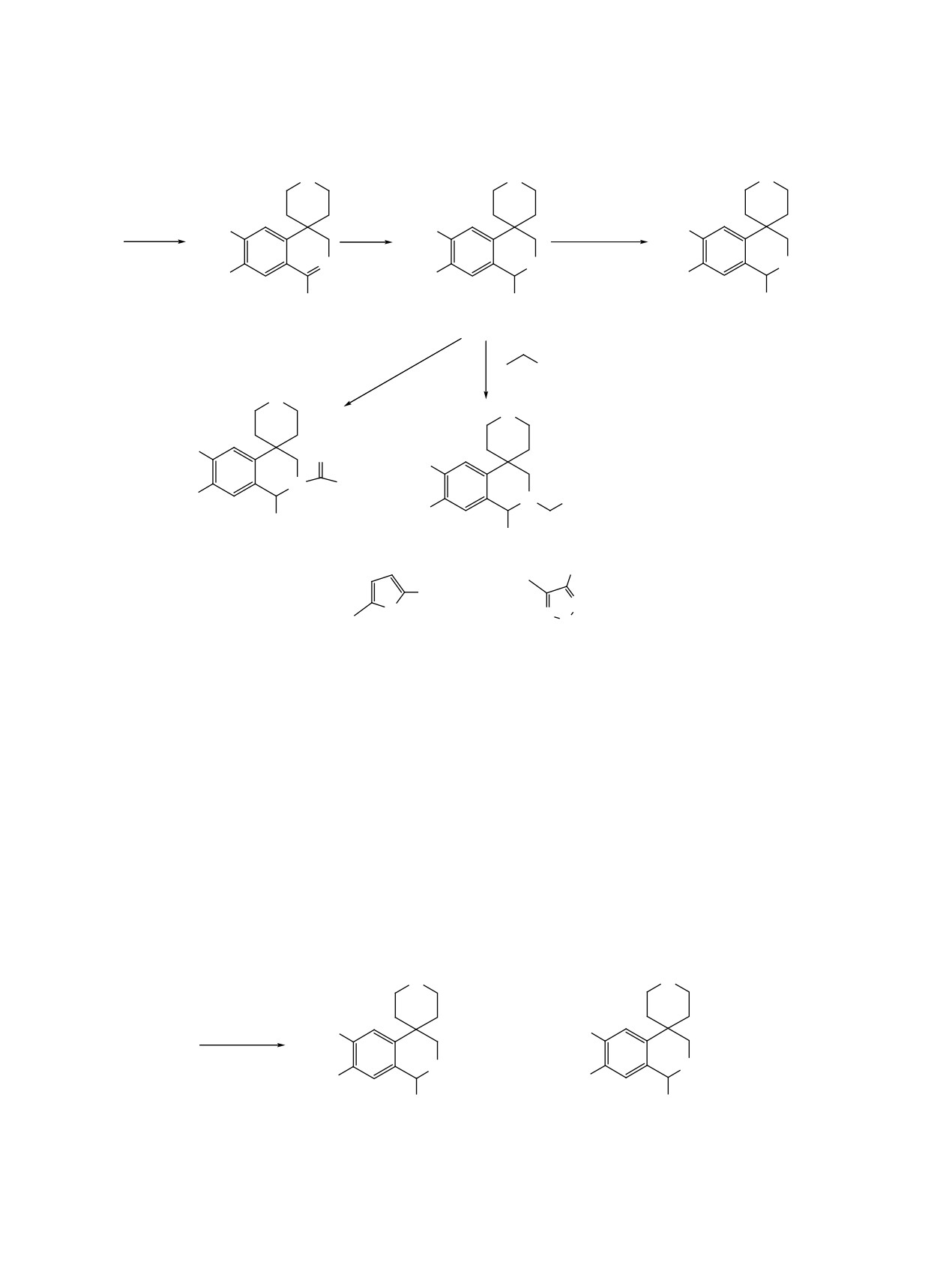
Исследована реакция избирательного гидриро-
ния 9 с метиловым эфиром хлоругольной кислоты
вания двойной связи дигидроизохинолина 4 борги-
получен карбамат 11, а алкилированием метило-
дридом натрия. Однако вследствие неустойчиво-
вым эфиром 5-хлорметифуран-2-карбоновой кис-
сти карбэтоксильной группы в условиях проведе-
лоты и 4-метил-3-хлорметил-1,2,5-оксадиазолом в
ния реакции выделить тетрагидроизохинолиновое
смеси диоксан-спирт (10:1) выделены 2-гетерил-
производное не удалось. С целью сохранения кар-
метилзамещенные тетрагидроизохинолины 12a, b
бонильного фрагмента действием метиламина был
(схема 3).
получен N-метилкарбоксамид дигидроизохиноли-
Восстановление дигидроизохинолина 8 алюмо-
на 8, восстановленный боргидридом натрия до со-
гидридом лития также приводит к тетрагидроизо-
ответствующего тетрагидроизохинолина 9 с кар-
хинолину 9 с небольшой примесью (≈ 10%) пол-
боксамидной группой в положении 1. Последний
ностью гидрированного соединения. Продукты
в условиях реакции Эшвайлерa-Кларка смесью
реакции удалось разделить благодаря различной
формалина и муравьиной кислоты переведен в
растворимости дигидрохлорида 13 и гидрохлори-
N-метильное производноe 10. Реакцией соедине-
да 14 в абсолютном этаноле (схема 4).
Схема 4
O
O
1. LiAlH4
2. HCl
H3CO
H3CO
8
+
NH
2HCl
NH . HCl
H3CO
H3CO
CH2NHCH3
CONHCH3
13
14
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1162
АГЕКЯН, ПАНОСЯН
Схема 5
O
O
HO
HBr
HCl
H3CO
9
NH
HBr
NH
HCl
HO
H3CO
COOH
COOH
15
16
Изучена реакция деметилирования тетрагидро-
28.6 г (0.2 моль) 2,2'-дихлордиэтилового эфира с
изохинолина 9 40%-ной бромистоводородной кис-
такой скоростью, чтобы температура поднималась
лотой. Установлено, что реакция деметилирования
не выше 70-75°С, и перемешивали при этой тем-
сопровождается гидролизом амидной группы с
пературе 4 ч. По охлаждении к смеси прибавля-
образованием гидробромида 6,7-дигидроксиизо-
ли 150 мл бензола и 300 мл воды, органический
хинолина 15, содержащего в положении 1 карбок-
слой отделяли, водный слой экстрагировали 2 раза
сильную группу. Гидролизом того же карбоксами-
бензолом. Объединенные бензольные экстракты
да 9 кипячением в концентрированной соляной
промывали водой, сушили MgSO4, отгоняли рас-
кислоте получен гидрохлорид 1-карбокси-6,7-ди-
творитель и остаток перегоняли в вакууме. Выход
метоксиизохинолинa 16 (схема 5). В спектре ЯМР
32.0 г (64.5%), т.кип. 210-215°С/2 мм рт.ст. (185-
1Н соединения 15 отсутствуют сигналы протонов
190°C/0.5 мм рт.ст. [15]), т.пл. 70°С (метанол), Rf
метоксильных групп, тогда как в спектре соедине-
0.51 (бензол-эфир, 10:1). Найдено, %: С 68.23; Н
ния 16 эти сигналы проявляются в области 3.80 и
6.82; N 5.48. С14Н17NО3. Вычислено, %: С 68.00;
3.84 м.д.
Н 6.93; N 5.66.
Все синтезированные соединения - кристал-
[4-(3,4-Диметоксифенил)тетрагидро-2Н-пи-
лические вещества, чистота и строение которых
ран-4-ил])метиламин
(2). К суспензии
4.5 г
подтверждены физико-химическими методами и
(0.12 моль) алюмогидрида лития в 150 мл абсо-
ТСХ.
лютного эфира прибавляли 15.0 г (0.06 моль) ни-
трила 1 в 100 мл тетрагидрофурана и реакционную
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
смесь кипятили 18 ч. Комплекс разлагали водой,
ИК спектры соединений сняты на спектро-
отфильтровывали, фильтрат сушили, отгоняли
метре Nicolet Avatar 330 FT-IR (США) в вазе-
растворитель и остаток перегоняли в вакууме.
линовом масле, спектры ЯМР 1Н - на приборе
Выход 11.5 г (75.5%), т.кип. 188-193°С/2 мм рт.ст.
Varian Mercury-300 (США) в ДМСО-d6, рабочая
(174-176°C/0.4 мм рт.ст. [15]), Rf 0.45 (бензол-аце-
частота 300 МГц, внутренний стандарт - ТМС.
тон, 1:1, пары NH3). Найдено, %: С 66.78; Н 8.59;
Температуры плавления определены на микро-
N 5.72. С14Н21NО3. Вычислено, %: С 66.91; Н 8.42;
нагревательном столике Boëtius (Германия).
N 5.57.
Контроль за ходом реакций и индивидуальностью
Этил-2-{[4-(3,4-диметоксифенил)тетраги-
синтезированных соединений осуществляли с по-
дро-2Н-пиран-4-ил]метиламино}-2-оксоацетат
мощью ТСХ на пластинах Silufol UV-254, прояви-
(3). К кипящему раствору 73.0 г (0.5 моль) ди-
тель - пары йода. Все использованные реагенты
этилоксалата в 200 мл хлороформа медленно при-
соответствуют стандарту «х.ч.».
бавляли по каплям раствор 25.1 г (0.1 моль) ами-
Нитрил 4-(3,4-диметоксифенил)тетрагидро-
на 2 в 100 мл хлороформа и смесь кипятили 10 ч.
2Н-пиран-4-карбоновой кислоты (1). K раство-
Отгоняли хлороформ и избыток диэтилоксалата,
ру 35.5 г (0.2 моль) нитрила 3,4-диметоксифе-
остаток кристаллизовали в эфире. Выход 29.5 г
нилуксусной кислоты в 150 мл абс. ДМФА при
(83%), т.пл. 105-106°С (гексан), Rf 0.63 (бензол-
перемешивании прибавляли 24.0 г (0.6 моль) по-
ацетон, 8:1). ИК спектр, ν, см-1: 3317 (NН), 1744
рошкообразного NaOH, через 0.5 ч прибавляли
(СОО), 1683 (NСО). Спектр ЯМР 1Н, δ, м.д.: 1.34
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ И НЕКОТОРЫЕ ПРЕВР
АЩЕНИЯ ЭТИЛОВОГО ЭФИРА
1163
т (3Н, СН2СН3, J 7.1 Гц), 1.82 д.д.д (2Н, CH2, J
1662.7 (CO), 1640 (C=N). Спектр ЯМР 1Н, δ, м.д.:
14.0, 8.8, 3.7 Гц), 1.96-2.05 м (2H, СН2), 3.33 д (2Н,
1.51 уш.д (2Н, J 13.6 Гц) и 1.92 д.д.д (2Н, СН2, J
NСН2, J 6.6 Гц), 3.45 д.д.д (2Н, ОCH2, J 11.5, 8.8,
13.6, 10.8, 5.5 Гц), 3.65-3.78 м (4Н, ОСН2), 3.80 с
2.7 Гц), 3.70 д.д.д (2Н, ОCH2, J 11.5, 5.3, 3.7 Гц),
(2Н, NСН2), 3.80 с (3Н, ОСН3), 3.89 с (3Н, ОСН3),
3.80 с (6Н, ОСН3), 4.22 к (2Н, СН2СН3, J 7.1 Гц),
4.20 уш.с (2Н, NН2), 6.94 c (1H) и 7.60 c (1H,
6.77-6.88 м (3Н, С6Н3), 7.71 т (1Н, NН, J 6.6 Гц).
С6Н2), 9.14 уш.с (1Н, NН). Спектр ЯМР 13С, δ,
Спектр ЯМР 13С, δ, м.д.: 13.5 (СН3), 33.0 (2СН2),
м.д.: 31.3, 32.5 (2СH2), 52.0 (NСН2), 55.2 (2ОСH3),
40.0, 48.7 (NСН2), 55.0 (СH3), 55.3 (СH3), 61.3
62.8 (2ОСH2), 106.0 (СН), 111.7 (СН), 117.9, 139.1,
(СН2), 63.0 (2СH2), 110.9 (СН), 111.6 (СН), 118.6,
146.5, 151.6, 159.6, 163.8. Найдено, %: С 60.43; Н
135.2, 147.4, 148.8, 156.4, 160.3. Найдено, %: С
6.52; N 13.03. С16Н21N3О4. Вычислено, %: С 60.17;
61.78; Н 7.29; N 3.73. С18Н25NО6. Вычислено, %:
Н 6.63; N 13.16.
С 61.52; Н 7.17; N 3.99.
Этил-N'-(6,7-диметокси-2',3',5',6'-тетра-
Этил-6,7-диметокси-2',3',5',6'-тетрагидро-
гидро-3Н-спиро[изохинолин-4,4'-пиран]-1-ил-
3Н-спиро[изохинолин-4,4’-пиран]-1-кар-
карбонил)формогидразонат
(6). Смесь
1.6 г
боксилат (4). Смесь 14.0 г (0.4 моль) амидоэфира
(0.005 моль) соединения 5 и 3 мл ортомуравьино-
3 и 60 мл хлорокиси фосфора в 250 мл ацетони-
го эфира нагревали 2 ч при 110-115°С и 10 ч при
трила кипятили в течение 9 ч, отгоняли раствори-
125-130°С. Образовавшиеся кристаллы отфиль-
тель, остаток растворяли в воде, экстрагировали
тровывали, промывали эфиром и перекристал-
бензолом дважды по 50 мл. Кислый слой отделяли
лизовывали из спирта. Смесь 2 изомеров, 85:15.
и при охлаждении (5-8°С) подщелачивали амми-
Выход 1.4 г (74%), т.пл. 204-205°С, Rf 0.53 (бен-
ачной водой до рН 8.0. Экстрагировали бензолом
зол-ацетон, 1:2). Спектр ЯМР 1Н, δ, м.д.: 1.36 т
(3×100 мл), раствор сушили сернокислым натрием,
(0.45 Н) и 1.42 т (2.55Н, СН3, J 7.1 Гц), 1.46-1.56
отгоняли растворитель и остаток кристаллизовали
м (2Н) и 1.89-2.01 м (2Н, СН2), 3.66-3.81 м [4Н,
в эфире. Выход 9.5 г (71%), т.пл. 116-118°С (бен-
(СН2)2О], 3.82 с (0.45Н) и 3.83 с (2.55Н, ОСН3),
зол-эфир, 2:1), Rf 0.52 (бензол-ацетон, 1:1). ИК
3.90 с (0.45Н) и 3.91 с (2.55Н, ОСН3), 3.85 с (2Н,
спектр, ν, см-1: 1726 (СОО), 1645 (C=N). Спектр
NСН2), 4.22 к (0.3Н) и 4.26 к (1.7Н, ОСН2СН3, J
ЯМР 1Н, δ, м.д.: 1.41 т (3Н, СН3, J 7.1 Гц), 1.46-
7.1 Гц), 6.94 с (0.85Н) и 7.56 с (0.15Н, =СН), 6.96
1.54 м (2Н, CH2), 1.95 д.д.д (2H, CH2, J 13.7, 10.7,
с (0.85Н) и 7.57 с (0.15Н, =СН), 7.81 с (0.85Н) и
5.7 Гц), 3.67-3.77 м (4Н, ОСН2), 3.80 с (3Н, ОСН3),
8.38 с (0.15Н, N=СН), 10.24 с (0.85Н) и 10.72 с
3.83 с (2Н, NСН2), 3.90 с (3Н, ОСН3), 4.35 к (2Н,
(0.15Н, NН). Найдено, %: С 60.57; Н 6.83; N 11.35.
ОСН2, J 7.1 Гц), 6.98 с (1Н) и 7.09 с (1Н, С6Н2).
С19Н25N3О5. Вычислено, %: С 60.79; Н 6.71; N
Спектр ЯМР 13С, δ, м.д.: 13.7 (СН3), 31.3 (СН2),
11.19.
32.5 (СН2), 40.0, 52.0 (NСН2), 55.2 (ОСH3), 55.3
6,7-Диметокси-N'-(4-оксопентан-2-илиден)-
(ОСH3), 60.4 (ОСН2), 62.7 (2.ОСH2), 106.3 (СН),
2',3',5',6'-тетрагидро-3Н-спиро[изохинолин-
110.3 (СН), 117.2, 138.9, 146.8, 151.9, 158.8, 164.1.
4,4'-пиран]-1-карбогидразид
(7). Смесь
1.6 г
Найдено, %: С 64.67; Н 6.77; N 4.42. С18Н23NО5.
(0.005 моль) гидразида 5 и 2.0 г (0.02 моль) пен-
Вычислено, %: С 64.85; Н 6.95; N 4.20.
тан-2,4-диона в 10 мл сухого диоксана нагрева-
Гидразид
6,7-диметокси-2',3',5',6'-тетраги-
ли при 90-100°С 10 ч. Отгоняли растворитель, к
дро-3Н-спиро[изохинолин-4,4’-пиран]-1-кар-
остатку прибавляли воду, кристаллы отфильтро-
боновой кислоты (5). Смесь 5.0 г (0.015 моль)
вывали, промывали разбавленной уксусной кисло-
соединения 4 и 15 мл гидразин-гидрата в 30 мл
той, водой, сушили и перекристаллизовывали из
этанола кипятили 1 ч и оставляли при комнатной
метанола. Выход 1.3 г (65%), т.пл. 179-181°С, Rf
температуре 5 ч. Выпавшие кристаллы отфиль-
0.48 (бензол-ацетон, 1:2). Спектр ЯМР 1Н, δ, м.д.:
тровывали, промывали спиртом, водой, сушили
1.60-1.76 м (2Н) и 1.82-2.03 м (2Н, СН2), 1.86 с (3Н,
и перекристаллизовывали из спирта. Выход 4.0 г
N=ССН3), 1.95 с (3Н, СОСН3), 2.83 с (2Н, СН2),
(83%), т.пл. 175-177°С, Rf 0.40 (бензол-ацетон,
3.64-3.82 м [4Н, (СН2)2О], 3.73 с (3Н, ОСН3), 3.73
1:1). ИК спектр, ν, см-1: 3364.5, 3306.7 (NH, NH2),
с (2Н, NСН2), 3.88 с (3Н, ОСН3), 6.51 уш.с (1Н,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1164
АГЕКЯН, ПАНОСЯН
NН), 6.79 с (1Н) и 6.96 с (1Н, С6Н2). Найдено, %: С
63.0 (ОСН2), 109.2 (СН), 110.0 (СН), 125.4, 135.1,
62.59; Н 6.90; N 10.61. С21Н27N3О5. Вычислено, %:
146.7, 147.8, 172.2. Найдено, %: С 64.01; Н 7.42; N
С 62.83; Н 6.78; N 10.47.
8.65. С17Н24N2О4. Вычислено, %: С 63.73; Н 7.55;
N 8.74. Т.пл. гидрохлорида 168-170°С (спирт).
6,7-Диметокси-N-метил-2',3',5',6'-тетра-
гидро-3Н-спиро[изохинолин-4,4’-пиран]-1-кар-
6,7-Диметокси-N,2-диметил-2,2',3,3',5',6'-
боксамид (8). Смесь 10.0 г (0.03 моль) дигидро-
гексагидро-1Н-спиро[изохинолин-4,4’-пиран]-
изохинолина 4 и 1.9 г (0.06 моль) метиламина в
1-карбоксамид (10). Смесь 1.3 г (0.004 моль) те-
100 мл этанола оставляли на 8 ч при комнатной
трагидроизохинолина 9, 2.3 г 85%-ной муравьиной
температуре. Растворитель отгоняли, остаток кри-
кислоты и 2.1 г 28%-ного формалина нагревали
сталлизовали в эфире. Выход 8.5 г (88.5%), т.пл.
3 ч на масляной бане (tбани 140°C). По охлаждении
171-172°С (бензол-эфир, 2:1). Rf 0.47 (бензол-
добавляли 50 мл воды и экстрагировали бензолом
ацетон, 1:1). ИК спектр, ν, см-1: 3308 (NH), 1652
(3×30 мл). Бензольный экстракт промывали водой,
(CO), 1640 (C=N). Спектр ЯМР 1Н, δ, м.д.: 1.45-
сушили сернокислым магнием и отгоняли досуха.
1.54 м (2Н, CH2), 1.93 д.д.д (2Н, СН2, J 13.4, 10.8,
Маслообразный остаток кристаллизовали в эфи-
5.4 Гц), 2.82 д (3Н, NСН3, J 4.9 Гц), 3.65-3.79 м
ре и перекристаллизовывали из бензола. Выход
[4Н, (СН2)2О], 3.80 с (2Н, NСН2), 3.82 с (3Н) и 3.89
0.93 г (68.4%), т.пл. 157-159°С, Rf 0.54 (бензол-
с (3Н, ОСН3), 6.94 с (1Н) и 7.74 с (1Н, С6Н2), 7.95
ацетон, 2:1, пары NH3). ИК спектр, ν, см-1: 3306
уш.к (1Н, NH, J 4.9 Гц). Спектр ЯМР 13С, δ, м.д.:
(NН), 1650 (NСО). Спектр ЯМР 1Н, δ, м.д.: 1.20-
25.2 (СН3), 31.3, 32.4 (2СН2), 52.1 (NСН2), 55.1
1.28 м (1Н), 1.70-1.82 м (1Н), 2.02-2.10 м (1Н)
(2С), 62.8 (2С), 105.9 (СН), 112.3 (СН), 117.9, 139.2,
и 2.26-2.34 м (1Н, СН2), 2.17 уш.д (1Н, NСН2, J
146.4, 151.4, 159.4, 164.3. Найдено, %: С 64.41; Н
11.7 Гц), 2.37 с (3Н, NСН3), 2.67 д (3Н, NНСН3,
6.75; N 8.68. С17Н22N2О4. Вычислено, %: С 64.13;
J 4.8 Гц), 3.44 д (1Н, NСН2, J 11.7 Гц), 3.52-3.69
Н 6.97; N 8.80.
м (2Н, ОСН2), 3.63 с (1Н, СН), 3.71-3.82 м (2Н,
ОСН2), 3.74 с (3Н) и 3.79 с (3Н, ОСН3), 6.82 с
6,7-Диметокси-N-метил-2,2',3,3',5',6'-гек-
(1Н) и 6.87 с (1Н, С6Н2), 7.05 к (1Н, NН, J 4.8 Гц).
сагидро-1Н-спиро[изохинолин-4,4'-пиран]-
Найдено, %: С 64.83; Н 7.67; N 8.51. С18Н26N2О4.
1-карбоксамид (9). К раствору 6.4 г (0.02 моль)
Вычислено, %: С 64.65; Н 7.84; N 8.38.
дигидроизохинолина 8 в 100 мл метанола при тем-
пературе 0-5°С и при перемешивании небольшими
Метил-6,7-диметокси-1-(метилкарбамоил)-
порциями прибавляли 3.0 г (0.08 моль) боргидрида
2',3',5',6'-тетрагидро-1Н-спиро[изохинолин-
натрия. Оставляли на ночь при комнатной темпе-
4,4'-пиран]-2(3Н)-карбоксилат (11). K раство-
ратуре, отгоняли растворитель, к остатку добавля-
ру 1.3 г (0.004 моль) тетрагидроизохинолина 9 и
ли 100 мл воды и экстрагировали бензолом 3 раза
0.4 г (0.004 моль) триэтиламина в 30 мл бензола
по 50 мл. Бензольный раствор промывали водой,
прибавляли 0.4 г (0.004 моль) метилового эфира
сушили сульфатом магния, отгоняли растворитель
хлоругольной кислоты и перемешивали при ком-
и остаток перекристаллизовывали из смеси бен-
натной температуре 4 ч. К смеси прибавляли воду,
зол_эфир (1:5). Выход 5.2 г (80%), т.пл. 175-177°С,
отделяли слои и водный раствор экстрагировали
Rf 0.50 (бензол-ацетон, 2:1, пары NH3). ИК спектр,
бензолом (2×30мл). Объединенные бензольные
ν, см-1: 3362, 3309 (NН, NН), 1666.7 (NСО). Спектр
растворы промывали водой, 10%-ной HCl, 10%-
ЯМР 1Н, δ, м.д.: 1.37-1.44 м (1Н), 1.77-1.97 м (2Н)
ным раствором Na2CO3, водой и сушили MgSO4.
и 2.07-2.18 м (1Н, СН2), 2.69 д (3Н, NСН3, J 4.8 Гц),
Отгоняли растворитель и кристаллический оста-
2.83 д (1Н) и 3.31 д (1Н, NСН2, J 12.5 Гц), 3.06 уш.с
ток перекристаллизовывали из смеси бензол-
(1Н, NНСН2), 3.52-3.65 м (2Н) и 3.70-3.77 м (2Н,
эфир (1:1). Выход 1.0 г (65%), т.пл. 146-148°С,
ОСН2), 3.75 с (3Н) и 3.79 с (3Н, ОСН3), 4.29 с (1Н,
Rf 0.51 (бензол-ацетон, 1:1). ИК спектр, ν, см-1:
СН), 6.84 с (1Н) и 6.92 с (1Н, С6Н2), 7.52 уш.к (1Н,
3332 (NН), 1687, 1669 (СО). Два изомера 60:40
NНСН3, J 4.8 Гц). Спектр ЯМР 13С, δ, м.д.: 25.3
(%). Спектр ЯМР 1Н, δ, м.д.: 1.78 уш.д (2Н, СН2, J
(СН3), 33.4, 35.3 (СН2), 35.7 (СН2), 46.6 (NСН2),
14.0 Гц), 2.03-2.18 м (2Н, CH2), 2.70 д (3Н,
55.0 (ОСН3), 55.3 (ОСН3), 59.9 (СН), 62.9 (ОСН2),
NНСН3, J 4.5 Гц), 3.27 уш.д (0.4Н, J 12.5 Гц), 3.56
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ И НЕКОТОРЫЕ ПРЕВР
АЩЕНИЯ ЭТИЛОВОГО ЭФИРА
1165
уш.д (0.6Н, J 13.5 Гц), 3.81 уш.д (0.6Н, J 13.5 Гц)
11.3 Гц), 2.40 с (3Н, СН3), 2.69 д (3Н, NСН3, J
и 3.94 уш.д (0.4Н, NСН2, J 12.5 Гц), 3.60-3.71 м
4.7 Гц), 3.60-3.71 м (2Н) и 3.73-3.82 м (2Н, ОСН2),
(2Н) и 3.73-3.82 м (2Н, ОСН2), 3.70 с (3Н), 3.77
3.74 с (3Н) и 3.77 с (3Н, OСН3), 3.77 д (1Н) и 3.84 д
с (3Н) и 3.78 с (3Н, ОСН3), 5.22 уш.с (0.4Н) и
(1Н, NСН2, J 14.3 Гц), 4.07 с (1Н, СН), 6.67 с (1Н) и
5.28 уш.с (0.6Н, СН), 6.69 с (1Н), 6.88 уш.с (0.6Н)
6.73 с (1Н, С6Н2), 7.41 к (1Н, NН, J 4.7 Гц). Спектр
и 6.92 уш.с (0.4Н, С6Н2), 7.78 уш.с (0.4Н) и 7.99
ЯМР 13С, δ, м.д.: 7.6 (СН3), 25.3 (СН3), 35.7 (СН2),
уш.с (0.6Н, NН). Найдено, %: С 60.52; Н 6.78; N
38.8 (СН2), 45.3, 46.9 (NСН2), 55.1 (ОСН3), 55.3
7.29. С19Н26N2О6. Вычислено, %: С 60.30; Н 6.93;
(ОСН3), 57.4 (NСН2), 62.8 (СН2), 63.0 (СН2), 67.3
N 7.40.
(СН), 108.9 (СН), 109.1 (СН), 124.2, 135.1, 146.9,
148.2, 150.7, 151.2, 171.4. Найдено, %: С 60.78; Н
Метил-5-({6,7-диметокси-1-(метилкар-
6.56; N 13.32. С21Н28N4О5. Вычислено, %: С 60.56;
бамоил)-2',3',5',6'-тетрагидро-1Н-спиро[изохи-
Н 6.78; N 13.45.
нолин-4,4'-пиран]-2(3Н)-ил}метил)фуран-
2-карбоксилат (12а). Смесь 1.3 г (0.004 моль)
Дигидрохлорид
1-(6,7-диметокси-2,2',3,3',-
тетрагидроизохинолина
9,
0.7 г
(0.004 моль)
5',6'-гексагидро-1Н-спиро[изохинолин-4,4'-пи-
метил-5-хлорметилфуран-2-карбоксилата,
0.4 г
ран]-1-ил)-N-метилметанамина
(13). Восста-
(0.004 моль) триэтиламина и 2-3 кристалла KI в
новление 6,7-диметокси-N-метил-2',3',5',6'-тет-
смеси диоксан-этанол (10:1) нагревали при 60-
рагидро-3Н-спиро[изохинолин-4,4'-пиран]-1-
65°С 10 ч. Растворители отгоняли, остаток раство-
карбоксамида. К 1.9 г (0.05 моль) алюмогидрида
ряли в 30 мл 5%-ной HCl, примеси экстрагировали
лития в 50 мл абсолютного эфира при перемеши-
бензолом. Кислый раствор подщелачивали 10%-
вании прибавляли по каплям 1.9 г (0.006 моль)
ным раствором NaOH и экстрагировали бензолом.
дигидроизохинолина 8 в 50 мл абсолютного бен-
Экстракт сушили безводным MgSO4, отгоняли
зола. Смесь кипятили 20 ч. Комплекс разлагали
растворитель и маслообразный остаток кристал-
водой, отфильтровывали и отгоняли растворите-
лизовали в эфире. Выход 1.0 г (53.8%), т.пл. 118-
ли. Остаток растворяли в абсолютном эфире, дей-
120°С, Rf 0.51 (бензол-ацетон, 2:1). ИК спектр, ν,
ствием эфирного раствора хлористого водорода
см-1: 3310 (NН), 1730 (COO), 1645 (NСО). Спектр
получали гидрохлорид. Кристаллы гидрохлорида
ЯМР 1Н, δ, м.д.: 1.78 уш.д (2Н, СН2, J 14.0 Гц),
кипятили в этаноле и отфильтровывали нераство-
2.03-2.18 м (2Н, CH2), 2.32 д (1Н) и 2.78 д (1Н,
римый в горячем спирте дигидрохлорид 13. Выход
NСН2, J 11.7 Гц), 2.72 д (3Н, NНСН3, J 4.8 Гц),
0.25 г (11%), т.пл. 192-193°С, Rf 0.33 (бутанол-
3.64 д (1Н) и 3.77 д (1Н, NСН2, J 14.8 Гц), 3.74 с
уксусная кислота-вода, 5:3:3). Спектр ЯМР 1Н, δ,
(3Н), 3.79 с (3Н) и 3.84 с (3Н, ОСН3), 4.01 с (1Н,
м.д: 1.20-1.28 м (1Н), 1.70-1.82 м (1Н), 2.02-2.10
СН), 6.51 д (1Н, Н4фурил, J 3.4 Гц), 6.68 с (1Н) и 6.91
м (1Н) и 2.26-2.34 м (1Н, СН2), 2.67 с (3Н, СН3),
с (1Н, С6Н2), 7.12 д (1Н, Н3фурил, J 3.4 Гц), 7.24 к
3.11 д (1Н) и 3.21 д (1Н, NСН2, J 13.6 Гц), 3.34 д.д
(1Н, NH, J 4.8 Гц). Найдено, %: С 62.58; Н 6.68; N
(1Н, J 14.2, 2.1 Гц) и 3.71 д.д (1Н, NСН2СН, J 14.2,
6.29. С24Н30N2О7. Вычислено, %: С 62.87; Н 6.59;
9.3 Гц), 3.52-3.69 м (2Н) и 3.72-3.83 м (2Н, ОСН2),
N 6.11.
3.79 с (6Н, ОСН3), 4.79 д.д (1Н, СН, J 9.3, 2.1 Гц),
6.82 с (1Н) и 7.02 с (1Н, С6Н2), 9.65 уш.с (4Н, NН,
6,7-Диметокси-N-метил-2-[(4-метил-1,2,5-
HCl) Найдено, %: С 53.65; Н 7.31; Cl 18.78; N 7.57.
оксадиазол-3-ил)метил]-2,2',3,3',5',6'-гексаги-
С17Н26N2О3·2HCl. Вычислено, %: С 53.83; Н 7.44;
дро-1Н-спиро[изохинолин-4,4'-пиран]-1-кар-
Cl 18.69; N 7.39.
боксамид (12b). Получали аналогично соедине-
нию 12а из 1.6 г (0.005 моль) тетрагидроизохи-
Характеристики кристаллов соединения
14,
нолина 9 и 0.7 г (0.005 моль) 4-метил-3-хлорме-
которое выделяли по охлаждении спиртового
тил-1,2,5-оксадиазола. Выход 1.2 г (57.7%), т.пл.
раствора, соответствовали таковым для гидрох-
126-128°С, Rf 0.47 (бензол-ацетон, 2:1). ИК спектр,
лорида тетрагидроизохинолина
9, полученного
ν, см-1: 3309 (NН), 1662 (NСО). Спектр ЯМР 1Н,
ранее. Выход гидрохлорида 14 1.3 г (61.4%), т.пл.
δ, м.д.: 1.78 уш.д (2Н, СН2, J 14.0 Гц), 2.01-2.16
168-170°С. Спектр ЯМР 1Н, δ, м.д: 1.78 уш.д (2Н,
м (2Н, CH2), 2.29 д (1Н) и 2.93 д (1Н, NСН2, J
СН2, J 14.0 Гц), 2.03-2.18 м (2Н, СН2), 2.78 д (3Н,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1166
АГЕКЯН, ПАНОСЯН
NСН3, J 4.6 Гц), 3.29-3.38 м (1Н) и 3.90-3.99 м
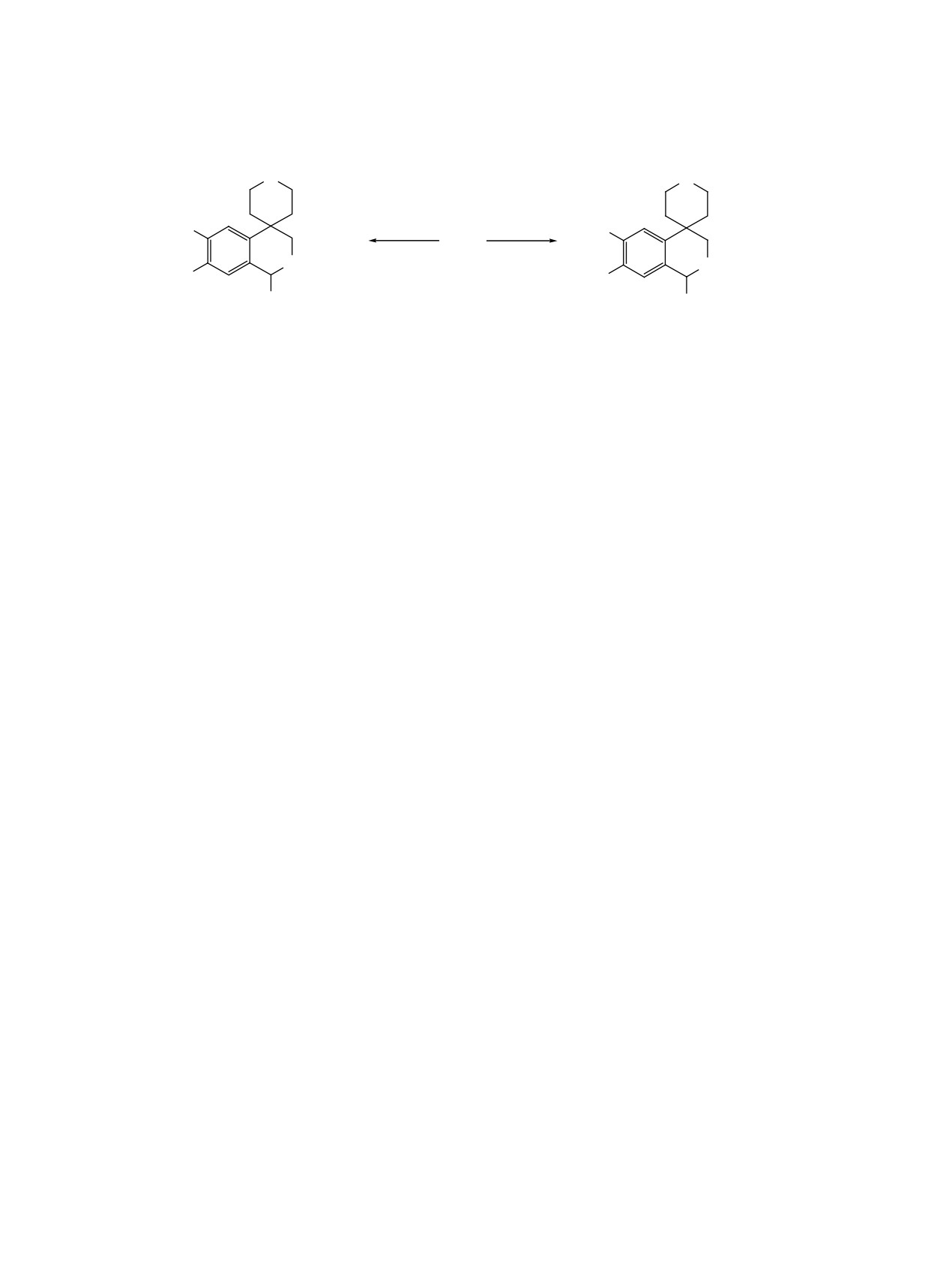
лина карбэтоксильнoй группы позволяет провести
(1Н, NСН2), 3.60-3.71 м (2Н) и 3.73-3.82 м (2Н,
ряд реакций, приводящих к новым производным
ОСН2), 3.79 с (3Н, OСН3), 3.83 с (3Н, OСН3), 5.13
4-спиротетрагидропиранзамещенного дигидро-
уш.с (1Н, СН), 6.92 с (1Н) и 7.04 с (1Н, С6Н2), 9.06
изохинолина с различными функциональными
уш.с (1Н) и 10.91 уш.с (1Н, NН+НCl), 9.25 к (1Н,
группами в положении 1. Введены различные
NНСН3, J 4.6 Гц). Найдено, %: С 57.41; Н 7.21; Cl
заместители в положение 2 гетероциклического
9.76; N 7.67. С17Н24N2О4·HCl. Вычислено, %: С
кольца 4-спиротетрагидропиранзамещенного те-
57.22; Н 7.06; Cl 9.94; N 7.85.
трагидроизохинолина, полученного восстановле-
нием соответствующего N-метилкарбоксамидного
Гидробромид
6,7-дигидрокси-2,2',3,3',5',6'-
производного дигидроизохинолина.
гексагидро-1Н-спиро[изохинолин-4,4'-пиран]-
1-карбоновой кислоты
(15). Раствор
0.96 г
ИНФОРМАЦИЯ ОБ АВТОРАХ
(0.003 моль) изохинолина 9 в 50 мл бромистоводо-
родной кислоты кипятили 3 ч. По охлаждении об-
orcid.org/0000-0001-6151-4951
разовавшиеся кристаллы отфильтровывали и про-
Паносян Генрих Агавардович, ORCID: https://
мывали холодной водой. Выход 0.6 г (60%), т.пл.
orcid.org/0000-0001-8311-6276
210-212°С. Спектр ЯМР 1Н, δ, м.д.: 1.62 уш.д (1Н,
J 13.8 Гц), 1.81-1.97 м (2Н) и 2.01-2.13 м (1Н, CH2),
КОНФЛИКТ ИНТЕРЕСОВ
3.54-3.68 м (4Н) и 3.74-3.82 м (2Н, ОСН2 и NСН2),
Авторы заявляют об отсутствии конфликта ин-
4.97 с (1Н, СН), 6.83 с (1Н) и 6.88 с (1Н, С6Н2), 8.72
тересов.
уш.с (1Н) и 8.97 уш.с (1Н, ОН), 9.66 уш.с (2Н, NH,
HBr), 9.7 уш.с (1Н, СООН). Найдено, %: С 46.49;
СПИСОК ЛИТЕРАТУРЫ
Н 5.17; N 3.78. С14Н17NО5·НBr. Вычислено, %: С
1. Passler U., Knolker H.-J. The Alkaloids: Chemistry and
46.68; Н 5.04; N 3.89.
Biology. Amsterdam: Еlsevier, 2011, 70, 79.
Гидрохлорид
6,7-диметокси-2,2',3,3',5',6'-
2. Mашковский М.Д. Лекарственные средства. М.:
Новая волна. 2010, 409, 410.
гексагидро-1Н-спиро[изохинолин-4,4'-пиран]-
1-карбоновой кислоты
(16). Раствор
0.64 г
3. Graig P.N., Nabenhauer F.P., Williams P.M., Macko E.,
(0.002 моль) соединения 9 в 20 мл соляной кис-
Toner J. J. Am. Chem. Soc. 1952, 74, 1316-1317. doi
10.1021/ja01125a051
лоты кипятили 10 ч. Образовавшиеся кристаллы
отфильтровывали и промывали холодной водой.
4. Gitto R., DeLuca L., Ferro S., Agnello S., Russo E.,
De Sarro G., Chimirri A. Chem. Pharm. Bull. 2010, 58,
Выход 0.45 г (65%), т.пл. 180-182°С. Спектр ЯМР
1602-1605. doi 10.1248/cpb.58.1602
1Н, δ, м.д: 1.55-1.63 м (1Н), 1.93-2.08 м (2Н) и
5. Глушков В.А., Арапов К.А., Минова О.Н., Исмайло-
2.13-2.25 м (1Н, СН2), 3.56-3.71 м (4Н) и 3.74-3.84
ва Н.Г., Сыропятов Б.Я., Шкляев Ю.В. Хим.-фарм.
м (2Н, NСН2 и ОСН2), 3.80 с (3Н) и 3.84 с (3Н,
ж. 2006, 40, 18-21. [Glushkov V.A., Аrapov K.A.,
ОСН3), 5.01 с (1Н, СН), 6.00 (2Н, NH+HCl), 6.94 с
Minova O.N., Ismailova N.G., Syropyatov B.Y.,
(1Н) и 6.99 с (1Н, С6Н2), 10.00 уш.с (1Н, СООН).
Shklyaev Yu.V. Pharm. Chem. J. 2006, 40, 363-366.]
Спектр ЯМР 13С, δ, м.д.: 32.7, 35.5 (СН2), 36.2
doi 10.1007/s11094-006-0128-1
(СН2), 43.1 (NСН2), 54.5 (СН), 55.3 (СН3), 55.4
6. Panchaud Ph., Bruyere Th., Blumstein A.-C., Bur D.,
(СН3), 62.7 (2ОСН2), 109.0 (СН), 110.2 (СН), 117.9,
Chambovey A., Ertel E.A., Gude M., Hubschwerlen C.,
132.4, 147.7, 149.4, 168.6. Найдено, %: С 55.71; Н
Jacob L., Kimmerlin Th., Pfeifer L., Seiler P., Ritz D.,
6.68; Cl 10.20; N 4.21. С16Н21NО5·НCl. Вычислено,
Rueedi G. J. Med. Chem. 2017, 60, 3755-3777. doi
%: С 55.90; Н 6.45; Cl 10.31; N 4.07.
10.1021/asc.jmedchem.6b01834
7. Scott J.D., Williams R.M. Chem. Rev. 2002, 102,
ЗАКЛЮЧЕНИЕ
1669-1730. doi 10.1021/cr010212u
Разработан оптимальный путь синтеза этило-
8. Kubota H., Watanabe T., Kakefuda A., Masuda N., Wa-
вого эфира
6,7-диметокси-2',3',5',6'-тетрагидро-
da K., Ishii N., Sakamoto S., Tsukamoto S. J. Bioorg.
3Н-спиро[изохинолин-4,4’-пиран]-1-карбоновой
Med. Chem. Lett. 2004, 12, 3049-3052. doi 10.1016/
кислоты. Наличие в положении 1 дигидроизохино-
j.bmcl.2004.04.031
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ И НЕКОТОРЫЕ ПРЕВР
АЩЕНИЯ ЭТИЛОВОГО ЭФИРА
1167
9. Земцова М.Н., Головко Ю.А., Грузд Ю.А., Куле-
13. Galvis C. E. P., Macнas M.A., Kouznetsov V.V.
мина С.В., Баймуратов М.Р., Климочкин Ю.Н.
Synthesis. 2019, 51, 1949-1960. doi 10.1055/s-0037-
ЖОрХ. 2021, 57, 728-736. [Zemtsova M.N., Golov-
1610684
ko Yu.A., Gruzd Yu.A., Kulemina S.V., Baimura-
14. Михайловский А.Г., Погорелова Е.С., Першина Н.Н.
tov M.R., Klimochkin Yu.N. Russ. J. Org. Chem. 2021,
ХГС. 2020, 56, 562-565. [Mikhailovskii A.G., Po-
57, 793-800.] doi 10.1134/S1070428021050055
gorelova E.S., Pershina N.N. Chem. Heterocycl.
Compd. 2020, 56, 562-565.] doi 10.1007/s10593-020-
10. Riganti C., Contino M., Guglielmo S., Perrone M.G.,
02700-w
Salaroglio I.C, Milosevic V., Giampietro R., Leonet-
15. Маркарян Э.А., Арустамян Ж.С., Василян С.С.,
ti, F., Rolando B., Lazzarato L., Colabufo N.A., Frutte-
Маркарян К.Ж. Арм. Хим. ж. 1976, 29, 591-596.
ro R. J. Med. Chem. 2019, 62, 974-986. doi 10.1021/
acs.jmedchem.8b01655
16. Агекян A.A., Мкрян Г.Г., Паносян Г.А., Сафа-
рян А.С, Аракелян А.Г, Степанян Г.М. ЖОрХ. 2020,
11. Lin C., Li P., Wang L. Tetrahedron Lett. 2021, 73,
56, 283-289. [Aghekyan A.A., Mkryan G.G., Pano-
153102. doi 10.1016/j.tetlet.2021.153102
syan H.A, Safaryan A.S., Arakelyan A.S., Stepa-
12. Crestey F., Jensen A.A., Soerensen Ch., Magnus Ch.B.,
nyan H.M. Russ. J. Org. Chem. 2020, 56, 281-286.] doi
Andreasen J.T., Peters G.H.J., Kristensen J.L.
10.1134/S1070428020020177
J. Med. Chem. 2018, 61, 1719-1729. doi 10.1021/
17. Амбарцумян Э.Н., Ворсканян А.С., Енгоян А.П.
acs.jmedchem.7b01895
Хим. ж. Армении. 2011, 64, 544-550.
Synthesis and Some Transformations of Ethyl 6,7-Dimethoxy-
2',3',5',6'-tetrahydro-3H-spiro[isoquinoline-4,4'-pyran]-
1-carboxilate
A. A. Aghekyan* and H. A. Panosyan
The Scientific Technological Centre of Organic and Pharmaceutical Chemistry NAS RA,
prosp. Azatutyana, 26, Yerevan, 0014 Armenia
*е-mail: aaghekyan@mail.ru
Received December 28, 2021; revised January 11, 2022; accepted January 13, 2022
By the reaction of [4-(3,4-dimethoxyphenyl)tetrahydro-2Н-pyran-4-yl]methylamine with diethyloxalate was syn-
thesized ethyl 2-{[4-(3,4-dimethoxyphenyl)tetrahydro-2Н-pyran-4-yl]methylamino}-2-oxoacetate, by cycliza-
tion of which with phosphorus oxychloroxide in the condition of Bischler-Napieralski reaction 1-carbethoxysub-
stituted dihydroisoquinoline was obtained. The latter by the action of methylamine is converted to corresponding
N-methylcarboxamide derivative, the reduction of which 6,7-dimethoxy-N-methyl-2,2',3,3',5',6'-hexahy-
dro-1Н-spiro[isquinoline-4,4'-pyran]-1-carboxamide was carried out. By a number of the chemical reactions
new derivatives of the 4-spirotetrahydropyransubstituted-dihydro- and tetrahydroisoquinolines with various
different substituents in the first and second positions of the heterocyclic ring have been obtained.
Keywords: tetrahydropyran, diethyloxalate, carboxamide, tetrahydroisoquinoline, reduction, Bischler-Napi-
eralski reaction
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022