ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 11, с. 1192-1199
УДК 547.594.3
ВЗАИМОДЕЙСТВИЕ 6-ОКСОЦИКЛОГЕКСАН-
1,3-ДИКАРБОКСАМИДОВ С БИНУКЛЕОФИЛЬНЫМИ
РЕАГЕНТАМИ. АНТИНОЦИЦЕПТИВНАЯ
АКТИВНОСТЬ ПОЛУЧЕННЫХ ПРОИЗВОДНЫХ
ГИДРАЗОНОВ И 2,3,4,5,6,7-ГЕКСАГИДРО-
1H-ИНДАЗОЛОВ
© 2022 г. В. Л. Гейнa, *, Д. Д. Лежнинаa, Н. В. Носоваa, Р.Р. Махмудовb, c, М. В. Дмитриевb
a ФГБОУ ВО «Пермская государственная фармацевтическая академия» Минздрава России,
Россия, 614990 Пермь, ул. Полевая, 2
b ФГАОУ ВО «Пермский государственный национальный исследовательский университет»,
Россия, 614990 Пермь, ул. Букирева, 15
с Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения,
Россия, 614045 Пермь, ул. Монастырская, 82
*e-mail: geinvl48@mail.ru
Поступила в редакцию: 01.02.2022 г.
После доработки 12.02.2022 г.
принята к публикации 14.02.2022 г.
Взаимодействием 2-арил-4-гидрокси-4-метил-6-оксоциклогексан-1,3-дикарбоксамидов с тозил-
гидразидом, 2,4-динитрофенилгидразином и фенилгидразином в этаноле получены новые 2-арил-4-ги-
дрокси-4-метил-6-(2-тозилгидразоно)циклогексан-1,3-дикарбоксамиды, 2-арил-4-гидрокси-4-метил-6-[2-
(2,4-динитрофенил)гидразоно]циклогексан-1,3-дикарбоксамиды и 4-арил-6-гидрокси-6-метил-3-оксо-2-
фенил-2,3,4,5,6,7-гексагидро-1H-индазол-5-карбоксамиды соответственно. Изучена антиноцицептивная
активность полученных соединений.
Ключевые слова: 6-оксоциклогексан-1,3-дикарбоксамиды, тозилгидразид, 2,4-динитрофенилгидразин,
фенилгидразин, гидразоны, гексагидроиндазол-5-карбоксамиды, антиноцицептивная активность
DOI: 10.31857/S0514749222110076, EDN: LSFDGB
ВВЕДЕНИЕ
Ранее нами было показано, что взаимодействие
N-незамещенных
6-оксоциклогексан-1,3-дикар-
Функционализированные циклогексаноны
-
боксамидов с гидразин-гидратом протекает с уча-
доступные, высокореакционноспособные, поли-
стием 1,3-дикарбонильного фрагмента с циклиза-
функциональные соединения, удобные для син-
цией с образованием производных индазола [10],
теза на их основе гетероциклических соединений.
а взаимодействие с гидроксиламином приводит к
Производные циклогексанонов
- структурные
соответствующим оксимам [11]. Взаимодействие
фрагменты большого ряда биологически актив-
6-оксоциклогексан-1,3-дикарбоксамидов с дру-
ных соединений, обладающих противомикробной
гими нуклеофильными реагентами не изучалось.
[1-3], цитостатической [4], анальгетической [5],
Среди полученных ранее производных функцио-
антифаговой [6], противосудорожной [7], проти-
нализированных циклогексанонов были обнару-
вовоспалительной [8] и психоседативной активно-
жены вещества, проявляющие анальгетическую
стью [9].
активность [5, 10].
1192
ВЗАИМОДЕЙСТВИЕ 6-ОКСОЦИКЛОГЕКСАН-1,3-ДИКАРБОКСАМИДОВ
1193
Схема 1
O
NH S
O
N
S NH NH2
O O
O
NH
2
EtOH, t°
R1
HO
O NH2
R2
2a, b
NH
NH2
O2N
NO2
O
O
NH
NO2
NH2
N
NO2
O
R1
EtOH, t°
NH2
HO
AcOH
R1
HO
O NH2
R2
1a-g
O NH2
R2
2c-e
NH NH2
N
HN
O
EtOH, t°
R1
HO
R2
O NH2
3a, b
R1 = H, R2 = CH3 (1a, 2a); R1 = H, R2 = Br (1b, 2b); R1 = NO2, R2 = H (1c, 1f, 2c, 3a);
R1 = H, R2 = COOCH3 (1d, 2d); R1 = H, R2 = Cl (1e, 2e); R1 = R2 = H (1g, 3b).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
4,5,6,7-гексагидро-1H-индазол-5-карбоксамиды
3a, b соответственно (схема 1).
С целью изучения реакционной способности
N-незамещенных
6-оксоциклогексан-1,3-дикар-
Соединения 2a, b и 3a, b представляют собой
боксамидов, а также с целью получения новых
бесцветные или светло-желтые кристалличе-
биологически активных соединений нами было
ские вещества, соединения 2с-е - ярко-желтые
исследовано взаимодействие
2-арил-4-гидрок-
кристаллические вещества, растворимые в ди-
метилсульфоксиде (ДМСО), диметилформамиде
си-4-метил-6-оксоциклогексан-1,3-дикарбоксами-
(ДМФА), при нагревании в этиловом и изопропи-
дов 1a-g с тозилгидразидом, 2,4-динитрофенилги-
ловом спиртах, в ацетоне, нерастворимые в воде.
дразином и фенилгидразином. При кипячении ре-
агентов в этиловом спирте были получены новые
В спектрах ЯМР 1H растворов соединений
2-арил-4-гидрокси-4-метил-6-(2-тозилгидразоно)-
2a-e наблюдаются 2 дублета протонов групп CH
циклогексан-1,3-дикарбоксамиды 2a, b, 2-арил-
в положениях 1 и 3 цикла (2.55-3.71 и 3.36-3.80
4-гидрокси-4-метил-6-[2-(2,4-динитрофенил)ги-
м.д., J 12.0 Гц), триплет протона в положении 2
дразоно]циклогексан-1,3-дикарбоксамиды 2c-e и
цикла (3.59-3.91 м.д., J 12.0 Гц), синглет 2 прото-
4-арил-6-гидрокси-6-метил-3-оксо-2-фенил-2,3,-
нов амидной группы в положении 3 цикла (6.82-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1194
ГЕЙН и др.
C8
H7B
N7
H1
O3
O1
C3
O4
C4
H7A C9
N4
O5
C2
H3
C5
C1
C17
C16
C10
C11
N3
C6
C18
C12
N2
O6
C14
O2
C15
N5
C13
C7
C21
C19
C20
O8
N1
N6
O7
O9
H1B
H1A
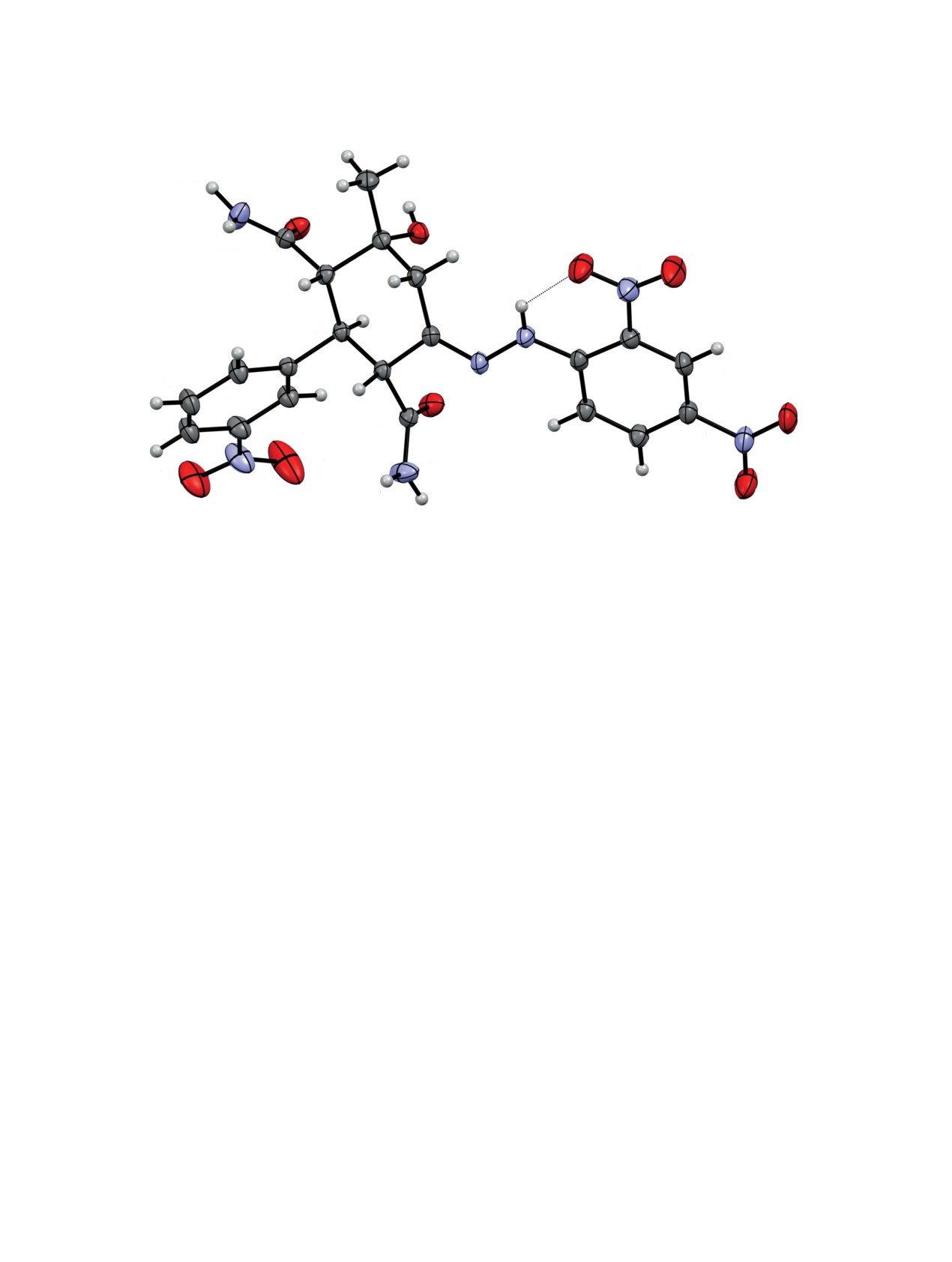
Рис. 1. Общий вид молекулы соединения 2c по данным РСА в тепловых эллипсоидах 30% вероятности
7.25 м.д.) и 2 синглета протонов амидной группы
ных связей (МВС), за счет которой молекулы в
в положении 1 цикла (6.60-6.97 и 7.00-7.08 м.д.).
кристалле связаны в трехмерную сеть.
Наличие сигнала пятого NH протона, смещенно-
Индазолы 3a, b могут существовать в виде не-
го в область более слабого поля по сравнению с
скольких кетонных или енольных таутомерных
сигналами NH протонов амидных групп (10.10-
форм [8, 10, 12]. Локализация протона и расположе-
11.07 м.д.), свидетельствует о существовании со-
ние двойных связей в пиразольном цикле частич-
единений 2a-e в гидразонной форме. В спектрах
но гидрированных индазолов по-прежнему оста-
ЯМР 13С растворов соединений 2a-е присутству-
ются предметом дискуссий. Растворы соединений
ют сигналы при 28.01-28.70 (CH3), 167.95-169.76
3a, b дают интенсивное фиолетовое окрашивание
(C1ONH2), 174.07-174.56 (C3ONH2) м.д.
со спиртовым раствором FeCl3 (III). В спектрах
Для установления пространственного строе-
ЯМР 1H растворов соединений 3a, b наблюдаются
ния, в том числе относительной конфигурации
2 дублета протонов при С5 и С4 цикла (3.47-3.52,
хиральных центров, проведено рентгеноструктур-
3.81-3.93 м.д., J 10.0-10.2 Гц), 2 синглета NH про-
ное исследование монокристалла соединения 2с.
тонов амидной группы (6.62-7.05 м.д.) и синглет
Согласно данным рентгеноструктурного анализа
в области 10.66-10.71 м.д., соответствующий NH-
(РСА) (рис. 1), соединение 2c кристаллизуется в
протону пиразольного цикла. Для установления
центросимметричной пространственной группе
строения соединений 3a, b в кристаллическом со-
моноклинной сингонии в виде сольвата с этанолом
стоянии было проведено рентгеноструктурное ис-
в соотношении 1:1 (молекула этанола на рис. 1 не
следование кристалла соединения 3b.
изображена). Циклогексановое кольцо находится
в конформации кресло с экваториальным распо-
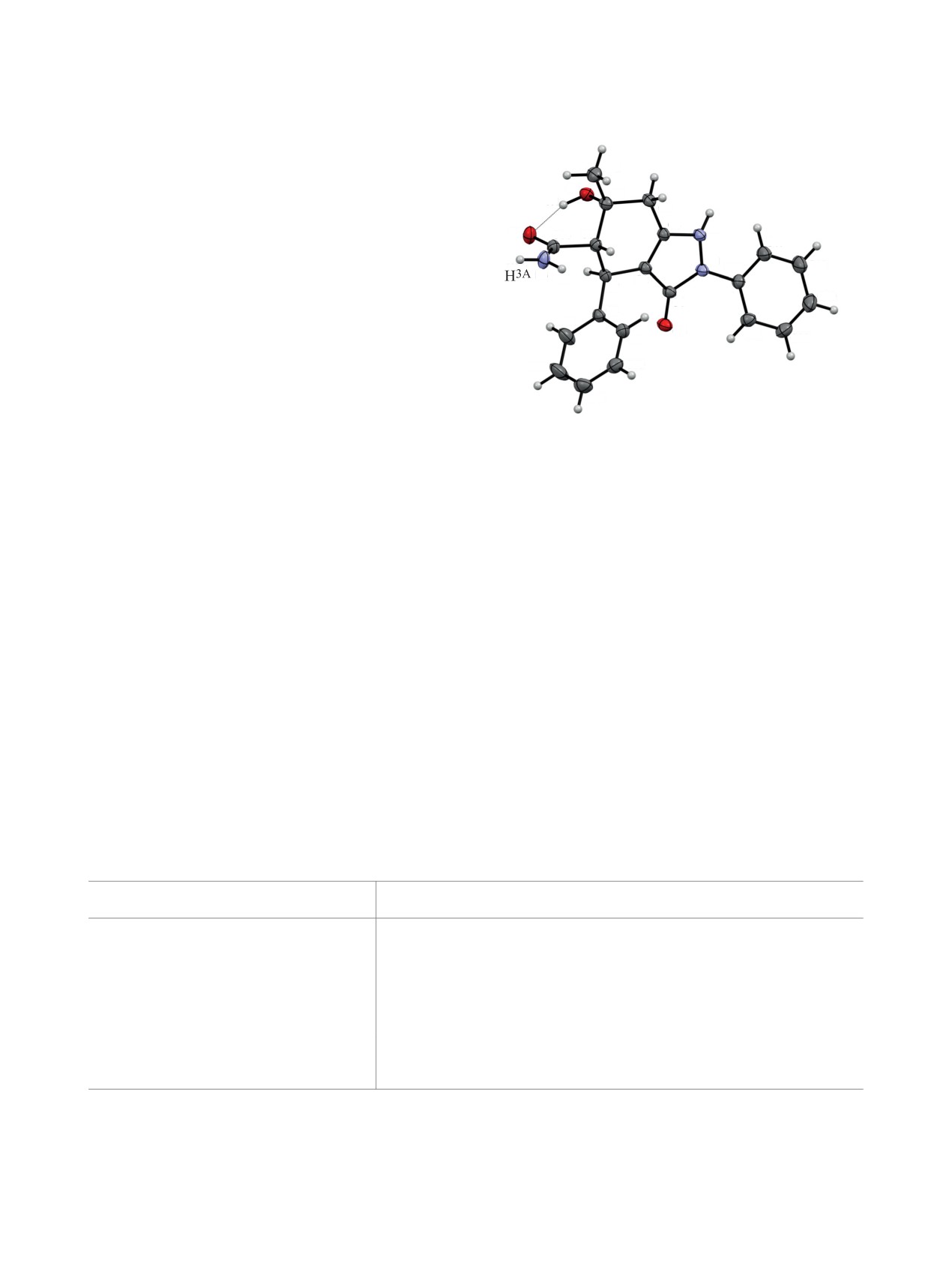
Согласно данным РСА (рис. 2), соединение
ложением метильного, фенильного и 2 карбамо-
3b кристаллизуется в центросимметричной про-
ильных заместителей. Остаток гидразина лежит
странственной группе моноклинной сингонии.
в одной плоскости с динитрофенильным замести-
Пиразольный цикл плоский в пределах 0.03 Å,
телем, что позволяет ему участвовать в образова-
атом водорода H2 однозначно локализован у ато-
нии внутримолекулярной водородной связи (ВВС)
ма азота N2. Циклогексеновое кольцо находится в
N3-H3∙∙∙O4 (рис. 1, пунктирная линия). Все NH2 и
конформации полукресло, атомы C5 и C6 отклоня-
OH группы соединения 2c и этанола участвуют в
ются на 0.30 и -0.44 Å в разные стороны от пло-
образовании системы межмолекулярных водород-
скости C7C2C3C4. Как и в соединении 2c, наиболее
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
ВЗАИМОДЕЙСТВИЕ 6-ОКСОЦИКЛОГЕКСАН-1,3-ДИКАРБОКСАМИДОВ
1195
объемные заместители (метильный, фенильный и
C15
карбамоильный) находятся в псевдоэкваториаль-
ных положениях. Гидроксильная группа образует
C5
H1
H2
O1
C4
внутримолекулярную водородную связь (ВВС)
O2
C3
O1-H1∙∙∙O2 (рис. 2, пунктирная линия). За счет
C14
C6
N2
C17
межмолекулярной водородной связи (МВС) с уча-
N1
C18
стием групп NH2 и NH молекулы в кристалле свя-
N3
H3B
C2
C16
C19
C7
заны в трехмерную сеть.
C1
C8
C13
Полученные соединения 2a, b, d и 3а были
O3
C9
C21
C20
подвергнуты биологическому скринингу на анти-
C12
C10
ноцицептивную активность. Статистически обра-
ботанные результаты представлены в таблице. Как
C11
видно из полученных данных, все исследованные
соединения проявляют выраженное антиноци-
Рис. 2. Общий вид молекулы соединения 3b по дан-
ным РСА в тепловых эллипсоидах 30% вероятности
цептивное действие. Наиболее выраженный анти-
ноцицептивный эффект оказывает соединение 3а,
SCALE3 ABSPACK [13]. Структуры расшифрова-
достоверно превышая таковой препарата сравне-
ны с помощью программы SHELXS [14] и уточ-
ния метамизола натрия.
нены полноматричным методом наименьших ква-
дратов (МНК) по F2 в анизотропном приближении
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
для всех неводородных атомов с помощью про-
ИК спектры записаны в вазелиновом масле на
граммы SHELXL [15] с графическим интерфейсом
Фурье-спектрометре ФСМ-1202 (Россия). Спектры
OLEX2 [16]. Атомы водорода включены в уточ-
ЯМР 1Н и 13C записаны для образцов в ДМСО-d6
нение в модели наездник (за исключением атомов
на приборе Bruker DRX 400 (Германия) с рабочи-
водорода групп OH и NH2, уточненных независи-
ми частотами 400 и 100 МГц соответственно, вну-
мо в изотропном приближении). Результаты РСА
тренний стандарт - тетраметилсилан. Элементный
зарегистрированы в Кембриджском центре кри-
анализ проводили на приборе PerkinElmer 2400
сталлографических данных под номерами CCDC
(США). Температуру плавления определяли на
2141734 и CCDC 213336 и могут быть запрошены
приборе Melting Point M-565 (Швейцария). РСА
выполнен на монокристальном дифрактометре
Xcalibur Ruby с ССD-детектором (Израиль) по
Кристаллографические данные соединения 2c.
стандартной методике (MoKα-излучение, 295(2) K,
Моноклинная сингония, пространственная группа
ω-сканирование c шагом 1°). Поглощение учте-
C2/c, C21H21N7O9∙C2H6O, M 561.51, a 38.765(12) Å,
но эмпирически с использованием алгоритма
b 12.1453(15) Å, c 11.3988(18) Å, β 95.72(2)°, V
Антиноцицептивная активность синтезированных соединений 2a, b, d и 3а в концентрациях 50 мг/кг
Соединение
Время оборонительного рефлекса на пике действияа, с
2a
19.94±0.68
2b
20.88±0.44)
2d
21.60±0,68
3a
24.60±0.98)
Метамизол натрияb
16.60±3.40 (p < 0.1)
Контрольc
10.78±0.34
a Достоверность различий по сравнению с контролем p < 0.05
b В дозе 93 мг/кг (ЕД50)
c 2%-ный крахмальный раствор
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1196
ГЕЙН и др.
5340(2) Å3, Z 8, dвыч 1.397 г·см-3, μ 0.111 см-1.
2-(4-Бромфенил)-4-гидрокси-4-метил-6-(2-
Окончательные параметры уточнения: R1 0.0693
тозилгидразоно)циклогексан-1,3-дикарбок-
[для 4195 отражений с I > 2σ(I)], wR2 0.2043 (для
самид (2b). Выход 0.3 г (21%), т.пл. 226-228°С
всех 6534 независимых отражений, Rint 0.0678),
(этанол). ИК спектр, ν, см-1: 3490 (OH), 3384,
S 1.035.
3223 (NH), 1670, 1649 (CON, С=N). Спектр ЯМР
1Н, δ, м.д.: 1.20 с (3Н, CH3), 1.89 д (1Н, С5НАНВ,
Кристаллографические данные соединения 3b.
J 14.0 Гц), 2.38 с (3H, 4-CH3C6H4 SO2), 2.62 д (1Н,
Моноклинная сингония, пространственная груп-
С5НАНВ, J 14.0 Гц), 2.99 д (1H, C3H, J 12.0 Гц),
па P21/c, C21H21N3O3, M 363.41, a 11.109(2) Å,
3.35 д (1H, C1H, J 12.0 Гц), 3.59 т (1H, C2H, J
b 14.677(2) Å, c 12.287(2) Å, β 110.00(2)°, V
12.0 Гц), 4.88 с (1Н, ОН), 6.60 с (1H, NH2), 6.85 с
1882.6(6) Å3, Z 4, dвыч 1.282 г·см-3, μ 0.087 см-1.
(2H, NH2), 7.08 с (1H, NH2), 7.15 д (2H, 4-BrC6H4,
Окончательные параметры уточнения: R1 0.0521
J 8.0 Гц), 7.33 д (2H, 4-BrC6H4, J 8.0 Гц), 7.40
[для 2970 отражений с I > 2σ(I)], wR2 0.1529 (для
д (2Н, 4-CH3С6Н4SO2, J 8.0 Гц), 7.76 д (2Н,
всех 4378 независимых отражений, Rint 0.0349),
4-CH3С6Н4SO2, J 8.0 Гц), 10.10 с (1Н, NH). Спектр
S 1.039.
C, δ, м.д.: 21.00, 28.70, 43.60, 55.22, 55.86,
ЯМР 13
2-Арил-4-гидрокси-4-метил-6-оксоциклогек-
70.59, 119.40, 127.72, 129.06, 130.44, 130.80, 136.43,
сан-1,3-дикарбоксамиды 1a-g получали по извест-
140.46, 142.69, 156.04, 169.76, 174.56. Найдено,
ной методике [17].
%: C 49.09; H 4.62; N 10.42. C22H25BrN4O5S.
4-Гидрокси-4-метил-2-(п-толил)-6-(2-то-
Вычислено, %: C 49.17; H 4.69; N 10.43.
зилгидразоно)циклогексан-1,3-дикарбоксамид
4-Гидрокси-4-метил-6-[2-(2,4-динитрофе-
(2a). К раствору 1 г (0.003 моль) 4-гидрокси-4-ме-
нил)гидразоно]-2-(3-нитрофенил)циклогек-
тил-6-оксо-2-п-толилциклогексан-1,3-дикарбокса-
сан-1,3-дикарбоксамид
(2с). К раствору
1 г
мида (1a) в 35 мл 95%-ного этилового спирта до-
(0.003 моль)
4-гидрокси-4-метил-2-(3-нитрофе-
бавляли 0.74 г (20%-ный избыток) тозилгидразида
нил)-6-оксоциклогексан-1,3-дикарбоксамида
1с
(97%, Sigma-Aldrich). Реакционную смесь кипяти-
в 30 мл 95%-ного этилового спирта добавляли
ли 6 ч, затем охлаждали. Кристаллы отфильтровы-
0.71 г (20%-ный избыток) N-(2,4-динитрофенил)-
вали и перекристаллизовывали из этилового спир-
гидразина (98%, Россия) и 0.6 мл (2 об %) ледяной
та. Выход 0.24 г (36%), т.пл. 240-242°С (этанол).
уксусной кислоты. Реакционную смесь кипятили
ИК спектр, ν, см-1: 3492 (OH), 3447, 3316, 3277,
4.5 ч, затем охлаждали. Кристаллы отфильтровы-
3177 (NH), 1685, 1657 (CON, С=N). Спектр ЯМР
вали и перекристаллизовывали из этилового спир-
1Н, δ, м.д.: 1.23 с (3Н, CH3), 2.10 д (1Н, С5НАНВ,
та. Выход 0.8 г (52%), т.пл. 223-225°С (этанол). ИК
J 14.0 Гц), 2.26 с (3H, 4-CH3C6H4), 2.42 д (1Н,
спектр, ν, см-1: 3503 (OH), 3377, 3329 (NH), 1691,
С5НАНВ, J 14.0 Гц), 2.45 с (3Н, 4-СН3C6H4SO2),
1659 (CON, C=N). Спектр ЯМР 1Н, δ, м.д.: 1.35 с
2.55 д (1H, C3H, J 12.0 Гц), 3.46 д (1H, C1H, J
(3Н, CH3), 2.45 д (1Н, С5НАНВ, J 14.0 Гц), 2.93 д
12.0 Гц), 3.65 т (1H, C2H, J 12.0 Гц), 4.63 с (1Н,
(1Н, С5НАНВ, J 14.0 Гц), 2.99 д (1H, C3H, J 12.0 Гц),
ОН), 6.48 д (2H, 4-CH3C6H4, J 8.0 Гц), 6.90 д (2H,
3.79 д (1H, C1H, J 12.0 Гц), 3.90 т (1H, C2H, J
4-CH3C6H4, J 8.0 Гц), 6.95 с (1H, NH2), 7.00 с
12.0 Гц), 5.18 с (1Н, ОН), 6.79 с (1H, NH2), 6.97
(1H, NH2), 7.47 д (2Н, 4-CH3С6Н4SO2, J 8.0 Гц),
с (1H, NH2), 7.25 с (2H, NH2), 7.61 т (1H, C6H3, J
7.67 д (2Н, 4-CH3С6Н4SO2, J 8.0 Гц), 10.83 с (1Н,
8.0 Гц), 7.78 д (2H, 3-NO2C6H4, J 12.0 Гц), 8.09 д
NH). Спектр ЯМР 13C, δ, м.д.: 20.63, 21.17, 28.01,
(1Н, 3-NO2С6Н4, J 8.0 Гц), 8.18 с (1Н, 3-NO2С6Н4),
57.65, 69.23, 103.84, 127.50, 127.66, 128.27, 129.70,
8.38 д (1H, C6H3, J 12.0 Гц), 8.90 с (1H, C6H3), 11.07
132.70, 134.87, 137.53, 145.20, 160.36, 164.95,
с (1Н, NH). Спектр ЯМР 13C, δ, м.д.: 18.50, 28.66,
174.45. Найдено, %: C 58.39; H 5.92; N 11.82.
44.79, 55.51, 55.74, 56.01, 71.41, 115.81, 121.71,
C23H28N4O5S. Вычислено, %: C 58.46; H 5.97; N
123.04, 129.19, 129.27, 129.96, 135.83, 137.07,
11.86.
143.18, 144.97, 147.55, 157.65, 169.59, 174.04.
Соединение
2b получали аналогично из
Найдено, %: C 48.89; H 4.07; N 18.98. C21H21N7O9.
0.003 моль (1 г) соединения 1b.
Вычислено, %: C 48.93; H 4.11; N 19.02.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
ВЗАИМОДЕЙСТВИЕ 6-ОКСОЦИКЛОГЕКСАН-1,3-ДИКАРБОКСАМИДОВ
1197
Соединения 2d, e получали аналогично из
7.24 с (2H, CONH2), 6.65-6.68 м (1H, Ph), 7.07-7.13
0.003 моль (1 г) соединений 1d и 1e.
м (4H, Ar), 7.57 т (1H, 3-NO2C6H4, J 8.0 Гц), 7.69 д
(1Н, 3-NO2C6H4, J 8.0 Гц), 8.06 д (1Н, 3-NO2C6H4,
4-Гидрокси-4-метил-6-[2-(2,4-динитрофе-
J 8.0 Гц), 8.11 с (1Н, 3-NO2C6H4), 10.66 с (1Н, NH).
нил)гидразоно]-2-(4-метоксикарбонилфенил)-
Найдено, %: C 61.39; H 5.32; N 13.62. C21H22N4O5.
циклогексан-1,3-дикарбоксамид
(2d). Выход
Вычислено, %: C 61.45; H 5.40; N 13.65.
0.37 г (28%), т.пл. 225-227°С (этанол). Спектр ЯМР
1Н, δ, м.д.: 1.33 с (3Н, CH3), 2.43 д (1Н, С5НАНВ, J
Соединение
3b получали аналогично из
14.0 Гц), 2.86 д (1Н, С5НАНВ, J 14.0 Гц), 3.71 д (1H,
0.003 моль (1 г) соединения 1g.
C3H, J 12.0 Гц), 3.80 д (1H, C1H, J 12.0 Гц), 3.85 с
6-Гидрокси-6-метил-3-оксо-2,4-дифенил-
(3H, OCH3), 3.91 т (1H, C2H, J 12.0 Гц), 5.16 с (1Н,
2,3,4,5,6,7-гексагидро-1H-индазол-5-кар-
ОН), 6.71 с (1H, NH2), 6.94 с (1H, NH2), 7.17 с (2H,
боксамид (3b). Выход 0.71 г (65%), т.пл. 276-278°С
NH), 7.43 д (2H, 4-COOCH3C6H4, J 8.0 Гц), 7.77 д
(этанол). ИК спектр, ν, см-1: 3462 (OH), 3303 (NH),
(1H, C6H3 , J 8.0 Гц), 7.86 д (2H, 4-COOCH3C6H4,
1670 (CON). Спектр ЯМР 1Н, δ, м.д.: 1.29 с (3Н,
J 8.0 Гц), 8.39 д (1Н, С6Н3, J 8.0 Гц), 8.89 с (1H,
CH3), 2.42 д (1Н, С7НАНВ, J 14.0 Гц), 2.72 д (1Н,
C6H3), 11.06 с (1Н, NH). Найдено, %: C 52.19; H
С7НАНВ, J 14.0 Гц), 3.47 д (1H, C5H, J 10.0 Гц),
4.57; N 15.86. C23H24N6O9. Вычислено, %: C 52.27;
3.93 д (1H, C4H, J 10.0 Гц), 4.74 с (1Н, ОН), 7.05 с
H 4.58; N 15.90.
), 7.39-7.68 м (5H,
(2H, NH2), 7.30-7.35 м (5H, C6H5
4-Гидрокси-4-метил-6-[2-(2,4-динитрофе-
C6H5), 10.71 с (1Н, NH). Найдено, %: C 68.99; H
нил)гидразоно]-2-(4-хлорофенил)циклогексан-
6.32; N 11.42. C21H23N3O3. Вычислено, %: C 69.02;
1,3-дикарбоксамид (2e). Выход 0.72 г (48%),
H 6.34; N 11.50.
т.пл. 195-197°С (этанол). Спектр ЯМР 1Н, δ, м.д.:
Фармакологический скрининг антиноци-
1.34 с (3Н, CH3), 2.36 д (1Н, С5НАНВ, J 14.0 Гц),
цептивной активности проводили на белых нели-
2.80 д (1Н, С5НАНВ, J 14.0 Гц), 2.89 д (1H, C3H, J
нейных мышах (самках) массой 18-22 г методом
12.0 Гц), 3.62 д (1H, C1H, J 12.0 Гц), 3.81 т (1H,
термического раздражения
«горячая пластина»
C2H, J 12.0 Гц), 5.17 с (1Н, ОН), 6.67 с (1H, NH2),
[18]. Для оценки болевой чувствительности ис-
6.72 с (1H, NH2), 6.96 с (2H, NH), 7.25 д (1H, C6H3,
пользовали прибор (анальгезиметр) ЕН-01 Orchid
J 8.0 Гц), 7.31 д (2H, 4-ClC6H4, J 8.0 Гц), 7.76 д
Scientific (Индия).
(2H, 4-ClC6H4, J 8.0 Гц), 8.42 д (1Н, С6Н3, J 8.0 Гц),
8.77 с (1H, C6H3), 10.99 с (1Н, NH). Найдено, %: C
Исследуемые вещества вводили внутрибрю-
49.89; H 4.07; N 16.56. C21H21ClN6O7. Вычислено,
шинно в концентрации 50 мг/кг в виде взвеси в
%: C 49.96; H 4.19; N 16.65.
2%-ном крахмальном растворе за 30 мин до по-
мещения животных на нагретую до 53.5°С метал-
6-Гидрокси-6-метил-4-(3-нитрофенил)-3-
оксо-2-фенил-2,3,4,5,6,7-гексагидро-1H-инда-
лическую пластину [19]. В опытах использовали
животных с исходным латентным действием обо-
зол-5-карбоксамид (3a). К 1 г (0,003 моль) 4-ги-
дрокси-4-метил-2-(3-нитрофенил)-6-оксоцикло-
ронительного рефлекса не более 40 с. Показателем
гексан-1,3-дикарбоксамида 1f в 30 мл 95%-ного
ноцицепции служила длительность пребывания
этилового спирта по каплям прибавляли 0.35 мл
животного на горячей пластине до появления пове-
(20%-ный избыток) фенилгидразина (97%, Acros
денческого ответа на ноцицептивную стимуляцию
Organics). Реакционную смесь кипятили в течение
(облизывания задних лап, прыжков, отдергивания
4.5 ч, затем охлаждали. Выпавшие кристаллы от-
задних лап), измеряемая в секундах. Каждое сое-
фильтровывали и перекристаллизовывали из эти-
динение испытывали на 6 животных. Результаты
лового спирта. Выход 0.30 г (26%), т.пл. 190-192°С
оценивали по увеличению времени наступления
(этанол). ИК спектр, ν, см-1: 3456 (OH), 3306 (NH),
оборонительного рефлекса по сравнению с исход-
1668 (CON). Спектр ЯМР 1Н, δ, м.д.: 1.30 с (3Н,
ными данными. Эффект оценивали через 0.5, 1 и
CH3), 1.99 д (1Н, С7НАНВ, J 14.0 Гц), 2.79 д (1Н,
2 ч после введения соединений. Контрольной
С7НАНВ, J 14.0 Гц), 3.52 д (1H, C5H, J 10.2 Гц),
группе животных вводили 2%-ный крахмальный
3.81 д (1H, C4H, J 10.1 Гц), 4.96 с (1Н, ОН), 6.94 с,
раствор, в качестве препарата сравнения исполь-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1198
ГЕЙН и др.
зовали коммерчески доступную субстанцию ме-
3. Amirthaganesan S., Aridoss G., Park K.S., Lim K.T.,
тамизола натрия (ООО «Фармхимкомплект») в
Jeong Y.T. Bull. Korean Chem. Soc. 2010, 31, 1135-
1142. doi 10.5012/bkcs.2010.31.5.1135
дозе 93 мг/кг, соответствующей ЕД50 по тесту
«горячая пластина». Статистическую обработку
4. Dandawate P., Khan E., Padhye S., Gaba H., Sinha S.,
экспериментального материала проводили с ис-
Deshpande J., wamy K.V., Khetmalas M., Ahmad A.,
пользованием критериев достоверности Фишера-
Sarkar F.H. Bioorg. Med. Chem. Lett. 2012, 22, 3104-
3108. doi 10.1016/j.bmcl.2012.03.060
Стьюдента.
5. Ghodse A.H., Galea S. Side Effects Drugs Annual.
Эффект считали достоверным при р < 0.05 [20].
2011, 33, 205-239. doi 10.1016/B978-0-444-53741-
Исследования выполнены в соответствии со
6.00008-8
всеми применимыми международными, нацио-
6. Сорокин В.В., Кривенько А.П., Виноградова Н.А.,
нальными и институциональными руководящими
Плотников О.П. Хим.-фарм. ж. 2001, 35, 24-26.
принципами по уходу и использованию животных.
[Sorokin V.V., Kriven’ko A.P., Vinogradova N.A.,
Plotnikov O.P. Pharm. Chem. J. 2001, 35, 488-490.]
ЗАКЛЮЧЕНИЕ
doi 10.1023/A:1014090608261
Реакцией замещенных 6-оксоциклогексан-1,3-
7. Jain J., Kumar Y., Sinha R., Kumar R., Stab-
дикарбоксамидов с тозилгидразидом, 2,4-дини-
les J. Med. Chem. 2011, 7, 56-61. doi 10.2174/
трофенилгидразином и фенилгидразином в эта-
157340611794072689
ноле получены новые производные гидразонов и
8. Guglielmotti A., Capezzone de Joannon A., Cazzol-
2,3,4,5,6,7-гексагидро-1H-индазолов. Все изучен-
la N., Marchetti M, Soldo L., Cavallo G., Pinza M.
ные соединения - перспективная группа органиче-
Pharmacol. Res. 1995, 32, 369-373. doi 10.1016/
ских веществ для дальнейшего целенаправленного
S1043-6618(05)80042-8
синтеза и фармакологического скрининга с целью
9. Said M.M., Ahmed A.A.E., El-Alfy A.T. Arch. Pharm.
создания новых лекарственных средств.
Res. 2004, 27, 1194. doi 10.1007/BF02975880
10. Гейн В.Л., Носова Н.В., Лежнина Д.Д., Гейн О.Н.,
ФОНДОВАЯ ПОДДЕРЖКА
Воронина Н.В., Старовойтова М.О., Дмитриев М.В.
Исследование выполнено при финансовой под-
ЖОХ. 2021, 91, 68-75. [Gein V.L., Nosova N.V.,
держке Пермского научно-образовательного цен-
Lezhnina D.D., Gein O.N., Voronina N.V., Starovoyto-
тра «Рациональное недропользование», 2022 год.
va M.O., Dmitriev M.V. Russ. J. Gen. Chem. 2021, 91,
57-63.] doi 10.31857/S0044460X21010066
ИНФОРМАЦИЯ ОБ АВТОРАХ
11. Носова Н.В., Лежнина Д.Д., Рубцова Д.Д., Гейн В.Л.
Носова Наталья Владимировна, ORCID: https://
Бутл. сообщ. 2020, 63, 31-34. [Nosova N.V., Lezhni-
orcid.org/0000-0001-6380-2543
na D.D., Rubtsova D.D., Gein V.L. Butlerov Comm.
2020, 63, 31-34.] doi 10.37952/ROI-jbc-01/20-63-9-
Гейн Владимир Леонидович, ORCID: https://
31
orcid.org/0000-0002-8512-0399
12. Усова Е.Б., Лысенко Л.И., Крапивин Г.Д., Завод-
Махмудов Рамиз Рагибович, ORCID: https://
ник В.Е., Кульневич В.Г. ХГС. 1997, 11, 1459-1465.
orcid.org/0000-0002-2326-3976
[Usova E.B., Lysenko L.I., Krapivin G.D., Zavod-
nik V.E., Kul’nevich V.G. Chem. Heterocycl. Compd.
КОНФЛИКТ ИНТЕРЕСОВ
1997, 33, 1259-1265.] doi 10.1007/BF02320324
Авторы заявляют об отсутствии конфликта ин-
13. CrysAlisPro,
Agilent
Technologies,
Version
тересов.
1.171.37.33.
СПИСОК ЛИТЕРАТУРЫ
14. Sheldrick G.M. Acta Crystallogr., Sect. A. 2008, 64,
112-122. doi 10.1107/S0108767307043930
1. Rollas S., Gulerman N., Erdeniz H. Farmaco. 2002, 57,
171-174. doi 10.1016/S0014-827X(01)01192-2
15. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
3-8. doi 10.1107/S2053229614024218
2. Secci D., Bizzarri B., Bolasco A., Carradori S.,
D’Ascenzio M., Rivanera D., Mari E., Polletta L.,
16. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Zicari A. Eur. J. Med. Chem. 2012, 53, 246-253. doi
ward J.A.K., Puschmann H.J. Appl. Crystallogr. 2009,
10.1016/j.ejmech.2012.04.006
42, 339-341. doi 10.1107/S0021889808042726
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
ВЗАИМОДЕЙСТВИЕ 6-ОКСОЦИКЛОГЕКСАН-1,3-ДИКАРБОКСАМИДОВ
1199
17. Gein V.L., Nosova N.V., Yankin A.N., Bazhina A.Y.,
19. Миронов А.Н. Руководство по проведению докли-
Dmitriev M.V. Tetrahedron Lett. 2019, 60, 1592-1596.
нических исследований лекарственных веществ.
doi 10.1016/j.tetlet.2019.05.023
М.: Гриф и К, 2012. Ч. 1.
18. Eddy N.B., Leimbach D.J. J. Pharmacol. Exp. Ther.
20. Беленький М.Л. Элементы количественной оценки
1953, 107, 385.
фармакологического эффекта. Л.: Медгиз, 1963.
Interaction of 6-Oxocyclohexane-1,3-dicarboxamides
with Binucleophilic Reagents. Antinociceptive Activity
of the Obtained Hydrazones and 2,3,4,5,6,7-Hexahydro-
1H-indazoles
V. L. Geina, *, D. D. Lezhninaa, N. V. Nosovaa, R.R. Makhmudovb, c, and M. V. Dmitrievb
a Perm State Pharmaceutical Academy, ul. Polevaya, 2, Perm, 614990 Russia
b Perm State National Research University, ul. Bukireva, 15, Perm, 614990 Russia
c Federal Scientific Center for Medical and Preventive Health Risk Management Technologies,
ul. Monastyrskaya, 82, Perm, 614045 Russia
*e-mail: geinvl48@mail.ru
Received February 1, 2022; revised February 12, 2022; accepted February 14, 2022
Novel hydrazones and hexahydro-1H-indazole-5-carboxamides were obtained via the reaction of 2-aryl-4-hy-
droxy-4-methyl-6-oxocyclohexane-1,3-dicarboxamides with tosylhydrazide, 2,4-dinitrophenylhydrazine and
phenylhydrazine, respectively. The structures of the products was proved using IR, 1H and 13C NMR spectros-
copy, X-rays analysis. The synthesized compounds were tested for antinociceptive activity.
Keywords: 6-oxocyclohexane-1,3-dicarboxamides, tosylhydrazide, 2,4-dinitrophenylhydrazine, phenylhydra-
zine, hydrazones, hexahydro-1H-indazole-5-carboxamides, antinociceptive activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022