ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 11, с. 1229-1233
КРАТКИЕ СООБЩЕНИЯ
УДК 547.855 + 547.88 + 547.64:54.027
РЕГИОСЕЛЕКТИВНОСТЬ АЛКИЛИРОВАНИЯ
АЗОЛО[1,5-a]ПИРИМИДИНОВ
© 2022 г. Г. Г. Данагулянa, c, *, В. А. Островскийb, **, В. К. Гарибяна
a Российско-Армянский университет, Армения, 0051 Ереван, ул. Овсепа Эмина, 123
b ФГБОУ ВО «Санкт-Петербургский государственный технологический институт (технический университет)»,
Россия, 190013 Санкт-Петербург, Московский просп., 26
c Научно-технологический центр органической и фармацевтической химии
Национальной академии наук Республики Aрмения, Aрмения, 0014 Ереван, просп. Азатутян, 26
*e-mail: gevorg.danagulyan@rau.am; gdanag@email.com
**e-mail: va_ostrovskii@mail.ru
Поступила в редакцию 02.02.2022 г.
После доработки 14.02.2022 г.
Принята к публикации 18.02.2022 г.
Реакцией 3-метил-5-аминопирaзола и 5-амино-1,2,4-триазола с этоксиметилиденацетилацетоном синте-
зированы замещенные пиразоло[1,5-a]- и 1,2,4-триазоло[1,5-a]пиримидины и изучено их алкилирование
метилиодидом и этилиодидом. На основании спектров ЯМР (NOESY) доказано, что алкилирование пира-
золо[1,5-a]пиримидинов идет по атому азота пиримидинового кольца, тогда как в 1,2,4-триазоло[1,5-a]-
пиримидинах алкилируется по атому азота N-3 триазольного цикла.
Ключевые слова: пиразоло[1,5-a]пиримидин, 1,2,4-триазоло[1,5-a]пиримидин, алкилирование, региосе-
лективность, NOESY, иодид пиразоло[1,5-a]пиримидиния-4, иодид 1,2,4-триазоло[1,5-a]пиримидиния-3
DOI: 10.31857/S051474922211012X, EDN: LSSVFI
Алкилирование азинов, азолов и конденсиро-
нил- и 7-метил-2-фенил-6-этоксикарбонилпиразо-
ванных систем на их основе, как правило, протека-
ло[1,5-a]пиримидины алкилируются метилиоди-
ет легко по атому азота кольца [1, 2]. В случае азо-
дом по атому азота пиримидинового кольца [4]. С
лопиримидинов, содержащих оба типа ароматиче-
применением методики [5] NOESY ЯМР 1Н спек-
ских гетероциклов, реакции могут протекать как
троскопии на примере двух 1,2,4-триазоло[1,5-a]-
по атому азота пиримидинового, так и пятичлен-
пиримидинов (соответственно,
5,7-диметил- и
ного кольца. Мы изучили алкилирование заме-
7-метил-6-этоксикарбонилпроизводных) было по-
щенных пиразоло[1,5-a]- и 1,2,4-триазоло[1,5-a]-
казано, что метилирование идет иначе - по атому
пиримидинов, содержащих узловой (мостиковый)
азота триазольного кольца.
атом азота. С учетом распределения электронного
Цель данной работы - выявление наличия за-
облака, в частности, очевидной электроноизбы-
кономерности в направлении протекания реакций
точности пятичленных азолов и электронодефи-
алкилирования в ряду 1,2,4-триазоло[1,5-a]пири-
цитности пиримидинового кольца [3], следовало
мидинов и пиразоло[1,5-a]пиримидинов.
ожидать алкилирования по атому азота пятичлен-
ного цикла. Однако нами ранее было показано [4,
Реакцией α-аминоазолов 1 и 2 с этоксимети-
5], что алкилирование подобных систем не всегда
лиденацетилацетоном (схема 1) синтезированы
идет однозначно. Так, 2,7-диметил-6-этоксикарбо-
6-ацетил-2,7-диметилпиразоло[1,5-a]пиримидин
1229
1230
ДАНАГУЛЯН и др.
Схема 1
N
CH3
X
R
R
CH3
N
X
N
COCH3
O
N
+
CHOC2H5
N NH2
N
O
X
H
CH3
R
N
N
COCH3
1, 2
CH3
3, 4
1, 3, R = CH3, X = CH; 2, 4, R = H, X = N.
(3) и 6-ацетил-7-метил-1,2,4-триазоло[1,5-a]пири-
ствия, зарегистрированы ЯЭО (ядерный эффект
мидин (4). Показано, что в образовании пирими-
Оверхаузера) между протоном 5-Н и протонами
динового кольца в обоих случаях участвует эток-
метильной группы ацетильного фрагмента, а так-
симетилиденовый фрагмент реагента, что приво-
же протоном 3-Н и метильной группой, находящи-
дит к получению соответствующих 6-ацетилпро-
мися в пиразольном кольце.
изводных.
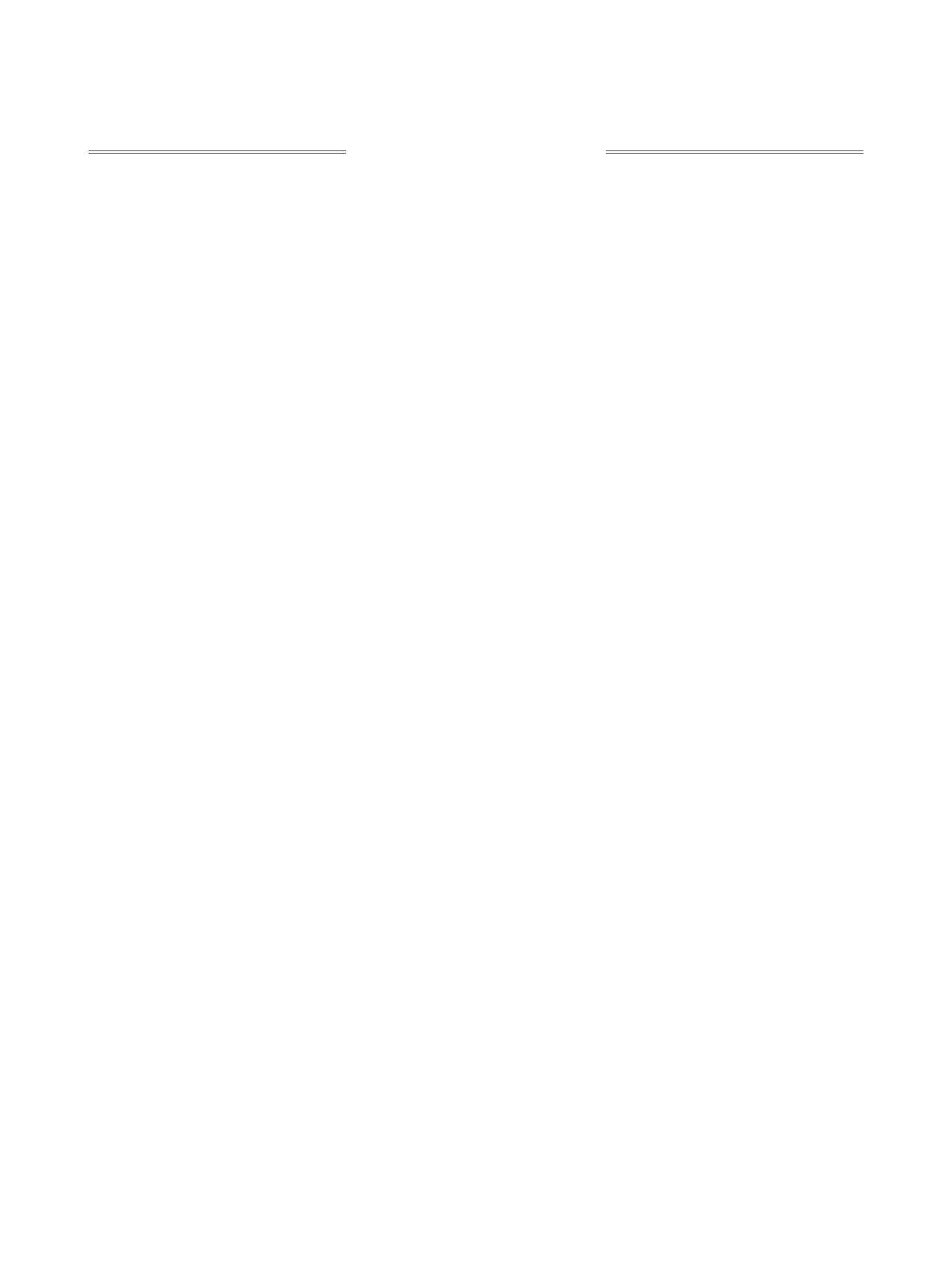
В спектре иодида, полученного реакцией того
Алкилирование азоло[1,5-a]пиримидинов мо-
же пиразолопиримидина 3 с этилиодидом (соль 6),
жет протекать по всем атомам азота, кроме мо-
отмечен отклик между метиленовой группой
стикового, который, по-видимому, по причине
N-этильного фрагмента с протонами 5-Н и 3-H, но
включения его неподеленной электронной пары в
отсутствует взаимодействие этих протонов с ме-
общую систему ароматических p-электронов би-
тильной группой N-алкильного фрагмента.
циклической системы не имеет возможности под-
Алкилирование замещенного пиразоло[1,5-a]-
вергаться электрофильной атаке.
пиримидина, как и в ранее описанных примерах
Проведенные нами опыты подтвердили отме-
алкилирования других пиразоло[1,5-a]пиримиди-
ченную ранее региоспецифичность алкилирова-
нов, протекает по атому азота N-4, пиримидино-
ния. Так, алкилирование 6-ацетил-2,7-диметил-
вого цикла. Отметим, что приведенные спектры
пиразоло[1,5-a]пиримидина (3) метилиодидом и
ЯМР NOESY выступают косвенным подтвержде-
этилиодидом привело к алкилированию по атому
нием образования соответствующих 7-метил-, а не
азота N-4 пиримидинового кольца (доказано спек-
5-метилпиразолопиримидинов, тем самым позво-
трами ЯМР 1Н, методика NOESY). В спектрах
ляют однозначно определить направление цикли-
обеих солей 5 и 6 зарегистрированы сигналы,
зации несимметричного карбонильного реагента.
свидетельствующие о взаимодействии протонов
N-алкильной группы как с протоном 3-Н, нахо-
При алкилировании
6-ацетил-7-метил-1,2,4-
дящимся в пиразольном кольце, так и с протоном
триазоло[1,5-a]пиримидина (4) были выделены
5-Н, расположенным в пиримидиновом фрагмен-
продукты реакции, соответствующие N-алки-
те молекулы. В спектре ЯМР образующегося ио-
лированию по атому азота триазольного кольца.
дида
6-ацетил-2,4,7-триметилпиразоло[1,5-a]пи-
Фактически обе реакции и с метилиодидом, и с
римидиния (5), помимо отмеченного взаимодей-
этилиодидом подтвердили ранее отмеченную за-
N
N
N
H3C
N
N
N
COCH3
N
COCH3
CH3
CH3
3
4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
РЕГИОСЕЛЕКТИВНОСТЬ АЛКИЛИРОВАНИЯ АЗОЛО[1,5-a]ПИРИМИДИНОВ
1231
CH3
CH3
H2C
H
H
N
H
N
H
I
I
H3C
H3C
N
N
N
COCH3
N
COCH3
CH3
CH3
5
6
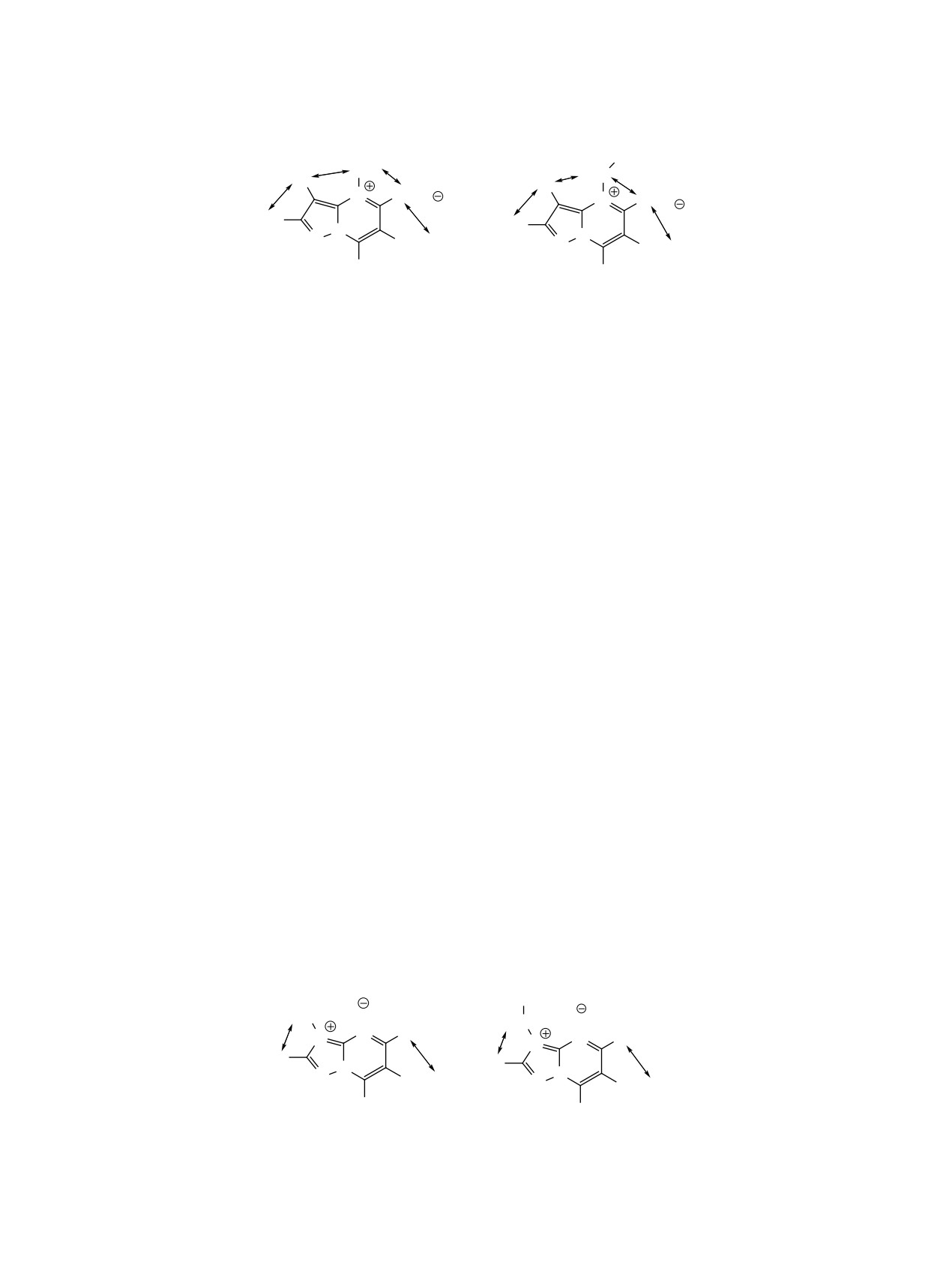
кономерность, а именно то, что алкилирование
ливали 4.0 г (0.0258 моль) этоксиметилиденаце-
по атому азота N-3 триазольного кольца приводит
тилацетона, прибавляли еще 10 мл абсолютного
к получению иодидов 7 и 8. В спектре NOESY
этанола. Через 3-5 мин кипения выпадал осадок.
N-метилпроизводного 7 отмечен кросс-пик прото-
Смесь продолжали кипятить в течение 4-6 ч. По
нов N-метильной группы с протоном триазольно-
окончании растворитель отгоняли, остаток промы-
го кольца, тогда как подобного взаимодействия с
вали эфиром и сушили. Перекристаллизовывали
протоном 5-Н пиримидинового кольца не наблю-
из гексана.
далось. В пользу алкилирования по атому азота
6-Ацетил-2,7-диметилпиразоло[1,5-a]пири-
N-3, а не N-1 триазольного цикла, свидетельству-
мидин (3). Выход 3.56 г (73%), т.пл. 135-136°C, Rf
ет отсутствие в спектре NOESY сигнала, отвеча-
0.86 (бензол-ацетон, 2:1). Спектр ЯМР 1Н, δ, м.д.:
ющего за взаимодействие протонов N-алкильной
2.50 с (3Н, 2-СН3), 2.64 с (3Н, СН3-СО), 3.03 с (3Н,
группы с протонами 7-метильной группы сосед-
7-СН3), 6.42 с (1Н, 3-Н), 8.80 с (1Н, 5-Н). Спектр
него пиримидинового кольца. Отметим, что иден-
ЯМР 13C, δ, м.д., 14.3 (CH3), 14.4 (CH3), 29.2
тификации синглетных сигналов 2 протонов 3-Н
(CH3), 96.4 (C-CH3), 116.5, 148.3, 148.4 (C-CH3),
и 5-Н (то есть корректному отнесению к триазолу
148.5 (CH), 156.1 (CH), 195.3 (C=O). Найдено, %:
и пиримидину) способствует также наличие в том
C 63.25; H 5.77; N 21.98. C10H11N3O. Вычислено,
же спектре взаимодействия одного из протонов
%: C 63.48; H 5.86; N 22.21.
(а именно 5-Н пиримидинового кольца) с прото-
6-Ацетил-7-метил-1,2,4-триазоло[1,5-а]пи-
нами СН3 ацетильной группы, находящейся в том
римидина (4). Выход 3.3 г (73%), т.пл. 203-204°C,
же кольце. Подобная картина отмечена и в спек-
Rf 0.91 (бензол-ацетон, 2:1). Спектр ЯМР 1Н, δ,
тре NOESY иодида N-этилпроизводного 8. Важно,
м.д.: 2.73 с (3Н, СН3-СО), 3.09 с (3Н, 7-СН3), 8.50
что, как и в спектре N-этилпроизводного пиразо-
с (1Н, 2-Н), 9.26 с (1Н, 5-Н). Спектр ЯМР 13C, δ,
ло[1,5-a]пиримидина 6, был отмечен ЯЭО прото-
м.д.: 15.0 (CH3), 29.5 (C-CH3), 119.7, 150.4, 154.2,
нов метиленовой группы N-этильного фрагмента
154.6 (CH), 156 (CH), 195.3 (C=O). Найдено, %: C
с соседним по триазольному кольцу протоном 2-H
54.41; H 4.65; N 31.65. C8H8N4O. Вычислено, %: C
и отсутствует подобное взаимодействие с метиль-
54.54; H 4.58; N 31.80.
ной группой N-алкильного фрагмента.
Метил- и этилиодиды азолопиримидинов
Азоло[1,5-а]пиримидины
3 и
4. К
2.5 г
5-8 (общая методика). В запаянной стеклян-
(0.0258 моль) 3-метил-5-аминопиразола (1), либо
ной ампуле, погруженной в кипящую водяную
2.17 г (0.0258 моль) 5-амино-1,2,4-триазола (2),
баню, нагревали в течение 6-8 ч смесь 0.87 г
растворенных в 10 мл абсолютного этанола, при-
(0.0046 моль) пиразолопиримидина 3 или 0.81 г
CH3
I
H3C
I
H2C
N
H
N
N
H
N
H
H
N
N
N
COCH
N
3
COCH
3
CH
3
CH3
7
8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1232
ДАНАГУЛЯН и др.
(0.0046 моль) триазолопиримидина 4 с избытком
124.9 (C-CH3), 146.2, 147.6 (CH), 153.8,
160.0
(0.031 моль) соответствующего иодида - 4.4 г
(CH), 194.8 (C=O). Найдено, %: C 36.03; H 3.75; N
(2 мл) метилиодида или 4.84 г (2 мл) этилиодида.
16.69. C10H13IN4O. Вычислено %: C 36.16; H 3.95;
По окончании ампулу охлаждали, вскрывали, оса-
N 16.87.
док отфильтровывали, промывали эфиром, гекса-
Спектры ЯМР (1H, 13C и NOESY) записаны на
ном и сушили. По ТСХ на силуфоле точка остается
спектрометре Varian Mercury-300VX (300 и 75 МГц
на старте (бензол-ацетон, 2:1). Получали соответ-
соответственно) в растворе ДМСО-ССl4, 1:3, при
ственно соединения 5-8.
температуре 298 K. Элементный анализ выпол-
Иодид 6-ацетил-2,4,7-триметилпиразоло[1,5-
нен на приборе Eurovector EA 3000. Температуры
a]пиримидиния (5). Выход 1.3 г (87%), т.пл. 134-
плавления измерены на приборах для определения
135°C. Спектр ЯМР 1Н, δ, м.д.: 2.64 с (3Н, 2-СН3),
точки плавления органических веществ SMP 11
2.83 с (3Н, СН3-СО), 3.26 с (3Н, 7-СН3), 4.43 с (3Н,
(STUART) и SMP 30 (STUART) (Великобритания).
Чистота и индивидуальность веществ под-
N-СН3), 7.24 с (1Н, 3-Н), 9.95 с (1Н, 5-Н). Спектр
ЯМР 13C, δ, м.д.: 14.6 (CH3), 16.3 (CH3), 30.1 (CH3),
тверждена на высокоэффективном препаративном
жидкостном хроматографе SENMIPREPARATIV
44.1 (CH3), 95.0 (C-CH3), 115.6 (CH), 139.6 (CH),
HPLC (HPLC Knauer AZURA PREP + Analitical
149.7 (C-CH3), 158.2, 159.9 (C-CH3), 193.2 (C=O).
UV Detector), а также ТСХ на пластинах силуфол
Найдено, %: C 39.79; H 4.19; N 12.55. C11H14IN3O.
(UV-254). В синтезе азолопиримидинов использо-
Вычислено, %: C 39.90; H 4.26; N 12.69.
ваны 5-амино-1,2,4-триазол и 3-метил-5-аминопи-
Иодид
6-ацетил-2,7-диметил-4-этилпиразо-
разол фирмы Aldrich.
ло[1,5-a]пиримидиния (6). Выход 0.95 г (60%),
ЗАКЛЮЧЕНИЕ
т.пл. 140-141°C. Спектр ЯМР 1Н, δ, м.д.: 1.67 т
(3Н, СН3СН2, J 7.1 Гц), 2.63 с (3Н, 2-СН3), 2.84
Алкилирование пиразоло[1,5-a]пиримидинов
с (3Н, СН3-СО), 3.25 с (3Н, 7-СН3), 4.93 к (2Н,
протекает по атому азота пиримидинового коль-
N-СН2, J 7.1 Гц), 7.38 с (1Н, 3-Н), 9.99 с (1Н, 5-Н).
ца, тогда как 1,2,4-триазоло[1,5-a]пиримидины в
Спектр ЯМР 13C, δ, м.д.: 13.2 (CH3-C), 14.6 (CH3),
тех же условиях реагируют с участием атома азота
16.3 (CH3), 30.1 (CH3), 53.1 (CH2), 94.7, 116.2,
триазольного цикла.
138.8, 148.7 (C-CH3), 160.0 (C-CH3), 193.3 (C=O).
ФОНДОВАЯ ПОДДЕРЖКА
Найдено, %: C 41.61; H 4.77; N 12.05. C12H16IN3O.
Исследование выполнено в Российско-
Вычислено, %: C 41.75; H 4.67; N 12.17.
Армянском университете за счет средств, выде-
Иодид 6-ацетил-3,7-диметил-1,2,4-триазоло-
ленных в рамках субсидии Минобрнауки России
[1,5-a]пиримидиния (7). Выход 1.1 г (75%), т.пл.
на финансирование научно-исследовательской
149-150°C. Спектр ЯМР 1Н, δ, м.д.: 2.81 с (3Н,
деятельности РАУ, а также при финансовой под-
СН3-СО), 3.10 с (3Н, 7-СН3), 4.04 с (3Н, N-СН3),
держке ГосКомНауки РА и РФФИ /РНФ/ (проект
9.76 с (1Н, 5-Н), 9.81 с (1Н, 2-Н). Спектр ЯМР
№ 20RF-138/20-53-05010 Arm_а/).
13C, δ, м.д.: 15.1 (CH3), 31.8 (CH3), 31.8 (N-CH3),
ИНФОРМАЦИЯ ОБ АВТОРАХ
124.9 (C-CH3), 146.8, 148.8 (CH), 154.0,
160.4
(CH), 196.0 (C=O). Найдено, %: C 33.74; H 3.35; N
Данагулян Геворг Грачевич, ORCID: https://
17.38. C9H11IN4O. Вычислено, %: C 33.98; H 3.49;
orcid.org/0000-0002-3591-4529
N 17.61.
Островский Владимир Аронович, ORCID:
Иодид
6-ацетил-7-метил-3-этил-1,2,4-триа-
золо[1,5-а]пиримидиния (8). Выход 0.8 г (70%),
т.пл. 155-156°C. Спектр ЯМР 1Н, δ, м.д.: 2.65 т
orcid.org/0000-0002-5798-3074
(3Н, СН3СН2, J 7.1 Гц), 2.85 с (3Н, СН3-СО), 3.15
КОНФЛИКТ ИНТЕРЕСОВ
с (3Н, 7-СН3), 4.61 к (2Н, N-СН2, J 7.1 Гц), 9.75 с
(1Н, 5-Н), 10.03 с (1Н, 2-Н). Спектр ЯМР 13C, δ,
Авторы заявляют об отсутствии конфликта ин-
м.д.: 13.7 (CH3), 15.0 (CH3), 30.2 (CH3), 41.1 (CH2),
тересов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
РЕГИОСЕЛЕКТИВНОСТЬ АЛКИЛИРОВАНИЯ АЗОЛО[1,5-a]ПИРИМИДИНОВ
1233
СПИСОК ЛИТЕРАТУРЫ
4. Данагулян Г.Г., Бояхчян А.П., Данагулян А.Г., Пано-
1. Худина О.Г., Бургарт Я.В., Салоутин В.И. ЖОрХ.
сян Г.А. ХГС. 2011, 47, 393-405. [Danagulyan G.G.,
2017, 53, 1528-1535. [Khudina O.G., Burgart Ya.V.,
Boyakhchyan A.P., Danagulyan A.G., Panosyan H.A.
Saloutin V.I. Russ. J. Org. Chem. 2017, 53, 1556-
Chem. Heterocycl. Compd. 2011, 47, 321-331.] doi
1563.] doi 10.1134/S1070428017100116
2. Kobayashi R., Shibutani S., Nagao K., Ikeda Z., Wang J.,
10.1007/s10593-011-0760-x
Ibáñez J., Reynolds M., Sasaki Y., Ohmiya H. Org.
5. Danagulyan G.G., Boyakhchyan A.P., Tumanyan A.K.,
Lett. 2021, 23, 5415-5419. doi 10.1039/D1DT03652A
Danagulyan A.G., Araqelyan M.R. Chem. J. Armenia.
3. Пожарский А.Ф. Теоретические основы химии ге-
тероциклов. М.: Химия, 1985.
2020, 73, 349-358.
Regioselectivity of Alkylation of Azolo[1,5-a]pyrimidines
G. G. Danagulyana, c, *, V. A. Ostrovskiib, **, and V. K. Gharibyana
a Russian-Armenian University, ul. Hovsep Emina, 123, Yerevan, 0051 Armenia
b Saint-Petersburg State Institute of Technology, Moskovskii prosp., 26, Saint-Petersburg, 190013 Russia
c Scientific and Technological Center for Organic and Pharmaceutical Chemistry
National Academy of Sciences of the Republic of Armenia,
prosp. Azatutyana, 26, Yerevan, 0014 Armenia
*e-mail: gevorg.danagulyan@rau.am; gdanag@email.com
**e-mail: va_ostrovskii@mail.ru
Received February 2, 2022; revised February 14, 2022; accepted February 18, 2022
The reaction of substituted 5-aminopyrazoles and 5-amino-1,2,4-triazole with ethoxymethylideneacetylace-
tone, as well as with the sodium salt of ethyl ester of acetylpyruvic acid, synthesized a number of substituted
pyrazolo[1,5-a]- and 1,2,4-triazolo[1,5-a]pyrimidines. The alkylation of the synthesized pyrazolo[1,5-a]- and
1,2,4-triazolo[1,5-a]pyrimidines with methyl iodide and ethyl iodide was studied. It was proved that the al-
kylation of pyrazolo[1,5-a]pyrimidines occurs at the nitrogen atom of the pyrimidine ring, while in 1,2,4-tri-
azolo[1,5-a]pyrimidines the N-3 nitrogen atom of the triazole ring is alkylated.
Keywords: pyrazolo[1,5-a]pyrimidine, 1,2,4-triazolo[1,5-a]pyrimidine, alkylation, regioselectivity, NOESY,
pyrazolo[1,5-a]pyrimidin-4-ium iodide, 1,2,4-triazolo[1,5-a]pyrimidin-3-ium iodide
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022