ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 11, с. 1234-1238
КРАТКИЕ СООБЩЕНИЯ
УДК 547.824:542.91:548.737
СИНТЕЗ ОСНОВАНИЙ МАННИХА НА ОСНОВЕ
N-ИМИДА МАЛЕОПИМАРОВОЙ КИСЛОТЫ
© 2022 г. А. А. Смирнова, Е. В. Третьякова*, О. Б. Казакова
Уфимский Институт химии - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
Россия, 450054 Уфа, просп. Октября, 71
*e-mail: tretyakovaelv@gmail.com
Поступила в редакцию 04.02.2022 г.
После доработки 16.04.2022 г.
Принята к публикации 17.04.2022 г.
Реакцией Манниха под действием вторичных аминов и параформальдегида в присутствии катализатора
CuCl осуществлен синтез новых, замещенных по ангидридному кольцу, аминометильных производных
имида метилового эфира малеопимаровой кислоты.
Ключевые слова: дитерпеноиды, диеновые аддукты, малеопимаровая кислота, имид, Реакция Манниха
DOI: 10.31857/S0514749222110131, EDN: LSWOZA
Интерес к функционально замещенным произ-
ных) с формальдегидом и нуклеофильными ре-
водным малеопимаровой кислоты (легкодоступ-
агентами, в настоящее время является одним из
ного диенового аддукта левопимаровой кислоты,
важнейших инструментов органического синте-
основного метаболита сосновой живицы Pinus
за [13-15]. Одним из вариантов конденсации по
Silvestris, и малеинового ангидрида) обусловлен
Манниху является реакция аминометилирования
широким спектром их биологической активно-
имидов дикарбоновых кислот, представляющая
сти и высокой реакционной способностью [1-4].
собой удобный способ получения соединений,
Наличие нескольких реакционноспособных цен-
содержащих в своей структуре N-алкилимидный
тров позволяет использовать данные соединения
фрагмент [16]. Подобные соединения, входят в
в синтезе полициклических структур, проявляю-
состав препаратов, использующихся в лечении
щих противоязвенную, противовоспалительную,
панкреатита [17], обладают антидепрессантными,
антимикробную, противовирусную и другие виды
антипсихотическими, анксиолитическими свой-
активности [5-9]. Известно также, что азотсодер-
ствами [18-21]. Продукты аминометилирования
жащие производные малеопимаровой кислоты,
сукцинимида и фталимида формальдегидом в со-
модифицированные по ангидридному кольцу, об-
четании с оксазолидинами показали свою актив-
ладают фунгицидным, нематоцидным, антибак-
ность, как диуретики, противовоспалительные,
териальным и цитотоксическим действием [10-
антибактериальные и противогрибковые средства
12].
[22].
Реакция α-аминометилирования (реакция
В настоящей работе нами осуществлен синтез
Манниха), заключающаяся во введении аминоме-
новых гетероциклических дитерпеновых произ-
тильного фрагмента в органические соединения
водных на основе реакции аминоалкилирования
путем конденсации аминов (как правило, вторич-
имида метилмалеопимарата вторичными амина-
1234
СИНТЕЗ ОСНОВАНИЙ МАННИХА НА ОСНОВЕ N-ИМИДА МАЛЕОПИМАРОВОЙ КИСЛОТЫ
1235
Схема 1
O
O
H
H
1'
NH
i
N R
H
H
H O
H O
H
H
O
O
O
O
1
2-5
5'
2'
3'
2'
3'
6'
2'
4'
4'
N
3'
2, R =
,
3, R =
N O
,
4, R =
N N CH3 ,
5, R =
N
NH
2"
3"
2"
3"
2"
3"
2'
3'
Ɋɟɚɝɟɧɬɵ ɢ ɭɫɥɨɜɢɹ i ɩɚɪɚɮɨɪɦɚɥɶɞɟɝɢɞ
ɞɢɨɤɫɚɧ &X&O
& ɱ
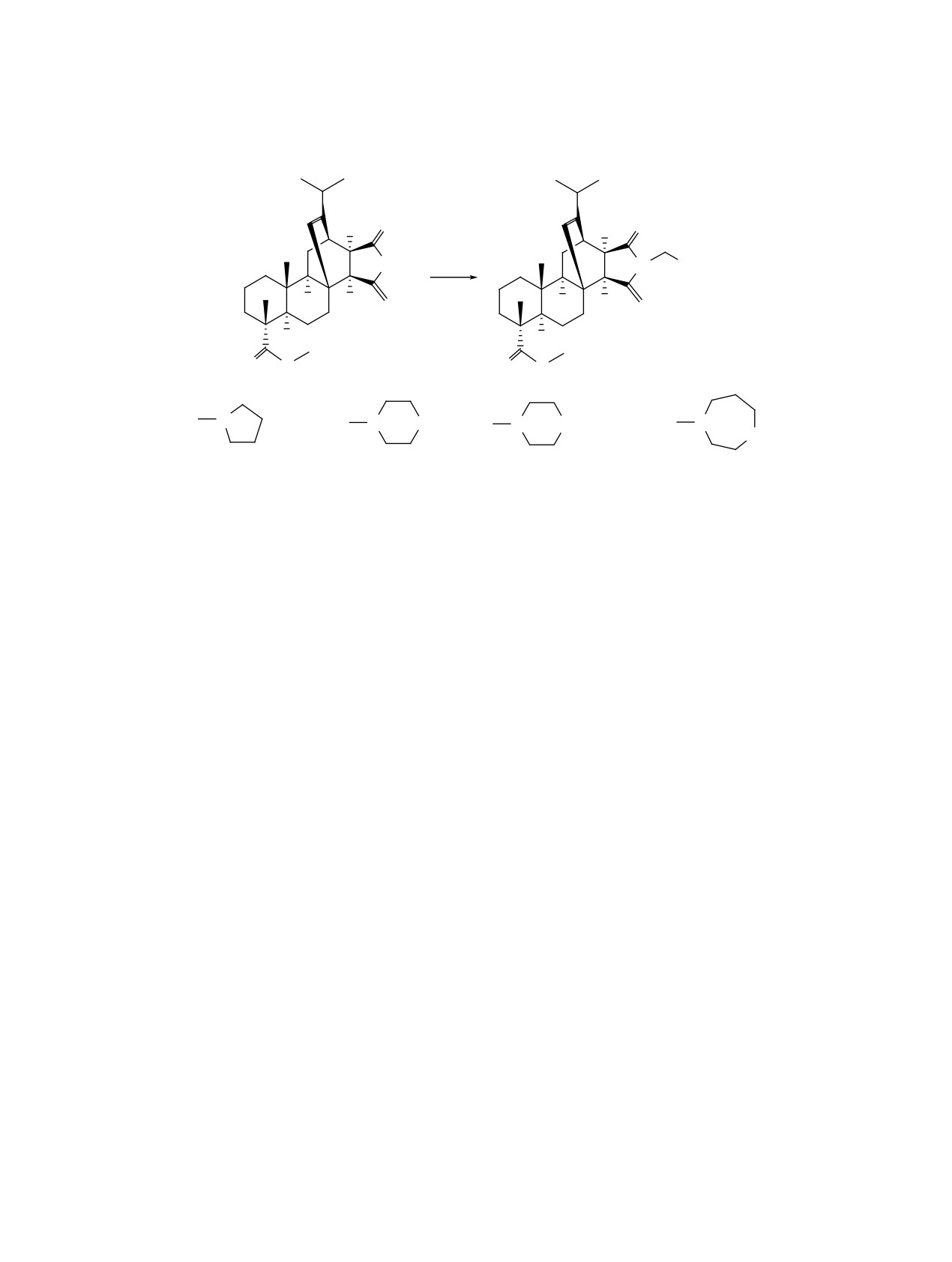
ми в присутствии параформальдегида и хлорида
Общая методика синтеза соединений 2-5. К
меди (I) в качестве катализатора.
смеси 1.2 ммоль (0.5 г) соединения 1 и 1.2 ммоль
(0.036 г) параформальдегида в 15 мл сухого 1,4-ди-
Для синтеза новых гетероциклических произ-
оксана при перемешивании добавляли 2 ммоль
водных дитерпеноидов мы использовали трехком-
циклического вторичного амина и
0.4 ммоль
понентную конденсацию имида метил малеопима-
(0.04 г) хлорида меди (I). Реакционную смесь пе-
рата 1 с формальдегидом и вторичными аминами
ремешивали при комнатной температуре в течение
(пирролидин, морфолин, N-метилпиперазин и
24 ч (контроль ТСХ), затем разбавляли 20 мл хло-
гомопиперазин) в присутствии в качестве ката-
роформа, промывали последовательно 25%-ным
лизатора CuCl. Реакция протекала в течение 24 ч
водным раствором аммиака, 10%-ным водным рас-
при комнатной температуре в среде 1,4-диоксана
твором соляной кислоты и водой до нейтральной
с образованием продуктов N-аминоалкилирования
реакции, сушили над CaCl2, упаривали. Остаток
2-5 с выходами 70-82% после очистки методом
очищали колоночной хроматографией на SiO2,
колоночной хроматографии (схема 1).
используя смесь петролейный эфир-этилацетат в
объемном соотношении от 3:1 до 1:1 в качестве
Структура синтезированных соединений 2-5
элюента.
установлена с помощью ЯМР спектроскопии и
Метил-13-изопропил-4,10-диметил-23,24-
масс-спектрометрии. Во всех случаях, молекуляр-
диоксо-N-[2'-(2H-пирролидин-3'-ил)метил]-
ные ионные пики соответствовали молекулярным
гексадекагидро-8,12-этенонафто[2,1-e]изоин-
массам синтезированных соединений. В спектрах
дол-4-карбоксилат (2). Выход 0.35 г (70%). Rf 0.16,
ЯМР 1Н оснований Манниха 2-5 наблюдаются ха-
т.пл. 56-58°C. [α]D20 -24.9° (c 0.005, CHCl3). Спектр
рактерные синглеты метиленовых групп H1' в об-
ЯМР 1H (СDCl3), δ, м.д.: 0.60 с (3H, Н20), 0.80-0.87
ласти δ 3.60-4.20 м.д., сигналы пирролидинового
м (1H, H1а), 0.89 д (3H, Н18, J 6.7 Гц), 0.98 д (3H,
фрагмента в соединении 2 - в области δ 1.62-1.90
Н19, J 7.0 Гц), 1.11 с (3H, Н21), 1.18-1.81 м (16Н,
и 2.73-2.80 м.д., морфолинового остатка в соеди-
Н1е, Н2а,е, Н3а,е, Н5, Н6а,е, H7a, H9, Н11а,е, H3', H3''),
нении 3 - в области δ 2.39-2.70 и 3.55-3.76 м.д.
2.08-2.18 м (1H, H17), 2.41-2.49 м (1H, H7e), 2.60
Спектры ЯМР 1Н оснований Манниха 4, 5 содер-
уш.с (1H, H16), 2.73-2.80 м (4H, H2', H2''), 2.92-3.05
жали также синглеты протона метильной группы
м (2H, H15, H12), 3.60 c (3H, H25), 3.66-3.76 м (2H,
в области δ 1.62-1.90 м.д. (соединение 4), и ами-
H1'), 5.45 с (1Н, Н14). Спектр ЯМР 13С (СDCl3), δ,
ногруппы гомопиперазинового цикла - в области
м.д.: 15.71 (С20), 16.76 (С19), 17.05 (C2), 19.62 (С16),
слабых полей δ 8.30-8.35 м.д. (соединение 5).
20.70 (С17), 21.77 (С6), 23.37 (C3', C3''), 27.57 (С11),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1236
СМИРНОВА и др.
32.73 (С15), 35.24 (С7), 35.55 (С12), 35.71 (С10),
(С10), 38.13 (С1), 40.75 (С8), 45.10 (С5), 49.49 (С25),
36.71 (С3), 38.13 (С1), 40.28 (С8), 45.29 (С5), 47.15
50.09 (С4), 51.91 (С24), 51.95 (С4'), 52.27 (С22),
(С4), 49.54 (С2', C2''), 50.95 (С1’), 51.99 (С21), 52.44
54.24 (С9), 54.75 (С2', C2''), 59.17 (C1'), 67.05 (C3',
(С22), 53.99 (С25), 54.31 (С9), 124.40 (C14), 147.12
C3'') 124.48 (C14), 147.09 (C13), 170.95 (C24), 172.67
(C13), 170.99 (C24), 172.76 (C23), 179.19 (C18). Масс
(C23), 179.13 (C18). Масс спектр, m/z: 526.4 [М +
спектр, m/z: 497.4 [М + Н]+. Найдено, %: C 72.54; H
Н]+. Найдено, %: C 70.84; H 9.02; N 7.96; O 12.18.
8.95; N 5.64; O 12.87. C30H44N2O4. Вычислено, %:
C31H47N3O4. Вычислено, %: C 70.82; H 9.01; N
C 72.55; H 8.93; N 5.64; O 12.88. M 496.7.
7.99; O 12.18. M 525.7.
Метил-13-изопропил-4,10-диметил-N-[2'-
Метил-13-[2'-(3',6'-диазепан-3'-ил)метил]-
(2H-морфолинометил)]-23,24-диоксо-гексаде-
изопропил-4,10-диметил-23,24-диоксо-гексаде-
кагидро-8,12-этенонафто[2,1-e]изоиндол-4-кар-
кагидро-8,12-этенонафто[2,1-e]изоиндол-4-кар-
боксилат (3). Выход 0.37 г (74%). Rf 0.17, т.пл. 63-
боксилат (5). Выход 0.38 г (76%). Rf 0.16, т.пл. 61-
65°C. [α]D20 -53.4° (c 0.005, CHCl3). Спектр ЯМР 1H
63°C. [α]D20 -55.5° (c 0.005, CHCl3). Спектр ЯМР 1H
(CDCl3), δ, м.д.: 0.59 с (3H, Н20), 0.81-0.86 м (1H,
(СDCl3), δ, м.д.: 0.50 с (3H, Н20), 0.80-0.85 м (1H,
H1а), 0.87 д (3H, Н18, J 6.9 Гц), 0.96 д (3H, Н19, J
H1а), 0.86 д (3H, Н18, J 6.9 Гц), 0.95 д (3H, Н19, J
7.0 Гц), 1.13 с (3H, Н21), 1.15-1.85 м (12Н, Н1е,
7.0 Гц), 1.11 с (3H, Н21), 1.19-1.81 м (14Н, Н1е, Н2а,е,
Н2а,е, Н3а,е, Н5, Н6а,е, H7a, H9, Н11а,е), 2.10-2.34 м
Н3а,е, Н5, Н6а,е, H7a, H9, Н11а,е, Н5'), 2.18-2.23 м (1H,
(3H, H17, H7e, Н16), 2.39-2.70 м (4H, H2', H2''), 2.80
H17), 2.46-2.54 м (6H, H7e, H16, H3', H4'), 2.65-2.69
уш.с (1H, Н15), 3.05 уш.с (1H, Н12, J 8.4 Гц), 3.54 c
м (2H, H2'), 2.79 уш.с (1H, H15), 3.04 с (1H, H12),
(3H, H25), 3.55-3.76 м (4H, H3', H3''), 4.25 д (2Н, Н1'),
3.10 д (2H, H6'), 3.50-3.54 м (2H, H1'), 3.60 c (3H,
5.40 уш.c (1H, H14). Спектр ЯМР 13C (СDCl3), δ,
H25), 5.45 с (1Н, Н14), 8.31 уш.с (1Н, NH). Спектр
м.д.: 15.73 (С20), 16.73 (С19), 17.03 (С2), 19.56 (С16),
ЯМР 13С (СDCl3), δ, м.д.: 15.53 (С20), 16.72 (С19),
20.69 (С17), 21.76 (С6), 27.42 (С11), 32.57 (С15),
17.04 (C2), 19.95 (С16), 20.70 (С17), 21.75 (С6), 27.56
35.25 (С7), 35.70 (С12), 36.70 (С10), 37.72 (С3), 38.12
(С11), 32.76 (С15), 34.78 (С7), 35.18 (C5'),
35.52
(С1), 40.72 (С8), 45.28 (С5), 47.13 (С4), 49.50 (C21),
(С10), 35.67 (С12), 36.69 (С3), 38.14 (С1), 45.64 (C6'),
50.73 (С2', C2''), 52.00 (С9), 52.33 (C22), 54.42 (С25),
45.66 (С8), 45.75 (С4), 46.51 (С5), 46.66 (C4'), 49.15
59.51 (С1'), 66.60 (C3', C3''), 125.14 (C14), 148.08
(C3'), 49.53 (С21), 51.98 (С22), 53.29 (C2'),
53.70
(C13), 170.99 (C24), 172.70 (C23), 179.05 (C18). Масс
(С9), 53.98 (С25), 67.06 (C1'), 124.54 (C14), 147.18
спектр, m/z: 513.4 [М + Н]+. Найдено, %: C 70.26; H
(C13), 170.99 (C24), 173.27 (C23), 179.12 (C18). Масс
8.64; N 5.48; O 15.62. C30H44N2O5. Вычислено, %:
спектр, m/z: 526.4 [М + Н]+. Найдено, %: C 70.81; H
C 70.28; H 8.66; N 5.46; O 15.60. M 512.7.
9.02; N 7.97; O 12.20. C31H47N3O4. Вычислено, %:
C 70.82; H 9.01; N 7.99; O 12.18. M 525.7.
Метил-13-изопропил-4,10-диметил-N-[2'-
(2H-метилпиперазин-3'-ил)метил]-23,24-диок-
Температуры плавления определяли на ми-
со-гексадекагидро-8,12-этенонафто[2,1-e]изо-
кростолике
«Boetius». Оптическое поглощение
индол-4-карбоксилат (4). Выход 0.41 г (82%). Rf
измеряли на поляриметре
«Perkin-Elmer
241
0.17, т.пл. 66-68°C. [α]D20 -9.8° (c 0.005, CHCl3).
MC» (Германия) в трубке длиной 1 дм. ТСХ-
Спектр ЯМР 1H (СDCl3), δ, м.д.: 0.52 с (3H, Н20),
анализ проводили на пластинках Сорбфил (ЗАО
0.75 с (1H, H1а), 0.96 д (3H, Н18, J 6.8 Гц), 0.98 д
Сорбполимер, Россия), используя систему рас-
(3H, Н19, J 7.1 Гц), 1.12 с (3H, Н21), 1.18-1.81 м
творителей хлороформ-этилацетат, 1:1. Вещества
(12Н, Н1е, Н2а,е, Н3а,е, Н5, Н6а,е, H7a, H9, Н11а,е),
обнаруживали 10% раствором серной кислоты с
2.18-2.23 м (2H, H17, H7e), 2.30-2.62 м (9H, H16,
последующим нагреванием при 100-120°С в тече-
H2', H2'', H3', H3''), 2.71 уш.с (1H, H15), 2.94 с (1H,
ние 2-3 мин. Элементный анализ осуществляли на
H12), 3.58 c (3H, H25), 3.60-3.70 д (3H, H4'), 4.11-
СHNS-анализаторе EuruEA-3000, основной стан-
4.16 м (2H, H1'), 5.35 уш.с (1Н, Н14). Спектр ЯМР
дарт ацетанилид. Колоночную хроматографию
13С (СDCl3), δ, м.д.: 15.64 (С20), 16.73 (С19), 17.03
проводили на SiO2 (Silica 60, Macherey-Nagel).
(C2), 19.89 (С16), 20.66 (С17), 21.76 (С6), 27.51 (С11),
Масс-спектры соединений снимали на приборе
32.62 (С15), 35.26 (С7), 35.47 (С12), 36.68(С3), 37.69
Thermo Finnigan MAT 95 XP. Спектры ЯМР 1Н и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ ОСНОВАНИЙ МАННИХА НА ОСНОВЕ N-ИМИДА МАЛЕОПИМАРОВОЙ КИСЛОТЫ
1237
13С зарегистрированы на импульсном спектроме-
va I.E., Spirikhin L.V., Tolstikov G.A., Chudov I.V.,
тре «Bruker» Avance III с рабочей частотой 500.13
Bazekin G.V., Ismagilova A.F. Russ. J. Bioorg. Chem.
2010, 36, 257-262.] doi 10.1134/S1068162010020160
(1H) и 125.47 (13C) МГц с использованием 5 мм
датчика с Z-градиентом PABBO при постоянной
6. Третьякова Е.В., Смирнова И.Е., Салимова Е.В.,
температуре образца 298 K. Химические сдвиги
Пашкова Т.М., Карташова О.Л., Одиноков В.Н.,
Парфенова Л.В. Биорг. хим. 2017, 43, 317-323.
в спектрах ЯМР 1Н и 13С приведены в м.д. отно-
[Tretyakova E.V., Smirnova I.E., Salimova E.V.,
сительно сигнала внутреннего стандарта тетраме-
Pashkova T.M., Kartashova O.L., Odinokov V.N.,
тилсилана (ТМС). Имид метилового эфира малео-
Parfenova L.V. Russ. J. Bioorg. Chem. 2017, 43, 317-
пимаровой кислоты 1 получали по ранее описан-
322.] doi 10.1134/S1068162017020169
ной методике [23].
7. Tretyakova E.V., Smirnova I.E., Salimova E.V.,
ЗАКЛЮЧЕНИЕ
Odinokov V.N. Bioorg. Med. Chem. 2015, 23, 6543-
6550. doi 10.1016/j.bmc.2015.09.006
На основе реакции аминоалкилирования ими-
8. Tretyakova E.V., Salimova E.V., Parfenova L.V.,
да метилмалеопимарата вторичными аминами
Yunusbaeva M.M., Dzhemileva L.U., D’yakonov V.V.,
в присутствии параформальдегида и CuCl в ка-
Dzhemilev U.M. Anticancer Agents Med. Chem. 2019,
честве катализатора осуществлен синтез новых
19, 1172-1183. doi 10.2174/187152061966619040410
гетероциклических дитерпеновых производных
0846
с пирролидиновым, морфолиновым, N-метил-
9. Казакова О.Б., Третьякова Е.В., Куковинец О.С.,
пиперазиновым и гомопиперазиновым фрагмен-
Толстиков Г.А., Назыров Т.И., Чудов И.В., Исмаги-
тами.
лова А.Ф. Биоорг. хим. 2010, 36, 832-840. [Kazako-
va O.B., Tret’yakova E.V., Kukovinets O.S., Tolsti-
ФОНДОВАЯ ПОДДЕРЖКА
kov G.A., Nazyrov T.I., Chudov I.V., Ismagilova A.F.
Работа выполнена по теме Госзадания
Russ. J. Bioorg. Chem. 2010, 36, 762-770.] doi
№ 1021062311392-9-1.4.1.
10.1134/S1068162010060130
10. Schuller W.H., Minor J.C., Block S.S., Lawrence R.V.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Пат. US3636215А (1972). США.
Третьякова Елена Валерьевна, ORCID: https://
11. Wang J., Chen Y.P., Yao K., Wilbon P.A., Zhang W.,
orcid.org/0000-0002-0693-220X
Ren L., Zhou J., Nagarkatti M., Wang Ch., Chu F.,
КОНФЛИКТ ИНТЕРЕСОВ
He X., Decho A.W., Tang Ch. Chem. Commun. 2012,
48, 916-918. doi 10.1039/C1CC16432E
Авторы заявляют об отсутствии конфликта ин-
12. Yao G.-Y., Ye M.-Y., Huang R.-Zh., Li Y.-J., Zhu Y.-T.,
тересов.
Pan Y.-M., Liao Zh.-X., Wang H.-Sh. Bioorg. Med.
СПИСОК ЛИТЕРАТУРЫ
Chem. Lett.
2013,
23,
6755-6758. doi
10.1016/
j.bmcl.2013.10.028
1. Третьякова Е.В. ЖОрХ.
2021,
57,
420-425.
13. Arend M, Westermann B, Risch N. Angew. Chem.
[Tret’yakova E.V. Russ. J. Org. Chem. 2021, 57, 391-
Int. Ed.
1998,
37,
1044-1070. doi
10.1002/
395.] doi 10.1134/S1070428021030106
(SICI)1521-3773(19980504)37:8<1044::AID-
2. Третьякова Е.В. ЖОрХ.
2021,
57,
852-859.
ANIE1044>3.0.CO;2-E
[Tret’yakova E.V. Russ. J. Org. Chem. 2021, 57, 930-
14. Tramontini M., Angiolini L. Mannich-Bases, Chemistry
935.] doi 10.1134/S1070428021060075
and Uses. Boca Raton: CRC, 1994.-
3. Tretyakova E.V., Salimova E.V., Parfenova L.V. Nat.
15. Aboraia A.S., Abdel-Rahman H.M., Mahfouz N.M.,
Prod. Res. 2020, doi 10.1080/14786419.2020.1762187
El-Gendy M.A. Bioorg. Med. Chem. 2006, 14, 1236-
4. Smirnova I.E., Tret’yakova E.V., Baev D.S., Kaza-
1246. doi: 10.1016/j.bmc.2005.09.053
kova O.B. Nat. Prod. Res.
2021. doi
10.1080/
16. Bundgaard H., Johansen M. J. Pharm. Sci. 1980, 69,
14786419.2021.1969566
44-46. doi 10.1002/jps.2600690112
5. Казакова О.Б., Третьякова Е.В., Смирнова И.Е.,
17. Prous J., Castaсer J. Drugs Future. 1988, 13, 613.
Спирихин Л.В., Толстиков Г.А., Чудов И.В., Базе-
кин Г.В., Исмагилова А.Ф. Биорг. хим. 2010, 36,
18. Ishizumi K., Kojima A., Antoku F. Сhem Pharm Bull.
277-282. [Kazakova O.B., Tret’yakova E.V., Smirno-
1991, 39, 2288. doi 10.1248/cpb.39.2288
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1238
СМИРНОВА и др.
19. Silvestre J., Graul J., Castaсer J. Drugs Future. 1998,
22. Kalm M.J. J. Org. Chem. 1960, 25, 1929-1937. doi
23, 161. doi 10.1358/dof.1998.023.02.445830
10.1021/jo01081a026
20. Abou-Gharbia M., Moyer J.A., Haskins J.T. Drugs
23. Maciejewski C., Gastambide B. Helv. Him. Acta. 1977,
Future. 1989, 14, 442-443.
21. Prous, J., Castacer J. Drugs Future. 1991, 16, 122.
60, 524-536.
Synthesis of Mannich Bases on the Basis
of N-Imide Maleopimaric Acid
A. A. Smirnova, E. V. Tret’yakova*, and O. B. Kazakova
Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences,
prosp. Oktyabrya, 71, Ufa, 450054 Russia
*e-mail: tretyakovaelv@gmail.ru
Received February 4, 2022; revised April 16, 2022; accepted April 17, 2022
The Mannich reaction under the action of secondary amines and paraformaldehyde in the presence of a CuCl
catalyst was used to synthesize new aminomethyl derivatives of maleopimaric acid methyl ester imide substi-
tuted at the anhydride ring.
Keywords: diterpenoids, diene adducts, maleopimaric acid, imide, Mannich reaction
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022