ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 11, с. 1243-1247
КРАТКИЕ СООБЩЕНИЯ
УДК 547-327
СИНТЕЗ ПРОИЗВОДНЫХ 1,3-ДИТИОЛАН-2-ИМИНА
ИЗ D-МАННИТА
© 2022 г. В. А. Ширяев*, А. К. Ширяев
ФГБОУ ВО «Самарский государственный технический университет», Россия, 443100 Самара, ул. Куйбышева, 153
*e-mail: shiryaev.va@samgtu.ru
Поступила в редакцию 07.02.2022 г.
После доработки 18.02.2022 г.
Принята к публикации 20.02.2022 г.
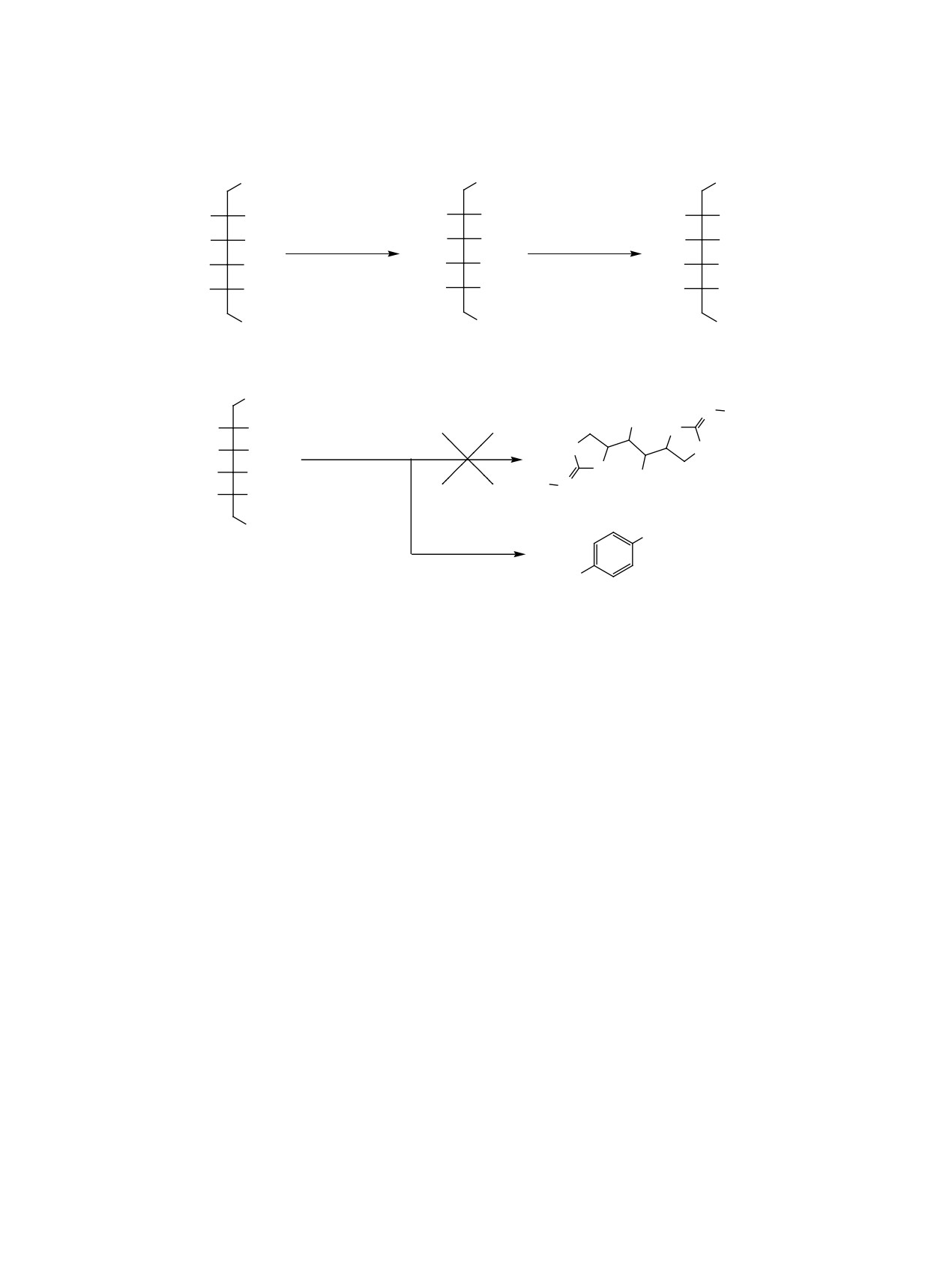
Различные производные D-маннита были использованы в реакции Риттера с 1-адамантанолом. В случае
(2S,3S,4S,5S)-2,3,4,5-тетраацетокси-1,6-дитиоцианогексана был выделен только один продукт - 1,4-ди-
адамантилбензол. При взаимодействии (4S,5S,6S,7S)-4,7-бис(тиоцианометил)-5,6-дибензоилокси-1,3-ди-
оксепана c 1-адамантанолом в серной кислоте получен (1S,2S)-1,2-бис[(5S)-2-(1-адамантилимино)-1,3-ок-
сатиолан-5-ил]-этан-1,2-диилдибензоат.
Ключевые слова: оксатиолан, маннит, диадамантилбензол
DOI: 10.31857/S0514749222110155, EDN: LTERPK
Тиосахара и их производные, такие как тиоаль-
D-Маннит представляет собой коммерчески до-
диты, используются при разработке новых лекар-
ступный субстрат, который легко превращается в
ственных средств, так как замена атома кислоро-
1,6-бис-тиоцианопроизводное 3 [18]. При прове-
да на атом серы придает молекуле углевода ряд
дении реакции циклизации 1,6-бис-тиоцианата 3
уникальных свойств [1-9]. Наличие атома серы в
был выделен не бис-1,3-оксатиолан-2-имин (4), а
молекуле замедляет реакции моносахаридов, что
1,4-ди-(1-адамантил)бензол (5). Данная реакция,
позволяет использовать их в качестве ингибито-
вероятно, происходит вследствие превращения
ров ферментов, таких как гликозилазы [10-13].
производного маннита 3 в бензол в сернокислой
Обнаружено, что аналогичную активность прояв-
среде, который затем алкилируется присутству-
ющим в реакционной массе 1-адамантильным
ляют аналоги углеводов - полигидрокситетраги-
катионом с образованием 1,4-ди-(1-адамантил)-
дротиофены [11], которые могут быть получены
бензола (5). Реакцию повторяли несколько раз при
из 1,4-ангидро-4-тио-D-маннита [6]. Выделение
тщательном исключении попадания следов бен-
тиосахаров и тиоальдитов из природных источ-
зола в реакционную смесь, и всегда при добавле-
ников [14] и изучение биологической активности
нии бис-тиоцианата 3 к раствору 1-адамантанола
синтетических серосодержащих производных
в серной кислоте выделялись белые кристаллы
сахаров определяет интерес к ним как к потен-
1,4-ди(1-адамантил)бензола (5) (схема 1).
циальным ингибиторам ферментов. В данном ис-
следовании мы изучали возможность применения
Другой путь к серосодержащему производ-
реакции циклизации 1,2-гидрокситиоцианатов в
ному маннита - синтез 1,6-бис-тиоцианата 7 из
N-замещенные
1,3-оксатиолан-2-имины
[15-17]
диоксипандибромида 6 [19]. Производное ман-
для получения производных тиоальдита из D-ман-
нита 8, содержащее 2 фрагмента 1,3-оксатио-
нита.
лан-2-имина, образуется при N-алкилировании
1243
1244
В. А. ШИРЯЕВ, А. К. ШИРЯЕВ
Схема 1
OH
Br
SCN
HO
H
AcO
H
AcO
H
1. AcBr/ɞɢɨɤɫɚɧ
HO
H
2. Ac2O/ɩɢɪɢɞɢɧ
AcO
H
KSCN/ɚɰɟɬɨɧ
AcO
H
H
OH
H
OAc
100°C, 10 ɱ
H
OAc
H
OH
H
OAc
H
OAc
OH
Br
SCN
1
2
3
SCN
N
Ad
OAc
AcO
H
O
AcO
H
AdOH, H2SO4
S
S
5°C
O
H
OAc
AcO
Ad
N
H
OAc
4
SCN
Ad
Ad
5
диоксипана 7 1-адамантанолом в серной кислоте.
(32.5 м.д.) бис-оксатиолана 8 от сильнопольных
Обычно подобная циклизация 2-гидрокситиоци-
сигналов соответствующих групп одного из изо-
анатов требует нескольких минут [15], но в слу-
меров N-(1-адамантил)-5-бензоил-1,3-оксатиолан-
чае образования соединения 8 промежуточный
2-имина (75.2 + 80.4 и 31.7 + 34.9 м.д.) [17].
N-1-адамантилтионитрилиевый катион подверга-
Бис-тиоцианаты 3 и 7 (общая методика). В
ется циклизации только после сольволиза диок-
стальную ампулу помещали соответствующий
сепанового кольца 7. При проведении реакции с
дибромид 2 или 6 (4.2 г или 4.7 г соответственно,
трет-бутиловым спиртом был выделен исходный
8.9 ммоль), 8.65 г (89 ммоль) сухого роданида ка-
диоксепан 7, вероятно, из-за более быстрого пре-
лия и 80 мл сухого ацетона. Ампулу нагревали при
вращения трет-бутильного катиона в алкен по
100°С в течение 10 ч в случае дибромида 2 или
сравнению с его присоединением к атому азота ти-
72 ч в случае дибромида 6. Полученную смесь пе-
оцианатной группы (схема 2).
реносили в колбу и выпаривали досуха. Остаток
разбавляли в хлористом метилене (100 мл) и рас-
В ИК спектре соединения 8 присутствуют ха-
твор промывали водой (3×50 мл), насыщенным
рактерные полосы поглощения связей С=О и С=N
раствором соли (3×50 мл), сушили над безводным
в областях 1740-1760 и 1630-1660 см-1 соответ-
сульфатом натрия, выпаривали растворитель и
ственно, а в спектре ЯМР 13С все углеродные
остаток кристаллизовали из метанола.
атомы представлены одним набором сигналов, в
отличие полученных ранее N-замещенных 1,3-ок-
1,6-Дидезокси-1,6-ди(тиоциано)-2,3,4,5-
сатиолан-2-иминов, которые дают двойной на-
тетра-O-ацетил-D-маннит
(3). Выход
3.57 г
бор сигналов в спектре ЯМР 13С вследствие Z/Е-
(92%), бесцветные кристаллы, т.пл. 129-131°C
изомерии относительно связи C=N [20]. Вероятно,
(MeOH), [α]D25 112.1° (c 1.11, CHCl3). ИК спектр
стерические затруднения со стороны 2 бензоатных
(KBr), νmax, см-1: 2193 (SCN), 1749 (C=O). Спектр
групп сильно дестабилизируют один из изомеров.
ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 2.10 c (6H,
Это подтверждается минимальным отличием сиг-
2СН3), 2.13 c (6H, 2СН3), 2.86 д.д (2H, CH2, 2JHH
налов углеродов групп CHO (75.8 м.д.) и CH2S
14.8, 3JHH 5.6 Гц), 3.28 д.д (2H, CH2, 2JHH 14.8,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ ПРОИЗВОДНЫХ 1,3-ДИТИОЛАН-2-ИМИНА ИЗ D-МАННИТА
1245
Схема 2
Br
O
O
O
O
HO
H
H
H
Ph
Ph
PhCHO/ȾɆɎȺ
CH2Br2/CH2Cl2
O
O
H
O
H
O
H
NBS
1
H
O
H
O
O
H
O
O
Ph
Ph
Ph
Ph
H
H
OH
H
O
O
Br
O
6
R
NCS
Ph
N
O
H
O
O O
KSCN, ɚɰɟɬɨɧ
O O
H
ROH, H2SO4
S
100°C, 72 ɱ
H
O
24 ɱ, rt
O
S
Ph
Ph
O
O
O
H
O
N
SCN
Ph
R
7
8
R = Ad-1.
3JHH 3.2 Гц), 5.19 д.д.д (2H, 2CH, 3JHH 8.6, 5.4,
1,2-дитиоцианогексана в 2 мл ледяной уксусной
3.6 Гц), 5.4 д (2Н, 2СН, 2JHH 8.9 Гц). Спектр ЯМР
кислоты при температуре не выше 5°С и остав-
13C (100 МГц, CDCl3), δ, м.д.: 20.58 (CH3), 20.75
ляли смесь при комнатной температуре на 12 ч.
(CH3), 35.14 (CH2), 67.61 (CН), 68.82 (CH), 112.21
Далее реакционную смесь выливали на 10 г ко-
(SCN), 169.87 (C=O), 170.47 (C=O). Вычислено, %:
лотого льда, нейтрализовали твердым карбона-
C 44.44; H 4.66; N 6.48. C16H20N2O8S2. Найдено,
том натрия и отфильтровывали осадок. Продукт
%: C 44.61; H 4.59; N 6.44. М 432.47.
перекристаллизовывали из бензола. Выход 0.6 г
(75%), бесцветные иглы, т.пл. 300-301°С (бензол).
(4S,5S,6S,7S)-4,7-Бис(тиоцианометил)-5,6-
(301-302°C [20]). ИК спектр, νmax, см-1: 2915 (CH).
дибензоилокси-1,3-диоксепан (7). Выход 4.10 г
Спектр ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 1.76 c
(95%), бесцветные кристаллы, т.пл. 112-114°C
(12H, CH2, 2Ad), 1.92 c (12H, CH2, 2Ad), 2.08 c
(MeOH), [α]D25 -95.3° (c 1.16, CHCl3). ИК спектр
(6H, CH, 2Ad), 7.31 c (4H, Ph). Спектр ЯМР 13C
(KBr), νmax, см-1: 2158 (SCN), 1726 (C=O). Спектр
(100 МГц, CDCl3), δ, м.д.: 29.08 (CH, Ad), 35.89 (C,
ЯМР 1H (400 МГц, CDCl3), δ, м.д.: 3.06-3.21 м (4H,
Ad), 36.95 (CH2, Ad), 43.31 (CН2, Ad), 124.57 (CH,
CH2S), 4.25-4.35 м (2H, CHO), 5.08 с (2H, OCH2O),
Ph), 148.44 (Cчетв, Ph).
5.42 д (2H, CHOBz, 3JHH 7.0 Гц), 7.33-7.86 м (10H,
(1S,2S)-1,2-Бис[(5S)-2-(1-адамантилимино)-
Ph). Спектр ЯМР 13C (100 МГц, CDCl3), δ, м.д.:
1,3-оксатиолан-5-ил]этан-1,2-диилдибензоат
36.22 (CH2S), 72.72 (CHOBz), 75.11 (CHO), 94.57
(8). Раствор 1 г (2.06 ммоль) (4S,5S,6S,7S)-4,7-
(OCNO), 111.88 (SCN), 128.24 (Ph), 128.69 (Ph),
бис(тиоцианометил)-5,6-дибензоилокси-1,3-ди-
129.93 (Ph), 134.01 (Ph), 165.64 (C=O). Вычислено,
оксепана в 4 мл хлористого метилена добавляли
%: C 57.01; H 4.16; N 5.78. C23H20N2O6S2. Найдено,
при перемешивании и охлаждении до -10 … -5°C
%: C 57.05; H 4.11; N 5.72. М 484.454.
к смеси 10 мл серной кислоты и 0.62 г (4.08 ммоль)
1,4-Бис(1-адамантил)бензол
(5). К охлаж-
1-адамантанола. Смесь выдерживали в течение
денной смеси 4.8 мл (86 ммоль) конц. H2SO4
24 ч при комнатной температуре и затем выливали
и 0.7 г (4.6 ммоль) адамантанола-1 при пере-
на 50 г дробленого льда. Полученный раствор ней-
мешивании по каплям добавляли раствор 1 г
трализовали твердым карбонатом натрия и экстра-
(2.3 ммоль)
(2S,3S,4S,5S)-2,3,4,5-тетраацетокси-
гировали хлороформом (3×20 мл). Объединенные
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
1246
В. А. ШИРЯЕВ, А. К. ШИРЯЕВ
экстракты промывали водой (2×20 мл), насыщен-
ция (2S,3S,4S,5S)-2,3,4,5-тетраацетокси-1,6-дитио-
ным раствором NaCl (2×30 мл), сушили над без-
цианогексана в условиях реакции Риттера, при-
водным сульфатом натрия и растворитель упари-
водящая к получению
1,4-диадамантилбензо-
вали. Выход 1.12 г (74%), светло-желтое масло,
ла. В то же время реакция
(4S,5S,6S,7S)-4,7-
[α]D25 -59.2° (c 1.91, CHCl3). ИК спектр, νmax,
бис(тиоцианометил)-5,6-дибензоилокси-1,3-ди-
см-1: 1779 (C=O), 1662 (C=N). Спектр ЯМР 1H
оксепана в тех же условиях приводит к получению
(400 МГц, CDCl3), δ, 1.59-1.64 м (12H, CH2, 2Ad),
ожидаемого производного 1,3-оксатиолан-2-ими-
1.88-1.93 м (12H, CH2, 2Ad), 2.00-2.06 м (6H,
на.
CH, 2Ad), 2.95 д.д (2H, 1H + 1H, 2CH2S, 3JHH 9.0,
БЛАГОДАРНОСТИ
2JHH 14.1 Гц), 3.27 д.д (2H, 1H + 1H, 2CH2S, 3JHH
3.0, 2JHH 14.1 Гц), 4.06-4.14 м (4H, CHO), 5.41 д
Работа выполнена с использованием научно-
(CHOBz, 3JHH 6.0 Гц), 7.25-7.90 м (5H, Ph). Спектр
го оборудования центра коллективного пользова-
ЯМР 13C (100 МГц, CDCl3), δ, м.д.: 29.5 (CH2, Ad),
ния СамГТУ «Исследование физико-химических
32.5 (CH2S), 36.3 (CH2, Ad), 41.9 (CH, Ad), 54.1 (C,
свойств веществ и материалов».
Ad), 73.2 (CHOBz), 75.8 (CHO), 128.4 (Ph), 129.3
ФОНДОВАЯ ПОДДЕРЖКА
(Ph), 130.0 (Ph), 133.2 (Ph), 163.8 (C=N), 165.8
(C=O). Вычислено, %: C 68.08; H 6.53; N 3.78.
Работа выполнена при финансовой поддерж-
C42H48N2O6S2. Найдено, %: C 68.13; H 6.49; N
ке Российского научного фонда (проект № 20-
73-00254). Исследование спектральных характе-
3.73. М 740.970.
ристик выполнено при финансовой поддержке
ИК спектры соединений записывали в режи-
Минобрнауки РФ в рамках проектной части госу-
ме подавления сигнала H2O и CO2 в интервале
дарственного задания № 0778-2020-0005.
волновых чисел 400-4000 см-1 на спектрометре
Shimadzu Irrafinity-1 (Япония) в таблетках KBr и в
ИНФОРМАЦИЯ ОБ АВТОРАХ
тонкой пленке. Спектры ЯМР 1Н и 13C записывали
на приборе JEOL JNM ECX-400 (Япония) с рабо-
orcid.org/0000-0002-6710-0722
чей частотой 400 и 100 МГц соответственно в рас-
Ширяев Андрей Константинович, ORCID:
творе CDCl3 (внутренний стандарт CDCl3), хими-
ческие сдвиги определены по шкале δ, м.д. Масс-
спектры получены на хроматомасс-спектрометре
КОНФЛИКТ ИНТЕРЕСОВ
Thermo Finnigan Trace GC (США) с электронным
Авторы заявляют об отсутствии конфликта ин-
возбуждением, ионизационный потенциал 70 эВ.
тересов.
Углы вращения измеряли с помощью поляриме-
тра Rudolph Autopol V Plus (США), элементный
СПИСОК ЛИТЕРАТУРЫ
анализ проводили на приборе EuroEA Elemental
1. Xiong T., Xie R., Huang C., Lan X., Huang N.,
Analyzer (Италия).
Yao H. J. Carbohyd. Chem. 2021, 40, 401-439. doi
Адамантан-1-ол
(Олайнфарм),
D-маннит
10.1080/07328303.2022.2027433
(Lachema) использовались без дополнительной
2. Voss J., Otzen D., Adiwidjaja G. Zeit. für Naturforsch.
очистки, растворители перегонялись перед исполь-
B. 2018, 73, 553-556. doi 10.1515/znb-2018-0037
зованием, (2S,3S,4S,5S)-2,3,4,5-тетраацетокси-1,2-
3. Bennai N., Chabrier A., Fatthalla M.I., Tran C.,
дибромгексан, 1,3:4,6-ди-O-бензилиден-D-маннит,
Yen-Pon E., Belkadi M., Alami M., Grimaud L.,
2,5-O-метилен-1,3:4,6-ди-O-бензилиден-D-маннит
Messaoudi S. J. Org. Chem. 2020, 85, 8893-8909. doi
и (4S,5S,6S,7S)-4,7-бис(бромметил)-5,6-дибензоил-
10.1021/acs.joc.0c00766
окси-1,3-диоксепан были получены по методикам
4. Chiaverini L., Pratesi A., Cirri D., Nardinocchi A.,
[15-18].
Tolbatov I., Marrone A., Di Luca M., Marzo T., La
Mendola D. Molecules. 2022, 27, 2578. doi 10.3390/
ЗАКЛЮЧЕНИЕ
molecules27082578
Осуществлен синтез
2 новых производных
5. Rodrigues L., Tilve S.G., Majik M.S. Eur. J. Med. Chem.
маннита. Обнаружена необычная ароматиза-
2021, 224, 113659. doi 10.1016/j.ejmech.2021.113659
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022
СИНТЕЗ ПРОИЗВОДНЫХ 1,3-ДИТИОЛАН-2-ИМИНА ИЗ D-МАННИТА
1247
6. Witczak Z.J., Culhane J.M. Appl. Microbiol. Biotechnol.
13. Debreczeni N., Bege M., Borbas A. Eur. J. Org. Chem.
2005, 69, 237-244. doi 10.1007/s00253-005-0156-x
2021, 48, 6743-6747. doi 10.1002/ejoc.202101220
14. Sasaki E., Liu H.-W. J. Am. Chem. Soc. 2010, 132,
7. Robina I., Vogel P. Curr. Org. Chem. 2002, 6, 471-491.
15544-15546. doi 10.1021/ja108061c
doi 10.2174/1385272024604952
15. Ширяев А.К., Моисеев И.К., Попов В.А. ЖОрХ.
8. Yuasa H., Hashimoto H. Rev. Heteroat. Chem. 1999,
1992, 28, 418-421.
19, 35-65.
16. Shirayev A.K., Kong Thoo lin P., Moiseev I.K.
9. Witczak Z.J., Curr. Med. Chem. 1999, 6, 165-178.
Synthesis. 1997, 38-40. doi 10.1055/s-1997-1510
17. Shirayev A.K., Moiseev I.K., Karpeev S.S. Arkivoc.
10. Cagnoni A.J., Uhrig M.L., Varela O. Bioorg. Med. Chem.
2005, iv, 199-207.
2009, 17, 6203-6212. doi 10.1016/j.bmc.2009.07.055
18. Csanyi E., Horvath J.P., Institoris L. Arzneimittel-
11. Jayakanthan K., Mohan S., Pinto B.M. J. Am. Chem.
Forschung. 1967, 17, 145-149.
Soc. 2009, 131, 5621-5626. doi 10.1021/ja900867q
19. Nazhaoui M., Gross B., Joly J.-P. Tetrahedron Lett. 1993,
12. Fanton J., Camps F., Castillo J.A., Guérard-Hélaine C.,
34, 1287-1290. doi 10.1016/S0040-4039(00)91776-3
Lemaire M., Charmantray F., Hecquet L. Eur. J. Org.
20. Моисеев И.К., Ширяев А.К., Климочкин Ю.Н.,
Chem. 2012, 203-210. doi 10.1002/ejoc.201101137
Матвеев А.И. ЖОрХ. 1988, 24, 1269-1271.
Synthesis of 1,3-Dithiolane-2-imine Derivatives from D-Mannitol
V. A. Shiryaev* and A. K. Shiryaev
Samara State Ttechnical University, ul. Kuybisheva, 153, Samara, 443100 Russia
*e-mail: shiryaev.va@samgtu.ru
Received February 7, 2022; revised February 18, 2022; accepted February 20, 2022
Several derivatives of D-mannitol were used in Ritter reaction with 1-adamantanol. In case of (2S,3S,4S,5S)-
2,3,4,5-tetraacetoxy-1,6-dithiocyanohexane only one product was isolated - 1,4-diadamantylbenzene. The
reaction of (4S,5S,6S,7S)-4,7-bis(thiocyanomethyl)-5,6-dibenzoyloxy-1,3-dioxepane with 1-adamantanol in
sulfuric acid gives (1S,2S)-1,2-bis-[(5S)-2-(1-adamantylimino)-1,3-oxathiolan-5-yl]-ethane-1,2-diyl dibenzoate.
Keywords: oxathiolane, mannitol, diadamantylbenzene
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 11 2022