ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 12, с. 1302-1344
ОБЗОРНАЯ СТАТЬЯ
УДК 547.022.1
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ
ТИОЦИАНИРОВАНИЯ
© 2022 г. O. M. Мулина, O. В. Битюков, В. А. Виль, A. O. Терентьев*
ФГБУН Институт органической химии им. Н.Д. Зелинского РАН,
Россия, 119991 Москва, Ленинский просп., 47
*e-mail: terentev@ioc.ac.ru
Поступила в редакцию 05.03.2022 г.
После доработки 10.03.2022 г.
Принята к публикации 12.03.2022 г.
Обзор освещает современный уровень развития фото- и электрохимических методов введения SCN
группы в различные органические соединения. Наибольшее внимание уделено анализу литературы
с 2010-х годов по настоящее время. Указанный период характеризуется бурным развитием фото- и
электрохимических подходов к тиоцианированию. Химия органических тиоцианатов привлекает все
большее внимание, так как эти соединения используются в агрохимии для создания инсектицидных,
фунгицидных и бактерицидных средств.
Ключевые слова: окисление, электросинтез, фоторедокс катализ, тиоцианирование, связь углерод-сера
Doi 10.31857/S0514749222120023, EDN: MWUWGW
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ТИОЦИАНИРОВАНИЕ КРАТНЫХ С-С СВЯЗЕЙ
2. ТИОЦИАНИРОВАНИЕ КАРБОЦИКЛОВ
3. ТИОЦИАНИРОВАНИЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
4. ПРОЧИЕ РЕАКЦИИ
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
электрофильных реагентов [12-15], либо системы
SCN-/окислитель [3]. В последнем случае в каче-
Органические тиоцианаты привлекают огром-
стве окислителей применяются различные хими-
ное внимание химиков по причине возможности
ческие соединения [16-23], которые, как правило,
их использования в качестве прекурсоров в химии
производят стехиометрические количества отхо-
серасодержащих соединений [1-3], а также благо-
дов. Поэтому методы тиоцианирования, в которых
даря их бактерицидным [4, 5], фунгицидным [6-9],
используется видимый свет и электричество, нахо-
и инсектицидным [10,11] свойствам. Введение тио-
дят все большую популярность. Настоящий обзор
цианатной группы может быть проведено с ис-
посвящен фото- и электрохимическим подходам к
пользованием либо предварительно полученных
тиоцианированию.
1302
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1303
В последние годы были разработаны фотока-
1. ТИОЦИАНИРОВАНИЕ
талитические методы тиоцианирования, которые
КРАТНЫХ С-С СВЯЗЕЙ
используют воздух в качестве «зеленого» окис-
Исследования процессов тиоцианирования
лителя [24, 25] и фотокатализатор, работающий в
под действием видимого света начались в 20 веке.
видимом свете. Низкая стоимость электрического
Фотолиз триарилвинил бромида 1 с тиоцианатом
тока, наряду с разнообразием механизмов элек-
калия при использовании ртутной лампы высоко-
трохимических реакций, делают органический
го давления в качестве источника света привел к
электросинтез мощным и экологичным методом
образованию винилтиоцианата 2 (схема 1) [29]. В
проведения окислительно-восстановительных ре-
некоторых случаях изотиоцианаты 3 были получе-
акций [26-28]. Ключевой стадией фото- или элек-
ны как побочные продукты.
трохимического тиоцианирования является обра-
зование радикала SCN путем одноэлектронного
Один из первых примеров электрохимиче-
окисления аниона SCN с последующим присоеди-
ского тиоцианирования алифатических двойных
нением к субстрату. Неочевидность обсуждаемых
связей был опубликован в 2015 г. [30]. Процесс
процессов связана с тем, что синтезированные
проводился в двухфазной системе растворителей
органические тиоцианаты являются электро- и фо-
(DCM-H2O) с добавлением H2SO4 как в услови-
тохимически лабильными соединениями, поэтому
ях постоянного тока, так и в условиях постоянно-
их селективный синтез в данных условиях пред-
го потенциала. В результате электролиза алкена 4
ставляет собой сложную задачу.
были получены различные продукты: тиоцианиро-
вания-изотиоцианирования 5, дитиоцианирования
В настоящем обзоре методы тиоцианирования
6, а также тиоцианирования-гидроксилирования и
классифицированы в зависимости от структуры
продукты отрыва протона (схема 2).
исходных веществ: от тиоцианирования ненасы-
щенных связей до карбо- и гетероциклов, и бо-
Винилтиоцианаты являются ценными интер-
лее сложных исходных соединений. Поскольку в
медиатами органического синтеза. Их двойная
фото- и электрохимических процессах часто уча-
связь может вступать в ряд процессов присоеди-
ствуют одни и те же субстраты, классификация по
нения, что приводит к образованию различных
методу воздействия не применялась. Настоящий
полифункциональных соединений. Предложены
обзор, в основном, суммирует исследования по
как электро-, так и фотохимические подходы к
фото- и электрохимическому тиоцианированию,
синтезу винилтиоцианатов. В 2020 г. был разра-
опубликованные после 2010 г.
ботан фоторедокс-катализируемый синтез винил-
Схема 1. Фотолиз триарилвинил бромида 1 в присутствии тиоцианата калия
R2
R2
R2
R1
R1
R1
KSCN
Hg lamp (100 W)
+
Bu4NBr, N2, 10°C
DCM/H2O
Br
SCN
NCS
R2
R2
R2
1
2
3
77% R1 = OMe, R2 = OMe
0%
62% R1 = OMe, R2 = Ph
0%
39% R1 = Me, R2 = Ph
0%
48% R1 = H, R2 = Ph
0%
42% R1 = OMe, R2 = Me
27%
18% R1 = H, R2 = Me
29%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1304
МУЛИНА и др.
Схема 2. Электрохимическое тиоцианирование алкена 4
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
CCE, C(+)/Pt( )
SCN
NCS
+ NH4SCN
+
H2SO4 (0.5 N)
SCN
SCN
DCM H2O, 0°C, 4 F/mol
4
5, 46%
6, 8%
Схема 3. Фоторедокс-катализируемый синтез винилтиоцианатов 8 из β-нитростиролов 7 и NH4SCN
Eosin Y (3 ɦɨɥ %)
NO2
SCN
3 W green LED
+ NH4SCN
R
R
CH3CN, ɜɨɡɞ.,
rt, 6
10 ɱ
7
8
SCN
R = H, 85%
R = F, 71%
R = Br, 80%
R = OMe, 88% R = Cl, 74% R = NO2, 33%
R
SCN
R = Me, 91% R = Cl, 78%
R = CF3, 50%
R = OMe, 94%
R = Br, 81%
R = CN, 72%
R = F, 79%
R
SCN
R
SCN
SCN
Cl
N
Cl
R = Me, 87%
54%
31%
R = OMe, 89%
тиоцианатов 8 из β-нитростиролов 7 и тиоцианата
присоединяющегося к двойной связи β-нитро-
аммония (схема 3) [31]. Эозин Y использовали как
стирола
7 с образованием соответствующего
фотокатализатор, реакцию проводили в CH3CN на
С-центрированного радикала 7'. Анион-радикал
воздухе.
эозина окисляется кислородом воздуха с образова-
В данном процессе реализовано «восстано-
нием исходной формы. На последнем этапе из 7'
вительное гашение». Эозина Y в возбужденной
элиминируется NO•, в результате чего образуется
форме окисляет SCN анион до SCN радикала,
конечный продукт 8 (схема 4).
Схема 4. Предположительный путь образования винилтиоцианатов 8
O2
eosin Y
green LED
COOH
O2
Br
Br
NO2
R
eosin Y
eosin Y*
7
HO
O
O
Br
Br
eosin Y
SCN
SCN
NO2
R
SCN
R
SCN
NO2
7'
8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1305
Схема 5. Синтез винилтиоцианатов 10 электрохимическим тиоцианированием коричных кислот 9
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
COOH
SCN
CCE (5 ɦA), Pt(+)/Pt(-)
+ NH4SCN
R
R
NaHCO3 (1 ɷɤɜ)
NaClO4 (0.1 M)
9
CH3CN/H2O, rt, 9 ɱ
10
SCN
SCN
R = Me, 80%
R = Cl, 65%
R = OMe, 71%
R = Br, 61%
SCN
R = F, 59%
R = NO2, 29%
Cl
R
Cl
54%
33%
R = Me, 75%
R = OCF3, 58%
SCN
R = OMe, 52%
R = CF3, 54%
R
SCN
SCN
R = F, 70%
R = CN, 65%
R = Cl, 65%
R = CHO, 12%
R
N
R = Br, 57%
R = H, 77%
24%
R = Me, 63%
R = OMe, 45%
R = CF3, 51%
Электрохимический синтез винилтиоцианатов
Авторы предположили, что тиоцианирование
10 и 12 был осуществлен из коричных кислот 9
коричных кислот 9 происходило по радикально-
[32] и кетендитиоацеталей 11 [33]. Для тиоциани-
му механизму. Первой стадией является анодное
рования коричных кислот 9 использовали нераз-
окисление тиоцианат-аниона. SCN радикал присо-
делённую электрохимическую ячейку, снабжен-
единяется к циннамат-аниону 9', образующемуся
ную платиновой фольгой в качестве электродов
в результате депротонирования исходной корич-
(схема 5) [32]. Выходы винилтиоцианатов 10 со-
ной кислоты 9 гидроксид-анионом, сгенерирован-
ставили 24-80%, преимущественно образовыва-
ным на катоде. В результате образуется радикал
лась Е-форма.
9'', который подвергается анодному окислению и
Схема 6. Возможный путь электрохимического тиоцианирования коричных кислот 9
Ⱥ
ɧɨɞ
Ʉɚɬɨɞ
COOH
R
OH
SCN
9
+e
-e
H2O
SCN
COO
R
9'
COO
R
SCN
-e
9''
SCN
R
10
CO2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1306
МУЛИНА и др.
Схема 7. Совместный электролиз кетендитиоацеталей 11 и KSCN
n
S
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
n
S
CCE (5 ɦA), Pt(+)/C(-)
H
SCN
+ KSCN
S
S
LiClO4 (4 ɷɤɜ), H2O (2 ɷɤɜ)
R
CH3CN, rt, 3 ɱ
R
11
12
S
n
S
R = 4-Me, 98%
R = 4-Cl, 97%
R = 4-F, 96%
SCN
R = 3-Me, 83%
R = 3-Cl, 84%
R = 2-F, 84%
SCN
n = 1, 96%
S
S
R = 2-Me, 85%
R = 4-Br, 94%
R = 4-CF3, 88%
n = 2, 82%
R = 4-OMe, 96% R = 2-Cl, 83% R = 4-Ph, 88%
O
O
R
S
S
S
S
SCN
SCN
SCN
S
SCN
X = O, 95%
S
S
S
X = S, 94%
O
X
O
O
O
O
O
85%
87%
93%
отщеплению СО2 с образованием винилтиоциана-
ную, так и ионную природу. В первом случае путь
та 10 (схема 6).
аналогичен описанному выше (схема 6): он вклю-
чает анодное окисление SCN-, присоединение
Тиоцианирование кетендитиоацеталей 11 про-
водили в среде CH3CN-H2O в неразделенной ячей-
SCN• к двойной связи 11 и окисление образовав-
ке с использованием платинового анода и уголь-
шегося радикала в конечный продукт 12. Другой
ного катода, а также LiClO4 в качестве фонового
возможный путь начинается с анодного окисле-
электролита (схема 7) [33]. Разработанная методи-
ния исходного кетендитиоацеталя 11 в катион-ра-
ка продемонстрировала высокую толерантность к
дикал 11' с последующей нуклеофильной атакой
функциональным группам.
SCN аниона с образованием интермедиата 11''.
Авторами выдвинуто предположение, что клю-
Наконец, окисление 11'' дает винилтиоцианат 12
чевая стадия реакции может иметь как радикаль-
(схема 8).
Схема 8. Возможный механизм электросинтеза винил тиоцианатов 12
Ⱥ
ɧɨɞ
Ʉɚɬɨɞ
n
S
H
OH
+ H2
S
R
–e
+e
11
n
S
H2O
H
S
R
n
S
n
S
11'
H
SCN
SCN
S
S
HSCN
SCN
SCN
-e
R
R
11''
12
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1307
Схема 9. Тиоцианирование енаминонов 13
O
O
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
CCE (10 ɦA), C(+)/Pt( )
N
+ KSCN
N
(a)
CH
3
CN, rt, 2 ɱ
R
R
SCN
13a
14a
O
R = H, 97%
R = 4-Ph, 95%
R = 4-OCF3, 93%
R = 3,4-OMe, 89%
R = 4-Me, 95%
R = 4-Cl, 90%
R = 2-F, 83%
R = 4-COOMe, 90%
N
R = 2-Me, 90%
R = 4-Br, 85%
R = 3-Cl, 96%
R = 4-NO2, 88%
R
SCN
R = 4-OMe, 92%
R = 4-CF3, 86%
R = 3,4-Cl, 89%
R = 3-NO2, 85%
O
O
O
O
N
N
N
N
S
SCN
SCN
SCN
SCN
96%
95%
97%
89%
O
O
Rose Bengal (1 ɦɨɥ %)
2
14 W CFL
R
R2
N
+ NH4SCN
N
(b)
THF, ɜɨɡɞɭɯ,
R
R
rt, 12 ɱ
R1
SCN
R1
13b
14b
O
R = H, 87%
R = 4-Br, 79%
O
R1 = Me,
R = 4-Me, 95%
R = 4-CN, 80%
2
R2 = Et, 79%;
R
N
R = 2-Me, 81%
R = 3,4-Cl, 81%
N
R1 = n-Pr,
R
R = 3-OMe, 82%
R = 3-NO2, 76%
R2 = Bn, 74%
SCN
SCN
R1
O
O
O
N
N
N
R = H, 68%
R = Cl, 70%
S
SCN
SCN
SCN
O
R
83%
84%
O
O
O
R = Me, 75%
O
N
N
N
R = Cl, 71%
SCN
SCN
SCN
O
R
86%
68%
Сообщалось о ряде подходов к тиоцианирова-
докс катализа в видимом свете были необходимы
нию арилзамещенных енаминонов 13. В электро-
NH4SCN в качестве источника тиоцианогруппы,
химическом варианте использовалась неразделен-
облучение CFL лампой, бенгальский розовый в
ная ячейка, снабженная угольным стержневым
качестве фотокатализатора и ТГФ в качестве рас-
анодом и катодом из платиновой пластины, KSCN
творителя (схема 9, b) [35]. Оба метода приводили
служил как источником SCN-группы, так и элек-
к целевым соединениям 14 с высокими выходами.
тролитом, CH3CN использовался в качестве рас-
творителя (схема 9, а) [34]. Для проведения тио-
При наличии ОН-группы в орто-положении
цианирования енаминонов 13b в условиях фоторе-
исходных арилзамещенных енаминонов 13 SCN-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1308
МУЛИНА и др.
Схема 10. Образование хромонов 15 и тризамещенных алкенов 16 из енаминонов 13 и NH4SCN
(a) CCE (10 ɦA), C(+)/Pt( )
O
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
O
MeCN, rt, 2 ɱ
SCN
N
+ NH4SCN
(a)
R
(b) Rose Bengal (1 ɦɨɥ %)
R
14 W CFL
OH
O
THF, ɜɨɡɞɭɯ, rt, 12 ɱ
13
15
O
R = Me, (a) 97%; (b) 92%
O
R = i-Pr (a) 94%
R
SCN
SCN
R = H, (a) 95%; (b) 89%
R = t-Bu (a) 98%
R = Cl, (a) 88%; (b) 84%
R = OMe (a) 92%
R = OMe, (b) 94%
O
R = F, (a) 89%; (b) 80%
R
O
R = Cl, (a) 92%; (b) 86%
R = Br, (a) 85%; (b) 82%
O
O
Ru(bpy)3Cl2Â6H22 ɦɨɥ
14 W CFL
SCN
N
+ NH4SCN
(b)
ɷɬɢɥɥɚɤɬɚɬ, ɜɨɡɞɭɯ,
R
R
rt, 12 ɱ
NH
2
13b
16
O
O
O
R = H, 76%
SCN
Cl
SCN
SCN
R = Me, 69%
R = Cl, 44%
R
NH2
R = Br, 41%
Cl
NH2
NH2
42%
63%
функционализированные хромоны 15 могли быть
С-центрированного радикала 13' на катоде, окис-
получены обоими путями (схема 10, a) [34, 35].
ленной формой фотокатализатора или кислородом
Замена растворителя при фотохимическом тио-
воздуха приводит к соответствующему катиону
цианировании енаминонов 13b на этиллактат и
13''. Депротонирование катиона 13'' приводит к
использование фотокатализатора на основе Ru
винилтиоцианатам 14, 16. В случае наличия 2-ОН
позволили синтезировать тризамещенные алке-
группы в исходном енаминоне 13 происходит ну-
ны 16, содержащие карбонильные, тиоциано- и
клеофильная атака ОН-группы на катион с образо-
аминогруппы (схема 10, b) [35]. Разработан также
ванием хромона 15.
электрохимический синтез этих соединений из
Разработаны различные фотокаталитические
енаминонов и NH4SCN. Наиболее эффективно он
методы оксотиоцианирования ненасыщенных свя-
протекал в неразделенной ячейке с использовани-
зей. Соединения 18, содержащие вицинальные ти-
ем угольного анода, платинового катода и смеси
оциано- и гидроксигруппы, были синтезированы
CH3CN/H2O/HFIP в качестве растворителя [36].
аэробным тиоцианированием ненасыщенных сое-
Механизмы описанных превращений весьма
динений 17 (схема 12) [37]. Реакция проходила при
схожи (схема 11) [34, 35]. Ключевыми этапами
облучении люминесцентной лампой или солнеч-
являются образование SCN радикала либо пу-
ным светом с использованием бенгальского розо-
тем анодного окисления SCN аниона, либо путем
вого в качестве фотокатализатора. Разработанный
восстановительного гашения фотокатализатора.
метод совместим с широким спектром стиролов,
Присоединение SCN• по двойной связи енаминона
2-(проп-1-ен-2-ил)тиофеном и
2,3-диметилбута-
13 с последующим окислением образовавшегося
1,3-диеном.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1309
Схема 11. Возможные пути тиоцианирования енаминонов 13
O
O
SCN
1
R
R
N
H+
R1
R
O2
SCN
R2
N
PC
13''
R2
ɨɛɥɭɱɟɧɢɟ
14, 16
R = 2-OH
O
O2
O
1
R
PC*
Ph2CH3
N
SCN
R
SCN
R2
R
SCN
13'
SCN
O
15
ɚɧɨɞɧɨɟ
-ɟ
ɨɤɢɫɥɟɧɢɟ
O
R1
N
R
R2
13
Этот процесс протекает аналогично тиоциани-
стадии 17'' восстанавливается тиоцианат-анионом
рованию β-нитростиролов 7 путем восстанови-
в конечное гидрокси-замещенное производное 18
тельного гашения (схема 4). Но в данном случае
(схема 13).
образовавшийся С-центрированный радикал 17'
Были предложены различные подходы к кето-
перехватывается кислородом воздуха, в результате
тиоцианатам, исходя из разных классов соедине-
чего образуется гидропероксид 17''. На последней
ний. Арилзамещенные кетотиоцианаты 20 получе-
Схема 12. Фотокаталитическое тиоцианирование-гидроксилирование алкенов 17
Rose Bengal (3 ɦɨɥ %)
OH
R2
PhCOOH
R2
SCN
+ NH4SCN
R3
R1
32 W CFL, CH3CN
R1
ɜɨɡɞɭɯ, rt, 6
12 ɱ
R3
17
18
OH
R = 4-Me, 50%
R = 4-F, 50%
R = 4-I, 45%
R = 4-OMe, 52%
R = 4-Ph, 54%
R = 4-NO2, 54%
SCN
R = 4-Cl, 76%
R = 4-Br, 56%
R = 2-OMe, 54%
R
R = 3-Cl, 63%
OH
R1 OH
R1 = H, 47%
OH
OH
SCN
SCN
R1 = Me, 61%
SCN
SCN
R1 = Et, 63%
R1 = Ph, 38%
S
55%
49%
47%
NCS
OH
OH
OH
SCN
SCN
SCN
OH
Cl
45%
42%
50%
45%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1310
МУЛИНА и др.
Схема 13. Предположительный механизм образования вицинальных тиоцианоспиртов 18
O2
RB
32 W CFL
2
R
O2
R3
R1
RB*
RB
17
SCN
SCN
R2
O
O
O2
SCN
R2
R1
SCN
Rose bengal (RB)
R1
3
R
I
I
R3
17'
HO
O
OH
SCN
O2
H
OH
I
O
I
H
O
Cl
R2
SCN
O
R1
SCN
Cl
R3
Cl
17''
Cl
SCN
SCN
OH
R2
SCN
R1
R3
18
ны фотокаталитически из стиролов 19 и роданида
Фотоэлектроны активируют O2 до супероксидного
аммония в гомогенных (схема 14, а) [38] и гетеро-
анион-радикала (O•-) или синглетного кислорода
генных (схема 14, b) [39] условиях. В обоих слу-
(1O2). Фотосгенерированная дырка mpg-C3N4 да-
чаях реакция протекала в CH3CN при освещении
лее подвергается однократному переносу электро-
синим светодиодом, в качестве фотокатализато-
на (SET) с тиоцианатом аммония с образованием
ров использовали эозин Y или mpg-C3N4 соответ-
SCN радикала. После этого реализуются те же эта-
ственно. К сожалению, разработанные подходы не
пы, что описаны выше.
применимы для тиоцианирования стильбенов и
Широкий ряд арилзамещенных акриловых
алифатических алкенов.
кислот 21 был успешно тиоцианирован под дей-
Ключевые стадии катализируемого эозином Y
ствием света люминисцентной лампы с образова-
тиоцианирования стиролов 19 аналогичны опи-
нием β-кетотиоцианатов 22 с выходами 20-89%
санным ранее [37], но на последней стадии про-
(схема 15) [40]. В качестве фотокатализатора при-
межуточный гидропероксид отщепляет воду, и
меняли
9,10-дицианоантрацен (DCA), никаких
образуется кетон 20. В гетерогенной версии по-
других добавок не требовалось.
глощение света полупроводниковым фотоката-
лизатором mpg-C3N4 приводит к разделению за-
Реакция, предположительно, проходила через
рядов с образованием электронно-дырочных пар.
восстановительное гашение с образованием SCN
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1311
Схема 14. Фотокаталитический синтез кетотиоцианатов 20
Na2-Eosin Y (2 ɦɨɥ %)
O
3 W blue LED
R2
SCN
+ NH4SCN
(a)
R1
R1
CH3CN, O2, rt, 5 ɱ
R2
19a
20a
R = H, 79%
R = 4-t-Bu, 69%
R = 4-Cl, 68%
O
R = 4-Me, 70%
R = 4-OMe, 51%
R = 3-Cl, 72%
SCN
R = 3-Me, 78%
R = 4-F, 79%
R = 4-Br, 64%
R
R = 2-Me, 74%
R = 3-F, 71%
R = 2-Br, 62%
R = 4-OAc, 49%
O
O
O
SCN
SCN
SCN
Cl
82%
51%
72%
mpg-C3N4
(5 ɦɝ)
O
R1
blue LED
SCN
+ NH
(b)
R
4SCN
CH3CN, ɜɨɡɞɭɯ,
R
rt, 10 ɱ
R1
19b
20b
R = H, 86%
R = 4-OMe, 75%
O
R = 4-Me, 85%
R = 4-F, 81%
SCN
R = 3-Me, 77%
R = 4-Cl, 77%
R
R = 2-Me, 69%
R = 3-Cl, 72%
R = 4-t-Bu, 80% R = 4-Br, 79%
O
O
SCN
SCN
74%
68
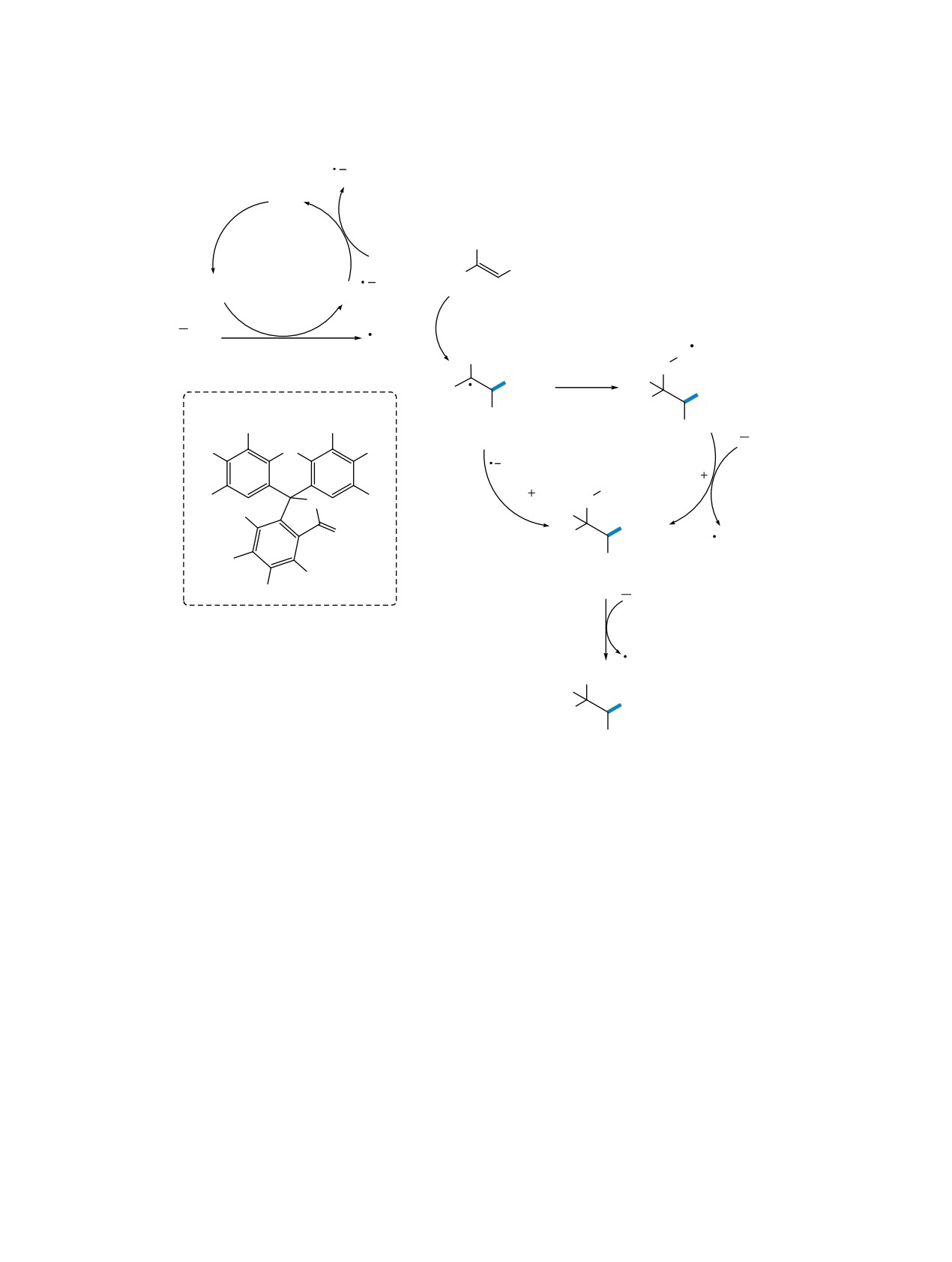
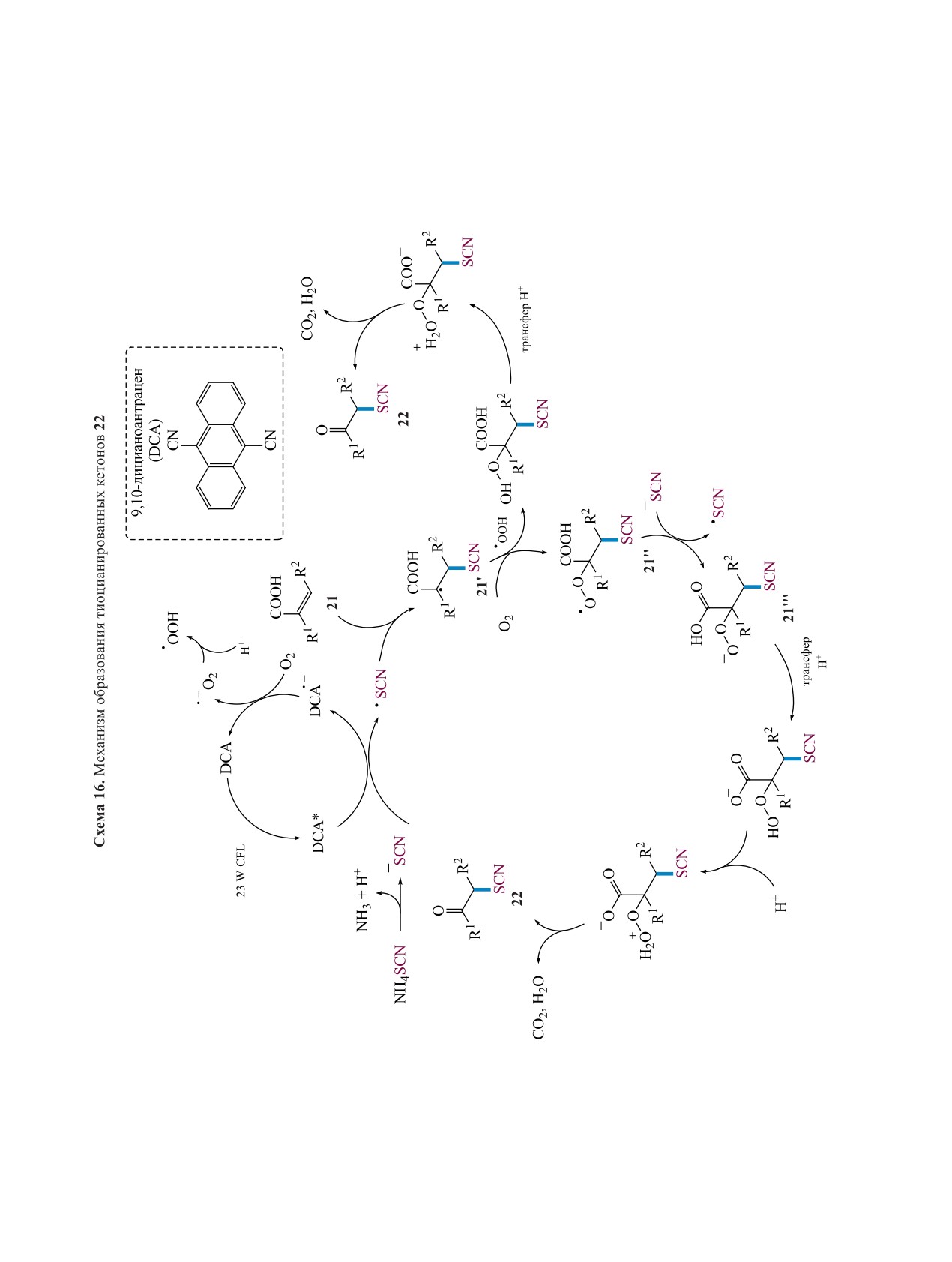
радикала и анион-радикала DCA. DCA•- окисля-
трольные эксперименты. Анион 21''' подвергается
ется O2 обратно в DCA, и в то же время образу-
последовательному переносу протона, протони-
ется супероксидный анион-радикал (O•-), что за-
рованию, декарбоксилированию и отщеплению
вершает фотокаталитический цикл. В результате
воды, в результате чего образуется 22. Второй
присоединения SCN радикала к акриловой кисло-
возможный путь включает перехват радикала 21'
те 21 образуется С-центрированный радикал 21'.
•OOH с последующим переносом протона, декар-
Этот промежуточный продукт превращается в
боксилированием и отщеплением воды (схема 16).
конечный продукт 22 двумя различными путями.
Различные β-кетотиоцианаты 24 были синте-
Первый включает перехват интермедиата 21' кис-
лородом воздуха с образованием пероксирадикала
зированы из алкинов 23 и роданида аммония под
21'', который восстанавливается анионом SCN в
действием белого света (схема 17, a). Реакцию
соответствующий анион 21'''. Анион SCN, обра-
проводили в MeCN на воздухе с использованием
зующийся на этой стадии, может вносить вклад в
[Acr-Mes]+ClO4- в качестве фотокатализатора.
цепной радикальный процесс, что показали кон-
Арил- и гетарилзамещенные ацетилены 23 успеш-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1312
МУЛИНА и др.
Схема 15. Катализируемая видимым светом реакция между акриловыми кислотами 21 и NH4SCN
O
COOH
9,10-ɞɢɰɢɚɧɨɚɧɬɪɚɰɟɧ (1 ɦɨɥ %)
R2
+ NH4SCN
R2
R1
23 W CFL, O2, CH3CN,
R1
rt, 10 ɱ
SCN
21
22
O
O
O
R1 = Me, 86%
R1 = F, 60%
SCN
R1 = OMe, 42%
R1 = CF3, 24%
SCN
R1 = SMe, 40%
R1 = Br, 74%
R1 = H, 79%
R1 = n-Bu, 84%
1
SCN
R
R1
R1 = Cl, 64%
R1 = t-Bu, 89%
R1
R1 = Me, 84%
20%
R1 = Cl, 43%
O
O
O
SCN
O
SCN
S
SCN
MeO
R2
SCN
83%
44%
26%
R2 = Me, 39%
R2 = Et, 30%
но вступали в это превращение, давая конечные
радикал 29' присоединяется к олефину 28 с об-
продукты с выходами 32-82%. К сожалению, ал-
разованием С-центрированного радикала 28', ко-
кил и дизамещенные алкины не вступали в обна-
торый затем окисляется Ru(III) в соответствую-
руженную реакцию. В случае использования ди-
щий катион 28'' и замыкает каталитический цикл.
енов 25 в качестве исходных реагентов наряду с
Нуклеофильная атака SCN-аниона на интерме-
кетонами 27 были получены соответствующие ти-
диат 28'' дает желаемый продукт 30. Кроме того,
оцианированные спирты 26 (схема 17, b) [41].
возможен и цепной свободнорадикальный путь.
В этом случае тиоцианат аммония реагирует с
Описан ряд фотохимических процессов ди-
арилдиазониевой солью 29 с образованием аддук-
функционализации алкенов с введением SCN-
та 29''. На следующем этапе взаимодействие 29''
группы. Взаимодействие широкого круга арома-
с исходным алкеном 28 приводит к образованию
тических, гетероароматических и алифатических
С-центрированного радикала 28' с отщеплением
алкенов 28 с тиоцианатом аммония в качестве
SCN-радикала и молекулярного азота. Наконец,
источника тиоцианата и солями диазония 29 в ка-
28' реагирует с арилдиазотиоцианатом 29'' с обра-
честве арилирующего агента приводило к арилза-
зованием целевого продукта и арилдиазенильного
мещенным тиоцианатам 30 с выходами от умерен-
радикала 29''', который продолжает радикальную
ных до высоких в условиях фоторедокс катализа
цепь.
под действием видимого света (схема 18) [42].
Сообщалось также о совместном тиоциа-
В отличие от всех предыдущих фотокатали-
нировании/трифторметилировании алкенов
31
тических превращений в данном случае наблю-
(схема 20). Тиоцианат аммония и реагент Умемото
дается окислительное гашение фотокатализатора
II служили источниками SCN- и CF3-групп соот-
(схема 19). Процесс начинается с восстановления
ветственно. Следует особо отметить, что фото-
соли арилдиазония 29 фотовозбужденным катали-
катализатор не требовался. Реакция проходила в
затором на основе Ru(II). В результате образуются
CH3CN в атмосфере азота при облучении синим
арильный радикал 29' и Ru(III). Образовавшийся
светодиодом. Широкий спектр алкенов 31, вклю-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1313
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1314
МУЛИНА и др.
Схема 17. Фотокаталитическое тиоцианирование алкинов 23 с использованием NH4SCN
[Acr-Mes]+ClO4- ɦɨɥ
O
white LED
SCN
+ NH4SCN
ɚ
R
CH3CN, ɜɨɡɞɭɯ, rt, 12 24 ɱ
R
23
24
O
R = 4- t-Bu, 73%
R = 4-Ph, 68%
R = 4-F, 57%
O
SCN
R = 4-Me, 72%
R = 4-OPh, 69%
R = CN, 32%
SCN
R = 4-OMe, 78%
R = 3-F, 52%
R = 3,4,5-OMe, 82%
R
R = 3-Me, 70% R = 4-Cl, 63%
68%
O
O
O
SCN
SCN
SCN
R = allyl, 65%
R = propargyl, 68%
MeO
OR
71%
64%
[Acr Mes]+ClO4
OH
O
(4 ɦɨɥ %)
SCN
SCN
+ NH4SCN
+
white LED
R
R
CH3CN, ɜɨɡɞɭɯ,
rt, 6
8 ɱ
25
26
27
30%
R = H
52%
72%
R = 4-OMe
20%
68%
R = 3-OPh
16%
75%
R = 2-Br
15%
85%
R = 4-CN
trace
88%
R = 4-NO2
trace
чая субстраты, полученные из природных соеди-
процессе образуется комплекс с переносом заряда
нений, реагировали в этих условиях с образова-
между 34 и K3PO4. Его разложение под действием
нием дифункционализированных продуктов 32 с
видимого света приводит к PO42-, I- и Rf радика-
выходами 42-93% [43].
лу. Последний является ключевым промежуточ-
ным звеном этого превращения. Присоединение
Ключевыми стадиями этого процесса яв-
радикала Rf по двойной связи 33 приводит к
ляются фотодеградация реагента Умемото II
С-центрированному радикалу 33', который затем
и присоединение образовавшегося CF3 ради-
окисляется PO42- в соответствующий катион 33''.
кала по двойной связи. Радикальная или ион-
Наконец, 33'' реагирует с SCN-, полученным из
ная реакция С-центрированного радикала 31' с
TMSNCS, с образованием целевой молекулы 35.
SCN-источником дает конечное соединение
32
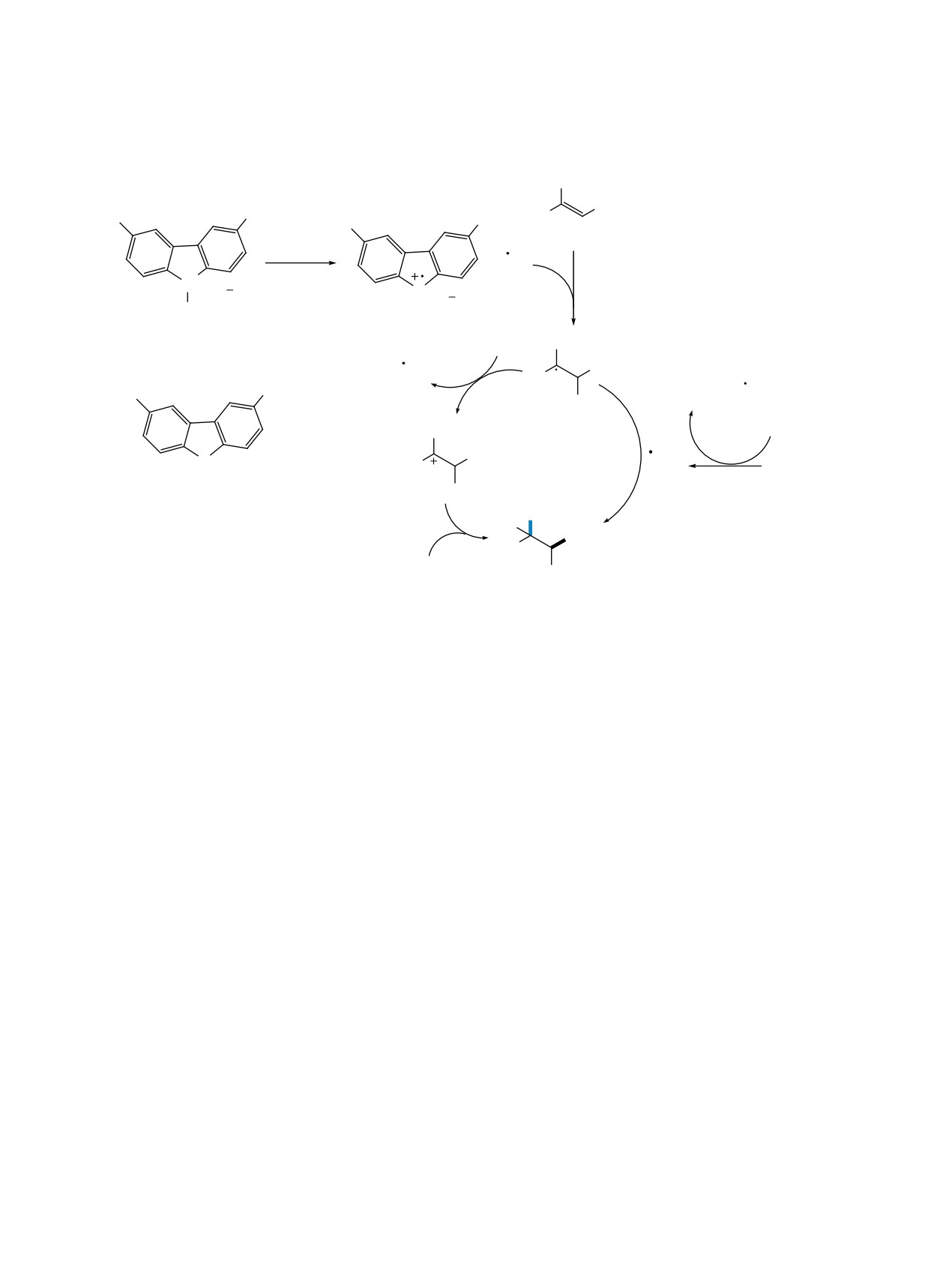
Реакции присоединения SCN-группы к кратным
(схема 21).
связям были использованы в каскадных реакциях,
Осуществлена фотокаталитическая дифункцио-
приводящих к образованию различных гетеро-
нализация алкенов 33 TMSNCS и перфторалкили-
циклических соединений. Так, тиазолины 37 были
одидами 34 (схема 22). Реакция проходила при об-
синтезированы электролизом N-аллилтиоамидов
лучении фиолетовым светодиодом с добавлением
36a в присутствии NH4SCN. При использовании
CuCl и K3PO4 в CH3CN [44]. Предположительно, в
в качестве исходных реагентов тиоамидов 36b,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1315
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1316
МУЛИНА и др.
Схема 19. Возможный путь синтеза тиоцианатов 30
R
R
SCN
R1
1
R
NCS
R3
R2
R3
R2
28''
30
Ru(II)
R
blue LED
R1
R3
N
N
R2
R
Ru(II)*
Ru(III)
28'
29'''
R
R1
29''
N2
N2BF4
R3
R
29'
R2
28
29
R
N
SCN
NH4SCN
N
R
SCN
R1
R3
N2
29''
R2
28'
содержащих 1,2-дигидронафталин или аналогич-
с использованием в
качестве фотокатализатора
ный заместитель, были получены тиазины 38.
[Acr-Mes]+ClO4-. Показана хорошая толерантность
Использовались угольные электроды, растворите-
метода к различным функциональным группам в
лем служил MeCN. Выходы целевых гетероциклов
исходных соединениях 39 (схема 25).
37 и 38 составили 32-85% (схема 23) [45].
Что касается механизма, то в данном слу-
Радикальные ловушки, такие как TEMPO и
чае имеет место восстановительное гашение.
BHT, не ингибировали реакцию, поэтому автора-
Ключевыми стадиями этого процесса являют-
ми был предложен ионный путь протекания про-
ся образование SCN радикала, его присоеди-
цесса. Предположительно на аноде образуется
нение по двойной связи исходного N-алкил-N-
диродан, после чего он присоединяется к нена-
метакрилоилбензамида 39, циклизация образовав-
сыщенному тиоамиду 36 с образованием сульфо-
шегося С-центрированного радикала 39' на арома-
ниевого интермедиата А. После этого происходит
тическом кольце и окисление (схема 26).
нуклеофильное раскрытие цикла с последующим
В аналогичных условиях было выполнено тио-
депротонированием, в результате чего образуется
цианирование N-арилпропинамидов 41 (схема 27,
конечный гетероцикл 37 или 38 (схема 24).
а) [47]. В результате были селективно получены
Фоторедокс-катализируемое тиоцианирование
производные азаспиротриендиона 42, продукта
N-алкил-N-метакрилоилбензамидов 39 под дей-
орто-циклизации не наблюдалось. На заключи-
ствием NH4SCN приводило к функционализиро-
тельной стадии этой реакции делокализованный
ванным изохинолиндионам 40 [46]. Реакция про-
на бензольном кольце радикал перехватывается
текала при облучении люминесцентной лампой
кислородом воздуха и образуется дополнительная
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1317
Схема 20. Фотокаталитическое взаимодействие алкенов 31, NH4SCN и реагента Умемото II
ɪɟɚɝɟɧɬ ɍɦɟɦɨɬɨ ,,
F
SCN
F
ɪɟɚɝɟɧɬ ɍɦɟɦɨɬɨ II (1.5 ɷɤɜ)
R2
R2
blue LED (450 ɧɦ)
CF3
+ NH4SCN
R3
R1
CH3CN, N2, rt, 4 ɱ
R1
R3
S+
OTf
31
32
CF3
SCN
R = H, 51%
R = 4-Cl, 72%
SCN
SCN
R = 4-t-Bu, 70%
R = 3-Cl, 55%
CF3
CF3
R = 4-Me, 70%
R = 2-Cl, 48%
R
CF3
R = 3,5-Me, 62%
R = 4-CF3, 62%
R = 4-OMe, 75%
R = 4-Br, 92%
48% (dr 2:1)
45%
O
OMe
SCN
SCN
SCN
MeO
SCN
CF3
N
CF3
CF3
n
CF3
n
O
76%
n = 1, 68%
n = 3, 52%
67%
n = 2, 89%
n = 17, 46%
SCN
O
SCN
EtO
SCN
O
CF3
EtO
CF
P
TsO
CF3
3
BnO
O
51%
83%
73%
O
O
O
CF3
SCN
H
SCN
BnO
CF3
N NH
H
H
R
O
F3C
SCN
R = Me, 69%
Cl
R = Ph, 61%
58% (dr 1:1)
68%
R = Bn, 62%
карбонильная группа. Такое же превращение было
Облучение зеленым светодиодом 2-изоциано-
реализовано при облучении синим светодиодом с
бифенилов 45 в присутствии NH4SCN и эозина Y
использованием
2,4,5,6-тетра(9H-карбазол-9-ил)-
привело к тиоцианированным фенантридинам 46
изофталонитрила в качестве фотокатализатора
(схема 29) [50]. Как электронодонорные, так и
(схема 27, b) [48].
электроноакцепторные группы в исходных аро-
матических соединениях 45 совместимы с раз-
Каскад радикального присоединения-анне-
лирования был также использован для фоторе-
работанным процессом. Механизм реакции
докс-катализируемого видимым светом синтеза
аналогичен указанному выше и включает обра-
SCN-замещенных бензотиофенов 44 из 2-алкинил-
зование SCN-радикала путем восстановитель-
тиоанизолов 43 и тиоцианата аммония (схема 28).
ного гашения, его присоединение по связи С-N,
Выходы конечных продуктов составили 52-81%
внутримолекулярную циклизацию и окисле-
[49].
ние.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1318
МУЛИНА и др.
Схема 21. Возможный механизм тиоцианирования/трифторметилирования алкенов 31
R2
R3
F
F
F
R1
F
31
blue LED
+
CF3
S+
S
OTf
CF3
OTf
A
B
A
R2
R3
B
+
CF
3
R1
F
F
C
+
NH4OTf
+
CF3
CF3
31'
A
R2
R3
S
SCN
NH4SCN
R1
C
CF
3
SCN
R2
CF3
R1
NH4SCN
3
R
32
2. ТИОЦИАНИРОВАНИЕ КАРБОЦИКЛОВ
продукта. Выходы тиоцианирования других суб-
стратов составили 13-42%.
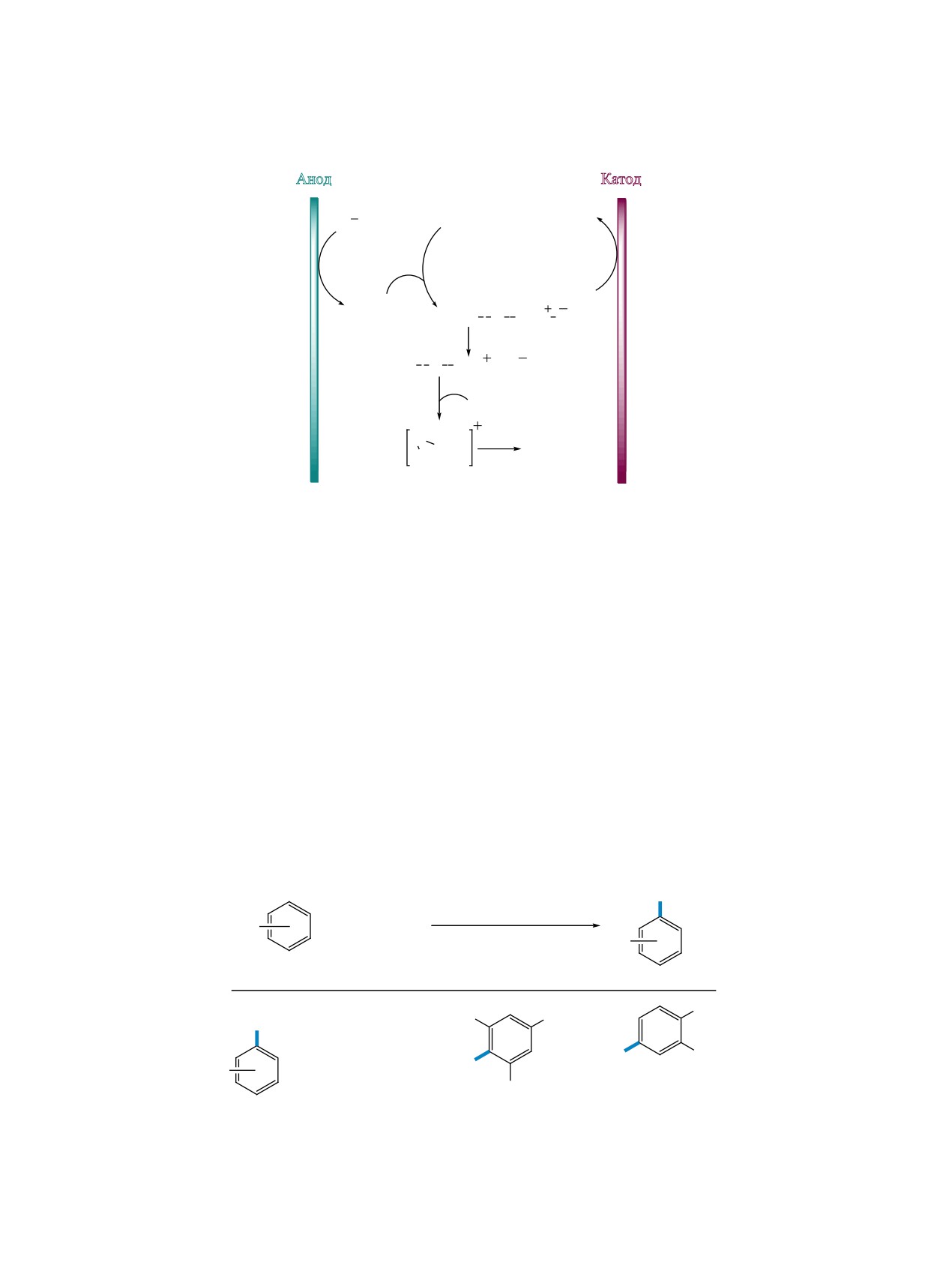
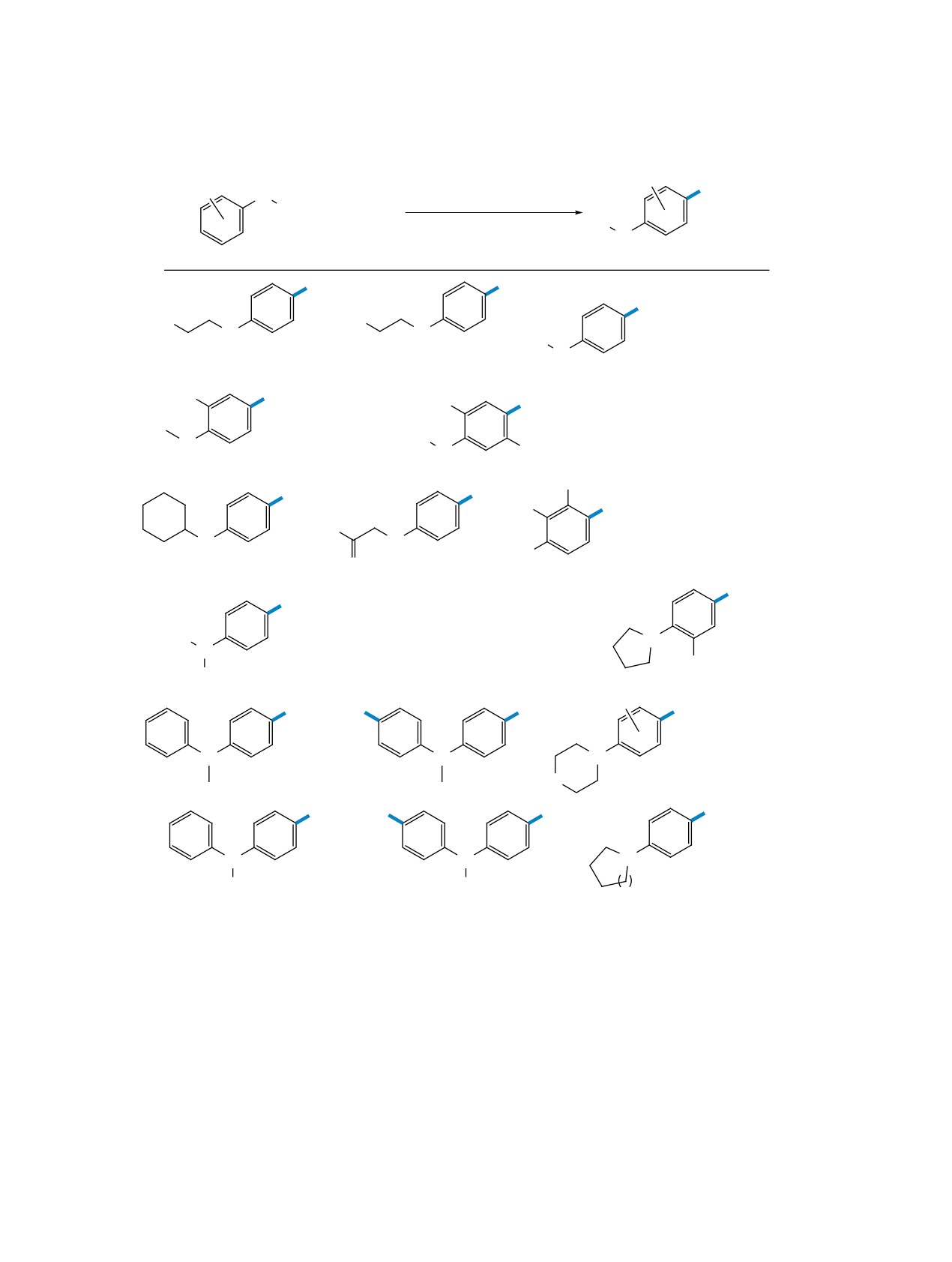
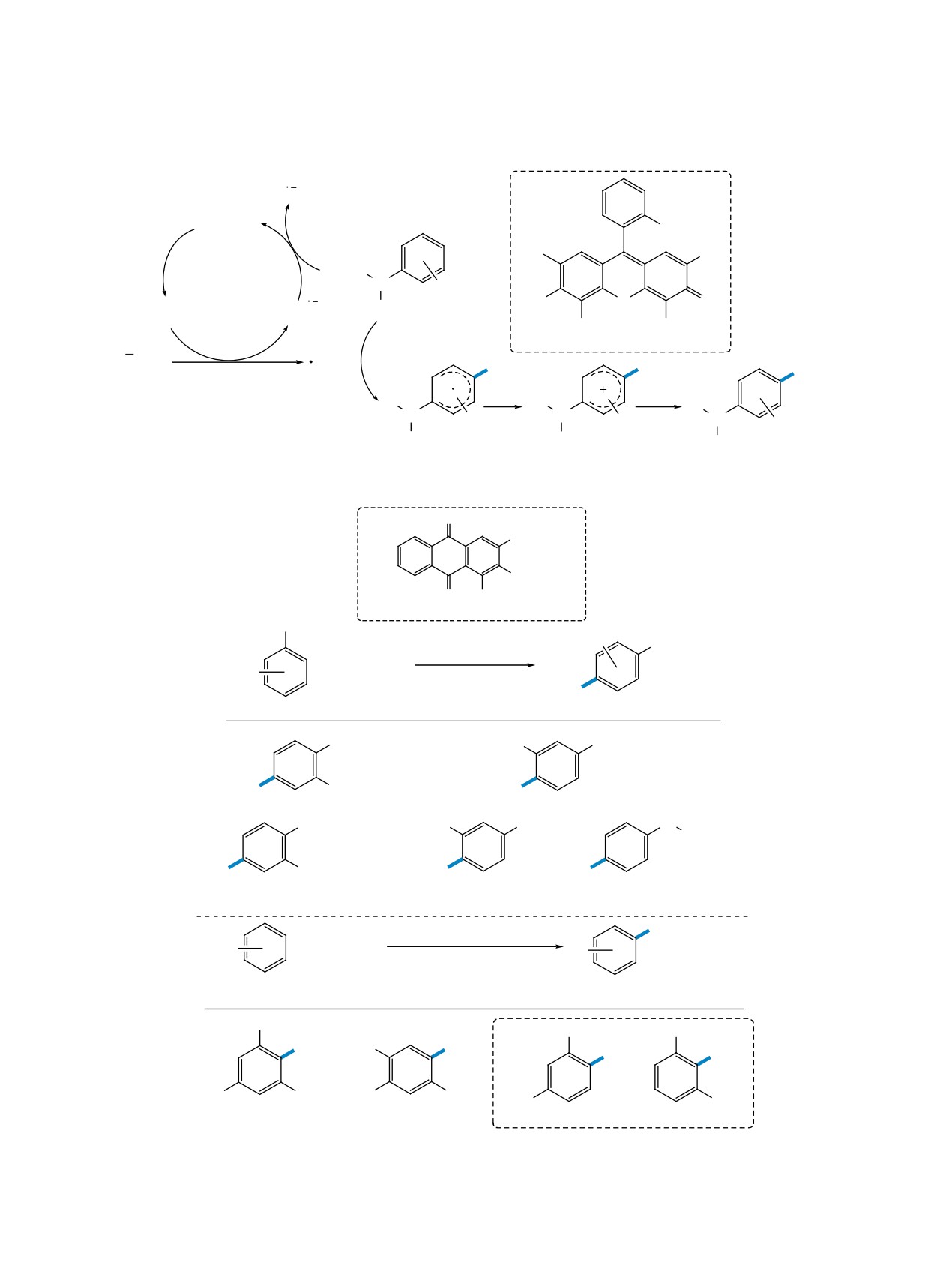
Сообщалось о ряде подходов к тиоцианирова-
нию в пара-положение электроно-избыточных аре-
Предположительно, процесс проходит через
нов, таких как фенол, анизол и производные ани-
образование диродана, образующегося в результа-
лина. Одним из первых примеров было электро-
те последовательного анодного окисления аниона
химическое тиоцианирование о-крезола NH4SCN
SCN и димеризации образовавшегося радикала
в двухфазной смеси воды, H2SO4 и дихлорме-
(схема 31). Далее диродан взаимодействует с ук-
тана с получением
2-метил-4-тиоцианофенола.
сусной кислотой с образованием интермедиата А,
Процесс проводился при высокой плотности тока
который распадается на аддукт В и анион SCN.
150 мА/см2, выход по току составил 50% [51].
Первый атакует исходное ароматическое соеди-
Электрохимическое тиоцианирование анизола
нение 47 с образованием катиона 47', реаромати-
зация которого приводит к конечному тиоцианату
47 тиоцианатом аммония было проведено в усло-
виях постоянного потенциала (1.1 В vs Ag|AgCl)
48.
в разделенной электрохимической ячейке
Осуществлено также электрохимическое ти-
(схема 30). Уксусная кислота и LiClO4 служили
оцианирование анизола и различных диметок-
растворителем и фоновым электролитом соответ-
сибензолов в орто-положение к ОМе-группе
ственно. В результате был селективно получен
[54]. Замещенные анилины 49 тиоцианировали
п-тиоцианоанизол 48 с выходом 77% [52]. Позже
при постоянном токе в неразделенной ячейке с
авторы продемонстрировали применимость свое-
платиновыми электродами в CH3CN (схема 32).
го метода к замещенным анизолам, толуолу, м-кси-
Тиоцианирование первичных, вторичных и тре-
лолу, анилину и N-замещенным анилинам [53].
тичных анилинов 49 позволило получить целевые
Однако наилучшая эффективность по-прежнему
соединения 50 с выходом 72-98% [55].
наблюдалась для анизола, введение метильных и
метоксильных заместителей в молекулу анизола
В дальнейшем ряд анилинов, успешно всту-
в большей или меньшей степени снижало выход
пающих в реакции тиоцианирования, был значи-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1319
Схема 22. Дифункционализация алкенов 33 под действием TMSNCS и перфторалкилиодидов 34
SCN
CuCl (10 ɦɨɥ %)
24 W violet LED (390 410 ɧɦ)
Rf
R
+ RfI
+ TMSNCS
CH3CN, Ar, rt, 4 ɱ
R
33
34
35
SCN
SCN
SCN
CF2CO2Et
C3F7
C6F13
R
R
R
R = F, 49%
R = 4-F, 89%
R = 4-F, 84%
R = Br, 52%
R = 4-Br, 86%
R = 4-Br, 84%
O
R = 4-Me, 86%
R = 4-Me, 87%
R = 3-Cl, 86%
R = 3-Cl, 89%
H
SCN
SCN
C8F17
C10F21
H
H
R
Rf
t
Bu
SCN
R
88%
R = 4-F, 72%
f = C3F7, 84%
Rf = C6F13, 86%
R = 4-Br, 77%
Rf = C8F17, 82%
R = 4-Me, 75%
R = 3-Cl, 78%
violet LED
K3PO4
+ RfI
PO43
I
Rf
Rf + PO42
+ I
EDA complex
PO42
PO43
Rf
R
Rf
f
R
R
R
33
33'
33''
CuCl
TMSNCS
SCN
SCN
Rf
R
35
тельно расширен. Оптимальными условиями для
получено 37 примеров тиоцианированных анили-
синтеза широкого круга тиоцианированных произ-
нов 52, содержащих электронодонорные и элек-
водных различных анилинов 51 являлись неразде-
троноакцепторные группы (схема 33) [56].
ленная ячейка, угольный анод, платиновый катод,
Фотохимическое тиоцианирование электроно-
NH4SCN в качестве источника тиоцианатной груп-
избыточных аренов проводили как в гомогенном,
пы, CH3CN или CH3CN/AcOH в качестве раство-
так и в гетерогенном варианте. В первом случае
рителя и воздушная атмосфера. В этих условиях
органический краситель эозин Y использовали
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1320
МУЛИНА и др.
Схема 23. Каскадная реакция N-аллилтиоамидов 36 с NH4SCN с образованием тиазолинов 37 и тиазинов 38
S
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
R1
E = 2 V, C(+)/C( )
S
R3
+ NH4SCN
(a)
R1
N
R3
CH3CN, rt, 5 ɱ
N
H
R2 SCN
R2
36a
37
SCN
R = H, 85%
R = 4-CF3, 80%
SCN
SCN
R = 4-Me, 70%
R = 4-COOMe, 84%
S
S
S
R = 4-OMe, 72%
R = 3-Cl, 84%
R = 4-Ph, 74%
R = 2-Cl, 88%
N
N
N
R = 4-Cl, 81%
R = 3,5-Me, 68%
R
X
X = S, 76%
N
R = 4-Br, 82%
X = O, 63%
79%
SCN
SCN
S
SCN
R = C6H5, 61%
R = 4-Br-C6H4, 68%
S
Ph
R = 4-Me-C6H4, 65%
R = 4-CN-C6H4, 62%
S
N
R = 4-OMe-C6H4, 67%
R = 2-pyridyl, 67%
Ph
N
R = 4-Cl-C6H4, 69%
R N
63%
44%
Ph
SCN
SCN
R = 4-Me-C6H4, 60%
SCN
R = C6H5, 66%*
R
R = 4-Cl-C6H4, 62%
S
S
R = 4-Me-C6H4, 63%*
R = Me, 76%
S
Ph
N
R N
Ph
N
Ph
NCS
Ph
58%
SCN
SCN
S
CF3
S
S
N
N
Ph
N
32%*
36%*
Br
72%
*ɫɨɨɬɧɨɲɟɧɢɟ ɞɢɚɫɬɟɪɟɨɦɟɪɨɜ > 19:1
R1
R1
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
NCS
S
E = 2 V, C(+)/C( )
N
(b)
+ NH4SCN
N
CH3CN, rt, 8 ɱ
X
H
S
X
R2
R2
36b
38
NCS
NCS
NCS
R2 = H, 44%
N
R2 = Br, 52%
N
N
R2 = CF3, 54%
O
S
S
S
S
R2
58%
60%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1321
Схема 24. Возможный путь электрохимического синтеза тиазолинов 37 или тиазинов 38
Ⱥ
ɧɨɞ
Ʉɚɬɨɞ
S
R1
N
R3
H
R2
2 SCN
36
H2
SCN
-2e
+2e
NC
S
(SCN)2
S
2H+
R1
N
R3
H
R2
A
H+
NCS
R1
S
R3
R2
N
ɢɥɢ
N
R2 SCN
R3
S
R1
37
38
как катализатор в реакции анилинов 53 с тиоци-
Сообщалось об электрохимическом ипсо-ти-
анатом аммония в CH3CN при освещении синим
оцианировании арилборных соединений
57
(схема 34, а) или зеленым (схема 34, b) светодио-
(схема 37). Реакция протекала в неразделенной
дом [57, 58].
ячейке, снабженной платиновыми электродами,
в условиях постоянного тока. Применение арил-
Предположительно процесс проходит цикл вос-
борных кислот 57a в качестве исходных реаген-
становительного гашения и включает в себя гене-
тов сделало возможным тиоцианирование ши-
рацию SCN радикала, его атаку на ароматическое
рокого круга электроноизбыточных субстратов
кольцо 53, окисление образовавшегося радикала
с помощью NH4SCN. При использовании арил-
53' в катион 53'' и депротонирование с образова-
трифторборатов 57b применимость разработан-
нием конечного продукта 54 (схема 35).
ного метода была еще шире и включала стериче-
Гетерогенное тиоцианирование анилинов и фе-
ски затрудненные о,о-дизамещенные соединения
нолов 55 осуществляли с использованием в каче-
[61].
стве гетерогенных фоторедокс катализаторов али-
TMSNCS также применяли для электрохимиче-
) [59] и ме-
заринового красного S-TiO2 (ARS-TiO2
ского ипсо-тиоцианирования арилборных кислот
зопористого графитового нитрида углерода (mpg-
59 (схема 38) [62]. При этом в этот процесс успеш-
) (схема 36) [60]. Основным преимуществом
C3N4
но вступают реагенты, содержащие как электроно-
нерастворимых гетерогенных полупроводниковых
донорные, так и электроноакцепторные группы.
катализаторов является их фото- и химическая
Некоторые аннелированные гетероциклы также
стабильность, что позволяет легко извлекать их
реагировали с образованием тиоцианатов. На ос-
из реакционных смесей простым фильтрованием
новании экспериментов по улавливанию радика-
или центрифугированием. Тиоцианогруппа в обо-
лов и циклической вольтамперометрии авторы
их случаях переходит в пара-положение к группам
предложили возможный путь реакции. В результа-
OR или NR2. При наличии заместителей в пара-по-
те взаимодействия между TMSNCS и KF образу-
ложении исходных соединений, тиоцианирование
ется SCN анион, который на аноде окисляется до
не происходит.
SCN радикала. Образовавшийся радикал участву-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1322
МУЛИНА и др.
Схема 25. Фоторедокс-катализируемое тиоцианирование N-алкил-N-метакрилоилбензамидов 39 тиоцианатом
аммония при облучении видимым светом
NCS
[Acr Mes]+ClO4 (2 ɦɨɥ %)
R1
O
R
23 W CFL, DCM
N
+ NH4SCN
R
ɜɨɡɞɭɯ, 35°C, 36 48 ɱ
N
R1
O O
O
39
40
NCS
NCS
NCS
R = Me, 89%
R = t-Bu, 89%
R
O
O
R = Me, 85%
O
R = OMe, 70%
R = CF3, 49%
R = F, 71%
N
N
R = Cl, 45%
N
R = Cl, 65%
R
R = Br, 30%
R = Br, 56%
O
O
O
62%
NCS
NCS
NCS
R1 = Et, 74%
O
O
MeO
O
R = H, 85%
R1 = ɧ-Pr, 67%
R = Me, 59%
N
N
R1 = i-Pr, 42%
N
R1
R1 = Bn, 71%
MeO
R
O
O
O
71%
NCS
NCS
O
Cl
O
N
N
Cl
O
O
51%
46%
ет в формальном замещении борного фрагмента
По мнению авторов, фотовозбужденный
59 с образованием целевых соединений 60.
g-C3N4 окисляется O2 до соответствующего кати-
он-радикала, который реагирует с SCN- с образо-
3. ТИОЦИАНИРОВАНИЕ
ванием SCN радикала и исходной формы g-C3N4.
ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Образовавшийся SCN радикал присоединяется к
Различные пиразолы 61 были успешно тио-
исходному пиразолу 61, в результате чего образу-
цианированы в условиях гетерогенного фотока-
ется С-центрированный радикал 61'. Наконец, O
•-,
тализа (схема 39). Реакция проходила в ДМСО в
образующийся при окислении фотовозбужденного
атмосфере кислорода при облучении синим све-
g-C3N4, отрывает атом водорода от радикала 61' с
тодиодом, NH4SCN и нитрид углерода в графито-
образованием целевого продукта 62 (схема 40).
вой фазе применялись в качестве тиоцианирую-
Облучение люминесцентной лампой корро-
щего агента и фотокатализатора соответственно.
лов 63 в присутствии NH4SCN в MeCN приво-
Целевые 4-SCN-замещенные пиразолы 62 полу-
дит к тетратиоцианокорролам 64 со средними
чены с выходами 63-94% [63]. N-Фенилпиррол,
выходами (схема
41). Структура полученных
N-бензилпиррол и
2-метокситиофен успешно
SCN-производных
64 однозначно подтвержде-
вступали в процесс тиоцианирования в аналогич-
на данными рентгеноструктурного анализа.
ных условиях [60].
Синтезированные соединения 64 имеют существен-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1323
Схема 26. Предполагаемый механизм образования изохинолиндионов 40
O2
Acr+-Mes
23 W CFL
R1
O
2 R
N
Acr+-Mes*
Acr-Mes
O O
39
SCN
NH4SCN
SCN
R1
R
NCS
N
SCN
O
O O
R
39'
N
R1
SCN
O
40
O
R
N
R1
O
но различающиеся фотофизические свойства и мо-
ние производных пиррола, изатина, карбазола, пи-
гут рассматриваться как спектроскопические мо-
разола и изоксазола.
дельные системы пигментов хлорофилла-А [64].
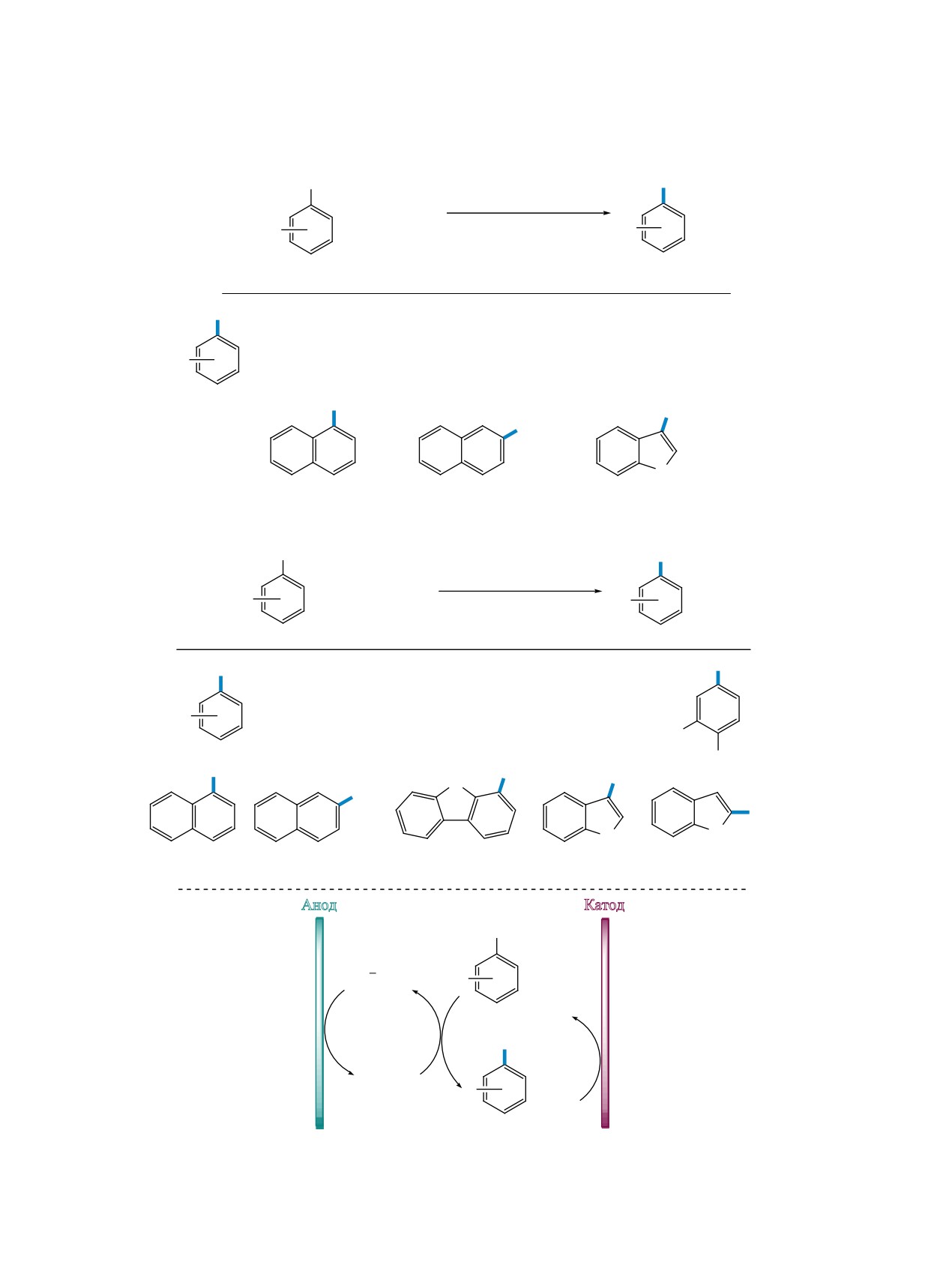
3-SCN-Замещенные индолы были также синте-
Электрохимическое тиоцианирование 5-амино-
зированы в условиях гомогенного и гетерогенного
пиразолов 65 NH4SCN проводили в условиях как
фотокатализа. Применение бенгальского розового
постоянного потенциала, так и постоянного тока в
в качестве фотокатализатора позволило эффектив-
системе MeCN-H2O, в качестве фонового электро-
но тиоцианировать индолы 69 при облучении лю-
лита использовали NaClO4 (схема 42). Полученные
минесцентной лампой (схема 44) [68]. Широкий
4-тиоциано-5-аминопиразолы 66 подвергали кис-
спектр функциональных групп в исходных индо-
лотно-катализируемой конденсации с дикарбо-
лах 69 устойчив к такому превращению.
нильными соединениями и их производными с
Эксперименты по гашению флуоресценции
образованием
3-тиоцианатопиразоло[1,5-а]пири-
показали, что интенсивность излучения фотока-
мидинов [65].
тализатора резко уменьшалась в присутствии ти-
оцианата аммония, что подтвердило окисление
Разработан ряд электро- и фотохимических ме-
NH4SCN фотовозбужденной формой бенгальского
тодов тиоцианирования индолов. Для тиоцианиро-
розового. Образовавшийся SCN радикал присо-
вания индолов 67 роданидом аммония в электро-
единяется к 3-положению индола 69 с образова-
химических условиях использовали как потенци-
нием радикала 69'. Последующее окисление и де-
остатический, так и гальваностатический режим
протонирование приводят к получению конечного
электролиза (схема 43) [55, 66, 67]. Во всех случа-
продукта 70 (схема 45).
ях SCN-группа селективно занимала 3-положение
индольного ядра. Выходы полученных продуктов
Гетерогенное фотокаталитическое тиоциани-
68, в основном, высокие. Предложенные авторами
рование индолов 71 осуществляли с использо-
условия были также расширены на тиоцианирова-
ванием в качестве фотокатализаторов mpg-C3N4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1324
МУЛИНА и др.
Схема 27. Фотокаталитическое тиоцианирование N-арилпропинамидов 41 с образованием азаспиротриендионов 42
R2
SCN
[Acr-Mes]+ClO4(2 ɦɨɥ %)
R2
AcOH (0.5 ɷɤɜ)
R
+ NH4SCN
O
(a)
R
23 W CFL, DCM
N
ɜɨɡɞɭɯ, 35°C, 15 48 ɱ
N
O
O
R1
R1
41a
42a
SCN
R2
Ph
R2 = H, 85%
R2 = 4-CF3, 85%
SCN
R = Me, 77%
SCN
R2 = 4-Me, 95%
R2 = 4-F, 78%
R = Cl, 40%
R2 = 4-OMe, 75%
R2 = 4-Cl, 76%
N
O
R = Br, 51%
R2 = 3-OMe, 73% R2 = 4-Br, 55%
N
O
O
N
O
R
50%
SCN
SCN
R = Me, 75%
R1 = Et, 78%
SCN
SCN
R = Cl, 60%
R1 = i-Pr, 88%
R = OMe, 72%
R1 = Bn, 72%
O
O
O
N
R = Ph, 61%
N
R1 = Ac, 74%
N
N
O
O
R1
R
O
57%
50%
R2
SCN
R
4CzlPN (5 ɦɨɥ %)
R2
eO
10 W blue LED
R
(b)
N
+ NH4SCN
O
CH3CN, ɜɨɡɞɭɯ,
N
rt, 12 ɱ
NC
CN
N
O
O
R1
R1
41b
42b
N
N
R1 = Me, 80%
SCN
SCN
SCN
N
R1 = Et, 65%
S
R1 = ɧ-Pr, 75%
R1 = ɧ-Bu, 91%
O
O
O
N
R1 = Bn, 72%
N
N
4CzlPN
R1 = Ac, 45%
O
O
78%
80%
(схема 46, а) [39] и ализаринового красного S-TiO2
синим светодиодом. Выходы синтезированных
(схема 46, b) [59]. Различные аминотиазолы 73
3-SCN-замещенных гетероциклов 72 и 74 превы-
шали 70%.
также были успешно тиоцианированы с использо-
ванием ализаринового красного S-TiO2
(схема 46,
Электрохимическое тиоцианирование имида-
c). Все реакции протекали в ТГФ при облучении
зопиридинов 75 тиоцианатом аммония в условиях
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1325
Схема 28. Синтез 3-тиоцианобензотиофенов 44
R
ɗɨɡɢɧ Y (5 ɦɨɥ %)
SCN R
blue LED
+ NH4SCN
DMSO, O2,
rt, 48 ɱ
S
S
43
44
SCN
SCN
SCN
R
R
R
S
S
S
R = H, 78%
R = t-Bu, 75%
R = H, 58%
R = ɧ-Bu, 71%
R = Me, 81%
R = OEt, 72%
R = Br, 52%
R = OEt, 70%
R = Et, 78% R = Br, 61%
R = CF3, 64%
R = H, 69%
SCN
SCN
SCN
Cl
Br
F3C
R
R
R
S
S
S
R = Me, 65%
R = ɧ-Bu, 72%
R = Me, 74%
R = H, 67%
R = H, 68% R = OEt, 66%
R = Et, 54%
R = Et, 67%
Схема 29. Фоторедокс-катализируемая видимым светом реакция между 2-изоцианобифенилами 45 и NH4SCN
ɗɨɡɢɧ Y (2 ɦɨɥ %)
R1
R1
2.5 W green LED (535 ɧɦ)
+ NH4SCN
CH3CN, ɜɨɡɞɭɯ,
R
R
rt, 8
16 ɱ
CN
N SCN
45
46
R1
R1 = t-Bu, 89%
R = OMe, 86%
R1 = OMe, 87%
R = CF3, 73%
R1 = Cl, 80%
R = NO2, 69%
R1 = CN, 71%
N SCN
R1 = COOMe, 75%
R
N SCN
R
R
Cl
N SCN
N SCN
N SCN
R
74%
R = Me, 88%
R = F, 76%
R = F, 71%
R = OMe, 53%
Схема 30. Электрохимическое тиоцианирование анизола 47
CPE
ɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
SCN
H-ɬɢɩɚ
+ NH4SCN
AcOH
MeO
LiClO4 (0.5M)
MeO
47
48, 77%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1326
МУЛИНА и др.
Схема 31. Предполагаемый механизм электросинтеза 4-тиоцианоанизола 48
Ⱥ
ɧɨɞ
Ʉɚɬɨɞ
H2
CH3COOH
2 SCN
+2e
-2e
2H+
(SCN)2
CH3COO H NCS SCN
A
CH3COO H NCS
+ SCN
B
47
Ar
SCN
ArSCN
H
H+
47'
48
постоянного тока в неразделенной ячейке приво-
Предложено также фотохимическое тиоциа-
дит к образованию 3-SCN-замещенных произ-
нирование имидазопиридинов 77 (схема 49) [71].
водных 76 (схема 47) [69, 70]. Некоторые другие
Аналогично электрохимическому варианту [69,
конденсированные гетероциклы, такие как про-
70], тиоцианогруппа была введена в 3 положение
изводные тиазола, имидазо[1,2-а]хинолин и ими-
кольца. Реакция проходила в присутствии эози-
дазо[1,2-а]пиразин, также эффективно вступали в
на Y при облучении синим светодиодом. Широкий
обнаруженное превращение.
ряд исходных гетероциклов 77 совместим с этим
процессом. Помимо имидазопиридинов, имидазо-
Тиоцианирование начинается с анодного окис-
тиазол и бензоимидазотиазол также подвергались
ления SCN аниона в соответствующий радикал
тиоцианированию в этих условиях. Конечные про-
(схема 48). Далее SCN радикал присоединяет-
дукты 78 были получены с выходами 54-93%. В
ся к катион-радикалу 75' (путь i), который мо-
этой реакции реализуется восстановительный
жет быть предварительно сгенерирован на аноде.
цикл гашения.
С-центрированный радикал 75'' образуется по
пути ii и затем подвергается анодному окислению
Широкий ряд пиразолопиримидинов 79 был
до катиона. Окончательное депротонирование ка-
успешно тиоцианирован NH4SCN в электрохими-
тиона приводит к целевому соединению 76.
ческих условиях (схема 50) [72-74]. Применялся
Схема 32. Электрохимическое тиоцианирование анилинов 49 NH4SCN в условиях постоянного тока
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
SCN
CCE (18 ɦA), Pt(+)/Pt( )
R
+ NH4SCN
Ar, CH3CN, rt, 3 ɱ
R
49
50
NH2
R = 4-NH2, 72%
MeO
NH2
SCN
R = 4-NHMe, 91%
R = 4-NMe2, 75%
NCS
R
R = 4-NEt2, 92%
NCS
R
R = 4-NHPh, 91%
OMe
R = 4-NEt2, 92%
97%
R = Me, 98%
R = Cl, 83%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1327
Схема 33. Электросинтез 4-тиоцианированных анилинов 52
R
H
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
SCN
R
N
CCE (8 12 ɦA), C(+)/Pt( )
R1
+ NH4SCN
CH3CN ɢɥɢ CH3CN/AcOH
R1
rt, 4
6.5 ɱ
N
H
51
52
SCN
SCN
R1 = Me, 81%
SCN
R1 = Et, 83%
HO
NC
N
N
R1 = i-Pr, 87%
H
H
R1
N
R1 = Bu, 80%
H
80%
89%
R1 = allyl, 86%
R = Me, 79%
R
SCN
R2
SCN
R = OMe, 56%
R1 = Et, R2 = Me, R3 = H; 83%
R = Cl, 84%
R1 = Me, R2 = H, R3 = Me; 65%
R1
N
R = Br, 92%
R1 = Et, R2 = H, R3 = Me; 67%
N
R3
H
R = F, 75%
H
R2
SCN
SCN
R1 = Cl, R2 = H; 52%
R1
SCN
R1 = Br, R2 = H; 35%
EtO
N
N
R1 = H, R2 = H; 72%
H
H
H2N
R1 = H, R2 = Me; 78%
O
78%
89%
SCN
SCN
R1 = R2 = Et, 90%
R1 = R2 = ɧ-Pr, 86%
R2
R1 = R2 = Me, 89% R1 = Me, R2 = Et, 85%
N
N
CN
R1
37%
R
SCN NCS
SCN
SCN
R = H, 87%
N
N
N
R = 3-Me, 62%
R = 2,6-Me, 78%
O
51%
33%
SCN NCS
SCN
SCN
N
N
N
n = 1, 76%
Ph
Ph
n
n = 2, 80%
57%
38%
режим электролиза при постоянном потенциале.
синтезированы необычные оксиды аммония 82 с
Для субстратов с высоким потенциалом окисле-
выходами 60-95%. Процесс совместим с широ-
ния было необходимо добавление кислот Льюиса.
ким рядом пиразолин-5-онов 81, содержащих как
Предположительно, целевые продукты 80 образу-
электронодонорные, так и электроноакцепторные
ются в результате реакции катион-радикала пира-
группы в разных положениях цикла. Показано, что
золопиримидина 79 с SCN анионом.
полученные продукты 82 эффективно реагировали
Также была реализована электрохимическая
с реактивами Гриньяра с образованием соответ-
окислительная реакция кросс-сочетания между
ствующих сульфидов. Применение KSCN вместо
2,5-замещенными пиразолин-5-онами 81 и рода-
NH4SCN приводило к свободной ОН-форме тио-
нидом аммония (схема 51) [75]. В результате были
цианированного продукта.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1328
МУЛИНА и др.
Схема 34. Фотохимическое тиоцианирование анилинов 53
ɗɨɡɢɧ Y (5 ɦɨɥ %)
SCN
blue LED (452 ɧɦ)
+ NH4SCN
(a)
ɜɨɡɞɭɯ, CH3CN,
H2N
H2N
R
rt, 24 ɱ
R
53a
54a
Cl
R
SCN
SCN
R = H, 85%
R = F, 45%
SCN
R = Me, 68%
R = Cl, 50%
R = I, 71%
R = Br, 52%
H2N
H2N
R
R = Cl, 62%
R = NO2, 0%
H2N
Cl
R = Br, 65%
48%
SCN
ɗɨɡɢɧ Y (5 ɦɨɥ %)
30 W green LED
R1
1
(b)
+ NH4SCN
R
N
O2, CH3CN,
R
N
rt, 24 ɱ
R
R2
R2
53b
54b
SCN
R1 = Bn, 85%
R1 = i-Pr, 83%
SCN
R = F, 73%
R1 = Me, 81%
R1 = Ph, 90%
R = Cl, 76%
R1
R1 = Et, 80%
Bn
R = Br, 72%
N
N
R
R = OMe,72%
H
H
Cl
Cl
SCN
SCN
SCN
SCN
Bn
N
N
N
N
H
H
H
77%
84%
78%
89%
R
i-Pr
SCN
R
SCN
SCN
H2N
R = Br, 93%
R = H, 81%
H2N
H2N
R = Me, 92%
R = Me, 73%
i-Pr
95%
Предположительно, механизм образования ок-
Замена арильного заместителя R на H или CO2Me
сидов аммония 82 включает анодную генерацию
резко снижала выход конечных продуктов
84.
SCN радикала, его присоединение к енольной фор-
Подобно тиоцианированию индола, данное пре-
ме исходного пиразолин-5-она 81, анодное окисле-
вращение проходит через цикл восстановительно-
ние образовавшегося С-центрированного радика-
го гашения.
ла 81' в катион 81'', депротонирование и взаимо-
В результате взаимодействия
4-(N-метил)-
действие с катионом аммония (схема 52).
анилинокумаринов 85 с роданидом аммония об-
Предложено фотохимическое тиоцианирование
разуются 3-тиоцианированные производные
86
2-арилхинолин-4-онов 83 под действием NH4SCN
(схема 54) [76]. Процесс протекал в атмосфере
(схема 53) [57]. Эозин Y и CH3CN служили фото-
кислорода с использованием белого светодиод-
катализатором и растворителем соответственно.
ного излучения, фотокатализатор не требовался.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1329
Схема 35. Возможный механизм фоторедокс-катализируемого синтеза тиоцианоанилинов 53
O2
ɗɨɡɢɧ Y
COOH
green LED
Br
Br
O2
R1
N
R
HO
O
O
ɗɨɡɢɧ Y*
ɗɨɡɢɧ Y
R2
53
Br
Br
ɗɨɡɢɧ Y
SCN
SCN
SCN
SCN
SCN
[O]
R1
R1
R1
N
N
+
R
H
N
R
R
R2
R2
R2
53'
53''
54
Схема 36. Тиоцианирование электроноизбыточных аренов 55 в гетерогенных фотокаталитических условиях
O
SO3Na
OH
O
H
ɚɥɢɡɚɪɢɧɨɜɵɣ ɤɪɚɫɧɵɣ S (ARS)
X
ARS-TiO2
R
X
15 W blue LED
+ NH4SCN
(a)
R
THF, ɜɨɡɞɭɯ,
rt, 24 ɱ
NCS
55a
56a
OH
R = H, 84%
R
OH
R = Me, 65%
R = NO2, 67%
R = Et, 73%
R = Br, 69%
R = OMe, 87%
NCS
R
NCS
R = CHO, 73%
H
NH2
R
NH2
N
R
R = H, 81%
R = Me, 83%
NCS
R
R = Me, 96%
NCS
NCS
R = Et, 76%
R = Cl, 77%
R = Cl, 93%
R = Ph, 82%
R = OMe, 63%
SCN
mpg-C3N4
R
+ NaSCN
(b)
R
blue LED (455 nm)
DMSO/H2O, ɜɨɡɞɭɯ, 25°C, 72 ɱ
55b
56b
OMe
OMe
OMe
SCN
MeO
SCN
SCN
SCN
MeO
OMe
MeO
OMe
16:1
MeO
OMe
97%
94%
ɫɭɦɦɚɪɧɵɣ ɜɵɯɨɞ
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1330
МУЛИНА и др.
Схема 37. Электрохимическое тиоцианирование арилборных соединений 57
[
B
]
SCN
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
CCE (80 ɦA), Pt(+)/Pt( )
+ NH4SCN
R
AcOH ɢɥɢ CH3CN/HCO2H
R
rt, 2 ɱ
57
58
[B] = B(OH)2a ɢɥɢ %)3Kb
SCN
R = H, 0%a, 34%b
R = 4-OBn, 95%a, 70%b
R = 2,4-Me, 81%b
R = 4-OMe, 93%a, 67%b
R = 4-OPh, 86%a, 70%b
R = 2,6-Me, 67%b
R = 2-OMe, 68%a, 78%b
R = 4-Me, 8%a, 83%b
R = 2,4,6-Me, 91%a, 47%b
R
R = 4-F, 0%a, 54%b
R = 3-Me, 0%a, 60%b
R = 4-Ph, 0%a, 72%b
R = 4-Oi-Pr, 100%a
R = 2-Me, 38%a, 64%b R = 3-Ph, 28%b
SCN
SCN
SCN
S
0%a, 47%b
0%a, 74%b
91%a
Схема 38. Тиоцианирование бороновых кислот 59 под действием электрического тока
B(OH)2
SCN
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
CCE (10 ɦA), C(+)/C( )
+ TMSNCS
R
KF (5 ɷɤɜ)
R
CH3CN(ɛɟɡɜɨɞɧ.)/H2O
59
60
R = H, 25%
R = 2-NH2, 0%
R = 2,5-Me, 60%
SCN
SCN
R = 4-OMe, 83%
R = 4-NMe2, 87%
R = 4-Br, 21%
R = 2-OMe, 65%
R = 4-i-Pr, 55%
R = 4-Cl, 22%
R
R = 2,4-OMe, 85%
R = 4-Me, 62%
R = 4-COOMe, 32%
OHC
R = 4-OH, 78% R = 2-Me, 58% R = 4-CN, 33%
OMe
SCN
SCN
SCN
60%
O
SCN
SCN
X
X
63%
31%
< 5%
X = S, 83%
X = S, < 5%
X = O, 73% X = O, 65%
Ⱥ
ɧɨɞ
Ʉɚɬɨɞ
B(OH)2
2 SCN
R
59
H2
–2e
SCN
+2e
(SCN)2
R
2H+
60
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1331
Схема 39. Фотокаталитический синтез тиоцианированных пиразолов 62
R
R
g-C3N4, blue LED (450 ɧɦ)
N N
N N
+ NH4SCN
R2
R2
O2, DMSO, rt, 48 ɱ
1
1
R
R
SCN
61
62
R
R = H, 91%
R = 3-Me, 94%
R = 4-Me, 93%
R = 3-F, 76%
R = 4-OMe, 92%
R = 3-Cl, 87%
R = 4-F, 85%
R = 2-Me, 89%
N N
N N
N N
R = 4-Cl, 88%
R = 2-F, 66%
OH
R = 4-Br, 91%
SCN
SCN
SCN
79%
70%
R
R
R = 4-Br, 85%
R = R1 = Me, 63%
N
R = 4-OMe, 90%
N N
R = R1 = Ph, 87%
N
NH2
NH2
R = Ph, R1 = Me, 71%
R1
R = Ph, R1 = t-Bu, 78%
SCN
SCN
Схема 40. Возможный механизм тиоцианирования пиразолов 61
R
N N
R2
R1
61
R
SCN
g-C3N4
N N
2
R
blue LED
R1
SCN
SCN
g-C3N4*
g-C3N4
61'
H
O2
R
O2
N N
OOH
R2
R1
SCN
62
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1332
МУЛИНА и др.
Схема 41. Взаимодействие корролов 63 с NH4SCN при облучении люминесцентной лампой
R
R
NH HN
NH HN
20 W CFL/LED
+ NH4SCN
R1
R1
ɜɨɡɞɭɯ, CH3CN,
R1
R1
rt, 2.5 ɱ
N HN
N HN
NCS
SCN
NCS
SCN
63
64
R
OMe
R = H, 30%
R = CN, 32%
OMe
R = NO2, 12%
NH HN
NH HN
R
R
NC
CN
N HN
N HN
NCS
SCN
NCS
SCN
NCS
SCN
NCS
SCN
45%
Br
F
F
F
F
F
F
F
F
F
NH HN
NH HN
NC
CN F
F
N HN
N HN
F
F
F
F
NCS
SCN
NCS
SCN
NCS
SCN
NCS
SCN
48%
35%
Схема 42. Электрохимическое тиоцианирование 5-аминопиразолов 65
H
ɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
NCS
NH2
CPE (E = 0.9 ȼ), GC(+)/GC( )
NH2
+ NH4SCN
R
NaClO4 (0.1M ɜ CH3CN/H2O = 20/1)
R
NH
NH
N
N
65
66
R = Me, 83%; R = cyclopropyl, 87%.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1333
Схема 43. Электросинтез 3-тиоцианированных индолов 68
SCN
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
R
R1
CCE ɢɥɢ CPE
+ NH4SCN
R
R1
N
CH3OH ɢɥɢ CH3OH, rt
2
N
R
R2
67
68
Схема 44. Фоторедокс-катализируемое тиоцианирование индолов 69
SCN
Rose Bengal (1 ɦɨɥ %)
R
R1
14 W CFL
+ NH4SCN
R
R1
N
THF, ɜɨɡɞɭɯ,
N
2
R
rt, 18
48 ɱ
R2
69
70
SCN
R
SCN
SCN
R = Me, 96%
R = OMe, 73%
R
R = H, 98%
R = OMe, 98%
R = F, 94%
R = Me, 85%
R = F, 94%
R = Br, 85%
R = OBn, 93%
N
N
R = Br, 76%
N
R
R = Cl, 87%
H
H
H
SCN
SCN
R2 = Me, 91%
R2 = Ph, 88%
R2 = Bn, 95%
N
N
2
R
85%
Схема 45. Возможный путь образования 3-тиоцианированных индолов 70
O2
RB
14 W CFL
SCN
R
R1
O2
N
R
R1
RB*
RB
R2
N
69
R2
70
SCN
SCN
H
SCN
SCN
[O]
R
R1
R
R1
N
N
2
R
R2
69'
Заместитель у атома азота определял хемоселек-
4. ПРОЧИЕ РЕАКЦИИ
тивность процесса, при удалении Ме-группы от
3-Амино-2-тиоцианато-α,β-ненасыщенные
азота, происходила циклизация с образованием
карбонильные соединения получены как фотохи-
производных
1H-хромено[4,3-d]тиазол-4(2H)-о-
мическими, [77] так и электрохимическими мето-
нов.
дами [78] тиоцианирования/аминирования дике-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1334
МУЛИНА и др.
Схема 46. Гетерогенное фотокаталитическое тиоцианирование индолов 72 и аминотиазолов 73
SCN
mpg-C3N4 (5 ɦɝ)
R
R1
blue LED
+ NH4SCN
R
R1
(a)
N
THF, ɜɨɡɞɭɯ,
N
2
rt, 10 ɱ
R
R2
71a
72a
SCN
SCN
SCN
R = OMe, 93%
R = H, 92%
R
R = Cl, 89%
R = Me, 91%
R = Br, 87%
N
N
N
H
H
90%
88%
SCN
ARS-TiO2
R
R1
15 W blue LED
+ NH4SCN
R
R1
(b)
N
,
THF, O2
N
2
rt, 24 ɱ
R
R2
71b
72b
NCS
ARS-TiO2
S
15 W blue LED
S
+ NH4SCN
(c)
N NH2
THF, O2,
R
rt, 24 ɱ
N
NH2
R
73
74
R = H, 91%
R = 4-Cl, 83%
R = 4-Ph, 96%
R = 3-NO2, 73%
R = 4-Br, 88%
R = 2-Cl, 79%
R = 4-Me, 97%
тонов, кетоэфиров, кетоамидов и их гетероанало-
ванием NH4Br в качестве фонового электролита и
гов.
CH3CN в качестве растворителя в условиях посто-
янного тока (схема 56).
Фотохимическое аминотоцианирование ди-
карбонильных соединений и их гетероаналогов
На основании данных циклической вольтам-
87 проводили при облучении синим светодиодом
перометрии и контрольных экспериментов пред-
с использованием флуоресцеина в качестве фо-
ложен механизм процесса. На первом этапе бро-
токатализатора [77]. Тиоцианат аммония служил
мид-анион окисляется на аноде с образованием
источником как амино-, так и тиоцианогрупп. Ряд
брома. Реакция исходного дикарбонильного со-
совместимых субстратов 87 весьма внушителен и
единения 89 с Br2 приводит к промежуточному
включал кетоэфиры с ненасыщенными связями,
соединению 89', которое подвергается нуклео-
гетероциклические и стероидные производные,
фильному замещению карбамодитиоат анионом с
дикетоны, а также соединения с заместителями на
образованием производного 89''. Далее его тауто-
основе фосфора и серы (схема 55).
мерная форма 89''' реагирует с образовавшимся на
В электрохимическом варианте [78] в качестве
катоде аммиаком, в результате чего образуется ке-
источника тиоциано- и аминогруппы использова-
тоимин 90' и его таутомер 90''. Наконец, анодное
ли карбамодитиоат аммония или систему KSCN/
окисление последнего, сопровождающееся отще-
NH4OAc. Реакции проводили в неразделенной
плением H2S, приводит к целевому соединению 90
ячейке с платиновыми электродами с использо-
(схема 57).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1335
Схема 47. Синтез тиоцианированных имидазопиридинов 76 в электрохимических условиях
R
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
N
R
N
CCE (10 ɦA), C(+)/Pt( )
R1
+ NH4SCN
(a)
R1
N
AcOH (2 ɷɤɜ)
N
CH3CN, rt, 2.5 ɱ
SCN
75a
76a
R1 = H, 95%
R1 = 4-Ph, 90%
R1 = 4-COOMe, 80%
N
R1 = 4-Me, 88%
R1 = 4-CF3, 85%
R1 = 4-F, 88%
N
R1 = 2-Me, 88%
R1 = 4-Ms, 75%
R1 = 4-Cl, 80%
R1
R1 = 3-OMe, 84% R1 = 4-CN, 55% R1 = 4-Br, 95%
SCN
N
S
N
N
N
N
N
SCN
SCN
SCN
80%
95%
90%
Br
R = Me, 98%
N
N
N
N
R = CF3, 95%
R = F, 85%
N
N
N
R
R = Cl, 80%
SCN
SCN
SCN
R = Br, 95%
93%
95%
R
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
R
N
N
CCE (5 ɦA), Pt(+)/Pt( )
R1
(b)
+ NH4SCN
R1
N
ɧ-Bu4NPF6 (0.05M)
N
CH3CN, rt, 6 ɱ
SCN
75b
76b
R1 = H, 85%
R1 = 2-Cl, 70%
N
N
R1 = 4-Me, 80%
R1 = 3-Cl, 77%
R1
N
R1 = 4-OMe, 79%
R1 = 3,4-Cl, 80%
N
R1
R1 = 4-F, 73%
SCN
R1 = 4-CF3, 76% R1 = H, 82%
SCN
R1 = Me, 84%
R
N
S
N
N
N
N
N
SCN
SCN
SCN
71%
80%
R = H, 66%; R = Me, 73%
R
R = 8-F, 77%
R = 7-CF3, 76%
N
N
R = 8-Cl, 84%
R = 7-CN, 74%
CF3
N
N
R = 8-CF3, 79%
R = 6-Me, 86%
R = 7-Me, 73%
R = 6-F, 81%
SCN
SCN
R = 7-F, 74%
R = 6-Cl, 78%
80%
R = 7-Cl, 83%
R = 6-Me,8-Br, 75%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1336
МУЛИНА и др.
Схема 48. Возможный путь электросинтеза производных имидазопиридина 76
Ⱥ
ɧɨɞ
Ʉɚɬɨɞ
R
N
H2
R1
N
+2e
75
e
2H+
R
R
N
N
SCN
R1
R1
ii
N
N
SCN
75'
75''
SCN
i
ɚɧɨɞɧɨɟ
ɨɤɢɫɥɟɧɢɟ
R
e
N
R1
N
SCN
SCN
76
Схема 49. Фотокаталитическая реакция между имидазопиридинами 77 и NH4SCN
ɗɨɡɢɧ Y (5 ɦɨɥ %)
N
N
blue LED (425 ɧɦ)
R1
R1
+ NH4SCN
N
N
CH3CN, ɜɨɡɞɭɯ,
R
R
rt, 3 ɱ
SCN
77
78
R1 = H, 93%
R1 = 4-F, 88%
N
N
R1 = 4-Me, 85%
R1 = H, 54%
R1 = 4-Cl, 78%
R1
R1 = CF3, 67%
R1 = 3-NO2, 86%
R1 = 4-CN, 67%
N
N
1
R1 = s-Bu, 69%
R
R1 = 4-OMe, 82%
R1 = 2-OH, 71%
R1 = 4-Ms, 77%
SCN
SCN
N
N
N
N
N
R
N
N
N
SCN
SCN
SCN
R = CN, 61%
SCN
R = Cl, 65%
74%
71%
79%
R = Br, 68%
Широкий ряд монокарбонильных соединений
реакцию также вступали некоторые β-дикарбо-
91 также успешно вступал в реакцию тиоцианиро-
нильные соединения. Ключевой стадией процесса
вания с NaSCN в неразделенной электрохимиче-
является образование α-иодзамещенного кетона в
результате взаимодействия исходного соединения
ской ячейке (схема 58) [79]. NaI и Amberlyst-15(H)
с электросгенерированным I2 с последующим ну-
служили окислительно-восстановительным и кис-
клеофильным замещением иода SCN анионом.
лотным катализаторами соответственно. В резуль-
тате были получены α-тиоцианированные произ-
Тиоцианирование различных карборанов осу-
водные 92 с выходами 15-72%. В обнаруженную
ществлялось в условиях постоянного тока как в
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1337
Схема 50. Электрохимическое тиоцианирование пиразолопиримидинов 79
H
NCS
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
N
R1
N
R1
CPE (E = 0.7 ɢɥɢ Epox ), Pt(+)/Pt(
)
R
R
+ NH4SCN
N
NaClO4 (0.1M ɜ CH3CN)
N
N
N
R2
R2
79
80
Epox - ɨɤɢɫɥɢɬɟɥɶɧɵɣ ɩɨɬɟɧɰɢɚɥ 79
NCS
NCS
NCS
N
R1
N
R1
N
R1
N
N
N
N
N
N
NH2
CF3
R1 = H, 89% (E
ȼ
R1 = CCl3, 60% (E
ȼ R1 = H, 63% (E
ȼ
R1 = Me, 86% (E
ȼ
R1 = CF3, 60% (E
ȼ R1 = Ph, 62% (E
ȼ
NCS
NCS
NCS
NCS
NCS
N
N
N
N
N
S
N
N
N
N
N
N
N
N
N
N
CF3
CCl3
CF3
65% (E
ȼ
60% (E
ȼ
85% (E
ȼ
83% (E
ȼ
75% (E
ȼ
Схема 51. Электрохимическое окислительное кросс-сочетание 2,5-замещенных пиразолин-5-онов 81
с тиоцианатом аммония
R1
O
R1
O
NH4
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
CCE (12 ɦA), C(+)/Pt( )
N
N
+ NH4SCN
CH3CN, 3 ɱ
SCN
N
N
R2
R2
81
82
R1 = H, 95%
R1 = 3-Cl, 81%
R1
O
NH4
O NH4
R1 = 4-Me, 97%
R1 = 3,5-Cl, 70%
R1 = 3,4-Me, 83%
R1 = 4-CN, 81%
N
N
SCN
R1 = 4-F, 93%
R1 = 4-OMe, 60%
SCN
N
N
R1 = 4-Cl, 82%
R1 = 4-OBn, 65%
74%
O
NH4
NH
R2 = C2H5, 61%
R2 = C6H5, 74%
4
O
R2 = C3H7, 60%
R2 = 4-Me-C6H4, 72%
N
N
R2 = Cy, 63%
R2 = 2-Me-C6H4, 70%
SCN
SCN
N
N
R2 = CF3, 90%
R2 = 4-Br-C6H4, 71%
R2
58%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1338
МУЛИНА и др.
Схема 52. Предполагаемый механизм образования оксидов аммония 82
Ⱥ
ɧɨɞ
Ʉɚɬɨɞ
1
R
R1
OH
O
N
N
H2
SCN
N
N
-e
+e
2
R
R2
81
enol-81
2H+
SCN
R1
O
NH4
R1
OH
N
N
A
SCN
SCN
N
N
–e
R2
81'
R2
82
+e
R1
OH
NH4
R1
OH
N
SCN
N
+
N
H
SCN
N
2
R
81''
R2
Схема 53. Фотохимическое тиоцианирование 2-арилхинолин-4-онов 83 тиоцианатом аммония
O
O
ɗɨɡɢɧ Y (5 ɦɨɥ %)
SCN
blue LED (452 ɧɦ)
+ NH4SCN
ɜɨɡɞɭɯ, CH3CN,
N
R
rt, 12 ɱ
N
R
H
H
83
84
O
O
R = H, 91%
R = 4-OBz, 68%
SCN
R = 4-Me, 78%
R = 4-Ph, 62%
SCN
R = 4-OMe, 81%
R = 3-Cl, 65%
R
R = 4-F, 86%
R = 3-Br, 72%
OMe
N
N
H
R = 4-Cl, 94%
R = 3-F, 68%
H
R = 4-Br, 82%
OMe
88%
O
O
O
SCN
SCN
SCN
OMe
N
OEt
Br
H
N
N
H
H
OMe
OMe
OMe
OMe
83%
85%
84%
O
O
O
SCN
SCN
SCN
R = H, 85%
O
R = Me, 62%
R = COOMe, 24%
O
N
N
COOMe
N
R
H
H
H
10%
21%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1339
Схема 54. Взаимодействие 4-(N-метил)-анилинокумаринов 85 с NH4SCN при облучении видимым светом
R1
R2
R1
R2
N
N
12 W blue LED
H
SCN
+ NH4SCN
TFA, 1,4-ɞɢɨɤɫɚɧ
R
R
O2, rt, 12 ɱ
O O
O O
85
86
R = H, 82%
N
R = Me, 54%
N
N
R = H, 62%
R
SCN
R = Cl, 70%
SCN
Cl
SCN
R = Br, 58%
73%
O O
R
O O
O O
Схема 55. Аминотиоцианирование дикарбонильных соединений и их гетероаналогов 87
в условиях фоторедокс-катализа
NH2
Ɏɥɭɨɪɟɫɰɟɢɧ (2 ɦɨɥ %)
O
blue LED
R1
+ NH4SCN
R1
R
R
CH3CN, ɜɨɡɞɭɯ, rt
SCN
87
88
NH2
O
R1 = Me, 92%
R1 = Bn, 86%
NH2
O
R1 = Et, 95%
R1 = C8H17, 90%
OEt
OR1
R1 = i-Pr, 90%
R1 = allyl, 90%
R1 = ɧ-Bu, 82% R1 = propargyl, 88%
SCN
SCN
88%
O
NH2
O
H
H
Cl
OEt
NH2
O
NH2
O
H
H
H
H
SCN
O
O
86%
SCN
SCN
78%
73%
NH2
O
NH2
H
R1
NH2
O
R
OEt
NH2
O
H
SCN
SCN
O
R = Et, 94%
R1 = CN, 95%
O
SCN
R = i-Pr, 80%
R1 = P(O)(OMe)2, 91%
SCN
H
R = C11H23, 78%
R1 = P(O)(OEt)2, 92%
80%
65%
NH2
O
NH2
O
NH2
O
R1
NH2
O
R = COOEt, 87%
S
R
R
R = OPh, 75%
S
OEt
R
SCN
SCN
OEt
R = C6H5, 89%
SCN
R = 4-F-C6H4, 87% R1 = ɧ-Bu, 85%
R = Et, 80%
SCN
68%
R1 = s-Bu, 91%
R = Me, 89%
NH2
O
NH2
O
NH2
O
CN
O
O
O
OEt
SCN
SCN
SCN
94%
74%
40%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1340
МУЛИНА и др.
Схема 56. Электросинтез тиоцианированных енаминов 90
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
NH2
O
O O
S
CCE (12.5 ɦA), Pt(+)/Pt( )
+
NH4+
R
R1
NH4Br (0.5 ɷɤɜ)
R
R1
H2N S
CH3CN, 40°C, 3.5 F/ɦɨɥɶ
SCN
89
90
NH2
O
NH2
O
R1 = OMe, 75%
R1 = Me, 80%
R = ɧ-Pr, 80%
R1 = OEt, 89%
R1 = NHC6H5, 52%
R1
R
OEt
R = i-Pr, 71%
R1 = Ot-Bu, 85%
R1 = NEt2, 59%
SCN
SCN
NH2
NH2
NH2
O
NH2
O
SCN
SCN
N
H
SCN
SCN
O
O
67%
49%
11%
55%
Схема 57. Предполагаемый путь образования тиоциано-енаминов 90 в электрохимической ячейке
Ⱥ
ɧɨɞ
Ʉɚɬɨɞ
S
+
NH4
O
O
H2N S
R
R1
S
+
2Br
89
NH4
H2N S
+e
-e
O
O
Br2
H2 + NH3
R
R1
Br
89'
O
O
O O
R
R1
R
R1
S
S
S
SH
NH2
NH
89''
89'''
NH2
O
NH
O
1
R
R
R
R1
S
SH
S
SH
NH
NH
NH2
O
90''
90'
R
R1
H2S
SCN
90
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1341
Схема 58. Тиоцианирование 91 под действием электрического тока
ɧɟɪɚɡɞɟɥɟɧɧɚɹ ɹɱɟɣɤɚ
O
CCE (10 ɦA), C(+)/C( )
O
2
j
= 4 ɦA/ɫɦ
R3
SCN
+ NaSCN
1
R1
NaI (0.5 ɷɤɜ), A-15(H)
R
EtOH/DMSO/H2O
R3
R2
R2
91
92
O
O
O
O
SCN
SCN
SCN
SCN
R2 = H, 60%
R2 = Me, 70%
R2
15%
50%
45%
OH
OH
Cl
Cl
O
O
SCN
SCN
O
O
O OEt
O OEt
SCN
O
SCN
O
50%
55%
10%
18%
O
O
SCN
R1 = 4-Me, 71% R1 = 4-OMe, 72% R1 = 3-Cl, 62%
R1 = 3-Me, 70% R1 = 4-Cl, 60%
R1 = 4-F, 61%
R1
SCN
35%
разделенных [80], так и в неразделенных электро-
чивающим их применение, является узкий круг
химических ячейках [81]. Полученные тиоциани-
субстратов, представленных в основном соедине-
рованные производные выделяли в виде солей ал-
ниями с кратными связями. Кроме того, для за-
киламмония.
вершения фото- и электросинтеза часто требуется
длительное время.
ЗАКЛЮЧЕНИЕ
Дальнейшее развитие фото- и электрохимиче-
Анализ литературных данных показал, что в
ского тиоцианирования может быть основано на:
последние годы фото- и электрохимическое ти-
1) поиске новых реакций с участием широкого
оцианирование вызывают все больший интерес
круга субстратов; 2) разработке электрохимиче-
химиков, получен большой экспериментальный
ских методов, не требующих разделенной ячейки
материал в этой области. Большинство извест-
или контролируемого потенциала; 3) разработке
ных в настоящее время методов фото- и электро-
фотохимических методов на основе доступных,
синтеза тиоцианатов основаны на использовании
удобных и безопасных фотокатализаторов, рабо-
доступных солей тиоциановой кислоты в качестве
тающих в диапазоне видимого света.
источника SCN. Реакции фотохимического тиоци-
анирования, обсуждаемые в этом обзоре, в основ-
ФОНДОВАЯ ПОДДЕРЖКА
ном протекают при облучении видимым светом.
Работа выполнена при финансовой поддержке
Электросинтез тиоцианатов совершил значитель-
гранта Российского научного фонда (проект № 21-
ный прорыв в последние годы, перейдя от требу-
73-10016).
ющего сложного аппаратного обеспечения элек-
ИНФОРМАЦИЯ ОБ АВТОРАХ
тролиза с контролируемым потенциалом к техно-
логически более простому и масштабируемому
Мулина Ольга Михайловна, ORCID: https://
электролизу в условиях постоянного тока.
orcid.org/0000-0003-0149-4914
Недостатком большинства фото- и электро-
химических методов тиоцианирования, ограни-
orcid.org/0000-0002-6452-0801
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1342
МУЛИНА и др.
Dawane B.S. Synlett.
2018,
29,
1902-1908. doi
orcid.org/0000-0002-6847-6035
10.1055/s-0037-1609553
16. Ji F., Fan Y., Yang R., Yang Y., Yu D., Wang M., Li Z.
Терентьев Александр Олегович, ORCID: https://
Asian J. Org. Chem. 2017, 6, 682-685. doi 10.1002/
orcid.org/0000-0001-8018-031X
ajoc.201700050
КОНФЛИКТ ИНТЕРЕСОВ
17. Mao X., Ni J., Xu B., Ding C. Org. Chem. Front. 2020,
7, 350-354. doi 10.1039/C9QO01174A
Авторы заявляют об отсутствии конфликта ин-
18. Gu Q., Wang Q., Dai W., Wang X., Ban Y., Liu T.,
тересов.
Zhao Y., Zhang Y., Ling Y., Zeng X. Org. Biomol. Chem.
СПИСОК ЛИТЕРАТУРЫ
2021, 19, 2512-2516. doi 10.1039/D1OB00156F
1. Bisogno F.R., Cuetos A., Lavandera I., Gotor V. Green
19. Chen Y., Wang S., Jiang Q., Cheng C., Xiao X.,
Chem. 2009, 11, 452-454. doi 10.1039/B900137A
Zhu G. J. Org. Chem. 2018, 83, 716-722. doi 10.1021/
2. Wang F., Chen C., Deng G., Xi C. J. Org. Chem. 2012,
acs.joc.7b02700
77, 4148-4151. doi 10.1021/jo300250x
20. Nair V., George T.G., Nair L.G., Panicker S.B.
3. Castanheiro T., Suffert J., Donnard M., Gulea M.
Tetrahedron Lett. 1999, 40, 1195-1196. doi 10.1016/
Chem. Soc. Rev. 2016, 45, 494-505. doi 10.1039/
S0040-4039(98)02563-5
C5CS00532A
21. Wu G., Liu Q., Shen Y., Wu W., Wu L. Tetrahedron Lett.
4. James N.R., Jayakrishnan A. Biomaterials. 2003, 24,
2005, 46, 5831-5834. doi 10.1016/j.tetlet.2005.06.132
2205-2212. doi 10.1016/s0142-9612(03)00022-x
22. Pan X.-Q., Lei M.-Y., Zou J.-P., Zhang W.
5. Kameda T., Ono M., Grause G., Mizoguchi T., Yoshio-
Tetrahedron Lett. 2009, 50, 347-349. doi 10.1016/
ka T. J. Polym. Res. 2011, 18, 945-947. doi 10.1007/
j.tetlet.2008.11.007
s10965-010-9492-3
23. Dey A., Hajra A. Adv. Synth. Catal. 2019, 361, 842-
6. Vannini G.L., Dall’olio G., Giori P. Mycopathologia.
849. doi 10.1002/adsc.201801232
1976, 58, 39-47. doi 10.1007/BF00493592
24. Prier C.K., Rankic D.A., MacMillan D.W. Chem. Rev.
7. Romagnoll C., Vicentini C.B., Mares D. Lett. Appl.
2013, 113, 5322-5363. doi 10.1021/cr300503r
Microbiol.
1995,
20,
5-6. doi
10.1111/j.1472-
25. Romero N.A., Nicewicz D.A. Chem. Rev. 2016, 116,
765X.1995.tb00394.x
10075-10166. doi 10.1021/acs.chemrev.6b00057
8. Kokorekin V.A., Terent’ev A.O., Ramenskaya G.V.,
26. Yan M., Kawamata Y., Baran P.S. Chem. Rev. 2017,
Grammatikova N.É., Rodionova G.M., Ilovaiskii A.I.
117, 13230-13319. doi 10.1021/acs.chemrev.7b00397
Pharm. Chem. J. 2013, 47, 422-425. doi 10.1007/
27. Wiebe A., Gieshoff T., Mohle S., Rodrigo E., Zirbes M.,
s11094-013-0973-7
Waldvogel S.R. Angew. Chem. Int. Ed. 2018, 57, 5594-
9. Yaubasarova R.R., Kokorekin V.A., Ramenskaya G.V.,
5619. doi 10.1002/anie.201711060
Petrosyan V.A. Mendeleev Commun. 2019, 29, 334-
28. Karkas M.D. Chem. Soc. Rev. 2018, 47, 5786-5865.
336. doi 10.1016/j.mencom.2019.05.032
doi 10.1039/c7cs00619e
10. El-Sebae A.H., Metcalf R.L., Fukuto T.R. J. Econ.
29. Kitamura T., Kobayashi S., Taniguchi H. J. Org. Chem.
Entomol. 1964, 57, 478-482. doi 10.1093/jee/57.4.478
1990, 55, 1801-1805. doi 10.1021/jo00293a025
11. Hewlett P.S. Ann. Appl. Biol. 1969, 63, 477-481. doi
30. Levy A., Becker J.Y. Electrochim. Acta. 2015, 178,
10.1111/j.1744-7348.1969.tb02843.x
294-302. doi 10.1016/j.electacta.2015.07.127
12. Li C., Long P., Wu H., Yin H., Chen F.-X. Org.
Biomol. Chem. 2019, 17, 7131-7134. doi 10.1039/
31. Kapoor R., Chawla R., Yadav L.D.S. Tetrahedron Lett.
C9OB01340G
2020, 61, 152505. doi 10.1016/j.tetlet.2020.152505
13. Wu D., Qiu J., Karmaker P.G., Yin H., Chen F.-X.
32. Yang S.M., He T.J., Lin D. Z., Huang J.M. Org. Lett.
J. Org. Chem. 2018, 83, 1576-1583. doi 10.1021/
2019, 21, 1958-1962. doi 10.1021/acs.orglett.8b04136
acs.joc.7b02850
33. Wen J., Zhang L., Yang X., Niu C., Wang S., Wei W.,
14. Qiu J., Wu D., Karmaker P.G., Yin H., Chen F.-X.
Sun X., Yang J., Wang H. Green Chem. 2019, 21,
Org. Lett. 2018, 20, 1600-1603. doi 10.1021/acs.
3597-3601. doi 10.1039/c9gc01351b
orglett.8b00342
34. Yang Z., Wang Y., Hu L., Yu J., Li A., Li L., Yang T.,
15. Kadam S.N., Ambhore A.N., Hebade M.J., Kamb-
Zhou C. Synthesis. 2019, 52, 711-718. doi 10.1055/
le R.D., Hese S.V., Gaikwad M.V., Gavhane P.D.,
s-0039-1691486
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
ФОТО- И ЭЛЕКТРОИНИЦИИРУЕМЫЕ ПРОЦЕССЫ ТИОЦИАНИРОВАНИЯ
1343
35. Gao Y., Liu Y., Wan J.P. J. Org. Chem. 2019, 84, 2243-
56. Zhang Y., Gao H., Guo J., Zhang H., Yao X. Chem.
2251. doi 10.1021/acs.joc.8b02981
Commun.
2021,
57,
13166-13169. doi
10.1039/
d1cc05208j
36. Lu F., Zhang K., Yao Y., Yin Y., Chen J., Zhang X.,
Wang Y., Lu L., Gao Z., Lei A. Green Chem. 2021, 23,
57. Chauhan P., Ritu, Preeti, Kumar S., Jain N. Eur. J.
763-766. doi 10.1039/d0gc03590d
Org. Chem. 2019, 2019, 4334-4340. doi 10.1002/
ejoc.201900349
37. Zhang W., Guo J.-T., Yu Y., Guan Z., He Y.-H.
Tetrahedron.
2018,
74,
3038-3044. doi
10.1016/
58. Yi B., Wen X., Yi Z., Xie Y., Wang Q., Tan J.-P.
j.tet.2018.05.007
Tetrahedron Lett. 2020, 61, 152628. doi 10.1016/
j.tetlet.2020.152628
38. Yue H., Nan G. Synlett. 2018, 29, 1340-1345. doi
10.1055/s-0037-1609443
59. Koohgard M., Hosseinpour Z., Sarvestani A.M.,
Hosseini-Sarvari M. Cat. Sci. Technol. 2020, 10, 1401-
39. Chen W., Li T., Peng X. New J. Chem. 2021, 45,
1407. doi 10.1039/c9cy02268f
14058-14062. doi 10.1039/d1nj00532d
60. Ghosh I., Khamrai J., Savateev A., Shlapakov N.,
40. Wang Z.L., Chen J., He Y.H., Guan Z. J. Org. Chem.
Antonietti M., Konig B. Science. 2019, 365, 360-366.
2021, 86, 3741-3749. doi 10.1021/acs.joc.0c02471
doi 10.1126/science.aaw3254
41. Gullapalli K., Vijaykumar S. Org. Biomol. Chem. 2019,
61. Dyga M., Hayrapetyan D., Rit R.K., Gooßen L.J. Adv.
17, 2232-2241. doi 10.1039/c9ob00054b
Synth. Catal. 2019, 361, 3548-3553. doi 10.1002/
42. Hoque I.U., Chowdhury S.R., Maity S. J. Org. Chem.
adsc.201900156
2019, 84, 3025-3035. doi 10.1021/acs.joc.8b03155
62. He D., Yao J., Ma B., Wei J., Hao G., Tuo X., Guo S.,
43. Nadiveedhi M.R., Cirandur S.R., Akondi S.M. Green
Fu Z., Cai H. Green Chem. 2020, 22, 1559-1564. doi
Chem. 2020, 22, 5589-5593. doi 10.1039/d0gc01726d
10.1039/c9gc03797g
44. Li Z., Wang S., Huo Y., Wang B., Yan J., Guo Q.
63. Pan J., Liu C., Wang J., Dai Y., Wang S., Guo C.
Org. Chem. Front. 2021, 8, 3076-3081. doi 10.1039/
Tetrahedron Lett. 2021, 77, 153253. doi 10.1016/
d1qo00126d
j.tetlet.2021.153253
45. Zhang Y.-A., Ding Z., Liu P., Guo W.-S., Wen L.-R.,
64. Sahu K., Mondal S., Mobin S.M., Kar S. J. Org. Chem.
Li M. Org. Chem. Front. 2020, 7, 1321-1326. doi
2021, 86, 3324-3333. doi 10.1021/acs.joc.0c02683
10.1039/d0qo00300j
65. Kokorekin V.A., Neverov S.V., Kuzina V.N., Petro-
46. Chen Y.-J., He Y.-H., Guan Z. Tetrahedron 2019, 75,
syan V.A. Molecules. 2020, 25, 4169. doi 10.3390/
3053-3061. doi 10.1016/j.tet.2019.04.053
molecules25184169
47. Chen Y., Chen Y.-J., Guan Z., He Y.-H. Tetrahedron.
66. Fotouhi L., Nikoofar K. Tetrahedron Lett. 2013, 54,
2019, 75, 130763. doi 10.1016/j.tet.2019.130763
2903-2905. doi 10.1016/j.tetlet.2013.02.106
48. Zeng F.-L., Chen X.-L., Sun K., Zhu H.-L., Yuan X.-Y.,
67. Kokorekin V.A., Sigacheva V.L., Petrosyan V.A.
Liu Y., Qu L.-B., Zhao Y.-F., Yu B. Org. Chem. Front.
Tetrahedron Lett. 2014, 55, 4306-4309. doi 10.1016/
2021, 8, 760-766. doi 10.1039/d0qo01410a
j.tetlet.2014.06.028
49. Tambe S.D., Jadhav M.S., Rohokale R.S., Kshirsa-
68. Fan W., Yang Q., Xu F., Li P. J. Org. Chem. 2014, 79,
gar U.A. Eur. J. Org. Chem. 2018, 2018, 4867-4873.
10588-10592. doi 10.1021/jo5015799
doi 10.1002/ejoc.201800833
69. Chen J., Yang H., Zhang M., Chen H., Liu J., Yin K.,
50. Singh M., Yadav A., Yadav L., Singh R. Synlett. 2017,
Chen S., Shao A. Tetrahedron Lett. 2021, 65, 152755.
29, 176-180. doi 10.1055/s-0036-1590921
doi 10.1016/j.tetlet.2020.152755
51. Krishnan P., Gurjar V.G. J. Appl. Electrochem. 1993,
70. Sun P., Liu P., Cui T., Zhang X., Lin J., Zhu Z. Synlett.
23, 268-270. doi 10.1007/bf00241920
2021, 32, 267-272. doi 10.1055/a-1299-3009
52. Gitkis A., Becker J.Y. J. Electroanal. Chem. 2006, 593,
71. Mitra S., Ghosh M., Mishra S., Hajra A. J. Org. Chem.
29-33. doi 10.1016/j.jelechem.2005.12.011
2015, 80, 8275-8281. doi 10.1021/acs.joc.5b01369
53. Gitkis A., Becker J.Y. Electrochim. Acta. 2010, 55,
72. Kokorekin V.A., Yaubasarova R.R., Neverov S.V.,
5854-5859. doi 10.1016/j.electacta.2010.05.035
Petrosyan V.A. Mendeleev Commun. 2016, 26, 413-
54. Burasov A.V., Petrosyan V.A. Russ. Chem. Bull. 2008,
414. doi 10.1016/j.mencom.2016.09.016
57, 1321-1322. doi 10.1007/s11172-008-0172-y
73. Kokorekin V.A., Yaubasarova R.R., Neverov S.V.,
55. Zhang X., Wang C., Jiang H., Sun L. RSC Adv. 2018, 8,
Petrosyan V.A. Eur. J. Org. Chem. 2019, 2019, 4233-
22042-22045. doi 10.1039/c8ra04407d
4238. doi 10.1002/ejoc.201900390
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022
1344
МУЛИНА и др.
74. Kokorekin V.A., Melnikova E.I., Yaubasarova R.R.,
78. Kang L.-S., Luo M.-H., Lam C.M., Hu L.-M., Litt-
Petrosyan V.A. Mendeleev Commun. 2020, 30, 70-72.
le R.D., Zeng C.-C. Green Chem. 2016, 18, 3767-3774.
doi 10.1016/j.mencom.2020.01.023
doi 10.1039/c6gc00666c
79. Liang S., Zeng C.-C., Tian H.-Y., Sun B.-G., Luo X.-G.,
75. Yuan Y., Li L.S., Zhang L., Wang F., Jiang L., Zuo L.,
Ren F.-z. Adv. Synth. Catal. 2018, 360, 1444-1452. doi
Wang Q., Hu J.G., Lei A. Chem. Commun. 2021, 57,
10.1002/adsc.201701401
2768-2771. doi 10.1039/d1cc00486g
80. Rudakov D.A., Potkin V.I., Lantsova I.V. Russ.
76. Li G., Yan Q., Gong X., Dou X., Yang D. ACS
J. Electrochem. 2009, 45, 813-817. doi 10.1134/
Sustainable Chem. Eng. 2019, 7, 14009-14015. doi
s1023193509070179
10.1021/acssuschemeng.9b02511
81. Rudakov D.A., Shirokii V.L., Potkin V.I., Maier N.A.,
77. Yuan P.-F., Zhang Q.-B., Jin X.-L., Lei W.-L.,
Bragin V.I., Petrovskii P.V., Sivaev I.B., Bregadze V.I.,
Wu L.-Z., Liu Q. Green Chem. 2018, 20, 5464-5468.
Kisin A.V. Russ. Chem. Bull. 2005, 54, 1599-1602. doi
doi 10.1039/c8gc02720j
10.1007/s11172-006-0009-5
Photo- and Electrochemically Initiated Thiocyanation Reactions
O. M. Mulina, O. V. Bityukov, V. A. Vil’, and A. O. Terent’ev*
N. D. Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences,
Leninsky prosp., 47, Moscow, 119991 Russia
*e-mail: terentev@ioc.ac.ru
Received March 5, 2022; revised March 10, 2022; accepted March 12, 2022
An overview of electrochemical and photochemical methods to introduce SCN group is presented in this
review. A survey of the literature from 2010 onwards provides an overview of modern trends in photo- and
electro-chemical thiocyanation procedures. During the indicated period of time, new efficient and scale-up
methods for preparing these compounds were developed. The chemistry of organic thiocyanates has attracted
considerable attention, because these compounds are used in agrochemistry for the design of insecticidal, fun-
gicidal, and bactericidal agents.
Keywords: oxidation, electrosynthesis, photoredox catalysis, thiocyanation, C-S bond formation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 12 2022