ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 4, с. 337-380
ОБЗОРНАЯ СТАТЬЯ
УДК 547.979.733
ОСНОВНЫЕ СТРАТЕГИИ СИНТЕЗА
мезо-АРИЛПОРФИРИНОВ
© 2022 г. О. И. Койфман, Т. А. Агеева*
ФГБОУ ВО «Ивановский государственный химико-технологический университет»,
Россия, 153000 Иваново, Шереметевский просп., 7
*e-mail: president@isuct.ru, tageeva@isuct.ru
Поступила в редакцию 15.11.2021 г.
После доработки 12.12.2021 г.
Принята к публикации 28.12.2021 г.
Мезо-арилпорфирины, как наиболее доступные объекты среди тетрапиррольных макрогетероциклов,
всегда были в центре внимания исследователей практически полезных свойств этих соединений. В связи
с этим история развития их синтеза насчитывает около девяносто лет. За это время выходы в синтезе этих
соединений выросли с 5 до 80%. В обзоре проанализированы пути и методологии различных способов
синтеза мезо-арилзамещенных порфиринов и показаны наиболее эффективные, способные привести в
случае необходимости, к промышленным масштабам их получения.
Ключевые слова: мезо-арилпорфирины, синтез, пиррол-альдегидная конденсация, циклотетрамериза-
ция, стратегии синтеза, смешанно-пиррольная конденсация, альтернативные методы синтеза, микровол-
новой синтез, механохимический синтез, ионные жидкости
DOI: 10.31857/S0514749222040012, EDN: WQOYLM
ВВЕДЕНИЕ
1. ОСНОВНЫЕ МЕТОДОЛОГИИ СИНТЕЗА ТЕТРАПИРРОЛЬНОГО МАКРОГЕТЕРОЦИКЛА
2. АЛЬТЕРНАТИВНЫЕ МЕТОДОЛОГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
интерес к этому классу соединений не случаен.
За последние полвека наука о порфиринах и род-
Тетрапиррольные макрогетероциклические со-
ственных соединениях превратилась в самосто-
единения, самыми известными представителями
ятельную научную область и прочно заняла свои
которых являются «пигменты жизни»: хлорофил-
позиции в химии, физике, биохимии, науке о мате-
лы, бактериохлорофиллы и гемы, участвуют в
важнейших процессах жизнедеятельности, таких
риалах. Накопленный огромный материал в этой
как растительный и бактериальный фотосинтез,
области знаний нашел свое отражение в 45-том-
дыхание, ферментативный катализ, сульфит- и
ном издании «Нandbook of Porphyrin Science» [1],
нитроредукция, метаногенез, и являются источ-
которое позволяет найти необходимую обзорную
ником поддержания жизни на нашей планете.
и справочную информацию по всем ключевым во-
Поэтому постоянный и непрерывно возрастающий
просам этого класса соединений.
337
338
КОЙФМАН, АГЕЕВА
Сочетание в одной молекуле порфирина и его
формильные, пропионильные заместители, обе-
аналогов уникальных фотофизических свойств
спечивающие закрепление их тем или иным об-
с чрезвычайно высокой стабильностью, катали-
разом в нативной полимерной матрице. Синтез
тической активностью в химических, фотохими-
таких соединений очень трудоемок и сопровожда-
ческих и электрохимических процессах, фото- и
ется низкими выходами, а осуществленные синте-
биологической активностью открывает широкие
зы хлорофилла Р. Вудвордом и гемина Г. Фишером
возможности создания новых функциональных
имеют чисто фундаментальное значение. Общий
материалов на их основе: катализаторов практиче-
синтез этих макрогетероциклических молекул,
ски важных процессов, материалов медицинско-
каждый из которых включает около тридцати ста-
го, технического и сельскохозяйственного назна-
дий, является одним из величайших достижений
чения, сенсорных и оптоэлектронных устройств
в органической химии. По сей день хлорофилл и
высокой эффективности, оптических лимитеров,
витамин В12 представляют собой самые сложные
фотосенсибилизаторов, преобразователей солнеч-
когда-либо синтезированные порфирины [21, 22].
ной энергии, оптохемосенсорных материалов и др.
Поэтому биопорфирины групп хлорофилла и гема
[2-5]. Особо важное место сегодня отводится при-
целесообразно выделять из природных источни-
менению тетрапиррольных макрогетероцикличе-
ков: растений, водорослей, крови животных и при
ских соединений для решения медико-биологиче-
необходимости модифицировать [22, 23]. Сегодня
ских проблем. Наряду с прекрасно зарекомендо-
способы выделения тетрапирролов из раститель-
вавшими себя препаратами на основе порфиринов
ного и животного сырья и их целенаправленная
для фотодинамической терапии [6-17] проявление
модификация получили широкое развитие, и мно-
способности этих соединений к инактивции виру-
гообразие методических подходов их получения
сов различной этиологии, в том числе коронови-
из различных источников может стать предметом
руса SARS-CoV-2, открывает перспективу к созда-
отдельного обзора [24-27].
нию новых альтернативных подходов к лечению
Так уникальные свойства хлорофилла а и бак-
лекарственно устойчивых вирусных и бактериаль-
териохлорофилла а открыли широкие возможно-
ных инфекций [18-20].
сти для создания на их основе фотосенсибилизато-
Успешное развитие любых областей примене-
ров для антимикробной и противораковой фотоди-
ния тетрапирролов зависит от надежных методов
намической терапии [6, 7]. Химическая модифика-
синтеза и модификации порфиринов, обладающих
ция боковых заместителей исходного природного
необходимыми для этих целей физико-химически-
макрогетероцикла позволяет существенно повы-
ми и функциональными свойствами и сохраняю-
сить стабильность его производных, увеличить
щих свою стабильность к действию агрессивных
тропность к злокачественным новообразованиям,
сред и внешних условий. Поэтому направленный
улучшить физико-химические свойства
[8-17].
синтез тетрапиррольных макрогетероциклических
Фотосенсибилизаторы на основе производных
соединений заданной структуры или модифика-
хлорофилла «Фотодитазин» и «Фоторан Е6» се-
ция имеющихся порфиринов с целью придания им
годня успешно используются при диагностике и
необходимых физико-химических или функцио-
лечении онкологических заболеваний.
нальных свойств является первоочередным шагом
Пигмент крови, гем, также может быть модифи-
в формировании функциональных материалов, и
цирован путем химических превращений перифе-
создание хороших стратегий синтеза в химии пор-
рических заместителей макрогетероцикла [26-28].
фиринов безусловно остается главной целью на
На основе гематопорфирина, производного гема,
протяжении многих десятилетий.
был получен препарат для фотодинамической те-
Вопросам синтеза, выделения, модификации
рапии и флюоресцентной диагностики «Фотогем».
с самого начала исследований этих соединений
Хотя порфирины, полученные на основе гема бо-
уделялось особое внимание [13-15, 21-29]. Все
лее стабильны, чем пигменты зеленых растений и
природные порфирины являются несимметрично
водорослей, лишенные макромолекулярного окру-
замещенными макрогетероциклами, имеющими
жения они становятся малоустойчивыми к воздей-
на периферии молекулы алкильные, винильные,
ствию среды, света, температуры.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
339
В связи с этим поиск синтетических аналогов и
центре приводят к изменению структуры порфи-
технологичных подходов к синтезу тетрапирроль-
рина и его реакционной способности [38-40].
ных макрогетероциклических соединений открыл
Группа тетраарилпорфиринов, синтетических
огромный класс синтетических порфиринов и их
аналогов природных порфиринов, занимает особое
аналогов, в значительной степени более стабиль-
место среди тетрапиррольных макрогетероцикли-
ных, чем природные.
ческих соединений. Доступность мезо-арилзаме-
В настоящем обзоре мы сосредоточили вни-
щенных порфиринов, их высокая стабильность,
мание на ключевых стратегиях получения синте-
способность к различным химическим превра-
тических порфиринов, основной упор делая на
щениям позволяет использовать эти соединения в
большинстве областей применения [30]. Наиболее
арилпроизводные порфиринов, как наиболее ис-
пользуемые в создании новых функциональных
распространенным и хорошо исследованным пред-
материалов для различных областей науки, техни-
ставителем тетраарилпорфиринов является сим-
метрично замещенный 5,10,15,20-тетрафенилпор-
ки, технологии, медицины [2-5].
фирин (рис. 2) и благодаря этому его фотофизиче-
Сегодня синтетическая химия порфиринов и
ские свойства обеспечивают эталон для сравнения
их аналогов достигла такого уровня, что позволяет
всех других мезо-тетраарилпорфиринов [41-43].
целенаправленно получать тетрапирролы практи-
На сегодняшний день он является самым востре-
чески с любой заданной структурой и свойствами.
бованным и испытанным в большинстве областей
Многочисленные публикации по синтезу и хими-
применения порфиринов и их металлокомплесов.
ческим превращениям порфиринов обобщены в
Введение различных заместителей в фенильные
международных изданиях The Porphyrin Handbook
кольца мезо-тетрафенилпорфина позволяет це-
и Handbook of Porphyrin Science. Наиболее важные
ленаправленно изменять его свойства: раствори-
методические приемы в синтетической химии это-
мость, термическую устойчивость, фотоактив-
го класса соединений отражены в обзорах [29-35].
ность, реакционную способность и формировать
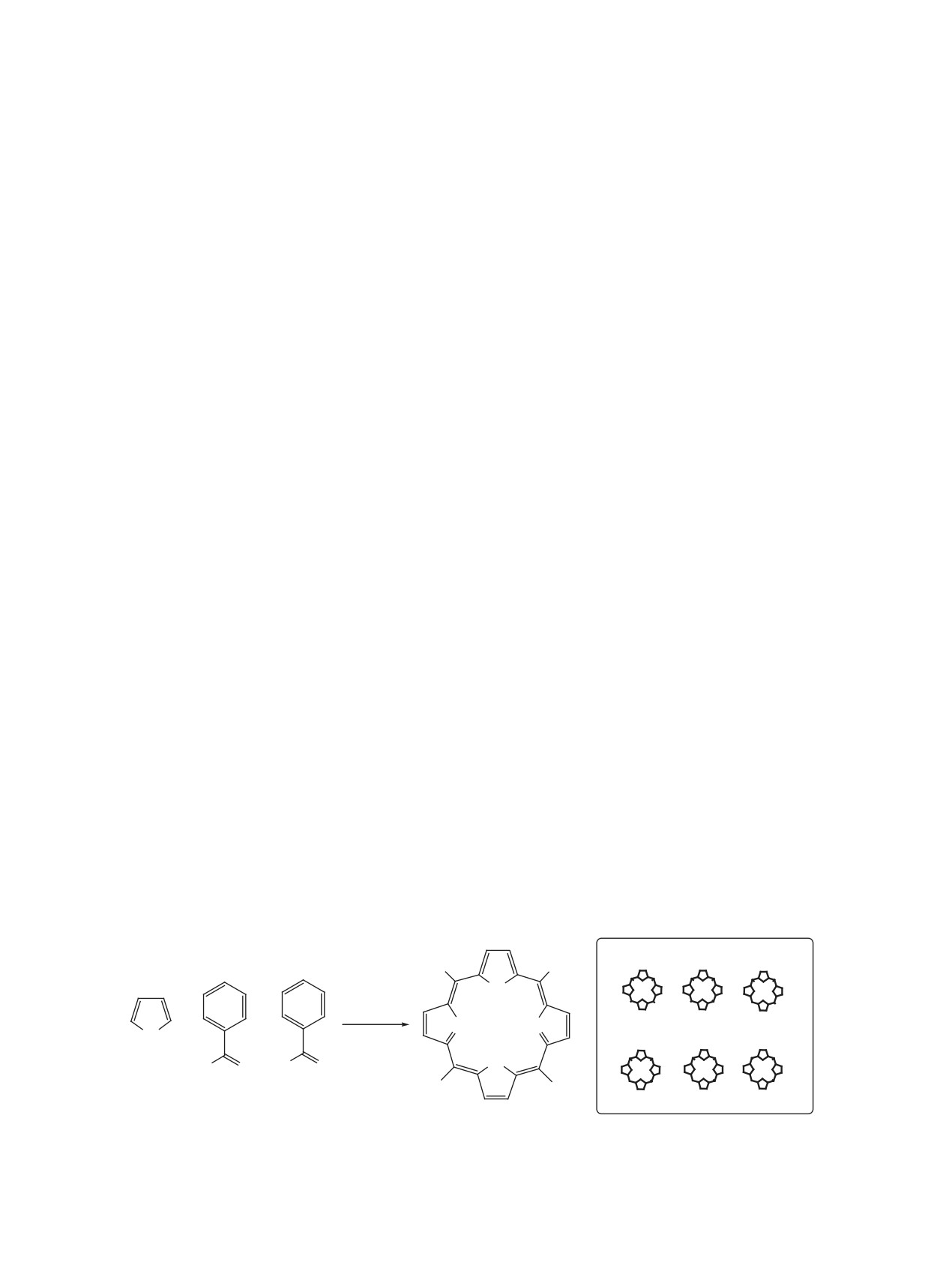
Основу всех тетрапиррольных макрогетеро-
необходимые строительные блоки для создания
циклических соединений составляет макрогете-
функциональных материалов для различных об-
роцил (рис. 1), четыре пиррольных кольца (I-IV)
ластей науки, техники, медицины. Симметрично
в котором связаны метиновыми мостиками (α, β,
замещенные тетраарилпорфирины, которые при-
нято классифицировать как порфирины А4-типа
γ, δ) образующими мезо-положения макрогетеро-
цикла. Положения 2,3; 7,8; 12,13 и 17,18 в пир-
[31], являются наиболее часто синтезируемыми
ролах, называемые β-положениями, могут быть
синтетическими порфиринами. Однако достиже-
ния в прикладной химии тетрапиррольных макро-
заняты различными функциональными группами,
гетероциклов и использование их для различных
определяющими многообразие соединений класса
целей сегодня чаще всего требуют использования
порфиринов. Тетрапиррольный макрогетероцикл
обладает многоконтурным сопряжением, мощной
несимметричных порфиринов. Для большинства
применений в оптике, материаловедении и фото-
хромофорной системой, высокой D4h симметрией.
медицине требуются несимметрично замещенные
Координационный центр порфирина, сформиро-
производные, например, амфифильные системы
ванный четырьмя атомами азота пиррольных ко-
для использования в качестве фотосенсибилиза-
лец имеет характерную полость диаметром 4 Å,
торов [44, 45], донорно-акцепторные системы для
что является идеальным размером для включения
преобразования солнечной энергии [45-48], су-
в него различных ионов металлов с образованием
прамолекулярной химии [49, 50], нелинейно опти-
высокостабильных координационных соединений.
ческих материалов [51-54].
Сегодня синтезированы и эффективно использу-
ются в различных областях применения металло-
Таким образом, интерес к тетрапиррольным ма-
комплексы порфиринов и их аналогов практически
крогетероциклам сместился в сторону использова-
со всеми металлами Периодической системы [36,
ния мезо-замещенных порфиринов со смешанны-
37]. Вместе с тем любые изменения в макрогетеро-
ми типами заместителей и к менее симметричным
цикле, на периферии его или в координационном
системам, которые принято классифицировать по
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
340
КОЙФМАН, АГЕЕВА
R
3'
R
b
R
2'
4'
– мезо-положения макрогетероцикла
2 3
Ar
5'
1'
R
- β-положения макрогетероцикла
20
I
4
5
6'
1
N
meso R
M - координационный центр порфирина
1819
6
R
7
A
IV
A
- аннелирование пиррольных колец
N
M
N
II
17
16
9
8
R
R
- функциональные заместители
15
14
N
10
11
Ar
- мезо-арильный заместитель
III
13
12
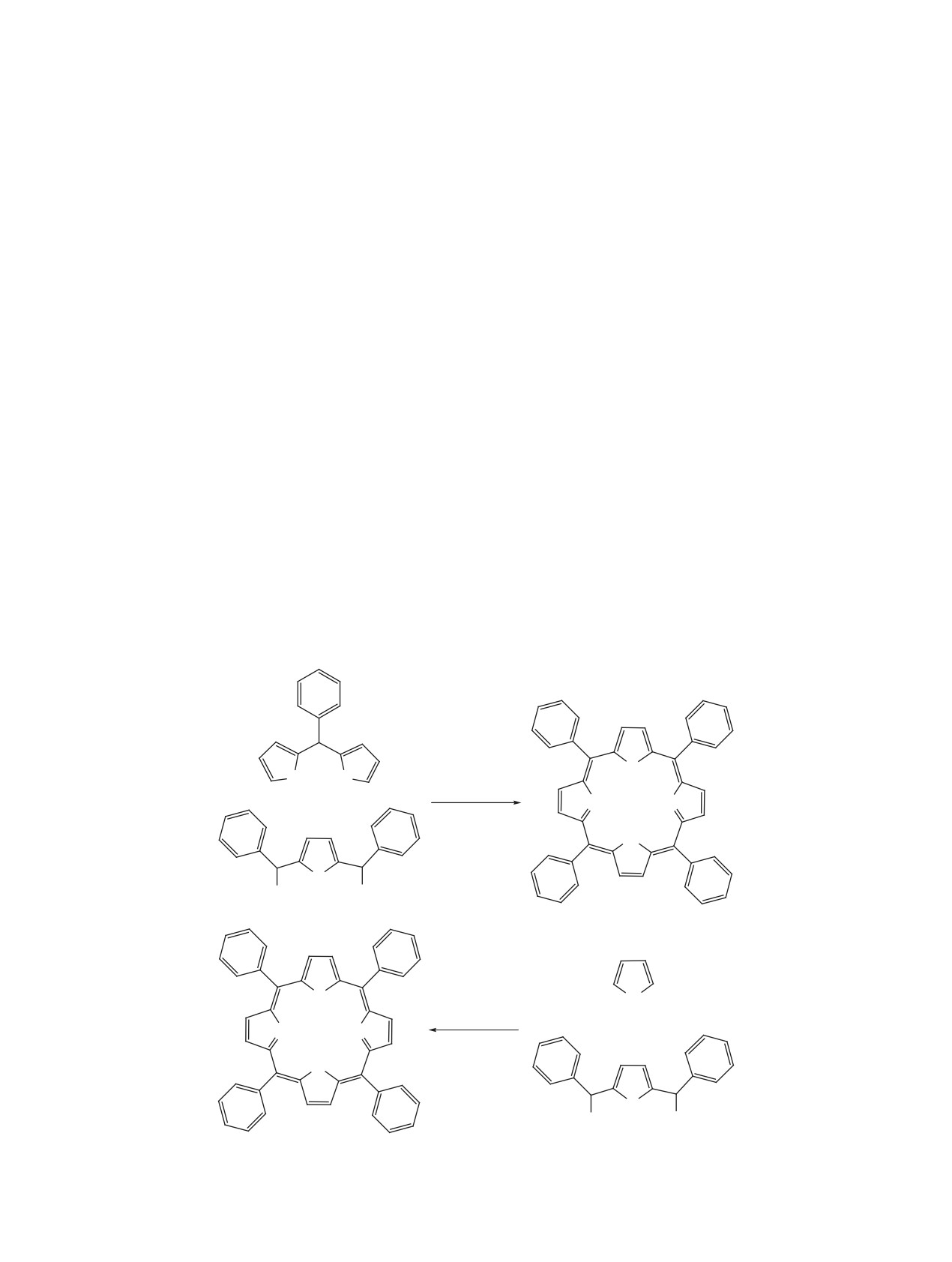
Рис. 1. Основная структура мезо-арилпорфирина и возможные направления функционализации его макрогетероцикла
расположению заместителей относительно тетра-
5,10,15,20-тетраарилпорфиринов в результате
пиррольного макрогетероцикла. Согласно этой
конденсации алифатических, ароматических и
классификации выделяют 10 структурных типов
гетероциклических альдегидов с пирролом в сме-
мезо-замещенных порфиринов с различной сте-
шанном растворителе пиридин-метанол при 145-
пенью и симметрией замещения (рис. 2). Не-
155°С в анаэробных условиях в течение несколь-
симметрично замещенные мезо-арилпорфирины,
ких дней [74-76]. Методология, предложенная П.
особенно моно-замещенные производные, явля-
Ротмундом более 85 лет назад и развитая впослед-
ются удобными структурными блоками для вклю-
ствии А. Адлером, Ф. Лонго [77, 78] и Д. Линдсем
чения их в различные самоорганизованные нано-
[79-81] и др. лежит в основе большинства методов,
размерные системы [55, 56], порфиринполимеры
формирующих порфириновый макрогетероцикл
[57-61], дендримеры [62, 63], гибридные мате-
[29-35]. Основным синтоном тетрапирролов яв-
риалы [64, 65], электрополимеризованные плен-
ляется либо незамещенный пиррол, вступающий
ки порфиринов [64-69], инициирующие системы
в реакцию конденсации с соединениями, способ-
для контролируемой радикальной полимеризации
ными к образованию метиленовых мостиков пор-
[70-72].
фиринового цикла, либо имеющий α-метиленовые
группировки и циклотетрамерамеризующийся в
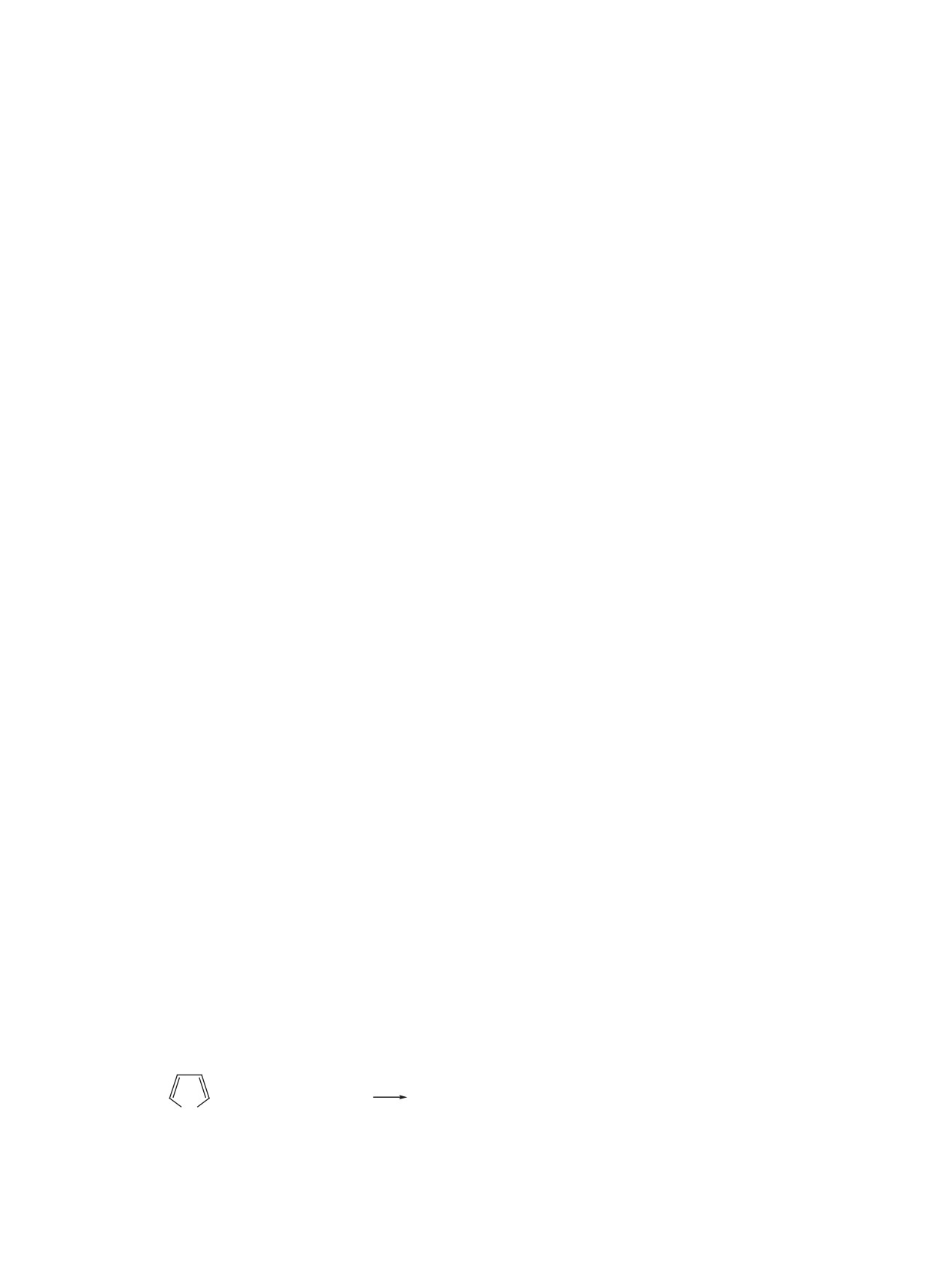
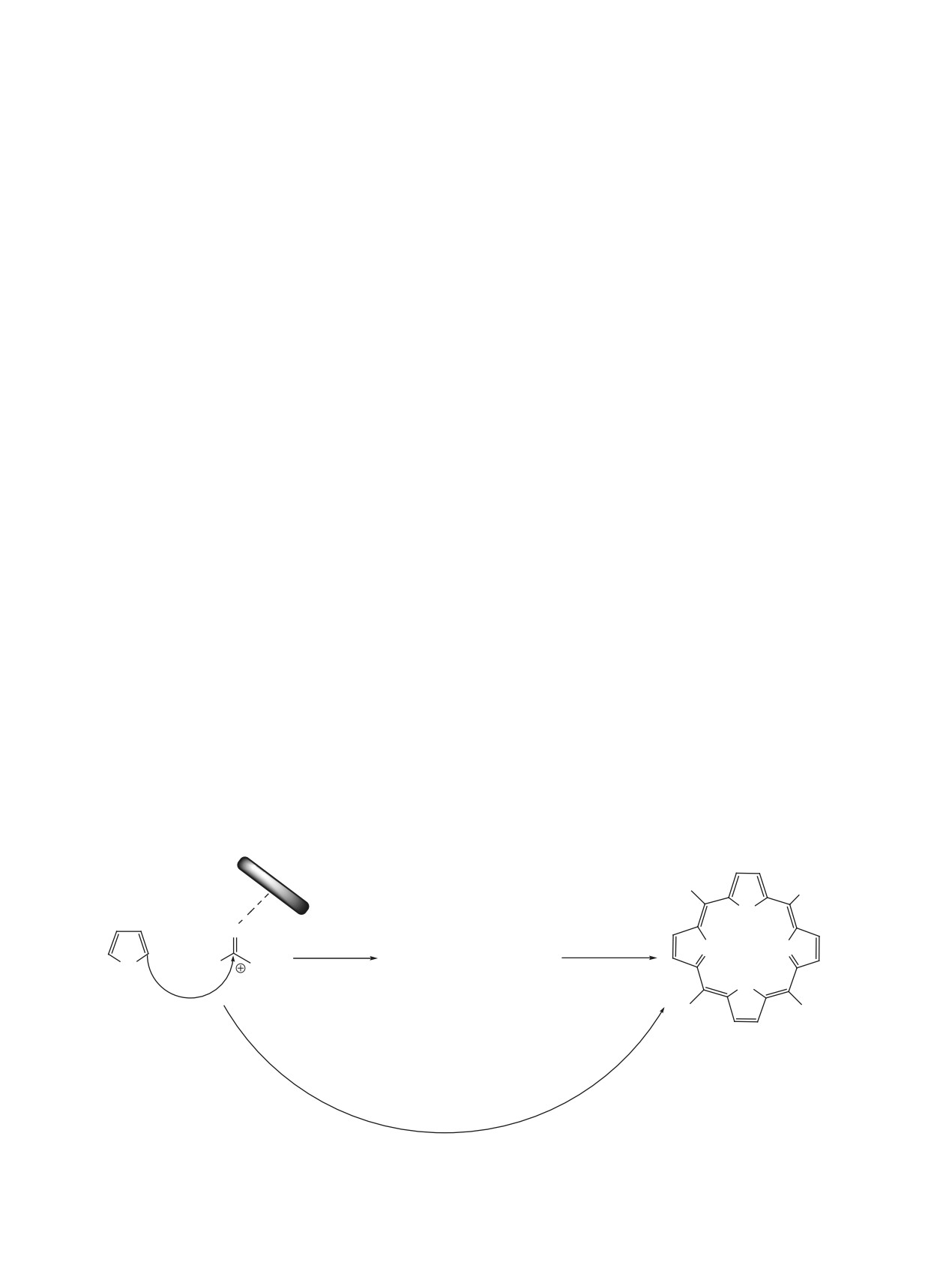
1. ОСНОВНЫЕ МЕТОДОЛОГИИ СИНТЕЗА
макрогетероцикл (схема 1). Необходимые функ-
ТЕТРАПИРРОЛЬНОГО МАКРОГЕТЕРОЦИКЛА
циональные заместители на периферии порфири-
Ключевым моментом в стратегии синтеза пор-
на можно сформировать, включив их в исходный
фиринов является образование тетрапиррольного
пиррол или альдегид. В настоящее время реакци-
макрогетероцикла. Исторически процесс разра-
ей конденсации пирролов с альдегидами получе-
ботки и оптимизации методов синтеза мезо-арил-
но огромное количество порфиринов, имеющих
порфиринов укладывается в почти вековой путь,
самые различные заместители как в β-положениях
отмеченный определенными вехами появления
пиррольных колец, так и в мезо-положениях ма-
важнейших стратегических подходов к форми-
кроцикла.
рованию тетрапиррольного макрогетероцикла
В целом, все стратегии синтеза, используе-
(рис. 3).
мые до настоящего времени, основаны на со-
Синтетическая химия порфиринов берет свое
вершенствовании реакции Ротмунда (схема
1).
начало с получения симметричных тетраарил-
Формирование порфиринового макрогетероцикла
порфиринов. П. Ротмунд впервые получил серию
основано на циклотетрамеризации пиррола или
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
341
N
H
NH N
N
N
H
N HN
N
1
2
A
A
A
A
A
A
A
A
A
A
A
A
3
4
5
6
7
A
A
A
A
A
A
B
B
B
B
B
A
8
9
10
A
A
A
B
B
C
C
D
11
12
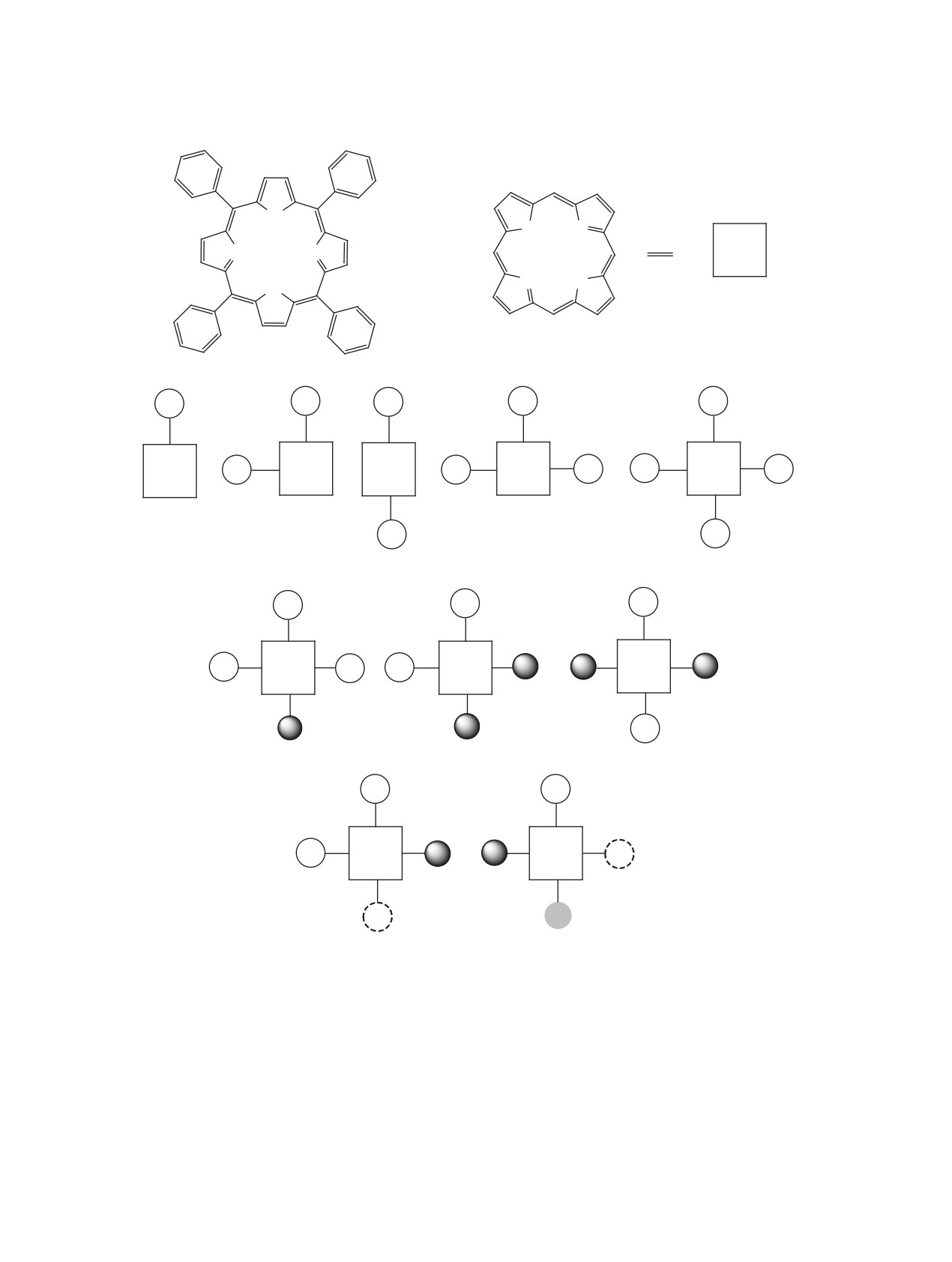
1 - 5,10,15,20-тетрафенилпорфин; 2 - тетрапиррольный остов; 3 - А; 4 - А2-цис; 5 - А2-транс; 6 - А3;
7 - А4; 8 - А3В; 9 - А2В2-цис; 10 - А2В2-транс; 11 - А2ВC; 12 - AВCD.
Рис. 2. Структура возможных типов мезо-арилпорфиринов
его производных и позволяет получить с хорошим
плекс из 1-формилдипиррометана в присутствии
выходом только замещенные порфирины.
окислителя 2,3-дихлор-5,6-дициан-п-бензохинона
(DDQ) и бромида магния с 30-40% выходом [81]
Несмотря на то что успехи в синтезе порфина,
не имеющего заместителей в макрогетероцикле,
синтез родоначальника порфиринов остается «са-
позволяют сегодня получать его магниевый ком-
мым сложным в синтезе тетрапирролов» [82-85].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
342
КОЙФМАН, АГЕЕВА
Выделение, очистка и исследования порфина
сильно осложняются его низкой растворимостью
в органических растворителях. Поэтому наиболее
привлекательным синтетическим порфирином яв-
ляется мезо-тетрафенилпорфин, который не толь-
ко легко получается любым из разработанных к
настоящему времени методов, но и успешно мо-
жет быть модифицирован по любому положению
как в β-пиррольных, так и в фенильных кольцах. В
связи с этим все новые методы синтеза мезо-арил-
порфиринов, оптимизация условий конденсации
пиррола и альдегида, исследования реакций обра-
зования металлокомплесов начинаются с мезо-те-
трафенилпорфина. Очевидно эта тенденция будет
продолжаться и дальше, в первую очередь в созда-
нии и исследовании новых функциональных мате-
риалов на основе тетрапиррольных макрогетеро-
цилов. Поэтому разработка удобной методологии
синтеза этого соединения, повышение входа реак-
ции конденсации пиррола с бензальдегидом, об-
легчение методов выделения и очистки продуктов
реакции, безопасности и экологичности процесса
остается важнейшей задачей в химии тетрапир-
рольных макрогетероциклических соединений.
Проведение реакции монопиррольной конден-
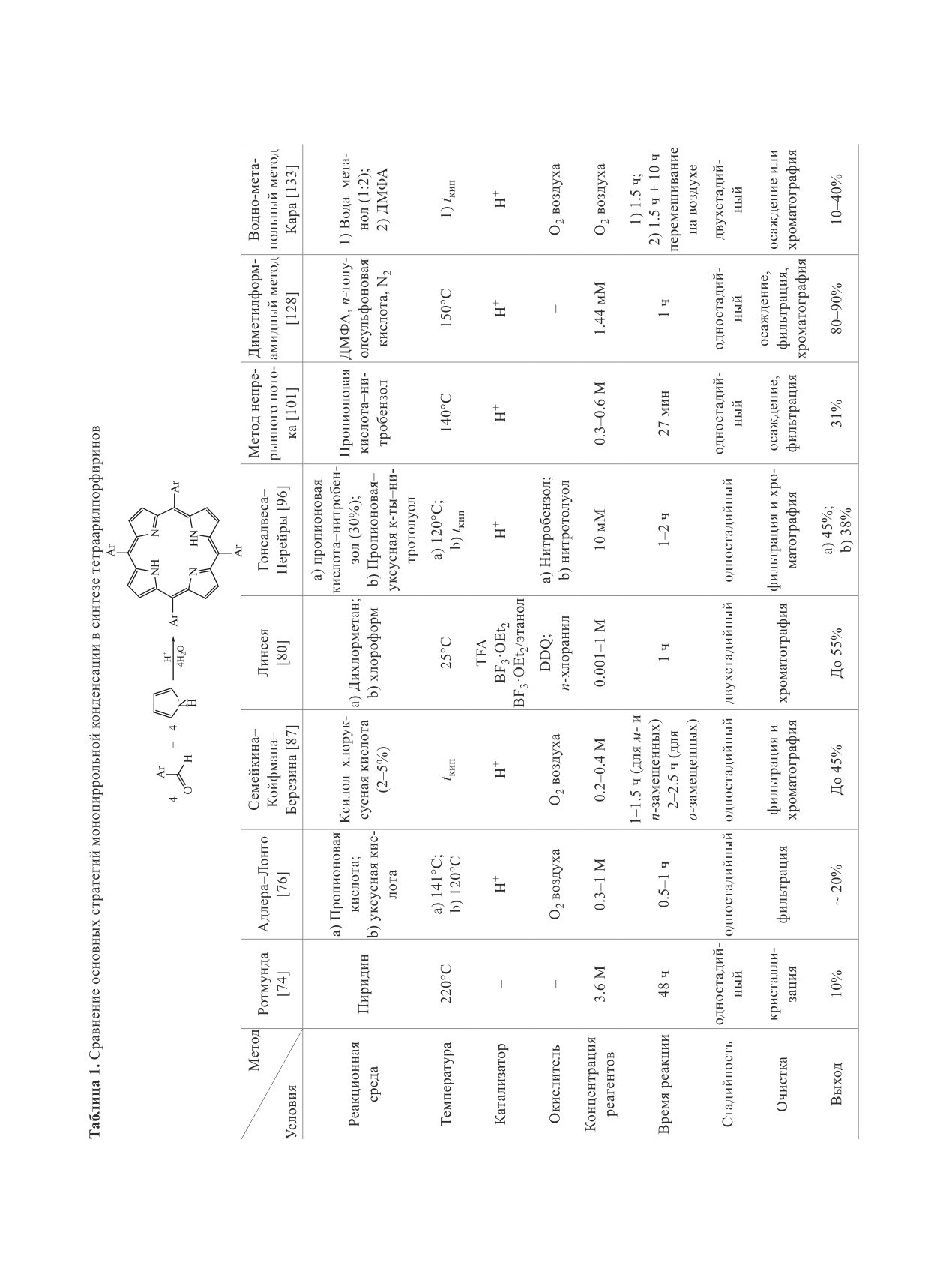
сации по методу Адлера-Лонго (схема 1, табл. 1)
в средах, содержащих кислоту, в присутствии
кислорода воздуха является одним из основных
и доступных одностадийных методов получения
мезо-тетрафенилпорфина и других симметрично
замещенных мезо-арилпорфиринов. Оптимальной
средой для проведения этой реакции являются
уксусная или пропионовая кислоты, а также би-
нарные растворители такие как пиридин-уксус-
ная кислота и некоторые другие кислотные среды
[86]. Оптимизация метода Адлера-Лонго и выбор
удобных сред для проведения реакции конденса-
ции позволили в значительной степени направить
ее в сторону образования тетрапиррола. Так при
использовании стратегии Семейкина-Койфмана-
Березина выход мезо-тетраарилпорфирина в сме-
си ксилол-монохлоруксусная кислота увеличива-
ется в среднем в два раза по сравнению с выходом
в пропионовой кислоте [87-91]. Реакция обычно
проводится при температуре кипения растворите-
ля, иногда при пропускании через реакционную
смесь кислорода воздуха. Выход тетраарилпор-
фиринов зависит от природы альдегида и темпе-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
343
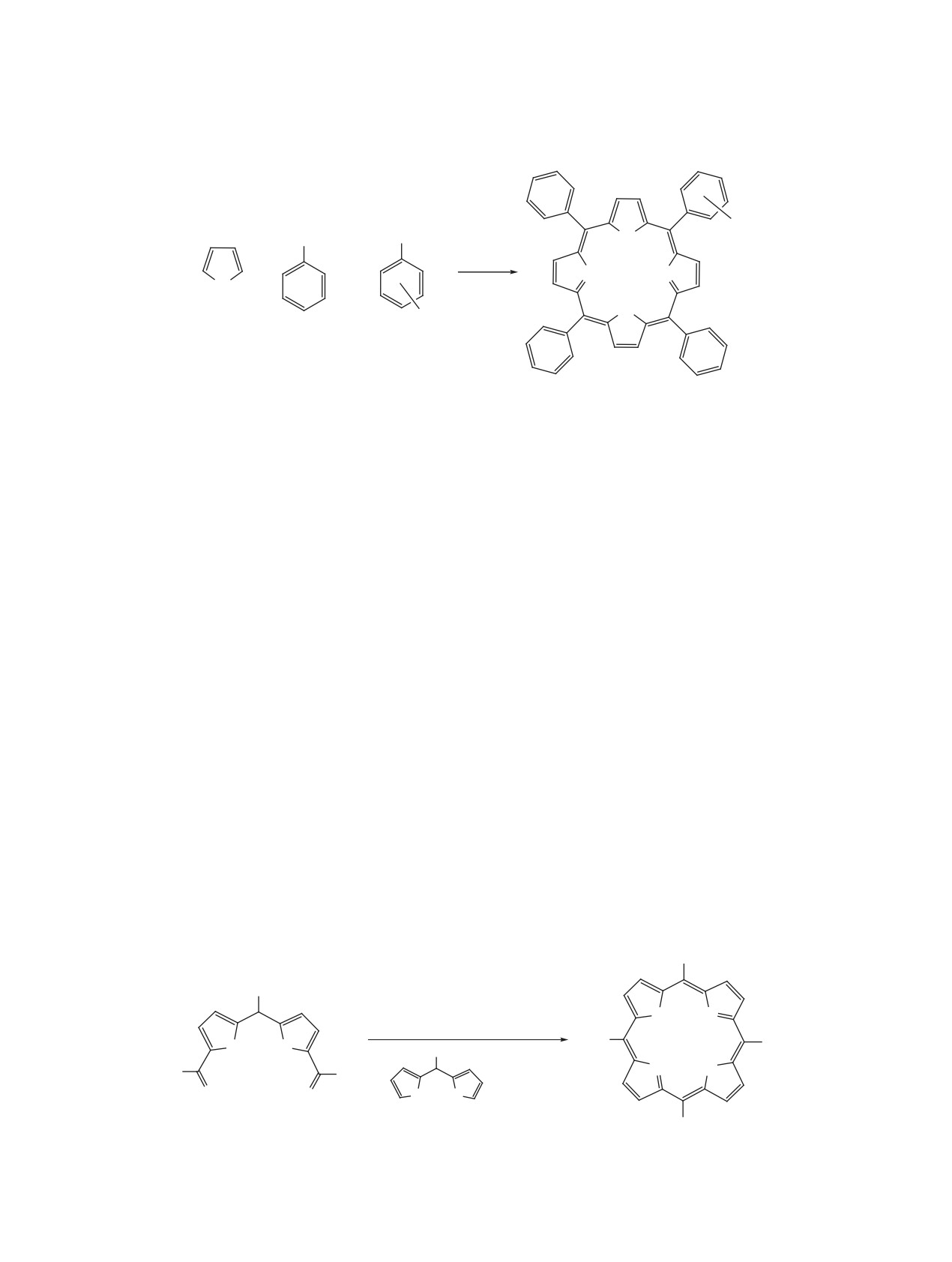
Схема 1
Метод Гонсалвеса
CH3COOH-C6H5NO2,
120°C, 41 ч
Ar
Ar
Ar
Ar
Метод Ротмунда
Py, 140-240°C, 48 ч
N
N
H
H
H
O
H
4
+
4
Ar C
N
N
+
N
N
N
H
Метод Адлера-Лонго
H
H
H
H+, O2 воздуха, кипение,
N
N
H
H
30 мин
Ar
Ar
Ar
Ar
Метод Семейкина-
мезо-арилпорфирин
мезо-арилхлорин
Койфмана-Березина
Ксилол-хлоруксусная кислота,
O2 воздуха, кипение, 1.5 ч
Метод Линдсея
CH2Cl2,
BF3∙OEt2,
CH2Cl2, Δ, 1 ч
rt, 0.5-1.5 ч
DDQ
Ar
H
Ar
H
N
H
NH
HN
H
N
H
Ar
H
Ar
мезо-арилорфириноген
ратуры реакционной среды, и наибольший выход
температурах, многих алифатических альдеги-
реализуется при температурах близких к 140°С
дов и 2,6-дизамещенных бензальдегидов. Синтез
[87-91].
мезо-арилпорфиринов, имеющих в фенильных
кольцах лабильные в кислой среде группы или со-
Метод Адлера-Лонго превосходно себя зареко-
держащие в мезо-положениях макрогетероцикла
мендовал для синтеза в препаративном масштабе
некоторые гетероциклические фрагменты (напри-
порфиринов из альдегидов, которые являются от-
мер, фурановые или пиррольные), требует среды
носительно стабильными. Способность быстро и
высококипящих растворителей таких как пири-
легко получать приблизительно с 20%-ным выхо-
дин, 2,4,6-триметилпиридин (коллидин), или хи-
дом таких порфиринов делает этот метод достаточ-
нолин при атмосферном давлении и присутствия
но доступным и удобным. Однако его применение
кислорода воздуха в качестве окислителя [92].
ограничено при синтезе мезо-замещенных порфи-
ринов из альдегидов, имеющих заместители, не
В условиях реакции кислотной конденсации
выдерживающие действия кислот при высоких
кроме порфиринов могут образовываться соот-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
344
КОЙФМАН, АГЕЕВА
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
345
ветствующие хлорины (схема 1), а в некоторых
(30%) в качестве окислителя образующегося те-
случаях они становятся основными продуктами
траарилпорфириногена (схема 1, табл. 1) [96-99].
реакции [90], однако их можно легко перевести
Преимуществом этого метода является то, что
в соответствующие порфирины обработкой про-
он является достаточно универсальным и позво-
изводными бензохинона: пара-хлоранилом или
ляет синтезировать порфирины прямой конден-
2,3-дихлор-5,6-дициан-п-бензохиноном
(DDQ)
сацией пиррола с альдегидами независимо от их
[91].
природы и типа заместителей. Так, например,
Двухстадийный метод синтеза мезо-замещен-
5,10,15,20-тетракис(3'-гидроксифенил)порфин
ных порфиринов в мягких условиях, предложе-
был получен, используя нитробензольный метод,
ный Д. Линдсеем и сотрудниками [76, 77, 92-94],
с выходом 40% [100], что не удается сделать, ис-
заключается в конденсации эквимолярных коли-
пользуя методологию Адлера-Лонго.
честв пиррола с альдегидом в хлороформе или
С целью оптимизации нитробензольного ме-
хлористом метилене в присутствии трифторук-
тода авторы [101], предложили технологию про-
сусной кислоты, или эфирата трифторида бора в
ведения синтеза мезо-тетраарилпорфиринов в ус-
инертной атмосфере при комнатной температуре
ловиях непрерывного потока. Синтез порфирина
до соответствующего порфириногена с после-
в непрерывном потоке осуществляли с использо-
дующим окислением полученной реакционной
ванием нагреваемого трубчатого реактора из не-
смеси стехиометрическим количеством DDQ или
ржавеющей стали и двухканального шприцевого
пара-хлоранилом (схема 1). Процесс образования
насоса. Реагенты: пропионовая кислота и пир-
порфириногена, представляющий собой процесс
рол+бензальдегид+нитробензол, поступающие из
самосборки, чувствителен к концентрации реа-
разных насосов в зону смешения, перекачивали в
гентов и наибольший выход обычно получается
высокотемпературный трубчатый реактор, чтобы
при использовании 0.01 М. В настоящее время ме-
предотвратить раннюю полимеризацию реагентов.
тод Линдсея считается лучшим методом синтеза
Условия реакции синтеза мезо-тетрафенилпорфи-
мезо-замещенных порфиринов с наивысшим вы-
на были оптимизированы для различных концен-
ходом и широкими возможностями получения
траций исходных соединений, температуры, ско-
порфиринов разнообразной структуры [31-33].
рости потока и определены наиболее оптимальные
Многочисленные исследования влияния усло-
показатели для осуществления монопиррольной
вий реакции конденсации пиррола с бензальде-
конденсации (табл. 1). Скорость потока растворов
гидом и другими ароматическими альдегидами
реагентов составила 0.3-0.6 мл/мин. Порфирины
позволили установить основные закономерности
были выделены простым осаждением из метано-
влияния растворителей, температуры, соотноше-
ла и дальнейшей кристаллизацией из хлористого
ния реагентов, механизм процесса и оптимальные
метилена и метанола. Предложенная технология
условия получения мезо-тетраарилпорфиринов,
позволяет воспроизводимо получать различные
подробно описанные в обзорах [29-35, 92-94].
мезо-арил- и мезо-алкилпорфирины в граммовых
При использовании однореакторного двухстадий-
количествах с выходом реакции, соизмеримым с
ного синтеза Линдсея выход мезо-тетрафенилпор-
классическими методами.
фина может быть достигнут до 50-58% (табл. 1)
Установлено, что рKа среды и тип использу-
[95].
емого кислотного катализатора (органическая
С целью модификации метода Адлера-Лонго и
кислота, кислота Льюиса) являются определяю-
получения свободного от хлорина продукта Роша
щими факторами для эффективной циклотетра-
Гонсалвес с сотрудниками предложили для синте-
меризации пиррола с альдегидом [102]. С целью
за симметричных мезо-замещенных порфиринов
выявления специфической роли кислотного ката-
одностадийный нитробензольный метод, заключа-
лиза в сочетании с химическим окислением про-
ющийся в конденсации пиррола с алифатическими
межуточных продуктов в процессе образования
или ароматическими альдегидами в уксусной или
мезо-тетрафенилпорфина авторы работы
[103]
пропионовой кислоте с добавкой нитробензола
установили, что наиболее эффективная кислот-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
346
КОЙФМАН, АГЕЕВА
ная активация исходных соединений происходит
защищенные группы, возрастает в 10 раз, а необ-
в смешанном растворителе пропионовая-уксусная
ходимые амино- и оксизамещенные порфирины
кислоты, а эффективным окислителем образую-
легко получаются гидролизом соответствующих
щегося порфириногена в кислой среде являются
тетраацетокси- или тетраацетамино-производных
нитробензол, или его производные [104-106]. По
порфиринов.
методу, предложенному в работе [103] и опреде-
Поэтому выбор стратегии синтеза порфирина
ленному авторами как метод смешанного раство-
всегда должен быть сделан с учетом природы заме-
рителя, мезо-тетрафенилпорфин был получен в
стителей тетрапиррольного макрогетероцикла, как
бинарном кислотном растворителе в присутствии
важнейших факторов, оказывающих существен-
м-нитротолуола высокой степени чистоты и с вы-
ное влияние как на выход реакции конденсации
ходом порядка 38%. Причем другие производные
исходных компонентов, так и на спектральные,
нитробензола также являются хорошими окисли-
координационные и другие физико-химические
телями и позволяют получать тетраарилпорфири-
свойства образующихся порфиринов [112, 113].
ны без примеси хлорина с выходом 30% и более
[103] (табл. 1).
Сочетание жесткого тетрапиррольного макро-
гетероцикла и гибких периферических заместите-
Практически в любом из этих методов выход
лей различной природы в тетраарилпорфиринах и
мезо-тетраарилпорфинов сильно зависит от харак-
их металлокомплексах предопределяет тенденцию
тера заместителя в бензальдегидах, используемых
этих молекул к самосборке в упорядоченные су-
в реакциях конденсации с пирролом, и на него
прамолекулярные ансамбли, легко откликающие-
существенно оказывает влияние как стерический
ся на любые внешние воздействия, и обуславлива-
фактор, так и электронная природа заместителей
ющие, тем самым, пути формирования современ-
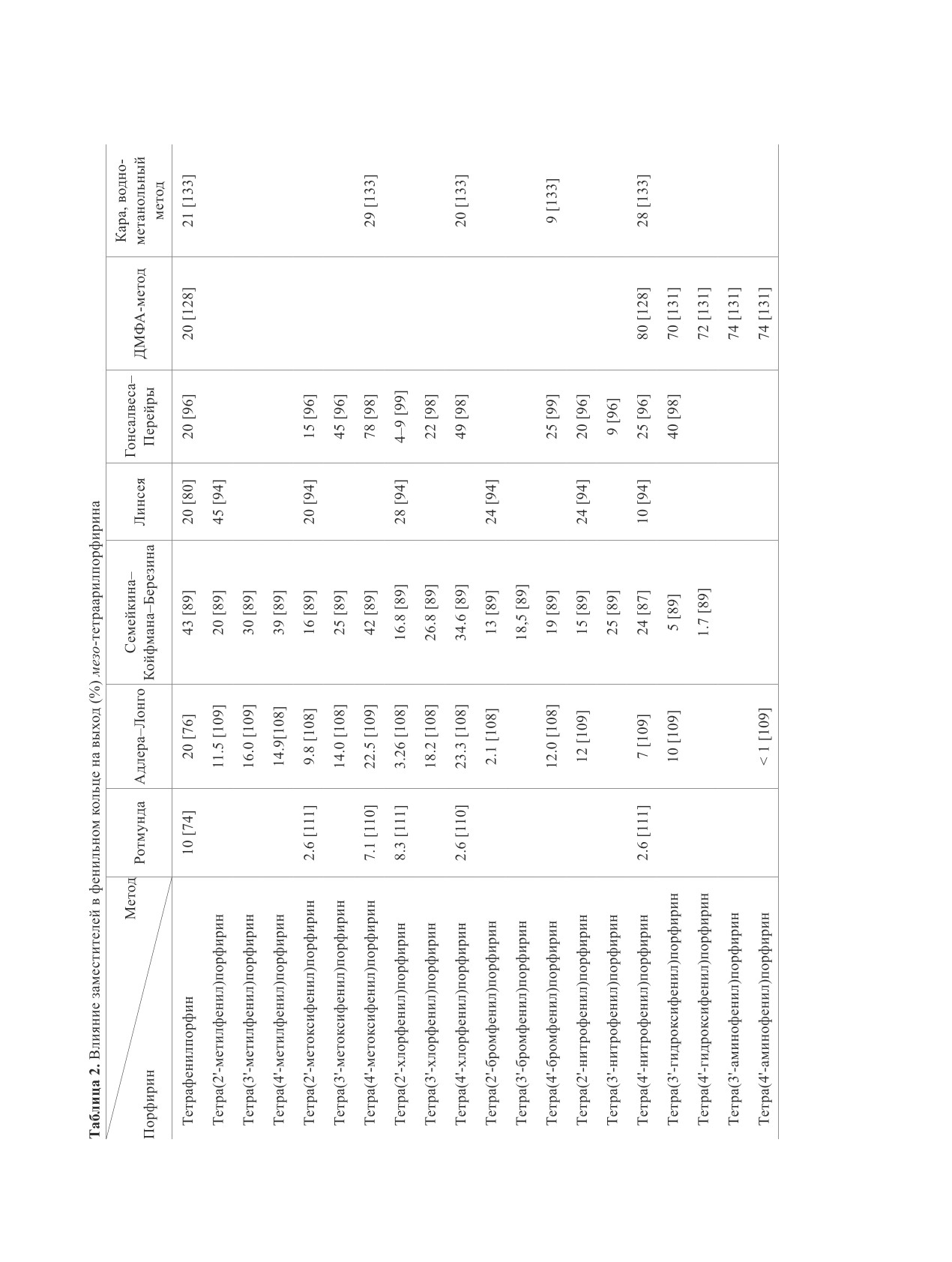
(табл. 2). Анализ многочисленных исследований
ных функциональных материалов и молекулярных
этого влияния показывает, что для пара- и мета-за-
устройств на их основе. Установлено, что симме-
мещенных бензальдегидов влияние стерического
трично замещенные тетраарилпорфирины пред-
фактора в процессе образования тетрапиррольно-
ставляют собой перспективные жидкокристалли-
го макрогетероцикла практически отсутствует и,
ческие материалы [114-116]. С целью определе-
следовательно, можно учитывать действие толь-
ния влияния структуры порфирина на мезогенные
ко электронных эффектов заместителей. В случае
свойства методом алкилирования галогеналка-
орто-замещенных по фенильным кольцам тетраа-
нами тетракисгидроксифенилпорфиринов был
рилпорфинов действие стерических факторов пре-
синтезирован гомологический ряд 5,10,15,20-тет-
валирует над действием электронных эффектов за-
ракис(алкоксифенил)порфиринов (от -OC4H9 до -
местителей [107]. Однако, скорость реакции кон-
OC16H33) [117, 118]. В связи с тем, что прямой ме-
денсации пиррола с ароматическими альдегидами
не всегда коррелирует с выходом порфирина. В ка-
тод конденсации пиррола и гидроксибензальдеги-
честве побочных продуктов могут образовывать-
да по Адлеру не позволяет получить необходимый
порфирин с хорошим выходом и нужной степени
ся линейные полимеры или устойчивые продукты
начальной конденсации пиррола с альдегидом,
чистоты, была применена отмеченная выше стра-
которые препятствуют их циклотетрамеризации и
тегия Р. Гонсалвеса [100], заключающаяся в кон-
образованию тетрапиррола. Так п-нитробензаль-
денсации соответствующего альдегида с пирро-
дегид образует тетра-(4-нитрофенил)порфирин с
лом в среде уксусная кислота-нитробензальдегид
выходом всего 7%, п-аминобензальдегид в резуль-
(3:1) при кипении в течение 2 ч и выдерживании
тате конденсации с пирролом дает тетра-(4-амино-
реакционной смеси при комнатной температуре в
фенил)порфирин с ничтожным выходом 1% [107].
течение 3-х сут. По этой методике 5,10,15,20-те-
Для того, чтобы получить порфирины с актив-
тракис(4'-гидроксифенил)порфин и 5,10,15,20-те-
ными функциональными группами в фенильных
тракис(3'-гидроксифенил)порфин были получены
кольцах в исходных альдегидах следует провести
с выходами 40 и 32%. Отмечено, что из 27 новых
ацилирование окси- или амино-групп. Выход об-
тетракис(алкоксифенил)порфиринов и их метал-
разующегося порфирина из альдегидов, имеющих
локомплексов 4 обладают термотропным и 1 - ли-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
347
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
348
КОЙФМАН, АГЕЕВА
отропным мезоморфизмом в бинарных системах с
Однако, недостатком любого из рассмотренных
толуолом, бензолом и хлороформом. Определена
методов является использование большого коли-
важная роль положения заместителя в фенильных
чества достаточно агрессивных органических рас-
кольцах порфиринов в формировании мезофаз.
творителей и трудоемкость выделения и очистки
Модификация молекулы в результате структурной
целевого порфирина. Поэтому упрощение любой
изомеризации из пара-положения алкоксигрупп в
стадии в процессе получения порфиринов и их ме-
фенильных кольцах в их мета- и орто-положения
таллокомплексов является важнейшей задачей.
приводит к понижению температуры фазового пе-
С целью получения большой серии мезо-за-
рехода. В сериях орто-замещенных порфиринов
мещенных порфиринов, проявляющих антиокси-
обнаружилась мезогенность у гомологов с более
дантную и цитотоксическую активность, А. Фадда
низким числом атомов углерода в алкоксигруппах
и сотрудники предложили новую методологию,
по сравнению с пара-замещенными аналогами.
которая заключается в однореакторной конден-
Установлено, что металлокомплексы мезогенных
сации эквимолярных количеств ароматического
лигандов порфиринов не проявляют жидкокри-
альдегида и пиррола в ДМФА в атмосфере инерт-
сталлических свойств [100, 114].
ного газа в присутствии эквимолярных количеств
толуолсульфоновой кислоты (схема 3) [128-130].
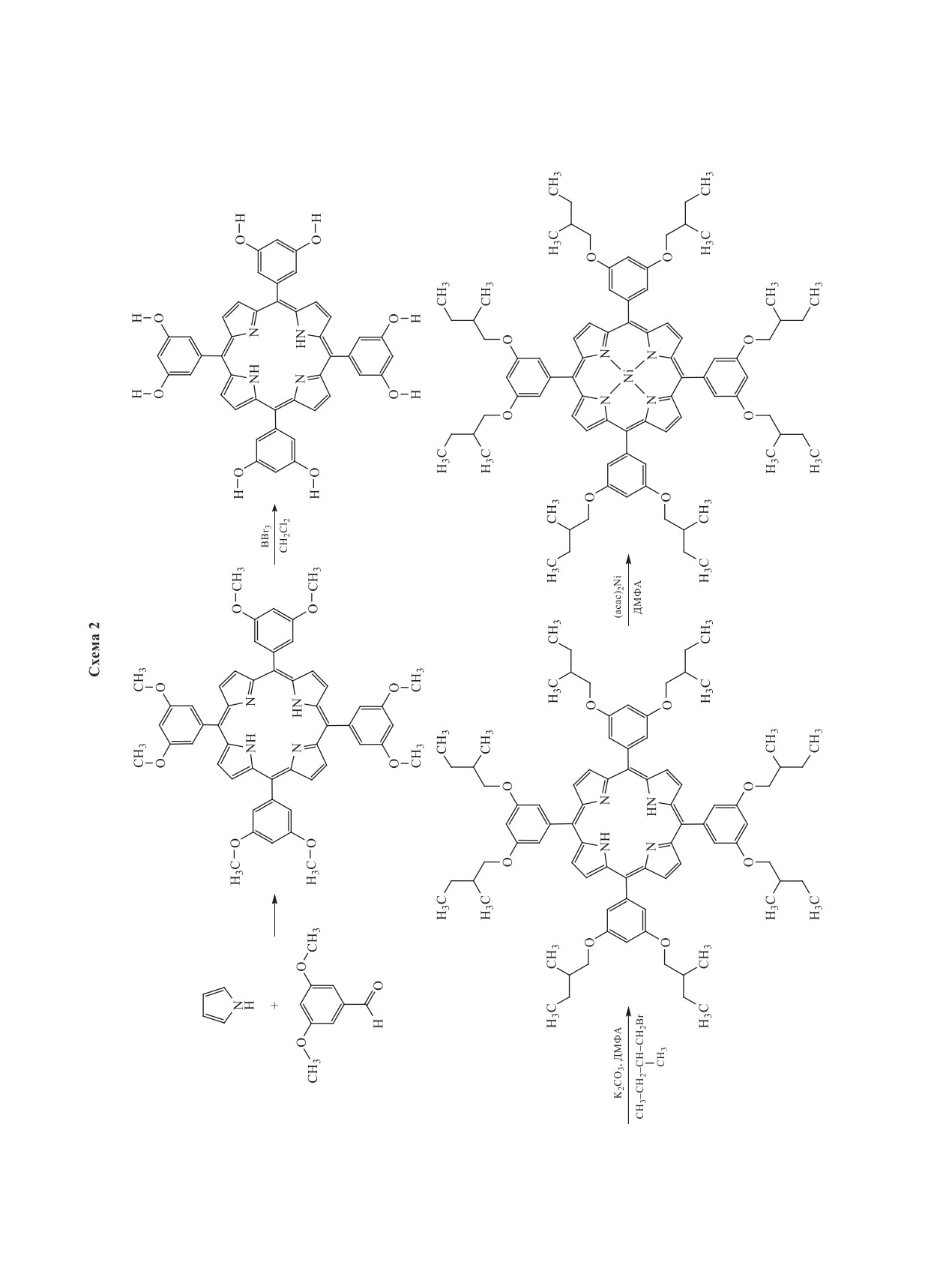
Авторами
[119-121] синтезирован хираль-
Порфирин, образующийся в течение 1-2 мин для
ный никелевый комплекс
5,10,15,20-тетракис-
полноты завершения процесса, выдерживается
[3',5'-ди(2''-метилбутилокси)фенил]-порфина
при 150°С в течение часа, после чего охлажденная
(схема 2), исследованный в качестве допанта не-
реакционная масса выливается в ледяную воду и
матических смесей на основе сильнополярных
выпавший в осадок порфирин собирается путем
алкоксицианобифенилов и эвтектической сме-
фильтрования.
си слабополярных оснований Шиффа [119]. Об-
наружены аномальные температурные зависимо-
Установлено, что выход и скорость конденса-
сти компонент диэлектрической проницаемости
ции зависят от концентрации п-толуолсульфоно-
ЖК растворов, обусловленные конкуренцией меж-
вой кислоты, растворителя, температуры и нали-
ду допантом, закручивающим мезофазу, и магнит-
чия кислорода в атмосфере, а также начальной
ным полем, стремящимся раскрутить спираль.
концентрации реагентов. Авторы [128-130] убе-
дительно показали, что диметилформамид являет-
Никелевый комплекс 5,10,15,20-тетракис[3',5'-
ся наиболее подходящей средой для конденсации
ди(2''-метилбутилокси)фенил]-порфина, был ис-
пиррола с альдегидами. В присутствии ДМФА в
пользован в качестве стационарной фазы для газо-
реакционной среде образуется комплекс с началь-
вой хроматографии. При хроматографическом раз-
ными продуктами конденсации (схема 4), предот-
делении изомерных 3,5- и 3,4-лутидинов он проя-
вращающий образование полимерного пиррола
вил высокую структурная селективность и показал
и приводящий в итоге к образованию тетрапир-
широкий рабочий интервал температур от 20°С до
рольного макрогетероцикла. Использование дру-
350°С [120, 121].
гих растворителей, способных выступать в роли
защитной группы, дает промежуточный комплекc
Таким образом, однореакторная стратегия мо-
преимщественно полимеризающийся в смолоо-
нопиррольной конденсации, стала основной для
бразные труднорастворимые продукты [128].
формирования тетрапиррольных макрогетероци-
клов, а варьирование условий этого процесса по-
Предложенный метод привлекает внимание
зволило получать с использованием этой методо-
прежде всего высоким выходом порфирина и
логии различные порфириноиды [122]: корролы
возможностью прямой конденсацией альдегида
[123, 124], инвертированные порфирины [125],
с пирролом получать порфирины, которые невоз-
сапфирины [126], расширенные порфирины [127],
можно получить другими методами. Все порфи-
и метод Ротмунда-Адлера-Лонго-Линсея можно
рины были получены с выходом 75-82% (табл. 1),
считать универсальным для получения синтетиче-
и, что немаловажно, метод выделения порфирина
ских порфиринов и порфириноидов.
осаждением его на лед значительно облегчает этот
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
349
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
350
КОЙФМАН, АГЕЕВА
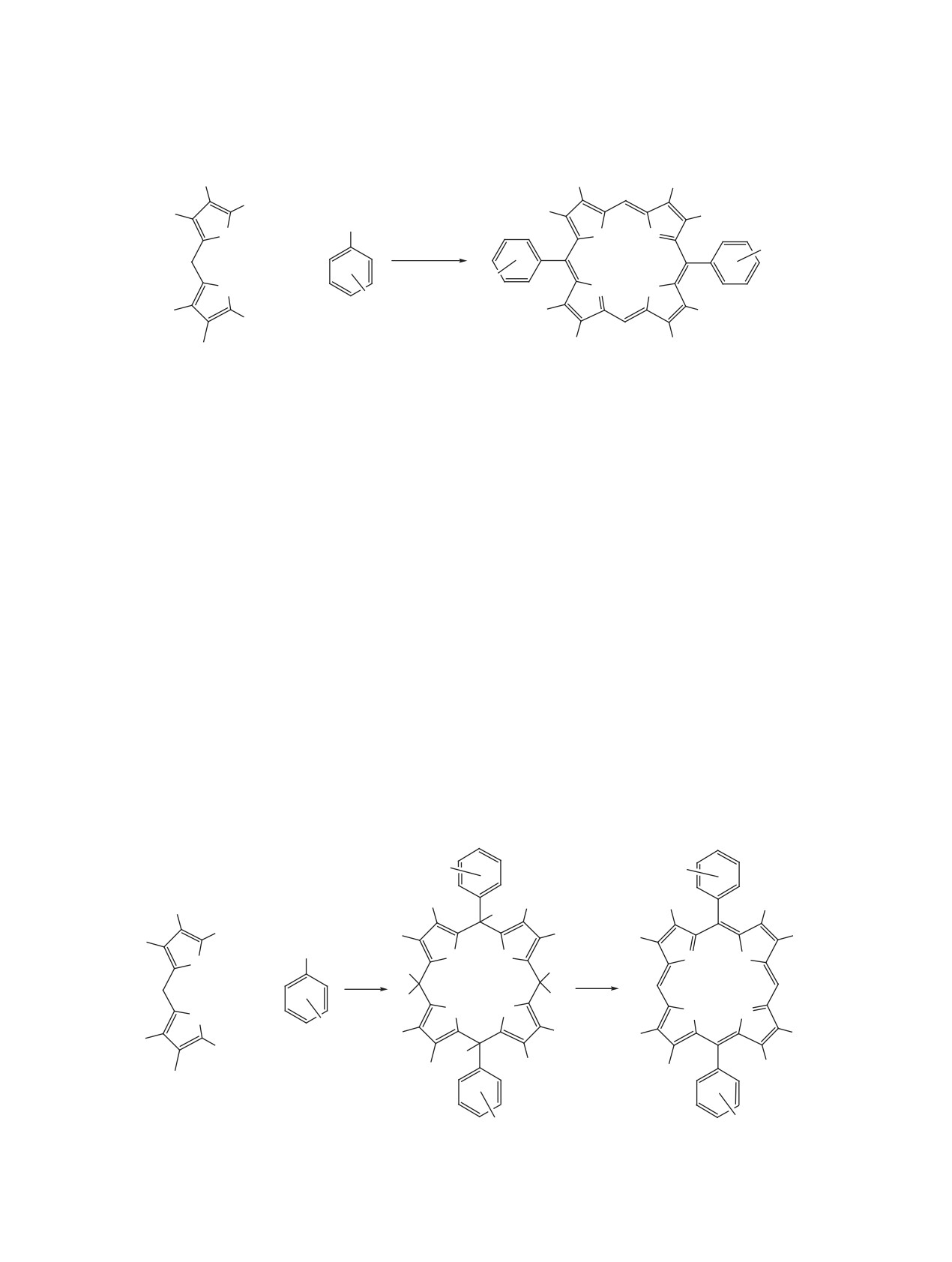
Схема 3
Ar
Ar
H
H+
+
N
C
N
Ar
O H
HO H
H
H
OH
N
H
H
Ar
N
N
-H+
N C Ar
-H2O
N
C
H
H
H
H
H
Ar
H
O
H H
Ar
Ar
O H
NH N
Ar
Ar
N HN
Ar
процесс, упрощает и ускоряет очистку конечного
порфирины, которые невозможно синтезировать
соединения [131, 132]. Кроме того, этот метод по-
другими методами или они получаются с очень
низким выходом (табл. 2).
зволяет получать путем прямой конденсаци аль-
дегида с пирролом порфирины, такие как тетра-
Новая методология синтеза мезо-арилпорфи-
гидроксифенилпорфирины или тетрааминофенил-
ринов симметричного и асимметричного строе-
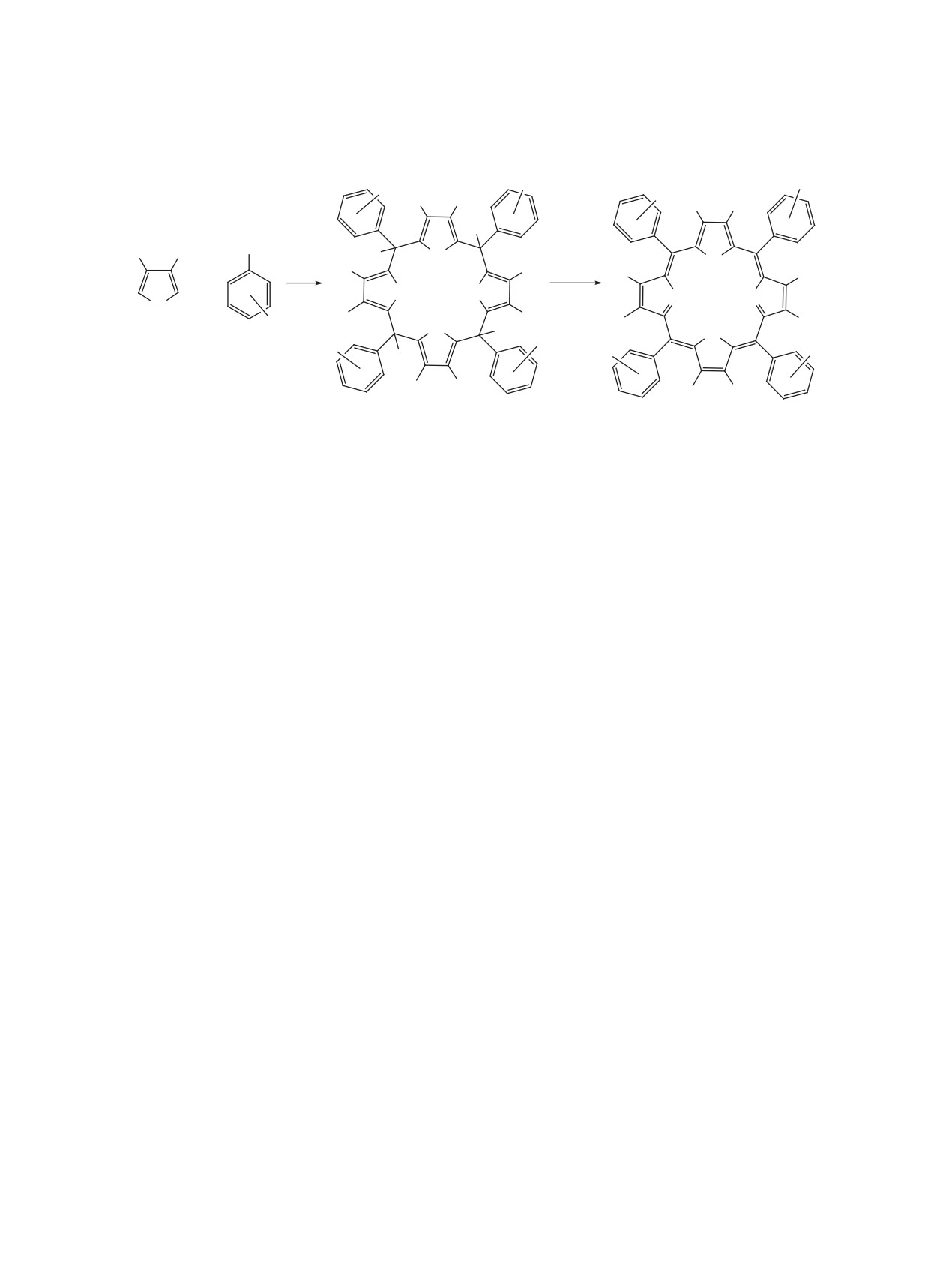
Схема 4
Предполагаемая роль ДМФА как защитной группы в процессе образования порфирина [128]
OH
H
O+
2
H
OH H
+
H
H+
N
N
N
O
H+
H
H
H
H
N
-H+
R
R
R
H
H
-H2O
H
CH3
H
CH3
N
R
N+
O CH3
O
H
CH3
H
N
+
−ДМФА
H
H
N
H
H
N
R
NH HN
R
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
351
ния, представляющая собой простой двухстадий-
Однако в этом случае в зависимости от выбран-
ный метод, разработана в 2020-21 году С. Каром
ной соли металла получается соответствующий
и сотрудниками [133, 134]. Первый этап включает
металлокомплекс порфирина [139]. Этот подход,
конденсацию пиррола или дипиррометана и аль-
позволяющий однореакторно провести две стадии
дегида в смеси H2O-MeOH с использованием HCl
получения металлопорфирина: тетрамеризацию
(схема 5) Раствор осадка в диметилформами-
пиррола и включение иона металла в координаци-
де, полученного на первой стадии, окисляли при
онный центр макрогетероцикла, дает существен-
кипячении в течение 1.5 ч и последующем пере-
ные преимущества в случае, когда для области его
мешивании в течение ночи на воздухе при комнат-
использования требуется металлокомплекс. Для
ной температуре. Последующая очистка методами
получения безметального порфирина необходима
хроматографии или перекристаллизации позволи-
стадия обработки полученного соединения кисло-
ла получить порфирин высокой степени чистоты.
той для разрушения комплекса, и в этом случае в
качестве темплата следует выбирать соль металла,
Достоинство предложенного метода состоит
дающую достаточно лабильный металлопорфи-
в том, что он не требует дорогостоящих и агрес-
рин, легко подвергающийся диссоциации в мягких
сивных окислителей таких как DDQ или п-хлор-
условиях [140].
анил, большого объема сухих хлорсодержащих
растворителей. В отличие от ранее используемых
Авторы
[141] предложили однореакторный
классических методологий, предложенный метод
метод синтеза кобальтового комплекса тетраме-
прекрасно масштабируется и идеально удовлет-
токсифенилпорфина с более высоким выходом в
воряет потребности в производстве мезо-арилпор-
хлорбензоле с пропионовой кислотой при темпе-
фиринов симметричного и несимметричного стро-
ратуре 130°С и в присутствии ацетата кобальта.
ения в граммовом масштабе. Выход порфиринов
Выход реакции составил до 38%. Причем иссле-
в водно-метанольном методе не самый высокий и
дования кинетики реакции конденсации пиррола с
составляет 10-40% в зависимости от выбранного
анисовым альдегидом показали, что ион кобальта
арилальдегида, однако он хорошо воспроизводит-
не работает в качестве шаблона в этом методе, и
ся, позволяет получить чистый порфирин, не тре-
поэтому добавлять соль металла необходимо по-
бующий в ряде случаев даже колоночной хромато-
сле того, как образовалось основное количество
графии.
тетрапиррола. Механизм действия соли металла в
Используя соли металлов как темплат, подобно
синтезе металлопорфиринов пока не ясен, но и в
фталоцианинам [135-137], удается повысить вы-
случае синтеза металлопорфиринов однореактор-
ход тетрапиррольного макрогетероцикла в реак-
ным методом с использованием диметилформа-
ции конденсации пиррола с бензальдегидом [138].
мидной стратегии [142-144] увеличение выхода
Схема 5
R
N
H
R
NH N
R
R
(I) H2O, CH3OH, HCl
или
+
(II) ДМФА, кипячение, 1.5 ч, О2 возд.
N HN
R
CHO
R
NH HN
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
352
КОЙФМАН, АГЕЕВА
Схема 6
Ar
NH N
EtOH, MX2, кипячение, 6-8 ч
Ar
Ar
Ar
N
HN
N
N
Ar
M
Ar
Ar
(I) ДМФА,
N
N
п-толуолсульфоновая к-та,
перемешивание 1 ч
+
Ar CHO
(II) ДМФА, МХ2, кипячение, 8 ч
Ar
N
H
макрогетероциклического соединения или его ме-
(схема 8) [149-151]. Темплатный синтез симме-
таллокомплекса достигается при последователь-
тричных металлокомплексов тетрабензопорфири-
ном добавлении реагентов (схема 6).
на и их производных осуществляется путем на-
гревания смеси порошкообразного фталимида или
Однако стратегия темплатного синтеза является
его щелочных солей с ацетатами цинка в инертной
определяющей в формировании тетрапиррольно-
атмосфере. Безметальные порфирины могут быть
го макрогетероцикла тетрабензопорфиринов и их
получены обработкой растворов их цинковых ком-
мезо-тетраарилпроизводных [145, 146]. Основным
плексов соляной кислотой. Использование арилук-
подходом к формированию структуры этой груп-
сусных кислот в этой методологии открыло путь
пы порфиринов являются высокотемпературная
к получению тетраарилтетрабензопорфиринов
темплатная тетрамеризация производных фта-
(ТАТБП) с различными заместителями в фениль-
левой кислоты с нуклеофильными реагентами,
ном кольце [152, 153].
являющимися источниками атомов углерода в
мезо-положениях макрокольца (схема 7) [147, 148],
Метод высокотемпературной темплатной кон-
и низкотемпературная сборка порфириновой си-
денсации производных изоиндола с арилуксусны-
стемы с использованием устойчивых насыщенных
ми кислотами подходит с некоторыми ограничени-
аналогов изоиндола и альдегидов c ароматизацией
ми для получения тетрабензопорфиринов, содер-
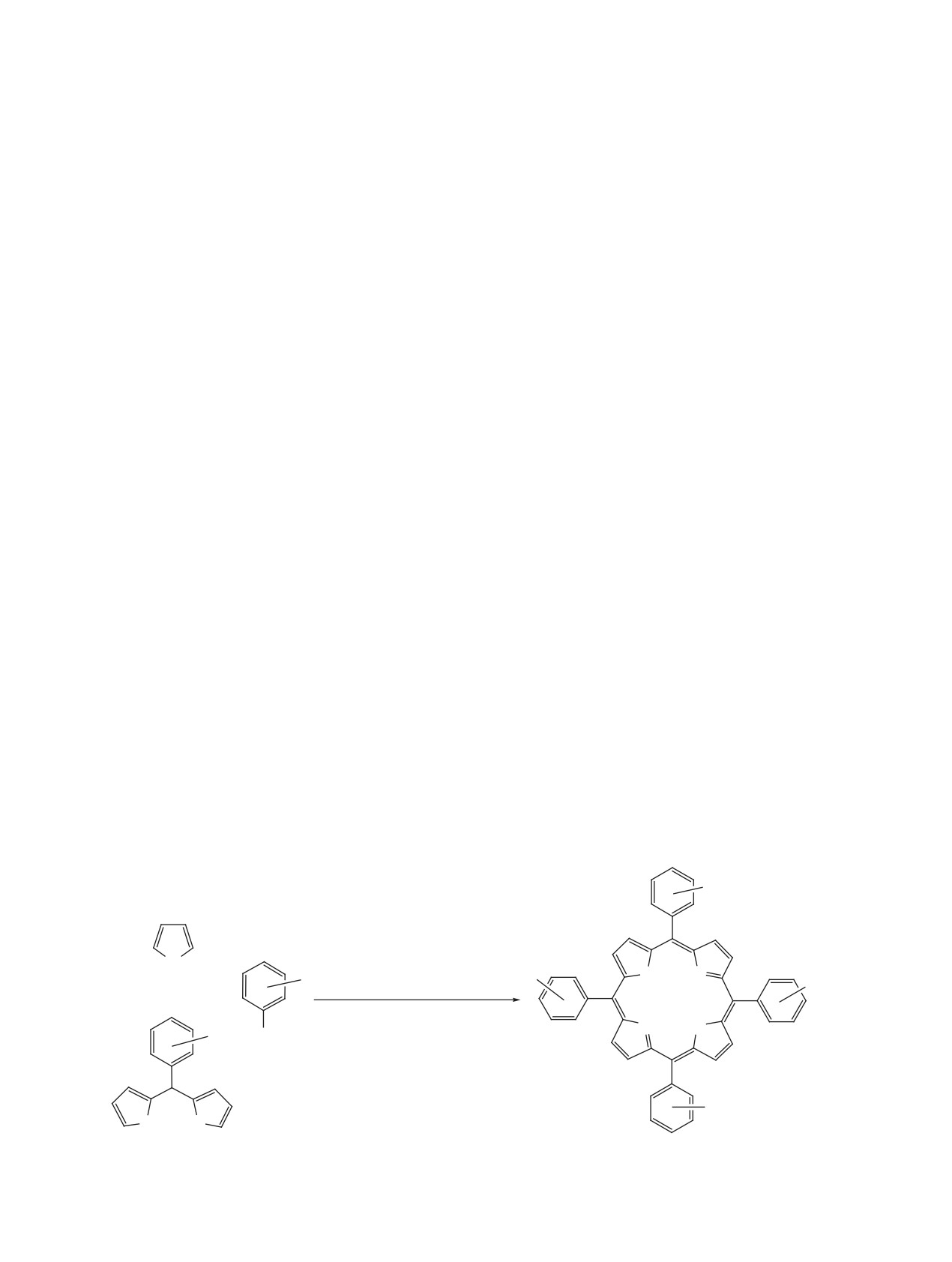
макрогетероцикла на последних стадиях процесса
жащих функциональные группы в изоиндольных
Схема 7
O
CH2COOH
N
N
Zn(HCOO)2
4
NH
+
4
Zn
N
N
O
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
353
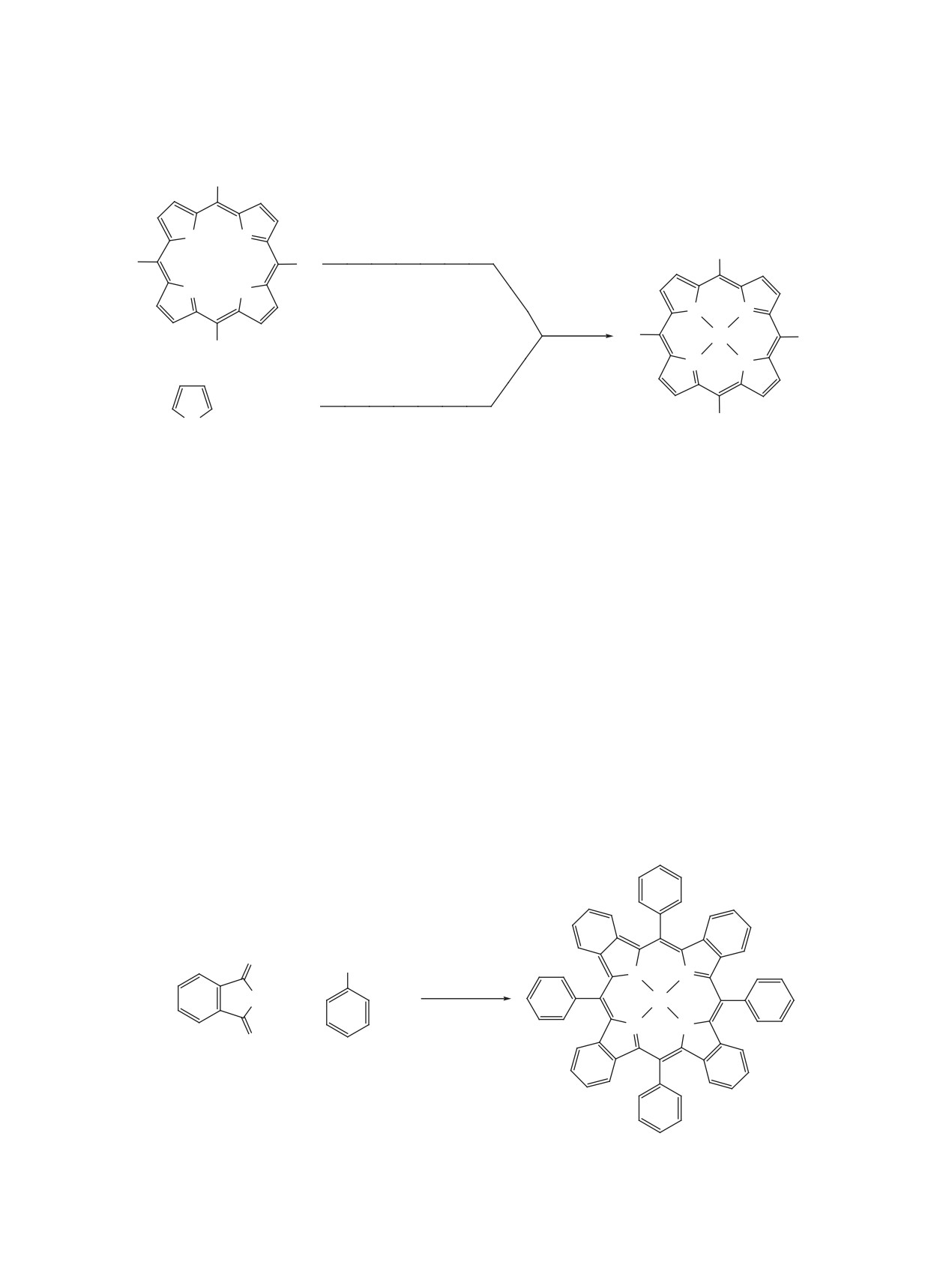
Схема 8
Ph
X
N
N
BnCO2H, ZnO
NH
Ph
Zn
Ph
N
N
X
Ph
X = S, NH; t = 290°C (X = S) или 270°C (X = NH).
фрагментах, которые связаны в основном с труд-
Метод конденсации тетрагидроизоиндола с
нодоступностью замещенных фталимидов и с неу-
ароматическим альдегидом включает в себя много
стойчивостью многих из них к действию высоких
этапов. Хотя выходы целевых продуктов на каждом
температур.
этапе достаточно высоки, общие выходы металло-
комплексов по отношению к исходному сульфоле-
Все используемые способы темплатного син-
ну не превышают 50% [153]. Тем не менее, практи-
теза мезо-замещенных тетрабензопорфиринов
ческая ценность этой методологии очевидна, т.к. с
характеризуются выходами металлокомплексов
ее использованием за один прием можно получать
не превышающими 20%. Для увеличения выхода
граммовые количества чистого тетраарилтетра-
металлопорфиринов предложено использовать бо-
бензопорфирината металла без применения хро-
лее активные, чем имид, реагенты дитиофталимид
матографических методов очистки. Она открывает
и 1,3-диаминоизоиндолин При взаимодействии
доступный путь к целому ряду важнейших метал-
этих соединений с фенилуксусной кислотой и ок-
локомплексов мезо-тетраарилтетрабензопорфири-
сидом цинка в течение 1 ч образуется порфирин
на, замещенных как по фенильным, так и по кон-
(схема 8) [149].
денсированным бензольным кольцам.
Авторами
[150-152] предложен простой и
Обе наиболее доступные в настоящее время
удобный способ синтеза тетраарилтетрабензопор-
стратегии синтеза тетрабензопорфина и его арил-
фирина в мягких условиях, включающий конден-
производных применимы к его симметричным
сацию очень стабильных, в отличие от изоиндола,
линейным бензологам: тетранафто- и тетраантра-
4,5,6,7-тетрагидроизоиндолов с ароматическим
порфиринам и их изомерам с угловым аннелиро-
альдегидом или его производными в присутствии
ванием макрогетероцикла: тетранафто[1,2]порфи-
кислоты Льюиса (BF3·Et2O) и последующую окис-
нам и тетрафенантро[9,10]порфиринам [154-156].
лительную ароматизацию гексадекагидротетра-
Интерес к этой группе высокосопряженных анне-
порфиринатов металлов (схема 9).
лированных порфиринов с расширенной системой
Этот подход, являющийся по сути модифици-
π-сопряжения возрос особенно в последние два
десятилетия. Важным стимулом исследований
рованным методом Ротмунда, позволяет получать
замещенные мезо-тетраарилтетракис(тетрагидро-
этих соединений стала необходимость разработки
длинноволновых хромофоров для новых функци-
бензо)порфирины. Фундаментальное отличие это-
ональных материалов на основе тетрабензопор-
го метода заключается в том, что бензоаннелиро-
фирина и его структурных аналогов в качестве
вание пиррольных циклов происходит на заключи-
инфракрасных светоизлучающих устройств [157],
тельной стадии синтеза, следующей за образова-
фотовольтаики [158], кислородных сенсоров [159],
нием макрогетероцикла порфирина и его металло-
фотосенсибилизаторов [160] и др.
комплекса. Ароматизация циклогексеновых колец
также протекает в мягких условиях, при комнат-
Несомненная перспективность этой группы
ной температуре в присутствии DDQ [151].
порфиринов требует поиска более эффективных
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
354
КОЙФМАН, АГЕЕВА
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
355
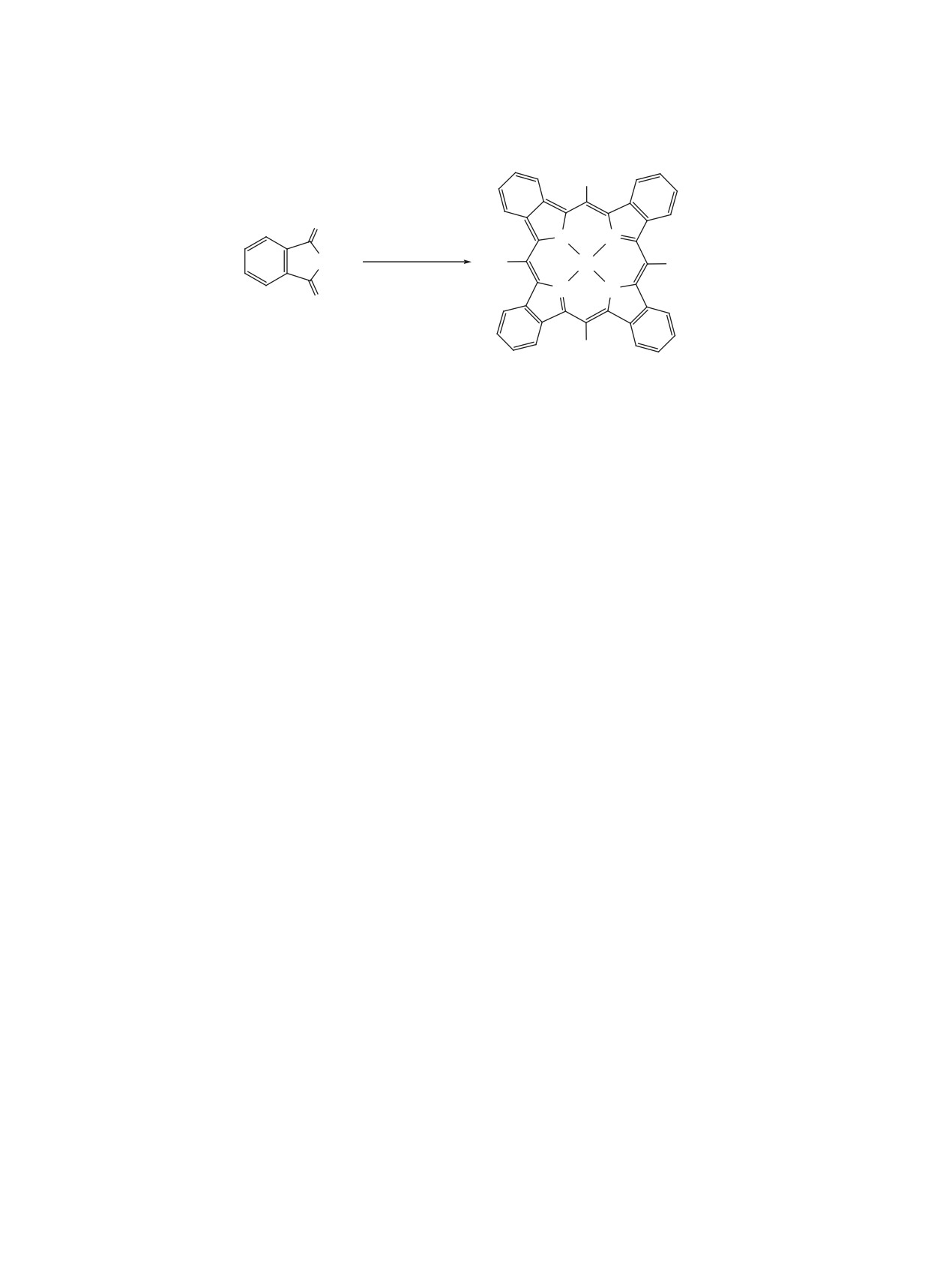
Схема 10
R
R
N
H
NH N
R
R
NH N
a, b
c
R
R
+
R
N HN
N HN
CHO
R
R
Реагенты и условия: a, CH2Cl2, BF3∙OEt2, N2, rt, 18 ч; b, DDQ, N2, кипячение, 2 ч;
c, вакуум, 205°С, 1 ч.
методов их получения. Совсем недавно группа
конденсации реагентов независимо от природы
ученых [161] предложила новый универсальный
альдегида. После завершения процесса конденса-
способ синтеза симметричных тетраарилтетра-
ции изоиндола с альдегидом в том же реакционной
бензопорфиринов, используя легко получаемый
колбе при добавлении DDQ в течение 2 ч при ки-
изоиндольный синтон, 4,7-дигидро-4,7-этано-2Н-
пении реакционной смеси достигается ароматиза-
изоиндол, который дает возможность получать
ция тетрабензопорфиринов, после чего проводит-
безметальный порфирин с высоким выходом не-
ся промывка 10%-ными растворами сульфата на-
зависимо от природы используемого альдегида
трия и карбоната натрия, растворитель удаляется,
путем конденсации изоиндола с ароматическим
и окончательная очистка достигается фильтрацией
альдегидом и последующей окислительной аро-
и переосаждением порфирина без использования
матизацией тетрапиррольного макрогетероцикла
методов колоночной хроматографии. В результате
(схема 10).
реализации этой стратегии были получены были
получены 30 безметальных тетраарилтетрабензо-
Конденсация этого изоиндола была описана
порфиринов с выходами от 50 до 86%. При необ-
ранее [162], но тетрабензопорфирин был получен
ходимости металлокомплексы этих тетрапирролов
лишь с незначительным выходом. В результате
легко получаются традиционными методами коор-
всесторонних исследований комбинации условий
динации порфиринов с солями металлов. Авторы
реакции было установлено, что определяющими
полагают, что предложенная методология является
факторами, влияющими на выход порфирина яв-
достаточно универсальной и может претендовать
ляются концентрация реагентов, время реакции и
на коммерческое приложение.
природа катализатора конденсации. Предложенная
стратегия была использована для получения 30 раз-
Структурное разнообразие тетраарилтетрабен-
личных симметричных тетраарилтетрабензопор-
зопорфиринов было расширено за счет примене-
фиринов с выходами, превышающими известные к
ния предложенной методологии в сочетании со
настоящему времени более, чем в два раза. Авторы
смешанной конденсацией [163]. Методом смешан-
установили, что темодинамически благоприятная
ной конденсации
4,7-дигидро-4,7-этано-2Н-изо-
тетрапиррольная структура образуется в инертной
индола со смесью двух арилальдегидов или двух
среде дихлорметана, в отсутствии дневного света
разных изоиндольных синтонов с бензальдегидом
в присутствии кислоты Льюиса BF3·OEt2 за 18 ч
были получены низкосимметричные ТАТБП с раз-
при комнатной температуре. Причем эта кислота
личными заместителями либо в мезо-арильных
Льюиса одинаково хорошо работает в процессе
фрагментах, либо на периферии макрогетероцик-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
356
КОЙФМАН, АГЕЕВА
ла с общим выходом 55-58%. Разделение смесей
его существенно ограничивается необходимо-
порфиринов было достигнуто за счет колоночной
стью трудоемкого хроматографического разделе-
хроматографии.
ния порфиринов. Применение такой методологии
представляет интерес в том случае, когда исполь-
Симметричная система заместителей в фениль-
зуется один из арилальдегидов, не дающий в клас-
ных кольцах мезо-тетраарилпорфинов ограничива-
сических методах монопиррольной конденсации
ет возможности их практического использования
симметричных мезо-арилпорфиринов или позво-
для решения ряда задач, связанных как с модели-
ляет получить их с очень низким выходом. Авторы
рованием функций природных порфиринов так и с
[167-168] показали, что оксибензальдегиды легко
конструированием эффективных гибридных мате-
вступают в смешанно-альдегидную конденсацию
риалов для различных областей техники и медици-
с бензальдегидом и пирролом, образуя при этом
ны. В связи с этим особый интерес представляют
монооксифенилтрифенилпорфины (схема 12).
тетраарилпорфирины с асимметричной системой
заместителей в мезо-положениях макрогетероцик-
С целью увеличения выхода несимметрично
ла. Одной из наиболее простых методологий син-
замещенного порфирина авторы [107, 167] усове-
теза таких порфиринов является смешанно-альде-
шенствовали методологию смешанно-альдегид-
гидная конденсация (схема 11) [164, 165]. Реакция
ной конденсации. Исключение окислителя на пер-
пиррола со смесью двух альдегидов позволяет по-
вой стадии конденсации пиррола с альдегидами в
лучить смесь шести порфиринов (рис. 2): А4, А3В,
среде ксилол-монохлоруксусная кислота позволя-
А2В2-цис, А2В2-транс, АВ3 и В4, которую можно
ет накапливать в реакционной среде арилпорфи-
разделить с помощью тонкослойной или колоноч-
риноген, имеющий в фенильных кольцах систему
ной хроматографии.
заместителей, создаваемую соотношением уча-
ствующих в реакции арилальдегидов, а последую-
Ожидаемое отношение порфиринов в статисти-
щее окисление его кислородом воздуха приводит к
ческом синтезе методом смешанно-альдегидной
целенаправленному получению А3В-порфирина с
конденсации задается биноминальным распреде-
выходом соизмеримым с выходами симметричных
лением. При одинаковой реакционной способно-
тетраарилпорфиринов.
сти арилальдегидов и их соотношении 1:1, коли-
чественное распределение получаемых тетраарил-
Методология смешанно-альдегидной конден-
порфиринов составляет A4 - 6.25%, А3В - 25%,
сации благодаря своей доступности и простоте
цис-A2B2 - 25%, транс-A2B2 - 12.5%, AB3 - 25%,
исполнения была применена авторами [170] для
B4 - 6.25%.
синтеза серии цинковых комплексов порфиринов
типа А3В в качестве элементов фотовольтаических
Чаще всего методом смешанно-альдегидной
устройств.
конденсации получают А3В-порфирины при соот-
ношении реагирующих альдегидов 3:1, при этом
Чтобы уменьшить число статистически воз-
на долю симметричного порфирина A4 и моноза-
можных продуктов конденсации при замыкании
мещенного А3В приходится 31.64 и 42.19%, соот-
тетрапиррольного макрогетероцикла Линдсей с
ветственно. Однако соотношение реагирующих
сотрудниками предложили методологию синте-
альдегидов, дающее самый высокий выход А3В-
за порфиринов, содержащих до четырех различ-
порфирина, зависит от фактической реакционной
ных мезо-заместителей [171], которая позволяет
способности арилальдегидов, а также от легкости
получать до грамма чистых порфиринов с мини-
разделения получаемой смеси порфиринов [166].
мальным использованием хроматографических
Несмотря на простоту и доступность метода сме-
методов. Она основана на конденсации дипирро-
шанно-альдегидной конденсации, применение
метанов, в которые направленно включены необ-
Схема 11
+ A-CHO + B-CHO
A4 + A3B + A2B2-цис + A2B2-транс + AB3 + B4
N
H
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
357
Схема 12
OH
CHO
CHO
N
H
H+
4
+
+
3
N
N
N
O2
H
H
N
OH
ходимые мезо-заместители, с последующим окис-
два удобных метода. Первый заключается в вы-
лением DDQ до порфирина (схема 13).
сокотемпературной конденсации дипиррометанов
с арилальдегидами (схема 14) в присутствии аце-
Детальное исследование процесса образования
тата цинка в азотсодержащих гетероциклических
асимметричных мезо-арилпорфиринов позволило
растворителях, таких как пиридин, коллидины, лу-
установить, что ход реакции главным образом за-
тидины, хинолин [175].
висит от природы вводимого в макрогетероцикл
заместителя и кислотного катализатора [172]. С
Второй двухстадийный метод состоит в кон-
учетом полученных закономерностей процесса
денсации α,α'-незамещенных дипиррометанов с
конденсации целенаправленный выбор замести-
бензальдегидами (схема 15) в галогенсодержащих
телей на стадии получения исходных синтонов
растворителях (хлороформе или хлористом мети-
порфиринов позволяет значительно повысить эф-
лене) при комнатной температуре с последующим
фективность реакции их образования и облегчить
окислением реакционной смеси производными
планирование синтеза тетрапиррольного макро-
бензохинонов (орто- или пара-хлоранил, DDQ)
гетероцикла. Методология Линдсея стала одной
[176, 177]. Более низкие выходы в первом случае
из самых востребованных для синтеза несимме-
компенсируются полным отсутствием продуктов
трично замещенных мезо-арилпорфиринов. Так,
кислотной перегруппировки дипирролилметенов, в
например, она была успешно использована для
то время как во втором случае в продукте реакции
формирования новых каталитически активных
присутствует до 1-2% монофенилоктаалкилпорфи-
металлопорфиринов [173] и для конструирования
ринов.
новых структурных блоков супрамолекулярных
Природные порфирины, как правило, содер-
систем [174].
жат в β-положениях пиррольных колец алкильные,
Для синтеза 5,15-дифенилпорфиринов с элек-
карбонильные, винильные карбоксильные группы,
тронодонорными и электроноакцепторными за-
каждая из которых выполняет определенную роль
местителями в фенильных кольцах разработаны
при включении их в нативную полимерную систе-
Схема 13
R1
R1
NH N
1. NaBH, THF/MeOH
2
R
R3
NH HN
R4
2.
, MeCN, TFA
N HN
R2
R3
O
O
NH HN
3. DDQ
R4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
358
КОЙФМАН, АГЕЕВА
Схема 14
Me
R
R
X
R
Me
Me
CHO
NH
NH N
1
Zn(OAc)
2
R
2
+
2
R1
NH
N
HN
R1
R
Me
Me
X
Me
R
R
X = H, COOH.
му. Поэтому моделирование природных процессов
дистой кислоты с последующим окислением обра-
требует получения β-замещенных порфиринов и их
зовавшегося порфириногена DDQ [180]. Метод по-
металлокомплексов [178]. Синтез таких порфири-
зволяет получать с хорошими выходами тетраари-
нов симметричного строения включает методы,
локтаалкилпорфирины как с электронодонорными
основанные на монопиррольной конденсации, и
так и электроноакцепторными заместителями в фе-
состоит в тетрамеризации пирролов, имеющих в
нильных кольцах (схема 16). Так 5,10,15,20-тетра-
одном из α-положений метиленовую группиров-
кис(4'-трет-бутилфенил)-2,3,7,8.12,13,17,18-ок-
ку, углерод которой может образовывать метино-
таметилпорфирин и
5,10,15,20-тетракис(3',5'-ди-
вые мостики порфиринового макрогетероцикла.
трет-бутилфенил)-2,3,7,8.12,13,17,18-октаме-
Д. Долфин, используя 3,4,-диметилпиррол как реа-
тилпорфирин были получены по разработанной
гент более чувствительный к электрофильной ата-
методике в атмосфере углекислого газа и очищены
ке, чем пиррол, показал, что в этом случае началь-
методом колоночной хроматографии на оксиде
ные стадии конденсации будут более быстрыми,
алюминия с суммарным выходом 60 и 15.2%, со-
тогда как стадия окисления порфирогена до порфи-
ответственно [181]. Предложенная методика доста-
рина будет замедлена из-за стерических затрудне-
точно универсальна и может быть использована для
ний [179].
направленного синтеза порфиринов с различными
Был разработан двухстадийный метод синтеза
заместителями в мезо-положении макрогетероцик-
тетрафенилоктаметилпорфиринов, заключающий-
ла с целью придания им необходимых функцио-
ся в конденсации 3,4-диметилпиррола и бензаль-
нальных свойств. Так, например, 5,10,15,20-тетра-
дегида в метаноле в присутствии бромистоводоро-
кис(тиен-2-ил)-2,3,7,8.12,13,17,18-октаметилпор-
Схема 15
R1
R1
Me
Me
Me
Me
Me
H
X
R
R
R
R
R
CHO
NH HN
N HN
NH
H
H
+
[O]
H
2
+
2
H
H
NH HN
NH
N
NH
R1
R
R
R
R
R
X
H
Me
Me
Me
Me
Me
R1
R1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
359
Схема 16
1
R1
R
R1
R1
R
R
R
R
H
R
R
CHO
H
N
N
R
H
R
DDQ
H+
R
H
R
4
+ 4
NH
HN
N
N
N
H
R
H
R
R1
R
H
R
N
H
N
R1
R1
R1
R1
H
R
R
R
R
фирин, полученный по той же методике [182], про-
ют путь к промышленным технологиям и расши-
являет свои хромофорные свойства в ближней ИК
рению областей использования тетрапиррольных
области и в связи с этим его можно рассматривать
макрогетероциклических соединений.
как перспективный молекулярный зонд и фотосен-
Одним из наиболее доступных альтернативных
сибилизатор в фотодинамической терапии.
методов синтеза мезо-арилпорфиринов является
Таким образом стратегия конденсации пиррола
микроволновой синтез [186, 187]. Использование
с альдегидами лежит в основе синтеза всех сим-
микроволнового излучения (МВИ) в органическом
метричных и асимметричных мезо-арилпорфири-
синтезе в настоящее время становится общеприня-
нов и широко используется для получения их как
той синтетической методологией. Было признано,
основы большинства функциональных материа-
что активация МВИ протекает на молекулярном
лов [2-5] и как строительных блоков для форми-
уровне, и поэтому реакции в микроволновом ре-
рования супрамолекулярных [49, 50, 56, 183, 184],
акторе обычно протекают быстрее, чем при тради-
саморганизованных [55] и порфиринполимерных
ционном термическом нагреве, снижая тем самым
ансамблей [56, 57, 185, 186], позволяющих кон-
время процесса и увеличивая выход порфирина
струировать современные гибридные материалы и
или его металлокомплекса.
молекулярные устройства на их основе.
Простота и доступность классических одно-
Однако синтез порфирина классическими ме-
реакторных методов конденсации пиррола и аль-
тодами часто включает использование высоких
дегида была положена в основу стратегии микро-
температур, токсичных и опасных реагентов, в ре-
волнового синтеза мезо-арилпорфиринов. Три
зультате чего продукт получается в очень малых
десятилетия МВИ-активация используется для
количествах и с плохой масштабируемостью.
усовершенствования и оптимизации этого процес-
2. АЛЬТЕРНАТИВНЫЕ МЕТОДОЛОГИИ
са, и многочисленные работы, появившиеся за это
СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
время и посвященные синтезу мезо-замещенных
порфиринов с использованием этой методологии,
Последние решения по повышению эффек-
отражены в обзорах [189-192].
тивности методов синтеза мезо-арилпорфиринов,
использование экологически более чистых про-
В последнее время неорганические материалы
цессов путем замены органических растворителей
продемонстрировали значительный потенциал для
на ионные жидкости и воду в сверхкритическом
замены органических кислот в качестве активато-
состоянии, повышение выхода за счет использо-
ров альдегида в синтезе мезо-тетразамещенного
вания твердых микропористых катализаторов в
порфирина [126-129]. Т.к. было однозначно уста-
сочетании с применением микроволновой химии,
новлено, что выбор кислоты является определяю-
снижение энергетического потребления за счет
щим фактором для эффективного катализа моно-
сокращения времени реакции, четко прокладыва-
пиррольной конденсации, использование твердых
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
360
КОЙФМАН, АГЕЕВА
кислот в этом процессе открыло новый экологи-
затора. Использование стеклянной пластины для
чески безопасный подход к синтезу тетрапирроль-
тонкослойной хроматографии в качестве подлож-
ных пигментов, особенно в сочетании с СВЧ облу-
ки для цеолитов, действующей как миниреактор
чением реакционной массы (схема 17).
в поле СВЧ, позволило повысить эффективность
конденсации пиррола с бензальдегидом (табл. 3)
Впервые МВИ было применено авторами [193]
и, вместе с тем, способствовало одновременно-
для синтеза мезо-тетрафенилпорфина в условиях
му разделению полученных соединений [195].
сухой среды. Конденсация пиррола и бензальде-
Предложенная методология благодаря своей эф-
гида, адсорбированных на поверхности силика-
фективности, быстроте и избирательности может
геля, который выполнил роль кислотного катали-
быть перспективна для применения ее в высоко-
затора в этом процессе, была проведена в течение
производительном параллельном синтезе в комби-
10 мин в бытовой микроволновой печи (табл. 3).
наторной химии [195].
Хотя максимальный выход порфирина в этих ус-
ловиях не превысил 9.5%, короткое время синтеза,
Асимметричные мезо-арилпорфирины типа
высокая степень чистоты продукта, простота его
А3В, содержащие два различных арильных фраг-
выделения показали перспективность предложен-
мента в мезо-положениях тетрапиррольного ма-
ной стратегии для получения небольших коли-
крогетероцикла были синтезированы при МВИ
честв тетрапиррольного соединения.
нагревании с использованием твердой подложки
Развитие безрастворной методологии получе-
из силикагеля. В основу микроволнового синтеза
ния тетрапиррольных макрогетероциклов полу-
была положена стратегия смешанно-альдегидной
чило с применением цеолитных катализаторов
конденсации. 4-карбометоксибензальдегид, 3-ги-
[194]. Использование цеолитных кислотных ка-
дроксибензальдегид и пиррол в соотношении 3:1:4,
тализаторов HZSM-5 и Al-MCM-41 в сочетании
предварительно адсорбированные на поверхности
с микроволновым нагревом обеспечило хороший
силикагеля, в открытом сосуде нагревались в бы-
выход и селективность в процессе образования
товой микроволновой печи при мощности 450 W
тетрапирролов: тетрафенилпорфина, тетра(4-ме-
в течение 12 мин. Десорбированные с силикаге-
токсифенил)порфирина, тетра(4-метилфенил)пор-
ля дихлорметаном тетрапиррольные соединения
фирина и каликсарена. При этом более высокий
разделяли методом колоночной хроматографии.
выход тетрафенилпорфина (табл. 3) на молеку-
При этом несимметрично замещенный 5-(3'-ги-
лярном сите HZSM-5 обусловлен поверхностной
дроксифенил)-10,15,20-трис(4'-карбометоксифе-
реакцией и высокой кислотной природой катали-
нил)порфирин и симметричный
5,10,15,20-те-
Схема 17
Синтез мезо-замещенных порфиринов с использованием твердых кислотных катализаторов
Твердый кислотный
катализатор
Ar
Ar
N
Двухстадийная реакция
H
O
N
N
+
Арилпорфириноген
N
H Ar
H
H
N
Ar
Ar
Одностадийная реакция
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
361
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
362
КОЙФМАН, АГЕЕВА
тракис(4'-карбометоксифенил)порфирин
были
ние для синтеза разнообразных симметричных и
получены с выходом 13 и 38% соответственно
несимметрично замещенных тетраарилпорфири-
[196]. Аналогично микроволновым синтезом в ус-
нов, требуют большого количества органических
ловиях отсутствия растворителя были получены
растворителей и трудоемких методов выделения
5-(2'-гидроксифенил)-10,15,20-трис-(4'-ацетокси-
и очистки целевых продуктов. Оптимизация этих
3'-гидроксифенил)порфирин и 5-(3'-гидроксифе-
методов с применением микроволнового нагрева
нил)-10,15,20-трис-(4'-ацетокси-3'-гидроксифе-
реакционной смеси позволила получить суще-
нил)порфирин [197]. Методом тонкослойной хро-
ственные преимущества в снижении времени про-
матографии было выявлено в реакционной смеси
цесса, повышении его эффективности, уменьше-
6 тетрапирролов (типа A4, A3B, A2B2 (цис и транс),
нии количества токсичных растворителей.
AB3 и B4) с высоким содержанием 5-(2'-гидрокси-
Проведение реакции циклоконденсации экви-
фенил)-10,15,20-трис(4'-карбоксиметилфенил)-
молярных количеств пиррола с различными ари-
порфирина (А3В). Конечный выход порфиринов
лальдегидами в открытом сосуде в условиях мето-
после колоночной хроматографии на силикагеле
дологии Адлера-Лонго [77] с использованием бы-
составил 33% для изомера A3B (2-я зона на колон-
товой СВЧ-печи в пропионовой кислоте и в при-
ке) и 48% для симметричного тетраарилпорфири-
сутствии кислорода воздуха позволило получить
на типа А4 (1-я зона на колонке).
не содержащие хлорина мезо-тетрарилпорфирины
Порфиринаты цинка и меди были получены
с выходом 20-43% за 4 мин [202] (табл. 3). Причем
для всех симметрично замещенных и несимме-
количество используемой пропионовой кислоты в
тричных порфиринов микроволновым одноре-
качестве реакционной среды в этом синтезе умень-
акторным методом при добавлении хлоридов со-
шено до 5 мл, что не только увеличило эффектив-
ответствующих металлов к реакционной смеси
ность процесса, но и повысило его экологичность.
пиррол-арилальдегиды [197-199], при этом выход
Эффективность этой методологии многократно
металлокомплексов несимметрично замещенных
показана в синтезе различных мезо-арилпорфи-
порфиринов существенно повысился.
ринов [191, 192, 202-204]. Прежде всего, время
Тетрафенилпорфиринат никеля (II) был полу-
конденсации пиррола с арилальдегидами в боль-
чен двумя способами: двухстадийным и односта-
шинстве случаев сократилось до 3-5 мин по срав-
дийным [200]. В первом случае тетрафенилпор-
нению с традиционным методом термического на-
фин, полученный монопиррольной конденсацией
грева. Вместе с тем выход порфиринов, имеющих
на силикагеле в условиях МВИ (табл. 3), реаги-
объемистые заместители в фенильных кольцах,
ровал с избытком NiCl2 в присутствии 1,8-диа-
таких как
5,10,15,20-тетракис(4'-терт-бутилфе-
забицикло[5.4.0]-ундек-7-ена (DBU) также в ми-
нил)порфирины (выход 56%) [203] и 5,10,15,20-те-
кроволновой печи с мощностью 750 Вт в течение
тракис[4'-(терпиридинил)фенил]порфирин (выход
6 мин. Выход металлокомплекса составил 57%,
12%) [204] возрос в несколько раз при использо-
при общем выходе процесса 38%.
вании МВИ.
Тот же самый металлопорфирин был получен
Детальные исследования влияния условий ре-
одностадийным методом с выходом 60% путем
акции конденсации пиррола с бензальдегидом в
конденсации пиррола и бензальдегида в присут-
пропионовой кислоте в условиях МВИ показали,
ствии хлорида никеля (II) в DBU при МВИ воздей-
что наибольший выход мезо-тетрафенилпорфи-
ствии на реакционную смесь в течение 8 мин. Было
на (30%) был получен в реакции, проведенной
установлено, что металлокомплекс не образуется
при 120°С при концентрации исходных соедине-
без DBU, существенная роль которого отмечена
ний 4.0 ммоль/мл в течение 30 мин в присутствии
и при микроволновом синтезе Mg, Cu, Tb(OAC),
п-хлоранила в качестве окислителя [205] (табл. 3)
Lu(OC), La(OC) комплексов
5,10,15,20-тетра-
и контролируемом МВИ-нагреве в СВЧ-реакторе
кис(4'-трет-бутилфенил)порфирина [201].
Synthewave 402 Prolabo с открытой вращающей-
Классические методы монопиррольной конден-
ся системой реакционного сосуда (максимальная
сации в растворах, получившие широкое примене-
мощность 300 Вт, частота 2450 МГц). Несмотря на
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
363
то, что этот порфирин может быть получен други-
честве твердого кислотного катализатора реакции
ми методами (табл. 1) с большим выходом, преи-
конденсации арилальдегида с пирролом наиболее
мущества этого подхода, заключающиеся в сокра-
эффективным является Al-MCM-41 [210]. Выход
щении времени реакции в несколько раз, умень-
фторсодержащего порфирина, инкапсулирован-
шении используемого растворителя в 250 раз,
ного внутри полостей катализатора составил 54%,
исключении токсичных реагентов, говорят о пер-
при этом тот же порфирин получается при синте-
спективности его использования. Авторы [205] от-
зе в растворе с выходом всего 9% [211]. На выход
мечают, что модификация метода монопиррольной
порфирина существенное влияние оказывает как
конденсации за счет применения МВИ активации
кислотность твердого катализатора, так и размер
процесса, позволяющая синтезировать порфирин
его пор [211]. Применение в качестве твердого
в неограниченном масштабе, соответствует прин-
катализатора NaY-цеолита в сочетании с методо-
логией классического нитробензольного синтеза
ципам зеленой химии.
позволило авторам [211] существенно повысить
Исследования кинетики реакции конденсации
эффективность процесса циклотетрамеризации
пиррола с бензальдегидом в пропионовой кисло-
пиррола. Предложенный метод синтеза мезо-а-
те и систематическая оценка влияния каждого па-
рилпорфиринов представляет собой конденсацию
раметра процесса на выход тетрафенилпорфина в
эквимолярных количеств альдегида и пиррола
системе закрытых сосудов СВЧ-реактора позво-
(концентрация 0.42 М) в смешанном растворите-
лили установить оптимальные условия получения
ле уксусная кислота-нитробензол (7:5) в присут-
тетрапиррола [206]. Наилучший выход 35% был
ствии гетерогенного NaY (0.016 М). Реакционную
достигнут при использовании в качестве окисли-
смесь нагревают при 130°C в течение 2 ч, после
теля нитробензола при температуре 200°С за 5 мин
чего фильтруют и порфирин выделяют либо пря-
МВИ-нагрева.
мым осаждением метанолом, либо методом коло-
Адаптация другой классической стратегии од-
ночной хроматографии. Цеолитный катализатор
после термической активации (500°C) может быть
нореакторного синтеза Гонсалвеса-Перейры к
повторно использован без потери каталитической
МВИ-технологиям [191, 192, 207, 208] показала
активности. Используя эту методологию, авторы
преимущества альтернативного источника энер-
[212] получили серию асимметричных, в том чис-
гии для повышения выхода тетраарилпорфири-
ле галогензамещенных мезо-арилпорфиринов, с
нов и их металлокомплексов при существенном
выходами практически в два раза превышающими
снижении времени процесса до 5 минут и умень-
выход, получаемый в классическом нитробензоль-
шении количества используемых растворителей
ном методе. Универсальность предложенной мето-
(табл. 3). Использование мономодового или муль-
дологии с применением твердого NaY-цеолитного
тимодового микроволнового реактора для орга-
катализатора была подтверждена авторами [213-
нического синтеза позволяет в контролируемом
215] в синтезе ряда несимметрично замещенных
режиме получать порфирины с хорошей воспроиз-
порфиринов, полученных с целью создания плат-
водимостью.
формы для различных биомедицинских приложе-
Применив предложенную методологию, авторы
ний, в том числе в качестве фотосенсибилизаторов
[209] синтезировали 5,10,15,20-тетракис(4'-фтор-
и диагностических препаратов. Особенно привле-
фенил)порфирин,
5,10,15,20-тетракис(3'-фторфе-
кательной эта методология оказалась для односта-
нил)порфирин,
5,10,15,20-тетракис(2'-фторфе-
дийного получения гибридных функциональных
нил)порфирин в пропионовой кислоте с добавкой
материалов на основе мезо-арилпорфиринов, ин-
нитробензола с выходом 36, 30 и 28%, соответ-
капсулированных в цеолитную матрицу [191].
ственно.
Применение СВЧ для интенсификации других
В развитии альтернативных методов синтеза
традиционно используемых методов для синтеза
мезо-арилпорфиринов Перейра с сотрудниками
мезо-арилпорфиринов также показывает хорошие
установили, что при использовании различных
результаты. МВИ активация реакционной смеси
алюмосиликатных мезопористых материалов в ка-
в двухстадийном синтезе тетрафенилпорфирина
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
364
КОЙФМАН, АГЕЕВА
в дихлорэтане с использованием в качестве окис-
другими методами сложнее или вообще невозмож-
лителя образующегося порфириногена молекуляр-
но синтезировать.
ного йода и п-хлоранила позволила Зерукки с со-
Авторы работы [218], используя методологию
трудниками [216] увеличить выход порфирина до
Зерруки, осуществили двухстадийную смешан-
47% (табл. 3). Впоследствии эта научная группа с
но-альдегидную монопиррольную конденсацию в
успехом применила предложенную методологию в
микроволновом реакторе (рис. 5). В зависимости
сочетании со смешанно-альдегидной конденсаци-
от соотношения бензальдегида и 4-карбометокси-
ей для синтеза несимметричных порфиринов типа
бензальдегида низкосимметричные тетраарилпор-
В [217].
А3
фирины типа А3В, цис-A2B2, транс-A2B2 и AB3
были выделены с различным выходом (табл. 4).
Проведение статистического синтеза несим-
метричных мезо-тетраарилпорфиринов всегда
Наряду с целевыми низкосимметричными пор-
требует дорогостоящих и трудоемких методов
фиринами в небольшом количестве получаются
разделения и очистки порфиринов [218]. В связи
другие побочные продукты такие, как расширен-
с этим для снижения затрат на расходные мате-
ные и сжатые порфириноиды, линейные олигоме-
риалы, экономии времени и сокращения отходов
ры и полимеры. Кроме того, всегда присутствуют
производства был разработан полуавтоматиче-
симметричные порфирины типа А4 и В4, которые
ский модульный процесс, включающий мономо-
не представляют интерес как продукт этого син-
довый МВИ-реактор, оснащенный автосамплером
теза, и легко могут быть получены с большим вы-
и устройством для мгновенной очистки методом
ходом монопиррольной конденсацией только с од-
жидкостной хроматографии среднего давления с
ним соответствующим бензальдегидом.
детектором УФ/видимого излучения и многоразо-
В классических методах получения и выделе-
вой стеклянной колонкой, заполненной силикаге-
ния порфиринов используется огромное количе-
лем. С помощью этого метода стало возможным
ство органических растворителей, которые пред-
синтезировать и очищать несколько статистиче-
ставляют большую опасность как для здоровья
ских смесей порфиринов одновременно, в зна-
человека, так и для окружающей среды. В связи с
чительной степени снижая фактор окружающей
этим сегодня ключевым фактором, который следу-
среды (Е-фактор) по сравнению с традиционными
ет учитывать при разработке новых синтетических
синтезами порфиринов.
стратегий, является фактор окружающей среды
Статистическая смешанно-альдегидная кон-
(E-фактор), определяемый как отношение суммар-
денсация пиррола с двумя различными арилаль-
ной массы всех образующихся в процессе отходов
дегидами (рис. 4), позволяющая одновременно по-
к массе полезного продукта, и дающий быструю
лучить шесть различных тетрапиррольных макро-
количественную оценку того, насколько процесс
гетероциклов в разном количестве, не считая дру-
является экологически чистым [219]. Например,
гих побочных продуктов, в большинстве случаев
наименьшее значение Е-фактора характерно для
оправдана тем, что она обеспечивают быстрый
процессов нефтепереработки (< 0.1), тогда как для
доступ к асимметричным порфиринам, которые
процессов фармацевтической промышленности он
A4
A3B транс-A2B2
B/A
A/B
A
A
A
A
A
B
1. H+
N
A
B
H
A
A
A
B
B
A
2. [O]
+
+
N
N
N
цис-A2B2
AB3
В4
H
H
A
A
A
B
B
B
N
H O H O
B
B
B
B
B
B
B/A
A/B
+ другие порфириноиды
Рис. 4 Статистическая смешанно-альдегидная конденсация двух арилальдегидов с пирролом [218].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
365
B/A
A/B
A
R
A3B4
N
A
H
a, b
хроматография
t-A2B2
B
+
m
+
n
N
N
c-A2B2
N
H
H
AB3
N
H O
B4
H O
B/A
A/B
полимеры
R = COOMe.
MeOOC
MeOOC
COOMe
N
N
H
H
N
N
N
N
H
H
N
N
A3B
цис-A2B2
Реагенты и условия: а, CH2Cl2, 10 мол % I2, 40°C, 5 мин, Pmax = 100 Вт;
b, добавление п-хлоранила, 40°C, 1 мин, Pmax =100 Вт.
Рис. 5 Статистический синтез 5-(4'-карбометоксифенил)-10,15,20-трифенилпорфирина в микроволновом реакторе
составляет 25-100, традиционный синтез тетраа-
ном сокращении требуемого времени и затрат на
рилпорфирина типа А4 с использованием страте-
химические и человеческие ресурсы.
гии Линдсея достигает значений Е-фактора >2000
Таким образом, многочисленные исследования
[79, 191]. Величина фактора окружающей среды
применения МВИ для интенсификации процес-
для синтеза несимметрично замещенных порфи-
са монопиррольной конденсации показали воз-
ринов с использованием предложенной модульной
можность применения этого подхода для любого
системы снижается до 530-624 [218].
классического метода синтеза мезо-арилпорфири-
Поэтому в настоящее время мощным инстру-
нов. Особенности МВИ-нагрева по сравнению с
ментом для создания экологически чистых техно-
термическими методами применительно к любой
логий может стать разработка автоматизирован-
стратегии синтеза порфиринов включают резкое
ных систем, позволяющих не только сократить
сокращение времени реакции, увеличение выхода
взаимодействие между оператором и реакционны-
тетрапиррола и повышение селективности про-
ми системами, но также повысить воспроизводи-
дукта при незначительных загрязнениях соответ-
мость и надежность процессов при одновремен-
ствующими хлоринами.
Таблица 4. Суммарный выход 5-(4'-карбометоксифенил)-10,15,20-трифенилпорфирина в микроволновом синтезе
а
Выход порфирина
Соотношение m/n
Общий выход
А3В
транс-А2В2
цис-А2В2
АВ3
1.1/0.9
8.9
4.1
19.0
12.0
44.0
3/1
22.0
1.5
3.1
0.9
27.5
а Выход определен относительно пиррола
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
366
КОЙФМАН, АГЕЕВА
За последнее десятилетие зеленая химия при-
ной мощности реактора 300 Вт. Авторы [226] по-
обрела статус крупной научной дисциплины [219,
казали, что вода в состоянии суперкритического
220]. Исследование и применение ее основных
флюида является не только растворителем, но
принципов привело к разработке более чистых и
и выполняет функцию кислотного катализатора
безопасных химических процессов. Безусловно
и окислителя. Выход мезо-тетрафенилпорфина,
для химии тетрапиррольных макрогетероцикли-
осажденного из охлажденной реакционной сме-
ческих соединений важное значение приобретает
си этанолом, составил 27% с содержанием мезо-
использование такого подхода в связи с расту-
тетрафенилхлорина менее 2% (табл. 3).
щим кругом прикладных задач, решаемых сегод-
Сравнение различных методологий синтеза
ня с применением этого класса соединений [2-5].
мезо-тетрафенилпорфина показало, что микро-
Поэтому растет спрос на разработку новых син-
волновой синтез с использованием воды показал
тетических процессов, включающих более устой-
лучшие количественные характеристики его эко-
чивые химические принципы, заменяющие по
логичности (табл. 5), когда-либо полученные для
возможности опасные органические растворители
этого процесса.
альтернатиными, сокращающие время энергоза-
тратных процедур, трудоемкие хроматографиче-
Широкая универсальность этой методологии
ские методы выделения и очистки кристаллизаци-
продемонстрирована хорошими выходами, полу-
ей из раствора.
ченными для симметричных как арил-, так и ал-
Одним из наиболее экологичных подходов в
килзамещенных порфиринов [226], несимметрич-
органическом синтезе является замена органи-
ных мезо-арилпорфиринов и их металлокомплек-
ческих растворителей на наиболее распростра-
сов, характеризующихся низкими температурами
ненный, безопасный и экологически чистый рас-
плавления [227], синтез, выделение и очистка
творитель - воду. Вода при температурах выше
которых традиционными методами представляет
точки кипения и давлении выше 16 бар переходит
большую проблему. Использование новых эколо-
в сверхкритическое состояние, в котором она мо-
гичных технологий синтеза новых тетрапирроль-
жет быть использована в качестве потенциально-
ных макрогетероциклов открывает путь для созда-
го растворителя для гидрофобных органических
ния функциональных материалов для различных
соединений [221, 222], кислотного или основного
областей применения: катализа, биомедицины,
катализатора, а также в определенных условиях
нелинейно оптических материалов, фотовольтаи-
в качестве окислителя [223, 224]. Свойства воды
ки [228].
как растворителя изменяются вследствие измене-
Использование альтернативных растворителей,
ния ее диэлектрической проницаемости, электро-
удовлетворяющих принципам «зеленой химии»,
проводности, ионного произведения, структуры
становится все более привлекательным в синте-
водородных связей [225]. Простым, быстрым и
тической химии порфиринов. К числу таких рас-
безопасным способом получения перегретой воды
творителей относятся ионные жидкости, которые
является использование микроволнового (МВИ)
с начала этого века стали широко использоваться
аппарата, предназначенного для органического
в качестве среды для различных органических ре-
синтеза [222, 224].
акций [229, 230]. Особую группу составляют про-
Научной группой М. Перейры впервые осу-
тонные ионные жидкости, в которых сочетание
ществлен микроволновой синтез мезо-тетрафе-
свойств кислоты и ионной жидкости в одной моле-
нилпорфина в воде, находящейся в сверхкритиче-
куле открыло их новые возможности, и, в первую
ском состоянии. Оптимизация условий проведе-
очередь, высокую каталитическую активность,
ния реакции конденсации пиррола с бензальдеги-
превышающую в идентичных процессах актив-
дом показала, что максимальный выход порфири-
ность органических и минеральных кислот [231].
на получается при смешении пиррола (9.8 ммоль),
альдегида (9.8 ммоль) и воды (0.2 мл, т.е. 50 М)
Исикава и сотрудники впервые предложили ис-
в микроволновом сосуде объемом 10 мл, МВИ-
пользовать протонную ионную жидкость (ПИЖ)
нагревании при 200°C в течение 10 мин и началь-
3-бутил-1-(бутил-4-сульфонил)имидазолий три-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
367
Таблица 5. Вычисленные Е-фактор и EcoScale для синтеза мезо-тетрафенилпорфина, при использовании различных
методологий [191]
№
Синтетическая методология
Е-фактор
EcoScale
Ссылка
1
Adler-Longoa
158
28
[77]
2
Gonsalves-Pereiraa
300
20
[98]
3
Lindseya
2252
-19
[79]
4
Zerroukib
2393
4.5
[216]
5
Chauhanb
278
5.5
[202]
6
Pineirob
600
12
[207]
7
Henriquesb
35
50.5
[226]
a Традиционный метод
b Микроволновой метод
фторэтансульфонат в качестве растворителя и ка-
составил 41%, и 7% его инвертированного изомера
тализатора для конденсации пиррола и бензальде-
(табл. 3) [233]. Использование ионных жидкостей
гида [232]. В основу предложенной методологии
в методологии Линдсея позволило в значительной
был положен двухстадийный метод Линдсея, в
степени уменьшить использование хлорсодержа-
котором вместо дихлорметана была использова-
щих растворителей.
на двухфазная система ионная жидкость-дихлор-
Позднее группа Исикавы применила протонные
метан (3:10), на границе раздела которой образу-
ионные жидкости в качестве реакционной среды и
ются в присутствии метансульфоновой кислоты
катализатора вместо пропионовой кислоты [234].
при 22°С в течение 30 мин 2 тетрапиррольных
Реакция конденсации пиррола с бензальдегидом в
макрогетероциклических соединения, окисление
ПИЖ при 120°С в течение 60 мин позволяет полу-
которых DDQ на 2-ой стадии дает мезо-тетрафе-
чить мезо-тетрафенилпорфин с таким же выходом
нилпорфин (ТРР) и его изомер инвертированный
как в синтезе в пропионовой кислоте при исполь-
мезо-тетрафенилпорфин (NC-TPP) (схема 18).
зовании традиционного метода Адлера-Лонго [77]
Использование двухфазной системы дает преи-
(табл. 3). При применении этой синтетической
мущество перед синтезом в гомогенных условиях:
стратегии, порфирины легко были выделены из
целевые порфирины собираются в слое дихлор-
реакционной смеси экстракцией в хлороформ, а
метана и легко могут быть отделены от ионной
ионные жидкости после регенерации можно было
жидкости, выделены и очищены хроматографи-
повторно использовать до трех раз без потери их
ческим методом, а ионная жидкость может быть
активности.
использована повторно до 10 раз, как показано в
работе [233], без потери каталитической активно-
Авторы [235] распространили этот метод на
сти. Максимальный выход тетрафенилпорфирина
другие мезо-замещенные арилпорфирины, в част-
Схема 18
Ph
Ph
Ph
Ph
1) H+
N
N
H
H
2) DDQ
N
+
N
N
+
N
N
ИЖ
H
H
H
N
N
H O
Ph
Ph
Ph
Ph
TPP
NC-TPP
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
368
КОЙФМАН, АГЕЕВА
ности для получения
5,10,15,20-тетра(4'-пири-
ринов заключается в отсутствии хлорированных
дил)порфирина, синтез и очистка которого услож-
растворителей, токсичного катализатора, дополни-
няется его высокой растворимостью в кислотах.
тельных окисляющих агентов. Ионная жидкость,
Выход порфирина при этом составил 14%, также,
используемая в этом методе, действует как раство-
как и в синтезе по методу Адлера, но с упроще-
ритель и как кислотный катализатор Льюиса, обе-
нием процедуры его выделения из реакционной
спечивая быстрый и эффективный путь синтеза
массы.
мезо-замещенных порфиринов с более высокими
выходами по сравнению с методом Ротмунда.
В работе [236] был предложен быстрый и эф-
фективный способ синтеза мезо-арилпорфиринов
Метод синтеза порфиринов в протонных ион-
с использованием протонной ионной жидкости те-
ных жидкостях обеспечивает простой и альтерна-
трафторборат-l-бутил-3-метилимидазолия в каче-
тивный способ получения различных мезо-заме-
стве катализатора процесса конденсации пиррола
щенных порфиринов в экологически чистых усло-
с арилальдегидами в условиях реакции Ротмунда
виях с выходами, достигающими 33%.
при температуре 100°С в течение 2-3 ч в присут-
В работе [237] предложена методология син-
ствии кислорода воздуха в качестве окислителя. В
теза модифицированных по координационному
результате был получен чистый мезо-тетрафенил-
центру порфиринов в ПИЖ (схема 19). Реакция
порфин с выходом 26%, не содержащий ни инвер-
2,5-бис-(α-арилгидроксиметил)тиофена с 5-арил-
тированного изомера, ни хлорина, что превышает
дипиррометаном в присутствии ионной жидкости
выход порфирина по методу его получения в пири-
дает 21-тиа-5,10,15,20-тетраарилпорфирин с 30%
дин-уксусной или пропионовой кислоте.
выходом, а реакция конденсации 2,5-бис-(α-арил-
Основное преимущество этого метода в отли-
гидроксиметил)тиофена с пирролом позволяет
чие от других методов синтеза мезо-арилпорфи-
получить 21,23-дитиа-5,10,15,20-тетраарилпорфи-
Схема 19
ПИЖ/CH2Cl2,
S
NH HN
DDQ
+
N
N
H
N
S
OH
OH
S
N
ПИЖ/CH2Cl2,
H
DDQ
N
N
+
S
S
OH
OH
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
369
рин с выходом 35%. Авторы [237] показали, что
нием экологически чистых растворителей или в
протонные ионные жидкости являются лучшим
условиях «сухих» технологий без растворителя с
катализатором и реакционной средой для синтеза
помощью механического воздействия на реакци-
модифицированных порфиринов, чем реакция, ка-
онную смесь. Этот процесс основан на механиче-
тализируемая кислотой в органических раствори-
ской активации твердофазных реакций, протекаю-
телях.
щих в ходе измельчения реагентов в шаровых или
планетарных мельницах. Подводимая в этом слу-
Методы синтеза металлокомплексов порфи-
чае механическая энергия, как правило, индуци-
ринов, являющиеся важным звеном в получении
рует химическое взаимодействие. Кроме быстрой
функциональных материалов на основе тетрапир-
макроциклизации эти технологии обеспечивают
рольных макрогетероциклических соединений
более безопасные методы синтеза, снижение энер-
[2-5], требуют большого количества органических
гетических затрат, повышение интенсификации
растворителей и часто ограничены растворимо-
процесса и уменьшение отходов [240-242].
стью одного или другого реагента в реакционной
среде. В связи с этим использование ионных жид-
В работе [243] представлен двухстадийный
механохимический синтез мезо-тетрафенилпор-
костей для целей введения иона металла в коорди-
национный центр порфирина представляет боль-
фирина, осуществленный путем диспергирования
эквимолярных количеств бензальдегида и пирро-
шой интерес.
ла без растворителя, в присутствии кислотного
Авторы [238] исследовали ряд ионных жидко-
катализатора с получением через 6 мин твердого
стей в качестве среды для получения медного ком-
розового порошка порфириногена (схема 20). Без
плекса мезо-тетрафенилпорфина. Было показано,
дополнительной стадии очистки этот порошок
что оптимальной ионной жидкостью для синтеза
был окислен до порфирина либо на воздухе, либо
металлопорфирина является
1-гексил-3-октили-
в хлороформе органическим окислителем.
мидазолиум бромид. Эффективность использова-
Этот метод синтеза был также применен к за-
ния такой среды для проведения реакций компле-
мещенным бензальдегидам и нафтальдегидам для
сообразования порфиринов с солями металлов в
получения различных мезо-тетразамещенных пор-
значительной степени повышается при сочетании
фиринов [244], которые были получены за 20 мин
ионных жидкостей с микроволновым нагревом.
(выход 3-33%). Для облегчения процесса конден-
Комплексы переходных металлов мезо-арилпор-
сации в реакционную смесь добавляли измельчаю-
фиринов в имидазольных ионных жидкостях при
щий агент (хлорид натрия, кремнезем или сульфат
МВИ-воздействии на реакционную среду были
магния), чтобы облегчить процесс диспергирова-
получены с выходом 71-98% в течение 5 мин
ния исходных реагентов за счет увеличения трения
[239].
и/или удаления воды из зоны реакции. Окисление
Таким образом протонные ионные жидкости
может происходить либо с использованием окис-
могут быть хорошей заменой летучим, токсичным
лителя в растворе, чтобы получить выходы, со-
и легко воспламеняемым органическим раство-
поставимые с теми, которые опубликованы для
рителям, используемым в традиционных методах
традиционных методов синтеза порфирина, либо
синтеза мезо-арилпорфиринатов металлов.
с помощью механохимических средств, приводя-
щих к двухступенчатому механохимическому син-
Реакции образования тетрапиррольных ма-
тезу, дающему несколько более низкие выходы. В
крогетероциклических соединений требуют эф-
качестве «зеленых» методов выделения и очистки
фективного катализа и подходящей физической
порфирина было предложено использовать мето-
активации реакционной среды. Разработки новых
ды сублимации [245].
синтетических стратегий синтеза мезо-арилпор-
фиринов показали, что методы механохимии и
В поисках устойчивых синтетических методо-
сонохимии могут в значительной степени спо-
логий был исследован механохимический прием
собствовать макроциклизации пиррола с арилаль-
как новый инструмент для одностадийго и двух-
дегидами в гетерогенных условиях с использова-
стадийного синтеза мезо-арилзамещенных порфи-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
370
КОЙФМАН, АГЕЕВА
Схема 20
Двухстадийный синтез тетраарилпорфиринов механохимическим методом
H
Ar
Ar
Ar
Ar
N
H
N
H
[O]
H
Ar
H+, -H2O
4
NH
HN
+
4
N
N
N
диспергирование
на воздухе,
H
H O
H
в растворе или
H
H
N
при диспергировании
N
Ar
Ar
H
Ar
Ar
«Розовый порошок»,
содержащий арилпорфириноген
ринов [246]. Исследования показали, что наилуч-
ния. Все эти синтетические подходы несомненно
шей методологией является двухстадийный синтез
внесут свой вклад в доступность и безопасность
мезо-арилпорфиринов. На первом этапе механиче-
методов получения порфиринов и их металлоком-
ская активация эквимолярных количеств пиррола
плексов как важнейших составляющих функци-
и арилальдегида осуществлялась в присутствии
ональных материалов нового поколения для раз-
катализатора п-толуолсульфоновой кислоты при
личных молекулярных устройств и медицины.
диспергировании в мельнице в течение 30 мин.
ЗАКЛЮЧЕНИЕ
Полученный розовый порошок порфириногена
окислялся в открытом сосуде при перемешивании
Перспективы использования мезо-арилпорфи-
экологически приемлемого растворителя
2-ме-
ринов будут расширяться в связи с возрастающим
тилтетрагидрофурана оксидом марганца (IV), ко-
ростом функциональных материалов на основе
торый зарекомендовал себя в качестве эффектив-
тетрапиррольных макрогетероциклических соеди-
ного гетерогенного окислителя гидропорфиринов
нений для современных технологий, медицины и
материаловедения. Самосборка этих соединений
[208].
как удобных «строительных блоков» для разноо-
Наилучшие результаты были получены в двух-
бразных супрамолекулярных систем, включение
стадийном методе при механической обработке
их в качестве функциональной основы в гибрид-
реакционной смеси на стадии окисления в при-
ные материалы, доступность изменения структу-
сутствии экологически приемлемого растворите-
ры и свойств за счет многочисленных направлений
ля 2-метилтетрагидрофурана и MnO2 в качестве
модификации макрогетероцикла открывает прак-
гетерогенного окислителя. Выходы порфиринов,
тически неограниченные возможности для дизай-
синтезируемых с применением механохимической
на новых материалов и устройств.
активации меньше, чем в других методологиях
В связи с этим потребности в этих соединениях,
(табл. 3), но простота и безопасность такого под-
равно как и в удобных методологиях их получения
хода позволяет надеяться на перспективность при-
будут только расти. Анализ приведенных методов
менения его в синтетической химии порфиринов.
синтеза мезо-арилзамещенных порфиринов пока-
Таким образом альтернативные методологии,
зывает, что исследователи располагают широкими
которые обеспечивают синтез порфиринов в мяг-
возможностями для выбора необходимого способа
ких условиях, с удобными приемами выделения и
их получения с учетом в том числе и условий «зе-
хорошими выходами привлекают к себе все боль-
леной химии».
шее внимание синтетиков. Пока эти методы полу-
ФОНДОВАЯ ПОДДЕРЖКА
чили наибольшее распространение применитель-
но к наиболее простой и доступной группе мезо-
Работа выполнена в рамках государственного
арилпорфиринов, но вместе с тем наиболее вос-
задания Министерства науки и высшего образова-
требованной в различных областях их примене-
ния РФ (проект № FZZW-2020-0008).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
371
ИНФОРМАЦИЯ ОБ АВТОРАХ
Bull. 2016, 65, 333-349.] doi 10.1007/s11172-016-
1307-1
Койфман Оскар Иосифович, ORCID: https://
8.
Nyuchev A.V., Otvagin V.F., Gavryushin A.E., Roma-
orcid.org/0000-0002-1764-0819
nenko Yu.I., Koifman O.I., Belykh D.V., Schmalz H.-G.,
Агеева Татьяна Арсеньевна, ORCID: https://
Fedorov A.Yu. Synthesis. 2015, 47, 3717-3726. doi
orcid.org/0000-0001-9445-4262
10.1055/s-0034-1378876
КОНФЛИКТ ИНТЕРЕСОВ
9.
Nyuchev A.V., Kochetkov E.N., Schegravin K.V.,
Zamyshlyayeva O.G., Baten’kin M.A., Samsonov M.A.,
Авторы заявляют об отсутствии конфликта ин-
Koifman O.I., Romanenko Y.V., Melnikova N.B.,
тересов.
Fedorov A.Yu. Mendeleev Commun. 2017, 27, 610-
СПИСОК ЛИТЕРАТУРЫ
612. doi 10.1016/j.mencom.2017.11.024
1.
Handbook of Porphyrin Science. Ed. K.M. Kadish,
10.
Otvagin V.F., NyuchevA.V., Kuzmina N.S., Grishin I.D.,
K.M. Smith, R. Guilard. New Jersey-London-Singa-
Gavryushin A.E., Romanenko Yu.V., Koifman O.I.,
pore-Beijing-Shanghai-Hong Kong-Taipei-Chennai:
Belykh D.V., Peskova N.N., Shilyagina N.Yu., Ba-
World Scientific Publishing Сo Inc. 2010-2019. 1-45.
lalaeva I.V., Fedorov A.Yu. Eur. J. Med. Chem. 2018,
144, 740-750. doi 10.1016/j.ejmech.2017.12.062
2.
Функциональные материалы на основе тетрапир-
рольных макрогетероциклических соединений. Ред.
11.
Otvagin V.F., Kuzmina N.S., Krylova L.V., Volovets-
О.И. Койфман. М.: ЛЕНАНД. 2019. [Functional
ky A.B., Nyuchev A.V., Gavryushin A.E., Mesh-
Materials Based on Tetrapirrole Macroheterocyclic
kov I.N., Gorbunova Y.G., Romanenko Y.V., Koif-
Compounds. Ed O.I. Koifman. Мoscow: LENAND.
man O.I., Balalaeva I.V., Fedorov A.Yu. J. Med.
2019.]
Chem.
2019,
62,
11182-11193. doi
10.1021/
3.
Koifman O.I., Ageeva T.A., Beletskaya I.P., Averin A.D.,
acs.jmedchem.9b01294
Yakushev A.A., Tomilova L.G., Dubinina T.V.,
12.
Kuzmina N.S., Otvagin V.F., Krylova L.V., Nyu-
Tsivadze A.Yu., Gorbunova Yu.G., Martynov A.G.,
chev A.V., Romanenko Y.V., Koifman O.I., Balalae-
Konarev D.V., Khasanov S.S., Lyubovskaya R.N., Lo-
va I.V., Fedorov A.Yu. Mendeleev Commun. 2020, 30,
mova T.N., Korolev V.V., Zenkevich E.I., Blaudeck T.,
159-161. doi 10.1016/j.mencom.2020.03.009
von Borczyskowski Ch., Zahn D.R.T., Mironov A.F.,
13.
Койфман О.И., Пономарев Г.В. Пат. 2490273 (2013).
Bragina N.A., EzhovA.V., Zhdanova K.A., Stuzhin P.A.,
РФ. Б.И. 2013, № 23. [Koifman O.I., Ponomarev G.V.
Pakhomov G.L., Rusakova N.V., Semenishyn N.N.,
RF Patent no. 2490273, 2013; Byull. Izobr., 2013,
Smola S.S., Parfenyuk V.I., Vashurin A.S., Makarov
no. 23.]
S.V., Dereven’kov I.A., Mamardashvili N.Zh., Kurti-
kyan T.S., Martirosyan G.G., Burmistrov V.А., Alek-
14.
Пономарев Г.В., Койфман О.И. Пат. 2523380 (2014).
sandriiskii V.V., Novikov I.V., Pritmov D.A., Grin M.A.,
РФ. Б.И. 2014, № 20. [Ponomarev G.V., Koifman
Suvorov N.V., Tsigankov A.A., Fedorov A.Yu., Kuzmi-
O.I. RF Patent no. 2523380, 2014; Byull. Izobr., 2014,
na N.S., Nyuchev A.V., Otvagin V.F., Kustov A.V.,
no. 20.]
Belykh D.V., Berezin D.B., Solovieva A.B., Tima-
15.
Койфман О.И., Пономарев Г.В., Сырбу С.А.,
shev P.S., Milaeva E.R., Gracheva Yu.A., Dodokho-
Жаров Е.В., Сергеева Т.В., Луковкин А.В. Пат.
va M.A., A.V. Safronenko, Shpakovsky D.B., Syr-
2535097 (2014). РФ. Б.И. 2014, № 34. [Koifman O.I.,
bu S.A., Gubarev Yu.A., Kiselev A.N., Koifman M.O.,
Ponomarev G.V., Syrbu S.A., Zharov E.V., Sergee-
Lebedeva N.Sh., Yurina E.S. Macroheterocycles. 2020,
va T.V., Lukovkin A.V. RF Patent no. 2535097, 2014;
13, 311-467. doi 10.6060/mhc200814k
Byull. Izobr., 2014, no. 34.]
4.
Park J.M., Hong K.-I., Lee H., Jang W.-D. Acc.
16.
Сергеева Т.В., Жаров Е.В., Койфман О.И., Бога-
Chem. Res.
2021,
54,
2249-2260. doi
10.1021/
тырев О.П., Базаева В.В., Луковкин А.В., Понома-
acs.accounts.1c00114
рев Г.В. Пат. 2537759 (2015). РФ. Б.И. 2015, № 1.
5.
Shi Y., Zhang F., Linhardt R.J. Dyes Pigm. 2021, 188,
[Sergeeva T.V., Zharov E.V., Koifman O.I., Bogaty-
109136. doi 10.1016/j.dyepig.2021.1091
rev O.P., Bazaeva V.V., Lukovkin A.V., Ponoma-
6.
Миронов А.Ф. Рос. хим. ж.
2017,
61,
42-68.
rev G.V. RF Patent no. 2537759, 2015; Byull. Izobr.,
[Mironov A.F. Russ. J. Gen. Chem. 2019, 89, 1952-
2015, no. 1.]
1983.] doi 10.1134/S1070363219090354
17.
Kustov A.V., Kustova T.V., Berezin D.B., Belykh D.V.,
7.
Грин М.А., Миронов А.Ф. Изв. АН. Сер. хим. 2016,
Khudyaeva I.S. Dyes Pigm. 2020, 173, 107948. doi
65, 333-349. [Grin M.A., Mironov A.F. Russ. Chem.
10.1016/j.dyepig.2019.107948
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
372
КОЙФМАН, АГЕЕВА
18.
Койфман О.И., Лебедева Н.Ш., Губарев Ю.А., Кой-
33.
Vicente M.D., Smith K.M. Curr. Org. Synth. 2014, 11,
фман М.О. ХГС. 2021, 57, 423-431. [Koifman O.I.,
3-28. doi 10.2174/15701794113106660083
Lebedeva N.S., Gubarev Y.A., Koifman M.O. Chem.
34.
Smith K.M. New J. Chem. 2016, 40, 5644-5649. doi
Heterocycl. Compd. 2021, 57, 423-431.] doi 10.1007/
10.1039/C6NJ00820H
s10593-021-02920-8
35.
Senge M.O., Sergeeva N.N., Hale K.J. Chem. Soc. Rev.
19.
Lebedeva N.S., Gubarev Y.A., Koifman M.O., Koif-
2021, 50, 4730-4789. doi 10.1039/C7CS00719A
man O.I. Molecules. 2020, 25, 4368-4392. doi 10.3390/
36.
Lomova T.N., Tyulyaeva E.Y. Direct Synthesis of Metal
molecules25194368
Complexes. Ed. B. Kharisov. Amsterdam: Elsevier.
20.
Lebedeva N.Sh., Gubarev Y.A., Mamardashvili G.M.,
2018. 239-278.
Zaitceva S.V., Zdanovich S.A., Malyasova A.S.,
37.
Ломова Т.Н. Аксиально координированные ме-
Romanenko J.V., Koifman M.O., Koifman O.I. Sci.
таллопорфирины в науке и практике. М.: КРА-
Rep. 2021, 11, 19481. doi 10.1038/s41598-021-99072-
САНД. 2018. [Lomova T.N. Axially Coordinated
8
Metalloporphyrins in Science and Practice. Moskow:
21.
The Porphyrin Handbook. Ed. K.M. Kadish, K.M.
KRASAND. 2018.]
Smith, R. Guilard. New York: Academic Press. 2000. 1.
38.
Березин Д.Б. Макроциклический эффект и струк-
22.
Порфирины: структура, свойства, синтез. Ред.
турная химия порфиринов. М.: КРАСАНД. 2010.
Н.С. Ениколопян. М.: Наука.
1985.
[Porphyrins:
[Berezin D.B. Macrocyclic Effect and Structural
Structure, Properties, Synthesis. Ed. N.S. Enikolopjan.
Chemistry of Porphyrins. Moskow: KRASAND. 2010.]
M: Nauka. 1985.]
39.
Kingsbury C.J., Senge M.O. Coord. Chem. Rev. 2021,
23.
Аскаров К.А., Агеева Т.А., Рашидова С.Т. Отходы
431, 213760. doi 10.1016/j.ccr.2020.213760
шелководства. Пути их переработки, перспективы
применения. Ред. О.И. Койфман. М.: Химия. 2008.
40.
Койфман О.И., Трифонова И.П., Бурмистров В.А.
[Askarov K.A., Ageeva T.A., Rashidova S.T. Wastes
Изв. АH. Сер. хим. 2015, 2562-2572. [Koifman O.I.,
Trifonova I.P., Burmistrov V.A. Russ. Chem. Bull.
of Sericulture. Ways of their Processing, Application
Prospects. Ed. O.I. Koifman. M.: Khimiya. 2008.]
2015, 64, 2562-2572.] doi 10.1007/s11172-015-1191-0
24.
Senge M.O., Ryan A.A., Letchford K.A., MacGo-
41.
Brückner C. Acc. Chem. Res. 2016, 49, 1080-1092. doi
wan S.A., Mielke T. Symmetry. 2014, 6, 781-843. doi
10.1021/acs.accounts.6b00043
10.3390/sym6030781
42.
Lopes J.M.S., Reis J.R.T., Machado A.E.H., Lei-
25.
Chlorophylls and Bacteriochlorophylls: Biochemistry,
te T.H.O., Batista A.A., Acunha T.V., Araujo P.T., Ne-
Biophysics Functions and Applications. Ed. B. Grimm,
to N.M.B. Spectrochim. Acta, Part A. 2020, 118389.
R.J. Porra, W. Rüdiger, H. Scheer. Dordrecht: Springer.
doi 10.1016/j.saa.2020.118389
2006.
43.
Taniguchi M., Lindsey J.S., Bocian D.F., Holten D.
26.
Hayashi T., Hisaeda Y. Acc. Chem. Res. 2002, 35, 35-
J. Photochem. Photobiol. C: Photochem. Rev. 2021,
43. doi 10.1021/ar000087t
46, 100401. doi 10.1016/j.jphotochemrev.2020.100401
27.
Sitte E., Senge M.O. Eur. J. Org. Chem. 2020, 3171-
44.
Pisarek S., Maximova K., Gryko D. Tetrahedron. 2014,
3191. doi 10.1002/ejoc.202000074
70, 6685-6715. doi 10.1016/j.tet.2014.05.090
28.
Poulos T.L. Chem. Rev. 2014, 114, 3919-3962. doi
45.
Брагина Н.А., Жданова К.А., Миронов А.Ф. Усп.
10.1021/cr400415k
хим. 2016, 85, 477-512. [Bragina N.A., Zhdano-
29.
Shanmugathasan S., Edwards C., Boyle R.W. Tetra-
va K.A., Mironov A.F. Russ. Chem. Rev. 2016, 85,
hedron. 2000, 56, 1025-1046. doi 10.1016/s0040-
477-512.] doi 10.1070/RCR4533
4020(99)00907-2
46.
Койфман О.И., Агеева Т.А. Высокомол. соед. Сер. С.
30.
Lindsey J.S. Acc. Chem. Res. 2010, 43, 300-311. doi
2014,
56,
89-110.
[Koifman O.I., Ageeva T.A.
10.1021/ar900212t
Polymer Sci. Ser. C. 2014, 56, 84-103.] doi 10.1134/
S1811238214010056
31.
Senge M.O., Chem. Commun. 2011, 47, 1943-1960.
doi 10.1039/c0cc03984e
47.
Zeng K., Tong Z., Ma L., Zhu W., Wu W., Xie Y. Energy
Environ. Sci. 2020, 13, 1617-1657. doi 10.1039/
32.
Beletskaya I.P., Tyurin V.S., Uglov A., Stern C., Gui-
C9EE04200H
lard R. Handbook of Porphyrin Science. Eds.
K.M. Kadish, K.M. Smith, R. Guilard. Singapore:
48.
Park J.M., Lee J.H., Jang W.-D. Coord. Chem. Rev.
World Scientific Publishing. 2012, 23, 81-278.
2020, 407, 213157. doi 10.1016/j.ccr.2019.213157
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
373
49.
Мамардашвили Г.М., Мамардашвили Н.Ж., Койф-
62.
Yao D., Zhang X., Abid S., Shi L., Blanchard-Des-
ман О.И. Усп. хим. 2005, 74, 839-855. [Mamardashvi-
ce M., Mongin O., Paul F., Paul-Roth C.O. New J.
li G.M., Mamardashvili N.Zh., Koifman O.I. Russ.
Chem. 2018, 42, 395-401. doi 10.1039/c7nj03522e
Chem. Rev.
2005,
74,
765-780.] doi
10.1070/
63.
Li W.-S., Aida T. Chem. Rev. 2009, 109, 6047-6076.
RC2005v074n08ABEH001056
doi 10.1021/cr900186c
50.
Beletskaya I., Tyurin V.S., Tsivadze A.Y., Guilard R.,
64.
Dąbrowski J.M., Pucelik B., Pereira M.M.,
Stern C. Chem. Rev. 2009, 109, 1659-1713. doi
Arnaut L.G., Macyk W., Stochel G. RSC Adv. 2015,
10.1021/cr800247a
5, 93252-93261. doi 10.1039/c5ra19742b
51.
Keinan S., Therien M.J., Beratan D.N., Yang W. J.
65.
Vieira Ferreira L.F., Ferreira Machado I., Gama A.,
Phys. Chem. A. 2008, 112, 12203-12207. doi 10.1021/
Lochte F., Socoteanu R.P., Boscencu R. J. Photochem.
jp806351d
Photobiol. A: Chem. 2019, 112152. doi 10.1016/
j.jphotochem.2019.112152
52.
Liu X., Wang D., Gao H., Yang Z., Xing Y., Cao H.,
He W., Wang H., Gu J., Hu H. Dyes Pigm. 2016, 134,
66.
Tesakova M.V., Popov I.A., Sheinin V.B., Semei-
155-163. doi 10.1016/j.dyepig.2016.07.01
kin A.S., Parfenyuk V.I., Koifman O.I. Macro-
heterocycles.
2013,
6,
152-157. doi
10.6060/
53.
Khadria A., Fleischhauer J., Boczarow I., Wilkin-
mhc121195p
son J.D., Kohl M.M., Anderson H.L. iScience. 2018, 4,
153-163. doi 10.1016/j.isci.2018.05.015
67.
Kuzmin S.M., Chulovskaya S.A., Koifman O.I.,
Parfenyuk V.I. Electrohem. Commun. 2017, 83, 28-32.
54.
Bao C., Li Y., Li Y., Si Z., Zhang Y., Chen C.,
doi 10.1016/j.elecom.2017.08.016
Wang L. Duan Q. New J. Chem. 2021, 45, 16030-
16038. doi 10.1039/d1nj02632a
68.
Tesakova M.V., Koifman O.I., Parfenyuk V.I. J. Por-
phyr. Phthalocyanines. 2018, 22, 632-639. doi 10.1142/
55.
Мамардашвили Г.М., Мамардашвили Н.Ж., Койф-
s1088424618500864
ман О.И. Усп. хим. 2008, 77, 60-77. [Mamardashvi-
li
G.M., Mamardashvili N.Zh., Koifman O.I.
69.
Kuzmin S.M., Chulovskaya S.A., Parfenyuk V.I.,
Russ. Chem. Rev. 2008, 77, 59-75.] doi 10.1070/
Koifman O.I. Mendeleev Commun. 2019, 29, 309-311.
doi 10.1016/j.mencom.2019.05.023
RC2008v077n01ABEH003743
70.
Исламова Р.М., Пузин Ю.И., Ионова И.А., Сыр-
56.
Койфман О.И., Мамардашвили Н.Ж. Росс. нанотех-
бу С.А., Койфман О.И., Монаков Ю.Б. Высокомол.
нологии. 2009, 4, 59-65. [Koifman O.I., Mamardashvi-
соед. Сер. Б. 2009, 51, 677-684. [Islamova R.M.,
li N.Zh. Nanotechnologies in Russia. 2009, 4, 253-
Puzin Y.I., Ionova I.A., Syrbu S.A., Koifman O.I.,
261.] doi 10.1134/S1995078009050012
Monakov Y.B. Polymer Sci. B. 2009, 51, 110-116.] doi
57.
Койфман О.И., Агеева Т.А. Порфиринполимеры:
10.1134/S1560090409030075
Синтез, свойства, применение. М.: ЛЕНАНД.
71.
Monakov Yu.B., Islamova R.M., Koifman O.I.
2018. [Koifman O.I., Ageeva T.A. Porphyrinpolymers:
Macroheterocycles. 2009, 2, 237-242.
Synthesis, Properties, Applications. M.: LENAND.
2018.]
72.
MonakovYu.B., Islamova R.M., Ionova I.A., Syrbu S.A.,
Ageeva T.A., Koifman O.I. Mendeleev Commun. 2010,
58.
Койфман О.И., Агеева Т.А. Высокомол. соединения.
20, 33-35. doi 10.1016/j.mencom.2010.01.013
Сер. С. 2004, 46, 2187-2215. [Koifman O.I., Agee-
73.
Pereira M., Dias L.D., Calvete M.J.F. ACS Catal.
va T.A. Polymer Sci. Series C. 2004, 46, 49-72.]
2018, 8, 10784-10808. doi 10.1021/acscatal.8b01871
59.
Койфман О.И., Агеева Т.А., Николаева О.И. Изв.
74.
Rothemund P. J. Am. Chem. Soc. 1935, 57, 2010-2011.
вузов. Cер. хим. и хим. технол. 2004, 47, 91-101.
doi 10.1021/ja01313a510
[Koifman O.I., Ageeva T.A., Nikolaeva O.I. Izv. Vuzov,
Khim. i Khim. Tekhnol. 2004, 46, 49-72.]
75.
Rothemund P. J. Am. Chem. Soc. 1939, 61, 2912-2915.
doi 10.1021/ja01265a096
60.
Сырбу С.А., Агеева Т.А., Семейкин А.С., Койф-
ман О.И. Изв. АН. Сер. хим. 2007, 56, 680-703.
76.
Rothemund P., Menotti A.P. J. Am. Chem. Soc. 1941,
[Syrbu S.A., Ageeva T.A, Semeikin A.S., Koifman O.I.
63, 267-270. doi 10.1021/ja01846a065
Russ. Chem. Bull. 2007, 56, 707-731.] doi 10.1007/
77.
Adler A.D., Longo E.R., Shergalis W. J. Am. Chem.
s11172-007-0108-y
Soc. 1964, 86, 3145-3149. doi 10.1021/ja01069a035
61.
Агеева Т.А., Сырбу С.А., Койфман О.И. Макрогете-
78.
Adler A.D., Longo F.R. Finarelli J.D., Goldmacher J.,
роциклы. 2009, 2, 139-150. [Ageeva T.A., Syrbu S.A.,
Assour J., Korsakoff L. J. Org. Chem. 1967, 32, 476.
Koifman O.I. Macroheterocycles. 2009, 2, 139-150.]
doi 10.1021/jo01288a053
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
374
КОЙФМАН, АГЕЕВА
79.
Lindsey J.S., Schreiman I.C., Hsu H.C., Kearney P.C.,
94.
Lindsey J.S., Wagner R.W. J. Org. Chem. 1989, 54,
Marguerettaz A.M. J. Org. Chem. 1987, 52, 827-836.
828-836. doi 10.1021/jo00265a021
doi 10.1021/jo00381a022
95.
Geier G.R. III, Lindsey J.S. J. Porphyr.
80.
Lindsey J.S., Hsu H.C., Schreiman I.C. Tetrahedron
Phthalocyanines. 2002, 6, 159-185. doi 10.1142/
Lett.
1986,
27,
4969-4970. doi
10.1016/S0040-
S1088424602000208
4039(00)85109-6
96.
Rocha Gonsalves A.M. d’A., Varejão J.M.T.B.,
81.
Dogutan D.K., Ptaszek M., Lindsey J.S. J. Org. Chem.
Pereira M.M. J. Heterocycl. Chem. 1991, 28, 635-
2007, 72, 5008-5011. doi 10.1021/jo070532z
640. doi 10.1002/jhet.5570280317
82.
Ellis P.E., Jr., Langdale W.A. J. Porphyr. Phtha-
97.
Rocha Gonsalves A.M. d’A., Pereira M.M. J. Hete-
locyanines. 1997, 01, 305-307. doi 10.1002/(SICI)1099-
rocycl. Chem. 1985, 22, 931-933. doi 10.1002/
1409(199707)1:3<305::AID-JPP27>3.0.CO;2-Q
jhet.5570220363
83.
Neya S., Quan J., Hata M., Hoshino T., Funasaki N.
98.
Johnstone R.A.W., Nunes M. L.P.G., Pereira M.M.,
Tetrahedron Lett. 2006, 47, 8731-8732. doi 10.1016/
Rocha Gonsalves A.M.d’A., Serra A.C. Heterocycles.
j.tetlet.2006.10.010
1996, 43, 1423. doi 10.3987/com-96-7436
84.
Senge M.O., Davis M. J. Porphyr. Phthalocyanines.
99.
Pinto S.M.A., Vinagreiro C.S., Tomé V.A.,
2010, 14, 557-567. doi 10.1142/S1088424610002495
Piccirillo G., Damas L., Pereira M.M. J. Porphyr.
85.
Kua J., Paradela T.L. J. Phys. Chem. A. 2020, 124,
Phthalocyanines. 2019, 23, 329-346. doi 10.1142/
10019-10028. doi 10.1021/acs.jpca.0c09922
S1088424619300039
86.
Kim J.B., Adler A.D., Longo, F.R. The Porphyrins.
100.
Любимова Т.В., Глазунов А.В., Сырбу С.А., Се-
Structure and Synthesis, Part A. Ed. D. Dolphin.
мейкин А.С., Быкова В.В., Жарникова Н.В., Ана-
London: Academic Press. 1978, 85-100. doi 10.1016/
ньева Г.А., Усольцева Н.В. Жидк. крист. и их прак-
b978-0-12-220101-1.5
тич. использ. 2010, 31, 23-36. [Lyubimova T.V.,
87.
Семейкин А.С., Койфман О.И., Березин Б.Д. ХГС.
Glazunov A.V., Syrbu S.A., Semeykin A.S., Byko-
1982, 18, 1354-1355. [Semeikin A.S., Koifman O.I.,
va V.V., Zharnikova N.V., Ananyeva G.A., Usoltse-
Berezin B.D. Chem. Heterocycl. Compd. 1983, 18,
va N.V. Liq. Cryst. and their Appl. 2010, 31, 23-36.]
1046-1047.
101.
Momo P.B., Bellete B.S., Brocksom T.J., de Sou-
88.
Семейкин А.С., Койфман О.И., Березин Б.Д., Сыр-
za R.O.M.A., de Oliveira K.T. RSC Adv. 2015, 5,
бу С.А. ХГС. 1983, 19, 1359-1361. [Semeikin A.S.,
84350-84355. doi 10.1039/c5ra16962c
Koifman O.I., Berezin B.D., Syrbu S.A. Chem.
102.
Kua J., Miller A.S., Wallace C.E., Loli H. ACS
Heterocycl. Compd. 1984, 19, 1082-1083.]
Omega.
2019,
4,
22251-22259. doi
10.1021/
89.
Семейкин А.С., Койфман О.И., Березин Б.Д. ХГС.
acsomega.9b03931
1986, 22, 798-801. [Semeikin A.S., Koifman O.I.,
103.
Sun Z., Jiao S., Li F., Wen J., Yu Y., Liu Y., Cao M.,
Berezin B.D. Chem. Heterocycl. Compd. 1986, 22,
Li L., Zhou Y., She Y. Asian J. Org. Chem. 2019, 8,
629-632. doi 10.1007/bf00575244]
542-548. doi 10.1002/ajoc.201900154
90.
Семейкин А.С., Кузьмин Н.Г., Койфман О.И. ЖПХ.
104.
Cristiano M.L.S., Gago D.J.P., d’A. Rocha Gonsal-
1988, 61, 1426-1429. [Semeikin A.S., Kuzmin N.G.,
ves A.M., Johnstone R.A.W., McCarron M., Vare-
Koifman O.I. J. Appl. Chem. of the USSR. 1988, 61,
jão J.M.T.B. Org. Biomol. Chem. 2003, 1, 565-574.
1426-1429.]
doi 10.1039/b210887a
91.
Семейкин А.С., Койфман О.И., Березин Б.Д. А.С.
105.
Rocha Gonsalves A.M. d’A., Serra A.C., Pineiro M.
1118642 (1984). СССР. Б.И. 1984, № 38. [Semei-
J. Porphyr. Phthalocyanines. 2009, 13, 429-445. doi
kin A.S., Koifman O.I., Berezin B.D. USSR Inventor’s
10.1142/S1088424609000607
Certificate no. 1118642, 1984; Byull. Izobr., 1984,
no. 38.]
106.
Serra A.C., Rocha Gonsalves A.M. d’A. Tetrahedron
Lett.
2010,
51,
4192-4194. doi
10.1016/
92.
Lindsey J.S. The Porphyrin Handbook. Eds. K.M.
j.tetlet.2010.06.010
Kadish, K.M. Smith, R. Guilard. Boston: Academic
Press. 2000, 1, 45-118.
107.
Сырбу С.А. Дис. … докт. хим. наук. Иваново.
2008. [Syrbu S.A. Doctoral (Chem.) Dissertation,
93.
Lindsey J.S. Metalloporphyrin-Catalyzed Oxidation.
Ivanovo, 2008.]
Eds. F. Montanary, L. Casella. The Netherlands:
Kluwer Academic Publishers.
1994,
49-86. doi
108.
Kim J.B., Leonard J.J., Longo F.R. J. Am. Chem. Soc.
10.1007/978-94-017-2247-6_2
1972, 94, 3986-3992. doi 10.1021/ja00766a056
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
375
109.
Treibs A., Häberle N. Lieb. Ann. 1968, 718, 183-207.
Semeikin A.S., Lyubimova T.V., Novikov I.V., Alek-
doi 10.1002/jlac.19687180118
sandriisky V.V., Kuvshinova S.A., Koifman O.I. RF
110.
Thomas D.W., Martell A.E. J. Am. Chem. Soc. 1956,
Patent no. 2557655 C1, 2015; Byull. Izobr., 2015,
78, 1335-1338. doi 10.1021/ja01588a020
no. 21.]
111.
Badger G., Jones R., Laslett R. Aust. J. Chem. 1964,
122.
Ghosh A.A. Angew. Chem., Int. Ed. 2004, 43, 1918-
17, 1028-1035. doi 10.1071/ch9641028
1931. doi 10.1002/anie.200201603
112.
Иванова Ю.Б., Семейкин А.С., Пуховская С.Г.,
123.
Barata J.F.B., Neves M.G.P.M.S., Faustino M.A.F.,
Мамардашвили Н.Ж. ЖОрХ. 2019, 55, 1888-1894.
Tome A.C., Cavaleiro J.A.S. Chem. Rev. 2017, 117,
[Ivanova Y.B., Mamardashvili N.Z., Semeikin A.S.,
3192-3253. doi 10.1021/acs.chemrev.6b00476
Pukhovskaya S.G. Russ. J. Org. Chem. 2019, 55,
124.
Березин Д.Б., Каримов Д.Р., Кустов А.В. Корролы
1878-1883.] doi 10.1134/S107042801912011X
и их производные: Синтез, свойства, перспек-
113.
Erzunov D., Vashurin A., Pukhovskaya S., Ivano-
тивы практического применения. Ред. О.И. Кой-
va Y., Semeykin A., Golubchikov O., Mamardashvi-
фман. М.: ЛЕНАНД. 2018. [Berezin D.B., Kari-
li N. J. Mol. Struct. 2019, 1192, 7-14. doi 10.1016/
mov D.R., Kustov A.V. Corrols and Their Derivatives:
j.molstruc.2019.04.074
Synthesis, Properties, and Prospects for Practical
114.
Усольцева Н.В., Быкова В.В., Ананьева Г.А.,
Application. Ed. O.I. Koifman. M.: LENAND. 2018.]
Александров А.И., Пашкова Т.В., Казак А.В.,
125.
Szyszko B., Latos-Grażyński L. Chem. Soc. Rev.
Семейкин А.С., Глазунов А.В., Любимова Т.В.,
2015, 44, 3588-3616. doi 10.1039/c4cs00398e
Юдин С.Г., Палто С.П. Жидк. крист. и их практич.
126.
Shan W., Desbois N., Blondeau-Patissier V., Naita-
использ. 2009, 30, 37-46. [Usoltseva N.V., Byko-
na M.L., Quesneau V., Rousselin Y., Gros C.P., Ou Z.,
va V.V., Ananyeva G.A., Alexandrov A.I., Pashko-
Kadish, K.M. Chem. Eur. J. 2017, 23, 12833-12844.
va T.V., Kazak A.V., Semeykin A.S., Glazunov A.V.,
doi 10.1002/chem.201701968
Lyubimova T.V., Yudin S.G., Palto S.P. Liq. Cryst.
their Appl. 2009, 30, 37-46.]
127.
Tanaka T., Osuka A. Chem. Rev. 2017, 117, 2584-
2640. doi 10.1021/acs.chemrev.6b00371
115.
Usol’tseva N., Bykova V., Zharnikova N., Alexandrov
A., Semeikin A., Kazak A. Mol. Cryst. Liq. Cryst. 2010,
128.
Fadda A.A., El-Mekawy R.E., El-Shafei A.L., Free-
525, 184-193. doi 10.1080/15421401003799557
man H. Arch. Pharm. Chem. Life Sci. 2012, 346, 53-
61. doi 10.1002/ardp.201200313
116.
Formirovsky K.A., Bragina N.A., Mironov A.F.,
Anan’eva G.A., Bykova V.V., Usol’tseva N.V.
129.
Fadda A.A., El-Mekawy R.E., El-Shafei A., Free-
Mendeleev Commun.
2012,
22,
278-280. doi
man H.S., Hinks D., El-Fedawy M. J. Chem. 2013,
10.1016/j.mencom.2012.09.01
1-11. doi 10.1155/2013/340230
117.
Семейкин А.С., Койфман О.И., Никитина Г.Е.,
130.
Fadda A.A., El-Mekawy R.E., El-Shafei A.I.
Березин Б.Д. ЖOX. 1984, 54, 1599-1603. [Semei-
J. Porphyr. Phthalocyanines. 2015, 19, 753-768. doi
kin A.S., Koifman O.I., Nikitina G.E., Berezin B.D.
10.1142/S1088424615500480
Zh. Obshch. Khim. 1984, 54, 1599-1603.]
131.
Tawfik E., Fadda A., Soliman N.N., Abouzeid L.A.,
118.
Березин Б.Д., Семейкин А.С., Никитина Г.Е., Кой-
Negm A. J. Porphyr. Phthalocyanines. 2019, 23, 251-
фман З.Ц., Койфман О.И. ЖФХ. 1985, 59, 2226-
259. doi 10.1142/S1088424619500093
2229. [Berezin B.D., Semeikin A.S., Nikitina G.E.,
132.
Abu-Melha S. Arch. Pharm. 2019, 352, 1800221. doi
Koifman Z.Ts., Koifman O.I. Zh. Fiz. Khim. 1985,
10.1002/ardp.201800221
59, 2226-2229.]
133.
Mondal S., Pain T., Sahu K., Kar S. ACS Omega. 2021,
119.
Burmistrov V.A., Novikov I.V., Aleksandriiskii V.V.,
6, 22922-22936. doi 10.1021/acsomega.1c03534
Semeikin A.S., Koifman O.I. Liq. Cryst. 2021, 48,
134.
Mondal S., Sahu K., Patra B., Jena S., Biswal H.S.,
794-805. doi 10.1080/02678292.2020.1817583
Kar S. Dalton Trans. 2020, 49, 1424-1432. doi
120.
Burmistrov V.A., Semeikin A.S., Kuvshinov G.V.,
10.1039/C9DT03573G
Aleksandriisky V.V., Lyubimova T.V., Kuvshino-
va S.A., Koifman O.I. J. Porphyr. Phthalocyanines.
135.
Кобаяши Н. Изв. вузов. Cер. хим. и хим. технол.
2017, 21, 103-109. doi 10.1142/S1088424617500110
2019, 62, 4-46. [Kobayashi N. Izv. Vuzov, Khim.
i Khim. Tekhnol. 2019, 62, 4-46.] doi 10.6060/
121.
Бурмистров В.А., Семейкин А.С., Любимова Т.В.,
ivkkt.20196206.5913_1
Новиков И.В., Литов К.М., Александрийский В.В.,
Кувшинова С.А., Койфман О.И. Пат. 2557655 C1
136.
Кобаяши Н. Изв. вузов. Cер. хим. и хим. технол.
(2015). РФ. Б.И. 2015, № 21. [Burmistrov V.A.,
2019, 62, 4-25. [Kobayashi N. Izv. Vuzov, Khim.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
376
КОЙФМАН, АГЕЕВА
i Khim. Tekhnol. 2019, 62, 4-25.] doi 10.6060/
150.
Finikova O., Cheprakov A., Beletskaja I., Vinogra-
ivkkt.20196206.5913_1
dov S. Chem. Commun. 2001, 261-262. doi 10.1039/
B008816L
137.
Кобаяши Н. Изв. вузов. Cер. хим. и хим. технол.
2019, 62, 4-37. [Kobayashi N. Izv. Vuzov, Khim.
151.
Финикова О.С., Чернов С.Ю., Чепраков А.В.,
i Khim. Tekhnol.. 2019, 62, 4-37.] doi 10.6060/
Филатов М.А., Виноградов С.А., Белецкая И.П.
ivkkt.20196211.5913.3
Докл. АН. 2003, 391, 781-783. [Finikova O.S., Cher-
nov S.Yu., Cheprakov A.V., Filatov M.A., Vinogra-
138.
Priesthoff J.H., Banks C.V. J. Am. Chem. Soc. 1954,
dov S.A., Beletskaya I.P. Doklady Chem. 2003, 391,
76, 937-938. doi 10.1021/ja01632a104
222-224.] doi 10.1023/A:1025340804084
139.
Kumar A., Maji S., Dubey P., Abhilash G.J., Pan-
152.
Finikova O.S., Cheprakov A.V., Beletskaya I.P.,
dey S., Sarkar S. Tetrahedron Lett. 2007, 48, 7287-
Carroll P.J., Vinogradov S.A. J. Org. Chem. 2004, 69,
7290. doi 10.1016/j.tetlet.2007.08.046
522-535. doi 10.1021/jo0350054
140.
Березин Б.Д., Ломова Т.Н. Реакции диссоциации
153.
Filatov M.A., Cheprakov A.V., Beletskaya I.P.
комплексных соединений. М.: Наука, 2007. [Bere-
Eur. J. Org. Chem. 2007, 3468-3475. doi 10.1002/
zin B.D., Lomova T.N. Reaktsii dissotsiatsii
ejoc.200700014
komleksnykh soedinenii (Dissociation Reactions of
Complex Compounds). Moscow: Nauka. 2007.]
154.
Cheprakov A.V. Handbook of Porphyrin Science. Eds.
K.M. Kadish, K.M. Smith, R. Guilard. Singapore:
141.
Gridnev A.A., Nikiforov G.A. Synth. Commun. 2009,
World Scientific Publishing Co. Pte. Ltd. 2011, 13,
39, 1679-1689. doi 10.1080/00397910802574617
1-149.
142.
Ahmed A., Omar W.A.E., El-Asmy H.A., Abou-
155.
Filatov M.A., Aleshchenkov S.E., Cheprakov A.V.
Zeid L., Fadda A.A. Dyes Pigm. 2020, 108728. doi
Macroheterocycles. 2009, 2, 198-205.
10.1016/j.dyepig.2020.108728
156.
Filatov M.A., Baluschev S., Enkelmann V., Land-
143.
Sun Z.-C., She Y.-B., Zhou Y., Song X.-F., Li K.
fester K., Ilieva I.Z., Miteva T., Aleshchenkov S.E.,
Molecules.
2011,
16,
2960-2970. doi
10.3390/
Cheprakov A.V. J. Org. Chem. 2012, 77, 11119-
molecules16042960
11131. doi 10.1021/jo302135q
144.
Hahn da Silveira C., Garoforo E.N., Chaves O.A.,
157.
Zach P.W., Freunberger S.A., Klimant I., Borisov S.M.
Gonçalves P.F.B., Streit L., Iglesias B.A. Inorg.
ACS Appl. Mater. Interfaces. 2017, 9, 38008-38023.
Chim. Acta.
2018,
482,
542-553. doi
10.1016/
doi 10.1021/acsami.7b10669
j.ica.2018.06.052
158.
Hu Y., Webre W.A., Thomas M.B., Moss A., Han-
145.
Carvalho C.M.B., Brocksom T.J., de Oliveira K.T.
cock S.N., Schaffner J., D’Souza F., Wang H. J. Mater.
Chem. Soc. Rev. 2013, 42, 3302-3317. doi 10.1039/
Chem. A. 2019, 7, 10712. doi 10.1039/C9TA01846H
c3cs35500d
159.
Xie B.-R., Yu Y., Liu X.-H., Zeng J.-Y., Zou M.-Z.,
146.
Галанин Н.Е., Шапошников Г.П., Койфман О.И.
Li C.-X., Zeng X., Zhang X.-Z. Biomaterials. 2021,
Усп. хим. 2013, 82, 412-428. doi 10.1070 [Gala-
272, 120782. doi 10.1016/j.biomaterials.2021.120782
nin N.E., Shaposhnikov G.P., Koifman O.I. Russ.
Chem. Rev.
2013,
82,
412-428.] doi
10.1070/
160.
Horiuchi H., Sakai A., Akiyama S., Ikeda R., Ito S.,
Furuya M., Gomibuchi Y., Ichikawa M., Yoshihara T.,
RC2013v082n05ABEH004317
Tobita S., Okutsu T. J. Photochem. Photobiol. A. 2017,
147.
Лукьянец Е.А., Дашкевич С.Н., Кобаяши Н. ЖОХ.
339, 19-24. doi 10.1016/j.jphotochem.2017.02.015
1993, 63, 1411-1415. [Luk’yanets E.A., Dashke-
161.
Ruppel M., Lungerich D., Sturm S., Lippert R.,
vich S.N., Kobayashi N. Zh. Obshch. Khim. 1993, 63,
1411-1415.]
Hampel F., Jux N., Chem. Eur. J. 2020, 26, 3287-
3296. doi 10.1002/chem.201904718
148.
Галанин Н.Е., Кудрик Е.В., Шапошников Г.П.
162.
Jeong S.-D., Min B., Cho S.Y., Lee C., Park B.K.,
Изв. АН. Сер. хим. 2008, 57, 1565-1580. [Gala-
An K.-S., Lim J. J. Org. Chem. 2012, 77, 8329-8331.
nin N.E., Kudrik E.V., Shaposhnikov G.P. Russ.
Chem. Bull. 2008, 57, 1595-1610.] doi 10.1007/
doi 10.1021/jo300831u
s11172-008-0207-4
163.
Ruppel M., Gazetas L.-P., Lungerich D., Hampel F.,
Jux N. J. Org. Chem. 2020, 85, 7781-7792. doi
149.
Галанин Н.Е., Кудрик Е.В., Шапошников Г.П.
10.1021/acs.joc.0c00293
Пат. 2215003. (2003). РФ. Б.И. 2003, № 30. [Gala-
nin N.E., Kudrik E.V., Shaposhnikov G.P. RF Patent
164.
Anton J.A., Loach P.A. J. Heterocycl. Chem. 1975,
no. 2215003, 2003; Byull. Izobr., 2003, no. 30.]
12, 573-576. doi 10.1002/jhet.5570120326
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
377
165.
Little R.G., Anton J.A., Loach P.A., Ibers J.A.
179.
Dolphin D. J. Heterocycl. Chem. 1970, 7, 275-283.
J. Heterocycl. Chem. 1975, 12, 343-349. doi 10.1002/
doi 10.1002/jhet.5570070205
jhet.5570120226
180.
Кузьмин Н.Г., Семейкин А.С., Койфман О.И. А.C.
166.
Lindsey J.S., Prathapan S., Johnson T.E., Wagner R.W.
1574603
(1990). СССР. [Kuzmin N.G., Semey-
Tetrahedron. 1994, 50, 8941-8968. doi 10.1016/
kin A.S., Koifman O.I. USSR Inventor’s Certificate
s0040-4020(01)85364-3
no. 1574603, 1990.]
167.
Сырбу С.А., Семейкин А.С. ЖОрХ. 1999, 35, 1262-
181.
Иванова Ю.Б., Дао Т.Н., Глазунов А.В., Семей-
1265. [Syrbu S.A., Semeikin A.S. Russ. J. Org. Chem.
кин А.С., Пуховская С.Г., Мамардашвили Н.Ж.
1999, 35, 1236-1239.]
ЖОХ. 2014, 84, 108-113. [Ivanova Yu.B., Mamar-
dashvili N.Zh., Nam D.T., Glazunov A.V., Semey-
168.
Герасимова О.А., Милаева Е.Р., Шпаковский Д.Б.,
kin A.S., Pukhovskaya S.G. Russ. J. Gen. Chem. 2014,
Сырбу С.А., Семейкин А.С. Изв. АН. Сер. хим.
84, 103-107.] doi 10.1134/S1070363214010162
2007, 56, 800-303. [Gerasimova O.A., Milaeva E.R.,
Shpakovsky D.B., Semeikin A.S., Syrbu S.A. Russ.
182.
Иванова Ю.Б., Разгоняев О.В., Семейкин А.С., Ма-
Chem. Bull. 2007, 56, 831-834.] doi 10.1007/s11172-
мардашвили Н.Ж. ЖОХ. 2015, 85, 635-640. [Iva-
007-0124-y
nova Yu.B., Mamardashvili N.Zh., Razgonyaev O.V.,
Semeikin A.S. Russ. J. Gen. Chem. 2015, 85, 876-
169.
Milaeva E.R., Gerasimova O.A., Jingwei Z., Shpa-
881.] doi 10.1134/S1070363215040192
kovsky D.B., Syrbu S.A., Semeykin A.S., Koif-
man O.I., Kireeva E.G., Shevtsova E.F., Bachu-
183.
Bottaria G., Trukhinaa O., Incea M., Torres T. Coord.
rin S.O., Zefirov N.S. J. Inorg. Biochem. 2008, 102,
Chem. Rev. 2012, 256, 2453-2477. doi 10.1016/
1348-1358. doi 10.1016/j.jinorgbio.2008.01.022
j.ccr.2012.03.011
170.
Ezhov A.V., Aleksandrov A.E., Zhdanova K.A.,
184.
Антипин И.С., Алфимов М.В., Арсланов В.В.,
Zhdanov A.P., Klyukin I.N., Zhizhin K.Y., Bragi-
Бурилов В.А., Вацадзе С.З., Волошин Я.З., Вол-
na N.A., Mironov A.F., Tameev A.R. Synth. Met.
чо К.П., Горбачук В.В., Горбунова., Ю.Г., Гро-
2020, 269, 116567. doi 10.1016/j.synthmet.2020.11
мов С.П., Дудкин С.В., Зайцев С.Ю., Захаро-
ва Л.Я., Зиганшин М.А., Золотухина А.В., Кали-
171.
Rao P.D., Dhanalekshmi S., Littler B.J., Lindsey J.S.
нина М.А., Караханов Э.А., Кашапов Р.Р., Койф-
J. Org. Chem. 2000, 65, 7323-7344. doi 10.1021/
ман О.И., Коновалов А.И., Коренев В.С., Макси-
jo000882k
мов А.Л., Мамардашвили Н.Ж., Мамардашви-
172.
Geier G.R., Lindsey J.S. Tetrahedron. 2004, 60,
ли Г.М., Мартынов А.Г., Мустафина А.Р., Нуг-
11435-11444. doi 10.1016/j.tet.2004.09.081
манов Р.И., Овсянников А.С., Падня П.Л., Пота-
173.
Antonangelo A.R., Westrup K.C.M., Burt L.A.,
пов А.С., Селектор С.Л., Соколов М.Н., Соловье-
Bezzu C.G., Malewschik T., Machado G.S., Nu-
ва С.Е., Стойков И.И., Стужин П.А., Суслов Е.В.,
nes F.S., McKeown N.B., Nakagaki S. RSC Adv.
Ушаков Е.Н., Федин В.П., Федоренко С.В., Фе-
2017, 7, 50610-50618. doi 10.1039/c7ra08734a
дорова О.А., Федоров Ю.В., Чвалун С.Н., Ци-
174.
Goswami S., Tripuramallu B.K., Goldberg I.
вадзе А.Ю., Штыков С.Н., Шурпик Д.Н., Щер-
CrystEngComm. 2017, 19, 6845-6857. doi 10.1039/
бина М.А., Якимова Л.С. Усп. хим. 2021, 90,
c7ce01642e
895-1107. [Antipin I.S., Alfimov M.V., Arslanov V.V.,
Burilov V.A., Vatsadze S.Z., Voloshin Ya.Z., Vol-
175.
Мамардашвили Н.Ж., Семейкин А.С., Голубчи-
cho K.P., Gorbatchuk V.V., Gorbunova Yu.G., Gro-
ков О.А. ЖОрХ. 1993, 29, 1213-1223. [Mamardash-
mov S.P., Dudkin S.V., Zaitsev S.Yu., Zakharo-
vili N.Zh., Semeykin A.S., Golubchikov O.A. Russ. J.
va L.Ya., Ziganshin M.A., Zolotukhina A.V., Kalini-
Org. Chem. 1993, 29, 1213-1223.]
na M.A., Karakhanov E.A., Kashapov R.R., Koif-
176.
Семейкин А.С., Любимова Т.В., Голубчиков О.А.
man O.I., Konovalov A.I., Korenev V.S., Maksi-
ЖПХ. 1993, 66, 710-712. [Semeykin A.S., Lyubimo-
movA.L., Mamardashvili N.Zh., Mamardashvili G.M.,
va T.V., Golubchikov O.A. Zh. Priklad. Khim. 1993,
Martynov A.G., Mustafina A.R., Nugmanov R.I.,
66, 710-712.]
Ovsyannikov A.S., Padnya P.L., Potapov A.S., Selek-
177.
Мамардашвили Н.Ж., Голубчиков О.А. Усп.
tor S.L., Sokolov M.N., Solovieva S.E., Stoikov I.I.,
хим. 2000, 69, 337-354. [Mamardashvili N.Zh.,
Stuzhin P.A., Suslov E.V., Ushakov E.N., Fedin V.P.,
Golubchikov O.A. Russ. Chem. Rev. 2000, 69, 337-
Fedorenko S.V., Fedorova O.A., Fedorov Yu.V., Chva-
354. doi 10.1070/RC2000v069n04ABEH000550]
lun S.N., Tsivadze A.Yu., Shtykov S.N., Shurpik D.N.,
178.
Lindsey J.S. Chem. Rev. 2015, 115, 6534-6620. doi
Shcherbina M.A., Yakimova L.S. Russ. Chem. Rev.
10.1021/acs.chemrev.5b00065
2021, 90, 895-1107.] doi 10.1070/RCR5011
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
378
КОЙФМАН, АГЕЕВА
185.
Койфман О.И., Агеева Т.А. Изв. АН. Сер. хим.
200.
Sharma R.K., Ahuja G., Sidhwani I.T. Green
2015, 64, 2001-2011. [Koifman O.I., Ageeva T.A.
Chem. Lett. Rev. 2009, 2, 101-105. doi 10.1080/
Rus. Chem. Bull. 2015, 64, 2001-2011.] doi 10.1007/
17518250903117463
s11172-016-1111-y
201.
Liu M.O., Tai C.-H., Hu A.T. Mater. Chem. Phys. 2005,
92, 322-326. doi 10.1016/j.matchemphys.2004.09.027
186.
Койфман О.И., Агеева Т.А. Рос. хим. ж. 2004, 48,
140-153. [Koifman O.I., Ageeva T.A. Ross. Khim.
202.
Chauhan S.M.S., Sahoo B.B., Srinivas K.A. Synth.
Zh. 2004, 48, 140-153.]
Commun.
2001,
31,
33-37. doi
10.1081/scc-
100000176
187.
Kappe C.O., Stadler A., Dalinger D. Microwaves
203.
Liu M.O., Tai C.H., Wang W.Y., Chen J.R., Hu A.T.,
in Organic and Medicinal Chemistry. 2nd Edn.
Wei T.H. J. Organomet. Chem. 2004, 689, 1078-1084.
Weinheim: Wiley-VCH. 2012.
doi 10.1016/j.jorganchem.2004
188.
Soni J.P., Chemitikanti K.S., Joshi S.V., Shanka-
204.
Cho T.J., Shreiner C.D., Hwang S.H., Moore-
raiah N. Org. Biomol. Chem. 2020, 18, 9737-9761.
field C.N., Courneya B., Godínez L.A., Manríquez J.,
doi 10.1039/d0ob01779e
Jeong K.U., Cheng S.Z.D., Newkome G.R. Chem.
189.
Cavaleiro J.A.S., Tomé A.C., Neves M.G.P.M.S.
Commun.
2007,
43,
4456-4458. doi
10.1039/
Handbook of Porphyrin Science. Eds. K.M. Kadish,
b707852h
K.M. Smith, R. Guilard. Singapore: World Scientific.
205.
Mikus A., Bielińska M.E., Lipińska T., Ostrowski S.
2010, 2, 193-294.
Synth. Commun. 2011, 41, 3703-3713. doi 10.1080/
190.
Gürek A.G., Hirel C. Photosensitizers in Medicine,
00397911.2010.52018
Environment and Security. Eds. T. Nyokong,
206.
De Paula R., Faustino M.A.F., Pinto D.C.G.A., Ne-
V. Ahsen. The Netherlands: Springer. 2012, 47-120.
ves M.G.P.M.S., Cavaleiro J.A.S., J. Heterocycl. Chem.
doi 10.1007/978-90-481-3872-2_2
2008, 45, 453-459. doi 10.1002/jhet.5570450224
191.
Pinto S.M.A., Henriques C.A., Tomé V.A., Vinag-
207.
Nascimento B.F.O., Pineiro M., Rocha Gonsal-
reiro C.S., Calvete M.J.F., Dąbrowski J.M., Piñei-
ves A.M.dA., Silva M.R., Beja A.M., Paixão J.A.
roa M., Arnauta L.G., Pereira M.M. J. Porphyr.
J. Porphyr. Phthalocyanines. 2007, 11, 77-84. doi
Phthalocyanines. 2016, 20, 45-60. doi 10.1142/
10.1142/S1088424607000102
s1088424616300020
208.
Nascimento B.F.O., Rocha Gonsalves A.M.dA.,
Pineiro M. Inorg. Chem. Commun. 2010, 13, 395-
192.
Pineiro M. Curr. Org. Synth. 2014, 11, 89-109. doi
398. doi 10.1016/j.inoche.2009.12.032
10.2174/157017941131066600
209.
Gao Y., Pan J.G., Huang Y.J., Ding S.Y., Wang M.L.
193.
Petit A., Loupy A., Maiuardb P., Momenteaub M.
J. Porphyr. Phthalocyanines. 2015, 19, 1251-1255.
Synth. Commun. 1992, 22, 1137-1142. doi 10.1080/
doi 10.1142/S1088424615501096
00397919208021097
210.
Silva M., Azenha M.E., Pereira M.M., Burrows H.D.,
194.
Radha Kishan M., Radha Rani V., Murty M.R.V.S.,
Sarakha M., Forano C., Ribeiro M.F., Fernandes A.
Sita Devi P., Kulkarni S.J., Raghavan K.V. J. Mol.
Appl. Catal. B: Environ. 2010, 100, 1-9. doi 10.1016/
Catal. A: Chem. 2004, 223, 263-267. doi 10.1016/
j.apcatb.2010.07.033
j.molcata.2003.07.022
211.
Silva M., Fernandes A., Bebiano S.S., Calvete M.J.F.,
195.
Radha Kishan M., Radha Rani V., Sita Devi P.,
Ribeiro M.F., Burrows H.D., Pereira M.M. Chem.
Kulkarni S.J., Raghavan, K.V. J. Mol. Catal. A: Chem.
Commun.
2014,
50,
6571-6573. doi
10.1039/
2007, 269, 30-34. doi 10.1016/j.molcata.2007.01.004
C4CC01100G
212.
Calvete M.J.F., Dias L.D., Henriques C.A., Pin-
196.
Socoteanu R., Boscencu R., Nacea V., Sousa Olivei-
to S.M.A., Carrilho R.M.B., Pereira M.M. Molecules.
ra A., Ferreira L.F.V. Rev. Chim. 2008, 59, 969-972.
2017, 22, 741-751. doi 10.3390/molecules220507
197.
Boscencu R., Socoteanu R., Vasiliu G., Nacea V. Rev.
213.
Vinagreiro C.S., Gonçalves N.P.F., Calvete M.J.F.,
Chim. 2014, 65, 888-891.
Schaberle F.A., Arnaut L.G., Pereira M.M. J.
198.
Boscencu R. Molecules. 2011, 16, 5604-5617. doi
Fluorine Chem. 2015, 180, 161-167. doi 10.1016/
10.3390/molecules16075604
j.jfluchem.2015.09
199.
Ferreira L.F.V., Ferreira D.P., Oliveira A.S., Boscen-
214.
Simões A.V.C., Pinto S.M.A., Calvete M.J.F., Go-
cu R., Socoteanu R., Ilie M., Constantin C., Nea-
mes C.M.F., Ferreira N.C., Castelo-Branco M.,
gu M. Dyes Pigm. 2012, 95, 296-303. doi 10.1016/
Llop J., Pereira M.M., Abrunhosa A.J. RSC Adv.
j.dyepig.2012.05.012
2015, 5, 99540. doi 10.1039/C5RA16103G
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ОСНОВНЫЕ СТР
АТЕГИИ СИНТЕЗА мезо-АРИЛПОРФИРИНОВ
379
215.
Henriques C.A., Pinto S.M.A., Pina J., Serpa C.,
Liquids: Theory and Practice (Problems of solution
Fernandes A., Rossi L.M., Ribeiro M.F., Perei-
chemistry). Ed. A.Y. Tsivadze. Ivanovo: Ivanovo
ra M.M., Calvete M.J.F. Dalton Trans. 2016, 45,
Publishing House, 2019.]
16211-16220. doi 10.1039/c6dt02428a
230.
Wasserscheid P., Welton T. Ionic Liquids in Synthesis.
216.
Lucas R., Vergnaud J., Teste K., Zerrouki R., Sol V.,
Weinheim: Wiley-VCH. 2008.
Krausz P. Tetrahedron Lett. 2008, 49, 5537-5539. doi
231.
Amarasekara, A.S. Chem. Rev. 2016, 116, 6133-6183.
10.1016/j.tetlet.2008.07.058
doi 10.1021/acs.chemrev.5b00763
217.
Boëns B., Faugeras P.-A., Vergnaud J., Lucas R., Tes-
232.
Kitaoka S., Nobuoka K., Ishikawa Y. Chem. Commun.
te K., Zerrouki R. Tetrahedron. 2010, 66, 1994-1996.
2004, 17, 1902-1903. doi 10.1039/b404241g
doi 10.1016/j.tet.2010.01.055
233.
Kitaoka S., Nobuoka K., Ishikawa Y. Tetrahedron.
218.
Hölzel H., Muth M., Lungerich D., Jux N.
2005, 61, 7678-7685. doi 10.1016/j.tet.2005.05.097
Chemistry-Methods. 2021, 1, 142-147. doi 10.1002/
234.
Kitaoka S., Nobuoka K., Hirakawa R., Ihara K.,
cmtd.202000055
Ishikawa Y. Chem. Lett. 2013, 42, 1397-1399. doi
219.
Кустов Л.М., Белецкая И.П. Рос. хим. ж. 2004, 48,
10.1246/cl.130662
3-12. [Kustov L.M., Beletskaya I.P Russ. Chem. J.
235.
Kitaoka S., Nobuoka K., Ihara K., Ishikawa Y.
2004, 48, 1-12.]
RSC Adv.
2014,
4,
26777-26782. doi
10.1039/
220.
Моисеев И.И. Усп. хим.
2013,
82,
616-623.
C4RA02522A
[Moiseev I.I. Russ. Chem. Rev. 2013, 82, 616-623.]
236.
Babu M.M., Amaravathi M., Giribabu L., Chandra-
doi 10.1070/RC2013v082n07ABEH004393
mouli G. J. Chem. Res. 2008, 2008, 666-668. doi
221.
Галкин А.А., Лунин В.В. Усп. хим. 2005, 74, 24-40.
10.3184/030823408x375124
[Galkin A.A., Lunin V.V. Russ. Chem. Rev. 2005, 74,
237.
Rawat A.K., Bhattacharya S., Chauhan S.M.S. Tetra-
24-40.] doi 10.1070/RC2005v074n01ABEH001167
hedron Lett. 2014, 55, 4537-4540. doi 10.1016/
222.
Dallinger D., Kappe C.O. Chem. Rev. 2007, 107,
j.tetlet.2014.05.00
2563-2591. doi 10.1021/cr0509410
238.
Kitaoka S., Hori T., Nobuoka K. Mat. Res. Soc. Jpn.
223.
Rathi A.K., Gawande M.B., Zboril R., Varma R.S.
2020, 45, 109-113. doi 10.14723/tmrsj.45.109
Coord. Chem. Rev. 2015, 291, 68-94. doi 10.1016/
239.
Jain N., Kumar A., Chauhan S.M.S. Synth. Commun.
j.ccr.2015.01.011
2005, 35, 1223-1230. doi 10.1081/scc-200054823
224.
Kremsner J.M., Kappe C.O. Eur. J. Org. Chem. 2005,
240.
Ardila-Fierro K.J., Hernández J.G. ChemSusChem.
3672-3679. doi 10.1002/ejoc.200500324
2021, 14, 2145-2162. doi 10.1002/cssc.202100478
225.
Weingärtner H., Franck E.U. Angew. Chem., Int. Ed.
241.
Suslick K.S. Faraday Discuss. 2014, 170, 411-422.
2005, 44, 2672-2692. doi 10.1002/anie.200462468
doi 10.1039/C4FD00148F
226.
Henriques C.A., Pinto S.M.A., Aquino G.L.B., Pinei-
242.
Tan D., Friščić T. Eur. J. Org. Chem. 2017, 2018, 18-
ro M., Calvete M.J.F., Pereira M.M. ChemSusChem.
33. doi 10.1002/ejoc.201700961
2014, 7, 2821-2824. doi 10.1002/cssc.201402464
243.
Shy H., Mackin P., Orvieto A.S., Gharbharan D., Pe-
227.
Henriques C.A., Pinto S.M.A., Pineiro M., Canotil-
terson G.R., Bampos N., Hamilton T.D. Faraday
ho J., Eusébio M.E.S., Pereira M.M., Calvete M.J.F.
Discuss. 2014, 170, 59-69. doi 10.1039/c3fd00140g
RSC Adv.
2015,
5,
64902-64910. doi
10.1039/
244.
Su Q., Hamilton T.D. Beilstein J. Org. Chem. 2019,
c5ra11820d
15, 1149-1153. doi 10.3762/bjoc.15.111
228.
Henriques C.A., Pinto S.M.A., Canotilho J., Erme-
245.
Gomes C., Peixoto M., Pineiro M. J. Porphyr.
linda M., Eusébio S., Calvete, M.J.F. J. Porphyr.
Phthalocyanines. 2019, 23, 889-897. doi 10.1142/
Phthalocyanines. 2016, 20, 843-854. doi 10.1142/
s1088424619500755
S1088424616500516
246.
Gomes C., Vinagreiro C.S., Damas L., Aquino G.,
229.
Ионные жидкости: теория и практика (Пробле-
Quaresma J., Pimenta C., Campos J., Pereira M.,
мы химии растворов) Ред. А.Ю. Цивадзе. Ивано-
Pineiro M. ACS Omega. 2020, 5, 10868. doi 10.1021/
во: Ивановский издательский дом. 2019. [Ionic
acsomega.0c00521
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
380
КОЙФМАН, АГЕЕВА
The Main Strategies for the Synthesis of meso-Arylporphyrins
O. I. Koifman and T. A. Ageeva*
Ivanovo State University of Chemistry and Technology, Sheremetevskiy prosp., 7, Ivanovo, 153000 Russia
*e-mail: president@isuct.ru, tageeva@isuct.ru
Received November 15, 2021; revised December 12, 2021; accepted December 28, 2021
meso-Arylporphyrins, as the most accessible objects among tetrapyrrole macroheterocycles, have been the
focus of attention of researchers on the practically useful properties of these compounds. In this regard, the
history of the development of their synthesis has about 90 years. During this time, the yields in the synthesis of
these compounds was increased from 5 to 80%. The ways and methodologies of various meso-aryl-substituted
porphyrin synthesis was analyzed in the review, and the most effective methods that can lead, if necessary, to
the industrial scale of their production were shown.
Keywords: meso-arylporphyrins, synthesis, pyrrole-aldehyde condensation, cyclotetramerization, synthesis
strategies, mixed-pyrrole condensation, alternative synthesis methods, microwave synthesis, mechanochemical
synthesis, ionic liquids
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022