ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 4, с. 392-405
УДК 547.521
ВОЗМОЖНЫЕ СКЕЛЕТНЫЕ ТРАНСФОРМАЦИИ
ЦИКЛООКТАТЕТРАЕНА ПРИ ЕГО ТЕРМИЧЕСКОЙ
ИЗОМЕРИЗАЦИИ
© 2022 г. О. Б. Томилин, Л. В. Фомина, Е. В. Родионова*
ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева»,
Россия, 430005 Саранск, ул. Большевистская, 68
*e-mail: rodionova_j87@mail.ru
Поступила в редакцию 02.09.2021 г.
После доработки 18.11.2021 г.
Принята к публикации 22.11.2021 г.
Исходя из свойств сопряженной системы р-электронов в циклических полиенах, найдены все возможные
пространственные структуры переходных состояний при скелетной трансформации циклооктатетраена
под действием температуры в бескислородной атмосфере. Существование переходных состояний об-
уславливается различными уровнями стабилизационного эффекта сопряжения р-электронов. Методом
DFT в приближении B3LYP c использованием базисного набора 6-31G* подтверждено существование
30 переходных состояния путем исследования фрагментов поверхности потенциальной энергии и харак-
тера установленных стационарных точек. Используя метод Гонсалеса-Шлегеля нахождения потенци-
альных барьеров реакций, построена схема термической изомеризации циклооктатетраена, состоящая
из 47 протекающих прямых и обратных реакций. Найдены их кинетические характеристики в виде
величин потенциальных барьеров. Полученные результаты соответствуют имеющимся в литературе
экспериментальным данным.
Ключевые слова: сопряжение, молекулярные графы, основное состояние, переходное состояние, по-
тенциальный барьер, термическая изомеризация
DOI: 10.31857/S0514749222040048, EDN: OAUFPO
ВВЕДЕНИЕ
тельства является пространственная структура и
энергия переходного состояния, которое дости-
Теоретическое построение механизма реакции
гается в тех или иных внешних условиях. Таким
органических соединений, как правило, основы-
образом, в теории реакционной способности ор-
вается на характеристиках электронного строения
ганических соединений проблема моделирования
молекул субстрата и реагента. Реализация взаимо-
всех возможных переходных состояний исходных
действия, исходя из тех или иных сочетаний этих
молекул в значительной степени сдерживает в на-
характеристик, часто оговаривается специальны-
стоящее время масштабный молекулярный дизайн
ми правилами, подтверждаемыми эксперимен-
целевых продуктов.
тально. Так как нахождение электронных характе-
ристик молекул субстрата и реагента осуществля-
Обсуждая эту задачу, следует выделить значи-
ется, в основном, в приближении изолированной
мые физико-химические взаимодействия, вызы-
молекулы, то сформулированные правила взаи-
вающие структурную трансформацию исходных
модействия оказываются в сильной зависимости
молекул. Естественно, что уровень значимости
от внешних условий реализации процесса, меняя
тех или иных физико-химических взаимодействий
подчас принципиально продукты взаимодействия
определяется классом рассматриваемых молекул.
реагирующих молекул. Причиной этого обстоя-
В качестве таких классов выделим, во-первых,
392
ВОЗМОЖНЫЕ СКЕЛЕТНЫЕ ТР
АНСФОРМАЦИИ ЦИКЛООКТАТЕТРАЕНА
393
насыщенные молекулы, имеющие изолированные
их перпендикулярной ориентации относитель-
функциональные группы в составе как углеродно-
но углеродного остова. Показано, что в молеку-
го каркаса, так и каркаса с гетероатомами, во-вто-
ле бензола, удовлетворяющей правилу Хюккеля,
рых, молекулы с сопряженной системой р-элек-
из всех возможных пространственных изомеров
тронов.
один является основным состоянием, все осталь-
ные - переходными состояниями. Убедительное
Для первого класса молекул основное значимое
соответствие полученных теоретических резуль-
физико-химическое взаимодействие представляет
татов и экспериментальных данных стимулиру-
собой трансаннулярное взаимодействие - стери-
ет проверку предложенного метода на других
ческое взаимодействие. Переходные состояния,
[N]-аннуленах, например, циклооктатетраене
порождаемые этим взаимодействием, образуют-
(ЦОТ). Более того, выбор ЦОТ мотивируется тем
ся преимущественно вращением радикальных
обстоятельством, что [8]-аннулен не подчиняется
фрагментов вокруг имеющихся простых связей.
правилу Хюккеля, с одной стороны, и, с другой,
Классическим примером таких переходных состо-
имеет значительную теоретическую и экспери-
яний являются заслоненные конформации молеку-
ментальную библиографию о своей скелетной
лы этана по отношению к заторможенным конфор-
трансформации, проходящей в бескислородной
мациям.
атмосфере. По этому поводу следует отметить те-
Можно отметить различные подходы к описа-
оретические работы О. Костаньо и др. по последо-
вательному и системному исследованию термиче-
нию стерических взаимодействий, а именно: мо-
дели пересекающихся парабол и пересекающихся
ской изомеризации циклооктатетраена [6-8].
кривых Морзе [1], модель конусных углов Толмана
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
[2], стереоатомная модель строения кристалличе-
А. МЕТОДЫ И МОДЕЛИ
ских веществ, опирающейся на характеристики
В соответствии с методом определения струк-
полиэдров Вороного-Дирихле [3], модель стери-
туры переходных состояний в планарных аннуле-
ческих сфер [4]. Заметим, что учет стерических
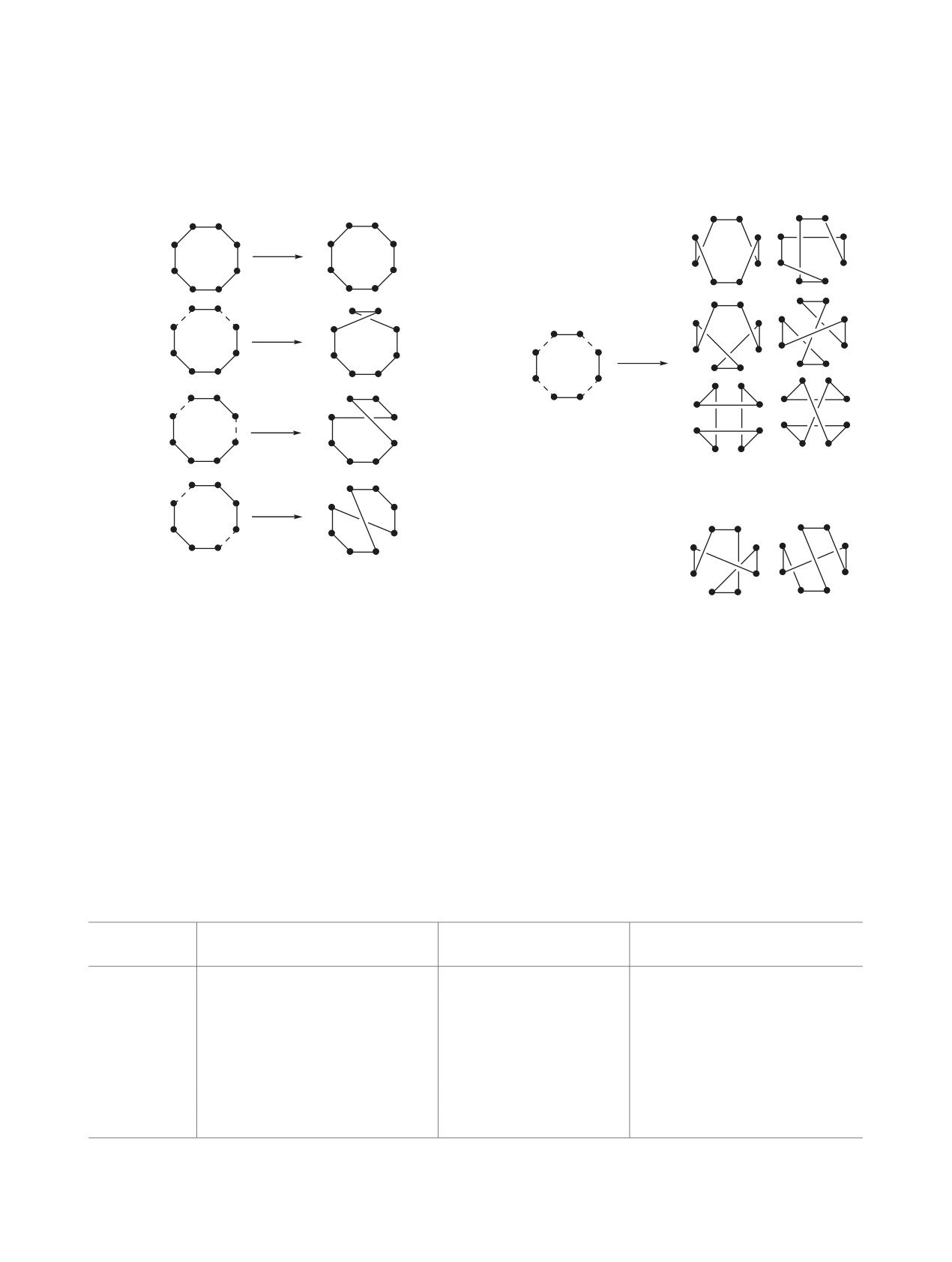
нах [5] построим все возможные изоспектральные
взаимодействий на реакционную способность мо-
молекулярные графы плоского ЦОТ с различным
лекул распространяется и на второй класс выде-
четным числом L инверсии знака в системе базис-
ляемых молекул в том случае, если вращающиеся
ных атомных орбиталей (L = 0, 2, 4, 6, 8), образу-
функциональные группы, не входящие в сопря-
ющих нижнюю связывающую молекулярную ор-
женную систему р-электронов, играют ключевую
биталь сопряженной системы р-электронов. Такие
роль в протекающей химической реакции.
изоспектральные графы существуют при условии,
Для второго класса молекул основное значимое
если число возникающих в исходном графе ребер
физико-химическое взаимодействие представляет
L с величиной связанности -1 будет четным L = 0,
собой состояние сопряженной системы р-электро-
2, 4, 6, ... (рис. 1).
нов. Однако, если переходные состояния ацикли-
Для значений L ≥ 2 возможно построение не-
ческих молекул полиенового типа, в основном,
скольких базовых изоспектральных графов с раз-
определяются закономерностями молекул первого
личным распределением величины связывания
класса, благодаря вращению радикальных фраг-
-1 по связям углеродного кольца для фиксирован-
ментов вокруг имеющихся простых связей, то
ного L. Каждый базовый изоспектральный граф
образование переходных состояний сопряженных
может порождать 1 или несколько молекуляр-
циклических молекул требует скелетной транс-
ных изоспектральных графов, отражающих про-
формации.
странственную структуру переходного состояния
(рис. 2). Построенные молекулярные изоспек-
В [5] на примере планарных аннуленов проде-
тральные графы могут быть как хиральными, так
монстрирован метод построения всех возможных
и ахиральными.
пространственных изомеров, в которых достига-
ется в той или иной степени стабилизирующий
Для молекулы циклооктатетраена (ЦОТ) с раз-
эффект сопряжения р-электронов при сохранении
личными возможными значениями L можно по-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
394
ТОМИЛИН и др.
Базовый
Молекулярный
Молекулярные
изоспектральный
изоспектральный
изоспектральные
граф:
граф:
хиральные графы:
L = 0
Базовый
изоспектральный
граф:
L = 2
L = 2
Молекулярные
изоспектральные
ахиральные графы:
L = 2
Рис.
1. Примеры изоспектральных графов для
[8]-аннуленов
Рис. 2. Пример соотнесения между собой базовых и
строить 96 различных изоспектральных молеку-
молекулярных изоспектральных графов для L = 4
лярных графов, которые представлены в табл. 1.
Учитывая, что количество возможных молеку-
лярных графов для ЦОТ велико (96), ограничим-
Так как образующиеся изоспектральные мо-
ся исследованием молекулярных графов, кото-
лекулярные графы
[8]-аннулена представляют
рым соответствуют следующие значения L: L = 0
собой двумерные сети, то реальные переходные
(1 граф), L = 2 (3 графа), L = 4 (20 графов). Для L =
состояния, соответствующие таким графам, бу-
6, 8 рассмотрим только некоторые из возможных:
дут иметь неплоскую структуру с сохраняющейся
L = 6 (5 графов). Всего исследованы простран-
ориентацией pz-АО. Различная структура молеку-
ственные структуры, соответствующие 30 графам.
лярных орбиталей сопряженной системы, занятых
Таким образом, для L = 0, 2, 4 исследовано суще-
электронами, обуславливает существование про-
ствование всех возможных пространственных пе-
странственных структур с различными уровнями
реходных состояний термической изомеризации
эффекта сопряжения р-электронов.
циклооктатетраена.
Таблица 1. Количество изоспектральных графов ЦОТ для различных значений L
Общее количество
Число хиральных
Число ахиральных
L
изоспектральных графов
изоспектральных графов
изоспектральных графов
0
1
1
0
2
3
3
0
4
20
8
12
6
53
10
43
8
19
10
9
Итого
96
31
65
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ВОЗМОЖНЫЕ СКЕЛЕТНЫЕ ТР
АНСФОРМАЦИИ ЦИКЛООКТАТЕТРАЕНА
395
Б. ЭНЕРГИИ ПЕРЕХОДНЫХ СОСТОЯНИЙ
раен имеет неплоскую форму углеродного остова
Исследование ППЭ в рамках используемого
в конфигурации ванна [6], которая способна к ав-
тоизомеризации через плоские изомеры симме-
метода показывает, что для всех рассмотренных
пространственных изомеров, соответствующих
трии D4h или D8h. Стабильность такой геометри-
изоспектральным графам молекулы ЦОТ, найде-
ческой структуры циклооктатетраена, имеющего
ны стационарные точки, причем все найденные
8 рz-электронов, определяется следствием правила
стационарные точки соответствуют переходным
Хюккеля, установленного для π-электронного со-
состояниям (количество мнимых колебательных
пряжения.
частот равно 1).
Проведенные расчеты также показывают, что
Для L = 0 молекулярному графу соответству-
наиболее устойчивой геометрической структурой
ют два плоских переходных состояния, имеющих
ЦОТ является конформация ванна, которая явля-
выровненные (D8h) и альтернирующие (D4h) дли-
ется основным состоянием. Плоская конформация
ны С-С связей, что соответствует результатам [6].
[8]-аннулена является антиароматической с точки
Некоторое различие в характере сопряжения р-э-
зрения правила Хюккеля и, таким образом, пред-
лектронов обуславливает различие в полной энер-
ставляет собой переходное состояние. Однако, от-
гии данных изомеров: полная энергия изомера
сутствие узлов в нижней молекулярной π-орбита-
симметрии D4h меньше, чем полная энергия изо-
ли делает его наиболее устойчивым среди других
мера симметрии D8h. Такое соотношение величин
возможных переходных состояний. Молекулярный
полных энергий в данных изомерах может быть
граф с L = 0 имеет две плоских пространственных
обусловлено эффектом Яна-Теллера.
реализации в виде переходного состояния TS1(a)
На рис. 3 представлены полные энергии TSх
симметрии D4h (аннулен с чередующимися двой-
(x - номер переходного состояния) ЦОТ. Как видно
ными связями) и переходного состояния TS1(б)
из представленных данных, исследованные пере-
симметрии D8h (аннулен с выровненными связя-
ходные состояния циклооктатераена по величине
ми). Разница в энергиях переходных состояний
полной энергии распадаются на несколько групп,
ΔЕ[TS1(а)-TS1(б)] равна 15.12 ккал/моль.
каждая из которых соответствует определенно-
му значению L: TS1(а), - L = 0; TS2-TS4 - L = 2;
Известно, что для циклооктатетраена в кон-
TS5-TS24 - L = 4; TS25-TS31 - L = 6. Соотнесение
формации
«ванна» характерны процессы ин-
переходных состояний найденным изоспектраль-
версии цикла и миграции двойных связей, энер-
ным графам проводилось на основе анализа про-
гии активации которых, согласно литератур-
странственных структур TSх.
ным данным, составляют 10-12 [6, 9-12] и 13-
15 [6, 9, 12] ккал/моль, соответственно. Сопос-
Из данных рис. 3 следует, что полная энергия
тавление имеющихся экспериментальных дан-
переходных состояний монотонно увеличивается
ных с результатами исследования ППЭ циклоок-
как внутри группы с фиксированным значением
L, так и с ростом величины L. Интервалы изме-
татетраена, представленных на рис. 4, позволяет
нения энергии TSх внутри группы не превышает
10.1 кДж/моль для L = 2, 4, 6. При переходе из
1 234 5678910121416182022242527 29
группы с L = 2 в группу с L = 4 полная энергия
увеличивается на 15,7 кДж/моль, из с L = 4 в груп-
пу с L = 6 - на 18.0 кДж/моль. Этот результат об-
уславливает возможность реализации различных
путей термической трансформации ЦОТ при от-
носительно равных температурах.
В. ТЕРМИЧЕСКАЯ ИЗОМЕРИЗАЦИЯ
ЦИКЛООКТАТЕТРАЕНА ПРИ L = 0
Etot, ккал/моль
Экспериментальные исследования C8H8 пока-
Рис. 3. Величины полной энергии переходных состоя-
зывают, что реально существующий циклооктате-
ний (ТSх) циклооктатераена
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
396
ТОМИЛИН и др.
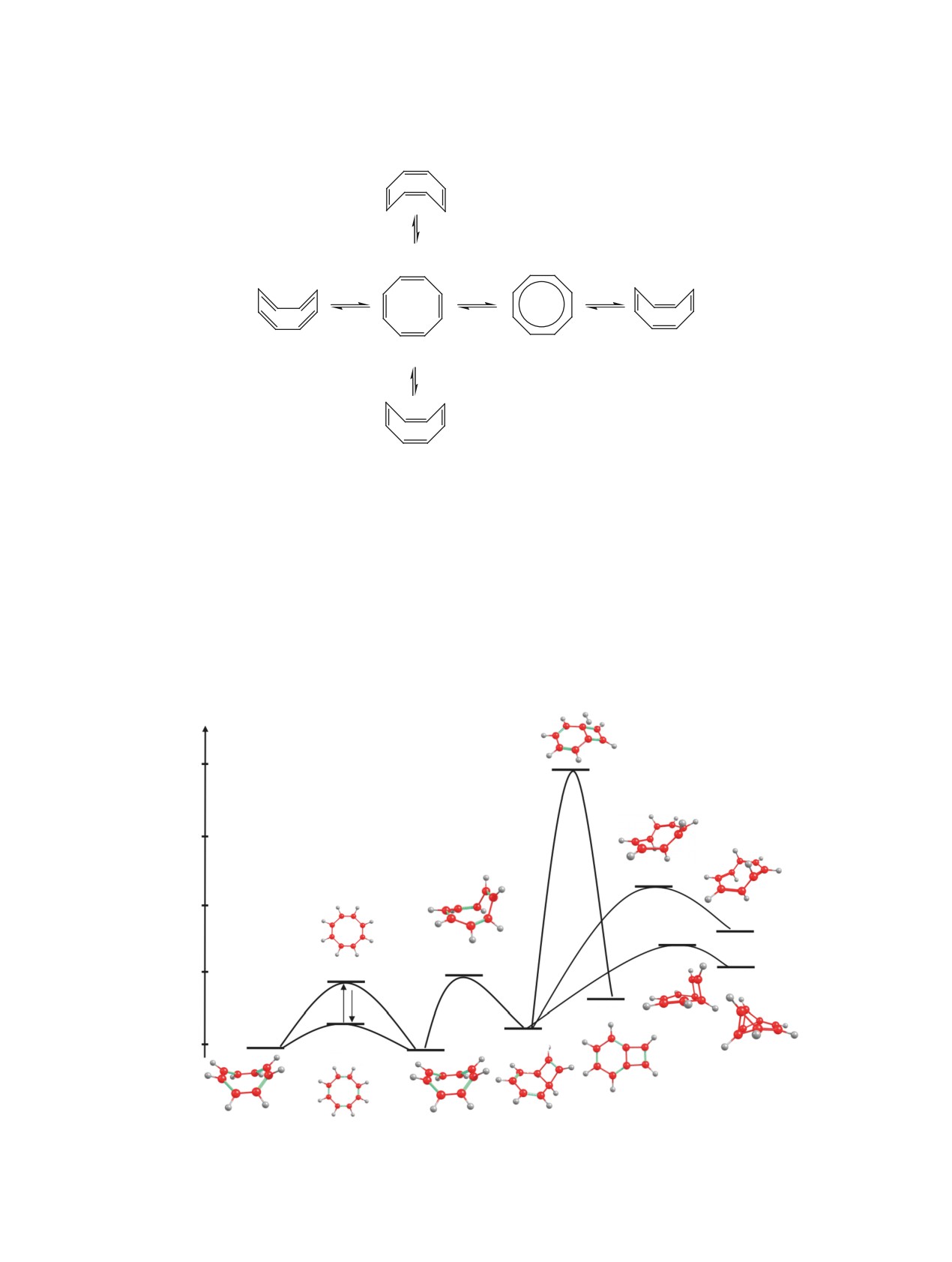
Схема 1
TS1(а)
TS1(б)
I
II
D4h
D8h
описать механизмы процессов структурной изо-
Миграцию двойных связей в молекуле ЦОТ
меризации ЦОТ «самого в себя» следующей схе-
можно представить в виде двухстадийного про-
мой 1.
цесса, показанного на схеме 1. На первой стадии
(I) образуется переходное состояние с альтерни-
Как видно из представленной схемы 1, инвер-
рующими связями TS1(a). Вторая стадия (II) пред-
сия цикла ЦОТ осуществляется через образование
ставляет собой валентную таутомеризацию пере-
переходного состояния TS1(a) симметрии D4h с
ходного состояния TS1(a) в конформацию «ванна»
потенциальным барьером ΔЕ[TS1(а)-М1], равным
через образование плоского переходного состо-
9.85 ккал/моль, что соответствует эксперимен-
яния TS1(б) с полностью делокализованными
тальному значению.
π-электронами.
Etot, ккал/моль
TS20
-194164
-194190
TS10
-194216
M4
TS7
TS4
-194242
TS1(б)
M3
M5
-194268
M2
M1
M1
TS1(а)
+ H2
Рис. 4. Пути термической изомеризации циклооктатетраена в продукты М2, М3, М4, М5
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ВОЗМОЖНЫЕ СКЕЛЕТНЫЕ ТР
АНСФОРМАЦИИ ЦИКЛООКТАТЕТРАЕНА
397
Скорость процесса миграции двойных связей
Проведенные расчеты подтвердили возмож-
определяется лимитирующей второй стадией. Как
ность скелетной трансформации ЦОТ (М1) в
видно из представленной схемы 1 и рис. 4, вели-
бицикло[4.2.0]окта-2,4,7-триен (М2). Величина
чина барьера активации лимитирующей стадии
потенциального барьера указанного процесса
ΔЕ[TS1(б)-TS1(а)] составляет 15.12 ккал/моль,
ΔE(TS4-M1), составляющая 28.93 ккал/моль [6,
10] соответствует имеющимся эксперименталь-
что соответствует экспериментальным данным [6,
ным данным (28.10 ккал/моль) [6, 10]. Как вид-
9, 12].
но из рис. 4 и табл. 2, обратный процесс изоме-
Г. ТЕРМИЧЕСКАЯ ИЗОМЕРИЗАЦИЯ
ризации М2 в ЦОТ характеризуется меньшим
ЦИКЛООКТАТЕТРАЕНА ПРИ L ≥ 2
значением энергии активации, что обеспечивает
условия протекания указанной реакции даже при
Как отмечалось в ряде экспериментальных ис-
низких температурах [6]. Полученный резуль-
следований [6, 10, 13-17], циклооктатетраен спо-
тат подтверждается литературными данными.
собен к термическим скелетным трансформациям
Значение энергии активации, полученной по ре-
в бескислородной атмосфере, образуя новые изо-
зультатам кинетических исследований реакции
мерные стабильные продукты. Например, сообща-
превращения бицикло[4.2.0]окта-2,4,7-триена в
ется о реакции валентной изомеризации циклоок-
ЦОТ в температурном интервале от -20 до 0°C
татетраена (М1) в бицикло[4.2.0]окта-2,4,7-триен
(18.7±0.8 ккал/моль) [6, 13], совпадает с рассчи-
(M2) [10], в тетрацикло[4.2.02,8.05,7]октен (М3)
танной нами величиной потенциального барьера
[13], в семибульвален (M6) [6,14] и бицикло[2.2.2]-
ΔE(TS4-М2), равной 19.45 ккал/моль.
окта-2,5,7-триен (баррелен) (М7) [6].
Как видно из рис.
4, бицикло[4.2.0]окта-
Используя полученные данные о возможных
2,4,7-триен (М2) может подвергаться дальнейшей
переходных состояниях, можно построить следу-
скелетной трансформации, приводящей к образо-
ющие непротиворечивые пути термической изо-
ванию тетрацикло[4.2.02,8.05,7]октена (М3) через
меризации ЦОТ (М1) в идентифицированные про-
образование переходного состояния TS7.
дукты:
В [13] представлены кинетические характери-
М1→TS4→M2→TS7→M3,
стики процесса термической изомеризации цикло-
октатетраена М1 в M3 в температурном интервале
М1→TS4→M2→TS10→M4,
100-400°C. Отмечено, однако, что в указанных ус-
М1→TS4→M2→TS20→M5,
ловиях продукт M3 не был выделен в устойчивом
состоянии. Авторы [13] предположили следую-
представленные на рис. 4 и подтвержденные про-
щую двух стадийную схему процесса (схема 2).
цедурой IRC. В табл. 2 представлены величины
потенциальных барьеров для процессов, показан-
Согласно
[13], образование тетрацикло-
ных на рис. 4.
[4.2.02,8.05,7]октена (М3) осуществляется по меха-
Таблица 2. Величины потенциальных барьеров ΔE процессов TSx-My термической изомеризации циклооктатера-
енаa
Процесс TSх-My
ΔE, ккал/моль
Процесс TSх-My
ΔE, ккал/моль
TS1(а)-M1
9.85
TS7-M3
11.48
TS1(б)-M1
24.98
TS10-M2
53.21
TS1(б)-TS1(а)
15.12
TS10-M4
6.40
TS4-M1
28.93
TS20-M2
98.83
TS4-M2
19.45
TS20-M5
78.38
TS7-M2
35.77
a x - номер переходного состояния, y - номер молекулы в основном состоянии
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
398
ТОМИЛИН и др.
Схема 2
Реакция дегидрирования бицикло[4.2.0]-
окта-2,4,7-триена
характеризуется довольно
высокой энергией активации: ΔE(TS20-M4)
98.83 ккал/моль. Однако, продукт М5 отличает-
ся большей термодинамической устойчивостью,
M1
M2
M3
по сравнению с М3. Этот факт может способство-
низму внутримолекулярного циклоприсоединения
вать образованию М5 в условиях термодинамиче-
Дильса-Альдера бицикло[4.2.0]окта-2,4,7-триена
ского контроля, то есть при высоких температурах.
(М2) с энергией активации 37±3ккал/моль. Рас-
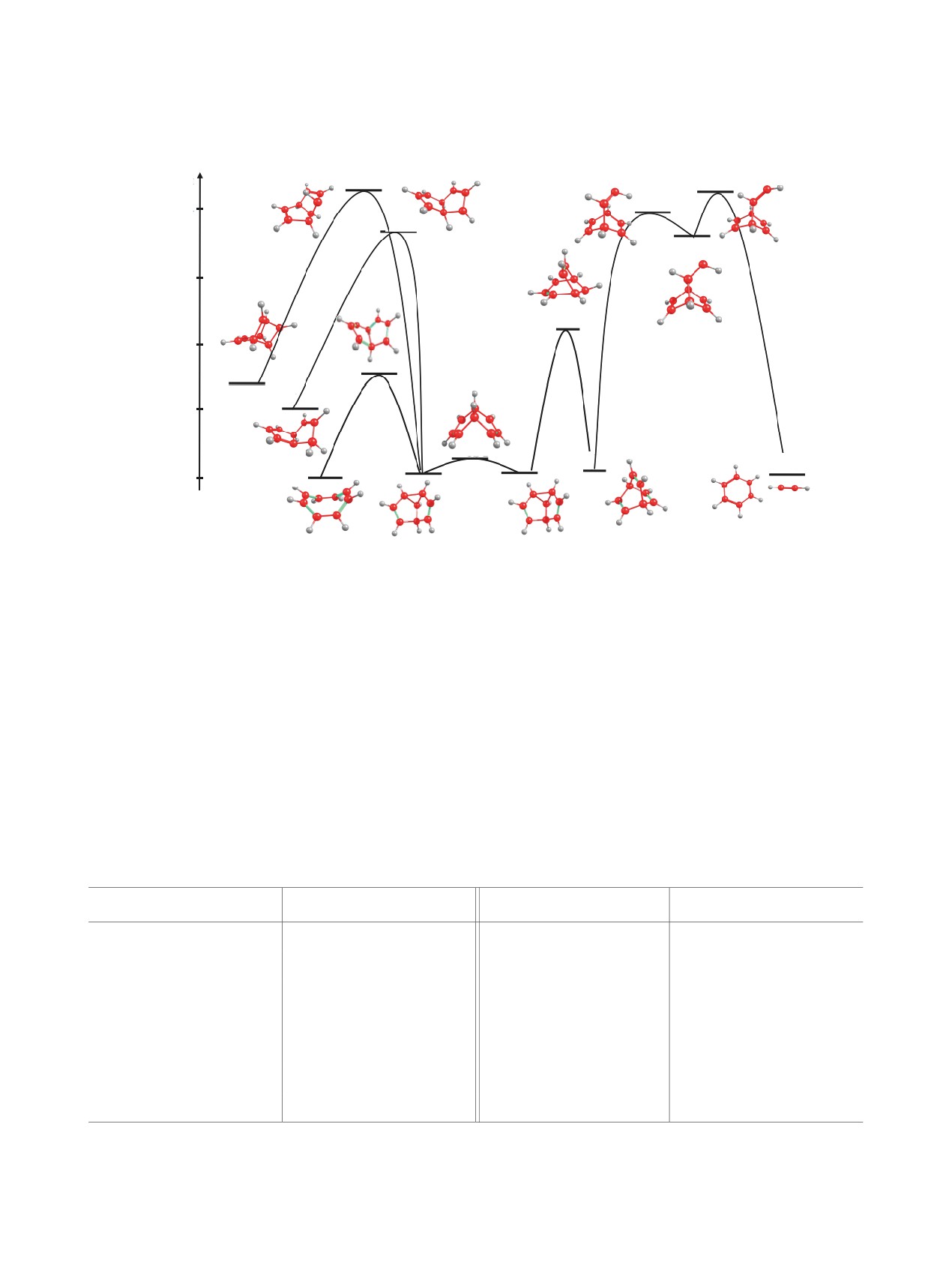
На рис. 5 показаны пути термической изомери-
считанный нами путь термической изомериза-
зации ЦОТ (М1), протекающих с участием семи-
ции М1 в М3 (М1→TS4→M2→TS7→M3) пол-
бульвалена (М6):
ностью подтверждает предложенной в [13] ме-
ханизм. Экспериментальное значение энергии
М1→TS5→M6→TS9→M7→TS19
активации реакции образования бицикло[4.2.0]-
→M8→TS22→M9,
окта-2,4,7-триена
(37±3ккал/моль) совпадает с
М1→TS5→M6→TS18→M10,
рассчитанным значением потенциального ба-
рьера лимитирующей стадии M2→TS7→M3
М1→TS5→M6→TS21→M11.
(35.77 ккал/моль).
В табл. 3 представлены вычисленные величины
потенциальных барьеров ΔE процессов TSx-My,
Обратный процесс термической изомеризации
представленных выше.
M3 в М1 характеризуется существенно меньшим
значением потенциального барьера активации
Как известно, реакция термической изомериза-
(ΔE[TS7-М3] 11.48 ккал/моль). Таким образом,
ции циклооктатетраена в семибульвален протека-
неудивительно, что тетрацикло[4.2.02,8.05,7]октен
ет при температуре ~ 300°С [8]. Причем экспери-
нестабилен к воздействию температуры, и не был
ментальное значение энергии активации, равное
выделен в условиях проведения реакции, описан-
42.2±0.2 ккал/моль [8, 13], близко к величине рас-
ных в [13].
считанного потенциального барьера ΔЕ(TS5-M1)
В настоящей работе также рассмотрены два
45.12 ккал/моль.
других направления скелетной трансформации
Электронная структура семибульвалена, в ко-
ЦОТ с участием бицикло[4.2.0]окта-2,4,7-триена
торой σ-связи сочленены с двумя сопряженными
(М2), протекающих параллельно процессам обра-
системами π-связей указывает на возможность
зования М3. Первый путь включает термическую
протекания в соединении сигматропной перегруп-
изомеризацию М2 в конформацию кресло М4 че-
пировки - перегруппировки Коупа. Формально эта
рез переходное состояние TS10:
перегруппировка включает разрыв трехчленного
М1→TS4→M2→TS10→M4.
цикла семибульвалена с последующей миграцией
π-связей и замыканием нового трехчленного цик-
Второй - реакцию дегидрирования М2 с об-
ла. Полученные результаты явно указывают на
разованием бицикло[4.2.0]окта-1,3,5,7-тетраена
описанный механизм перегруппировки. Как вид-
(M5):
но из рис. 4, семибульвален способен к автоизо-
М1→TS4→M2→TS20→M5.
меризации через переходное состояние TS2, кото-
рое образуется в результате разрыва связи С-С в
Как видно из табл. 2 и рис. 4 реакция скелетной
трехчленном цикле семибульвалена.
трансформации М2 в М4 имеет худшие кинетиче-
ские (большее значение энергии активации) и тер-
Из литературных данных известно, что в се-
модинамические (менее устойчивый продукт) по
мибульвалене перегруппировка Коупа может осу-
сравнению с параллельной реакцией образования
ществляться даже при температурах ниже 100°С.
М3, рассмотренной выше. Таким образом, образо-
Легкость протекания перегруппировки Коупа в
вание продукта M4 не обеспечивается ни кинети-
семибульвалене подтверждается низким барьером
ческими, ни термодинамическими факторами.
активации ΔЕ(TS2-M6) указанного процесса, со-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ВОЗМОЖНЫЕ СКЕЛЕТНЫЕ ТР
АНСФОРМАЦИИ ЦИКЛООКТАТЕТРАЕНА
399
Etot, ккал/моль
TS21
TS22
TS19
-194164
TS18
M8
-194190
TS9
-194216
M11
TS5
M10
-194242
TS2
M6
M6
M7
M9
–194268
M1
Рис. 5. Пути термической изомеризации циклооктатетраена в продукты М6, М7, М8, М9, М10, М11
ставляющем всего 5.58 ккал/моль (табл. 5). По раз-
трудниками расчетными методами предсказано
ным литературным данным эта величина меняется
стабильное состояние комплексов TS2 с ионами
в интервале 4.8-6.4 ккал/моль [6, 14]. Хотя струк-
Li+. Отметим, что экспериментально показано су-
тура TS2 относится к переходным состояниям,
ществование металлоценов с лигандами TS1(б)
малое число узлов в структуре нижней связываю-
[14].
щей МО допускает некоторый стабилизирующий
Известно, что семибульвален (M6) может
эффект сопряжения в такой системе, который, при
изомеризоваться в баррелен (бицикло[2.2.2]ок-
наложении дополнительных условий может спо-
собствовать переходу TS2 в основное состояние.
та-2,5,7-триен) (М7) фотохимическим путем [6].
Следует отметить, что предположение о возмож-
Данные, представленные на рис. 5 и табл. 5, ука-
ности стабилизации рассмотренного переходного
зывают на возможность осуществления этой реак-
состояния высказывалось Гофманом, Дьюаром,
ции в условиях термического синтеза через обра-
Шлейером и др. [14]. Например, Шлейером с со-
зование переходного состояния TS9. Как видно из
Таблица 3. Величины потенциальных барьеров ΔE процессов TSx-My термической изомеризации циклооктатера-
енаa
Процесс TSх-My
ΔE, ккал/моль
Процесс TSх-My
ΔE, ккал/моль
TS5-M1
45,12
TS9-M6
56,48
TS5-M6
39,66
TS9-M7
52,46
TS2-M6
5,58
TS19-M7
98,58
TS18-M6
96,6
TS19-M8
7,66
TS18-M10
75,55
TS22-M8
14,81
TS21-M6
104,36
TS22-M9
108,87
TS21-M11
75,43
a x - номер переходного состояния, y - номер молекулы в основном состоянии
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
400
ТОМИЛИН и др.
табл.
3 барьер активации указанной реакции
Как показывает проведенное обсуждение, рас-
ΔЕ(TS9-M6) составляет 56.48 ккал/моль. Обратная
смотренные процессы термической изомеризации
реакция характеризуется приблизительно таким
ЦОТ имеют сопоставимые энергии потенциаль-
же значением барьера активации ΔЕ(М7-TS9)
ных барьеров прямых и обратных реакций. Это
52.46 ккал/моль. Сопоставление с барьером
обстоятельство обуславливает эксперименталь-
активации процесса ЦОТ
→ семибульвален
ную идентификацию всех образующихся изоме-
(45.11 ккал/моль), протекающей при температуре
ров ЦОТ. Однако, могут существовать переходные
~ 300°С [8], позволяет предположить возможность
состояния, приводящие к изомерам ЦОТ, которые
термической изомеризации семибульвалена в бар-
очень легко превращаются в исходное соединение.
релен и обратно при температурах выше 300°С.
Если такие соединения выступают в роли интер-
медиатов, то они не обеспечивают дальнейшее
В [13] отмечалось, что в результате пироли-
развитие процессов термической изомеризации.
за баррелена (М7) при высоких температурах
Примером такого интермедиата является молеку-
образуются бензол и ацетилен (М9) в равных
ла циклооктатетраена в конформации полукресло
количествах. Как показали расчеты, реакция
(М12), структура которой показана на рис.
6.
протекает в две стадии. Активационный барьер
Молекула М12 образуется из ЦОТ (рис. 6) с энер-
лимитирующей стадии реакции ΔЕ(TS19-M7)
гией активации ΔЕ(М1-TS3) 21.15 ккал/моль. Для
98.58 ккал/моль существенно превышает акти-
обратной реакции ΔЕ(М12-TS3) 0.69 ккал/моль.
вационный барьер конкурирующей реакции изо-
меризации баррелена в семибульвален. Однако,
Представления о подобных неустойчивых ин-
бензола и ацетилен отличаются высокой стабиль-
термедиатах открывают возможность построения
ностью и их образование может осуществляться в
схемы процессов термической изомеризации син-
тезированных изомеров ЦОТ в исходный циклоок-
условиях термодинамического контроля.
татетраен. На рисунке 6 приведены пути термиче-
На рис. 5 также представлены пути термичес-
ской изомеризации в ЦОТ (М1) через образование
кой изомеризации семибульвалена (М6) в 1,3а-ди-
интермедиата M12 для синтезированных изомеров
гидропентален (М10) и тетрацикло[3.3.02,4.03,6]-
циклооктатетраена: пентацикло[5.1.0.02,4.03,5.06,8]-
окта-7-ен (М11). Однако, высокие барьеры акти-
октана (М16), трицикло[5.1.0.02,8]окта-3,5-дие-
вации (96.60 и 104.36 ккал/моль), а также относи-
на, (октавалена) (М18), трицикло[3.3.0.02,6]ок-
тельно низкая термодинамическая стабильность
та-3,7-диена (M20) и тетрацикло[4.2.0.02,403,5]-
продуктов этих реакций по сравнению с конку-
окта-7-ена (М21). Кроме того, описаны возмож-
рирующей реакцией скелетной трансформации
ные схемы изомеризации неидентифицированных
семибульвалена в баррелен, не обеспечивают не-
экспериментально изомеров М14, М16 (октаби-
обходимые условия для практической реализации
свален) и М17. Следует отметить, что октабисва-
указанных процессов.
лен (М16) получен в виде замещенного произво-
Таким образом, предварительное резюме по-
дного (Z)-3,7-бис(фенилсульфонил)пентацикло-
лученных результатов показывает: во-первых, мо-
[5.1.0.02,4.03,5.06,8]октана [15].
делирование возможных переходных состояний
Приведенные на рисунке продукты M18 и
удовлетворительно описывает экспериментальные
M21 имеют структурное сходство с бензваленом.
процессы термической изомеризации циклоокта-
Октавален (М18), гомолог бензвалена, был синте-
тетраена в идентифицируемые продукты, во-вто-
зирован из гомобульвалена [13, 16]. При темпера-
рых, моделирование возможных переходных со-
туре 60°С октавален легко изомеризуется в цикло-
стояний с трансформированной сопряженной
октатетраен с периодом полураспада τ1/2 5 ч [16].
системой р-электронов могут существенно рас-
Процесс термической изомеризации октавале-
ширить класс лигандов для металлоорганических
на (М18) в циклооктатетраен (М1) осуществляет-
комплексов, в том случае, если имеются благопри-
ся в две стадии (рис. 6):
ятные электронные и геометрические факторы со-
четания лигандов и центрального атома.
М18→TS8→M12→TS3→M1.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ВОЗМОЖНЫЕ СКЕЛЕТНЫЕ ТР
АНСФОРМАЦИИ ЦИКЛООКТАТЕТРАЕНА
401
Etot, ккал/моль
TS23
-194164
TS17
TS16
TS15
TS14
TS13
-194190
M13
M17
TS12
M16
M15
TS11
–194216
M19
M21
TS6
TS8
M20
M14
-194242
M18
TS3
M12
M12
-194268
M1
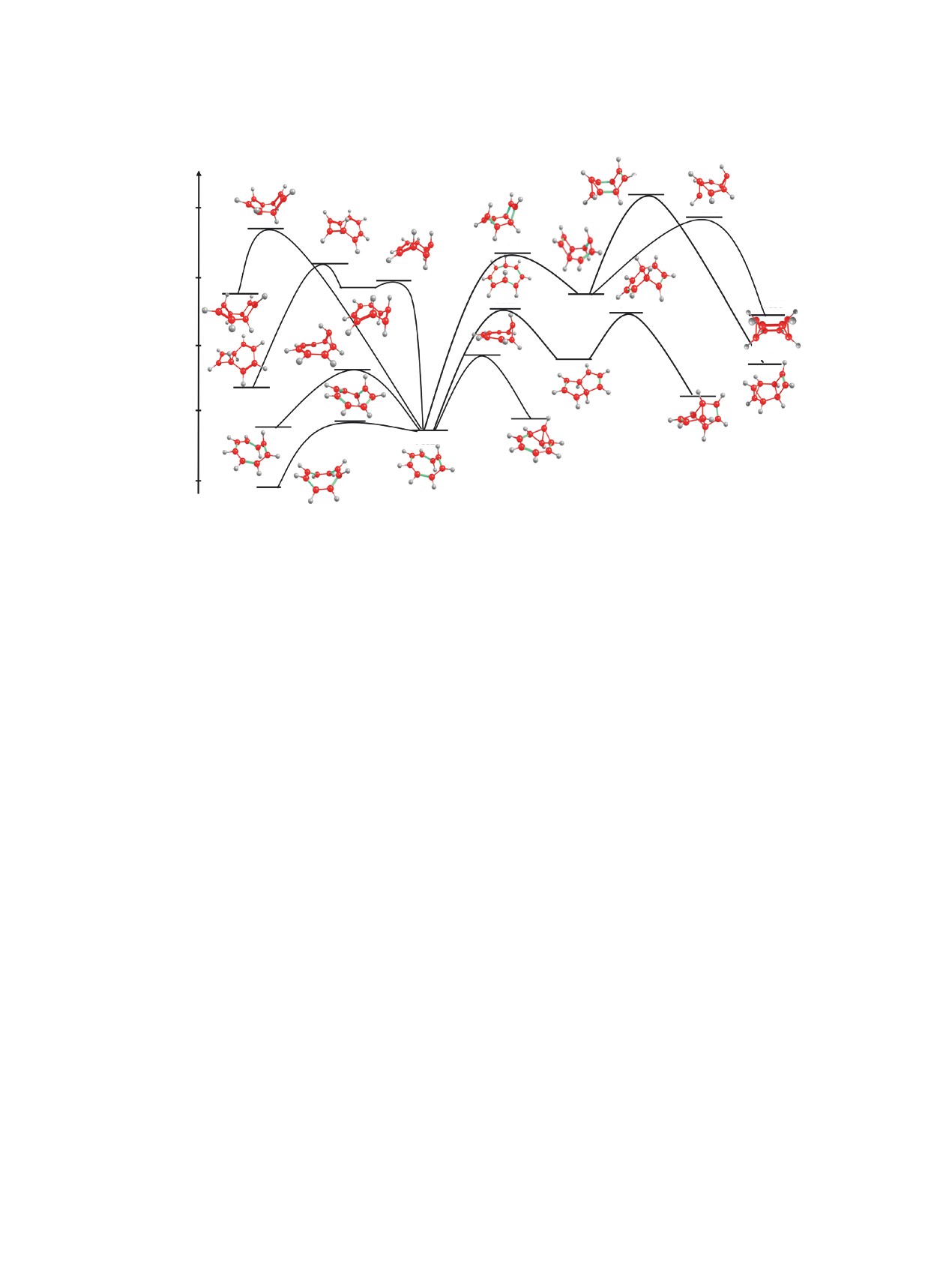
Рис. 6. Пути термической изомеризации циклооктатетраена в продукты М12, М13, М14, М15, М16, М17, М18, М19, М20,
М21
Величины барьеров активации на первой и
ческой изомеризации тетрацикло[4.2.0.02,403,5]-
второй стадиях невелики и составляют 27.86 и
окта-7-ена (М21) в ЦОТ при более высоких темпе-
0.69 ккал/моль, соответственно. Таким образом,
ратурах, по сравнению с реакцией изомеризации
реакция термического превращения октавалена
октавалена, как отмечается в [13].
(М18) в циклооктатетраен (М1) является доста-
Реакционный путь термической изомеризации
точно легко осуществимой, что и подтверждается
трицикло[3.3.0.02,6]окта-3,7-диена (M20) можно
экспериментальными данными [16].
схематично представить схемой:
Тетрацикло[4.2.0.02,403,5]окта-7-ен (М21) син-
М20→TS11→M19→TS12→M12→TS3→M1.
тезируют из бензвалена [17]. Известно, что М21
Как видно из представленной схемы и рис. 6
может подвергаться изомеризации в циклооктате-
изомеризация продукта М20 осуществляется в
траен путем фотолиза, термолиза, а также в при-
3 последовательные стадии: скелетная трансфор-
сутствии ионов серебра в качестве катализатора.
мация М20 в М19 через переходное состояние
Согласно представленным данным процесс терми-
TS11, превращение М19 в М12 через переходное
ческой изомеризации тетрацикло[4.2.0.02,403,5]ок-
состояние TS12 и скелетная трансформация М12
та-7-ена (М21) в ЦОТ (М1) включает три стадии
в циклооктатетраен M1 через переходное состо-
(рис. 6), а именно: скелетную трансформацию М21
яние TS3. Наибольшая величина барьера актива-
в М15 через переходное состояние TS23, далее
ции соответствует стадии термической изомери-
превращение М15 в М12 через переходное состо-
зации трицикло[3.3.0.02,6]окта-3,7-диена (М20) в
яние TS15 и скелетную трансформацию М12 в
бирадикал дигиропенталена (М19) и составляет
циклооктатетраен М1 через переходное состо-
31.00 ккал/моль. Таким образом, согласно расче-
яние TS3 (М21→TS23→M15→TS15→M12→
там реакция должна осуществляться в условиях
TS3→M1). Величины барьеров активации на
термолиза. Однако, литературные данные, опи-
второй
(10.67 ккал/моль) и третьей стадиях
сывающие процесс термической изомеризации
(0.69 ккал/моль) невелики, поэтому лимити-
трицикло[3.3.0.02,6]окта-3,7-диена (M20) в ЦОТ,
рующей является первая стадия, величина ба-
отсутствуют. Описывается только реакция фото-
рьера активации которой ΔЕ(TS23-M21) равна
химической трансформации М20 в семибульвален
70.91 ккал/моль (табл. 4). Указанное значение
и циклооктатетраен, причем механизм реакции не
ΔЕ(TS23-M21) предполагает возможность терми-
известен [6].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
402
ТОМИЛИН и др.
Таблица 4. Величины потенциальных барьеров ΔE процессов TSx-My термической изомеризации циклооктатера-
енаa
Процесс TSх-My
ΔE, ккал/моль
Процесс TSх-My
ΔE, ккал/моль
TS3-M1
21.15
TS13-М13
0.13
TS3-M12
0.69
TS14-M13
6.46
TS6-M12
24.16
TS14-M14
50.89
TS8-M12
33.45
TS15-M12
63.94
TS8-M18
27.86
TS15-M15
10.67
TS12-M12
49.57
TS23-M15
40.22
TS12-M19
19.83
TS23-M21
70.91
TS11-M19
14.75
TS17-M15
28.05
TS11-M20
31.00
TS17-M16
41.17
TS13-M12
56.54
TS16-M12
69.59
TS16-M17
19.45
a x - номер переходного состояния, y - номер молекулы в основном состоянии
Октабисвален (M16) представляет собой вы-
изомеров М14 и М17 в М1 относительно невели-
соконапряженное полициклическое соединение.
ки и достигают своего максимального значения
Хотя оксабисвален к настоящему времени не по-
ΔЕ(TS14-M14) 50.89 ккал/моль. Таким образом,
лучен, синтезирован его замещенный изомер
существование неустойчивого интермедиата М12
С8Н8Х2, где Х = SO2C6H5. Рассчитанный путь тер-
открывает возможности термической изомериза-
мической изомеризации М16 можно схематично
ции указанных изомеров в циклооктатетраен.
представить следующим образом (рис. 6):
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
М16→TS17→M15→TS15→M12→TS3→M1.
Расчеты электронной структуры исследуемых
молекулярных систем проводились неэмпириче-
Лимитирующей является первая стадия ске-
ским методом DFT в приближении B3LYP c ис-
летной трансформации октабисвалена в М15 че-
пользованием базисного набора 6-31G* из пакета
рез переходное состояние TS17, величина барье-
прикладных программ Firefly [18]. Характер экс-
ра активации которой составляет 41.17 ккал/моль
тремальных точек на поверхности потенциальной
(табл. 4). Так как реакции термической зомериза-
энергии определялся из анализа собственных зна-
ции ЦОТ в семибульвален с барьером активации
чений оператора Гесса. Выбор расчетного метода
45.12 ккал/моль, осуществляется при температу-
обусловлен хорошим соответствием результатов
ре ~ 300°С, можно предположить, что скелетная
расчета структурных и энергетических характери-
трансформация октабисвалена с барьером актива-
стик молекул экспериментальным данным.
ции 41.17 ккал/моль требует сходного температур-
ного режима.
Для подтверждения достоверности предпола-
гаемых путей использовался расчет так называе-
Пути термической изомеризации соединений
мой внутренней координаты реакции IRC (intrinsic
М14 и М17 можно представить следующим обра-
reaction coordinate). Поиск IRC осуществлялся ме-
зом:
тодом Гонсалеса-Шлегеля [19] (в рамках B3LYP/
М14→TS14→M13→TS13→M12→TS3→M1,
6-31G) из программного комплекса Firefly.
М17→TS16→M12→TS3→M1.
ЗАКЛЮЧЕНИЕ
Как видно из данных табл. 2, величины по-
Исходя из сопряженной системы р-электронов
тенциальных барьеров скелетной трансформации
[8]-аннулена при условии сохранения ориентации
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ВОЗМОЖНЫЕ СКЕЛЕТНЫЕ ТР
АНСФОРМАЦИИ ЦИКЛООКТАТЕТРАЕНА
403
pz-АО в непланарном углеродном остове, найдены
женного метода моделирования переходных со-
пространственные структуры возможных переход-
стояний для описания термической изомеризации
ных состояний, стабилизированных различными
полициклических сопряженных углеводородов.
уровнями эффекта сопряжения. Реальность пред-
Кроме того, знание пространственной струк-
лагаемых переходных состояний при скелетной
туры всех возможных переходных состояний с
трансформации циклооктатетраена подтверждена
трансформированной сопряженной системой р-э-
исследованием характера соответствующих ста-
лектронов может существенно расширить класс
ционарных точек на поверхности потенциальной
лигандов в металлоорганических комплексах, в
энергии.
том случае, если имеются благоприятные элек-
Используя 24 найденных переходных состоя-
тронные и геометрические факторы сочетания ли-
ния с возможной наименьшей полной энергией,
гандов и центрального атома. Примером реализа-
построены схемы прямых и обратных реакций,
ции такого подхода могут служить металлоргани-
протекающих при термической изомеризации
ческие соединения, использующие в качестве ли-
циклооктатетраена в интервале температур при-
ганда циклооктатетраен, который имеет плоскую
мерно до 400°С. Достоверность предполагаемых
структуру только в переходном состоянии [20].
путей подтверждена методом внутренней коор-
ИНФОРМАЦИЯ ОБ АВТОРАХ
динаты реакции IRC (метод Гонсалеса-Шлегеля).
Имеющиеся в литературе экспериментальные
orcid.org/0000-0002-1570-230X
данные подтверждают часть найденных реакций,
протекающих при термической изомеризации ци-
Фомина Людмила Владиславовна, ORCID:
клооктатетраена и отдельных стабильных его изо-
меров. Это соответствие носит как качественный,
Родионова Евгения Валерьевна, ORCID: https://
так количественный (оценка величин потенциаль-
orcid.org/0000-0001-7921-2732
ных барьеров) характер.
КОНФЛИКТ ИНТЕРЕСОВ
Естественно, что в настоящей работе не рас-
смотрены все возможные переходные состояния
Авторы заявляют об отсутствии конфликта ин-
скелетной трансформации циклооктатетраена, а
тересов.
только те, полная энергия которых значительно
СПИСОК ЛИТЕРАТУРЫ
не отклоняется от основного состояния ЦОТ. Это
1. Денисов Е.Т. Усп. хим. 2000, 69, 166-177. [Deni-
обстоятельство позволяет ожидать дальнейшей
sov E.T. Russ. Chem. Rev. 2000, 69, 166-177.] doi
экспериментальной проверки полученных теоре-
10.1070/RC2000v069n02ABEH000560
тических прогнозов в интервале температур, не
2. Müller T., Mingos D. Transit. Met. Chem. 1995, 20,
приводящих к термической деструкции циклоок-
533-539. doi 10.1007/BF00136415
татераена.
3. Сережкин В.Н., Пушкин Д.В., Сережкина Л.Б.,
Представленный метод моделирования про-
Севастьянов В.Г., Кузнецов Н.Т. ЖНХ. 2005, 50,
странственной структуры переходных состояний
2019-2028. [Serezhkin V.N., Pushkin D.V., Serezhki-
циклических карбополиенов позволяет не только
na L.B., Sevast’yanov V.G., Kuznecov N.T. Russ. J.
оценить все возможные энергетические характе-
Inorg. Chem. 2005, 50, 2019-2028.]
ристики переходные состояний, а, следовательно,
4. Томилин О.Б., Танасейчук Б.С., Бояркина О.В.
и все возможные продукты протекающей термиче-
ЖОрХ.
2016,
52,
1576-1586.
[Tomilin O.B.,
Tanaseichuk B.S., Boyarkina O.V. Russ. J. Org.
ской изомеризации, но может служить новым тео-
Chem.
2016,
52,
1576-1586.] doi
10.1134/
ретическим инструментом эффективного прогно-
S1070428016110051
зирования целевого препаративного синтеза.
5. Родионова Е.В., Томилин О.Б., Фомина Л.В. ЖОрХ.
Установленное соответствие теоретических ре-
2021, 57, 135-142. [Rodionova E.V., Tomilin O.B.,
зультатов и экспериментальных данных позволяет
Fomina L.V. Russ. J. Org. Chem. 2021, 57, 135-142.]
предположить возможность применения предло-
doi 10.1134/S1070428021020019
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
404
ТОМИЛИН и др.
6. Scott L.T., Jones M. Chem. Rev. 1972, 72, 181-203.
14. Jiao H.J., Nagelkerke R., Kurtz H.A., Williams R.V.,
doi 10.1021/cr60276a004
Borden W.T., Schleyer P.v.R. J. Am. Chem. Soc. 1997,
7. Andrés J.L., Castaño O., Morreale A., Palmeiro R.,
119, 5921-5929. doi 10.1002/chin.199741033
Gomperts R. Chem. Phys. 1998, 108, 203-207. doi
15. Rücker C., Prinzbach H. Angew. Chem. Int. Ed. 1985,
10.1063/1.475388
24, 411-412. doi 10.1002/anie.198504111
8. Garavelli M., Bernardi F., Cembran A., Castano O.,
16. Christl M., Lang R., Herzog C. Tetrahedron. 1986, 42,
Frutos L.M., Merchan M., Olivucci M. J. Am. Chem.
1585-1596. doi 10.1016/S0040-4020(01)87575-X
Soc. 2002, 124, 13770-13789. doi 10.1021/ja020741v
17. Leverett R.S., George E.G., Jearrold M. J. Org. Chem.
9. Klärner F.G. Angew. Chem. Int. Ed. 2001, 40, 3977-
1977, 42, 927-936. doi 10.1021/jo00426a001
3981. doi 10.1002/1521-3773
18. Schmidt M.W., Baldridge K.K., Boatz J.A.,
10. Deslongchamps G., Deslongchamps P. J. Org. Chem.
Elbert, S.T., Gordon, M.S., Jensen, J.H., Koseki S.,
2018, 83, 5751-5755. doi 10.1021/acs.joc.8b00809
Matsunaga N., Nguyen K.A., Su S., Windus T.L.,
11. Wu J.I., Fernandez I., Mo Y., Schleyer P.v.R. J. Chem.
Dupuis M., Montgomery J.A. J. Comput. Chem. 1993,
Theory Comput. 2012, 8, 1280-1287. doi 10.1021/
14, 1347-1363. doi 10.1002/jcc.540141112
ja00953a045
19. Gonzalez C., Schlegel H.B. J. Phys. Chem. 1990, 94,
12. Nishinaga T., Ohmae T., Iyoda M. Symmetry. 2010, 2,
76-79. doi 10.3390/sym20100076
5523-5527. doi 10.1021/j100377a021
13. Hassenrück K., Martin H-D., Walsh R. Chem. Rev.
20. Seyferth D. Organometallics. 2004, 23, 3562-3583.
1989, 89, 1125-1146. doi 10.1002/chin.198951355
doi 10.1021/om0400705
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
ВОЗМОЖНЫЕ СКЕЛЕТНЫЕ ТР
АНСФОРМАЦИИ ЦИКЛООКТАТЕТРАЕНА
405
Possible Skeletal Transformations of Cyclooctatetraene
during its Thermal Isomerization
O. B. Tomilin, L. V. Fomina, and E. V. Rodionova*
National Research Mordovia State University, ul. Bolshevistskaya, 68B, Saransk, 430005 Russia
*e-mail: rodionova_j87@mail.ru
Received September 2, 2021; revised November 18, 2021; accepted November 22, 2021
Based on the properties of the p-electrons conjugated system in cyclic polyenes, all possible spatial structures
of transition states during the skeletal transformation of cyclooctatetraene under the action of temperature in
an oxygen-free atmosphere have been found. The existence of transition states is due to different levels of the
stabilization effect of p-electrons conjugation. The DFT method in the B3LYP approximation using the 6-31G*
basis set confirmed the existence of 30 transition states by studying fragments of the potential energy surface
and the nature of the established stationary points. Using the Gonzalez-Schlegel method for finding potential
barriers to reactions, a scheme for the thermal isomerization of cyclooctatetraene was constructed, consisting
of 47 direct and reverse reactions. Their kinetic characteristics are found in the form of the values of potential
barriers. The results obtained correspond to the experimental data available in the literature.
Keywords: conjugation, molecular graphs, ground state, transition state, potential barrier, thermal isomerization
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022