ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 4, с. 422-429
УДК 547.466.1
СРАВНИТЕЛЬНАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ
В АЦИЛИРОВАНИИ ДИПЕПТИДОВ
НА ОСНОВЕ ТИРОЗИНА И ПРОЛИНА
© 2022 г. Т. П. Кустоваa, *, Л. Б. Кочетоваa, Д. С. Хачатрянb, c
a ФГБОУ ВО «Ивановский государственный университет», Россия, 1530250 Иваново, ул. Ермака, 39
b НИЦ «Курчатовский институт» - ИРEА, Россия, 107076 Москва, Богородский вал, 3
c НИЦ «Курчатовский институт», Россия, 123182 Москва, пл. Академика Курчатова, 1
*e-mail: kustova_t@mail.ru
Поступила в редакцию: 28.12.2021 г.
После доработки 11.01.2022 г.
Принята к публикации 13.01.2022 г.
Проведен сравнительный анализ реакционной способности дипептида l-Tyr-l-Pro и его аналога с вос-
становленной до -CH2OH карбоксильной группой на основе комплексного исследования, включающего
экспериментальное изучение кинетики бензоилирования дипептидов и компьютерного моделирования
структуры их молекул. На основе изучения взаимодействия дипептидов с активированными нитро-
группой фенилбензоатами в растворителе вода (40 масс %) - 1,4-диоксан в температурном интервале
298-313 K установлено, что константа скорости реакции с участием l-Tyr-l-Pro(CH2OH) в среднем в
5 раз превышает константу скорости реакции с участием l-Tyr-l-Pro и изменяется в диапазоне k298
0.065-2.219 л·моль-1·с-1. Методом DFT/B3LYP/cc-pVTZ выполнено компьютерное моделирование
структуры дипептидов и рассчитаны их геометрические, энергетические и электронные параметры.
Установлено, что величины энергии неподеленной пары атома азота концевой аминогруппы дипептида
и энергии НСМО замещенных фенилбензоатов могут быть использованы в качестве дескрипторов при
построении QSPR-моделей для прогнозирования реакционной способности изученных соединений в
реакциях ацильного переноса. Компьютерный скрининг биологической активности дипептидов и про-
дуктов их бензоилирования позволяет рекомендовать эти соединения для практического использования
в качестве потенциальных лекарственных препаратов.
Ключевые слова: дипептид, тирозилпролин, бензоилирование, кинетика, 1,4-диоксан, 2,4- и 2,6-дини-
трофенилбензоаты, пикрилбензоат
DOI: 10.31857/S0514749222040073, EDN: ZEEBTV
ВВЕДЕНИЕ
бран предпочтительный для ацилирования нукле-
офильный центр - азот первичной аминогруппы, и
На протяжении последнего десятилетия отме-
выполнены кинетические исследования бензоили-
чается возросший интерес профессионального
рования этого дипептида в среде водного 1,4-ди-
научного сообщества к синтезу, модификации и
оксана. Известно [8, 9], что по сравнению с Tyr-
исследованию биологической активности ди-
Pro его аналоги, полученные путем модификации
пептидов [1-9]. По запросу «dipeptide» платфор-
по карбоксильной группе пролина Tyr-Pro-Х, где
ма sciencedirect.com только за прошедший 2021
Х = NH2, OCH3, OC2H5, обладают более сильной
г. выдает более 1700 ссылок на оригинальные пу-
анальгетической активностью при раздражении
бликации [4-6]. В нашей предыдущей работе [7]
термо-, механо- и хеморецепторов боли у крыс.
в дипептиде l-Tyr-l-Pro на основе NBO-анализа
Модификация этих соединений по аминогруппе
распределения электронной плотности был вы-
может привести к усилению имеющейся биоло-
422
СР
АВНИТЕЛЬНАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ В АЦИЛИРОВАНИИ ДИПЕПТИДОВ
423
Схема 1
O
H
H2N
C C
N
CH2
CH2OH
+
C
O
(NO2)n
O
OH
O
H
+
HO
C NH
C C
N
(1)
(NO2)n
O
CH2
CH2OH
OH
гической активности или возникновению новой, в
ТНФБ. Аналогичный ряд реакционной способно-
связи с чем, исследование реакционной способно-
сти сложных эфиров в ацилировании наблюдался
сти аналога тирозилпролина с восстановленной до
нами ранее в реакциях с участием других ами-
-CH2OH карбоксильной группой в реакции с ак-
носоединений: алифатических аминов, аммиака,
тивированными нитрогруппой фенилбензоатами
аминокислот и дипептидов [10-13]. Полученная
представляется интересной научной задачей.
последовательность объясняется тем, что электро-
ноакцепторные нитрогруппы в уходящих группах
Целью настоящей работы является сравни-
эфиров ускоряют реакцию, стабилизируя частич-
тельный анализ реакционной способности в бен-
ный отрицательный заряд, возникающий на карбо-
зоилировании l-Tyr-l-Pro и l-Tyr-l-Pro(CH2OH)
нильном атоме углерода в переходном состоянии
в среде водного 1,4-диоксана и поиск дескрипто-
реакции. В молекуле тринитропроизводного этот
ров, которые можно использовать при построении
эффект проявляется сильнее, чем у динитропроиз-
QSPR-моделей для прогнозирования реакционной
водных. Снижение констант скорости ацилирова-
способности изученных дипептидов в реакциях
ния 2,6-ДНФБ по сравнению с 2,4-ДНФБ, по-ви-
ацильного переноса.
димому, обусловлено наличием двух заместителей
Кинетика реакции l-Tyr-l-Pro(CH2OH) с 2,4-
в орто-положении, создающих стерические пре-
и 2,6-динитрофениловыми эфирами (ДНФБ) и
пятствия нуклеофильной атаке на карбонильный
2,4,6-тринитрофениловым эфиром (ТНФБ) бен-
центр. Кроме этого, сопоставление результатов
зойной кислоты исследована в растворителе во-
выполненных нами в работе [10] квантово-хими-
да-1,4-диоксан с содержанием воды 40 масс % в
ческих расчетов молекул сложных эфиров {метод
интервале температур 298-313 K (схема 1).
RHF/6-31G(d), программный пакет Firefly 7.1.G
[13]} с кинетическими данными ацилирования
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
OH) показало, что константы ско-
l-Tyr-l-Pro(CH2
В табл.
1 представлены экспериментально
рости ацилирования зависят от энергий НСМО
определенные кинетические характеристики реак-
(ЕНСМО) замещенных фенилбензоатов: для моле-
ции (1).
кул 2,6-ДНФБ, 2,4-ДНФБ и 2,4,6-ТНФБ величины
Данные табл. 1 указывают на рост константы
ЕНСМО составляют, соответственно 1.30, 0.92 и
скорости и снижение активационного барьера
0.32 эВ. Следует отметить, что линейные зависи-
реакций в ряду 2,6-ДНФБ < 2,4-ДНФБ < 2,4,6-
мости констант скорости ацилирования от энер-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
424
КУСТОВА и др.
Таблица 1. Кинетические характеристики реакции (1) в растворителе вода (40 масс %)-1,4-диоксан; с = 1.00002·10-2,
моль·л-1
k298 [l-Tyr-l-
k·10,
ΔH≠298,
-ΔS≠298,
Т, K
Pro(CH2OH)]/
л·моль-1·с-1
кДж·моль-1
Дж·моль-1·K-1
k298 (l-Tyr-l-Pro)
2,4-ДНФБ
298
1.97 ± 0.12
303
2.97 ± 0.19
62 ± 2
48 ± 7
4.10
308
4.11 ± 0.20
313
7.06 ± 0.67
2,6-ДНФБ
298
0.65 ± 0.03
303
0.99 ± 0.05
65 ± 2
48 ± 6
1.90
308
1.31 ± 0.27
313
1.38 ± 0.14
2,4,6-ТНФБ
298
22.2 ± 2.9
303
38.0 ± 6.3
47 ± 2
79 ± 7
7.68
308
45.7 ± 3.1
313
60.1 ± 1.4
гий НСМО сложных эфиров наблюдались нами и
построения QSPR-моделей реакционной способ-
в реакциях с участием других аминосоединений
ности изученных дипептидов в реакциях ацильно-
[10].
го переноса проведено компьютерное моделирова-
ние молекулы l-Tyr-l-Pro(CH2OH) методом DFT/
Сравнительный анализ реакционной способ-
B3LYP/cc-pVTZ с использованием программы
ности l-Tyr-l-Pro(CH2OH) и l-Tyr-l-Pro в бензо-
Gaussian03 [15]. Основываясь на данных работы
илировании показывает, что во всех изученных
[7], для расчета электронных характеристик ди-
реакциях восстановленный по карбоксильной
пептида был выбран самый устойчивый конфор-
группе дипептид является более активным: кон-
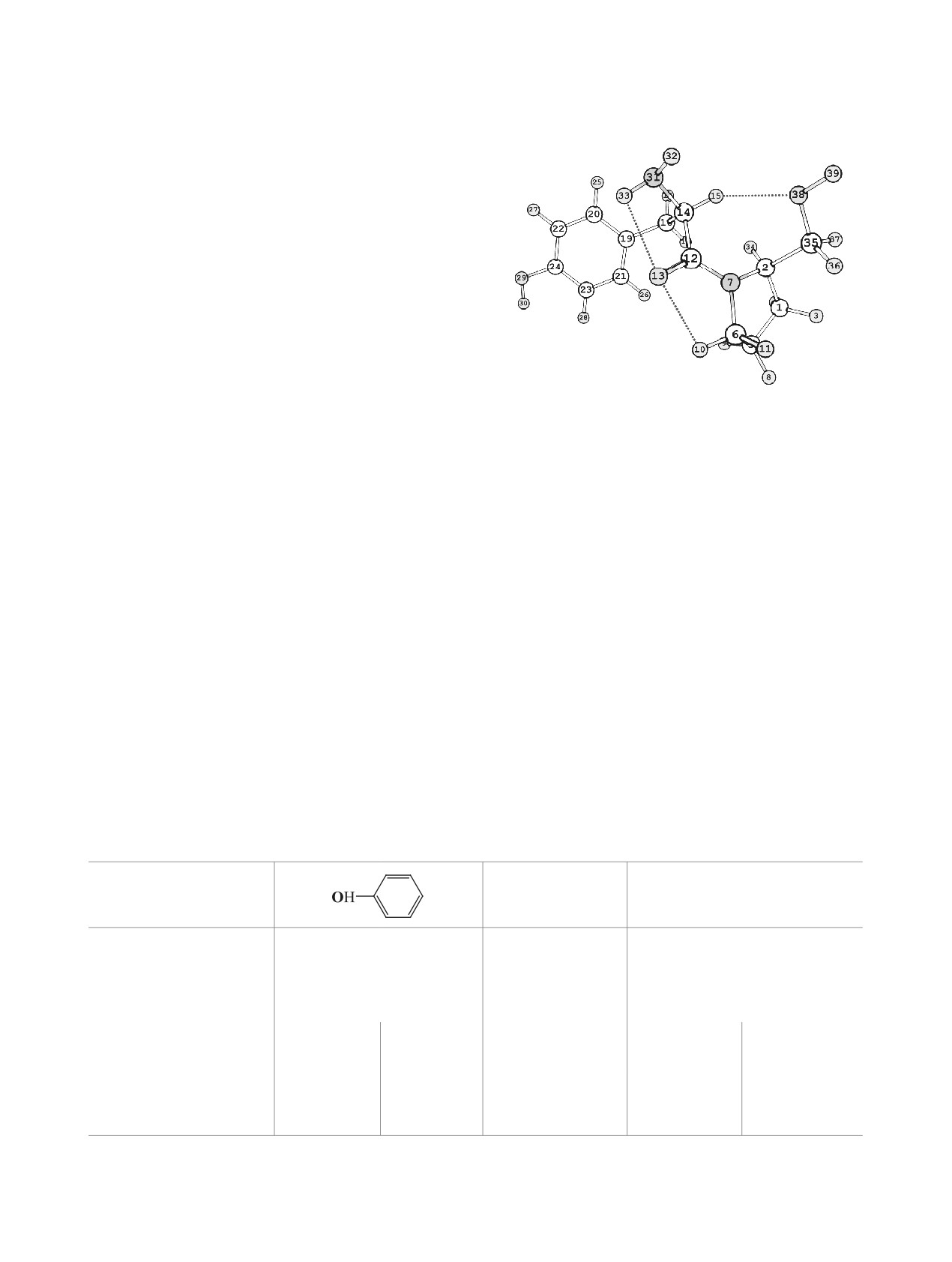
мер (см. рисунок). При расчетах выполняли пол-
станты скорости реакций с его участием выше в
ную оптимизацию геометрических параметров
2-8 раз. Этот экспериментально установленный
молекулы. Соответствие оптимизированной гео-
факт вполне ожидаем, он хорошо согласуется с те-
оретическими представлениями о передаче элек-
метрии минимуму на поверхности потенциальной
энергии проверяли расчетом частот колебаний,
тронных эффектов в ряду аминокислот, дипепти-
дов и их производных.
мнимых частот не обнаружено.
Ранее в нашей работе [7] были представлены
С целью сопоставления электронных характе-
результаты компьютерного моделирования Tyr-
ристик трех возможных нуклеофильных центров -
Pro, было показано, что NBO-анализ распределе-
азота первичной аминогруппы, кислорода феноль-
ния электронной плотности в дипептиде позволя-
ного гидроксила и кислорода группы CH2OH - вы-
ет оценить нуклеофильные свойства реакционных
полнен NBO-анализ [16, 17] распределения элек-
центров молекулы. В продолжение выполненных
тронной плотности, результаты которого сведены
исследований с целью поиска дескрипторов для
в табл. 2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
СР
АВНИТЕЛЬНАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ В АЦИЛИРОВАНИИ ДИПЕПТИДОВ
425
Как видно из данных табл. 2, атом кислорода
фенильного фрагмента имеет две неподеленные
пары: LP1 (sp1,2 гибридизации) с низкой энерги-
ей и LP2(рπ) с более высокой энергией, однако,
LP2-орбиталь кислорода вовлечена в сильное со-
пряжение с π-системой ароматического кольца
[LP2 →π*(C23-C24)], за счёт чего её электронодо-
норные свойства снижаются. Атом азота свобод-
ной аминогруппы имеет одну неподеленную пару
LP (sp3,6 гибридизации) с более высокой энергией
по сравнению с LP2-орбиталью кислорода. Атом
кислорода группы CH2OH, как и атом кислорода
фенольного гидроксила, имеет две неподеленные
Строение наиболее устойчивого конформера молеку-
лы Tyr-Pro(CH2OH), пунктиром обозначена внутримо-
пары: LP1 и LP2 с близкими значениями энергии.
лекулярная водородная связь
На основании проведенных расчетов можно за-
ключить, что среди трех рассмотренных нукле-
Известно, что аминокислоты и олигопепти-
фильных центров дипептида электронодонорные
ды обладают ярко выраженной биологической
свойства более выражены у атома азота концевой
активностью. Нами был проведен виртуальный
аминогруппы, поэтому именно он является пред-
скрининг изученных дипептидов и продуктов их
почтительным для атаки ацилирующего агента
бензоилирования с использованием программы
(например, бензоила).
PASSOnline [18], которая позволяет дать количе-
Сравнение энергетических и электронных
ственную оценку вероятности проявления разных
характеристик l-Tyr-l-Pro(CH2OH) (табл.
2) и
видов биологической активности (Pi) по шкале от
l-Tyr-l-Pro [7] показало, что изменение структуры
0 до 1. Результаты компьютерного прогнозирова-
С-концевой группы дипептида не оказывает силь-
ния представлены в табл. 3.
ного влияния на заселенность LP-орбиталей атома
Как следует из данных табл. 3, у продуктов
азота NH2-группы и энергию донорно-акцепторно-
го взаимодействия, вместе с тем, энергия неподе-
бензоилирования обоих дипептидов понижается
ленной пары атома азота изменяется существенно
по сравнению с исходными дипептидами способ-
и составляет -8.21 и -8.51 эВ соответственно, что
ность к ингибированию ряда важных ферментов
указывает на усиление нуклеофильных свойств
класса гидролаз
- протеинглутаматметилэсте-
атома азота при переходе от l-Tyr-l-Pro к его ана-
разы (ЕС 3.1.1.6), которая участвует в передаче
логу с концевой CH2OH-группой.
сигналов в бактериальных клетках, и пироглута-
Таблица 2. Электронные характеристики возможных нуклеофильных центров дипептида Tyr-Pro-CH2ОН
Электронные
NH2
CH2OH
характеристики
Энергия
-16.40 (LP1)
-17.14(LP1)
-8.21
неподеленных пар, эВ
-8.54 (LP2)
-8.65 (LP2)
Заселенность
1.97 (LP1)
1.98 (LP1)
1.95
LP-орбиталей
1.88 (LP2)
1.86 (LP2)
Взаимодействующие орби-
LP1 →
LP2 →
LP1 →
LP2 →
LP → σ*(C12-C14)
тали (донор → акцептор)
σ*(C23-C24)
π*(C23-C24)
σ*(C35-H36)
σ*(C35-H37)
Энергия донорно-акцеп-
торного взаимодействия,
7.10
27.6
8.91
5.50
7.48
ккал/моль
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
426
КУСТОВА и др.
Таблица 3. Результаты компьютерного прогнозирования биологической активности дипептидов и продуктов их
бензоилирования
Вероятность проявления биологической активности (Pi)
Виды
биологической активности
Tyr-Pro
Bz-Tyr-Pro
Tyr-Pro(CH2OH)
Bz-Tyr-Pro(CH2OH)
Ингибирование пироглутамилпептидазы II
0.898
0.797
0.835
0.634
Ингибирование протеинглутамат-
0.848
0.700
0.785
0.539
метилэстеразы
Антагонист нейротрансмиттера
0.749
0.698
0.729
0.674
Фибринолитическая активность
0.752
0.778
0.645
0.678
Аналептическая активность
0.652
0.755
0.607
0.714
Ноотропная активность
0.629
0.768
0.601
0.747
милпептидазы II (ЕС 3.4.19.6), расщепляющей
где k (л·моль-1·с-1) - константа скорости бензои-
TRH (тиреотропин-рилизинг-гормон) и стимули-
лирования дипептида; kн (с-1) - наблюдаемая кон-
рующей высвобождение тиреотропного гормона
станта скорости; с (моль·л-1) - начальная концен-
(TSH) и пролактина из передней доли гипофиза.
трация l-Tyr-l-Pro(CH2OH).
Вместе с тем, у бензоилпроизводных дипептидов
Дипептиды l-Tyr-l-Pro и l-Tyr-l-Pro(CH2OH)
заметно улучшаются такие полезные виды актив-
в форме соответствующих гидрохлоридов были
ности, как ноотропная (усиление когнитивных
синтезированы в ФГУП
«Институт химиче-
функций организма), аналептическая (стимуляция
ских реактивов и особо чистых химических ве-
жизненно важных функций: дыхания и кровообра-
ществ Национального исследовательского центра
щения), фибринолитическая (рассасывание кровя-
«Курчатовский институт»» (содержание основно-
ного сгустка) и др. Результаты прогнозирования
го вещества составляло 99.95%). 2,4-, 2,6-дини-
биологической активности изученных дипептидов
трофениловые и 2,4,6-тринитрофениловый эфиры
и продуктов их ацилирования позволяют рекомен-
бензойной кислоты получали ацилированием со-
довать эти соединения для практического исполь-
ответствующих нитропроизводных фенола бензо-
зования в качестве потенциальных лекарственных
илхлоридом. Все реактивы и растворитель были
препаратов.
очищены до полного соответствия их физических
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
параметров (температура плавления/кипения и
показатель преломления) литературным данным
Кинетику реакций изучали спектрофотометри-
[19]. 1,4-Диоксан квалификации «хч» в течение
ческим методом (λ 400 нм) при большом избытке
семи дней выдерживали над гидроксидом калия,
дипептида (в 102 раз) по сравнению с ацилирую-
затем осуществляли его перегонку при атмос-
щим агентом. За скоростью взаимодействия сле-
ферном давлении в присутствии металлического
дили по изменению концентрации продуктов реак-
натрия с целью удаления органических переки-
ции - нитрозамещенных фенолят-ионов. Про-
сей. Для приготовления бинарного растворителя
веденные ранее [10] кинетические исследования
использовали деионизованную воду, полученную
показали, что скорость гидролиза нитрозамещен-
на деионизаторе воды «ДВ-1». Рабочий раствор
ныхфенилбензоатов в среде водного 1,4-диоксана
дипептида с КОН в бинарном растворителе и ра-
пренебрежимо мала по сравнению со скоростью
бочий раствор эфира в 1,4-диоксане готовили по
реакции (1). В таком случае константу скорости
точной навеске и термостатировали в течение
реакции (1) можно рассчитать по уравнению (2):
30 мин до начала опыта. Начальные концентрации
kн
реагентов составляли 10-2 и 10-4 моль/л соответ-
k =
(2)
ственно. Изменение пропускания раствора в ходе
c
реакции фиксировали с помощью спектрофотоме-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
СР
АВНИТЕЛЬНАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ В АЦИЛИРОВАНИИ ДИПЕПТИДОВ
427
тра СФ-56, снабженного термостатируемой ячей-
Хачатрян Дереник Саркисович, ORCID: https://
кой для кювет.
orcid.org/0000-0002-5490-5652
ЗАКЛЮЧЕНИЕ
КОНФЛИКТ ИНТЕРЕСОВ
Изучена кинетика бензоилирования дипептида
Авторы заявляют об отсутствии конфликта ин-
l-Tyr-l-Pro с восстановленной до -CH2OH кон-
тересов.
цевой карбоксильной группой в среде водного
СПИСОК ЛИТЕРАТУРЫ
1,4-диоксана, в качестве ацилирующих агентов
1.
Гайдукевич В.А., Попова Л.А., Зубрейчук З.П.,
использованы активированные нитрогруппой фе-
Книжников В.А. ЖОрХ.
2019,
55,
1110-1114.
нилбензоаты, определены активационные характе-
[Gaidukevich V.A., Popova L.A., Zubreichuk Z.P.,
ристики реакции. Установлено, что модификация
Knizhnikov V.A. Russ. J. Org. Chem. 2019, 55, 1005-
С-концевой карбоксильной группы приводит к ро-
1008.] doi 10.1134/S1070428019070169
сту константы скорости реакции в среднем в 5 раз.
2.
Брель А.К., Лисина С.В., Будаева Ю.Н. ЖОрХ. 2021,
Результаты компьютерного моделирования струк-
57, 517-523. [Brel A.K., Lisina S.V., Budaeva Y.N.
туры дипептидов l-Tyr-l-Pro и l-Tyr-l-Pro(CH2OH)
Russ. J. Org. Chem. 2021, 57, 540-544.] doi 10.1134/
позволили предложить величины энергии неподе-
S1070428021040060
ленной пары атома азота концевой аминогруппы
3.
Сорокина Ю.М., Сладкова А.А., Попова Л.А., Ша-
дипептида и энергии НСМО замещенных фенил-
дыро О.И., Книжников В.А. ЖОрХ. 2012, 48, 1302-
бензоатов в качестве дескрипторов при постро-
1306. [Sorokina Y.M., Popova L.A., Knizhnikov V.A.,
Sladkova A.A., Shaduro O.I. Russ. J. Org. Chem. 2012,
ении QSPR-моделей для прогнозирования реак-
48, 1297-1301.] doi 10.1134/S1070428012100065
ционной способности изученных соединений в
4.
Li H., Liu L., Yuan X., Wang Y., Zhang C., Dong H.,
реакциях ацильного переноса. Компьютерный
Satoh T. Eur. J. Med. Chem. 2022, 228, 113977.
скрининг биологической активности дипептидов
5.
Aronimo B.S., Okoro U.C., Ali R., Ibeji C.U., Ezug-
и продуктов их бензоилирования показал, что эти
wu J.A., Ugwu D.I. J. Mol. Struct. 2021, 1246, 131201.
соединения могут быть рекомендованы для прак-
doi 10.1016/j.molstruc.2021.131201
тического использования в качестве потенциаль-
6.
Zhang C., Talukder P., Dedkova L.M., Hecht S.M.
ных лекарственных препаратов.
J. Bioorg. Med. Chem. 2021, 41, 116210. doi 10.1016/
БЛАГОДАРНОСТИ
j.bmc.2021.116210
Авторы выражают благодарность профессору
7.
Кустова Т.П., Локтева И.И., Кочетова Л.Б., Хача-
Гиричевой Н.И. за помощь в выполнении и обсуж-
трян Д.С. ЖОрХ. 2020, 56, 933-940. [Kustova T.P.,
Lokteva I.I., Kochetova L.B., Khachatryan D.S. Russ.
дении результатов квантово-химических расчетов,
J. Org. Chem. 2020, 56, 1034-1040.] doi 10.31857/
а также АИЦ НИЦ «Курчатовский институт» -
S0514749220060117
ИРЕА, на оборудовании которого проведены фи-
8.
Гузеватых Л.С., Воронина Т.А., Емельянова Т.Г.,
зико-химические исследования.
Андреева Л.А., Алфеева Л.Ю., Середенин С.Б.,
ФОНДОВАЯ ПОДДЕРЖКА
Мясоедов Н.Ф. Изв. РАН. Сер. биол. 2008, 35,
61-67. [Guzevatykh L.S., Voronina T.A., Emelyano-
Работа выполнена в рамках проекта
va T.G., Seredenin S.B., Andreeva L.A., Alfeeva L.Yu.,
«Биологически активные дипептиды: исследова-
Myasoedov N.F. Bio. Bull. 2008, 35, 50-55.] doi
ние реакционной способности в ацилировании
10.1134/S1062359008010081
и компьютерное моделирование маршрутов ре-
9.
Гузеватых Л.С. Биоорг. хим. 2008, 34, 591-609.
акций» (№ 15-21-Г) при финансовой поддержке
[Guzevatykh L.S. Russ. J. Bioorg. Chem. 2008, 34,
Ивановского государственного университета.
526-543.] doi 10.1134/S1068162008050026
ИНФОРМАЦИЯ ОБ АВТОРАХ
10.
Ишкулова Н.Р., Опарина Л.Е., Кочетова Л.Б., Ку-
стова Т.П., Калинина Н.В., Курицын Л.В. ЖОХ.
Кустова Татьяна Петровна, ORCID: https://
2010, 80, 794-797. [Ishkulova N.R., Oparina L.E., Ко-
orcid.org/0000-0001-5683-6470
chetova L.B., Kustova T.P., Kalinina N.V., Kuritsyn L.V.
Кочетова Людмила Борисовна, ORCID: https://
Russ. J. Gen. Chem. 2010, 80, 964-967.] doi 10.1134/
orcid.org/0000-0001-9609-0757
S1070363210050178
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
428
КУСТОВА и др.
11. Кочетова Л.Б., Калинина Н.В., Кустова Т.П. Изв.
Morokuma K., Voth G.A., Salvador P., Dannen-
АН. Сер. Хим. 2009, 58, 725-729. [Kochetova L.B.,
berg J.J., Zakrzewski V.G., Dapprich S., Daniels A.D.,
Kalinina N.V., Kustova T.P. Russ. Chem. Bull. 2009,
Strain M.C., Farkas O., Malick D.K., Rabuck A.D.,
58, 741-745.] doi 10.1007/s11172-009-0088-1
Raghavachari K., Foresman J.B., Ortiz J.V., Cui Q.,
12. Кочетова Л.Б., Кустова Т.П. Изв. вузов. Сер. хим. и
Baboul A.G., Clifford S., Cioslowski J., Stefa-
nov B.B., Liu G., Liashenko A., Piskorz P., Komaro-
хим. технол. 2009, 52, 12-15.
mi I., Martin R.L., Fox D.J., Keith T., Al-Laham M.A.,
13. Соколова Н.Р., Никитина Е.В., Кочетова Л.Б., Кали-
Peng C.Y., Nanayakkara A., Challacombe M.,
нина Н.В., Кустова Т.П. Бутлеров. сообщ. 2012, 29,
Gill P.M.W., Johnson B., Chen W., Wong M.W.,
7-14.
Gonzalez C., Pople J.A. Gaussian 03, Revision B 04,
14. Granovsky A.A. Firefly version
Gaussian Inc, Pittsburgh, PA, 2003.
16. Glendening E.D., Reed A.E., Carpenter J.E., Wein-
15. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
hold F. QCPE Bull. 1990, 10, 58.
Robb M.A., Cheeseman J.R., Montgomery J.A. Jr.,
17. Weinhold F., Landis C.R. Valency and Bonding -
Vreven T., Kudin K.N., Burant J.C., Millam J.M.,
A Natural Bond Orbital Donor-Acceptor Perspective.
Iyengar S.S., Tomasi J., Barone V., Mennucci B.,
Cambridge: Cambridge University Press. 2005.
Cossi M., Scalmani G., Rega N., Petersson G.A.,
18. Filimonov D.A., Lagunin A.A., Gloriozova T.A., Ru-
Nakatsuji H., Hada M., Ehara M., Toyota K., Fuku-
dik A.V., Druzhilovskii D.S., Pogodin P.V., Poroi-
da R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
kov V.V. Chem. Heterocycl. Compd. 2014, 50, 444-
Kitao O., Nakai H., Klene, Li X., Knox J.E., Hrat-
457. doi 10.1007/s10593-014-1496-1
chian H.P., Cross J.B., Adamo C., Jaramillo J., Gom-
perts R., Stratmann R.E., Yazyev O., Austin A.J.,
19. Потехин А.А. Свойства органических соединений:
Cammi R., Pomelli C., Ochterski J.W., Ayala P.Y.,
справочник. Ред. А.А. Потехин. Л: Химия. 1984.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022
СР
АВНИТЕЛЬНАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ В АЦИЛИРОВАНИИ ДИПЕПТИДОВ
429
Comparative Reactivity in Acylation of Dipeptides
Based on Tyrosine and Proline
T. P. Kustovaa, *, L. B. Kochetovaa, and D. S. Khachatryanb, с
a Ivanovo State University, ul. Ermaka, 39, Ivanovo, 1530250 Russia
b Kurchatov Institute- IREA, Bogorodsky val, 3, Moscow, 107076 Russia
c Kurchatov Institute, pl. Akad. Kurchatova, 1, Moscow, 123182 Russia
*e-mail: kustova_t@mail.ru
Received December 28, 2021; revised January 11, 2022; accepted January 13, 2022
A comparative analysis of the reactivity of the l-Tyr-l-Pro dipeptide and its analogue with the carboxyl group
reduced to -CH2OH was carried out on the basis of a comprehensive study, including an experimental study
of the dipeptides benzoylation kinetics and computer simulation of their molecules structure. Based on the
study of the dipeptides interaction with phenyl benzoates activated by the nitro group in the solvent water
(40 wt %) - 1,4 dioxane in the temperature range of 298-313 K, it was found that the rate constant of the reac-
tion with l-Tyr-l-Pro(CH2OH) participation is on average 5 times higher than the rate constant of the reaction
with l-Tyr-l-Pro participation and varies in the range k298 = 0.065-2.219 L·mol-1·s-1. A computer simulation
of the dipeptides structure was carried out with DFT/B3LYP/cc-pVTZ method and their geometric, energy and
electronic parameters were calculated. It was found that the energy value of the lone pair of the nitrogen atom
of the terminal amino group of the dipeptide and the LUMO energies of the substituted phenyl benzoates can
be used as descriptors in the construction of QSPR-models to predict the reactivity of the studied compounds
in acyl transfer reactions. Computer screening of the biological activity of the dipeptides and their benzoylation
products makes it possible to recommend them for practical use as potential drugs.
Keywords: dipeptide, tyrosylproline, benzoylation, kinetics, 1,4-dioxane, 2,4- and 2,6-dinitro phenyl benzoates,
picril benzoate
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 4 2022