ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 5, с. 469-475
УДК 547.833.3 + 548.737
НОВЫЙ МЕТОД СИНТЕЗА
ТЕТРАГИДРОИЗОХИНОЛИНОВ
© 2022 г. И. В. Дяченкоa, В. Д. Дяченкоa, П. В. Дороватовскийb,
В. Н. Хрусталевc, d, В. Г. Ненайденкоe, *
a Луганский государственный педагогический университет, Украина, 91011 Луганск, ул. Оборонная, 2
b НИЦ «Курчатовский институт», Россия, 123182 Москва, ул. Акад. Курчатова, 1
c ФГАОУ ВО «Российский университет дружбы народов», Россия, 117198 Москва, ул. Миклухо-Маклая, 6
d ФГБУН Институт органической химии им. Н.Д. Зелинского, Россия, 119991 Москва, Ленинский просп., 47
e ФГБОУ ВО «Московский государственный университет им. М. В. Ломоносова»,
Россия, 119991 Москва, Ленинские горы 1, стр. 3
*e-mail: nenajdenko@gmail.com
Поступила в редакцию 23.11.2021 г.
После доработки 12.12.2021 г.
Принята к публикации 14.12.2021 г.
Изучена реакция циклогексилиденцианотиоацетамида с диметилацеталем N,N-диметилформамида. Дан-
ное превращение в зависимости от условий реакции приводит к различным результатам: при кипячении
исходных реагентов без растворителя образуется 3-метилтио-5,6,7,8-тетрагидроизохинолин-4-карбони-
трил, а кипячение в бензоле заканчивается образованием 3-диметиламино-2-цианопроп-2-ентиоамида.
Строение этих продуктов изучено методом РСА.
Ключевые слова: тиоамид, диметилацеталь N,N-диметилформамида, тетрагидроизохинолин, рентге-
ноструктурный анализ
DOI: 10.31857/S0514749222050032, EDN: CTUTIT
ВВЕДЕНИЕ
клогексилиденцианотиоацетамида (1) с диметила-
цеталем N,N-диметилформамида (2). Обнаружено,
Производные частично гидрированного изо-
что при кипячении в течение 3 ч исходных реаген-
хинолина являются структурными фрагментами
тов (1) и (2) образуется 3-метилтио-5,6,7,8-тетра-
алкалоидов [1, 2], оптическим материалом для
гидроизохинолин-4-карбонитрил (3), а восьмича-
пленок Ленгмюра-Блоджетт [3-5], антагониста-
совое кипячение в бензоле заканчивается образо-
ми калиевых рецепторов [6] и противомикроб-
ванием
3-диметиламино-2-цианопроп-2-ентиоа-
ными средствами [7]. Основные методы их син-
мида (4) (схема 1) - перспективного реагента для
теза сводятся к 2 направлениям: достройке ци-
синтеза функционализированных азинов [12].
клогексанового фрагмента к пиридиновому или
пиридинового фрагмента к циклогексановому.
Вероятный механизм образования соединения
Функционализированные изохинолины с тио-
3 изображен на схеме 1. Первоначально реализует-
эфирной группой остаются до настоящего време-
ся алкилирование циклогексанового кольца по по-
ни малоизученными [8].
ложению 2 с образованием интермедиата A, транс-
формирующегося далее в енамин B. Затем следует
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
внутримолекулярное нуклеофильное винильное
В продолжение исследований по химии частич-
замещение (SNVin) [13, 14] (или переаминирова-
но гидрированных функционализированных изо-
ние), приводящее к замыканию изохинолинового
хинолинов [9-11] нами изучена конденсация ци-
цикла и образованию структуры C. Будучи доста-
469
470
ДЯЧЕНКО и др.
Схема 1
Me2NCH(OMe)2
2
CN
кипячение, 3 ч
CN
CN
Me2N
-MeOH
-MeOH
H
H2N
S
MeO
H
H2N
S
Me2N
H2N
S
1
A
B
H
Me2NCH OMe
-NHMe2
Бензол,
кипячение, 8 ч
MeO
E
2
-MeOH
CN
OMe
CN
CN
+
Me2N
H2N
S
H
N SH
G
N S
2
D
F
C
H2N
−DMF
CN
OMe
S
-MeOH
CN
H
Me
2N
CN
H2N
S
NMe2
N SMe
H
4
3
точно сильной, кислота С выступает в качестве
условиях [16]. Таким образом хемоселективность
источника протона, в результате чего возникают
реакции удается переключить за счет растворите-
тиолат D и оксонийкатион E. В дальнейшем оксо-
ля.
ниевый катион E элиминирует молекулу метанола
Строение соединений
3 и
4 подтвержде-
и превращается в иминиевый катион F, способный
но спектральными данными и методом РСА.
к метилированию анионов [15], что приводит к об-
Циклогексеновый цикл в соединении 3 прини-
разованию конечных соединений - тиоэфира 3 и
мает конформацию полукресло с выходом атомов
ДМФА.
углерода C6 (C6') и C7 (C7') из базальной плоскости
Проведение конденсации соединений 1 и 2 в
C5/C4A/C8A/C8 на 0.434(5) [-0.481(6)] и -0.372(5)
кипящем бензоле изменяет ее направление. По-
[0.295(6)] Å, соответственно (рис. 1). Вследствие
видимому, в ходе данной реакции реализуется
стерических эффектов метилтиозаместитель слег-
прототропная таутомерия соединения 1, что при-
ка скручен относительно плоскости пиридиново-
водит к замещенному циклогексену G, в дальней-
го цикла [торсионный угол N2-C3-S1-C9 равен
шем подвергшемуся формилированию по атому
10.10(19)°]. В кристалле молекулы 3 образуют
C2 цианотиоацетамидного фрагмента молекулы
зигзагообразные цепочки вдоль кристаллографи-
G с образованием интермедиата H. Последний в
условиях реакции трансформируется в конечное
ческой оси c за счет слабых межмолекулярных
соединение 4, полученное нами ранее, исходя из
водородных связей C-H∙∙∙N (см. таблицу, рис. 1).
циклопентилиденцианотиоацетамида и димети-
Цепочки расположены на ван-дер-ваальсовых рас-
лацеталя N,N-диметилформамида в аналогичных
стояниях.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
НОВЫЙ МЕТОД СИНТЕЗА ТЕТР
АГИДРОИЗОХИНОЛИНОВ
471
N1
C10
S1
C5
C4
C6
C4A
C3
C6'
C9
C7
N2
C7'
C8A
8
C1
C
a
0
c
b
Рис. 1. Молекулярная и кристаллическая структура соединения 3 в представлении атомов эллипсоидами анизотропных
смещений с 50% вероятностью. Альтернативная конформация циклогексенового цикла показана толстыми штриховыми
линиями. Тонкими штриховыми линиями показаны межмолекулярные водородные связи
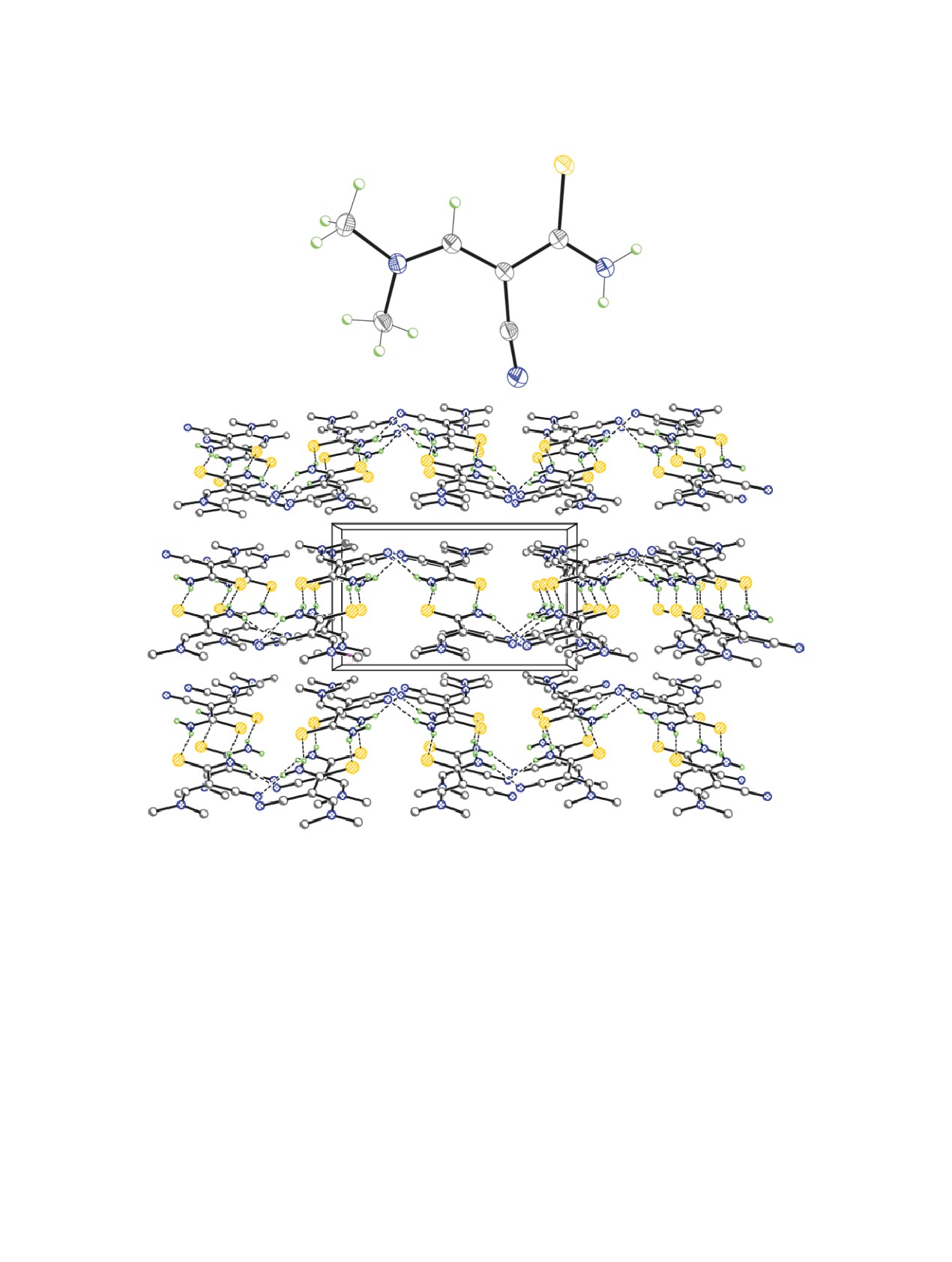
Молекула соединения 4 практически плоская
симметричные димеры за счет межмолекулярных
(среднеквадратичное отклонение атомов, исклю-
водородных связей N-H∙∙∙S (см. таблицу, рис. 2).
чая атомы водорода метильных групп, от средней
Димеры далее связаны в гофрированные слои, па-
плоскости равно 0.046 Å) и представляет E-изомер
раллельные плоскости (100), посредством слабых
относительно центральной двойной связи C2=C3
межмолекулярных водородных связей N-H∙∙∙N
(рис. 2). В кристалле молекулы 4 образуют центро-
(см. таблицу, рис. 2).
Водородные связи в структурах соединений 3 и 4
Соединение
D-H A, Å
d(D-H), Å
d(H∙∙∙A), Å
d(D∙∙∙A), Å
Угол(DHA), град
3
C8-H8A∙∙∙N1a
0.99
2.60
3.541(3)
158
N1-H1A∙∙∙N3b
0.84(2)
2.62(2)
3.0958(18)
117.9(14)
4
N1-H1B∙∙∙S1c
0.84(2)
2.60(2)
3.4102(16)
163.2(16)
a Кристаллографические операции для генерации симметрически эквивалентных атомов: x, y, z+1
b x, -y+1/2, z+1/2
c -x+1, -y+1, -z+2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
472
ДЯЧЕНКО и др.
S1
C5
3
C
C1
C2
N2
N1
C6
C4
N3
c
0
b
a
Рис. 2. Молекулярная и кристаллическая структура соединения 4 в представлении атомов эллипсоидами анизотропных
смещений с 50% вероятностью. Штриховыми линиями показаны межмолекулярные водородные связи
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
0.78790 Å, φ-сканирование с шагом 1.0°), (стра-
на-производитель - США) (соединение 4). Обра-
Параметры элементарных ячеек и интенсив-
ботка экспериментальных данных проведена с по-
ности отражений измерены на трехкружном
мощью программы SAINT (соединение 3) [17] и
рентгеновском дифрактометре Bruker D8 QUEST
iMOSFLM, входящей в комплекс программ CCP4
PHOTON-III CCD (предприятие-изготовитель -
(соединение 4) [18]. Для полученных данных про-
фирма «Bruker AXS Inc.», США) (T = 100 K,
веден учет поглощения рентгеновского излучения
MoKα-излучение, графитовый монохроматор, ω-
по программе SADABS (соединение 3) [19] и Scala
и φ-сканирование с шагом 0.5°) (соединение 3) и
синхротронной станции «РСА» Национального
(соединение 4) [20]. Основные кристаллоструктур-
исследовательского центра
«Курчатовский ин-
ные данные и параметры уточнения представлены
ститут» с использованием двухкоординатного
в приложении (табл. S1, дополнительные материа-
детектора Rayonix SX165 CCD (T = 100 K, λ =
лы). Структуры определены прямыми методами и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
НОВЫЙ МЕТОД СИНТЕЗА ТЕТР
АГИДРОИЗОХИНОЛИНОВ
473
уточнены полноматричным методом наименьших
док отфильтровывали и промывали этанолом и
квадратов по F2 в анизотропном приближении для
гексаном. Выход 1.3 г (63%), желтые кристаллы,
неводородных атомов. Циклогексеновый цикл в
т.пл. 80-82°С (EtOH). ИК спектр, ν, см-1: 2202
соединении (3) разупорядочен по 2 положениям
(C≡N). Спектр ЯМР 1Н, δ, м.д.: 1.64-1.82 уш.с
с заселенностями позиций 0.55:0.45. Атомы во-
[4Н, (CH2)2], 2.51 с (3H, Ме), 2.65 т (2Н, CH2, J
дорода аминогруппы в соединении (4) выявлены
5.3 Гц), 2.75 т (2Н, CH2, J 5.1 Гц), 8.34 с (1Н, Н1).
объективно в разностных Фурье-синтезах и уточ-
Масс-спектр, m/z (Iотн, %): 205.2 (100) [M + 1]+.
нены изотропно с фиксированными параметра-
Найдено, %: C 64.50; H 5.86; N 13.68. C11H12N2S.
ми смещения [Uизо(H) = 1.2Uэкв(N)]. Положения
Вычислено, %: C 64.67; H 5.92; N 13.71. M 204.3.
остальных атомов водорода в обоих соединениях
3-Диметиламино-2-цианопроп-2-ентиоамид
рассчитаны геометрически и включены в уточне-
(4). Смесь 1.8 г (10 ммоль) циклогексилиденци-
ние с фиксированными позиционными параметра-
анотиоацетамида (1) и 1.3 мл (10 ммоль) диме-
ми (модель наездник) и изотропными параметрами
тилацеталя N,N-диметилформамида (2) в 30 мл
смещения [Uизо(H) = 1.5Uэкв(C) для CH3-групп и
бензола кипятили с обратным холодильником 8 ч.
Uизо(H) = 1.2Uэкв(C) для остальных групп]. Все
После остывания реакционной смеси до комнат-
расчеты проведены с использованием комплекса
ной температуры образовавшийся осадок в виде
программ SHELXTL [21]. Таблицы координат ато-
темно-красных кристаллов отфильтровывали и
мов, длин связей, валентных и торсионных углов
промывали гексаном. Выход 1.1 г (73%) т.пл. 193-
и анизотропных параметров смещения для соеди-
195°С (бензол). ИК спектр, ν, см-1: 3338, 3247,
нений 3 и 4 депонированы в Кембриджском Банке
3142 (NH2), 2172 (С≡N), 1115 (С=S). Спектр ЯМР
Структурных Данных, номера депонирования -
1Н, δ, м.д.: 3.24 c (3Н, Ме), 3.30 с (3H, Ме), 7.94
CCDC 2123695 (соединение 3) и CCDC 2123696
уш.с (1Н, NH2), 8.36 с (1Н, СН=), 8.81 уш.с (1Н,
(соединение 4).
С, δ, м.д.: 44.75, 53.25, 81.87,
NH2). Спектр ЯМР 13
ИK спектры получали на приборе Varian Vertex
118.96, 157.44, 188.16. Масс-спектр, m/z (Iотн, %):
70 в таблетках KBr. Спектры ЯМР 1H и 13C реги-
156.2 (100) [M + 1]+. Найдено, %: C 46.31; H 5.76;
стрировали на спектрофотометре Varian VXR-400
N 26.99. C6H9N3S. Вычислено, %: C 46.43; H 5.84;
(предприятие-изготовитель
- фирма
«Varian»,
N 27.07. М 155.21.
США), (399.97 и 100 МГц соответственно) в рас-
ЗАКЛЮЧЕНИЕ
творах ДМСО-d6, внутренний стандарт - TMC.
Масс-спектры снимали на спектрометре Agilent
Взаимодействие циклогексилиденцианотиоа-
1100 Series (страна-производитель - США) с се-
цетамида с диметилацеталем N,N-диметилформ-
лективным детектором Agilent LS/MSDLS (об-
амида при кипячении без растворителя приводит
разцы вводили в матрице CH3COOH, ионизация
к образованию
3-метилтио-5,6,7,8-тетрагидрои-
ЭУ, 70 эВ). Элементный анализ осуществляли на
зохинолин-4-карбонитрила. Однако в кипящем
приборе Perkin Elmer CHN-analyser (страна-произ-
бензоле происходит образование 3-диметилами-
водитель - США). Температуру плавления опре-
но-2-цианопроп-2-ентиоамида.
деляли на блоке Кофлера (страна-производитель -
ИНФОРМАЦИЯ ОБ АВТОРАХ
США). Ход реакции и чистоту полученных соеди-
нений контролировали методом ТСХ на пластин-
Дяченко Иван Владимирович, ORCID: https://
ках Silufol UV-254 в системе ацетон-гексан, 3:5,
orcid/org/0000-0001-7255-3446
проявление парами йода и УФ-облучением.
Дяченко Владимир Данилович, ORCID: https://
3-Метилтио-5,6,7,8-тетрагидроизохинолин-
orcid/org/0000-0002-0993-4091
4-карбонитрил (3). Смесь 1.8 г (10 ммоль) ци-
Хрусталев Виктор Николаевич, ORCID: https://
клогексилиденцианотиоацетамида (1) [22] и 20 мл
orcid/org/0000-0001-8806-2975
диметилацеталя N,N-диметилформамида
(2)
(Aldrich, 94%) кипятили 3 ч и оставляли на 48 ч
Ненайденко Валентин Георгиевич, ORCID:
при комнатной температуре. Образовавшийся оса-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
474
ДЯЧЕНКО и др.
КОНФЛИКТ ИНТЕРЕСОВ
Vovk M.V. Russ. J. Org. Chem. 2013, 49, 1379-1383.]
doi 10.1134/s1070428013090224
Авторы заявляют об отсутствии конфликта ин-
11.
Сукач С.М., Дяченко В.Д. ЖОрХ. 2015, 51, 919-920.
тересов.
[Sukach S.M., Dyachenko V.D. Russ. J. Org. Chem.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
2015, 51, 903-905.] doi 10.1134/s1070428015060160
Дополнительные материалы доступны на
12.
Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. Усп.
хим. 2018, 87, 1-27. [Dyachenko V.D., Dyachen-
ko I.V., Nenajdenko V.G. Russ. Chem. Rev. 2018, 87,
СПИСОК ЛИТЕРАТУРЫ
1-27.] doi 10.1070/rcr4760
1. Shi J. Baran Group Meeting. 2006, 10, 1-11.
13.
Смит М. Органическая химия Марча. Реакции, ме-
2. Избранные методы синтеза и модификации ге-
ханизмы, строение: углубленный курс для универси-
тероциклов. Изохинолины. Химия и биологическая
тетов и химических вузов. М.: Лаборатория знаний,
активность. Ред. В.Г. Карцев. М.: МБФНС (ICSPF)
2020, 2.
Фонд: Научное партнерство, 2008, 7.
14.
Литвинов В.П., Якунин Я.Ю., Дяченко В.Д.
3. Ashwell G.J., Ranjan R., Whittam A.J., Gandolfo D.S.
ХГС. 2001, 41-80. [Litvinov V.P., Yakunin Ya.Yu.,
J. Mater. Chem. 2000, 10, 63-68. doi 10.1039/a902954k
Dyachenko V.D. Chem. Heterocycl. Compd. 2001, 37,
4. Ashwell G.J., Maxwell A.A., Green A. J. Mater. Chem.
37-76.] doi 10.1023/A:1017536700235
2002, 12, 2192-2196. doi 10.1039/B200565B
15.
Пушкарева Т.И., Зенкевич И.Г. Вестн. СПбГУ.
5. Ashwell G.J., Gandolfo D.S. J. Mater. Chem. 2002, 12,
2015, Сер. 4, 2, 269-284.
411-415. doi 10.1039/B109872C
16.
Дяченко И.В. ЖОХ. 2019, 89, 701-706. [Dyachen-
6. Hsin L.-W., Chang L.-T., Rothman R.B., Dersch C.M.,
ko I.V. Russ. J. Gen. Chem. 2019, 89, 896-900.] doi
Fishback J.A., Matsumoto R.R. J. Med. Chem. 2010,
10.1134/S1070363219050062
53, 1392-1396. doi 10.1021/jm901503e
17.
Bruker, SAINT, Bruker AXS Inc., Madison, WI, 2012.
7. Kamal A.M., Radwan S.M., Zaki R.M. Eur. J.
18.
Battye T.G.G., Kontogiannis L., Johnson O., Po-
Med. Chem.
2011,
46,
567-578. doi
10.1016/
well H.R., Leslie A.G.W. Acta Crystallogr., Sect. D.
j.ejmech.2010.11.036
2011, 67, 271-281. doi 10.1107/S0907444910048675
8. Дяченко И.В., Дяченко В.Д. ЖОрХ.
2017,
53,
19.
Sheldrick G.M. SADABS, Bruker/Siemens Area
1735-1754. [Dyachenko I.V., Dyachenko V.D. Russ.
Detector Absorption Correction Program; Bruker AXS
J. Org. Chem. 2017, 53, 1769-1787.] doi 10.1134/
Inc., Madison, WI, 2003.
s1070428017120016
20.
Evans P.R. Acta Crystallogr., Sect. D. 2006, 62, 72-
9. Дяченко И.В., Вовк М.В. ЖОрХ. 2013, 49, 771-772.
82. doi 10.1107/S0907444905036693
[Dyachenko I.V., Vovk M.V. Russ. J. Org. Chem. 2013,
49, 787-788.] doi 10.1134/s107042801305028x
21.
Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
3-8. doi 10.1107/S2053229614024218
10. Дяченко И.В., Русанов Э.Б., Вовк М.В. ЖОрХ.
2013, 49, 1364-1368. [Dyachenko I.V., Rusanov E.B.,
22.
Abdel-Latif F.F. Pharmazie. 1990, 45, 283-284.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
НОВЫЙ МЕТОД СИНТЕЗА ТЕТР
АГИДРОИЗОХИНОЛИНОВ
475
New Synthesis of Tetrahydroisoquinolines
I. V. Dyachenkoa, V. D. Dyachenkoa, P. V. Dorovatovskyb,
V. N. Khrustalevc, d, and V. G. Nenajdenkoe, *
a Lugansk State Pedagogical University, ul. Oboronnaya, 2, Lugansk, 91011 Ukraine
b National Research Center “Kurchatov Institute”, ul. Akad. Kurchatova, 1, Moscow, 123182 Russia
c Peoples’ Friendship University of Russia (RUDN University), ul. Miklukho-Maklaya, 6, Moscow, 117198 Russia
d Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences, Leninsky prosp., 47, Moscow, 119991 Russia
e Lomonosov Moscow State University, Leninskie Gory, 1/3, Moscow, 119991 Russia
*e-mail: nenajdenko@gmail.com
Received November 23, 2021; revised December 12, 2021; accepted December 14, 2021
The reaction of cyclohexylidenecyanothioacetamide with N,N-dimethylformamide dimethylacetal was studied.
This transformation, depending on the reaction conditions, leads to different results: when the starting reagents
are boiled without a solvent, 3-methylthio-5,6,7,8-tetrahydroisoquinoline-4-carbonitrile is formed, and boiling
them in benzene ends with the formation of 3-dimethylamino-2-cyanoprop-2-entiamide. The structure of these
products was studied by X-ray.
Keywords: thioamide, N,N-dimethylformamide dimethyl acetal, tetrahydroisoquinoline, X-ray structural
analysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022