ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 5, с. 502-508
УДК 547.781.2 + 547.562 + 547.446.8
СИНТЕЗ ПРОИЗВОДНЫХ 1-(АДАМАНТИЛ-1)-
2-[4-(1H-ИМИДАЗОЛ-1-ИЛМЕТИЛ)ФЕНОКСИ]ЭТАНОНА
©2022 г. А. А. Данилинa, *, В. Л. Гузманa, А. В. Басанцевa,
А. А. Головановb, П. П. Пурыгинa
a ФГБОУ ВО «Самарский национальный исследовательский университет им. Академика С. П. Королева»,
Естественнонаучный институт, Россия, 443086 Самара, Московское ш., 34
b ФГБОУ ВО «Тольяттинский государственный университет», Россия, 445020 Тольятти, ул. Белорусская, 14
*e-mail: vulck1@yandex.ru
Поступила в редакцию 03.10.2021 г.
После доработки 20.10.2021 г.
Принята к публикации 30.10.2021 г.
Предложены 2 метода получения производных 1-(адамантил-1)-2-[4-(1H-имидазол-1-илметил)фенокси]-
этанона на основе реакции алкилирования 4-(2-алкил-1H-имидазол-1-илметил)фенола (адамантил-1)-
бромметилкетоном и 2-этил-, 2-изопропил- и 4-нитроимидазола 1-(адамантил-1)-2-[4-(гидроксиметил)-
фенокси]этаноном. Установлена зависимость суммарного выхода целевых продуктов от стерического
объема и электронного влияния заместителей в положениях 2 и 4 имидазольного кольца.
Ключевые слова: (адамантил-1)бромметилкетон, производные имидазола, встречный синтез, О-алки-
лирование фенолов, 4-гидроксибезиловый спирт, п-метиленхинон
DOI: 10.31857/S051474922205007X, EDN: CUKUPL
ВВЕДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В представленной работе был осуществлен
Синтез эфиров 4-[(1Н-имидазол-1-ил)метил]-
синтез 1-(адамантил-1)-2-[4-(2-этил-1H-имидазол-
фенола и его производных является в ряде слу-
1-илметил)фенокси]этанона
(1a),
1-(адамантил-
чаев ключевой стадией получения соединений
1)-2-[4-(2-изопропил-1H-имидазол-1-илметил)
с широким спектром биологической активности
фенокси]этанона (1b) и 1-(адамантил-1)-2-[4-(4-
[1-3]. Однако сами рассматриваемые структуры,
нитро-1H-имидазол-1-илметил)фенокси]этанона
как было установлено в результате биологических
(1c) двумя различными методами а (схема 1) и b
испытаний, также проявляют высокую антибиоти-
(схема 2) с целью установления оптимальных ус-
ческую и противотуберкулезную активность [4-6].
ловий проведения реакции и оценки влияния ха-
Анализ литературы показывает, что для полу-
рактера заместителя в составе имидазола на выход
чения О-алкилированных 4-[(1Н-имидазол-1-ил)-
конечных продуктов.
метил]фенолов могут быть использованы 3 ос-
В соответствии с методом a получение произ-
новных метода [7-10]. Наиболее распространен-
водных 4-[(1Н-имидазол-1-ил)метил]фенола 3a, b
ным является N-алкилирование производных
было осуществлено сплавлением 4-гидроксибен-
имидазола
4-алкоксибензилхлоридами. Другим
зилового спирта (4) с производными имидазола 2a,
способом служит О-алкилирование производных
b при 160°C без растворителя в течение 15 мин.
4-[(1Н-имидазол-1-ил)метил]фенолов. В настоя-
Завершение реакции устанавливали по окончанию
щее время менее распространен, но тем не менее
выделения воды из реакционной смеси. Выходы
весьма перспективен электросинтез на основе
соединений 3a и b составили 71 и 80% соответ-
4-алкокситолуола и 1-замещенных имидазолов.
ственно.
502
СИНТЕЗ ПРОИЗВОДНЫХ
503
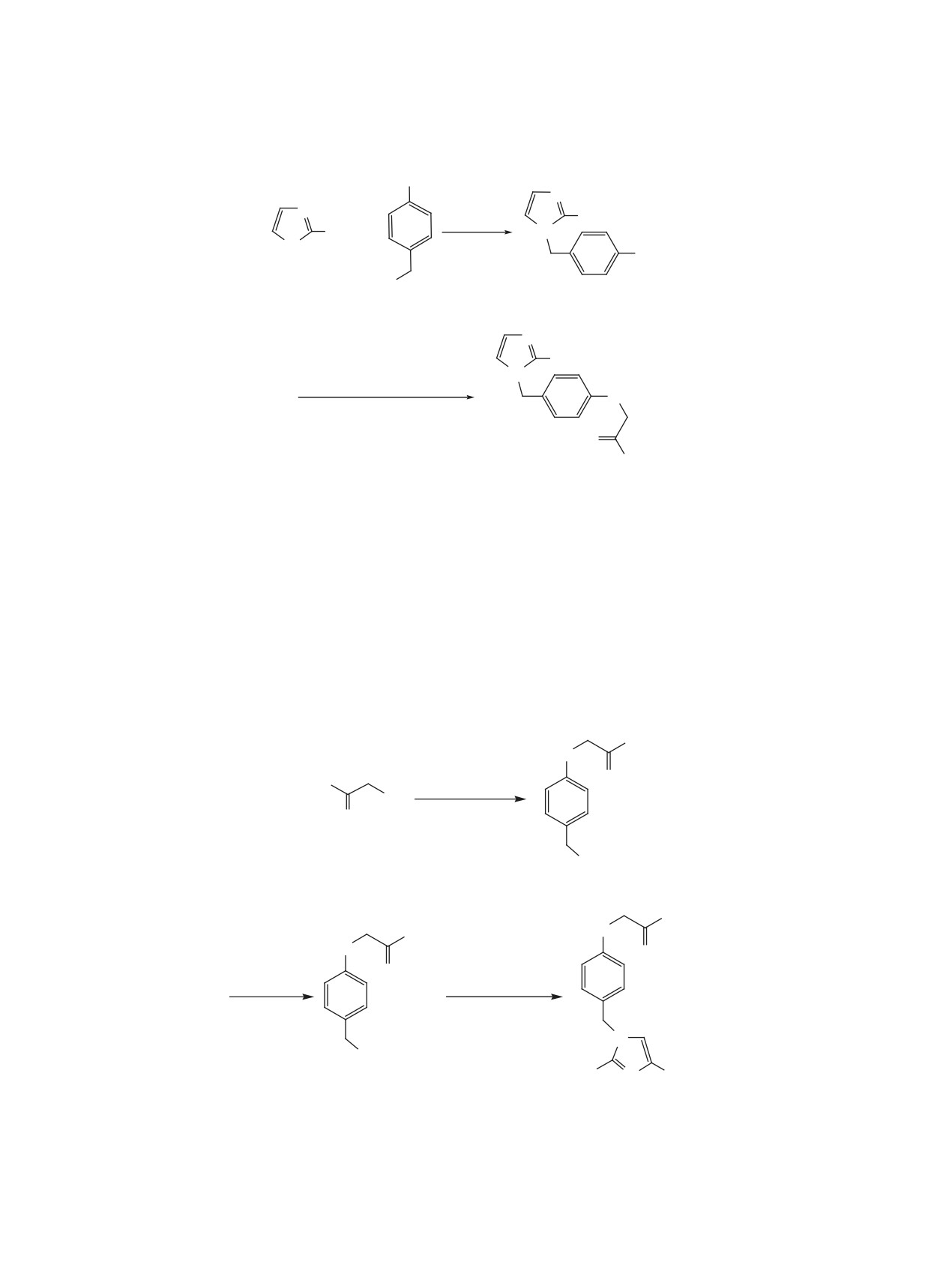
Схема 1
OH
N
N
160°C
R
15 мин
R
+
N
-H2O
N
H
OH
HO
2a, b
4
3a, b
N
R
N
3
1-AdC(O)CH2Br, Cs2CO
O
(CH3)2CO, 6 ч, кипячение
O
1-Ad
1a, b
1-3, R = C2H5 (a), (CH3)2CH (b).
В спектрах ЯМР 1Н соединений 3а, b обнару-
Показано [11], что реакции подобного типа
живаются сигналы алкильных групп в области
протекают через промежуточное образование ре-
1.13-3.08 м.д., сигналы протонов фрагмента CH2N
акционноспособного п-метиленхинона (схема 3).
в области 5.00-5.02 м.д., сигналы ароматических
Сплавление 4-нитроимидазола (2с) и спирта
колец в области 6.72-7.07 м.д., а также синглеты
4 не приводило к химическому взаимодействию
в области 7.29-9.50 м.д., соответствующие OH-
и образованию соединения 3с, на что указыва-
группе.
ло, в частности, отсутствие выделяющейся воды.
Схема 2
1-Ad
O
Ad
Cs2CO3
O
4
+
Br
CH3CN,
O
2 ч, 20°C
8 ч кипячение
OH
5
1-Ad
O
1-Ad
O
O
O
SOCl2
2a-c
C6H6, Py,
K2CO3, CH3CN
1 ч, 20°C
5 ч, кипячение
N
Cl
R
N
X
6
1a-c
1, R = C2H5 (a), (CH3)2CH (b), H (c); 1, X = H (a, b), NO2 (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
504
ДАНИЛИН и др.
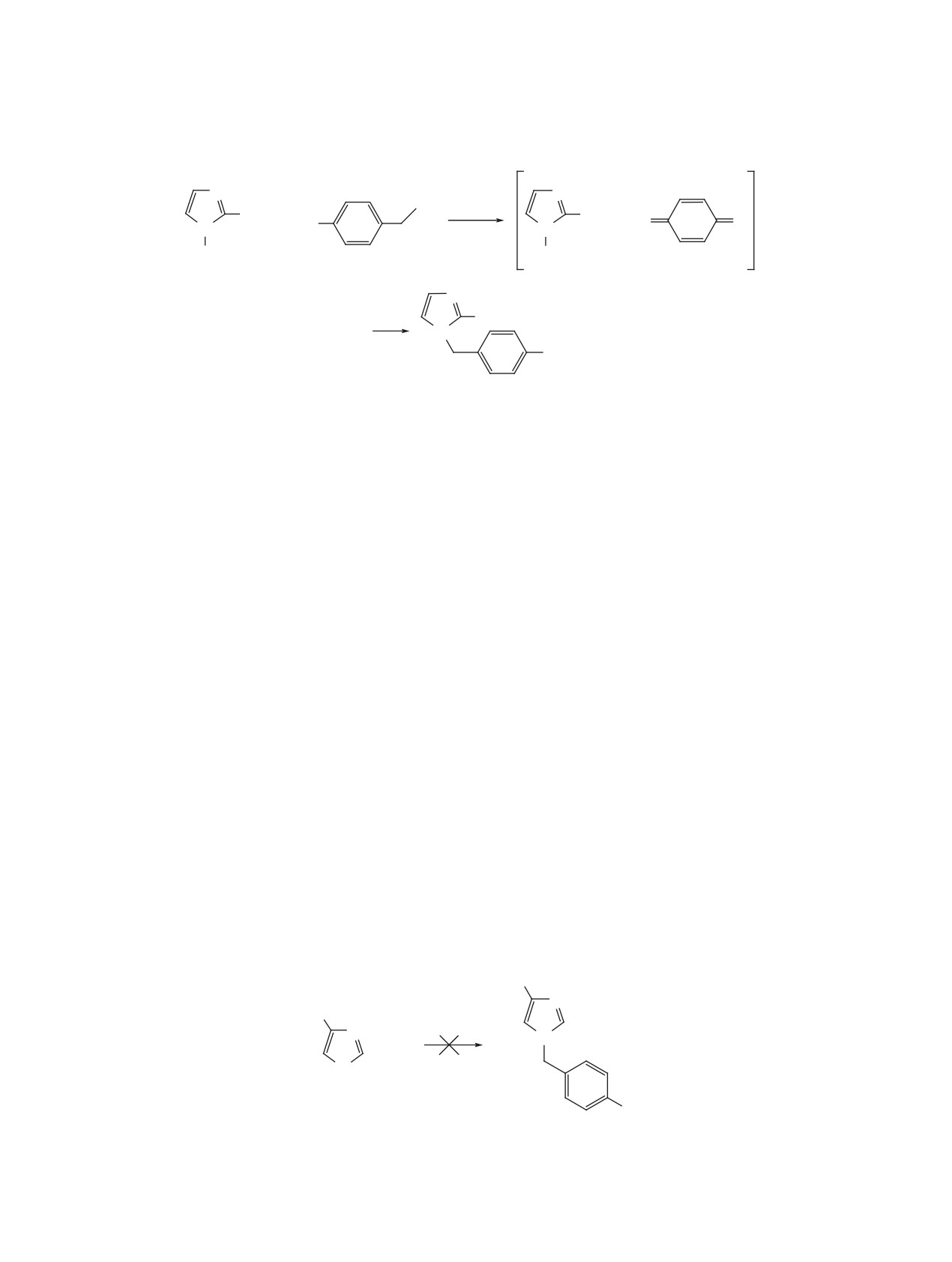
Схема 3
N
N
OH
160°C
R
R H O
+ H
O
N
-H2O
N
2C
H
H
N
R
N
OH
По-видимому, это вызвано электроноакцептор-
друплет), изопропильной группы - при 1.31 м.д.
ным действием нитрогруппы, понижающей ос-
(дублет) и при 2.99-3.08 м.д. (мультиплет).
новность азола, что препятствовало образованию
Попытки получения соединений 1a, b с при-
п-метиленхинона (схема 4).
менением других оснований (гидрида натрия,
Последующее О-алкилирование соединений
триэтиламина и карбоната калия) оказались безу-
3a, b было осуществлено (адамантил-1)бромме-
спешными, так как реакция в данных условиях со-
тилкетоном в присутствии карбоната цезия в аце-
провождалась значительным осмолением реакци-
тоне при кипячении в течение 6 ч в токе аргона.
онной смеси, компоненты которой не поддавались
Выход продукта 1а после очистки составил
спектральной идентификации.
67%, 1b - 70%.
С целью осуществления встречного синте-
Доказательство строения соединений 1а и b ос-
за соединений 1а-с (метод b) нами был получен
новано на их спектральных характеристиках и ре-
1-(адамантил-1)-2-[4-(гидроксиметил)фенокси]-
зультатах элементного анализа. Так, в ИК спектрах
этанон (5) в результате нагревания соединения 4
соединений 1а и b имеются характеристические
с (адамантил-1)бромметилкетоном в ацетонитри-
полосы поглощения, соответствующие валент-
ле в присутствии карбоната цезия в токе аргона
ным колебаниям С-Н связей адамантана (2912-
(схема 2). Выход продукта 5 составил 87%.
2848 см-1), карбонильной группы (1718, 1713 см-1)
В спектре ЯМР 1Н соединения 5 ключевыми
и простой эфирной связи (1245, 1235 см-1) соот-
являются сигналы протонов адамантильного ра-
ветственно. В спектре ЯМР 1Н этанонов 1а и b
дикала (м, 1.72-2.02 м.д.) и фрагмента СН2О (с,
ключевыми являются сигналы протонов адаман-
тильного радикала (м, 1.70-2.17 м.д.), фрагментов
5.05 м.д.). В ИК спектре соединения 5 присутству-
СН2О (с, 4.82-4.87 м.д.) и CH2N (с, 5.05-5.06 м.д.),
ют полосы поглощения валентных колебаний С-Н
а также бензольного и имидазольного кольца (м,
связей адамантана (2905, 2849 см-1), карбониль-
6.74-7.11 м.д.). Протоны этильной группы прояв-
ной группы (1698 см-1) и простой эфирной связи
ляют себя при 1.34 м.д. (триплет) и 2.79 м.д. (ква-
(1228 см-1).
Схема 4
O2N
N
O2N
N
N
+
4
N
H
OH
2c
3c
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
СИНТЕЗ ПРОИЗВОДНЫХ
505
N-Алкилирование соединений 2а-с с помо-
ветствующего производного имидазола 2 и 1.04 г
щью соединения 6, предварительно полученного
(8.4 ммоль) соединения 4. Реакционную смесь пе-
действием хлористого тионила на соединение 5
ремешивали и нагревали на металлической бане
в присутствии пиридина, привело к образованию
при 160°С в течение 15 мин, затем охлаждали до
продуктов 1а-с с выходами на данной стадии 63,
комнатной температуры. Образовавшийся корич-
58 и 38% соответственно.
невый твердый плав измельчали, затем в случае
соединения 3а промывали горячей водой и 25 мл
Строение соединений
1a-c (метод b) под-
этилацетата, в случае cоединения 3b - холодной
тверждено методами ИК, ЯМР 1Н спектроскопии
водой и 25 мл дихлорметана, отфильтровывали и
и данными элементного анализа. Так, отсутствие
сушили на воздухе.
характеристической полосы поглощения валент-
ного колебания связи С-Сl при 661 см-1 и нали-
4-(2-Этил-1H-имидазол-1-илметил)фенол
чие полосы поглощения, соответствующей связи
(3а). Выход 1.22 г (71%), светло-бежевые кри-
С=N имидазола, в области 1511-1515 см-1 по-
сталлы, т.пл. 167-169°C, Rf 0.30 (MeOH-ССl4,
зволяет судить об образовании продуктов 1а-с в
1:5). ИК спектр, ν, см-1: 2978 (OH), 1516 (C=N).
ходе N-алкилирования азолов. В спектрах ЯМР
Спектр ЯМР 1Н, δ, м.д.: 1.13 т (3Н, СН3, J 7.5 Гц),
1Н соединений 1а, b, полученных методом b, на-
2.58 к (2H, CH2СH3, J 7.5 Гц), 5.00 с (2Н, CН2),
блюдаются синглеты протонов фрагмента CH2N в
6.72-6.77 м (3Наром), 6.98-7.07 м (3Наром), 9.50 с
области 5.05-5.06 м.д и мультиплетные сигналы
(1Н, ОН). Найдено, %: С 71.25; Н 6.72. С12Н14N2O.
6 ароматических протонов в интервале 6.81-6.87 и
Вычислено, %: С 71.26; Н 6.98.
6.98-7.07 м.д. соответственно. Для соединения 1с,
4-(2-Изопропил-1H-имидазол-1-илметил)фе-
помимо синглетного пика при 5.23 м.д., характер-
нол (3b). Выход 1.45 г (80%), светло-коричневые
но наличие 2 синглетов, относящихся к протонам
кристаллы, т.пл. 53-56°C, Rf 0.45 (EtOH-ССl4,
второго (7.99 м.д.) и пятого (8.46 м.д.) положений
1:3). ИК спектр, ν, см-1: 2970 (OH), 1514 (C=N).
4-нитроимидазольного кольца.
Спектр ЯМР 1Н, δ, м.д.: 1.30 д.д (6H, CH3, J1 6.9, J2
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
7.0 Гц), 2.99-3.08 м [1Н, СН(СН3)2], 5.02 с (2Н,
ИК спектры сняты на ИК Фурье-спектрометре
СН2), 6.81-6.99 м (6Наром), 7.29 с (1Н, ОН). Найдено,
%: С 71.79; Н 6.98. С13Н16N2O. Вычислено, %: С
ФТ-801 с приставкой НПВО (Россия) в таблет-
ках KBr. Спектры ЯМР 1Н сняты на прибо-
72.19; Н 7.46.
ре Bruker AM300 (300.13 МГц) (Германия) в
Соединения 1a, b (общая методика). В кругло-
CDCl3 и ДМСО-d6, внутренний стандарт - ТМС.
донную колбу к раствору 1.2 ммоль соответству-
Элементный анализ проведен на установке для
ющего фенола 3 в 8 мл ацетона поместили 0.31 г
экспресс-гравиметрического определения эле-
(1.2 ммоль) (адамантил-1)бромметилкетона при
ментов
[12]. Абсолютирование растворителей
интенсивном перемешивании с последующим
осуществляли согласно методикам
[13]. ТСХ
добавлением 0.75 г (2.3 ммоль) карбоната цезия.
проведена на пластинах Sorbfil ПТСХ-П-В-УФ
Реакционную смесь кипятили в токе аргона в те-
(Россия), проявители - пары иода или хромато-
чение 6 ч, отфильтровывали от осадка, затем упа-
графический облучатель УФС 254/365 (Россия).
ривали на роторном испарителе. Образовавшийся
Температуру плавления определяли на приборе
продукт 1а промывали водой и перекристаллизо-
ПОТП-2 (Россия) в запаянном капилляре. В ра-
вывали из этилацетата, полученное масло 1b очи-
боте использовали коммерческие реактивы фирм
щали методом флэш-хроматографии на сухой ко-
«Fluka» (Германия), «Aldrich», «Sigma» (США),
лонке (AcOEt-CCl4, 1:1).
«Вектон» (Россия).
1-(Адамантил-1)-2-[4-(2-этил-1H-имидазол-
Метод а.
1-илметил)фенокси]этанон (1a). Выход 0.29 г
Соединения 3a, b (общая методика). В ши-
(67%), белые кристаллы, т.пл. 129-132°С, Rf 0.19
рокогорлую круглодонную колбу, снабженную
(MeCN-ССl4, 5:1). ИК спектр, ν, см-1: 2912, 2848
термометром, добавляли смесь 8.4 ммоль соот-
(Ad, C-H), 1713 (C=O), 1516 (С=N), 1245 (С-O-С).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
506
ДАНИЛИН и др.
Спектр ЯМР 1Н, δ, м.д.: 1.34 т (3Н, СН3, J 7.8 Гц),
вавшегося осадка, дважды промывали водой, по-
1.71-2.10 м (15H, Ad), 2.79 к (2H, CH2СH3, J
сле чего водную фазу экстрагировали небольшим
7.8 Гц), 4.87 с (2Н, CН2O), 5.06 c (2H, CH2N), 6.82-
количеством бензола. Органические слои объеди-
6.88 м (3Наром), 7.00-7.07 м (3Наром). Найдено, %:
няли и сушили над сульфатом магния, после чего
С 76.67; Н 8.41. С24Н30N2O2. Вычислено, %: С
упаривали в вакууме. Было получено белое кри-
76.16; Н 7.99.
сталлическое вещество, которое без очистки ис-
пользовали в дальнейших синтезах. Выход 2.33 г
1-(Адамантил-1)-2-[4-(2-изопропил-1H-ими-
(73%), т.пл. 101-103°С, Rf 0.69 (EtOH-ССl4, 1:3).
дазол-1-илметил)фенокси]этанон
(1b). Выход
ИК спектр, ν, см-1: 2907, 2849 (Ad, C-H), 1709
0.30 г (70%), желтое масло, Rf 0.54 (EtOH-ССl4,
(C=O), 1230 (С-O-С), 661 (С-Сl). Спектр ЯМР 1Н,
1:3). ИК спектр, ν, см-1: 2906, 2850 (Ad, C-H), 1718
δ, м.д.: 1.72-2.02 м (15H, Ad), 4.73 c (2H, CH2Cl),
(C=O), 1511 (С=N), 1235 (С-O-С). Спектр ЯМР
5.11 с (2Н, CН2O), 6.86 д (2Наром, J 8.7 Гц), 7.34 д
1Н, δ, м.д.: 1.31 д (6Н, 2СН3, J 6.6 Гц), 1.70-2.17 м
(2Наром, J 8.4 Гц). Найдено, %: С 71.57; Н 7.38; Сl
(15H, Ad), 2.99-3.08 м [1H, (CH3)2CH], 4.82 с (2Н,
10.77. С19Н23ClO2. Вычислено, %: С 71.57; Н 7.27;
CН2O), 5.05 c (2H, CH2N), 6.74-6.83 м (3Наром),
Сl 11.12.
6.97-7.11 м (3Наром). Найдено, %: С 70.45; Н 7.51.
С25Н32N2O2. Вычислено, %: С 70.49; Н 8.22.
Соединения 1a, b, c (общая методика). В кру-
глодонную колбу к раствору 0.41 г (1.3 ммоль)
Метод b.
соединения 6 в 14 мл ацетонитрила помещали
1-(Адамантил-1)-2-[4-(гидроксиметил)фе-
5.2 ммоль соответствующего производного ими-
нокси]этанон (5). В круглодонную колбу, снаб-
дазола 2 (1.3 ммоль в случае 2с) с последующим
женную магнитной мешалкой, к раствору 1.50 г
добавлением 0.18 г (1.3 ммоль) карбоната калия.
(12 ммоль) соединения 4 в 40 мл ацетонитрила
Реакционную смесь кипятили в токе аргона при
прибавляли 3.11 г (12 ммоль) (адамантил-1)бром-
перемешивании в течение 5 ч, затем отфильтро-
метилкетона при интенсивном перемешивании
вывали от образовавшегося осадка и упаривали.
с последующим добавлением 6.05 г (19 ммоль)
Полученный остаток растворяли в дихлорметане,
карбоната цезия. Реакционную смесь перемеши-
дважды промывали водой и сушили над сульфатом
вали при комнатной температуре в токе аргона в
натрия, после чего растворитель снова упаривали.
Целевой продукт очищали флэш-хроматографией
течение 2 ч, затем кипятили 8 ч, после чего от-
фильтровывали и упаривали на роторном испа-
на сухой колонке (в случае 1а и с - AcOEt-CCl4,
1:1, 1b - AcOEt-CCl4, 2:1).
рителе. Образовавшийся остаток промывали го-
рячим гексаном, отфильтровывали и сушили на
1-(Адамантил-1)-2-[4-(2-этил-1H-имидазол-
воздухе. Выход 3.16 г (87%), т.пл. 85-87°С, Rf 0.54
1-илметил)фенокси]этанон (1a). Выход 0.32 г
(EtOH-ССl4, 1:3). ИК спектр, ν, см-1: 3494 (OH),
(63%), белые кристаллы, т.пл. 130-132°С, Rf 0.20
2905, 2849 (Ad, C-H), 1698 (C=O), 1228 (С-O-С).
(MeCN-ССl4, 5:1). ИК спектр, ν, см-1: 2913, 2851
Спектр ЯМР 1Н, δ, м.д.: 1.72-2.02 м (15H, Ad), 3.34
(Ad, C-H), 1713 (C=O), 1515 (С=N), 1243 (С-O-С).
c (1H, OH) 4.42 д (2H, CH2OH, J 3.3 Гц), 5.05 с
Спектр ЯМР 1Н, δ, м.д.: 1.34 т (3Н, СН3, J 7.8 Гц),
(2Н, CН2О), 6.81 д (2Наром, J 7.8 Гц), 7.21 д (2Наром,
1.71-2.09 м (15H, Ad), 2.79 к (2H, CH2СН3, J
J 8.1 Гц). Найдено, %: С 76.03; Н 8.12. С19Н24O3.
7.5 Гц), 4.87 с (2Н, CН2О), 5.05 c (2H, CH2N), 6.82-
Вычислено, %: С 75.97; Н 8.05.
6.87 м (3Наром), 7.00-7.07 м (3Наром). Найдено, %:
С 75.88; Н 8.13. С24Н30N2O2. Вычислено, %: С
1-(Адамантил-1)-2-[4-(хлорметил)фенокси]-
76.16; Н 7.99.
этанон (6). К раствору 1.79 г (14.5 ммоль) хло-
ристого тионила и 0.78 г (9.6 ммоль) пиридина
1-(Адамантил-1)-2-[4-(2-изопропил-1H-ими-
в 11 мл абсолютного бензола прикапывали рас-
дазол-1-илметил)фенокси]этанон
(1b). Выход
твор 2.89 г (9.6 ммоль) соединения 5 в 38 мл аб-
0.35 г (58%), желтое масло, Rf 0.56 (EtOH-ССl4,
солютного бензола при комнатной температуре
1:3). ИК спектр, ν, см-1: 2910, 2850 (Ad, C-H), 1714
и интенсивном перемешивании в течение 1 ч.
(C=O), 1511 (С=N), 1241 (С-O-С). Спектр ЯМР
Реакционную смесь отфильтровывали от образо-
1Н, δ, м.д.: 1.32 д (6Н, 2СН3, J 6.9 Гц), 1.70-2.08 м
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
СИНТЕЗ ПРОИЗВОДНЫХ
507
(15H, Ad), 2.99-3.08 м [1H, (СН3)2CH], 4.86 с (2Н,
CН2О), 5.06 c (2H, CH2N), 6.81-6.84 м (3Наром),
orcid.org/0000-0002-9589-657X
6.98-7.05 м (3Наром). Найдено, %: С 70.90; Н 8.23.
КОНФЛИКТ ИНТЕРЕСОВ
С25Н32N2O2. Вычислено, %: С 70.49; Н 8.22.
Авторы заявляют об отсутствии конфликта ин-
1-(Адамантил-1)-2-[4-(4-нитро-1H-имидазол-
тересов.
1-илметил)фенокси]этанон (1с). Выход 0.29 г
(38%), белые кристаллы, т.пл. 147-149°С, Rf 0.32
СПИСОК ЛИТЕРАТУРЫ
(AcOEt-ССl4, 1:1). ИК спектр, ν, см-1: 2905, 2850
1.
Pu J., Kreft A.F., Aschmies S.H., Atchison K.P.,
(Ad, C-H), 1709 (C=O), 1514 (С=N), 1488 (NO2),
Berkowitz J., Caggiano T.J., Chlenov M., Diamanti-
1251 (С-O-С). Спектр ЯМР 1Н, δ, м.д.: 1.71-2.00
dis G., Harrison B.L., Hu Y., Huryn D., Jacob-
м (15H, Ad), 5.09 c (2Н, CН2O), 5.23 c (2H, CH2N),
sen J.S., Jin M., Lipinski K., Lu P., Martone R.L., Mor-
6.87 д (2Наром, J 8.4 Гц), 7.34 д (2Наром, J 8.1 Гц),
ris K., Sonnenberg-Reines J., Riddell D.R., Sabalski J.,
7.99 c (1Н, Н2, Im), 8.46 c (1Н, Н5, Im). Найдено,
Sun Sh.-Ch., Wagner E., Wang Y., Xu Zh., Zhou H.,
%: С 66.72; Н 6.25. С22Н25N3O4. Вычислено, %: С
Resnick L. Bioorg. Med. Chem. 2009, 17, 4708-4717.
66.82; Н 6.37.
doi 10.1016/j.bmc.2009.04.052
2.
Jisue L., Jae-Goo K., Haena L., Hoon L.T., Ki-
ЗАКЛЮЧЕНИЕ
Young K., Hakwon K. Pharmaceutics. 2021, 13, 1-20.
Сравнивая выходы соединений 1а, b, получен-
doi 10.3390/pharmaceutics13030312
ных методом a, можно утверждать об отсутствии
3.
Reayi A., Hosmane R.S. J. Med. Chem. 2004, 47,
стерического влияния алкильного заместителя на
1044-1050. doi 10.1021/jm0304257
выход продуктов. В случае соединения 2с наличие
4.
Arjomandi O.K., Kavoosi M., Adibi H. Bioorg. Chem.
электроноакцепторной нитрогруппы значительно
2019, 92, 1-9. doi 10.1016/j.bioorg.2019.103277
снижает основность азола, в результате чего полу-
5.
Miranda P.O., Gundersen L.-L. Arch. Pharm. 2010,
чение соединения 3с и, следовательно, соединения
343, 40-47. doi 10.1002/ardp.200900149
1с становится невозможным.
6.
Гуревич К.Г., Ураков А.Л., Басанцев А.В, Абза-
При проведении реакции по методу b получе-
лилов Т.А., Баширов И.И., Данилин А.А., Пуры-
ны 3 продукта 1а-с, что указывает на его большую
гин П.П., Голованов А.А., Хайрзаманова К.А., Са-
мородов А.В. Хим. фарм. ж. 2021, 55, 15-20. doi
универсальность. Снижение выходов соединений
10.30906/0023-1134-2021-55-8-15-20
1b и с по сравнению с соединением 1а, по-види-
мому, обусловлено стерическим экранированием
7.
Hamada S., Sugimoto K., Iida M., Furuta T. Tetrahedron
атома азота в случае соединения 1b и уменьшени-
Lett. 2019, 60, 1-9. doi 10.1016/j.tetlet.2019.151277
ем его нуклеофильности в случае соединения 1с. В
8.
Dubois J., de Figueiredo R., Thoret S., Huet C.
целом можно отметить более высокие суммарные
Synthesis. 2007, 4, 529-540. doi 10.1055/s-2007-
выходы целевых соединений 1а, b, полученных
965896
методом a.
9.
Белоусова З.П., Пурыгин П.П., Кошелев В.Н. Бут-
леров. сообщ. 2018, 54, 132-137. doi 10.37952/ROI-
ИНФОРМАЦИЯ ОБ АВТОРАХ
jbc-01/18-54-6-132
Данилин Андрей Александрович, ORCID:
10.
Morofuji T., Shimizu A., Yoshida J. J. Am. Chem. Soc.
2014, 136, 4496-4499. doi 10.1021/ja501093m
11.
Osyanin V.A., Sidorina N.E., Klimochkin Y.N.
Гузман Владислав Леонидович, ORCID: https://
Synth. Commun. 2011, 42, 2639-2647. doi 10.1080/
orcid.org/0000-0003-3054-4992
00397911.2011.563452
Басанцев Антон Владимирович, ORCID: https://
12.
Климова В.А. Основные микрометоды анализа ор-
orcid.org/0000-0002-8923-2531
ганических соединений. М.: Химия. 1975, 57-59.
Голованов Александр Александрович, ORCID:
13.
Кейл Б. Лабораторная техника органической хи-
мии. М.: Мир. 1966, 594-606.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
508
ДАНИЛИН и др.
Synthesis of 1-(Adamantyl-1)-2-[4-(1H-imidazol-
1-ylmethyl)phenoxy]ethanone Derivatives
A. A. Danilina, *, V. L. Guzmana, A. V. Basantseva, A. A. Golovanovb, and P. P. Purygina
a Institute of Natural Sciences, S.P. Korolev Samara National Research University,
Moskovskoe shosse, 34, Samara, 443086 Russia
b Togliatti State University, ul. Belorusskaya, 14, Togliatti, 445020 Russia
*e-mail: vulck1@yandex.ru
Received October 3, 2021; revised October 20, 2021; accepted October 30, 2021
Two methods have been developed for the first synthesis of 1-(adamantyl-1)-2-[4-(1H-imidazol-1-ylmethyl)-
phenoxy]ethanone derivatives by the reactions of 4-(2-alkyl-1H-imidazol-1-ylmethyl)phenol with (adamantyl-1)-
bromomethylketone and 2-ethyl-, 2-isopropyl-, 4-nitroimidazole with 1-(adamantyl-1)-2-[4-(hydroxymethyl)-
phenoxy]ethanone. It was found that total yields of the target products depend on steric and electronic substituent
effects into position 2 and 4 of the imidazole core.
Keywords: (adamantyl-1)bromomethylketone, imidazole derivatives, counter synthesis, О-alkylation of phe-
nols, (4-hydroxyphenyl)methanol, p-quinone methide
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022