ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 5, с. 532-542
УДК 547.665:547.638.1:547.572.6:544.473-039.63-386
ВНУТРИМОЛЕКУЛЯРНАЯ ЦИКЛИЗАЦИЯ
орто-ЗАМЕЩЕННЫХ ХАЛКОНОВ В ПРИСУТСТВИИ
КОМПЛЕКСОВ ПАЛЛАДИЯ С ХИРАЛЬНЫМИ
БИСФОСФИНОВЫМИ ЛИГАНДАМИ
© 2022 г. М. А. Ашаткина*, А. Н. Резников, Ю. Н. Климочкин
ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*e-mail: ashatkinamaria@gmail.com
Поступила в редакцию 18.11.2021 г.
После доработки 15.12.2021 г.
Принята к публикации 19.12.2021 г.
Oбсуждается влияние лигандов и уходящей группы на направление и селективность внутримолекуляр-
ного арилирования орто-замещенных халконов. В присутствии комплексов Pd с лигандами (S)-BINAP,
(R)-C3-TunePhos, (S,S',R,R')-TangPhos 3-фенилиндан-1-он получен с энантиомерными избытками до 83%.
Наряду с продуктом восстановительной циклизации наблюдается образование 2-метил-3-фенил-1Н-ин-
ден-1-она. Циклизация орто-мезилокси- и метоксикарбонилокси-замещенных халконов в аналогичных
условиях приводит к образованию 2-фенилхроман-4-она.
Ключевые слова: асимметрический синтез, орто-замещенные халконы, хиральные лиганды, комплексы
палладия, катализ
DOI: 10.31857/S0514749222050111, EDN: CVCETH
ВВЕДЕНИЕ
поскольку не всегда они оказываются коммерче-
ски доступными, и возникает необходимость в до-
Асимметрическое сопряженное присоединение
полнительной стадии их приготовления. Особенно
металлорганических реагентов к енонам является
актуальным поиск альтернативных методов реали-
эффективным подходом к получению энантио-
зации таких процессов становится в отношении
мерно обогащенных соединений. Использование
внутримолекулярных процессов сопряженного
цинк-, алюминий-, цирконий-, магнийорганиче-
присоединения, когда исходные реагенты для этих
ских реагентов [1-8], и, особенно, бороновых
целей зачастую труднодоступны. В связи с этим
кислот [7, 8], в этих реакциях с применением в
более привлекательным подходом в процессах
качестве катализаторов комплексов Cu, Pd и Rh
с хиральными лигандами (фосфорамидитными,
асимметрического внутримолекулярного сопря-
женного присоединения является каталитическая
NHC и бис-фосфиновыми) позволило достичь вы-
сокой энантиоселективности в данных процессах.
активация галогенпроизводных, трифлатов и др.
Особенно привлекательным является внутримоле-
подобных соединений комплексами металлов, ког-
кулярный вариант данной реакции, поскольку по-
да металлорганический интермедиат генерируется
зволяет осуществить синтез нерацемических би- и
в ходе окислительного присоединения реагента к
полициклических структур за одну стадию [9-11].
металлокомплексу, после чего следует сопряжен-
Однако использование металлорганических ре-
ное присоединение, происходящее при стереокон-
агентов или бороновых кислот в качестве прону-
троле со стороны хирального лиганда, и регенера-
клеофилов сопряжено с известными трудностями,
ция катализатора (схема 1) [12].
532
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ орто-ЗАМЕЩЕННЫХ ХАЛКОНОВ
533
Схема 1
O
«H-»
O
M
O
X
M
окислительное
R
внедрение
M
присоединение
X R
X
R
O
H
O
M
M
гидридный
восстановительное
перенос
элиминирование
R
R
Реализация такой синтетической методоло-
жения высокой энантиоселективности являлось
гии привлекательна еще и тем, что в этом случае
использование этиленгликоля в качестве раство-
не требуется использование стехиометрических
рителя, что было показано авторами в ряде кон-
количеств металлорганического реагента. Еще в
трольных экспериментов [16]. Успешная реали-
1980-х гг. Cacchi и сотр. показали, что арилгалоге-
зация методологии асимметрического внутримо-
ниды в присутствии комплексов Pd вступают в ре-
лекулярного сопряженного присоединения к ено-
акцию с енонами и еналями с образованием сопря-
нам с использованием в качестве катализаторов
женных аддуктов [13]. В 2005 г. впервые был ре-
комплексов Pd побудила к поиску эффективных
ализован внутримолекулярный вариант такой ре-
катализаторов в ряду комплексов неблагородных
акции, когда в качестве исходных реагентов были
металлов. Применение предкатализатора - ком-
использованы орто-бромзамещенные халконы
плекса Ni(II) в сочетании с хиральным лигандом
[14]. Долгое время осуществление асимметриче-
семикорринового типа позволило провести цикли-
ских процессов внутримолекулярного сопряжен-
зацию орто-бромзамещенных халконов с высокой
ного присоединения с участием арилгалогенидов
энантиоселективностью [17]. Однако использова-
представлялось проблематичным. Однако в 2007 г.
ние труднодоступных лигандов для обеспечения
группе Buchwald удалось осуществить внутримо-
высокой энантиоселективности в известных Pd- и
лекулярную циклизацию орто-замещенных хал-
Ni-катализируемых процессах существенно огра-
конов в 3-замещенные инданоны с высокой энан-
ничивает их практическое использование. В насто-
тиоселективностью. В качестве уходящих групп
ящей работе мы сообщаем о внутримолекулярной
авторы использовали трифлатную и нонафлатную
циклизации орто-замещенных халконов в присут-
[15]. Как предполагают авторы, последнее обстоя-
ствии комплексов Pd с различными коммерчески
тельство способствует реализации катионного ме-
доступными бис-фосфиновыми лигандами.
ханизма реакции, что, в свою очередь, определяет
высокую энантиоселективность реакции. Позднее
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
J.S. Zhou и сотр. [16] предложили оригинальный
С целью исследования влияния природы уходя-
протокол циклизации орто-бромзамещенных хал-
щий группы на ход реакции и энантиомерный из-
конов, обеспечивающий высокие энантиомерные
быток продукта в качестве исходных соединений
избытки образующихся 3-замещенных инданонов.
использовали орто-замещенные халконы 1a-d.
Соль аммония, генерируемая in situ из основания
Хенига и бензойной кислоты, как предполагают
Соединения 1а-с были синтезированы по опи-
авторы, способствует диссоциации бромидного
санным в литературе методикам [15, 18]. Карбонат
лиганда из комплекса, продукта окислительного
1d получали путем взаимодействия о-гидрокси-
присоединения, и дальнейшей реализации катион-
халкона 2 с метилхлорформиатом 3 в присутствии
ного пути реакции. Принципиальным для дости-
триэтиламина в качестве основания (схема 2).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
534
АШАТКИНА и др.
позволила получить продукт 4 с энантиомерным
O
избытком (R)-изомера 31% (строка 3). Однако,
Ph
наряду с ожидаемым продуктом сопряженного
присоединения, в этом случае также наблюдалось
X
образование 2-метил-3-фенил-1Н-инден-1-она 5,
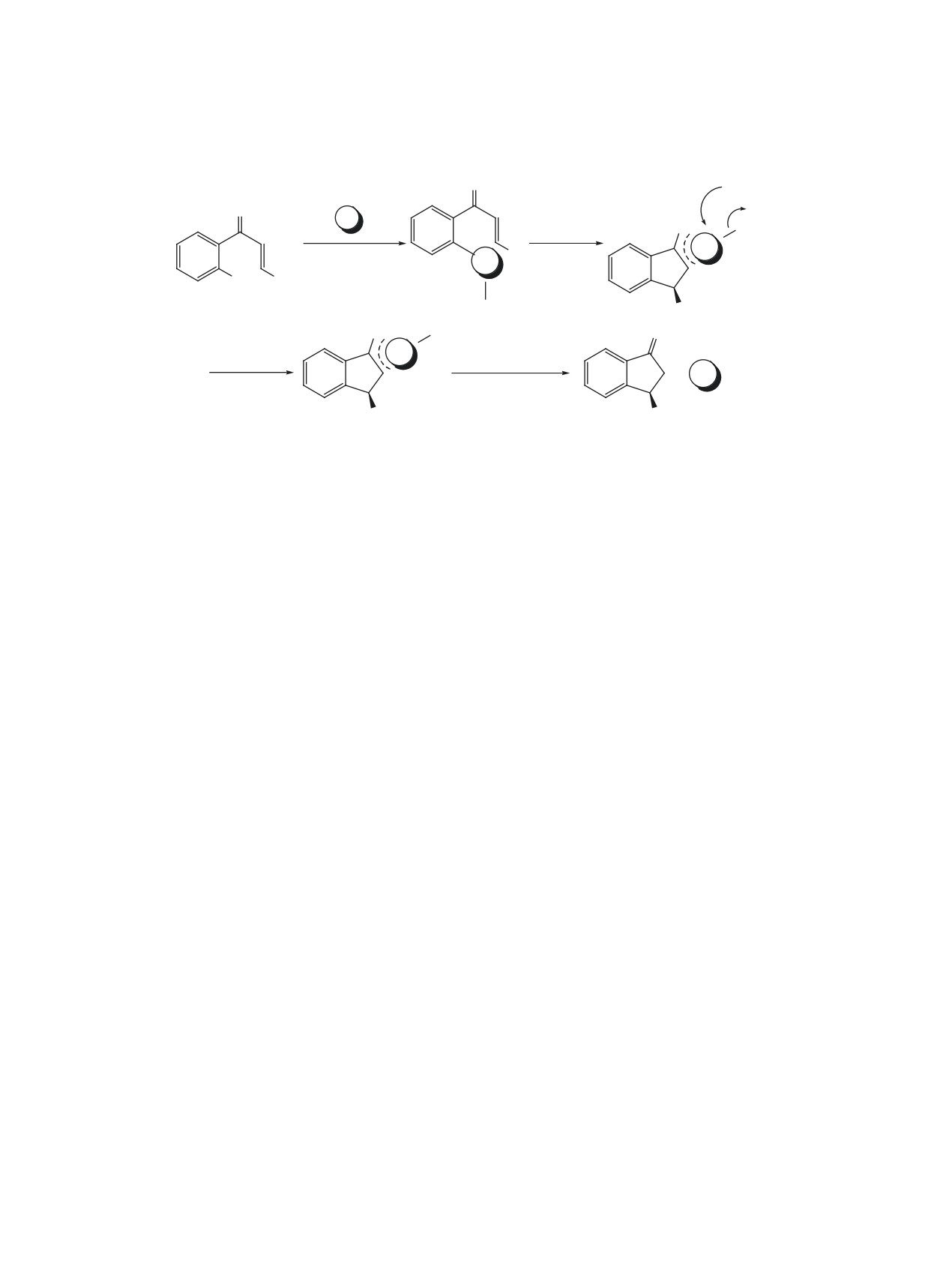
1a-d
который был выделен из реакционной смеси ко-
X = Br (a), OTf (b), OMs (c), OC(O)OMe (d).
лоночной хроматографией. Образование продукта
5 может объясняться взаимодействием продукта
Асимметрическое внутримолекулярное сопря-
сопряженного присоединения, енолята палладия
женное присоединение было исследовано в при-
D, с солью иминия E, генерируемой из третичного
сутствии комплекса [PdCl2(S)-BINAP], а также
амина; последующим элиминированием метилци-
комплексов Pd(0), генерируемых in situ из различ-
клогексиламина и изомеризацией 2-метилен-3-фе-
ных предкатализаторов и хиральных бисфосфи-
нилиндан-1-она F в более термодинамически ста-
нов L1-L7 (схема 3). Результаты проведенных ис-
бильный продукт 5 (схема 4) [15].
следований представлены в таблице.
Использование карбоната серебра для связыва-
Для надежного отнесения пиков энантиомеров
ния бромид-анионов привело к увеличению энан-
при ВЭЖХ был синтезирован рацемический 3-фе-
тиомерного избытка (R)-изомера 4 до 45% (стро-
нилинданон путем циклизации халкона 1а при
ка 4). Мы исследовали влияние различных спосо-
катализе комплексом [PdCl2(Ph3P)2] (см. таблицу,
бов генерации Pd(0) на выход продукта и энантио-
строка 1, метод a). При использовании в качестве
селективность реакции. Известно, что диизобути-
катализатора
[PdCl2(S)-BINAP] образовывался
лалюминийгидрид (DIBAL-H) является эффектив-
рацемический продукт с умеренным выходом
ным восстановителем фосфиновых комплексов
(строка 2). Этот результат побудил нас к поиску
Pd(II) до Pd(0) [23]. Каталитически активный ком-
условий, способствующих катионному пути про-
плекс был получен нами путем добавления 2 экв
текания реакции. Ранее было показано, что ис-
DIBAL-H к раствору [PdCl2(S)-BINAP] в ТГФ при
пользование третичных солей аммония в сочета-
-20°С. После выдержки к полученному раствору
нии с ионными жидкостями и/или протонных по-
добавляли остальные компоненты. Добавление
лярных растворителей способствует диссоциации
DIBAL-H в качестве восстановителя приводит к
галогенидного лиганда и реализации катионного
повышению выхода продукта 4 до 45% и сниже-
пути с существенным увеличением скорости ре-
нию энантиоселективности реакции (7% ее, стро-
акции [19-22]. В связи с этим мы провели реак-
ка 5). С другой стороны, использование комплекса
цию в присутствии соли аммония, генерируемой
Pd(dba)2 в качестве предкатализатора в сочетании
in situ из диметилциклогексиламина и бензойной
с (S)-BINAP позволило получить продукт 4 с выхо-
кислоты (метод b). Избыток амина необходим
дом 50% и энантиомерным избытком (R)-изомера
для образования комплексного гидрида палладия
49% (строка 7). Найденные условия обеспечивали
на стадии, предшествующей восстановительно-
наиболее высокую энантиоселективность, поэто-
му элиминированию продукта реакции. Реакцию
му дальнейший скрининг лигандов проводился в
проводили в смеси растворителей этиленгли-
соответствии с методом В при использовании в ка-
коль-ТГФ. Такая модификация условий реакции
честве предкатализатора Pd(dba)2.
Схема 2
O
O
O
Et3N
+
CH2Cl2, rt, 48 ч
MeO Cl
O
OH
O OMe
2
3
1d
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ орто-ЗАМЕЩЕННЫХ ХАЛКОНОВ
535
Схема 3
Ph
Ph
O
O Ph
+
Me
+
X
O
O
O
1a-d
4
5
6
OMe
X = Br, OTf, OMs, O
O
H3C
H
P
MeO
PPh2
CH3
P
P
P
CH3
P
PPh
2
H
OMe
P
t-Bu t-Bu
H3C
L1
L2
L3
L4
(S)-BINAP
(S,S',R,R')-TangPhos
(R,R)-Me-DUPHOS
(S,S)-DIPAMP
O
PPh2
P
P
P
P
Fe
O
PPh2
Me
L5
L6
L7
(R,Sp)-Josiphos
(R)-C3-Tunephos
(R)-BINAPHANE
В качестве лигандов был изучен ряд хиральных
системы Pd(dba)2/Josiphos (строка 13). Однако в
дифосфинов, хорошо зарекомендовавших себя во
этом случае, как и с (S,S)-DIPAMP, образуется ра-
многих каталитических процессах, с широким ди-
цемический продукт.
апазоном σ-донорных и π-акцепторных свойств и
Наиболее высокий энантиомерный избыток
углами прикуса от 77° до 93° [24-27].
продукта (S)-4 был достигнут с использованием
При использовании каталитических систем с
(R)-C3-Tunephos в сочетании с Pd(dba)2 в качестве
фосфолановыми лигандами (S,S',R,R')-TangPhos и
предкатализатора (строка 14). Однако выход (S)-
(R,R)-Me-DuPhos наблюдалось, главным образом,
4 в этих условиях был весьма низким вследствие
образование халкона 7 и 1,2-дифенилэтан-1-она 8
малой скорости реакции и конкурирующего обра-
(строки 9 и 10). Наблюдаемое направление реак-
зования продукта сопряженного присоединения/
ции, вероятно, связано с более высокой скоростью
реакции Манниха 5.
обмена брома на водород в продукте окислитель-
ного присоединения В по сравнению со скоростью
Сравнение 1а и b показывает, что использова-
внедрения и последующим быстрым восстанови-
ние трифлата 1b в целом приводит к несколько бо-
тельным элиминированием халкона 7 из интерме-
лее высоким выходам продукта 4 и энантиоселек-
диата G (схема 4). Сопряженное присоединение
тивности. Так, например, при проведении реакции
комплексного гидрида палладия к образовавшему-
в присутствии каталитической системы Pd(dba)2/
ся халкону 7 приводит к 1,2-дифенилэтан-1-ону 8.
(S)-BINAP в среде 1,4-диоксана продукт 4 был
Наилучший выход при высокой хемоселектив-
получен с энантиомерным избытком (R)-изомера
ности достигается в присутствии каталитической
53% (строка 15). В отличие от бромида 1а, реак-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
536
АШАТКИНА и др.
Результаты внутримолекулярного арилирования о-замещенных халконов в присутствии различных каталитических
систем
Содержание по
Выход, %
ГЖХ, %
№
Метод
X
Катализатор
Конверсия, %
еe 4, %
4
5
6
4
5
6
1
a
Br
[PdCl2(Ph3P)2]
100
86
-
-
68
-
-
0
2
a
Br
[PdCl2(S)-BINAP]
100
82
-
-
62
-
-
0
31
3
b
Br
[PdCl2(S)-BINAP]
58
35
22
-
30
18
-
(R)
45
4a
b
Br
[PdCl2(S)-BINAP]
100
35
35
-
20
21
-
(R)
7
5b
b
Br
[PdCl2(S)-BINAP]
100
71
-
-
55
-
-
(R)
Pd2(dba)3
6
6c
b
Br
93
34
30
-
25
15
-
L1
(R)
Pd(dba)2
49
7
b
Br
100
75
27
-
50
22
-
L1
(R)
Pd(dba)2
14
8a
b
Br
100
26
52
-
20
45
-
L1
(R)
Pd(dba)2
9d
b
Br
100
-
12
-
-
-
-
-
L2
Pd(dba)2
10e
b
Br
100
-
20
-
-
-
-
-
L3
Pd(dba)2
11
b
Br
62
50
8
-
35
-
-
0
L4
PdCl2(COD)
12
b
Br
43
34
4
-
27
-
-
0
L4
Pd(dba)2
13
b
Br
100
77
7
-
63
-
-
0
L5
Pd(dba)2
14
b
Br
35
20
12
-
12
-
-
76 (S)
L6
Pd(dba)2
15
c
OTf
100
73
-
27
55
-
21
53 (R)
L1
Pd(dba)2
16f
c
OTf
100
25
-
37
24
-
33
48 (R)
L1
Pd(dba)2
74
17
c
OTf
39
26
-
13
23
-
7
L2
(S)
Pd(dba)2
18
c
OTf
0
-
-
-
-
-
-
-
L3
Pd(dba)2
19
c
OTf
26
8
10
-
-
-
-
н/o
L7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ орто-ЗАМЕЩЕННЫХ ХАЛКОНОВ
537
Таблица. (продолжение).
Содержание по
Выход, %
ГЖХ, %
№
Метод
X
Катализатор
Конверсия, %
еe 4, %
4
5
6
4
5
6
Pd(dba)2
20
c
OTf
54
14
-
21
-
-
-
н/o
L4
Pd(dba)2
21
c
OTf
38
-
-
20
-
-
20
-
L5
Pd(dba)2
22
c
OTf
35
19
-
15
12
-
-
83 (S)
L6
Pd(dba)2
23
c
OMs
55
-
-
22
-
-
-
-
L1
Pd(dba)2
24
c
OCOOMe
100
-
-
85
-
-
-
-
L1
a Метод а: Катализатор 5 мол %, диизопропилэтиламин (2 экв), ДМФА, 150°С; метод b: Катализатор 5 мол %/предкатализатор
5 мол %, лиганд 6 мол %, диметилциклогексиламин (4.5 экв), бензойная кислота (1 экв), этиленгликоль-ТГФ 1:1; Аg2CO3
(1.2 экв)
b DIBAL-H (10 мол %)
c Растворитель ПЭГ-400
d наряду с соединением 5 образуются халкон (73%) и 1,2-дифенилэтан-1-он (15%)
e наряду с соединением 5 образуется 1,2-дифенилэтан-1-он (55%); метод c: Предкатализатор 5 мол %, лиганд 10 мол %, диметил-
циклогексиламин (2 экв), диоксан, 100°С
f ДМФА вместо диоксана
ция трифлата 1b при катализе Pd(dba)2/(S,S',R,R')-
вели контрольный эксперимент по методу c в усло-
TangPhos приводит к образованию 4 с выходом
виях, аналогичных реакционным, но в отсутствии
23% и энантиомерным избытком (S)-изомера 74%
катализатора. Этот эксперимент показал, что хро-
(строка 17).
манон 6 образуется в этом случае с выходом, близ-
ким к полученному в присутствии катализатора.
Наиболее высокая энантиоселективность ре-
акции была достигнута со структурно близким
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
BINAP лигандом (R)-C3-Tunephos
(83%, стро-
Спектры ЯМР 1H и 13С зарегистрированы на
ка 22). Отличительной особенностью циклизации
спектрометре JEOL NMR-ECX 400 (400 и 100 МГц
с участием трифлата 1b является образование,
соответственно). Температуры плавления опреде-
наряду с инданоном 4, 2-фенилхроман-4-она 6.
лены на приборе OptiMelt MPA100. Элементный
Образование этого продукта становится домини-
анализ выполнен на автоматическом CHNS-
рующим при реакции циклизации мезилата 1с и,
анализаторе EuroVector EA-3000. Энантиомерный
особенно, карбоната 1d (см. таблицу, строки 23 и
состав определен методом ВЭЖХ на Shimadzu
24).
Prominence LC-20AD с использованием колон-
Хроманон 6 является продуктом внутримолеку-
ки Chiralpak AD-3 (гексан-изопропанол
97:3;
лярной нуклеофильной атаки фенолят-аниона по
1.2 мл/мин). Масс-спектры получены на прибо-
углероду кратной связи енонового фрагмента. Мы
ре Finnigan Trace DSQ с энергией ионизирующих
предполагаем, что генерирование фенолят-аниона
электронов 70 эВ.
J из мезилата 1с и карбоната 1d может быть свя-
Соединения 1а-с были синтезированы по опи-
зано с нуклеофильной атакой третичным амином
санным в литературе методикам [15, 18].
по атомам серы мезилата или углероду карбониль-
ной группы карбоната [28-31] в соответствии со
2-Циннамоилфенилметилкарбонат
(1d). К
схемой 5. Чтобы проверить эту гипотезу, мы про-
раствору 2-гидроксихалкона 2 (1.5 г, 6.70 ммоль)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
538
АШАТКИНА и др.
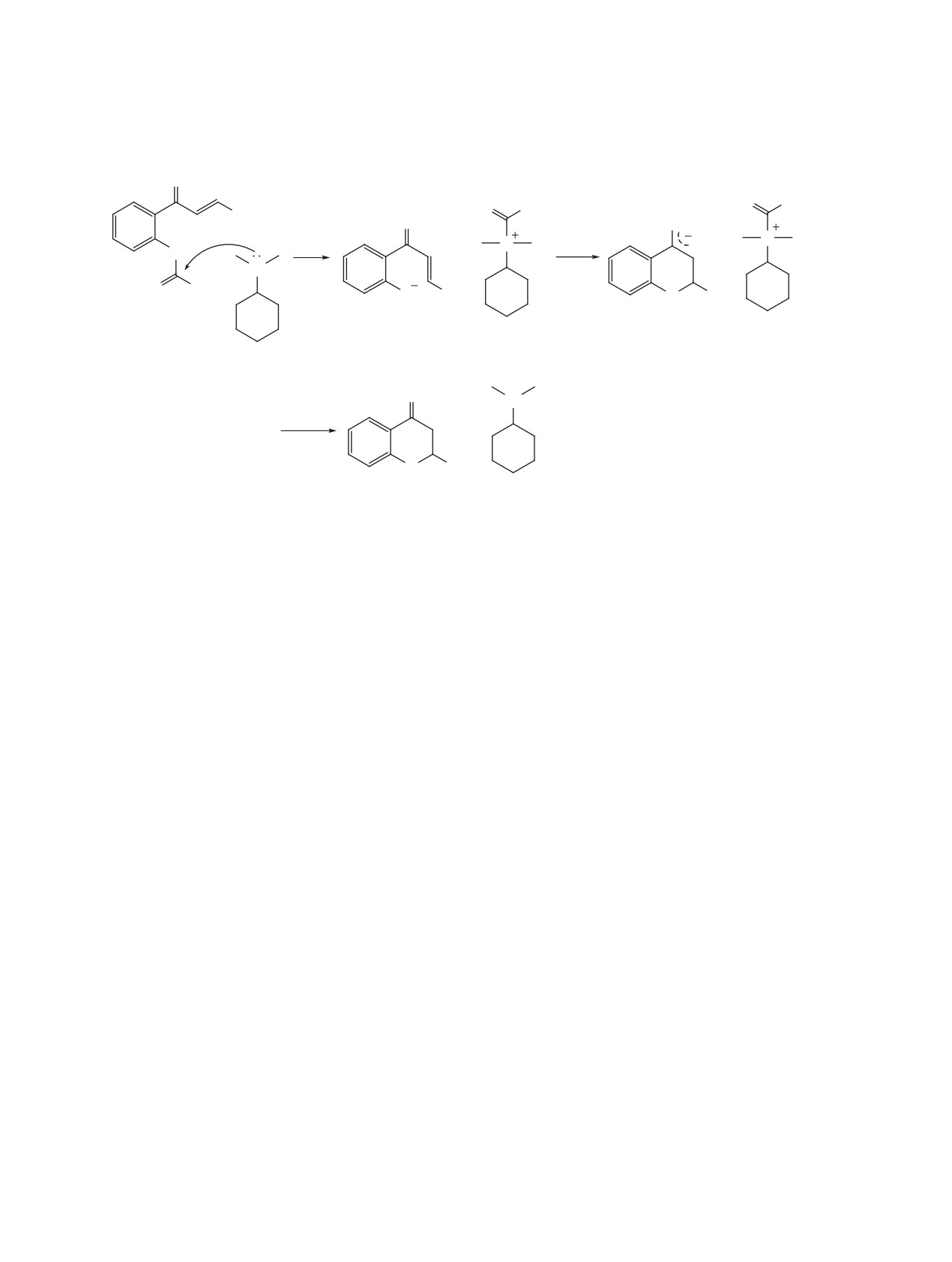
Схема 4. Предполагаемый механизм Pd-катализируемого внутримолекулярного арилирования орто-замещенных
халконов и образования побочных продуктов 5, 7 и 8
O
O
O
Ph
5
Ph
4
Br
P
1a
O
Pd0
P
A
P
O
O
Pd
Ph
P
F
H
Br
Pd
Ph
P
P
D
Me
Me
N
P
B
O
R
Pd
P
Me
Br
Me
N
Br-
N Br-
R
Me Me
O
R
E
N
Ph
E
C
R
H
Pd
P
P
G
P
Pd0
P
H
A
O
O
O
Pd
L
2PdH2
-Pd0
H
8
H
7
и триэтиламина (1.01 г, 10.04 ммоль) в 21 мл хло-
92°С (CH2Cl2). Спектр ЯМР
1Н (CDCl3), δ, м.д.:
ристого метилена медленно добавляли метилхлор-
3.80 с (3Н, СН3), 7.18-7.24 м (2Н, СН и СНаром),
формиат 3 (0.76 г, 8.04 ммоль). Полученную смесь
7.38-7.39 м (4Наром), 7.56-7.58 м (4Наром), 7.72-7.75
перемешивали при комнатной температуре в те-
м (1Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 55.7
чение 48 ч. Затем реакционную смесь промывали
(СН3), 123.2 (СН), 125.2 (СНаром), 126.5 (СНаром),
водой и экстрагировали хлористым метиленом
128.6 (СНаром), 129.1 (СНаром), 130.1 (СНаром),
(3×5 мл). Органические вытяжки сушили над
130.8 (СНаром), 132.0 (Саром), 132.8 (СНаром), 134.6
Na2SO4 и упаривали при пониженном давлении.
(Саром), 145.6 (СН), 149.3 (Саром), 153.9 (С=О),
Выход 1.6 г (84%), желтые кристаллы, т.пл. 90-
191.1 (С=О). Масс-спектр, m/z (Iотн, %): 282 (26),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ орто-ЗАМЕЩЕННЫХ ХАЛКОНОВ
539
Схема 5. Предполагаемый механизм образования продукта 6
O
O OMe
O OMe
Ph
O
O
N
N
O
N
O OMe
O Ph
O Ph
1d
J
K
O
N
H2O
+
+ CO2 + MeOH
O Ph
6
237 (33), 223 (37), 206 (100), 167 (22), 161 (79), 131
Органический слой сушили над Na2SO4. Рас-
(43), 103 (70), 92 (33), 77 (89), 59 (22). Найдено, %:
творитель упаривали в вакууме. Продукт очища-
C 72.37; H 5.04. C17H14O4. Вычислено, %: C 72.33;
ли методом колоночной хроматографии (элюент
H 5.00.
ССl4).
Методики внутримолекулярного арилиро-
c. В ампулу, заполненную аргоном, добавляли
вания о-замещенных халконов. a. К раствору
5 мол % предкатализатора (0.028 ммоль), 6 мол %
о-бромхалкона 1a (0.4 г, 1.39 ммоль) и диизопро-
лиганда (0.034 ммоль) и 2 мл диоксана. Смесь пере-
пилэтиламина (0.36 г, 2.78 ммоль) в 3 мл ДМФА
мешивали в течение 30 мин, затем добавляли N,N-
добавляли 5 мол % катализатора (0.070 ммоль).
диметилциклогексиламин (1.12 ммоль) и о-заме-
Смесь нагревали при 160°С в течение 16 ч в запа-
щенный халкон 1b-d (0.56 ммоль). Реакционную
янной ампуле в атмосфере аргона при перемеши-
смесь нагревали до температуры 100°С и переме-
вании. Затем растворитель упаривали при пони-
шивали 48 ч в запаянной ампуле. Затем раствор
женном давлении. Полученный остаток растворя-
подкисляли 2М раствором HCl, промывали водой
ли в EtOAc, подкисляли 2М HCl, промывали водой
и экстрагировали EtOAc (3×5 мл). Органический
и экстрагировали EtOAc (3×5 мл). Органические
слой сушили над Na2SO4. Растворитель упаривали
вытяжки сушили над Na2SO4, упаривали. Продукт
в вакууме. Продукт очищали методом колоночной
очищали методом колоночной хроматографии
хроматографии (элюент ССl4).
(элюент ССl4).
3-Фенилиндан-1-он (4). Бесцветные кристал-
b. В ампулу, заполненную аргоном, добавляли
лы, т.пл. 75-76°С (CCl4). Спектр ЯМР 1Н (CDCl3),
5 мол % катализатора (0.035 ммоль) или 5 мол %
δ, м.д.: 2.68 д.д (1Н, СН2, J 19.2, 3.8 Гц), 3.23 д.д
предкатализатора (0.035 ммоль) и 6 мол % лиган-
(1Н, СН2, J 19.2, 8.0 Гц), 4.56 д.д (1Н, СН, J 8.0,
да (0.042 ммоль) и 1 мл ТГФ. Смесь перемеши-
3.8 Гц), 7.12 д (2Наром, J 8.0 Гц), 7.22-7.32 м
вали в течение 30 мин, затем добавляли раствор
(4Наром), 7.41 т (1Наром, J 7.6 Гц), 7.55 т (1Наром, J
бензойной кислоты (0.09 г, 0.70 ммоль) и N,N-
7.6 Гц), 7.80 д (1Наром, J 7.6 Гц). Спектр ЯМР 13С
диметилциклогексиламина (0.4 г, 3.15 ммоль) в
(CDCl3), δ, м.д.: 44.5 (СН), 46.9 (СН2), 123.5 (СН),
1 мл этиленгликоля и о-бромхалкон 1a (0.2 г,
126.9 (СНаром), 127.1 (СНаром), 127.7 (СНаром), 127.9
0.70 ммоль). Реакционную смесь нагревали до
(СНаром), 129.0 (СНаром), 135.2 (СНаром),
136.8
температуры 100°С и перемешивали 48 ч в запа-
(Саром), 143.8 (Саром), 158.0 (Саром), 206.1 (С=О).
янной ампуле. Затем подкисляли 2М HCl, про-
Анализ ВЭЖХ: tr 8.5 мин (R), 9.1 мин (S). Масс-
мывали водой и экстрагировали EtOAc (3×5 мл).
спектр, m/z (Iотн, %): 208 (100), 193 (22), 178 (45),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
540
АШАТКИНА и др.
165 (39), 152 (12), 130 (10), 102 (8), 89 (9), 77 (9).
и N,N-диметилциклогексиламина (1.41 ммоль) в
Найдено, %: C 86.58; H 5.86. C15H12O. Вычислено,
2 мл диоксана нагревали до 100°С и перемешива-
%: C 86.51; H 5.81.
ли 48 ч в атмосфере аргона. Затем реакционную
смесь подкисляли 2М HCl, промывали водой и
2-Метил-3-фенил-1Н-инден-1-он (5). Желтые
экстрагировали EtOAc (3×5 мл). Органический
кристаллы, т.пл. 80-82°С (CCl4). Спектр ЯМР 1Н
слой сушили над Na2SO4. Растворитель упарива-
(CDCl3), δ, м.д.: 1.92 с (3Н, СН3), 7.05 д (1Наром,
ли в вакууме. В случае соединения 1с образуется
J 7.2 Гц), 7.18 т (1Наром, J 7.2 Гц), 7.28 т (1Н, J
2-фенилхроман-4-он (6) с выходом 30%, а в случае
7.2 Гц), 7.43-7.53 м (6Наром). Спектр ЯМР 13С
соединения 1d выход 2-фенилхроман-4-она соста-
(CDCl3), δ, м.д.: 8.7 (СН3), 120.5 (СНаром), 122.6
вил 73%.
(СНаром), 128.1 (СНаром), 128.2 (СНаром),
128.8
ЗАКЛЮЧЕНИЕ
(СНаром),
129.3 (СНаром),
131.1 (Саром),
131.2
(Саром), 132.8 (Саром), 133.2 (СНаром), 145.8 (Саром),
Асимметрическое внутримолекулярное арили-
154.8 (Саром), 198.4 (С=О). Масс-спектр, m/z (Iотн,
рование орто-замещенных халконов при катализе
%): 220 (100), 207 (25), 191 (58), 165 (46), 115 (6).
комплексами Pd(0) с бис-фосфиновыми лиганда-
Найдено, %: C 87.32; H 5.53. C16H12O. Вычислено,
ми, генерируемыми in situ из различных предката-
%: C 87.25; H 5.49.
лизаторов, приводит к образованию 3-фенилинда-
нона. Выходы и энантиомерные избытки продукта
2-Фенилхроман-4-он (6). Светло желтые кри-
в значительной степени зависят от используемо-
сталлы, т.пл. 74-76°С (CCl4). Спектр ЯМР 1Н
го лиганда и варьируются в широких пределах.
(CDCl3), δ, м.д.: 2.90 д.д (1Н, СН2, J 16.8, 2.8 Гц),
Наибольшая энантиоселективность (83%) достиг-
3.10 д.д (1Н, СН2, J 16.8, 13.2 Гц), 5.40 д.д (1Н,
нута при использовании (R)-C3-Tunephos. В ряде
СН, J 13.2, 2.8 Гц), 7.04-7.06 м (2Наром), 7.38-7.54
случаев сопряженное присоединение арилпалла-
м (7Наром), 7.93 д.д. (1Наром, J 8.0, 1.6 Гц). Спектр
диевого интермедиата сопровождается дальней-
ЯМР 13С (CDCl3), δ, м.д.: 44.8 (СН2), 79.7 (СН),
шим взаимодействием с иминиевой солью, гене-
118.2 (СНаром),
121.0 (Саром),
121.7 (СНаром),
рируемой из третичного амина. Это приводит к об-
126.3 (СНаром), 127.2 (СНаром), 128.8 (СНаром),
разованию 2-метил-3-фенил-1H-инден-1-она в ка-
128.9 (СНаром), 136.3 (СНаром), 138.8 (Саром), 161.7
честве побочного продукта реакции. Наибольшая
(Саром), 192.1 (С=О). Масс-спектр, m/z (Iотн, %):
хемоселективность в отношении образования
224 (30.1), 207 (100), 179 (19), 131 (22), 147 (20),
3-фенилинданона достигнута при использовании
131 (26), 120 (25), 103 (31), 77 (27). Найдено, %: C
лиганда Josiphos. Циклизация орто-мезилокси- и
80.39; H 5.44. C17H18O2. Вычислено, %: C 80.34;
орто-метоксикарбонилоксизамещенных халконов
H 5.39.
приводит к образованию 2-фенилхроман-4-она.
1,3-Дифенилпропан-1-он
(8).
Бесцветные
ФОНДОВАЯ ПОДДЕРЖКА
кристаллы, т.пл. 69-70°С (CCl4). Спектр ЯМР 1Н
Работа выполнена при финансовой поддержке
(CDCl3), δ, м.д.: 3.07 т (2Н, CH2, J 7.2 Гц), 3.30 т
Российского научного фонда (проект № 21-73-
(2Н, CH2, J 7.2 Гц), 7.20-7.32 м (5Наром), 7.44 т
20096). Спектральные исследования выполнены
(2Наром, J 8.0 Гц), 7.55 т (2Наром, J 7.2 Гц), 7.95 д
при финансовой поддержке Минобрнауки РФ в
(2Н, J 7.6 Гц). Спектр ЯМР 13С (CDCl3), δ, м.д.:
рамках базовой части государственного задания
30.2 (СН2),
40.5 (СН2),
126.2 (СНаром),
128.1
№ 0778-2020-0005.
(СНаром), 128.5 (СНаром), 128.6 (СНаром),
128.7
ИНФОРМАЦИЯ ОБ АВТОРАХ
(СНаром),
133.1 (СНаром),
136.9 (Саром),
141.4
(Саром), 199.3 (С=О). Масс-спектр, m/z (Iотн, %):
Ашаткина Мария Александровна, ORCID:
210 (82), 105 (100), 77 (36). Найдено, %: C 85.77;
H 6.76. C15H14O2. Вычислено, %: C 85.68; H 6.71.
Резников Александр Николаевич, ORCID:
Циклизация о-замещенных халконов 1с, d в
присутствии N,N-диметилциклогексиламина.
Климочкин Юрий Николаевич, ORCID: https://
Раствор о-замещенного халкона 1с, d (7.09 ммоль)
orcid.org/0000-0002-7335-4040
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ орто-ЗАМЕЩЕННЫХ ХАЛКОНОВ
541
КОНФЛИКТ ИНТЕРЕСОВ
14.
Pueschl A., Rudbeck H.C., Faldt A., Confante A.,
Kehler J. Synthesis. 2005, 2005, 291-295. doi 10.1055/
Авторы заявляют об отсутствии конфликта ин-
s-2004-834929
тересов.
15.
Minatti A., Zheng X., Buchwald S.L. J. Org. Chem.
СПИСОК ЛИТЕРАТУРЫ
2007, 72, 9253-9258. doi 10.1021/jo701741y
16.
Yue G., Lei K., Hirao H., Zhou J.S. Angew. Chem. Int.
1.
Wang Z. Organic Chemistry Frontiers. 2020, 7, 3815-
Ed. 2015, 127, 6531-6535. doi 10.1002/anie.201501712
3841. doi 10.1039/d0qo00763c
17.
Qin X., Yao Lee M. W., Zhou J.S. Org. Lett. 2019, 21,
2.
Vargova D., Nemethova I., Sebesta R. Org. Biomol.
5990-5994. doi 10.1021/acs.orglett.9b02130
Chem. 2020, 18, 3780-3796. doi 10.1039/D0OB00278J
18.
Babu M., Pitchumani K., Ramesh P. Helv. Chim. Acta.
3.
Hayashi M., Matsubara R. Tetrahedron Lett. 2017, 58,
2013, 96, 1269-1272. doi 10.1002/hlca.201200336
1793-1805. doi 10.1055/s-2007-966005
19.
Wu C., Zhou J. J. Am. Chem. Soc. 2014, 136, 650-652.
4.
Christoffers J., Koripelly G., Rosiak A., Rössle M.
doi 10.1021/ja412277z
Synthesis. 2007, 2007, 1279-1300. doi 10.1055/s-
2007-966005
20.
Mo J., Xiao J. Angew. Chem. Int. Ed. 2006, 45, 4152-
4157. doi 10.1002/anie.200600799
5.
Schmid T.E., Drissi-Amraoui S., Crevisy C., Basle O.,
Mauduit M. Beilstein J. Org. Chem. 2015, 11, 2418-
21.
Hyder Z., Ruan J., Xiao J. Chem. Eur. J. 2008, 14,
5555-5566. doi 10.1002/chem.200800411
2434. doi 10.3762/bjoc.11.263
22.
Ruan J., Iggo J.A., Berry N.G., Xiao J. J. Am. Chem.
6.
Harutyunyan S.R., den Hartog T., Geurts K., Min-
Soc. 2010, 132, 16689-16699. doi 10.1021/ja1081926
naard A.J., Feringa B.L. Chem. Rev. 2008, 108, 2824-
2852. doi 10.1021/cr068424k
23.
Negishi E.I., Takahashi T., Akiyoshi K. J. Chem. Soc.,
Chem. Commun.
1986,
1338-1339. doi
10.1039/
7.
Yoshida K., Hayashi T. Boronic Acids: Preparation
C39860001338
and Applications in Organic Synthesis and Medicine.
Ed. D.G. Hall. Weinheim: Wiley-VCH Verlag GmbH
24.
Privileged Chiral Ligands and Catalysts. Ed.
& Co. KGaA, 2005, 4, 171-241.
Q.-L. Zhou. New York: John Wiley & Sons, 2011,
1-484.
8.
Bartáček J., Svoboda J., Kocúrik M., Pochobradský J.,
Čegan A., Sedlák M., Váňa J. Beilstein J. Org. Chem.
25.
Dierkes P., van Leeuwen P.W. J. Chem. Soc. 1999,
2021, 17, 1048-1085.
1519-1529. doi 10.1039/A807799A
9.
Bronk B.S., Lippard S.J., Danheiser R.L.
26.
Li W. A Dissertation in Chemistry PhD. The
Organometallics. 1993, 12, 3340-3349. doi 10.1021/
Pennsylvania State University. 2012.
om00032a065
27.
van Leeuwen P.W., Kamer P.C., Reek J.N., Dierkes P.
10.
Navarro K., Csákÿ A.G. Org. Lett. 2008, 10, 217-219.
Chem. Rev. 2000, 100, 2741-2769. doi 10.1021/
doi 10.1021/ol702571c
cr9902704
11.
He Z.T., Tian B., Fukui Y., Tong X., Tian P., Lin G.Q.
28.
Carafa M., Mesto E., Quaranta E. Eur. J. Org. Chem.
Angew. Chem. Int. Ed. 2013, 52, 5314-5318. doi
2011, 2011, 2458-2465. doi 10.1002/ejoc.201001725
10.1002/anie.201300137
29.
Castro E.A., Freudenberg M. J. Org. Chem. 1980, 45,
12.
Reznikov A.N., Ashatkina M.A., Klimochkin Y.N. Org.
906-910. doi 10.1021/jo01293a027
Biomol. Chem. 2021, 19, 5673-5701. doi 10.1039/
30.
Sach N.W., Richter D.T., Cripps S., Tran-Dubé M.,
D1OB00496D
Zhu H., Huang B., Cui J., Sutton S.C. Org. Lett. 2012,
13.
Amorese A., Arcadi A., Bernocchi E., Cacchi S., Cerri-
14, 3886-3889. doi 10.1021/ol301615z
ni S., Fedeli W., Ortar G. Tetrahedron. 1989, 45, 813-
31.
Flynn A.J., Ford A., Maguire A.R. Org. Biomol. Chem.
828. doi 10.1016/0040-4020(89)80112-7
2020, 18, 2549-2610. doi 10.1039/c9ob02587a
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022
542
АШАТКИНА и др.
The Intramolecular Cyclization of ortho-Substituted Chalcones
in the Presence of Palladium Complexes
with Chiral Bisphosphine Ligands
M. A. Ashatkina*, A. N. Reznikov, and Y. N. Klimochkin
Samara State Technical University, ul. Molodogvardeyskaya, 244, Samara, 443100 Russia
*e-mail: ashatkinamaria@gmail.com
Received November 18, 2021; revised December 15, 2021; accepted December 19, 2021
The influence of ligands and a leaving group on the direction and selectivity of ortho-substituted chalcones
intramolecular arylation is discussed. In the presence of Pd complexes with (R)-BINAP, (R)-C3-TunePhos,
(S,S',R,R')-TangPhos ligands 3-phenylindan-1-one was obtained with enantiomeric excess up to 83%. Along
with the product of reductive cyclization, the formation of 2-methyl-3-phenyl-1H-indene-1-one is observed.
ortho-Mesyloxy- and methoxycarbonyloxy-substituted chalcones cyclization leads to the formation of 2-phenyl-
chroman-4-one under similar conditions.
Keywords: asymmetric synthesis, ortho-substituted chalcones, chiral ligands, palladium complexes, catalysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 5 2022