ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 6, с. 555-584
ОБЗОРНАЯ СТАТЬЯ
УДК 547.1’176: 547.77
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ
АЗИНОВ С (η6-АРЕН)ХРОМТРИКАРБОНИЛЬНЫМИ
ЗАМЕСТИТЕЛЯМИ1
© 2022 г. Н. Ю. Гришина*, Е. В. Сазонова, А. Н. Артемов
ФГБОУ ВО «Нижегородский государственный университет им. Н.И Лобачевского»,
Россия, 603950 Нижний Новгород, просп. Гагарина, 23, к. 5
*e-mail: zarovkinan@mail.ru
Поступила в редакцию 10.12.2021 г.
После доработки 17.12.2021 г.
Принята к публикации 20.12.2021 г.
Представлены и впервые обобщены методы получения, свойства и пути применения пяти- и шестичлен-
ных гетероциклических веществ с 2 гетероатомами, один из которых азот, содержащих (η6-арен)хромтри-
карбонильные фрагменты. Большое внимание уделено высокоселективным процессам, нашедшим
применение в тонком органическом синтезе и биомедицинской химии, протекание которых обусловлено
наличием хромтрикарбонильного фрагмента в реагирующих молекулах. В дополнительных материалах
приведены таблицы, систематизирующие некоторые свойства исследуемых веществ.
Ключевые слова: (арен)хромтрикарбонил, гетероциклические соединения, триамминхромтрикарбо-
нил, гексакарбонил хрома, оксазолины, оксазолидины, изоксазолидины, имидазолидины, оксазинаны,
дигидробензоксазины
DOI: 10.31857/S0514749222060015, EDN: CWDHAD
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ПРОИЗВОДНЫЕ АЗОЛОВ С (η6-АРЕН)ХРОМТРИКАРБОНИЛЬНЫМИ ГРУППАМИ
1.1. N,O-СОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ
1.1.1. ОКСАЗОЛИНЫ
1.1.2. ОКСАЗОЛИДИНЫ
1.1.3. ИЗОКСАЗОЛИДИНЫ
1.1.4. ИЗОКСАЗОЛИНЫ
1 Сокращения: (арен)ХТ - (η6-арен)хромтрикарбонильный/(η6-арен)хромтрикарбонил; ГКХ - гексакарбонил хрома; 1,3-ДЦ -
1,3-диполярное циклоприсоединение; МАЛДИ - матрично-активированная лазерная десорбция-ионизация; НПВО - нару-
шенное полное внутреннее отражение; ПНК - пептидная нуклеиновая кислота; ТАХТ - триамминхромтрикарбонил; ХТ -
хромтрикарбонильный/хромтрикарбонил; ЭУ - электронный удар; APCI - химическая ионизация при атмосферном давлении;
Boc - трет-бутилоксикарбонил; DCC - 1,3-дициклогексилкарбодиимид; de - диастереомерный избыток; DMAP - 4-диметил-
аминопиридин; DME - диметоксиэтан; dr - соотношение диастереомеров; ee - энантиомерный избыток; ESI - электроспрей;
HPMA - гексаметилфосфортриамид; HRMS - масс-спектроскопия высокого разрешения; LDA - диизопропиламид лития;
PMDTA - пентаметилдиэтилентриамин; p-Tol - пара-толил; Tf - трифторметилсульфонил; TMEDA - тетраметилэтилендиамин;
TMS - триметилсилил; Tr - тритил, трифенилметил; Ts - тозил, п-толилсульфонил.
555
556
ГРИШИНА и др.
1.2. N,N-СОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ
1.2.1. ИМИДАЗОЛЫ
1.2.2. ИМИДАЗОЛИДИНЫ
1.2.3. ИМИДАЗОЛИДИНОНЫ, ИМИДАЗОЛИНОНЫ
1.2.4. ПРОИЗВОДНЫЕ ПИРАЗОЛА
2. ПРОИЗВОДНЫЕ ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ С (η6-АРЕН)ХРОМТРИКАРБОНИЛЬНЫМИ ГРУП-
ПАМИ
2.1. N,O-СОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ
2.1.1. ОКСАЗИНАНЫ И ДИГИДРОБЕНЗОКСАЗИНЫ
2.1.2. МОРФОЛИНЫ
2.1.3. ФЕНОКСАЗИНЫ
2.2. N,N-СОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
тическую ценность для биологии, фармакологии,
оптики, электроники и материаловедения [8-10],
Широкое применение (η6-арен)хромтрикарбо-
в связи с чем синтез (арен)ХТ комплексов гетеро-
нильных [(арен)ХТ] комплексов в области органи-
циклов является весьма привлекательным направ-
ческой и металлоорганической химии для решения
лением. Однако получение ХТ π-комплексов с ге-
различных каталитических и синтетических задач
тероциклическим фрагментом в составе не всегда
обусловлено, прежде всего, способностью объем-
оказывается тривиальной задачей из-за возможно-
ной электроноакцепторной хромтрикарбонильной
сти координации неподеленной электронной пары
(ХТ) группы значительно изменять свойства коор-
гетероатома на металле и в некоторых случаях по
динированного арена (рис. 1), в частности, повы-
причине протекания других реакций с участием
шать кислотность протонов ароматического коль-
гетероциклических колец. Для ароматических ге-
ца и способствовать их депротонированию, стаби-
тероциклов с одним гетероатомом в составе уста-
лизировать бензильные карбкатионы и карбанио-
новлено, что богатые электронами системы, такие
ны, содействовать нуклеофильной атаке на атомы
как тиофен и N-метилпиррол, в реакциях с ГКХ
углерода арена. ХТ фрагмент также успешно при-
или его производными демонстрируют свойства,
меняется в качестве стереонаправляющей группы
подобные свойствам карбоциклических аренов,
в реакциях боковых цепей, связанных с ареновым
и способны выступать в качестве лигандов при
кольцом, позволяющих проведение высоко регио-
координации ХТ группы. В то время как электро-
и стереоселективных синтезов. Кроме того, (арен)-
нодефицитный пиридин в этих реакциях склонен
ХТ комплексы - относительно стабильные веще-
к формированию σ-комплексов, образование ко-
ства, и для большинства лигандов их достаточно
торых может быть полностью подавлено введе-
легко получить при нагревании исходного арена
нием в молекулу данного гетероцикла объемных
с гексакарбонилом хрома (ГКХ) или его произво-
орто-заместителей. При образовании конденсиро-
дными в инертной атмосфере. Стоит отметить, что
ванных гетероциклических (арен)ХТ соединений
после ряда химических трансформаций при необ-
координация ХТ группы, как правило, происходит
ходимости ХТ группа может быть легко удалена
на бензольном кольце, а общая тенденция к обра-
с помощью УФ-облучения раствора комплекса в
зованию π-комплексов контролируется типом ге-
присутствии кислорода, под действием йода или
тероцикла [11, 12].
соединений Ce(IV), Fe(III) [1-7].
В отличие от моногетероатомных произво-
Известно, что наличие гетероциклических ко-
дных, в настоящее время неизвестны (арен)ХТ
лец в различных типах соединений имеет прак-
комплексы, содержащие координированный на
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
557
Стабилизация бензильных
Селективные
карбкатионов и карбанионов
реакции в
боковых цепях
H
R
X
Нуклеофильная
H
Повышенная кислотность
атака на атомы
протонов аренового кольца
углерода
Cr
ароматического
CO
OC
кольца
CO
Объемная стереонаправляющая
группа
Рис. 1. Влияние хромтрикарбонильной группы на свойства координированного арена
хроме пяти- или шестичленный ароматический ге-
дующим действием электрофильных соединений,
тероцикл с двумя и более гетероатомами. Однако
что позволяет вводить новые углеводородные и
анализ литературных данных свидетельствует о
элементоорганические заместители в бензольное
том, что (арен)ХТ фрагмент может располагаться
кольцо. Большое значение имеют также реакции,
в боковой цепи таких соединений, их гидропроиз-
затрагивающие гетероциклические кольца, в част-
водных и конденсированных аналогов. При этом
ности, гидрирование, гидролиз. Наличие ХТ груп-
наибольшее число подобных веществ относится
пы при этом влияет как на стереохимию процессов
к N,O- или N,N-содержащим гетероциклам - про-
получения хромсодержащих производных азолов
изводным азолов (пятичленных азотсодержащих
и гетероциклических азинов, так и на протекание
ароматических гетероциклов с двумя и более ге-
химических превращений с участием данных ве-
тероатомами) и гетероциклических азинов (ше-
ществ, позволяя проводить реакции с высокой
стичленных азотсодержащих ароматических гете-
диастерео- и энантиоселективностью, что явля-
роциклов с двумя и более гетероатомами). Такие
ется ключевым фактором при создании аналогов
соединения и продукты их превращений активно
природных соединений и лекарственных средств,
применяются в тонком органическом синтезе и
процессов тонкого органического синтеза.
могут являться природными, биологически и фи-
В дополнительных материалах к статье при-
зиологически активными веществами.
ведены таблицы, обобщающие различные спек-
Целью настоящего обзора явилось обобщение
тральные и некоторые другие характеристики
информации о способах получения и свойствах
исследуемых веществ, содержащие главным обра-
азолов, гетероциклических азинов, их гидропро-
зом информацию о выходах соединений, частоте
колебаний карбонильных групп ХТ фрагмента в
изводных и конденсированных аналогов, содержа-
ИК спектрах, масс-спектрометрические характе-
щих (арен)ХТ группу. Основные стратегии синте-
за исследуемых веществ заключаются либо в ре-
ристики, температуры плавления.
акциях между ГКХ или его производными и уже
1. ПРОИЗВОДНЫЕ АЗОЛОВ
сформированной гетероциклической молекулой,
С (η6-АРЕН)ХТ ГРУППАМИ
содержащей ареновый фрагмент, либо в реакциях
1.1. N,O-СОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ
построения гетероциклического кольца с участи-
ем хромсодержащих компонентов. Химические
Пятичленные гетероциклы с атомами азота и
свойства изучаемых соединений, прежде всего,
кислорода в гетероциклическом кольце представ-
обусловлены склонностью координированного
лены такими группами органических соединений,
арена к активации под действием литийорганиче-
как оксазолы со связями N-C-O и изоксазолы, со-
ских веществ с протеканием реакций нуклеофиль-
держащие непосредственно связанные атомы азо-
ного присоединения/депротонирования с после-
та и кислорода, а также гидропроизводные данных
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
558
ГРИШИНА и др.
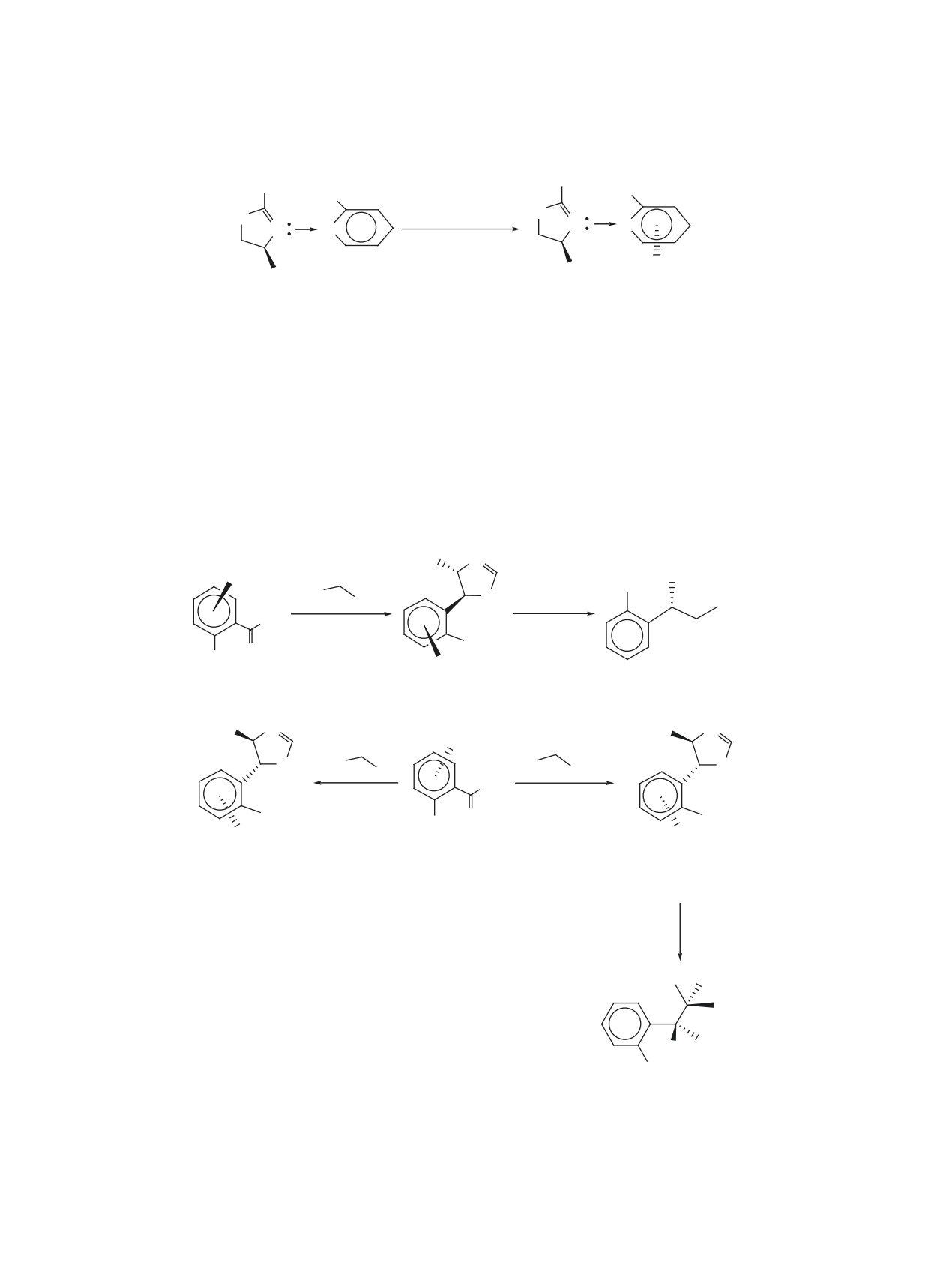
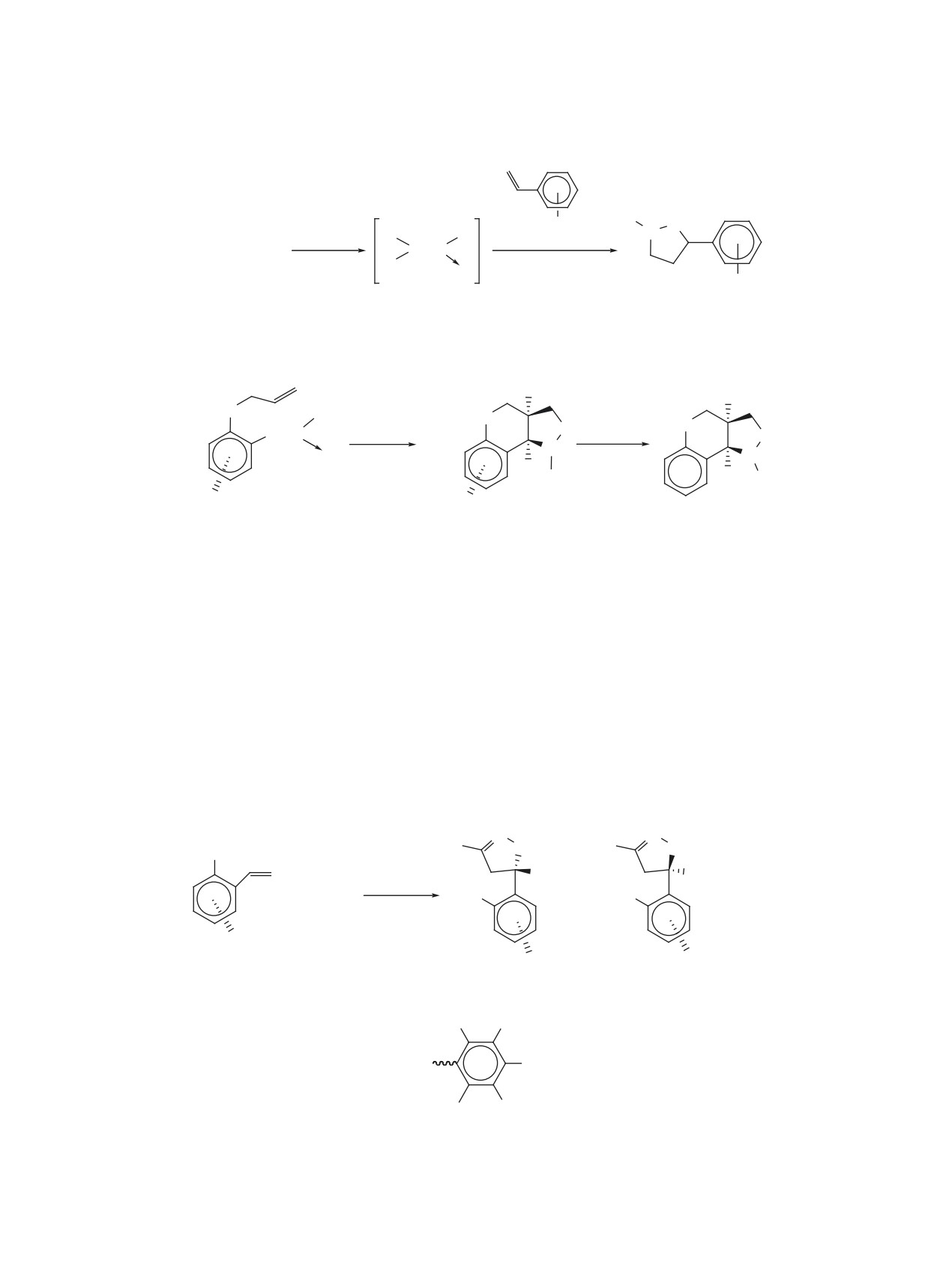
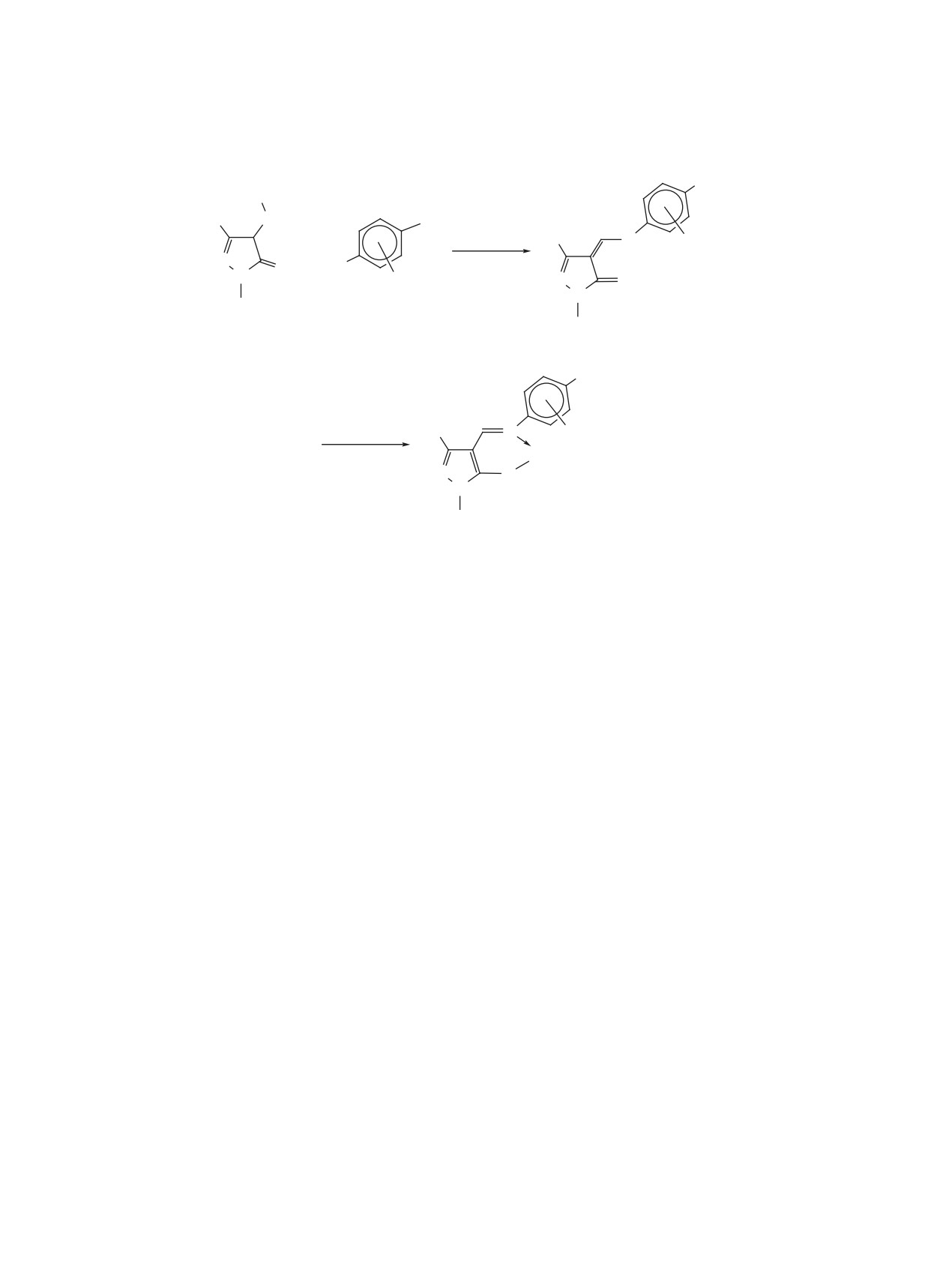
Схема 1
O
O
O
Cr(CO)6, декалин
+
N
HCO(O)Et, 1 ч, ∆
N
N
(OC)
3Cr
Cr(CO)
5
1
2, 0.7%
3, 18%
веществ и их конденсированные аналоги. В лите-
воздухе желтые иглообразные кристаллы, строе-
ратуре нами не обнаружены сведения об (арен)-
ние которых доказано различными методами фи-
ХТ производных изоксазолов и найдено только
зико-химического анализа. В случае оптически
одно соединение с оксазольным кольцом и (арен)-
активных исходных соединений 4c, d координа-
ХТ группой в составе, полученное при взаимодей-
ция ХТ группы приводила к соответствующим хи-
ствии ГКХ и бензоксазола 1 в среде декалина в
ральным продуктам 5c, d.
присутствии этилформиата (схема 1) [13].
В качестве единственного стереоизомера [18]
При этом (арен)ХТ производное бензоксазола 2
из соединения 6, в котором борабензольное коль-
цо связано донорно-акцепторной связью с атомом
с ХТ группой, координированной на карбоцикли-
азота дизамещенного 2-оксазолинового фрагмен-
ческом кольце, не было основным продуктом дан-
та, и триацетонитрилхромтрикарбонила с выхо-
ного взаимодействия. За 1 ч реакции его выход со-
дом 72% получен комплекс 7 (схема 3), явившийся
ставил 0.7% против 18% основного продукта 3, в
первым примером энантиомерно чистого планар-
котором атомы азота и хрома связаны σ-связью. В
ного хирального комплекса кислоты Льюиса.
то же время круг менее склонных к образованию
σ-комплексов (арен)ХТ-содержащих гидропроиз-
Другой подход к получению 2-оксазолинов с
водных оксазолов и изоксазолов широк, он вклю-
(арен)ХТ группами заключался в построении гете-
чает в себя оксазолины, оксазолидины, изоксазо-
роциклических колец по реакции хиральных хром-
лидины, изоксазолины.
содержащих ареновых альдегидов с замещенными
изонитрилами [2]. Исходя из альдегидов (2R)-8a
1.1.1. ОКСАЗОЛИНЫ
и (2S)-8a, b и тозилметилизоцианида/этилизоциа-
Среди изомерных оксазолинов (дигидрооксазо-
ноацетата, в присутствии основных катализаторов
лов) (арен)ХТ производные известны только для
получены продукты 9-11 с транс-расположением
2-оксазолинов. Описано [2, 3, 14-16] получение
заместителей при С4 и С5 атомах углерода гетеро-
большого ряда таких веществ и исследована их
циклического кольца с очень высокими выходами
реакционная способность. Показано [2, 3, 14-17],
и диастереоселективностью (схема 4). Благодаря
что их синтез возможен в реакции свободных от
высокой селективности проведенных синтезов на
ХТ группы 2-оксазолинов 4a-e с (η6-нафталин)ХТ
основе соединений 9 и 11b в дальнейшем удалось
или ГКХ (схема 2). Продукты данных взаимодей-
получить оптически чистый аналог алкалоида га-
ствий 5a-e образовывались с хорошими выходами
лостахина и β-замещенный аналог серина соответ-
(44-83%) и представляли собой стабильные на
ственно (схема 4).
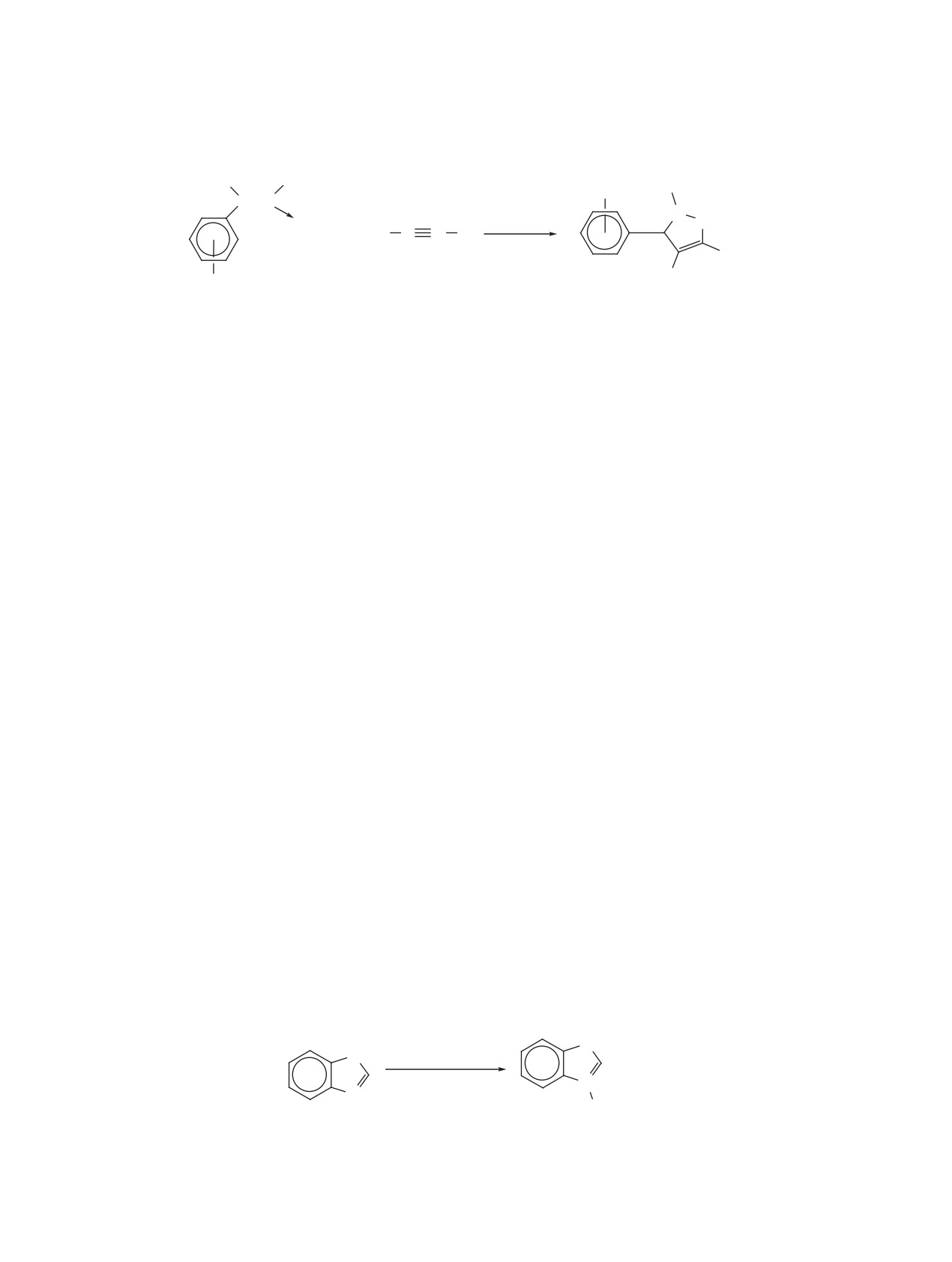
Схема 2
1
R
R1
N
N
i/ii
R2
3
R3
R2
R
O
O
Cr(CO)3
4a-e
5a-e, 44-83%
R1 = R2 = Me, R3 = H (a), R1 = R2 = Me, R3 = OMe (b), R1 = i-Pr, R2 = R3 = H (c),
R1 = t-Bu, R2 = R3 = H (d), R1 = R2 = R3 = Me (e).
Реагенты и условия: i, (η6-нафталин)хромтрикарбонил, ТГФ, 70°С; ii, Cr(CO)6, ТГФ, Bu2O, Δ.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
559
Схема 3
Ph
Ph
TMS
TMS
(MeCN)3Cr(CO)3
O
O
N
B
N
B
ТГФ, -78°C-rt
Cr(CO)3
i-Pr
i-Pr
6
7, 72%
Наличие электроноакцепторной ХТ группы в
кует преимущественно орто-положение арена и
молекулах хромсодержащих 2-оксазолинов обе-
присоединяется в экзо-позиции относительно ХТ
спечивает легкость прямой нуклеофильной атаки
группы (схема 5). Действие йода, [Ph3C]+[PF6]-,
на ареновое кольцо под действием литийорганиче-
алкилгалогенида R5Hal на интермедиат 12 на вто-
ских соединений [2, 3, 14]. Так для гетероциклов
рой стадии процесса или алкилгалогенида в при-
5a-e действие соединений R4Li при пониженных
сутствии СО, а затем гидрида натрия с тем же
температурах приводит к образованию η5-ци-
алкилгалогенидом дает выход к очень широкому
клогексадиенильных интермедиатов анионного
кругу продуктов, в том числе ХТ комплексам 2-ок-
характера 12, при этом входящий нуклеофил ата-
сазолинов 13a-l (схема 5). Возможно также проте-
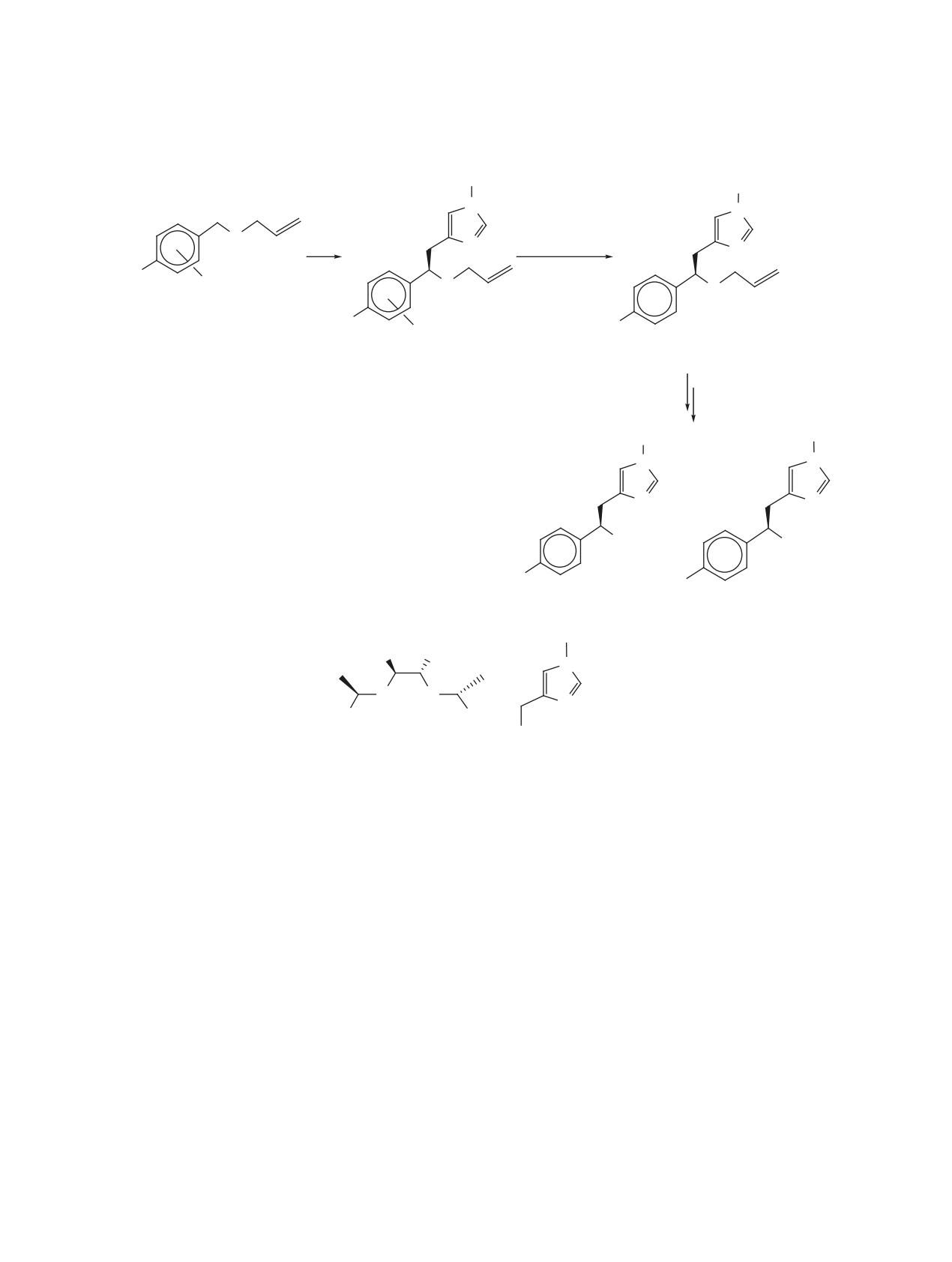
Схема 4
Ts
N
Cr(CO)3
OH
Me
CN
Ts
O
1. hν, CH2Cl
2
NHMe
H K2CO3, 0°C,
2. LiAlH4
MeOH, 95%
Me
O
Me
Cr(CO)3
(2R)-8a
9, 95%, C = 100%
аналог галостахина
Ts
N
EtO2C
N
Cr(CO)
3
CN
CN
O
Ts
CO2Et
O
H
K2CO3, 0°C,
LDA, -78°C
MeOH, 95%
R
O
R
R
Cr(CO)3
Cr(CO)3
10a, b, 100%,
(2S)-8a, b
11a, b, 95-98%,
C = 100% (a), 99% (b).
C = 90% (a), 96% (b).
1. Декомпл.
2. HCl, MeOH
H NH3Cl
COOH
OH
H
OMe
аналог серина
R = Me (a), OMe (b).
C - содержание изомера в диастереомерной смеси.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
560
ГРИШИНА и др.
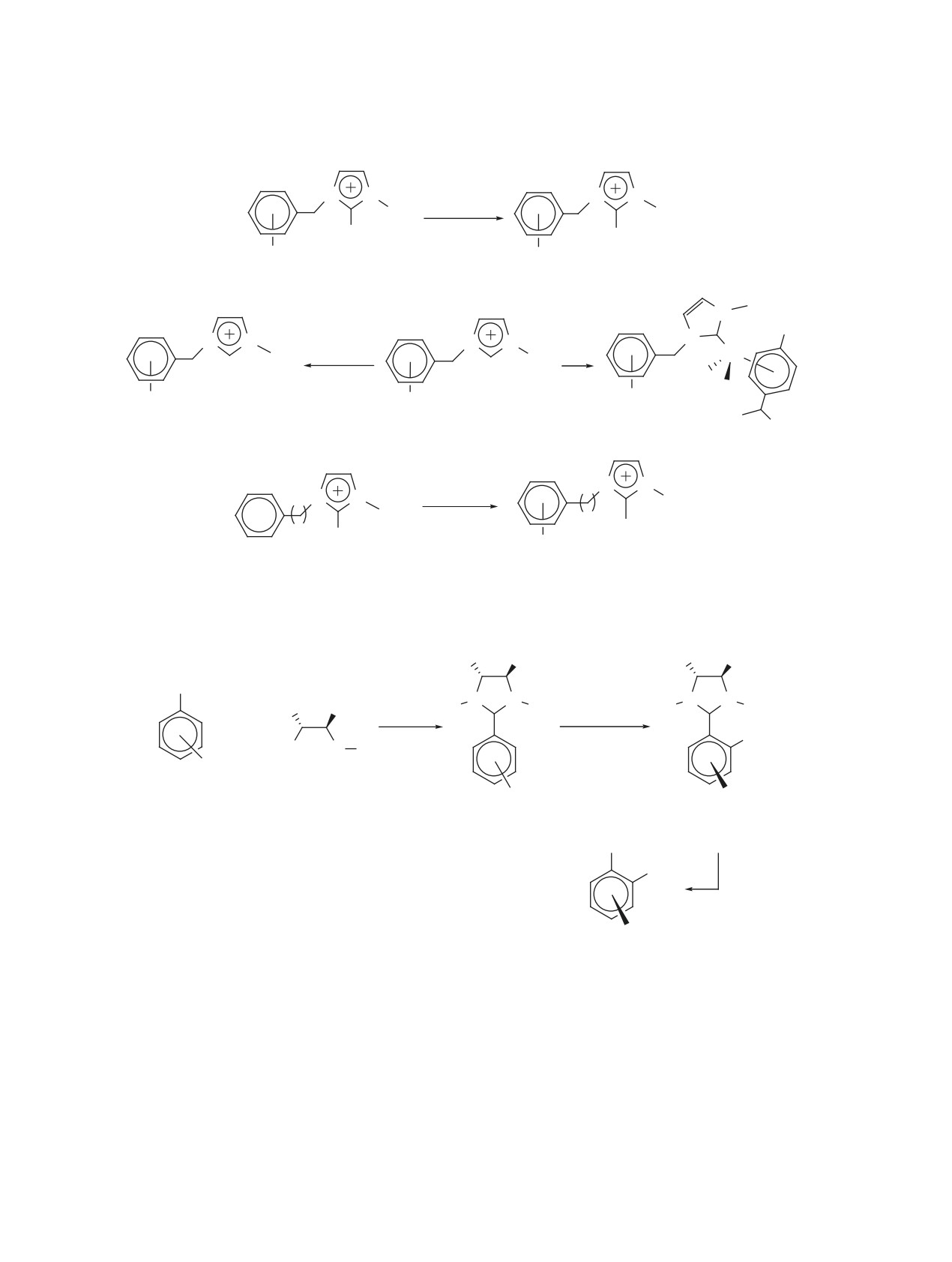
Схема 5
R1
N
R2
R3
O
Cr(CO)3
5a-e
R4Li
-Li+
R4
H
R1
R3
N
R2
I2
Cr
1. RI, CO, HPMA
O
CO
2. NaH, RI
OC
O
R4
CO
4
C
R
R
12
R1
N
R1
R3
R
R2
N
R5Hal
R3
O
[Ph3C]+[PF6]-
R2
30-93%
O
4
48-86%
R
R5
R4
R1
R1
N
N
R3
2
R3
R2
R
O
O
48-88%
Cr(CO)3
13a-l, 22-68%
R1 = Me, i-Pr, t-Bu; R2 = H, Me; R3 = H, Me, OMe; R4 = Me, Bu, t-Bu, Vin, Ph,
C(Me)2CN, CH(Me)CN, CH2CN, CH2SPh, CH2S(O)(p-Tol), CH2CO2(t-Bu), тиофен-2-ил,
CH2C≡C-TMS; R5 = All, CH2(Me)CH=CH2, Bn, CH2C≡CH, CH2C≡C-TMS; R = Me, Et.
13a-l, R1 = R2 = Me: R3 = H, R4 = Me (a); R3 = H, R4 = Bu (b); R3 = H, R4 = Vin (c);
R3 = H, R4 = Ph (d); R3 = H, R4 = тиофен-2-ил (e); R3 = OMe, R4 = Me (f); R3 = OMe, R4 = Bu (g);
R3 = OMe, R4 = Vin (h); R3 = OMe, R4 = Ph (i); R3 = H, R4 = CH2C≡C-TMS (j);
R3 = CH2C≡C-TMS, R4 = H (k); R3 = OMe, R4 = CH2C≡C-TMS (l).
кание реакций с образованием хиральных веществ
2-оксазолинов 14a-j с выходами 67-82% (схема 6)
[2, 3, 14]. Таким образом, наличие ХТ группы в мо-
[16].
лекулах 2-оксазолинов способствует проведению
Химическим свойством описываемых 2-окса-
высоко регио- и стереоселективного замещения/
золинов является фотолитическая замена карбо-
присоединения новых заместителей в ароматиче-
нильного лиганда в ХТ группе комплекса 5d на
ском кольце с сохранением гетероциклического
трифенилфосфин [19], которая характерна для ХТ
фрагмента.
комплексов аренов (схема 7) [2, 6].
В случае наличия непредельного заместителя
Также известен ряд реакций, связанных с обра-
CH2C≡C-TMS в ареновом кольце молекул хром-
содержащих 2-оксазолинов при последовательном
зованием металлокомплексов на основе веществ
действии бутиллития и электрофилов R1Br воз-
5a, e (схема 8) [17, 20, 21]. Получены [17, 20] со-
можно диастереоселективное замещение наибо-
единения 18a-c, в которых входящий металл (мар-
лее подвижного атома водорода, соседствующего
ганец или рений) координирован на атоме азота и
с тройной связью, заместителя CH2C≡C-TMS на
одном из углеродов (арен)ХТ кольца гетероциклов
радикал R1 и образование новых хромсодержащих
5a, e (схема 8).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
561
Схема 6
R1
TMS
TMS
H2C
HC
BuLi, ТГФ
R1Br
HC
TMS
Me
-78°C, 3 ч
-78°C-rt, 12 ч
N
Me N
Me
R
Me
R
Me N
Me
R
O
O
O
Cr(CO)3
Cr(CO)3
Cr(CO)
3
13j, l
14a-j, 67-82%
dr ≥ 98:2
13j, l, R = H (j), OMe (l); 14a-j, R = H, R1 = Me (a); R = H, R1 = All (b); R = H, R1 = CH2C≡CH (c);
R = H, R1 = CH2CBr=CH2 (d); R = H, R1 = PPh2 (e); R = H, R1 = SPh (f); R = H, R1 = OH (g);
R = OMe, R1 = Me (h); R = OMe, R1 = All (i); R = OMe, R1 = CH2C≡CH (j).
Схема 7
t-Bu
N
t-Bu
N
PPh3, hν
O
O
бензол
Cr
CO
Cr(CO)3
Ph
3P
CO
5d
82%
Соединения на основе марганца исследова-
1.1.2. ОКСАЗОЛИДИНЫ
ны в ряде реакций, в частности, с MeLi, что для
Оксазолидины (тетрагидрооксазолы) пред-
комплекса 18а привело к образованию продукта
ставляют собой пятичленные насыщенные гете-
13m (схема 8), PPh3, N2=CPh2 [17], PhLi и MeOTf
роциклические системы с фрагментом N-C-O. В
одном из первых упоминаний хромсодержащего
[20]. Для комплекса рения 18с изучено его взаи-
оксазолидина [22, 23] указано, что гетероцикл 19
модействие с диазоарилметанами [20]. Показан
с (арен)ХТ заместителем при С2 атоме углерода
[21] палладиевый димерный комплекс на основе
гетероциклического кольца может образовываться
2-оксазолина 5d, применяющийся в качестве ката-
из соответствующего имина в результате обрати-
лизатора в реакциях перегруппировки аллиловых
мой внутримолекулярной циклизации под дей-
N-арилзамещенных трифторацетимидов.
ствием Al2O3 (схема 9).
Схема 8
(CO)4
Met
Me N
[Met(CO)5(CH2Ph)]
Me
Me
R
N
R
Me
O
гептан, ∆
Cr(CO)3
O
Cr(CO)3
5a, e
18a-c, 44-96%
(CO)4
O
Mn
Me
1. MeLi, DME,
Me
-50°C-20°C
Me
N
N
Me
2. воздух
Me
O
O
Cr(CO)3
Cr(CO)3
18a
13m, 54%
5a, e, R = H (a), Me (e); 18a-c, R = H, Met = Mn (a); R = Me, Met = Mn (b); R = Me, Met = Re (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
562
ГРИШИНА и др.
Схема 9
Me
Me
O
O
OH
Al2O3
O
N
NH
Me
Cr(CO)3
Cr(CO)
Me
3
Me
Me
19
В 1996 г. продемонстрированы [24] химические
ся соединения 22a-d. Показано, что из аниона 21
свойства оксазолидина 20 с (η6-фенил)ХТ группой
может обратимо образовываться интермедиат 23,
при С4 атоме углерода гетероцикла, полученного
дающий при обработке йодом хиральный трици-
по реакции 3-цианометил-4-фенилоксазолидина и
клический гетероцикл 24 (схема 10).
ГКХ (схема 10).
Описан ряд бициклических оксазолидинов с
Показано, что при взаимодействии соединения
(арен)ХТ группой при С2 атоме углерода гете-
20 с диизопропиламидом лития происходит депро-
роциклического кольца [25]. С выходом 99% по-
тонирование исходного гетероцикла с образова-
лучен гетероцикл 25 по реакции ГКХ с соответ-
нием аниона 21, дальнейшая обработка которого
ствующим свободным оксазолидином (схема 11).
реагентами RX приводит к диастереомерной сме-
Взаимодействие соединения 25 с бутиллитием и
си продуктов, в которой преобладающими являют-
последующие реакции с разнообразными электро-
Схема 10
CN
CN
Cr(CO)6
N
N
-3CO
O
O
Cr(CO)3
20
LDA,
ТГФ,
HMPA
-70°C
CN
CN
N
N
O
(OC)3CrH
Cr(CO)3
O
23
21
I
2
RX
R CN
CN
N
N
O
H
O
Cr(CO)3
24, 20%
22a-d, 52-68%
RX = MeI, R = Me (a), de 40%; RX = EtI, R = Et (b), de 30%;
RX = BnBr, R = Bn (c), de 43%; RX = AllBr, R = All (d), de 36%.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
563
Схема 11
R
O
O
O
i
ii
N
-3CO
N
N
Cr(CO)3
t-Bu
t-Bu
Cr(CO)
t-Bu
3
25, 99%
26a-g, 94-100%
de 100%
26a-g, R = Me (a), SMe (b), SiMe3 (c), PPh2 (d), SnMe3 (e), Bn (f), CH(OH)Ph (g).
Реагенты и условия: i, Cr(CO)6, Bu2O/ТГФ (4:1), Δ; ii, 1. BuLi, ТГФ, -78°С; 2. RX, -78°С, rt.
RX = MeI (a), SMe2 (b), SiMe3Cl (c), PPh2Cl (d), SnMe3Cl (e), BnBr (f), PhCOH (g).
филами привели к получению новых комплексов
вещество
28 подвергалось последовательному
26a-g с орто-заместителями (в том числе эле-
действию бутиллития и йодметана c образовани-
ментоорганическими) в ареновом кольце с очень
ем соединения 29. Одним из побочных продук-
высокими выходами и полной диастереоселектив-
тов последней реакции явился 2-оксазолин с ХТ
ностью (схема 11). В отличие от реакций с участи-
группой (30).
ем 2-оксазолинов (см. раздел 1.1.1.) бутиллитий
Осуществлен синтез рацемической смеси
в данных процессах выполнял роль основания и
трициклического оксазолидина 31 [26]. Реакция
способствовал депротонированию аренового коль-
между ХТ производным замещенного фталимида
ца. Продукты реакций выделены в чистом виде и
и метилмагнийхлоридом в ТГФ при 25°С в тече-
охарактеризованы ИК-, ЯМР-спектроскопией,
ние 1 сут привела к смеси гетероциклов 31 и 32
масс-спектрометрией. Для комплексов 25, 26b, g
с выходами 46 и 13% соответственно (схема 13).
также выполнен рентгеноструктурный анализ
Проведение данной реакции при -78°С дает в ка-
(РСА).
честве единственного продукта соединение
32.
Образование оксазолидина 31 при повышенной
Попытки введения ХТ группы в молекулу 27,
температуре связано с внутримолекулярной реак-
содержащую 2 ароматических фрагмента, дей-
цией Вильямсона.
ствием ГКХ при соотношении реагентов 1:1 при-
вели к координации по ароматическому кольцу
Получен большой ряд оксазолидинов, содержа-
при С2 атоме углерода (схема 12) [25]. Полученное
щих (η6-фенил)ХТ группу главным образом при
Схема 12
O
O
O
N
N
N
Cr(CO)6,
BuLi, ТГФ,
Cr(CO)3
Cr(CO)3
SO2
Bu2O/ТГФ, ∆
SO2
-78°C
SO2
−3CO
MeI,
Me
−78°C-rt
Me
Me
Me
29, 50%
27
28
+
O
N
Cr(CO)3
30, 8%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
564
ГРИШИНА и др.
Схема 13
O
O
O
1. 2 экв MeMgCl,
ТГФ, 25°C, 24 ч
N
N
+
N
2. NH4Cl
Br
Br
(OC)3Cr
Me
Me
O
(OC)3Cr
O
(OC)3Cr
OH
31, 46%
32, 13%
Схема 14
R2
O
OH
а
N
R2HN
R1
R1
+
-H2O
H
R3
O
R3
33a-d
34a-d
35a-d, 30-71%
33a-d, R1 = H (a), Me (b), Ph (c), Ph[Cr(CO)3] (d); 34a-d, R2 = Ph, R3 = H (a), Me (b);
R2 = Ph[Cr(CO)3], R3 = H (c), Me (d); 35a-d, R1 = R3 = H, R2 = Ph[Cr(CO)3] (a);
R1 = Me, R2 = Ph[Cr(CO)3], R3 = H (b); R1 = H, R2 = Ph[Cr(CO)3], R3 = Me (c);
R1 = Me, R2 = Ph[Cr(CO)3], R3 = Me (d).
Реагенты и условия: a, толуол, 120°С, MgSO4 (безв.).
атоме азота [27, 28]. Использованы 2 подхода к
(схема 14). (η6-Бензальдегид)ХТ 33d также не ре-
синтезу целевых соединений: реакция конденса-
агировал с фенилсодержащими аминоспиртами.
ции альдегидов 33a-d и аминоспиртов 34a-d, при-
Установлено [28], что метод b позволяет получить
водившая к продуктам 35a-d (метод a, схема 14)
не только синтезированные ранее гетероциклы
[27], и действие триамминхромтрикарбонила
35a-d, но и недоступный конденсацией продукт
(ТАХТ) на фенилсодержащие оксазолидиновые
35e, а также оксазолидин с двумя ХТ группами —
лиганды 36 (метод b, схема 15) [28].
35f (схема 15). Также показана возможность вве-
дения (η6-фенил)ХТ группы в положение С2 гете-
Показано [27], что (η6-фенил)ХТ производные
роцикла (соединения 35h, i). Вещества охаракте-
аминоспиртов 34c, d дают продукты конденсации
ризованы различными методами, для ряда из них
только с простейшими альдегидами 33a, b (пара-
проведен РСА.
форм, уксусный альдегид), в то время как в реакци-
ях этих спиртов с бензальдегидом 33с или (η6-бен-
К соединениям, содержащим одновременно ок-
зальдегидом)ХТ 33d оксазолидины не образуются
сазолидиноновое кольцо и (арен)ХТ группу, отно-
Схема 15
R2'
R2
N R1'
b
N R1
-3NH
3
O
O
R3'
R3
36
35a-i, 30-51%
36, R1' = H, Me, Ph, Et; R2' = Ph, Ac, Boc; R3' = H, Me; 35a-i, R1 = R3 = H, R2 = Ph[Cr(CO)3] (a);
R1 = Me, R2 = Ph[Cr(CO)3], R3 = H (b); R1 = H, R2 = Ph[Cr(CO)3], R3 = Me (c);
R1 = R3 = Me, R2 = Ph[Cr(CO)3] (d); R1 = Ph, R2 = Ph[Cr(CO)3], R3 = H (e);
R1 = R2 = Ph[Cr(CO)3], R3 = H (f); R1 = Et, R2 = Ph[Cr(CO)3], R3 = H (g);
R1 = Ph[Cr(CO)3], R2 = Ac, R3 = H (h); R1 = Ph[Cr(CO)3], R2 = Boc, R3 = H (i).
Реагенты и условия: b, (NH3)3Cr(CO)3, 120°С, диоксан.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
565
Схема 16
R1
R1
H
R1
∆
N
N
R2
R2
C N
+
O
+
O
R3
R2
O
R3
R3
37a-j
38a-h
цис-39a-z
транс-39a-z
20-90%
37a-j, R1 = Me, R2 = o-TMS-Ph[Cr(CO)3] (a), Ph[Cr(CO)3] (b); R2 = Ph[Cr(CO)3], R1 = t-Bu (c),
Ph (d); R2 = Ph, R1 = Me (e), t-Bu (f), Ph (g); R2 = C5H4[Mn(CO)3], R1 = Me (h), t-Bu (i), Ph (j);
38a-h, R3 = Ph (a), OEt (b), OAc (c), TMS (d), CN (e), п-BrC6H4 (f), Ph[Cr(CO)3] (g),
C5H4[Mn(CO)3] (h); 39a-z, R1 = Me, R2 = o-TMS-Ph[Cr(CO)3], R3 = Ph (a);
R1 = Me, R2 = Ph[Cr(CO)3], R3 = Ph (b); R1 = Me, R2 = o-TMS-Ph[Cr(CO)3], R3 = OEt (c);
R1 = Me, R2 = Ph[Cr(CO)3], R3 = OEt (d); R1 = Me, R2 = o-TMS-Ph[Cr(CO)3], R3 = OAc (e);
R1 = Me, R2 = Ph[Cr(CO)3], R3 = OAc (f); R1 = Me, R2 = Ph[Cr(CO)3], R3 = TMS (g);
R1 = Me, R2 = o-TMS-Ph[Cr(CO)3], R3 = CN (h); R1 = Me, R2 = o-TMS-Ph[Cr(CO)3], R3 = п-BrC6H4 (i);
R1 = t-Bu, R2 = Ph[Cr(CO)3], R3 = Ph (j); R1 = R3 = Ph, R2 = Ph[Cr(CO)3] (k);
R2 = Ph, R3 = Ph[Cr(CO)3], R1 = Me (l), t-Bu (m), Ph (n); R2 = Ph[Cr(CO)3], R3 = CN, R1 = Me (o),
t-Bu (p), Ph (q); R2 = R3 = Ph[Cr(CO)3], R1 = Me (r), t-Bu (s), Ph (t);
R2 = Ph[Cr(CO)3], R3 = C5H4[Mn(CO)3], R1 = Me (u), t-Bu (v), Ph (w);
R2 = C5H4[Mn(CO)3], R3 = Ph[Cr(CO)3], R1 = Me (x), t-Bu (y), Ph (z).
o-TMS-Ph[Cr(CO)3] =
Me3Si
Cr(CO)3
сятся комплексы [29, 30], нашедшие применение в
ных за счет передачи электронной плотности от
синтезе природных веществ.
заместителя диполярофила к электронодефицит-
ному (арен)ХТ кольцу (рис. 2). Отмечено, что ис-
1.1.3. ИЗОКСАЗОЛИДИНЫ
пользование обеих хиральных форм нитрона 37a
Все известные в настоящее время изоксазоли-
в реакциях со стиролом 38a и этоксиэтиленом 38b
дины (насыщенные пятичленные гетероцикличе-
приводилo к энантиоселективному получению
ские системы со связью N-O) с (арен)ХТ фрагмен-
соответствующих изоксазолидинов с ee 96-98%
тами получены по реакции 1,3-диполярного ци-
[32].
клоприсоединения (1,3-ДЦ) нитронов (диполей) и
диполярофилов [31-38].
Продемонстрировано повышение цис/транс-
селективности реакций 1,3-ДЦ при введении ХТ
Показано [31, 32], что реакции хромсодержа-
группы в молекулы диполей и/или диполярофи-
щих нитронов 37a, b, с широким кругом олефинов
лов [33-37]. В качестве диполей были выбраны
38a-f приводили к регио- и стереоселективному
хромсодержащие нитроны 37b-d, их свободные
получению тризамещенных изоксазолидинов 39a-
от ХТ группы аналоги 37e-g, а также нитроны,
i (схема 16). Сравнение цис/транс-селективности
содержащие (η5-циклопентадиенил)марганецтри-
данных реакций с селективностью аналогичных
карбонильную группу
37h-j. Диполярофилами
процессов, компоненты которых не содержали ХТ
фрагментов, показало, что введение ХТ группы в
являлись стирол 38a, акрилонитрил 38e, (η6-сти-
молекулы диполей способствует значительному
рол)ХТ 38g и марганецсодержащий комплекс 38h.
увеличению доли цис-изомера в реакционной сме-
Установлено, что основными продуктами прове-
си. Склонность к цис-селективности (см. таблицу)
денных реакций были тризамещенные изоксазо-
объясняли преимущественным образованием пе-
лидины 39j-z с цис-расположением заместителей
реходных состояний эндо-типа, стабилизирован-
при С3 и С5 углеродных атомах (см. таблицу).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
566
ГРИШИНА и др.
Соотношение цис/транс-изомеров изоксазолидинов 39a-z [31-36]
Соотношение
Соотношение
Соотношение
Соединение
Соединение
Соединение
цис/транс-изомеров, %
цис/транс-изомеров, %
цис/транс-изомеров, %
39a
˃98:0a
39j
100:0
39s
100:0
39b
˃98:0a
39k
100:0
39t
100:0
39c
˃98:0a
39l
83:17
39u
100:0
39d
˃98:0a
39m
100:0
39v
100:0
39e
74:26a
39n
100:0
39w
100:0
39f
˃98:0a
39o
100:0
39x
88:12
39g
80:20a
39p
100:0
39y
100:0
39h
30:70a
39q
93:7
39z
100:0
39i
92:8a
39r
100:0
a Указано соотношение соответствующих декомплексованных продуктов (без ХТ группы)
Показана [33, 36] возможность получения гетеро-
стом метилене при облучении солнечным светом в
циклов с 2 металлтрикарбонильными группами
присутствии кислорода воздуха давала продукт 42
в составе (соединения 39r-z). Синтезированные
(схема 18) [39].
вещества выделены в чистом виде, проанализиро-
1.1.4. ИЗОКСАЗОЛИНЫ
ваны различными методами физико-химического
В литературе нами обнаружены только 2 рабо-
анализа, в ряде случаев выполнен РСА [33-36, 38].
ты, посвященные (арен)ХТ комплексам с изокса-
Показана возможность образования дизаме-
золиновыми кольцами в составе [40, 41]. Описаны
щенных изоксазолидинов 40a-c с (η6-фенил)ХТ
[40] реакции 1,3-ДЦ хиральных хромсодержащих
группой при пятом атоме углерода гетероцикла
диполярофилов с N-арилзамещенным нитрилок-
по реакции 1,3-ДЦ нитронов, синтезированных
сидом, протекавшие при комнатной температуре в
in situ из формальдегида и соответствующих ги-
диоксане с образованием смеси диастереомерных
дроксиламинов, c (η6-стирол)ХТ (схема 17) [34].
2-изоксазолинов 43a-c и 44a-c с общими выхода-
Установлена полная региоселективность данных
ми на уровне 65-70% (схема 19). Показано, что
реакций.
содержание изомеров 43 в смеси продуктов было
В литературе также имеется пример внутри-
значительно выше, чем изомеров 44 (см. соотно-
молекулярного цис-1,3-ДЦ, которое привело
шение диастереомеров на схеме 19). То есть про-
к энантиоспецифичному образованию трици-
веденные реакции протекали с полной региоселек-
клического изоксазолидина 41 с выходом 70%.
тивностью и с высокой диастереоселективностью.
Декомплексация раствора соединения 41 в хлори-
Полной региоселективностью характеризовалось
H
R1
N
R2
цис
O
H
R3
R1 = Me, t-Bu, Ph; R2 = o-TMS-Ph[Cr(CO)3], Ph[Cr(CO)3], C5H4[Mn(CO)3];
R3 = Ph, OEt, OAc, TMS, CN, п-BrC6H4, Ph[Cr(CO)3], C5H4[Mn(CO)3].
Рис. 2. Эндо-переходное состояние в реакции 1,3-диполярного циклоприсоединения
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
567
Схема 17
R
Cr(CO)3
O
H
R
N
диоксан
38g
H2C=O
+
RNHOH
C N
55°C, 16 ч
H
O
Cr(CO)3
40a-c, 44-47%
R = Me (a), t-Bu (b), Ph (c).
Схема 18
H
H
O
Me
O
H
O
O
hν, воздух
C N
80°C, 7 ч
O
N
O толуол
CH2Cl2, 2 ч
N
H
Me
H Me
(OC)3Cr
(OC)3Cr
41, 70%, ee = 100%
42
также 1,3-ДЦ (η6-фенил)ХТ комплексов нитронов
1.2.1. ИМИДАЗОЛЫ
37b-d с метиловым эфиром фенилпропиоловой
Проведенное в 1993 г. [13] действие ГКХ на
кислоты 45, протекавшее в среде толуола при 80°С
бензимидазол 47 не привело к образованию (арен)-
и приводящее к хромсодержащим 4-изоксазоли-
ХТ π-комплекса, а дало в качестве единственного
нам 46a-c (схема 20) [41].
продукта с выходом 20% вещество 48 со связью
N-Cr(CO)5 (схема 21) (сходные результаты были
1.2. N,N-CОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ
получены при образовании комплекса на основе
К пятичленным гетероциклам с 2 атомами азота
бензоксазола, см. выше).
в составе относят такие классы органических сое-
Однако получение соединений, содержащих
динений, как имидазолы, пиразолы и их произво-
одновременно (арен)ХТ группу и имидазольное
дные.
кольцо, оказалось возможным за счет других ре-
Схема 19
N
N
Ar
O
Ar
O
R
H
H
диоксан
+
ArCNO
R
+
R
24-30 ч, rt
Cr(CO)3
Cr(CO)3
Cr(CO)3
43a-c
44a-c
65-70%
Me
Cl
Ar =
Me
Me
Cl
R = OMe (a), dr 80:20; R = Me (b), dr ≥ 98:2; R = Cl (c), dr 96:4.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
568
ГРИШИНА и др.
Схема 20
H
R
R
Cr(CO)3
C N
N
O
толуол
O
+
H
C
C
Ph
3CO2C
80°C, 35 ч
Ph
CO2CH3
Cr(CO)3
37b-d
45
46a-c, 51-55%
37b-d, R = Me (b), t-Bu (c), Ph (d); 46a-c, R = Me (a), t-Bu (b), Ph (c).
акций [42, 43]. Целью работы [42] было получение
компонентов. Также показано получение рутение-
хиральных третичных спиртов с имидазольным
вого комплекса с имидазолиновым кольцом 57.
фрагментом, для этого было проведено литиро-
В литературе также имеются примеры метал-
вание ХТ комплекса 49 в присутствии диаминов
локомплексов на основе платины [44] и марганца
(+)-50/(-)-50 с дальнейшим действием электро-
[45], содержащие в молекулах (арен)ХТ кольцо и
филом 51 (схема 22). Продукты данных реакций
2-имидазолиновый заместитель.
(+)-52 и (-)-52 [соединение (-)-52 синтезировано
по реакции, аналогичной приведенной на схеме
1.2.2. ИМИДАЗОЛИДИНЫ
22, в присутствии диамина (-)-50] получены с вы-
Получены хиральные молекулы с (арен)ХТ
ходами 69-73% и очень высоким энантиомерным
группами и имидазолидиновыми (тетрагидроими-
избытком (≥ 99%). Декомплексация соединений
дазольными) кольцами в составе [46-50]. Показано
(+)-52 и (-)-52 в диэтиловом эфире на воздухе
[46, 47], что реакции (η6-бензальдегид)ХТ 33d с
при естественном освещении давала соединения
хиральными диаминами 58a-e приводят к образо-
(+)-53 и (-)-53, из которых с высокой энантиосе-
ванию моно- и бициклических хромсодержащих
лективностью в несколько стадий были синтези-
имидазолидинов 59a-e с выходами 83-95%, даль-
рованы целевые вещества.
нейшее взаимодействие которых с BuLi в среде
Описано [43] получение и изучены свойства
ТГФ и электрофильными агентами RX приводит
ионных комплексов, содержащих в своем составе
к орто-замещенным комплексам 60a-k с очень
(арен)ХТ группу и имидазольное кольцо. На осно-
высокой диастереоселективностью и хорошими
ве бромидов 54a, b с помощью реакций обмена,
выходами (схема 24), однако в случае менее сте-
протекавших при комнатной температуре, успеш-
рически затрудненных соединений 59a-с образу-
но синтезированы новые хромсодержащие ионные
ются также мета- и пара-аналоги. Показано, что
жидкости 55a, b, 56a c выходами 83, 51 и 97% со-
гидролиз гетероциклов 60a-k дает выход к гомо-
ответственно (схема 23). Синтез соединений 56a-c
хиральным альдегидам 8a, c-g.
также осуществляли реакцией ГКХ со свободны-
ми от ХТ группы соответствующими ионными
Продуктами реакции [48, 49] альдегидов 8a, b,
жидкостями в среде диоксана, однако в случае
h с диаминами 58a, c (схема 25) являются имида-
соединений 56a, b реакции протекали с весьма
золидины 60b, l-n, полученные в виде диастере-
низкими выходами, а вещество 56c, полученное
омерных смесей. Соединения 60b, l синтезирова-
с выходом 42%, не удалось отделить от исходных
ны также при взаимодействии свободных от ХТ
Схема 21
H
H
N
N Cr(CO)6, декалин
HCO(O)Et, 1 ч, ∆
N
N
Cr(CO)5
47
48, 20%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
569
Схема 22
Tr
Tr
N
N
O
i
N
hν, воздух
N
Et2O
t-Bu
Cr(CO)3
O
O
t-Bu
Cr(CO)3
t-Bu
49
(+)-52, 73%, ee ≥ 99%
(+)-53, 82%
H
Tr
N
N
N
N
или
OH
OH
t-Bu
t-Bu
85%, ee ≥ 99%
48%, ee ≥ 90%
Tr
Ph
Ph
N
i, 1.
; 2.
, BuLi.
NH HN
N
Ph
Ph
Br
(+)-50
51
группы имидазолидинов с ГКХ или (нафталин)-
1.2.3. ИМИДАЗОЛИДИНОНЫ,
ХТ [48]. Показано [49], что из веществ 60m, n воз-
ИМИДАЗОЛИНОНЫ
можно получить ХТ производные стирола с ими-
Показано [52], что из свободных от метал-
дазолидиновыми заместителями в ароматическом
ла бициклических имидазолидинонов анти- и
кольце (схема 25).
син-65 при комплексообразовании с ГКХ в среде
В результате действия ГКХ на бициклический
кипящих бутилацетата и октана получены хромсо-
имидазолидин 62 с ареновым заместителем полу-
держащие соединения анти- и син-66 (схема 27).
чен [50] (арен)ХТ комплекс 63 с выходом 35% и
Синтезированные вещества далее подвергали
диастереомерным избытком 84%, кислотный ги-
последовательным реакциям депротонирования
дролиз которого давал альдегид 64. На основе со-
трет-бутиллитием и электрофильного присоеди-
единения 64 далее в несколько стадий синтезиро-
нения широкого спектра реагентов RX с образова-
ван алкалоид (-)-лазубин (I) (схема 26).
нием в качестве основных продуктов соединений
Известны также комплексы рутения, содержа-
67a-i и 68a-e. Из продуктов 67a, g и 68a, d в реак-
щие в своем составе (арен)ХТ группу и имидазо-
циях с пара-толуолсульфокислотой были получе-
лидиновое кольцо, которые были успешно при-
ны имидазолиноны с (арен)ХТ заместителями 69a,
менены в качестве катализаторов в широком ряду
b и 70a, b. Хромсодержащие продукты [52] полу-
процессов метатезиса [51].
чены с высокими выходами, выделены в чистом
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
570
ГРИШИНА и др.
Схема 23
N N
N
N
LiTf2N, 3 ч
Me
Me
Br-
-
rt или 40°C
R
RTf2N
Cr(CO)3
Cr(CO)3
54a, b, 65-68%
55a, b, 51-83%
Me
N
Me
NaBF4,
N
N
N
N
N
MeCN
i
Ru
-
Me
Me
BF
Br-
4
Cl
rt, 2 дня
Cl
Cr(CO)3
Cr(CO)3
Cr(CO)3
Me
Me
56a, 97%
54a
57, 86%
N
N
Cr(CO)6
N
N
Me
-
n
Me
диоксан, ∆
R BF4-
n RBF4
Cr(CO)3
56a-c
54a, b, 55a, b, R = H (a), Me (b); 56a-c, n = 1, R = H (a), Me (b); n = 3, R = H (c).
Реагенты и условия: i, 1. Ag2O, CH2Cl2, rt, 18 ч; 2. [Ru2(пара-цимол)2Cl4], CH2Cl2, rt, 7 ч.
Схема 24
R2
R2
R2
R2
CHO
2
N N
N N
R
R2
R1
R1
R1
R1
Et2O
1. BuLi, ТГФ
+
мол. сита
2. RX
R
R1 NH HN
R1
Cr(CO)3
Cr(CO)3
Cr(CO)3
33d
58a-e
59a-e, 83-95%
60a-k, 77-95%,
de > 91%
CHO
R
H3O+
Cr(CO)3
(2R)-8a, c-g
53-100%
8a, c-g, R = Me (a), Br (c), Me3Si (d), Me3Sn (e), Ph2P (f), PhS (g); 58a-e, 59a-e, R1 = Me, R2 = Ph (a);
R1 = CH(Ph)(Me); R2 = H (b); R1 = Me, R2 + R2 = (CH2)4 (c); R1 = (CH2)2OMe, R2 + R2 = (CH2)4 (d);
R1 + R2 = (CH2)3 (e); 60a-k, R = R1 = Me, R2 = Ph (a); R = Me, R1 = CH(Ph)(Me), R2 = H (b);
R = R1 = Me, R2 + R2 = (CH2)4 (c); R = Me, R1 = (CH2)2OMe, R2 + R2 = (CH2)4 (d);
R = Me, R1 + R2 = (CH2)3 (e); R = Br, R1 = (CH2)2OMe, R2 + R2 = (CH2)4 (f);
R = Me3Si, R1 = (CH2)2OMe, R2 + R2 = (CH2)4 (g); R = Me3Si, R1 + R2 = (CH2)3 (h);
R = Me3Sn, R1 + R2 = (CH2)3 (i); R = Ph2P, R1 + R2 = (CH2)3 (j);
R = PhS, R1 + R2 = (CH2)3 (k); RX = MeI, (CH2Br)2, Me3SiCl, Me3SnCl, Ph2PCl, (PhS)2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
571
Схема 25
R1
R1
R1
R1
CHO
N N
N N
R1
R1
Me
Me
Me
Me
R
Et2O, rt
+
+
мол. сита
R
R
Me NH HN Me
Cr(CO)3
Cr(CO)3
Cr(CO)3
8a, b, h
58a, c
60b, l-n, 76-78%
R1
R1
N N
MePPh3Br, NaNH2
[P(O)(OEt)2]NaCHCO2Et
Me
Me
Et2O
R
1
R1
Cr(CO)3
16-28%
N N
Me
Me
CO2Et
Cr(CO)3
87%
8a, b, h, R = Me (a), OMe (b), С(O)H (h); 58a, c, R1 = Ph (a), R1 + R1 = (CH2)4 (c);
60b, l-n, R1 + R1 = (CH2)4, R = Me (b), OMe (l); R = С(O)H, R1 = Ph (m), R1 + R1 = (CH2)4 (n).
Схема 26
Me
Me
TMS N
TMS
N
Cr(CO)6, Bu2O
N
N
ТГФ, 140°C
Me
Me
MeO
MeO
(OC)3Cr
OMe
OMe
62
63, 35%, de 84%
H
OH
TMS
CHO
N
HCl, ТГФ
H
MeO
(OC)3
Cr OMe
MeO
OMe
64, 80%
(-)-лазубин (I),
84%, ee > 98%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
572
ГРИШИНА и др.
Схема 27
O
O
O
N
N
N
i
ii
N
N
Ph N
R
i-Pr-O
(OC)3Cr
(OC)3Cr
O-i-Pr
O-i-Pr
анти-65
анти-66, 80%
67a-i, 70-93%, dr > 95:5
O
O
R
O
N
N
N
i
ii
N
Ph N
N
(OC)3Cr
O-i-Pr
i-Pr-O
Cr(CO)3
O-i-Pr
син-65
син-66, 78%
68a-e, 86-94%, dr > 95:5
O
O
N
N
TsOH (2 экв)
N
N
CH2Cl2, ∆
R
R
O-i-Pr
(OC)3Cr
(OC)3Cr
67a, g
69a, b, 78-86%
R
O
R
O
N
TsOH (2 экв)
N
N
N
CH2Cl2, ∆
(OC)3Cr
O-i-Pr
(OC)3Cr
68a, d
70a, b, 77-94%
67a-i, R = Me (a), Ph2C(OH) (b), C(O)H (c), C(O)NHPh (d), SiMe3 (e), Ph2P (f), SMe (g), SnMe2 (h),
D (i); 68a-e, R = Me (a), C(O)H (b), C(O)NHPh (c), SMe (d), D (e); 69a, b, 70a, b, R = Me (a), SMe (b).
Реагенты и условия: i, Cr(CO)6 (1.1 экв), BuOAc (7 экв), октан, Δ, 24 ч;
ii, 1. t-BuLi (1.1 экв), ТГФ, -78°С, 1 ч; 2. RX, -78°С, rt.
RX = MeI, Ph2CO, ДМФА, PhNCO, Me3SiCl, Ph2PCl, (SMe)2, Me3SnCl, CD3(OD)3.
виде флеш-хроматографией, охарактеризованы
лидиндионовым кольцом, получен [53]
трейсер
ИК-, ЯМР-спектроскопией, масс-спектрометрией,
(компонент иммуноанализа) дифенилгидантои-
для соединения 67g проведен РСА.
на 71 (лекарственного препарата, используемого
По реакции этерификации, протекавшей между
при лечении эпилепсии) (схема 28). Применение
хромсодержащим спиртом и кислотой с имидазо-
подобных веществ в качестве биозондов, компо-
Схема 28
Ph
H
N
Ph H
Ph
N
O
Ph
HO
(H2C)2
DCC, DMAP
O
N
+
O
N
O
CH2CO2(CH)2
Cr(CO)3
CH2COOH
Cr(CO)3
71
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
573
Схема 29
Me
Me
Me
CH2N2
H
hν
H
H
CO2Me
CO2Me
CO2Me
N
N
(OC)3Cr
(OC)3Cr
H
H
N
N
72
73, 92%, de 100%
74, 100%
нентов иммуноанализа прежде всего связано с
йодида меди(I) происходит образование хромсо-
наличием очень интенсивных полос поглощения
держащего производного пропаргилового спирта,
карбонильных групп ХТ фрагмента в средней ИК-
которое в присутствии триэтиламина изомеризу-
области, что позволяет производить чувствитель-
ется в енон и претерпевает реакцию присоедине-
ное детектирование даже в сложных биологиче-
ния-циклоконденсации Михаэля под действием
ских матрицах [54].
метилгидразина.
1.2.4. ПРОИЗВОДНЫЕ ПИРАЗОЛА
Получены серу- и селенсодержащие (арен)ХТ
производные пиразола [57]. Реакции конденсации
Стереоселективно получен трициклический
альдегидов 77a-d с (арен)ХТ производным анили-
1-пиразолин в результате циклоприсоединения
на 78a или п-метиланилина 78b, приводившие к
хромсодержащего диполярофила 72 и диазометана
продуктам 79a-f с высокими выходами (70-90%),
(схема 29) [55]. Продукт реакции 73, полученный
протекали в соответствии со схемой 31. При кипя-
с выходом 92%, охарактеризован РСА, который
чении соединений 79a-f с ацетатами металлов в
показал, что метильный и сложноэфирный фраг-
среде этанола получены целевые димерные хелат-
менты располагаются в транс-положении относи-
ные комплексы цинка, кадмия, никеля и ртути.
тельно друг друга. Декомплексация под действи-
ем УФ-облучения данного соединения привела к
К примерам других соединений, содержащих в
количественному образованию соответствующе-
составе одновременно (арен)ХТ фрагмент и пира-
го свободного пиразолина 74. Показано, что ана-
зольное кольцо, можно отнести цинковые и кадми-
логичный процесс с участием диполярофила, не
евые комплексы [58].
содержащего ХТ фрагмент, приводит к диастере-
Получен ряд бициклических индазолов (бен-
оселективному получению продукта с цис-распо-
зопроизводных пиразола) с ХТ группой, коорди-
ложением Me и С(O)OMe групп. Следовательно,
нированной на бензольном кольце [12]. Исходя из
наличие ХТ группы в исходном соединении пол-
свободных от металла индазолов 80 и 81, при их
ностью меняет диастереоселективность процесса.
взаимодействии с ГКХ с выходами 60 и 92% со-
С выходом 63% в результате однореакторного
ответственно синтезированы соединения 82 и 83,
синтеза из (η6-хлорбензол)ХТ, замещенного про-
которые далее подвергали металлированию под
паргилового спирта 75 и метилгидразина синте-
действием BuLi и дальнейшему взаимодействию
зирован 2-пиразолин 76 (схема 30) [56]. Показано,
с электрофильными агентами RX (схема 32). При
что в данном процессе под действием каталити-
этом из индазола 82 получена смесь изомерных
ческой системы на основе комплекса палладия и
хромсодержащих гетероциклов 84-86, из которой
Схема 30
Me
Cl
1. PdCl2(PPh3)2,
CuI, Et3N, ТГФ
N N
+
CH(OH)Ph
2. MeNHNH2
Ph
(OC)3Cr
(OC)3Cr
75
76, 63%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
574
ГРИШИНА и др.
Схема 31
R2
H
Me
C O
R2
rt
Me
N
Cr(CO)3
+
H
N
EtOH, Et2O
H2N
N X
Cr(CO)
3
N
X
N
R1
R1
77a-d
78a, b
79a-f, 70-90%
R2
(MeCO2)2Met
Me
N
Cr(CO)3
EtOH, ∆
Met/2
N
X
N
R1
Met = Zn, Cd, Ni, Hg, 80-90%
77a-d, R1 = Ph, X = S (a), Se (b); R1 = i-Pr, X = S (c), Se (d); 78a, b, R2 = H (a), Me (b);
79a-f, R1 = Ph, X = S, R2 = H (a); R1 = Ph, X = Se, R2 = H (b); R1 = Ph, X = S, R2 = Me (c);
R1 = i-Pr, X = S, R2 = H (d); R1 = i-Pr, X = Se, R2 = H (e); R1 = i-Pr, X = S, R2 = Me (f).
методами колоночной хроматографии удалось в
водными (в том числе бензопроизводными) 1,3- и
чистом виде выделить продукты 84, 85. Реакции
1,4-оксазинов, а также 1,3- и 1,4-диазинов и отно-
соединения 83 с бутиллитием и электрофильными
сятся к оксазинанам, дигидробензоксазинам, мор-
агентами приводили к получению замещенных в
фолинам, феноксазинам, производным пиперази-
положении С7 продуктов 87a-c, а также свободных
на и пиримидина.
от ХТ группы продуктов 88a и 88b. Свободный
2.1. N,O-СОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ
от металла индазол 89 также получен при деком-
плексации гетероцикла 84. Отмечено, что попыт-
2.1.1. ОКСАЗИНАНЫ И ДИГИДРО-
ки построения индазольного кольца из (арен)ХТ
БЕНЗОКСАЗИНЫ
комплекса, содержащего гидразиновый и диоксо-
Шестичленные (арен)ХТ производные гетеро-
лановый фрагменты, привели к получению σ-, а не
циклов с N-C-O связями, как и их пятичленные
π-хромсодержащего производного индазола.
аналоги (см. выше), можно получить реакцией
Среди других пятичленных азотсодержащих
между свободными от ХТ группы гетероциклами и
гетероциклов с двумя и более атомами, отличны-
ТАХТ (метод а), а также в результате конденсации
ми от углерода, и (арен)ХТ группами в составе
хромсодержащих аминоспиртов с карбонильными
есть также соединения с N-Si-O [59], B-N-Si [60],
соединениями (метод b). Среди таких произво-
N-B-O и N-B-N фрагментами [61].
дных известны комплексы на основе оксазинанов
2. ПРОИЗВОДНЫЕ ГЕТЕРОЦИКЛИЧЕСКИХ
(тетрагидро-1,3-оксазинов) 90a, b, 91 (схема 33)
АЗИНОВ С (η6-АРЕН)-
[27, 28, 62] и бициклических соединений — диги-
ХРОМТРИКАРБОНИЛЬНЫМИ ГРУППАМИ
дро-3,1-бензоксазинов 92a-k (схема 34) [63-65].
Гетероциклические азины с (арен)ХТ группами
N-(Арен)ХТ комплексы 90a, b и С(2)-(арен)-
и их производные в меньшей степени представле-
ХТ производное 91 [28] получали методом а из
ны в литературе, чем их пятичленные аналоги. В
соответствующих гетероциклов и ТАХТ при на-
основном они являются гидрированными произ-
гревании в среде диоксана (схема 33). Наименее
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
575
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
576
ГРИШИНА и др.
Схема 33
Cr(CO)3
C(O)Me
C(O)Me
a
a
N
N
;
N R
-3NH3
-3NH3
N R
O
O Cr(CO)3
4
3
2
O
5
1
6
O
90a, b, 19-27%
91, 53%
Cr(CO)3
O
N
OH
b
H
+
H
-H2O
H
N
Cr(CO)
3
O
90a, 22%
R = H (a), Ph (b).
Реагенты и условия: а, (NH3)3Cr(CO)3, 120°С, диоксан; b, толуол, 120°С.
стерически затруднённый продукт 90a удалось по-
делить в чистом виде преобладающие транс-диа-
лучить также альтернативным методом b [27].
стереомеры (изомеры с различным расположени-
ем ХТ группы и заместителя R2 относительно ди-
В свою очередь, большинство хромсодержа-
гидробензоксазинового фрагмента). Полученные
щих дигидро-3,1-бензоксазинов 92a-k получено
вещества охарактеризованы различными метода-
как методом а, так и методом b [63] (схема 34).
ми физико-химического анализа, для ряда из них
Исключение составили реакции ТАХТ с диги-
проведен РСА [27, 62-65].
дро-3,1-бензоксазинами, содержащими проп-1-
2.1.2. МОРФОЛИНЫ
ен-1-ил, фуран-2-ил и пиридин-2-ил в качестве за-
местителей, в этих случаях образование целевого
Продемонстрирована способность (арен)ХТ
продукта не происходило. Те из хромсодержащих
комплексов, содержащих замещенный пропар-
дигидробензоксазинов, для которых заместители
гиловый радикал, претерпевать ионизацию под
R1 и R2 различны (соединения 92b, c , f-k), по-
действием кислот Льюиса и далее реагировать с
лучены [63] в виде диастереомерных смесей, из
нуклеофильными ловушками, в частности морфо-
которых колоночной хроматографией удалось вы-
лином (тетрагидро-1,4-оксазином) (93) (схема 35)
Схема 34
NH2
H
OH
H
1
N R
(OC)3Cr
a
b
N R1
2
R2
+
R
−3NH3
−H2O
O
R1
O
O
(OC)3Cr
R2
92a-k, 25-85%
92a-k, R1 = H, R2 = H (a), Me (b), Ph (c); R1 = R2 = Me (d); R1 + R2 = (CH2)5 (e);
R1 = Me, R2 = Et (f); R1 = H, R2 = Et (g), Bu (h), проп-1-ен-1-ил (i), фуран-2-ил (j), пиридин-2-ил (k).
Реагенты и условия: а, (NH3)3Cr(CO)3, 120°С, диоксан; b, MgSO4 (безвод.), ТГФ, Δ.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
577
Схема 35
H
O
N
OAc
H
2.
1. TMSOTf/SnCl4,
O
H
N
78°C, CH2Cl2
93
H
R
(OC)3Cr
R
(OC)3Cr
Ph
Ph
R
(OC)3Cr
Ph
R = Me (a), Cl (b); TMSOTf = Me3SiOSO3CF3.
94a, b, 71-90%
[66]. Отмеченные реакции протекали через ста-
способствует диастереоселективной миграции ХТ
дию образования замещенных α-пропаргиловых
группы в феноксазиновое/фенотиазиновое бензо-
катионов, взаимодействие которых с морфолином
льное кольцо (схема 37). Образующиеся при этом
(93) приводило к получению целевых комплексов
продукты 101a-d имеют высокие выходы и энан-
94a, b как основных диастереомеров, содержание
тиоселективность на уровне 85-95%.
которых в диастереомерных смесях, установлен-
2.2. N,N-CОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ
ное с помощью 1H ЯМР-спектроскопии, составля-
ло 97-99%.
Среди шестичленных комплексов с двумя ато-
мами азота и (арен)ХТ группой в литературе най-
Показано [67], что действие замещенного ами-
дены сведения о таких соединениях, как пипера-
да лития и галогенпроизводных RX в присутствии
зины (гексагидропиразины, гексагидро-1,4-диа-
каталитической системы на основе палладия по-
зины) [67], пиперазиноны [69-71] и производные
зволяет проводить функционализацию подвижных
пиримидина (1,3-диазина) [72-77].
бензильных протонов ХТ комплекса морфолина
95, что приводит к образованию продуктов 96a-h
Пиперазин с (η6-бензил)ХТ группой при атоме
в большинстве случаев с высокими значениями
азота 102 получен с высоким выходом при взаимо-
выходов и энантиоселективности (схема 36). На
действии ГКХ с соответствующим гетероциклом
примере соединений 96a-d показано, что выдер-
(схема 38) [67]. В процессах, аналогичных описан-
живание их растворов на воздухе при естествен-
ным выше, проведено замещение одного из мети-
ном освещении позволяет получить соответству-
леновых водородов бензильной группы соедине-
ющие свободные от ХТ группы продукты 97a-d.
ния 102 на фенил с образованием пиперазина 103,
Получение данных соединений возможно и при
энантиомерный избыток реакции составил 88%.
выдерживании в тех же условиях концентрирован-
Из антишистосомозного препарата празикван-
ной реакционной смеси, полученной после стадии
тела 104 и ГКХ получены диастереомерные пипе-
арилирования соединения 95 (схема 36).
разиноны 105 и 106 в среде дибутилового эфира и
2.1.3. ФЕНОКСАЗИНЫ
ТГФ (схема 39) [69].
Еще одной группой шестичленных (арен)ХТ
Соединения охарактеризованы различными
производных N,O-содержащих гетероциклов яв-
методами физико-химического анализа, для про-
ляются трициклические соединения - фенокса-
дукта 106 проведен РСА. Установлен высокий ан-
зины [68]. Также представлены их серосодержа-
тишистосомозный эффект исследуемых комплек-
щие аналоги - фенотиазины с (арен)ХТ кольцом.
сов in vitro, показана их хорошая стабильность в
Показано, что реакции хиральных фторзамещен-
плазме человеческой крови. Вещества 105 и 106
ных (арен)ХТ производных диоксоланов 98a, b с
исследованы [70] непосредственно внутри орга-
соединениями 99a-с под действием гидрида на-
низмов, вызывающих шистосомоз, с помощью
трия в присутствии краун-эфира приводят к хром-
масс-спектрометрии с индуктивно связанной
содержащим продуктам
100a-d, выдерживание
плазмой и впервые использованной комбинаци-
которых в среде кипящего толуола в течение 2 ч
ей методов рентгеновской флуоресценции и ИК-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
578
ГРИШИНА и др.
Схема 36
R
H
i
ii
N
N
N
Cr(CO)3
Cr(CO)3
O
O
O
95, 94%
96a-h, 36-80%
iii
1. ii (RX = ROTf,
24°C, 12 ч)
R
H
2. iii
N
O
97a-d
63-91%
ee 86-91% (синтез 97a-d из 95a-d)
96a-h, RX = TfO
Me
(a), ee 92%;
TfO
t-Bu
(b), ee 90%;
TfO
OMe
(c), ee 87%;
TfO
(d), ee 90%; TfO
(e), ee 89%;
Me
Me
Br
Br
NMe2
(f), ee 84%;
(g), ee 62%; TfO
(h), ee 53%;
NSi(i-Pr)3
97a-d, RX = TfO
Me (a); TfO
t-Bu (b);
TfO
OMe (c); TfO
(d).
Me
Реагенты и условия: i, Cr(CO)6, диоксан, ТГФ, 120°С, 2 дня, 94%;
ii, RX, LiN(TMS)2, [Pd/L*] кат., PMDTA, толуол/ТГФ; iii, hν, воздух.
абсорбционной микроскопии, которые показали
хромсодержащего альдегида 8f и 1,8-диаминнаф-
целостность ХТ фрагмента внутри паразитов.
талина (схема 40) [72]. Выход продукта за 12 ч
Несмотря на малоуспешные in vivo испытания
реакции составил 85%. Его дальнейшая последо-
данных препаратов [71], отмечено, что подобные
вательная обработка трет-бутилатом калия и йо-
исследования являются важным стимулом для ис-
дистым метилом позволила получить хиральный
пользования металлотрикарбонильных комплек-
N-метилзамещенный комплекс
108 с выходом
сов в медицинской химии [70, 71].
95%. Полученные соединения успешно примене-
Синтезирован трициклический планарный хи-
ны в качестве катализаторов гидроборирования
ральный гетероцикл 107 реакцией конденсации
замещенных стиролов [72].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
579
Схема 37
O
O
R2
R2
O
O
NaH, 18-crown-6
X
+ HN
X
N
F
толуол, 90°C
R2
R2
1
R1
R
(OC)3Cr
Cr(CO)
3
98a, b
99a-c
100a-d
R2
O
O
X
толуол
N
2 ч, ∆
R2
R1
Cr(CO)3
101a-d, 60-73%, ee 85-95%
98a, b, R1 = Me (a), H (b); 99a-c, X = O, R2 = H (a), Me (b); X = S, R2 = H (c);
100a-d, 101a-d, X = O, R1 = Me, R2 = H (a); X = O, R1 = R2 = H (b);
X = O, R1 = H, R2 = Me (c); X = S, R1 = R2 = H (d).
В результате реакций сочетания нуклеозидов
К производным пиримидина с (арен)ХТ заме-
109a, b и (арен)ХТ комплексов алкинов 110a, b на
стителем в боковой цепи также можно отнести
палладиевых катализаторах получены [73] хром-
мономеры пептидных нуклеиновых кислот (ПНК)
содержащие соединения
111a-c с тиминовым
с молекулой тимина в качестве азотистого осно-
кольцом в составе, являющиеся перспективны-
вания и (η6-фенил)ХТ группами в составе [54,
ми соединениями тонкого органического синтеза
74-77]. Пример таких соединений - вещество 112.
(схема 41).
Получение хромсодержащих ПНК возможно реак-
Схема 38
Cr(CO)6, диоксан,
N
ТГФ
N
Cr(CO)3
105-115°C, 4 дня
N
N
Me
Me
102, 93%
TfO
LiN(TMS)2
H
[Pd/L*] кат., PMDTA,
N
толуол/ТГФ
Cr(CO)3
N
Me
103, 69%, ee 88%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
580
ГРИШИНА и др.
Схема 39
O
N
N
H
O
O
(OC)3Cr
N
Cr(CO)6, Bu2O
105, 50%
+
N
ТГФ, 140°C
O
O
N
104
N
H
O
(OC)3Cr
106, 27%
Схема 40
PPh2
PPh2
H
O
молек. сита,
H2N
N
4Å
C
+
Et2O, 12 ч, ∆
H
H2N
HN
(OC)3Cr
Cr(CO)3
8f
107, 85%
PPh2 Me
N
KOt-Bu
MeI
N
(OC)3Cr
Me
108, 95%
Схема 41
2
R
O
I
R2
HN
C
O
Cr(CO)3
[Pd]
C
O
N
+
-HI
HN
R1O
O
C
Cr(CO)3
HC
O
N
R1O
O
R1O
R1O
109a, b
110a, b
111a-c, 40-76%
109a, b, R1 = H (a), Bz (b); 110a, b, R2 = H (a), Me (b);
111a-c, R1 = R2 =H (a); R1 = COPh, R2 = H (b), Me (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
581
цией конденсации между кислотой, содержащей
O
(арен)ХТ фрагмент, и соединения с аминогруппой
Me
[74], а также в результате реакции Уги [75-77].
HN
Кроме сведений о N,O- и N,N-содержащих про-
O
N
изводных азинов, в литературе найдены примеры
O
шестичленных циклических соединений с (арен)-
O
O
ХТ группами и атомами азота и бора в составе [61,
N
78-80].
N
OMe
H
ЗАКЛЮЧЕНИЕ
Cr(CO)3
Азотсодержащие гетероциклические соедине-
112
ния с двумя и более гетероатомами, обладающие
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
(арен)ХТ фрагментами, представляют большую и
разнообразную группу веществ, для которой ха-
Дополнительные материалы доступны на
рактерно наличие ХТ заместителя либо в боковой
цепи гетероцикла, либо в карбоциклическом коль-
СПИСОК ЛИТЕРАТУРЫ
це конденсированного производного. Наиболее
распространенными методами получения таких
1.
Rosillo M., Dominguez G., Perez-Castells J. Chem.
веществ являются реакции ГКХ или его произ-
Soc. Rev. 2007, 36, 1589-1604. doi 10.1039/b606665h
водных с уже сформированным аренсодержащим
2.
Transition Metal Arene π-Complexes in Organic
гетероциклом, а также процессы конденсации, ци-
Synthesis and Catalysts. Ed. E.P. Kündig. Berlin:
клоприсоединения с участием хромсодержащих
Springer-Verlag, 2004, 7. doi 10.1007/b76615
компонентов, приводящие к образованию гетеро-
3.
Pape A.R., Kaliappan K.P., Kündig E.P. Chem. Rev.
циклического кольца. Наличие объемной стерео-
2000, 100, 2917-2940. doi 10.1021/cr9902852
направляющей ХТ группы и гетероциклического
4.
Schmalz H.-G., Dehmel F. Transition Metals
фрагмента в одной молекуле обеспечивает боль-
for Organic Synthesis. 2nd Edn. Eds. M. Beller,
шой потенциал для разработки методов примене-
C. Bolm. Weinheim: Wiley-VCH, 2004, 1, 601-617.
ния подобных комплексов в биологии, медицине,
doi 10.1002/9783527619405
тонком органическом синтезе. Большая часть ис-
5.
Davies S.G., McCarthy T.D. Comprehensive Organo-
следуемых веществ уже зарекомендовала себя в
metallic Chemistry II. Eds. E.W. Abel, F.G.A. Stone,
качестве компонентов для проведения высокосте-
G. Wilkinson. Oxford: Pergamon, 1995, 12, 1039-
реоселективных реакций.
1070. doi 10.1016/B978-008046519-7.00135-0
6.
Semmelhack M.F. Comprehensive Organometallic
ФОНДОВАЯ ПОДДЕРЖКА
Chemistry II. Eds. E.W. Abel, F.G.A. Stone,
Работа выполнена при финансовой поддерж-
G. Wilikinson. Oxford: Pergamon, 1995, 12, 979-1015.
ке Министерства науки и высшего образования
doi 10.1016/B978-008046519-7.00133-7
Российской Федерации, проект № 0729-2020-0039
7.
Semmelhack M.F. Comprehensive Organometallic
в рамках базовой части государственного задания.
Chemistry II. Eds. E.W. Abel, F. G.A. Stone,
ИНФОРМАЦИЯ ОБ АВТОРАХ
G. Wilikinson. Oxford: Pergamon, 1995, 12, 1017-
1038. doi 10.1016/B978-008046519-7.00134-9
Гришина Наталия Юрьевна, ORCID: https://
orcid.org/0000-0003-2258-496X
8.
Chinchilla R., Najera C., Yus M. Chem. Rev. 2004, 104,
2667-2722. doi 10.1021/cr020101a
Сазонова Елена Васильевна, ORCID: https://
9.
Joule J.A., Mills K. Heterocyclic Chemistry. 5th Edn.
orcid.org/0000-0003-1372-1096
Chichester: Blackwell Publishing Ltd, 2010, 629-664.
Артемов Александр Николаевич, ORCID:
10.
Katritzky A.R., Ramsden C.A., Joule J.A., Zdan-
kin V.V. Handbook of Heterocyclic Chemistry. 3rd Edn.
КОНФЛИКТ ИНТЕРЕСОВ
Oxford: Elsevier, 2010. doi 10.1016/C2009-0-05547-0
Авторы заявляют об отсутствии конфликта ин-
11.
Wolfgramm R., Laschat S. J. Organometal. Chem. 1999,
тересов.
575, 141-144. doi 10.1016/S0022-328X(98)00987-5
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
582
ГРИШИНА и др.
12.
Da Costa M.R.G., Curto M.J.M., Davies S.G., Duar-
Cherkasov A.V., Faerman V.I., Grishina N.Yu. Russ.
te M.T., Resende C., Teixeira F.C. J. Organometal.
Chem. Bull. 2018, 67, 884-892.] doi 10.1007/s11172-
Chem.
2000,
604,
157-169. doi
10.1016/S0022-
018-2153-0
328X(00)00215-1
28.
Артемов А.Н., Сазонова Е.В., Аксенова Н.А., Фу-
13.
Prokesova M., Тoma S. Chem. Papers. 1993, 47, 314-
кин Г.К., Черкасов А.В., Фаерман В.И., Гриши-
316.
на Н.Ю. Изв. АН. Сер. хим. 2019, 68, 1548-1554.
[Artemov A.N., Sazonova E.V., Aksenova N.A., Fu-
14.
Fretzen A., Ripa A., Liu R., Bernardinelli G.,
kin G.K., Cherkasov A.V., Faerman V.I., Grishi-
Kündig E.P. Chem. Eur. J. 1998, 4, 251-259. doi
na N.Yu. Russ. Chem. Bull. 2019, 68, 1548-1554.] doi
10.1002/(SICI)1521-3765(19980210)4:2<251::AID-
10.1007/s11172-019-2590-4
CHEM251>3.0.CO;2-9
29.
Semmelhack M.F., Knochel P., Singleton T.
15.
Bernardinelli G., Gillet S., Kündig E.P., Liu R., Ri-
Tetrahedron Lett. 1993, 34, 5051-5054. doi 10.1016/
pa A., Saudan L. Synthesis. 2001, 13, 2040-2054. doi
S0040-4039(00)60673-1
10.1055/s-2001-17704
30.
Kamikawa K., Tachibana A., Sugimoto S., Uemura M.
16.
Ylijoki K.E.O., Lavy S., Fretzen A., Kündig E.P.
Org. Lett. 2001, 3, 2033-2036. doi 10.1021/ol010076f
Organometallics. 2012, 31, 5396-5404. doi 10.1021/
31.
Mukai C., Cho W.J., Kim I.J., Hanaoka M. Tetrahedron
om300427j
Lett.
1990,
31,
6893-6896. doi
10.1016/S0040-
17.
Djukic J.-P., Maisse-Francüois A., Pfeffer M.,
4039(00)97200-9
Dötz K.H., DeCian A., Fischer J. Organometallics.
32.
Mukai C., Kim I.J, Cho W.J., Kido M., Hanaoka M.
2000, 19, 5484-5499. doi 10.1021/om0006920
J. Chem. Soc., Perkin Trans. 1. 1993, 2495-2503. doi
18.
Tweddell J., Hoic D.A., Fu G.C. J. Org. Chem. 1997,
10.1039/P19930002495
62, 8286-8287 doi 10.1021/jo971757k
33.
Артемов А.Н., Сазонова Е.В., Заровкина Н.Ю. Изв.
19.
Overman L.E., Owen C.E., Zipp G.G. Angew.
АН. Сер. Хим. 2013, 62, 1382-1387. [Artemov A.N.,
Chem., Int. Ed.
2002,
41,
3884-3887. doi
Sazonova E.V., Zarovkina N.Yu. Russ. Chem. Bull.
10.1002/1521-3773(20021018)41:20<3884::AID-
2013, 62, 1382-1387.] doi 10.1007/s11172-013-0197-
ANIE3884>3.0.CO;2-0
8
20.
Werlé C., Le Goff X.-F., Djukic J.-P.
34.
Артемов А.Н., Сазонова Е.В., Маврина Е.А., За-
J. Organomet. Chem. 2014, 751, 754-759. 10.1016/
ровкина Н.Ю. Изв. АН. Сер. Хим. 2012, 61, 2059-
j.jorganchem.2013.07.070
2064. [Artemov A.N., Sazonova E.V., Mavrina E.A.,
Zarovkina N.Yu. Russ. Chem. Bull. 2012, 61, 2076-
21.
Overman L.E., Owen C.E., Pavan M.M. Org. Lett.
2081.] doi 10.1007/s11172-012-0290-4
2003, 5, 1809-1812. doi 10.1021/ol0271786
35.
Заровкина Н.Ю., Сазонова Е.В., Артемов А.Н.,
22.
Davies S.G., Goodfellow C.L. J. Chem. Soc., Perkin
Фукин Г.К. Изв. АН. Сер. Хим. 2015, 64, 923-929.
Trans. 1. 1989, 192-194. doi 10.1039/P19890000192
[Zarovkina N.Yu., Sazonova E.V., Artemov A.N.,
23.
Bromley L.A., Davies S.G., Goodfellow C.L.
Fukin G.K. Russ. Chem. Bull. 2015, 64, 923-929.] doi
Tetrahedron Asymmetry.
1991,
2,
139-156. doi
10.1007/s11172-015-0956-9
10.1016/S0957-4166(00)80533-9
36.
Гришина Н.Ю., Сазонова Е.В., Артемов А.Н., Фу-
24.
Besson L., Le Bail M., Aitken D.J., Husson H.-P.,
кин Г.К., Фаерман В.И. Изв. АН. Сер. хим. 2017,
Rose-Munch F., Rose E. Tetrahedron Lett. 1996, 37,
66, 313-319. [Grishina N.Yu., Sazonova E.V., Arte-
3307-3308. doi 10.1016/0040-4039(96)00520-5
mov A.N., Fukin G.K., Faerman V.I. Russ. Chem. Bull.
25.
Woodgate P.D., Singh Y., Rickard C.E.F. J. Organomet.
2017, 66, 313-319.] doi 10.1007/s11172-017-1733-8
Chem.
1998,
560,
197-209. doi
10.1016/S0022-
37.
Заровкина Н.Ю., Сазонова Е.В., Артемов А.Н.
328X(98)00492-6
ЖОрХ. 2014,
50,
1044-1048.
[Zarovkina N.Yu.,
26.
Habib O.M.A., Zhao-Karger Z., Abdelhamid I.A.,
Sazonova E.V., Artemov A.N. Russ. J. Org. Chem. 2014,
Wartchow R., Butenschön H. Eur. J. Org. Chem. 2010,
50, 1028-1032.] doi 10.1134/S1070428014070161
6072-6083. doi 10.1002/ejoc.201000758
38.
Fukin G.K., Cherkasov A.V., Zarovkina N.Yu.,
27.
Артемов А.Н., Сазонова Е.В., Крылова Н.А., Зве-
Artemov A.N. ChemistrySelect. 2016, 1, 5014-5018.
рева Е.А., Печень Н.А., Фукин Г.К., Черкасов А.В.,
doi 10.1002/slct.201601100
Фаерман В.И., Гришина Н.Ю. Изв. АН. Сер. хим.
39.
Baldoli C., Buttero P.D., Licandro E., Maiorana S.,
2018, 67, 884-892. [Artemov A.N., Sazonova E.V.,
Papagni A. Tetrahedron Asymmetry. 1995, 6, 1711-
Krylova N.A., Zvereva E.A., Pechen N.A., Fukin G.K.,
1717. doi 10.1016/0957-4166(95)00217-D
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
ПРОИЗВОДНЫЕ АЗОЛОВ И ГЕТЕРОЦИКЛИЧЕСКИХ АЗИНОВ
583
40.
Baldoli C., Buttero P.D., Maiorana S., Zecchi G.
(SICI)1521-3773(20000403)39:7<1253::AID-
Tetrahedron Lett. 1993, 34, 2529-2532. doi 10.1016/
ANIE1253>3.0.CO;2-X
S0040-4039(00)60460-4
57.
Uraev A.I., Nivorozhkin A.L., Frenkel A.S.,
41.
Заровкина Н.Ю., Сазонова Е.В., Артемов А.Н.,
Konstantinovsky L.E., Magomedov G.K.-I., Garnovs-
Фукин Г.К. Изв. АН. Сер. Хим. 2014, 63, 970-975.
ky A.D. J. Organometal. Chem. 1989, 368, 303-314.
[Zarovkina N.Yu., Sazonova E.V., Artemov A.N.,
doi 10.1016/0022-328X(89)85408-7
Fukin G.K. Russ. Chem. Bull. 2014, 63, 970-975.] doi
58.
Murugesapandian B., Roesky P.W. Z. Anorg. Allg. Chem.
10.1007/s11172-014-0535-5
2011, 637, 1818-1823. doi 10.1002/zaac.201100355
42.
Abecassis K., Gubson S.E., Martin-Fontecha M.
59.
Chung T.-M., Lee Y.-A., Chung Y.K., Jung I.N.
Eur. J. Org. Chem. 2009, 1606-1611. doi 10.1002/
Organometallics. 1990, 9, 1976-1979. doi 10.1021/
ejoc.200900007
om00156a046
43.
Moret M.-E., Chaplin A.B., Lawrence A.K., Scopelli-
60.
Köster R., Seidel G., Krüger C., Müller G., Jiang A.,
ti R., Dyson P.J. Organometallics. 2005, 24, 4039-
Boese R. Chem. Ber. 1989, 122, 2075-2083. doi
4048. doi 10.1021/om050283+
10.1002/cber.19891221106
44.
Pérez V., Barnes S.S., Fontaine F.G. Eur. J. Inorg. Chem.
61.
Goetze R., Nöth H. J. Organometal. Chem. 1978, 145,
2014, 33, 5698-5702. doi 10.1002/ejic.201402691
151-156. doi 10.1016/S0022-328X(00)91120-3
45.
Djukic J.-P., Michon C., Berger A., Pfeffer M.,
62.
Фукин Г.К., Баранов Е.В., Черкасов А.В., Румян-
DeCian A., Kyritsakas-Gruber N. J. Organometal.
цев Р.В., Артемов А.Н., Сазонова Е.В. Kоординац.
Chem. 2006, 691, 846-858. doi 10.1002/ejic.201402691
хим. 2019, 45, 584-592. [Fukin G.K., Baranov E.V.,
46.
Alexakis A., Kanger T., Mangeney P., Rose-Munch F.,
Cherkasov A.V., Rumyantcev R.V., Artemov A.N.,
Perrotey A., Rose E. Tetrahedron Asymmetry. 1995, 6,
Sazonova E.V. Russ J. Coord. Chem. 2019, 45, 680-
47-50. doi 10.1016/0957-4166(94)00348-F
688.] doi 10.1134/S0132344X19090044
47.
Alexakis A., Tomassini A., Andrey O., Bernardinel-
63.
Сазонова Е.В., Артемов А.Н., Фаерман В.И., Ак-
li G. Eur. J. Org. Chem. 2005, 1332-1339. doi 10.1002/
сенова Н.А., Тимофеева А.А., Зайцева Ю.А., Со-
ejoc.200400662
мов Н.В., Гришина Н.Ю. Изв. АН. Сер. хим. 2021,
48.
Alexakis A., Mangeney P., Marek I. J. Am. Chem. Soc.
70, 171-178. [Sazonova E.V., Artemov A.N., Faer-
1992, 114, 8288-8290. doi 10.1021/ja00047a049
man V.I., Aksenova N.A., Timofeeva A.A., Zaytse-
49.
Rose-Munch F., Gagliardini V., Perrotey A., Tran-
va Y.A., Somov N.V., Grishina N.Yu. Russ. Chem.
chier J.-P., Rose E., Mangeney P., Alexakis A., Kan-
Bull. 2021, 70, 171-178.] doi 10.1007/s11172-021-
ger T., Vaissermann J. Chem. Commun. 1999, 2061-
3073-y
2062. doi 10.1039/A906043J
64.
Fukin G.K., Cherkasov A.V., Rumyantcev R.V.,
50.
Ratni H., Kündig E.P. Org. Lett. 1999, 1, 1997-1999.
Grishina N.Yu., Sazonova E.V., Artemov A.N.,
doi 10.1021/ol991158v
Stash A.I. Mendeleev Commum. 2019, 29, 346-348.
51.
Vinokurov N., Garabatos-Perera J.R., Zhao-Karger Z.,
doi 10.1016/j.mencom.2019.05.036
Wiebcke M., Butenschön H. Organometallics. 2008,
65.
Fukin G.K., Cherkasov A.V., Baranov E.V., Rumyan-
27, 1878-1886. doi 10.1021/om701242t
tcev R.V., Sazonova E.V., Artemov A.N.
52.
Wilson-Konderka C., Doxtator K., Metallinos C. Adv.
ChemistrySelect. 2019, 4, 10976-10982. doi 10.1002/
Synth. Catal. 2016, 358, 2599-2603. doi 10.1002/
slct.201901394
adsc.201600369
66.
Netz A., Polborn K., Muller T.J.J. J. Am. Chem. Soc.
53.
Varenne A., Vessières A., Brossier P., Jaouen G. Res.
2001, 123, 3441-3453. doi 10.1021/ja0037116
Commun. Chem. Pathol. Pharmacol. 1994, 84, 81-92.
67.
McGrew G.I., Stanciu C., Zhang J., Carroll P.J., Dre-
54.
Биометаллоорганическая химия. Ред. Ж. Жауэна.
her S.D., Walsh P.J. Angew. Chem., Int. Ed. 2012, 51,
Москва: Бином.
2015.
[Bioorganometallics: Bio-
11510-11513. doi 10.1002/anie.201201874
molecules, Labeling, Medicine. 2nd Edn. Ed. G. Jaouen.
Weinheim: Willey-VCH, 2005.]
68.
Mori A., Kinoshita S., Furusyo M., Kamikawa K.
55.
Mercier P.R., Douglade J., Vebrel J. Acta Crystallogr.,
Chem. Commun. 2010, 46, 6846-6848. doi 10.1039/
Sect. C.
1983,
39,
1177-1180. doi
10.1107/
c0cc00836b
S0108270183007829
69.
Patra M., Ingram K., Pierroz V., Ferrari S., Spingler B.,
56.
Muller T.J.J., Ansorge M., Aktah D. Angew.
Gasser R.B., Keiser J., Gasser G. Chem. Eur. J. 2013,
Chem., Int. Ed. 2000, 39, 1253-1256. doi 10.1002/
19, 2232-2235. doi 10.1002/chem.201204291
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022
584
ГРИШИНА и др.
70. Clède S., Cowan N., Lambert F., Bertrand H.C.,
75. Baldoly C., Maiorana S., Licandro E., Zinzalla G.,
Rubbiani R., Patra M., Hess J., Sandt C., Trcera N.,
Perdicchia D. Org. Lett. 2002, 4, 4341-4344. doi
Gasser G., Keiser J., Policar C. ChemBioChem. 2016,
10.1021/ol026994a
17, 1004-1007 doi 10.1002/cbic.201500688
76. Baldoly C., Giannini C., Licandro E., Maiorana S.,
71. Patra M., Ingram K., Leonidova A., Pierroz V., Ferra-
Zinzalla G. Synlett. 2004, 6, 1044-1048. doi 10.1055/
ri S., Robertson M.N., Todd M.H., Keiser J., Gas-
s-2004-822886
ser G. J. Med. Chem. 2013, 56, 9192-9198. doi
10.1021/jm401287m
77. Baldoly C., Cerea P., Giannini C., Licandro E.,
72. Son S.U., Jang H.-Y., Lee I.S., Chung Y.K.
Rigamonti C., Maiorana S. Synlett. 2005, 13, 1984-
Organometallics. 1998, 17, 3236-3239. doi 10.1021/
1994. doi 10.1055/s-2005-871950
om980228j
78. Ashe A.J., Fang X., Fang X., Kampf J.W.
73. Etheve-Quelquejeu M., Tranchier J.-P., Rose-
Organometallics. 2001, 20, 5413-5418. doi 10.1021/
Munch F., Rose E., Naesens L., De Clercq E.
om0106635
Organometallics. 2007, 26, 5727-5730 doi 10.1021/
om700674v
79. Rohr A.D., Kampf J.W., Ashe A.J. Organometallics.
2014, 33, 1318-1321 doi 10.1021/om401077k
74. Hess A., Metzler-Nolte N. Chem. Commun. 1999, 885-
886. doi 10.1039/A901561B
80. Huttner G., Krieg B. Chem. Ber. 1972, 105, 3437-3444.
The Derivatives of Azoles and Heterocyclic Azines
with (η6-Arene)tricarbonylchromium Substitutes
N. Yu. Grishina*, E. V. Sazonova, and A. N. Artemov
Lobachevsky State University of Nizhny Novgorod, prosp. Gagarina, 23/5, Nizhny Novgorod, 603950 Russia
*e-mail: zarovkinan@mail.ru
Received December 10, 2021; revised December 17, 2021; accepted December 20, 2021
The review at first presents and summarizes the methods for the preparation, properties and the ways of ap-
plication of five- and six-membered heterocyclic compounds with two heteroatoms one of which is nitrogen
containing (η6-arene)tricarbonylchromium fragments. Much attention is paid to highly selective processes, the
occurrence of which is due to the presence of a tricarbonylchromium fragment in the reacting molecules that
have found application in fine organic synthesis and biomedical chemistry. Supporting information of the article
contains tables that systematize some properties of the studied compounds.
Keywords: (arene)tricarbonylchromium, heterocyclic compounds, triamminetricarbonylchromium, hexacar-
bonylchromium, oxazolines, oxazolidines, isoxazolidines, imidazolidines, oxazinanes, dihydrobenzoxazines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 6 2022