ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 7, с. 706-717
УДК 547.493
СИНТЕЗ И АНТИХОЛИЭСТЕРАЗНАЯ АКТИВНОСТЬ
НЕКОТОРЫХ 2,5-ДИЗАМЕЩЕННЫХ ИМИДАЗОЛ-
4-ОНОВ - ПРОИЗВОДНЫХ ХРОМОФОРА ЗЕЛЕНОГО
ФЛУОРЕСЦЕНТНОГО БЕЛКА
© 2022 г. В. О. Топузянa, А. А. Оганесяна, А. Т. Макичяна, b, *, Л. С. Унанянb
a Научно-технологический центр органической и фармацевтической химии НАН РА,
Армения, 0014 Ереван, просп. Азатутян, 26
b ГОУ ВПО Российско-Армянский университет, Армения, 0051 Ереван, ул. Овсепа Эмина, 123
*e-mail: ani.makichyan@rau.am
Поступила в редакцию 15.11.2021 г.
После доработки 12.12.2021 г.
Принята к публикации 16.12.2021 г.
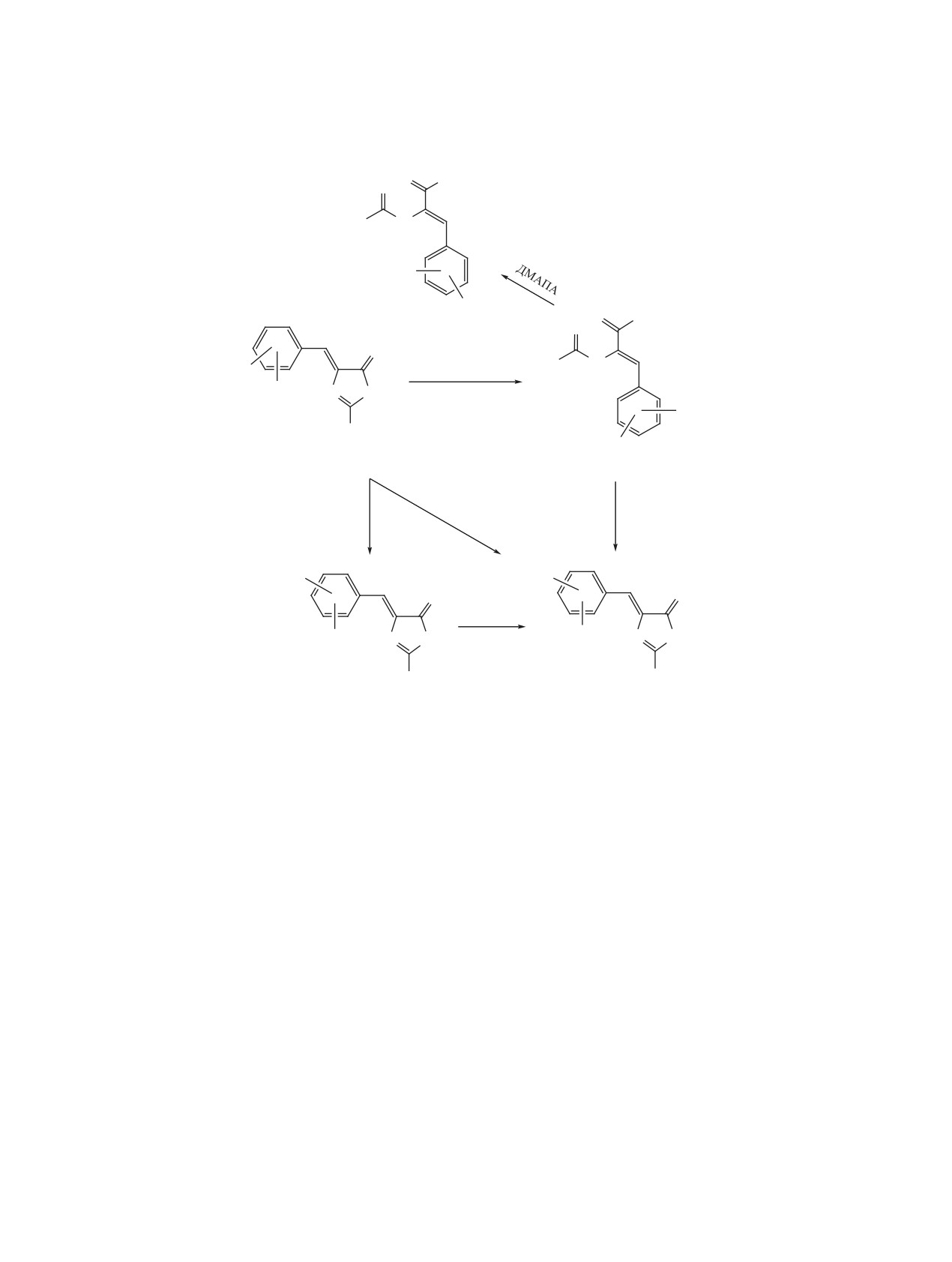
Взаимодействием 2-фенил-4-(4-бензоилоксиарилиден)-5(4Н)-оксазолонов с 1,1,1,3,3,3-гексаметилди-
силазаном в зависимости от условий реакции были синтезированы первичные амиды N,О-дибензо-
ил-α,β-дегидротирозинов (этилацетат, 25°С) и 2-фенил-5-(гидроксибензилиден)-4-имидазолоны (ДМФА,
140°С). Исследованы антирадикальные и антихолинэстеразные свойства синтезированных соединений.
Соединения с бензоильной О-защитной группой по антирадикальным свойствам уступают производным,
содержащим α,β-дегидротирозиновый остаток. Первичные амиды N-бензоил-α,β-дегидротирозинов по
антихолинэстеразным свойствам, в основном, уступают соответствующим 4-имидазолонам.
Ключевые слова: α,β-дегидроаминокислота, имидазол-4-он, антирадикальная активность, антихолин-
эстеразная активность
DOI: 10.31857/S0514749222070035, EDN: CZBKQI
ВВЕДЕНИЕ
ся в пределах 52-89%. В случае же применения в
качестве растворителя ДМФА и кипячения реак-
Известно, что 4-имидазолоны проявляют раз-
ционной смеси (0.5 ч) образуются 2,4-дизамещен-
личные биологические свойства [1-6]. Настоящая
ные 5-имидазолоны 12, 13 с выходами 75.9 и 61%
работа посвящена синтезу и изучению антиради-
соответственно. Увеличение продолжительности
кальных и антихолинэстеразных свойств некото-
времени нагревания реакционной смеси до 1.5 ч,
рых производных хромофора зеленого флуорес-
наряду с дегидратацией, приводит к удалению
центного белка - 2,5-дизамещенных 4-имидазоло-
бензоильной О-защитной группы с образованием
нов.
производных
5-гидроксиарилиден-4-имидазоло-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
нов 14-17 (схема 1).
Синтез целевых соединений осуществлен вза-
Такой же результат получен при реакции окса-
имодействием ненасыщенных 5(4Н)-оксазолонов
золона 1 и ГМДС в присутствии 3-диметилами-
1-4 с 1,1,1,3,3,3-гексаметилдисилазаном (ГМДС)
но-1-пропиламина (ДМАПА). В последнем слу-
при различных условиях. В случае проведения ре-
чае 4-имидазолон 14 получен с выходом 84% при
акции в этилацетате при комнатной температуре
кипячении реакционной смеси в течение 1 ч. Из
получены первичные амиды N,О-дибензоил-α,β-
производных α,β-дегидротирозинов 5-8 и 4-ими-
дегидротирозинов 5-8, выход которых колеблет-
дазолонов 12 и 13 О-бензоильную группу удаляли
706
СИНТЕЗ И АНТИХОЛИЭСТЕР
АЗНАЯ АКТИВНОСТЬ
707
Схема 1
O
NH2
O
N
Ph
H
R
OH
O
NH2
9-11
O
O
Ph
N
R
ГМДС
H
OBz N O
Этилацетат, 25°C
R
Ph
BzO
1-4
5-8
ГМДС
ДМФА,
ДМФА,
ГМДС
ДМАПА
150°C
150°C
R
R
O
O
ДМАПА
OBz
OH
N NH
N NH
Ph
Ph
12, 13
14-17
1, 5, 12, R = H, OBz-4; 2, 6, 13, R = 3-OMe, OBz-4; 3, 7, R = 3-OEt, OBz-4; 4, 8, R = 5-Br, OBz-2;
9, 14, R = H, OH-4; 10, 15, R = 3-OMe, OH-4; 11, 16, R = 3-OEt, OH-4; 17, R = 5-Br, OH-2.
реакцией с ДМАПА в среде ацетонитрила. При
Исследованы также антихолинэстеразные
этом с хорошими выходами получены амиды 9-13
свойства синтезированных соединений 5-17 в
и 4-имидазолоны 14 и 15.
отношении как ацетилхолинэстеразы (АХЭ), так
и бутирилхолинэстеразы (БуХЭ). Согласно дан-
В спектрах ЯМР синглетный сигнал CH=C ви-
ным, приведенным в табл. 1, все исследованные
нильного протона соединений 5-11 наблюдается
соединения обладают антихолинэстеразной актив-
при 7.20-7.25 м.д., a 12-17 - при 6.88-7.11 м.д., что
ностью. В случае АХЭ она колеблется в пределах
свидетельствует о Z-конфигурации этих веществ.
28-94%, а БуХЭ - 11-96%.
С применением стабильного радикала - 2,2'-ди-
При этом по ингибирующим свойствам из ами-
фенил-1-пикрилгидразила (ДФПГ●) - исследова-
дов α,β-дегидроаминокислот 5-11 сравнительно
ны антирадикальные свойства соединений 5-17
(табл. 1). Согласно полученным данным по инги-
высокую антихолинэстеразную активность про-
бированию ДФПГ● производные α,β-дегидроти-
являет амид N-бензоил-α,β-дегидро-3-метокси-О-
розина 9-11 и 5-гидроксибензилиден-4-имидазо-
бензоилтирозин (6, АХЭ - 75%; БуХЭ - 81%), тог-
лона 14-17 превосходят их О-бензоильные анало-
да как из соответствующих 4-имидазолонов 12-17
ги (5-8 и 12, 13). Из данных табл. 1 видно, что в
сравнительно высокую антихолинэстеразную
ряду соединений 5-17 высокой антирадикальной
активность проявляет 2-фенил-5-(4-гидроксибен-
активностью (99%) обладает амид N-бензоил-α,β-
зилиден)-4-имидазолон (14, АХЭ - 90%; БуХЭ -
дегидро-3-метокситирозина (10).
100%). Из данных табл. 1 видно, что при переходе
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
708
ТОПУЗЯН и др.
Таблица 1. Антирадикальная и антихолинэстеразная активность соединений 5-17
Ингибирование, %
Соединение
ДФПГ●
АХЭ
БуХЭ
5
7
67.2
46
6
7.5
75.2
81
7
9.7
28
74.4
8
31.9
51.35
87.5
9
67.1
31.9
67.1
10
99.1
44.8
33.3
11
79.8
69.6
52.4
12
23.5
94.8
96
13
35.8
48.4
11.3
14a
78.5
90
100
15
77.7
91.4
94.8
16
72.2
79.6
69.4
17
55.2
88.2
71.2
a При уменьшении концентрации соединения 14 в 2 раза антихолинэстеразная активность составляет:АХЭ - 21.6%, БуХЭ -59.2%
от амидов α,β-дегидроаминокислот 5-11 к 4-ими-
данному критерию. Был рассчитан также коэффи-
дазолонам 12-17 антихолинэстеразная активность
циент синтетической доступности. Также произ-
в отношении обоих ферментов возрастает.
веден прогноз возможной токсичности соедине-
ний 5-17, рассмотрены мутагенность, канцероген-
С использованием платформы SwissAdme [7]
ность и раздражающее действие на кожу и глаза
были рассчитаны фармакокинетические характе-
[11].
ристики соединений 5-17 (табл. 1S, дополнитель-
Оценка мутагенности соединения 8 привела к
ные материалы). Полученные результаты свиде-
положительному результату, а прогноз канцеро-
тельствуют о том, что показатель всасываемости
генности у всех соединений оказался отрицатель-
через желудочно-кишечный тракт на основе мето-
ным. Раздражающее действие на кожу и глаза у
да оценки проницаемости Эгана [8] имеет высокое
всех исследуемых соединений отсутствует.
значение для всех исследуемых соединений.
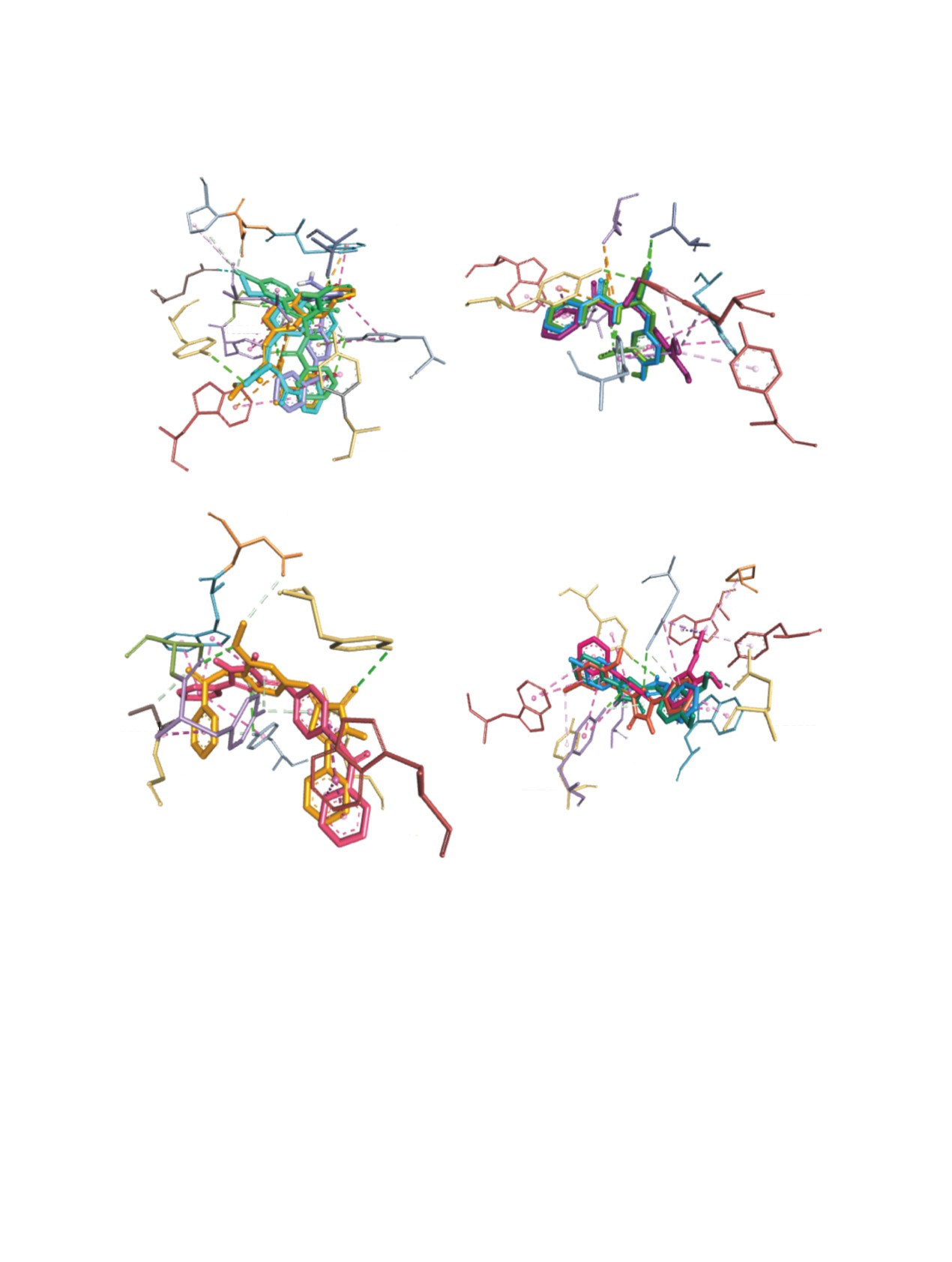
По результатам молекулярного докинга было
Переход через гематоэнцефалический барьер
выявлено, что все соединения 5-17 взаимодей-
(ГЭБ) имеет иную картину: соединения 5-11 пока-
ствуют с активным центром как АХЭ, так и БуХЭ.
зали отрицательный результат прохождения через
Были получены пространственно-энергетические
ГЭБ.
характеристики взаимодействия для всех комплек-
сов (табл. 2). Необходимо отметить, что соеди-
Важной характеристикой является соответ-
нение 7 проявляет к БуХЭ специфичность с кон-
ствие критерию «правила пяти» Липинского [9],
стантой связывания 6×107 моль-1, а соединение
все исследуемые соединения соответствуют дан-
8 имеет высокие показатели взаимодействия для
ному критерию. Было рассчитано также значение
2 белков-мишеней. С точки зрения конформаци-
биодоступности, которое составило 0.55 по шкале
онного анализа все соединения взаимодействуют
Abbot (ABS) [10].
с аминокислотными остатками, формирующими
С точки зрения оценки свойств «соединения-
участки активных центров АХЭ (рис. 1) и БуХЭ
лидера» соединения 5-8 и 12, 13 не соответствуют
(рис. 2).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ И АНТИХОЛИЭСТЕР
АЗНАЯ АКТИВНОСТЬ
709
Таблица 2. Рассчитанные значения биофизических параметров комплексообразования соединений 5-17 с АХЭ и
БуХЭ
АХЭ
БуХЭ
константа
константа
энергия связывания
энергия связывания
связывания
связывания
(ΔG, ккал/моль)
(ΔG, ккал/моль)
(Kc, моль-1)
(Kc, моль-1)
5
-9.18±0.46
4.9×106
-10.28±0.40
3×107
6
-8.99±0.48
4×106
-10.22±0.38
3×107
7
-8.93±0.50
3×106
-10.68±0.42
6×107
8
-9.67±0.47
1×107
-9.97±0.44
1.8×107
9
-8.7±0.49
2×106
-8.86±0.45
3×106
10
-8.58±0.44
2×106
-8.78±0.47
3×106
11
-9.13±0.47
5×106
-9.2±0.50
5×106
12
-9.9±0.40
1.6×106
-9.5±0.48
9×106
13
-9.05±0.46
3.9×106
-10±0.50
1.9×107
14
-8.86±0.48
2×106
-8.96±0.44
3×106
15
-8.67±0.49
2×106
-9.19±0.46
5×106
16
-8.55±0.50
1.6×106
-8.89±0.48
3×106
17
-8.6±0.49
1.8×106
-8.9±0.50
3×106
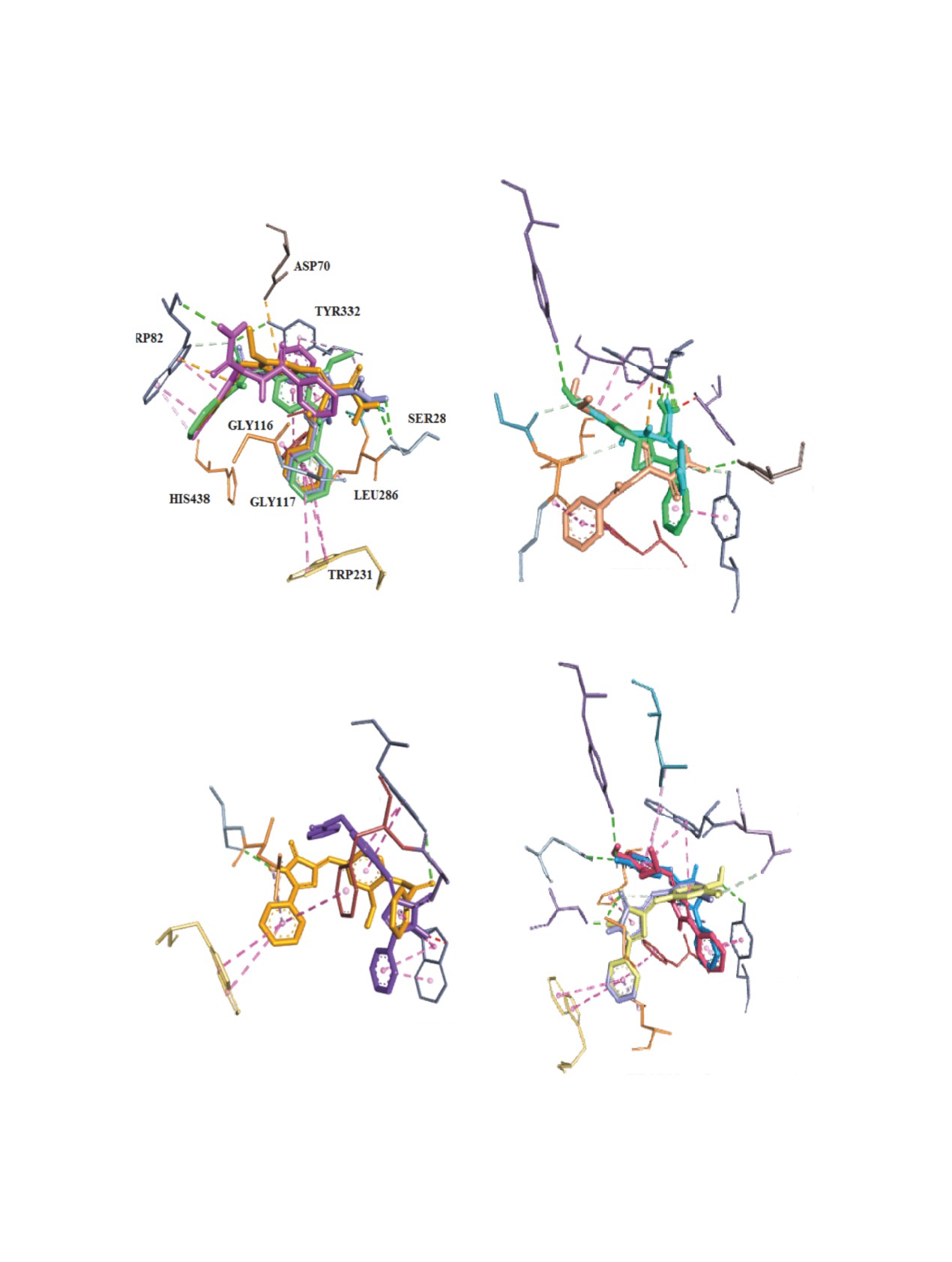
При этом в основном преобладает гидрофоб-
О-бензоил-4-имидазолины 12 и 13 связываются с
ный тип взаимодействия с аминокислотными
ALA328, ASP70 и HIS438.
остатками, формирующими активный центр бел-
Таким образом, осуществлен синтез первич-
ка-мишени. Определены также водородные свя-
ных амидов N-бензоил-α,β-дегидротирозинов и
зи (длина связей не превышает 3.0-3.5 Å). Так, у
их 4-имидазолонов - 2,5-дизамещенных аналогов
ацетилхолинэтеразы (АХЭ) (табл. 2S, дополни-
зеленого флуоресцентного белка, которые прояв-
тельные материалы) практически все соединения
ляют антирадикальные и антихолинэстеразные
взаимодействуют с ТYR337 водородными связя-
свойства.
ми. Основная часть исследуемых соединений вза-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
имодействуют также с TRP86, TRP286, TYR124
Температуру плавления измеряли на приборе
и TYR341. Для О-бензоильных производных как
Boetus (Германия). ИК спектры сняты в вазелино-
α,β-дегидротирозина 5-8, так и 4-имидазолона 12,
вом масле на спектрометре Specord M-80. Спектры
13 общим также является связывание с аминокис-
ЯМР 1H и 13C растворов соединений в ДМСО-d6
лотными остатками ASP74 и THR83.
сняты на спектрометре Mercury-300 (300 МГц).
Полученные результаты для бутилихолинэ-
Элементный анализ выполнен на анализаторе
стеразы (табл. 3S, дополнительные материалы)
EuroEA3000 CHNS-O. Чистоту полученных со-
свидетельствуют о том, что все синтезированные
единений определяли методом ТСХ (на пластин-
соединения 5-17 связываются с TRP82 и TYR332.
ках AlugramXtraSILG/UV) в системе растворите-
Кроме этого, для О-бензоильных аналогов α,β-де-
лей C6H6-MeOH-CH3COOH, 5:2:1, проявление -
УФ лучи.
гидротирозина 5-8 общим для связывания явля-
ются аминокислотные остатки активного центра
Ненасыщенные 5(4H)-оксазолоны 1-4 синте-
БуХЭ - GLY116, GLY117 и PHE329, тогда как
зированы аналогично методу [12].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
710
ТОПУЗЯН и др.
(a)
(b)
ASN87
PRO88
TRP86
ASP74
THR83
THR83
TRP286
TRP86
GLN71
TRP439
TYR341
TYR124
TYR72
TYR337
TYR337
TYR449
TRP286
TYR341
Соединения 5-8
Соединения 9-11
(c)
(d)
ASN87
PRO446
TYR337
TRP86
TYR72
TYR341
TRP439
TYR449
SER125
TRP286
GLU202
GLY121
TRP286
ASP74
TYR124
TYR72
TRP86
TYR337
GLY122
TYR124
TYR341
Соединения 12, 13
Соединения 14-17
Рис. 1. Пространственное суперпозиционирование исследуемых лигандов в активном центре АХЭ: соединения 5-8 (a);
соединения 9-11 (b); соединения 12, 13 (c); соединения 14-17 (d)
(Z)-4-{[5-Оксо-2-фенилоксазол-4(5H)-или-
ЯМР 1Н, δ, м.д.: 3.95 c (3H, CH3O), 7.22-7.27 м
ден]метил}фенилбензоат (1). Выход 9.4 г (72.8%),
(1H, C6H3), 7.33 c (1H, CH=C), 7.50-7.72 м (6H,
т.пл. 193-195°C (203-205°C [12]). Rf 0.87. ИК
C6H3, C6H5), 7.82-7.88 м (1H, C6H3), 8.12-8.22 м
спектр, ν, см-1: 1742 (CO-эфирн.), 1799 (CO-цикл.).
(5H, C6H5). Спектр ЯМР 13С, δ, м.д.: 55.3, 115.5,
C23H15NO4.
122.7, 125.0, 125.3, 127.6, 128.1, 128.5, 128.6, 129.6,
(Z)-2-Метокси-4-{[5-оксо-2-фенилoксазол-
130.3, 131.9, 132.3, 132.9, 133.0, 141.7, 150.8, 162.8,
4(5H)-илиден]метил}фенилбензоат
(2). Выход
162.9, 165.9. Найдено, %: C 71.85; H 5.05; N 6.53.
3.45 г (61.6%), т.пл. 182-184°C, Rf 0.85. ИК спектр,
C24H18N2O4. Вычислено, %: C 72.35; H 4.55; N
ν, см-1: 1737 (CO-эфирн.), 1796 (CO-цикл.). Спектр
7.03.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ И АНТИХОЛИЭСТЕР
АЗНАЯ АКТИВНОСТЬ
711
(a)
(b)
TYR128
T
TYR440
TRP82
TRP430
7
GLY115
HIS438
GLY116
ASP70
TYR332
GLY117
PHE329
Соединения 5-8
Соединения 9-11
(c)
(d)
TYR332
TYR128
LEU125
PHE329
TRP82
ASN83
GLU197
SER287
ALA328
SER198
GLY116
TYR332
TRP231
PHE329
TRP82
TRP231
LEU286
Соединения 12, 13
Соединения 14-17
Рис. 2. Пространственное суперпозиционирование исследуемых лигандов в активном центре БуХЭ: соединения 5-8 (a);
соединения 9-11 (b); соединения 12, 13 (c); соединения 14-17 (d)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
712
ТОПУЗЯН и др.
(Z)-2-Этокси-4-{[5-оксо-2-фенилоксазол-
0.534 г (42.7%), т.пл. 190-192°C, Rf 0.9. ИК спектр,
4(5H)-илиден]метил}фенилбензоат
(3). Выход
ν, см-1: 1650 (CO-амидн.), 1742 (CO-эфирн.), 3335
3.4 г (58.6%), т.пл. 177-178°C, Rf 0.81. ИК спектр,
(NH). Спектр ЯМР 1Н, δ, м.д.: 3.59 c (3H, OCH3),
ν, см-1: 1736 (CO-эфирн.), 1791 (CO-цикл.). Спектр
7.00 уш.с (1H, NH), 7.04-7.19 м (2H, C6H3), 7.28-
ЯМР 1Н, δ, м.д.: 1.39 т (3H, CH3, J 6.9 Гц), 4.21 к
7.68 м (9H, C6H3, C6H5, NH), 8.00-8.17 м (4H,
(2H, CH2, J 6.9 Гц), 7.22-7.27 м (1Hаром), 7.31 с (1H,
C6H5), 9.81 c (1H, NH). Спектр ЯМР 13С, δ, м.д.:
CH=C), 7.51-7.70 м (6Hаром), 7.81-7.87 м (1Hаром),
54.9, 112.8, 122.2, 127.6, 127.7, 128.0, 128.5, 128.7,
8.11-8.20 м (5Hаром). Спектр ЯМР 13С, δ, м.д.: 14.2,
129.6, 129.9, 130.9, 132.9, 133.0, 133.5, 139.3, 150.4,
63.7, 116.5, 122.7, 125.0, 125.2, 127.6, 128.0, 128.5,
163.2, 165.4, 166.5. Найдено, %: C 69.72; H 5.34; N
128.7, 129.5, 130.4, 131.8, 132.3, 132.8, 132.9, 142.1,
6.23. C24H20N2O5. Вычислено, %:C 69.22; H 4.84;
150.1, 162.7, 162.9, 165.9. Найдено, %: C 72.63; H
N 6.73.
5.03; N 3.79. C25H19NO5. Вычислено, %: C 72.63; H
(Z)-4-(3-Амино-2-бензамидо-3-оксопроп-1-
4.63; N 3.39.
ен-1-ил)-2-этоксифенилбензоат (7). Выход 0.722 г
(Z)-4-Бром-2-{[5-оксо-2-фенилоксазол-4(5H)-
(56%), т.пл. 202-205°C, Rf 0.71. ИК спектр, ν,
см-1: 1688 (CO-амидн.), 1738 (CO-эфирн.), 3276
илиден]метил}фенилбензоат (4). Выход 5.73 г
(63.6%), т.пл. 192-194°C, Rf 0.84. ИК спектр, ν,
(NH), 3475 (NH). Спектр ЯМР 1Н, δ, м.д.: 1.10 т
(3H, CH3, J 7.1 Гц), 3.79 к (2H, CH2, J 6.9 Гц), 6.98
см-1: 1744 (CO-эфирн.), 1799 (CO-цикл.). Спектр
уш.с (1H, NH2), 6.99 уш.с (1H, NH), 7.09 c (1H,
ЯМР 1Н, δ, м.д.: 7.19 с (1H, CH=C), 7.26-7.36 м
CH=C), 7.11-7.17 м (1H, C6H3), 7.40-7.68 м (9H,
(1H, C6H3), 7.54-7.77 м (7H, C6H5), 8.09-8.26 м
C6H3, C6H5, NH2), 7.98-8.16 м (4H, C6H3, C6H5),
(4H,C6H3, C6H4), 9.02-9.10 м (1H, C6H3). Спектр
9.81 c (1H, NH). Спектр ЯМР 13С, δ, м.д.: 14.0,
ЯМР 13С, δ, м.д.: 118.6, 120.3, 124.5, 124.6, 127.7,
63.3, 113.7, 122.1, 122.3, 127.5, 127.7, 128.0, 128.5,
127.9, 128.0, 128.4, 128.6, 129.6, 133.4, 133.7, 133.9,
128.8, 129.4, 129.7, 130.8, 132.9, 133.5, 139.7, 149.6,
134.2, 134.7, 148.9, 163.3, 164.3, 165.2. Найдено,
163.2, 165.4, 166.5. Найдено, %: C 69.26; H 5.65; N
%: C 61.13; H 3.65; Br 17.32; N 3.62. C23H14BrNO4.
6.01. C25H22N2O5. Вычислено, %: C 69.76; H 5.15;
Вычислено, %: C 61.63; H 3.15; Br 17.82; N 3.12.
N 6.51.
Амиды N,О-дибензоил-α,β-дегидротирозина
(Z)-2-(3-Амино-2-бензамидо-3-оксопроп-1-
5-8. К раствору 0.003 моль соответствующего
ен-1-ил)-4-бромфенилбензоат (8). Выход 0.740 г
ненасыщенного оксазолона 1-4 в 35 мл этилаце-
(52.8%), т.пл. 196-200°C, Rf 0.71. ИК спектр, ν,
тата добавляли 1.89 мл (1.45 г, 0.009 моль) ГМДС
см-1: 1639 (CO-амидн.), 1738 (CO-эфирн.), 3233
и смесь перемешивали 24 ч при комнатной тем-
(NH). Спектр ЯМР 1Н, δ, м.д.: 7.01 уш.с (1H, NH2),
пературе. Образовавшийся осадок отфильтро-
7.14-7.19 м (1H, C6H3), 7.20 c (1H, CH=C), 7.42
вывали, промывали водой и сушили на воздухе.
уш.с (1H, NH2), 7.42-7.64 м (5H, C6H5), 7.65-7.75
Перекристаллизацию проводили из смеси гексан-
м (1H, C6H3), 7.84-7.89 м (1H, C6H3), 7.91-8.00
этилацетат, 1:1.
м (3H, C6H5), 8.14-8.25 м (2H, C6H5), 9.71 c (1H,
(Z)-4-(3-Амино-2-бензамидо-3-оксопроп-1-
NH). Спектр ЯМР 13С, δ, м.д.: 119.6, 124.1, 127.5,
ен-1-ил)фенилбензоат (5). Выход 1.04 г (89.4%),
127.6, 128.3, 128.4, 129.6, 129.7, 130.8, 131.1, 131.6,
т.пл. 180-184°C. Rf 0.72. ИК спектр, ν, см-1: 1647
132.7, 133.4, 133.6, 147.5, 163.4, 165.4, 165.8, 177.9.
(CO-амидн.), 1734 (CO-эфирн.), 3277 (NH). Спектр
Найдено, %: C 59.87; H 3.18; Br 17.67; N 5.52.
ЯМР 1Н, δ, м.д.: 6.97 уш.с (1H, NH2), 7.14-7.20 м
C23H17BrN2O4. Вычислено, %: C 59.37; H 3.68; Br
(2H, C6H4), 7.25 c (1H, CH=C), 7.32 уш.с (1H, NH),
17.17; N 6.02.
7.41-7.56 м (5H, С6H5), 7.60-7.69 м (3H, С6H5),
Амиды N-бензоил-α,β-дегидротирозина 9-11.
7.98-8.06 м (2H, С6H5), 8.09-8.15 м (2H, C6H4).
К раствору 0.002 моль соответствующего фенил-
Найдено, %: C 71.99; H 4.20; N 7.75. C23H18N2O4.
бензоата 5-7 в 40 мл ацетонитрилла добавляли
Вычислено, %: C 71.49; H 4.70; N 7.25.
0.5 мл (0.41 г, 0.004 моль) 3-(диметиламино)-1-
(Z)-4-(3-Амино-2-бензамидо-3-оксопроп-1-
пропиламина и кипятили c обратным холодильни-
ен-1-ил)-2-метоксифенилбензоат
(6).
Выход
ком 3 ч. После охлаждения к реакционной смеси
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ И АНТИХОЛИЭСТЕР
АЗНАЯ АКТИВНОСТЬ
713
добавляли 100 мл слабокислого водного раствора
сыщенного оксазолона 1, 2 в 10 мл ДМФА добав-
соляной кислоты (pH ≈ 4.0). Образовавшийся оса-
ляли 0.84 мл (0.65 г, 0.004 моль) ГМДС и кипяти-
док отфильтровывали, промывали водой до ней-
ли с обратным холодильником 30 мин. После ох-
трального значения pH и сушили на воздухе.
лаждения к реакционной смеси добавляли 100 мл
слабокислого водного раствора соляной кислоты
(Z)-N-[3-Амино-1-(4-гидроксифенил)-3-оксо-
(pH ≈ 4.0), образовавшийся осадок отфильтровы-
проп-1-ен-2-ил]бензамид
(9). Выход
0.425 г
вали, промывали водой до нейтрального значения
(74.5%), т.пл. 242-245°C, Rf 0.23. ИК спектр, ν,
pH и сушили на воздухе.
см-1: 1643 (CO-амидн.), 3300 (NH), 3423 (OH).
Спектр ЯМР 1Н, δ, м.д.: 6.66-6.74 м (2H, C6H4),
(Z)-4-[(5-Оксо-2-фенил-1,5-дигидро-4H-ими-
6.83 уш.с (1H, NH), 7.11 уш.с (1H, NH), 7.20 c (1H,
дазол-4-илиден)метил]фенилбензоат
(12). Вы-
CH=C), 7.33-7.57 м (5H, C6H5), 7.97-8.08 м (2H,
ход 0.562 г (75.9%), т.пл. 224-227°C, Rf 0.84. ИК
C6H4), 9.40 c (1H, NH), 9.57 c (OH). Спектр ЯМР
спектр, ν, см-1: 1710 (CO-цикл.), 1732 (CO-эфирн.),
13С, δ, м.д.: 115.1, 124.8, 126.4, 127.6, 127.7, 129.9,
3156 (NH). Спектр ЯМР 1Н, δ, м.д.: 6.98 с (1H,
130.7, 130.8, 133.7, 157.9, 165.2, 167.0. Найдено, %:
CH=C), 7.25-7.33 м (2H, C6H4), 7.46-7.60 м (5H,
C 68.58; H 5.50; N 9.42. C16H14N2O3. Вычислено,
С6H5), 7.63-7.71 м (1H, С6H5), 8.13-8.23 м (4H,
%: C 68.08; H 5.00; N 9.92.
С6H5), 8.33-8.39 м (2H, С6H5), 11.95 с (1H, NH).
(Z)-N-[3-Амино-1-(4-гидрокси-3-метокси-
Найдено, %: C 75.49; H 4.88; N 7.20. C23H16N2O3.
фенил)-3-оксопроп-1-ен-2-ил]бензамид (10). Вы-
Вычислено,%: C 74.99; H 4.38; N 7.60.
ход 0.511 г (82.4%), т.пл. 210-213°C, Rf 0.43. ИК
(Z)-2-Метокси-4-[(5-оксо-2-фенил-1,5-ди-
спектр, ν, см-1: 1672 (CO-амидн.), 3350 (NH), 3450
гидро-4H-имидазол-4-илиден)метил]фенилбен-
(OH). Спектр ЯМР 1Н, δ, м.д.: 3.53 c (3H, CH3O),
зоат (13). Выход 0.488 г (61%), т.пл. 238-240°C,
6.69-6.76 м (1H, C6H3), 6.84 уш.с (1H, NH), 7.14
Rf 0.84. ИК спектр, н, см-1: 1702 (CO-цикл.), 1739
уш.с (1H, NH), 6.92-6.99 м (1H, C6H3), 7.17-7.21
(CO-эфирн.), 3156 (NH). Спектр ЯМР 1Н, δ, м.д.:
м (1H, C6H3), 7.24 c (1H, CH=C), 7.40-7.60 м (3H,
3.95 с (3H, CH3O), 6.98 с (1H, CH=C), 7.14-7.21 м
C6H5), 8.02-8.12 м (2H, C6H5), 8.86 c (1H, NH), 9.61
(1Haром), 7.46-7.58 м (5Haром), 7.62-7.78 м (2Haром),
c (1H, OH). Спектр ЯМР 13С, δ, м.д.: 54.7, 112.4,
8.11-8.21 м (4Haром), 8.33-8.37м (1Haром), 11.96 с
114.9, 123.8, 125.2, 126.4, 127.6, 127.7, 130.4, 130.8,
(1H, NH). Найдено, %: C 71.85; H 5.05; N 6.53.
133.6, 146.9, 147.5, 165.2, 166.9. Найдено, %: C
C24H18N2O4. Вычислено,%: C 72.35; H 4.55; N 7.03.
65.88; H 5.68; N 8.47. C17H16N2O4. Вычислено, %:
(Z)-5-(4-Гидроксибензилиден)-2-фенил-3,5-
C 65.38; H 5.16; N 8.97.
дигидро-4H-имидазол-4-он (14). a. К раствору
(Z)-N-[3-Амино-1-(3-этокси-4-гидрокси-
0.74 г (0.002 моль) имидазолона 12 в 50 мл аце-
фенил)-3-оксопроп-1-ен-2-ил]бензамид (11). Вы-
тонитрила добавляли 0.44 мл (0.35 г, 0.004 моль)
ход 0.554 г (85.2%), т.пл. 225-226°C, Rf 0.84. ИК
2-(диметиламино)-1-этиламина и кипятили с об-
спектр, ν, см-1: 1672 (CO-амидн.), 3351 (NH), 3454
ратным холодильником 3 ч. После охлаждения к
(OH). Спектр ЯМР 1Н, δ, м.д.: 1.19 т (3H, CH3, J
реакционной смеси добавляли 100 мл слабокисло-
7.0 Гц), 3.73 к (2H, OCH2, J 6.9 Гц), 6.69-6.75 м
го водного раствора соляной кислоты (pH ≈ 4.0).
(1H, C6H3), 6.82 уш.с (1H, NH2), 6.90-6.97 м (1H,
Образовавшийся осадок 14 отфильтровывали и
C6H3), 7.11 уш.с (1H, NH2), 7.14-7.19 м (1H, C6H3),
сушили на воздухе. Выход 14 составляет 0.432 г
7.23 с (1H, CH=C), 7.40-7.56 м (3H, C6H5), 8.03-
(81.5%).
8.11 м (2H, C6H5), 8.71 c (1H, OH), 9.61 c (1H, NH).
Спектр ЯМР 13С, δ, м.д.: 14.3, 63.2, 113.5, 114.9,
Методом a также синтезировано соединение
123.9, 125.1, 126.3, 127.5, 127.7, 130.4, 130.7, 133.6,
15.
146.0, 147.7, 165.1, 166.8. Найдено, %: C 65.75; H
b. К суспензии 1.0 г (0.002 моль) фенилбен-
6.06; N 8.08. C18H18N2O4. Вычислено, %: C 66.25;
зоата 5 в 10 мл ДМФА добавляли 1.32 мл (1.02 г,
H 5.56; N 8.58.
0.006 моль) ГДМС, 0.53 мл (0.3 г, 0.004 моль)
2-Фенил-4-(бензоилоксибензилиден)-5-
3-(диметиламино)-1-пропиламина и кипятили с
имидазолоны 12, 13. К раствору 0.002 моль нена-
обратным холодильником 1 ч. К реакционной сме-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
714
ТОПУЗЯН и др.
си добавляли 70 мл слабокислого водного раство-
130.9, 137.9, 146.4, 149.4, 158.2, 171.7. Найдено, %:
ра соляной кислоты (pH ≈ 4.0), образовавшийся
C 69.62; H 4.73; N 8.59. C18H16N2O3. Вычислено,
осадок 14 отфильтровывали, промывали водой до
%: C 70.12; H 5.23; N 9.09.
нейтрального значения pH и сушили на воздухе.
(Z)-5-(5-Бром-2-гидроксибензилиден)-2-
Выход 0.448 г (84.6%).
фенил-3,5-дигидро-4H-имидазол-4-он (17). Вы-
c. К раствору 0.74 г (0.002 моль) оксазоло-
ход 0.473 г (68.54%), т.пл. 311-314°C, Rf 0.8. ИК
на 1 в 10 мл ДМФА добавляли 1.25 мл (0.97 г,
спектр, ν, см-1: 1708 (CO-цикл.), 3350 (NH), 3398
0.006 моль) ГДМС и кипятили с обратным хо-
(OH). Спектр ЯМР 1Н, δ, м.д.: 6.78-6.83 м (1Hаром),
лодильником 1.5 ч. После охлаждения к реак-
7.11 с (1H, CH=C), 7.26-7.34 м (1Hаром), 7.49-7.63
ционной смеси добавляли 100 мл слабокислого
м (3Hаром), 8.03-8.14 м (3Hаром), 12.26 с (1H, ОH),
водного раствора соляной кислоты (pH ≈ 4.0).
12.69 с (1H, NH). Найдено, %: C 56.50; H 3.73; Br
Образовавшийся осадок 14 отфильтровывали и
22.78; N 7.66. C16H11BrN2O2. Вычислено, %: C
сушили на воздухе. Выход 0.52 г (97.9%).
56.00; H 3.23; Br 23.28; N 8.16.
Антирадикальные свойства синтезирован-
Методом c синтезированы также соединения
ных соединений 5-17 определяли спектрофотоме-
16, 17.
трически по методу [13].
Т.пл. 296-299°C, Rf 0.71. ИК спектр, ν, см-1:
Антихолинэстеразные свойствa определяли
1698 (CO-цикл.), 3335 (NH), 3509 (OH). Спектр
с использованием метода[14]. В исследованиях
ЯМР 1Н, δ, м.д.: 6.79-6.86 м (2H, C6H4), 6.88 c (1H,
применяли эритроцитарную АХЭ и плазменную
CH=C), 7.41-7.54 м (3H, C6H5), 8.05-8.21 м (4H,
БуХЭ человека. Измерения проводили в термоста-
C6H4, C6H5), 9.71 c (1H, NH), 11.74 c (1H, OH).
тируемой ячейке спектрофотометра «SpecordUV-
Спектр ЯМР 13С, δ, м.д.: 115.5, 125.5, 125.9, 126.9,
Vis» при 412 нм. В опытах реакционная среда в
128.1, 128.5, 130.9, 133.9, 137.8, 158.2, 159.5, 171.8.
2.5 мл конечного объема содержала реагенты в
Найдено, %: C 73.22; H 5.08; N 10.10. C16H12N2O2.
следующих концентрациях: дистиллированная
Вычислено, %: C 72.72; H 4.58; N 10.60.
вода - 1.25 мл; 0.1М фосфатный буфер - 1 мл (pH
(Z)-5-(4-Гидрокси-3-метоксибензилиден)-2-
7.6±0.1); 0.005M раствор 5,5'-дитиобис-2-нитро-
фенил-3,5-дигидро-4H-имидазол-4-он (15). Вы-
бензойной кислоты (ДТНБ) - 0.02 мл; 0.005М во-
ход 0.540 г (90.9%), т.пл. 221-224°C, Rf 0.78. ИК
дный раствор ацетилтиохолина (АТХ) - 0.005 мл;
спектр, ν, см-1: 1702 (CO-цикл.), 3372 (NH), 3523
водный раствор соответствующего фермента -
(OH). Спектр ЯМР 1Н, δ, м.д.: 3.95 с (3H,CH3O),
0.02 мл и 0.01М диметилсульфоксидного раство-
6.79-6.85 м (1H, C6H3), 6.88 c (1H, CH=C), 7.43-
ра исследуемого вещества - 0.02 мл. Для кон-
7.55 м (4H, C6H3, C6H5), 8.10-8.18 м (3H, C6H3,
трольных опытов раствор, содержащий фермент и
C6H5), 9.00 уш.с (1H, OH). Спектр ЯМР 13С, δ, м.д.:
ДТНБ, инкубировали 10 мин при 25°С, измеряли
44.9, 55.1, 114.9, 115.2, 125.9, 126.0, 126.8, 127.0,
поглощение, после чего добавляли АТХ и повтор-
128.1, 128.4, 130.9, 137.8, 147.3, 149.2, 158.2, 171.6.
но измеряли поглощение раствора после инку-
Найдено, %: C 69.88; H 5.29; N 9.02. C17H14N2O3.
бирования в течение 20 мин при 25°С. Тестовые
Вычислено, %: C 69.38; H 4.79; N 9.52.
опыты проводили аналогично, изначально в при-
сутствии исследуемого соединения.
(Z)-5-(3-Этокси-4-гидроксибензилиден)-2-
фенил-3,5-дигидро-4H-имидазол-4-он (16). Вы-
Трехмерные молекулярные модели синте-
ход 0.479 г (77.2%), т.пл. 261-264°C, Rf 0.86. ИК
зированных соединений были построены с помo-
спектр, ν, см-1: 1705 (CO-цикл.), 3369 (NH), 3520
щью программы ChemOffice версии 13.0 [15].
(OH). Спектр ЯМР 1Н, δ, м.д.: 1.50 т (3H, CH3, J
Минимизацию и стабилизацию полученных 3D
7.7 Гц), 4.19 к (2H, CH2, J 7.0 Гц), 6.80-6.85 м
структур проводили с использованием силовых
(1Hаром), 6.87 с (1H, CH=C), 7.45-7.56 м (4Hаром),
полей MM2 [16]. Молекулярные модели исследуе-
8.09-8.16 м (3Hаром), 9.08 с (1H, OH), 11.74 с (1H,
мых соединений были сохранены в формате *.PDB
NH). Спектр ЯМР 13С, δ, м.д.: 14.6, 14.6, 63.6,
и *.SMILES. Молекулярные модели АХЭ и БуХЭ
115.2, 116.3, 126.0, 126.2, 126.8, 126.9, 128.1, 128.5,
были взяты из базы данных RCSB [17].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ И АНТИХОЛИЭСТЕР
АЗНАЯ АКТИВНОСТЬ
715
Докинг-анализ проводили с использова-
Унанян Лерник Сурикович, ORCID: https://
нием программных пакетов AutoDockVina и
orcid.org/0000-0002-6913-017
AutoDockTools [18], использовали методику «сле-
КОНФЛИКТ ИНТЕРЕСОВ
пой способ». Статистическую достоверность ре-
Авторы заявляют об отсутствии конфликта ин-
зультатов докинга обеспечивали 5-кратной по-
вторяемостью 20 начальных конформаций для
тересов.
каждого соединения с объемом пространственно-
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
го поиска, не превышающего 27000 Å3. Значение
Дополнительные материалы доступны на
континуума исчислений равно 500.
Конформационный анализ осуществляли
СПИСОК ЛИТЕРАТУРЫ
с использованием программы Discovery Studio
Visualizer v19.1.0.18287 [19]. Определение физи-
1.
Meurer L.C., Finke P.E., Owens K.A., Tsou N.N.,
ко-химических и фармакокинетических параме-
Ball R.G., Mills S.G., MacCoss M., Sadowski S.,
Cascieri M.A., Tsao K.L., Chicchi G.G., Egger
тров для исследуемых соединений проводили с
L.A., Luell S., Metzger J.M., MacIntyre D.E., Rup-
использованием онлайн платформы SwissADME
niak N.M.J., Williams A.R., Hargreaves R. Bioorg.
[20].
Med. Chem. Lett. 2006, 16, 4497-4503. doi 10.1016/
Компьютерный анализ токсичности иссле-
j.bmcl.2006.06.035
дуемых соединений проводили с использованием
2.
Burgey C.S., Stump C.A., Nguyen D.N., Deng J.Z.,
программного пакета PeoTOX и TOXtree [21, 11].
Quigley A.G., Norton B.R., Bell I.M., Mosser S.D.,
Процесс прогнозирования осуществляли с исполь-
Salvatore C.A., Rutledge R.Z., Kane S.A., Kob-
lan K.S., Vacca J.P., Graham S.L., Williams T.M.
зованием базы данных RTECS [22].
Bioorg. Med. Chem. Lett. 2006, 16, 5052-5056. doi
Статистический анализ результатов иссле-
10.1016/j.bmcl.2006.07.044
дования проводили на основе комплексного при-
3.
Carling R.W., Moore K.W., Moyes C.R., Jones E.A.,
менения стандартных статистических методов,
Bonner K., Emms F., Marwood R., Patel S., Flet-
включающих вычисления стандартных отклоне-
cher A.E., Beer M., Sohal B., Pike A., Leeson P.D.
ний, средних значений, стандартных средних оши-
J. Med. Chem. 1999, 42, 2706-2715. doi 10.1021/
jm991029k
бок.
4.
Reitz D.B., Garland D.J., Norton M.B., Collins J.T.,
ЗАКЛЮЧЕНИЕ
Reinhard E.J., Manning R.E., Olins G.M., Chen S.T.,
Реакцией ненасыщенных
5-(4H)-оксазолонов
Palomo M.A., McMahon E.G. Bioorg. Med. Chem.
Lett.
1993,
3,
1055-1060. doi
10.1016/S0960-
с 1,1,1,3,3,3-гексаметилдисилазаном в зависимо-
894X(00)80286-3
сти от условий синтезированы первичные амиды
5.
Naylor E.M., Parmee E.R., Colandrea V.J., Perkins L.,
N-замещенных α,β-дегидротирозина и соответ-
Brockunier L., Candelore M.R., Cascieri M.A., Col-
ствующих им 4-имидазолонов - 2,5-дизамещен-
well L.F., Deng L., Feeney W.P., Forrest M.J.,
ных аналогов хромофора зеленого флуоресцент-
Hom G.J., MacIntyre D.E., Starader C.D., Tota L.,
ного белка. Полученные соединения проявляют
Wang P.R., Wyvratt M.J., Fisher M.H., Weber A.E.
антихолинэстеразные и антирадикальные свой-
Bioorg. Med. Chem. Lett. 1999, 9, 755-758. doi
ства.
10.1016/s0960-894x(99)00072-4
ИНФОРМАЦИЯ ОБ АВТОРАХ
6.
Andre’s J.I., Alonso J.M., Diaz A., Fernandez J., Iturri-
no L., Martinez P., Matesanz E., Freyne E.J., Deroo-
se F., Boeckx G., Petit D., Diels G., Megens A.,
orcid.org/0000-0002-1721-1993
Somers M., Wauwe J.V., Stoppie P., Cools M.,
Clerck F.D., Peeters D., Chaffoy D.D. Bioorg. Med.
Оганесян Армен Арамович, ORCID: https://
Chem. Lett. 2002, 12, 653-658. doi 10.1016/s0960-
orcid.org/0000-0003-0879-6800
894x(01)00817-4
7.
Daina A., Michielin O., Zoete V. Sci. Rep. 2017, 7,
orcid.org/0000-0003-0615-2542
article number 42717. doi 10.1038/srep42717
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
716
ТОПУЗЯН и др.
8. Egan W.J., Merz K.M., Baldwin J.J. J. Med. Chem.
15. Narayanaswamy V.K., Rissdörfer М., Odhav B. Int. J.
2000, 43, 21, 3867-3877. doi 10.1021/jm000292e
Theor. Appl. Sci. 2013, 5, 43-49. ISSN No. 2249-3247
9. Lipinski C. Drug Discov. Today Technol. 2004, 1, 337-
16. Evans M.J., Moore J.S. J. Chem. Ed. 2011, 88, 764-
341. doi 10.1016/j.ddtec.2004.11.007
768. doi 10.1021/ed100517g
10. Martin Y.C. J. Med. Chem. 2005, 48, 3164-3170. doi
17. Goodsell D.S., Zardecki Ch., Costanzo L.D., Duar-
10.1021/jm0492002
te J.M., Hudson B.P., Persikova I., Segura J., Shao Ch.,
Voigt M., Westbrook J.D., Young J.Y., Burley S.K.
11. Patlewicz G., Jeliazkova N., Safford R.J., Worth A.P.,
Protein Sci. 2020, 29, 52-65. doi 10.1002/pro.3730
Aleksiev B. SAR QSAR Environ Res. 2008, 19, 495-
524. doi 10.1080/10629360802083871
18. Trott O., Olson A.J. J. Сomputat.Сhem. 2010, 31, 455-
461. doi 10.1002/jcc.21334
12. Abdel-Galil E., Moawad E.B., El-Mekabaty A.,
Said G.E. J. Heterocycl. Chem. 2018, 55, 1092-1100.
19. Dassault Systèmes BIOVIA, Discovery Studio. San
doi 10.1002/jhet.3139
Diego: Dassault Systèmes, 2017.
13. Bondet V., Brand-Williams W., Berset C., Lebensm.-
20. Daina A., Michielin O., Zoete V. Sci. Rep. 2017, 7,
Wiss. U.-Technol. 1997, 30, 609-615. doi 10.1006/
article no. 42717. doi 10.1038/srep42717
fstl.1997.0240
14. Ellman G., Courtney K., Andres V.Jr, Feather-Stone R.
22. Bajda M., Więckowska A., Hebda M., Guzior N.,
Biochem. Pharm. 1961, 7, 88-95. doi 10.1016/0006-
Sotriffer C.A., Malawska B. Int. J. Mol. Sci. 2013, 14,
2952(61)90145-9
5608-5632. doi 10.3390/ijms14035608
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ И АНТИХОЛИЭСТЕР
АЗНАЯ АКТИВНОСТЬ
717
Synthesis and Anticholinesterase Activity of Certain
2,5-Disastered Imidazol-4-ones of Green Fluorescent
Protein Chromophor Derivatives
V. O. Topuzyanа, A. A. Hovhannisyanа, A. T. Makichyanа, b, *, and L. S. Hunanyanb
a Scientific Technological Center of Organic and Pharmaceutical Chemistry of NAS RA,
prosp. Azatutian, 26, Yerevan, 0014 Armenia
b Russian-Armenian University, ul. Hovsep Emina, 123, Yerevan, 0051 Armenia
*e-mail: ani.makichyan@rau.am
Received November 15, 2021; revised December 12, 2021; accepted December 16, 2021
By the reaction of 2-phenyl-4-(4benzoyloxyarylidene)-5(4H)oxazolones with 1,1,1,3,3,3-hexamethyl-disilazane,
depending on the reaction conditions, primary amides of N,O-dibenzoyl-α,β dehydrotyrosines were synthesized
(ethyl acetate, 25°C) and 2-phenyl-5-(hydroxybenzylidene)-4-imidazolones (DMF, 140°C). The antiradical and
anticholinesterase properties of the synthesized compounds were studied. Compounds with a benzoyl O-protec-
tive group are inferior in antiradical properties to derivatives containing an α,β-dehydrotyrosine residue. Primary
amides of N-benzoyl-α,β-dehydrotyrosines in terms of anticholinesterase properties are generally inferior to the
corresponding 4-imidazolones.
Keywords: α,β-dehydroamino acid, imidazol-4-one, antiradical activity, anticholinesterase activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022