ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 7, с. 754-759
УДК 547.46.052
СИНТЕЗ И ОПТИЧЕСКИЕ СВОЙСТВА 3,4-ДИАМИНО-
6-АРИЛ-1H-ПИРАЗОЛО[3,4-b]ПИРИДИН-
5-КАРБОНИТРИЛОВ
© 2022 г. Р. А. А. Аль-Шуаеебa, А. Ю. Алексееваb, Н. Н. Ященкоb, С. В. Житарьb,
Е. А. Мельникc, И. Н. Бардасовb, *
a Аль-Китаб Университет, Ирак, 36015 Киркук, Алтынкёпрю
b ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»,
Россия, 428015 Чебоксары, Московский просп., 15
c ФГБУН «Институт общей и неорганической химии им. Н.С. Курнакова РАН»,
Россия, 119991 Москва, Ленинский просп., 31
*e-mail: bardasov.chem@mail.ru
Поступила в редакцию 29.11.2021 г.
После доработки 14.12.2021 г.
Принята к публикации 18.12.2021 г.
Неизвестные ранее 3,4-диамино-6-арил-1H-пиразоло[3,4-b]пиридин-5-карбонитрилы были получены
взаимодействием гидразина с 4-амино-2-бром-6-арилпиридин-3,5-дикарбонитрилами. Исследование
спектрально-люминесцентных свойств показало наличие флуоресценции в растворах с максимумом в
области 484-548 нм и квантовым выходом 0.9-3.9%.
Ключевые слова: пиразоло[3,4-b]пиридины, нуклеофильное замещение, флуоресценция
DOI: 10.31857/S0514749222070084, EDN: CZJVSZ
ВВЕДЕНИЕ
держащих фрагментов [20-22]. В данной работе
нами представлен синтез новых 3,4-диамино-6-
Фрагмент пиразоло[3,4-b]пиридина является
арил-1H-пиразоло[3,4-b]пиридин-5-карбонитри-
важной структурной частью многих биологически
лов 1 и исследование их оптических свойств.
активных веществ. Так, среди них обнаружены
соединения, обладающие антипролиферативной
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
[1], антимикробной [2, 3], противораковой [4-6],
Ранее нами было показано, что галоген в 4-ами-
противопаразитарной [7], а также ингибирующей
но-2-бром-6-арилпиридин-3,5-дикарбонитрилах 2
активностью к ацетилхолинэстеразе [8], казеин-
[23, 24] легко замещается на первичный и вторич-
киназе 1 (CK1) и чекпойнт-киназе 1 (CHK1) [9],
ный амин с образованием соответствующих 2-ал-
Aurora A киназе [10], фактору роста фибробластов
киламинопиридинов [25]. В продолжение иссле-
(FGFR) [11]. Не менее интересными являются и оп-
дований соединения 2 были вовлечены в реакцию
тические свойства производных пиразоло[3,4-b]-
с гидразином. Согласно литературным данным
пиридина. В этой области можно отметить синтез
[26-28], замещение атома галогена гидразином
эффективных флуорофоров [12-14], а также хемо-
приводит к образованию производных 2-гидрази-
сенсоров на их основе [15, 16].
нилпиридин-3,5-дикарбонитрила, которые далее
Самым распространенным способом получе-
претерпевают реакцию внутримолекулярной гете-
ния 3-амино-1H-пиразоло[3,4-b]пиридинов явля-
роциклизации с образованием 3-амино-1H-пира-
ется нуклеофильное замещение атома галогена
золо[3,4-b]пиридинов. Как и ожидалось, взаимо-
[17], реже кислород- [3, 5, 18-19] или серосо-
действие соединений 2 с гидразином также при-
754
СИНТЕЗ И ОПТИЧЕСКИЕ СВОЙСТВА
755
Схема 1
NH2
NH2
NH2
NH2
NC
CN
NC
NC
CN
NH2NH2
1,4-dioxane
N
NH2
70°C
Ar
N
N
N
Ar
N
Ar
N
Br
H
H
2a-f
1a-f
Ar = Ph (a), 4-MeC6H4 (b), 3,4-diMeOC6H3 (c), 2-ClC6H4 (d),
3,4-diClC6H3 (e), 3-NO2C6H4 (f).
вело к выделению 3,4-диамино-6-арил-1H-пиразо-
зависит от природы растворителя. Более того, во
ло[3,4-b]пиридин-5-карбонитрилов 1 с выходами
многих случаях его точное положение установить
83-92% (схема 1). Стоит также отметить, что, не-
не удалось ввиду поглощения излучения раствори-
смотря на все попытки, выделить промежуточные
телями. Максимум флуоресценции располагается
2-гидразинилпиридины нам не удалось.
в интервале 452-514 нм и смещается в длинновол-
новую область при увеличении полярности рас-
В спектрах ЯМР 1Н наблюдаются сигналы
творителя (табл. 1).
протонов арильного заместителя. Сигналы двух
аминогрупп и NH проявляются в виде уширен-
В зависимости от природы заместителей в бен-
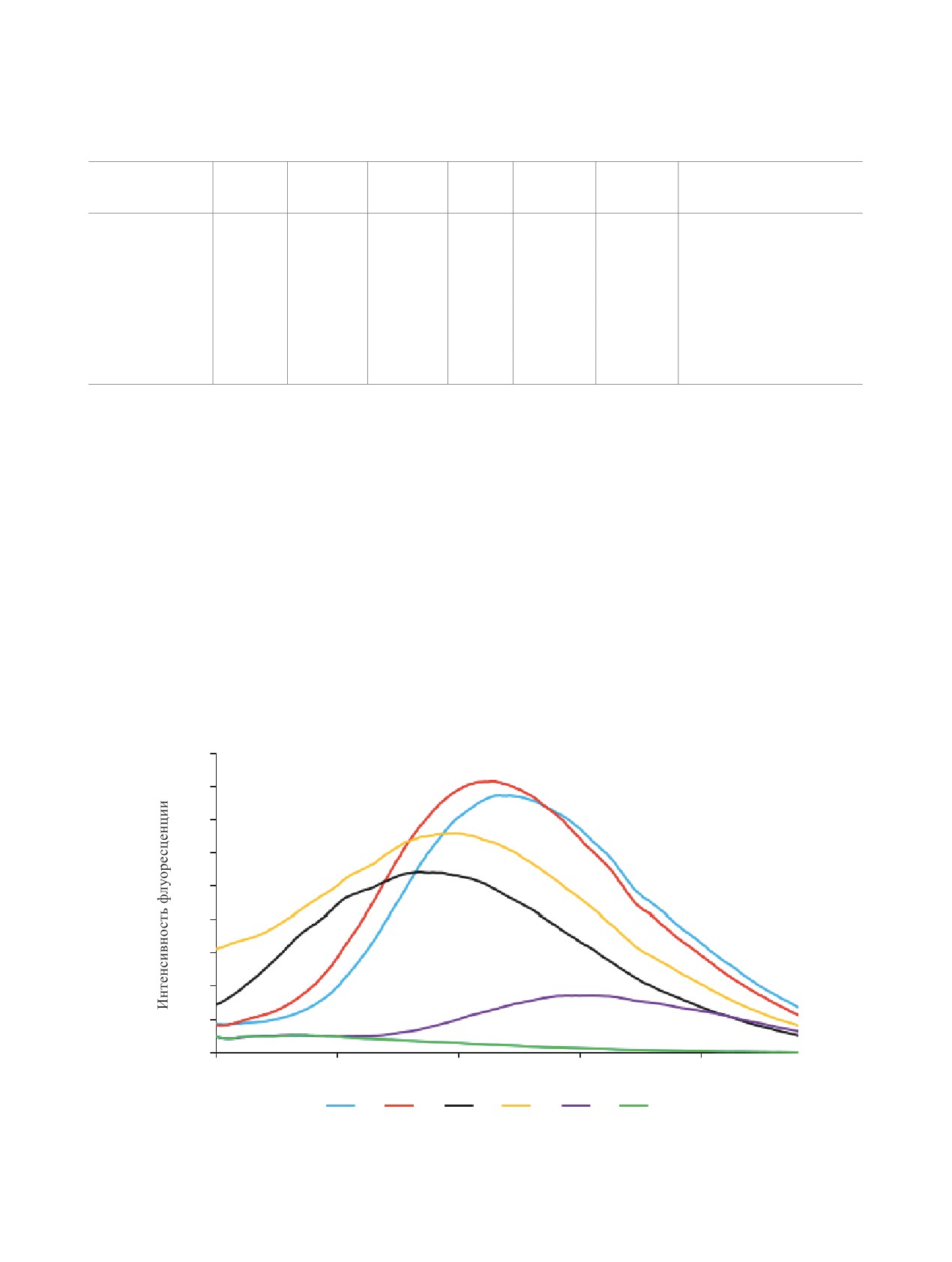
ных синглетов или находятся в обмене с водой.
зольном кольце максимумы флуоресценции соеди-
нений 1a-f в ДМСО располагаются области 484-
ИК спектры представлены полосами поглощения
548 нм (табл. 2). Наличие донорных заместителей
сопряженных цианогрупп при 2206-2218 см-1, а
в целом увеличивает интенсивность флуоресцен-
также аминогрупп и NH пиразола в области 3161-
ции и смещает максимум в коротковолновую об-
3466 см-1. В масс-спектрах всех соединений мак-
ласть (см. рисунок). В твердом состоянии соедине-
симальный пик соответствует пику молекулярного
ния 1 практически не флуоресцируют.
иона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтезированные соединения 1a-f представ-
ляют собой кристаллические вещества от желтого
ИК спектры зарегистрированы на Фурье-
до оранжевого цвета, малорастворимые в органи-
спектрометре ФСМ-1202 (Россия) в тонком слое
ческих растворителях, за исключением ДМСО. На
(суспензия в вазелиновом масле). Спектры ЯМР
примере соединения 1b было обнаружено, что по-
1Н зарегистрированы на спектрометре Bruker
ложение максимума поглощения практически не
DRX-500 (США) в ДМСО-d6, внутренний стан-
Таблица 1. Оптические свойства соединения 1b в разных растворителях
Растворитель
λабс, нм
A
εмакс
lg ε
λфлуо, нм
Квантовый выход, %
Стоксов сдвиг, см-1 (нм)
Этанолa,b
271
0,135
13460
4.13
502
0.6
16980 (231)
Дихлорметанb
268
0.130
13040
4.12
452
6.7
15190 (184)
Уксусная кислота
269
0.215
21470
4.33
-
-
-
Ацетонитрилb
262
0.227
22740
4.36
495
4.9
17966 (233)
Этилацетатb
264
0.169
16930
4.23
480
5.3
17045 (216)
Диоксанb
262
0.151
15120
4.18
459
5.2
16381 (197)
ДМСОa
274
0.167
16730
4.22
514
4.1
17041 (240)
a Максимум поглощения определен неточно из-за поглощения растворителем
b Соединение 1b имеет ограниченную растворимость в данном растворителе
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
756
АЛЬ-ШУАЕЕБ и др.
Таблица 2. Оптические свойства соединений 1a-f
Соединение
λабс, нм
A
εмакс
lg ε
λфлуо, нм
Ф, %
Стоксов сдвиг, см-1 (нм)
1a
273a
0,216
21620
4,33
517
3,9
17288 (244)
1b
274a
0,167
16730
4,22
514
4,1
17041 (240)
1c
274a
0,242
24170
4,38
484
2,7
15835 (210)
1d
295
0,122
12240
4,09
498
3,3
13818 (203)
1e
274a
0,228
22770
4,36
548
0,9
18248 (274)
1f
274a
0,205
20490
4,31
-
-
-
a Максимум поглощения определен неточно из-за поглощения более коротких волн ДМСО
дарт ТМС. Масс-спектры записаны на приборе
3,4-Диамино-6-фенил-1H-пиразоло[3,4-b]-
Finnigan МАТINCOS-50 (ионизация ЭУ, 70 эВ,
пиридин-5-карбонитрил
(1a). Смесь
0.299 г
США). Элементный анализ выполнен на CHN-
(1 ммоль)
4-амино-2-бром-6-фенилпиридин-3,5-
дикарбонитрила 2a и 0.15 г (3 ммоль) гидразин
анализаторе vario Micro cube (Германия). Спектры
гидрата кипятили с обратным холодильником в
флуоресценции сняты на приборе Cary Eclipse
5 мл 1,4-диоксана в течение 4 ч. После окончания
(США). Температуры плавления определены
реакции (ТСХ) к полученной смеси добавляли
на автоматическом приборе OptiMelt MPA100
30 мл дистиллированной воды. Полученный оса-
(США). Контроль за ходом реакций и чистотой
док отфильтровывали, промывали небольшими
синтезированных соединений осуществлен мето-
порциями дистиллированной воды, перекристал-
дом ТСХ на пластинах Sorbfil ПТСХ-АФ-А-УФ,
лизовывали из 1,4-диоксана. Выход 0.228 г (91%),
элюент EtOAc, проявление УФ облучением, пара-
т.пл. 291-292°С (разл.). ИК спектр, ν, см-1: 3454,
ми иода и термическим разложением. Соединения
3358, 3177 (NH, NH2), 2206 (CN), 1654 (C=C).
2 были синтезированы по методике [23]. Гидразин
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 5.72 с (2Н,
гидрат, 100% (Германия) - коммерческий продукт.
NН2), 7.27 с (2Н, NH2), 7.48-7.51 м (3Н, С6Н5),
450
400
350
300
250
200
150
100
50
0
400
450
500
550
600
Длина волны, нм
1a
1b
1c
1d
1e
1f
Спектры фотолюминесценции соединений 1a-f
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ И ОПТИЧЕСКИЕ СВОЙСТВА
757
7.71-7.74 м (2Н, С6Н5), 12.20 c (1Н, NH). Масс-
0.287 г (90%), т.пл. 322-323°С (разл.). ИК спектр,
спектр, m/z (Iотн, %): 250 (100). Найдено, %: C
ν, см-1: 3466, 3335, 3161 (NH, NH2), 2216 (CN),
62.45; H 4.09; N 33.46. C13H10N6. Вычислено, %: C
1657 (C=C). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
62.39; H 4.03; N 33.58. M 250.27.
5.74 уш.с (2Н, NН2), 7.36 с (2Н, NН2), 7.73 д.д (1Н,
С6Н3, J 8.3, 2.1 Гц), 7.77 д (1Н, С6Н3, J 8.4 Гц), 7.95
Соединения 1b-f получали аналогично.
, J 2.1 Гц), 12.27 уш.c (1Н, NH). Спектр
д (1Н, С6Н3
3,4-Диамино-6-(п-толил)-1H-пиразоло[3,4-
ЯМР 13С (ДМСО-d6), δ, м.д.: 80.73, 91.62, 118.54,
b]пиридин-5-карбонитрил (1b). Выход 0.219 г
129.34, 130.86, 131.00, 131.39, 132.55, 139.81,
(83%), т.пл. 306-307°С (разл.). ИК спектр, ν, см-1:
148.72, 153.50, 153.91, 158.80. Масс-спектр, m/z
3467, 3395 (NH, NH2), 2218 (CN), 1696 (C=C).
(Iотн, %): 320 (65), 319 (18), 318 (100). Найдено, %:
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.39 с (3Н,
C 48.80; H 2.60; N 26.39. C13H8Сl2N6. Вычислено,
СН3), 7.38 д (2Н, С6Н4, J 7.7 Гц), 7.62 д (2Н,
%: C 48.92; H 2.53; N 26.33. M 319.15.
С6Н4, J 7.7 Гц), 8.78 уш.с (3Н, NH, NH2). Спектр
ЯМР 13С (ДМСО-d6), δ, м.д.: 21.51, 81.85, 89.97,
3,4-Диамино-6-(3-нитрофенил)-1H-пира-
золо[3,4-b]пиридин-5-карбонитрил (1f). Выход
116.15,
129.53,
129.57,
142.14,
146.87,
148.41,
0.338 г (85%), т.пл. 243-244°С (разл.). ИК спектр,
155.41, 155.51, 159.70. Масс-спектр, m/z (Iотн, %):
264 (100). Найдено, %: C 63.52; H 4.63; N 31.85.
ν, см-1: 3460, 3343, 3185 (NH, NH2), 2210 (CN),
C14H12N6. Вычислено, %: C 63.62; H 4.58; N 31.80.
1672 (C=C). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
7.84 т (1Н, С6Н4, J 8.1 Гц), 8.22 д.т (1Н, С6Н4, J 7.8,
M 264.29.
1.4 Гц), 8.39 д.д (1Н, С6Н4, J 8.1, 2.4 Гц), 8.56-8.61
3,4-Диамино-6-(3,4-диметоксифенил)-1H-
м (1Н, С6Н4). Масс-спектр, m/z (Iотн, %): 295 (100).
пиразоло[3,4-b]пиридин-5-карбонитрил
(1c).
Найдено, %: C 52.77; H 3.00; N 33.32. C13H9N7O2.
Выход 0.276 г (89%), т.пл. 246-247°С (разл.). ИК
Вычислено, %: C 52.88; H 3.07; N 33.21. M 397.44.
спектр, ν, см-1: 3439, 3379, 3300 (NH, NH2), 2208
(CN), 1662 (C=C). Спектр ЯМР 1Н (ДМСО-d6), δ,
ЗАКЛЮЧЕНИЕ
м.д.: 3.82 с (3Н, OCH3), 3.83 с (3Н, OCH3), 5.70 с
Синтезированы
2,4-диамино-6-арилпиридин-
(2Н, NН2), 7.07 д (1Н, С6Н3, J 8.3 Гц), 7.22 с (2Н,
3,5-дикарбонитрилы 1 и исследованы их спек-
NН2), 7.32-7.38 м (2Н, С6Н3), 12.17 уш.c (1Н, NH).
трально-люминесцентные свойства. Соединения
Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 56.14, 56.20,
флуоресцируют в растворах с максимумами в диа-
80.72, 91.48, 111.63, 112.91, 119.35, 122.16, 131.95,
пазоне 484-548 нм и не флуоресцируют в твердом
148.74, 148.80, 150.44, 153.98, 154.15, 161.25.
состоянии.
Масс-спектр, m/z (Iотн, %): 310 (100). Найдено, %:
БЛАГОДАРНОСТИ
C 58.18; H 4.61; N 27.00. C15H14N6O2. Вычислено,
%: C 58.06; H 4.55; N 27.08. M 310.32.
Часть работы выполнена в рамках государ-
3,4-Диамино-6-(2-хлорфенил)-1H-пиразо-
ственного задания ИОНХ РАН в области фунда-
ментальных научных исследований.
ло[3,4-b]пиридин-5-карбонитрил
(1d). Выход
0.262 г (92%), т.пл. 308-309°С (разл.). ИК спектр,
ФОНДОВАЯ ПОДДЕРЖКА
ν, см-1: 3448, 3177 (NH, NH2), 2218 (CN), 1687
Исследование выполнено в рамках государ-
(C=C). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 7.57 т
ственного задания Минобрнауки России, проект
(1Н, С6Н4, J 7.6 Гц), 7.64 т (1Н, С6Н4, J 7.4 Гц),
№ 0849-2020-0003.
7.68-7.72 м (2Н, С6Н4), 8.80 уш.c (5Н, NH, 2NH2).
Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 66.82, 83.90,
ИНФОРМАЦИЯ ОБ АВТОРАХ
90.49, 115.15, 128.06, 130.21, 131.34, 131.91, 132.97,
Аль-Шуаееб Рияд Ахмед Атто, ORCID: https://
146.95, 148.70, 154.93, 157.80. Масс-спектр, m/z
orcid.org/0000-0001-9344-2147
(Iотн, %): 286 (33), 284 (100). Найдено, %: C 54.73;
H 3.25; N 29.60. C13H9ClN6. Вычислено, %: C
Алексеева Анастасия Юрьевна, ORCID: https://
54.84; H 3.19; N 29.52. M 284.71.
orcid.org/0000-0001-5607-6969
3,4-Диамино-6-(3,4-дихлорфенил)-1H-пира-
Ященко Наталия Николаевна, ORCID: https://
золо[3,4-b]пиридин-5-карбонитрил (1e). Выход
orcid.org/0000-0002-3421-8580
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
758
АЛЬ-ШУАЕЕБ и др.
Житарь Светлана Владимировна, ORCID:
12.
Chen J., Liu W., Ma J., Xu H., Wu J., Tang X., Fan Z.,
Wang P. J. Org. Chem. 2012, 77, 3475-3482. doi
10.1021/jo3002722
Мельник Елена Александровна, ORCID: https://
13.
Deore R., Dingore K., Jachak M. J. Fluoresc. 2015, 25,
orcid.org/0000-0002-1004-7879
1549-1557. doi 10.1007/s10895-015-1674-2
Бардасов Иван Николаевич, ORCID: https://
14.
Kendre D.B., Toche R.B., Jachak M.N. Tetrahedron.
orcid.org/0000-0002-5843-3381
2007, 63, 11000-11004. doi 10.1016/j.tet.2007.08.052
КОНФЛИКТ ИНТЕРЕСОВ
15.
García M., Romero I., Portilla J. ACS Omega. 2019, 4,
6757-6768. doi 10.1021/acsomega.9b00226
Авторы заявляют об отсутствии конфликта ин-
тересов.
16.
Orrego-Hernández J., Lizarazo C., Cobo J., Portilla J.
RSC Adv.
2019,
9,
27318-27323. doi
10.1039/
СПИСОК ЛИТЕРАТУРЫ
C9RA04682H
1.
Ye Q., Cao J., Zhou X., Lv D., He Q., Yang B.,
17.
Сираканян С.Н., Казарян С.Г., Акопян Э.К., Оваки-
Hu Y. Bioorg. Med. Chem. 2009, 17, 4763-4772. doi
мян А.А. ЖОрХ. 2020, 56, 797-801. [Sirakanyan S.N.,
10.1016/j.bmc.2009.04.043
Ghazaryan S.G., Hakobyan E.K., Hovakimyan A.A.
2.
Witherington J., Bordas V., Garland S.L., Hic-
Russ. J. Org. Chem. 2020, 56, 840-844.] doi 10.31857/
key D.M.B., Ife R.J., Liddle J., Saunders M.,
S0514749220050171
Smith D.G., Ward R.W. Bioorg. Med. Chem. Lett. 2003,
18.
Сираканян С.Н., Акопян Э.К., Овакимян А.А. ЖОрХ.
13, 1577-1580. doi 10.1016/S0960-894X(03)00134-3
2018, 54, 924-927. [Sirakanyan S.N., Hakobyan E.K.,
3.
Nagender P., Malla Reddy G., Naresh Kumar R.,
Hovakimyan A.A. Russ. J. Org. Chem. 2018, 54, 929-
Poornachandra Y., Ganesh Kumar C., Narsaiah B.
932.] doi 10.1134/S1070428018060167
Bioorg. Med. Chem. Lett. 2014, 24, 2905-2908. doi
19.
Hamza E.Kh., Hamdy N.A., Zarie E.S., Fakhr I.M.I.,
10.1016/j.bmcl.2014.04.084
Elwahy A.H.M., Awad H.M. J. Heterocycl. Chem.
4.
Mohamed M.S., Awad Y.E.E.-D., El-Hallouty S.M.,
2019, 57, 182-196. doi 10.1002/jhet.3764
El-Araby M. Open J. Med. Chem. 2012, 2, 78-88. doi
20.
Sanad S.M.H., Hawass M.A.E., Ahmed A.A.M.,
10.4236/ojmc.2012.23010
Elneairy M.A.A. Synth. Commun. 2018, 48, 1847-
5.
Ravi Kumar N., Poornachandra Y., Krishna Swa-
1856. doi 10.1080/00397911.2018.1468911
roop D., Jitender Dev G., Ganesh Kumar C., Nar-
21.
Sanad S.M.H., Abdel-Fattah A.M., Attaby F.A.,
saiah B. Bioorg. Med. Chem. Lett. 2016, 26, 5203-
5206. doi 10.1016/j.bmcl.2016.09.062
Elneairy M.A.A. J. Heterocycl. Chem. 2018, 56, 651-
662. doi 10.1002/jhet.3444
6.
Hao S.-Y., Qi Z.-Y., Wang S., Wang X.-R., Chen S.-W.
Bioorg. Med. Chem. 2021, 31, 115985. doi 10.1016/
22.
Abdel Fattah A.M., Elneairy M.A.A., Gad-Elka-
j.bmc.2020.115985
reem M.A.M. Phosphorus Sulfur Silicon Relat.
Elem.
2007,
182,
1351-1364. doi
10.1080/
7.
Ribeiro J.L.S., Soares J.C.A.V., Portapilla G.B.,
10426500601160991
Providello M.V., Lima C.H.S., Muri E.M.F., de
Albuquerque S., Dias L.R.S. Bioorg. Med. Chem. 2021,
23.
Bardasov I.N., Alekseeva A.U., Ershov O.V.
29, 115855. doi 10.1016/j.bmc.2020.115855
Tetrahedron Lett. 2018, 59, 1398-1399.
8.
Umar T., Shalini S., Raza M.K., Gusain S., Kumar J.,
24.
Bardasov I.N., Mihailov D.L., Alekseeva A.U.,
Seth P., Tiwari M., Hoda N. Eur. J. Med. Chem. 2019,
Ershov O.V., Nasakin O.E. Tetrahedron Lett. 2013, 54,
175, 2-19. doi 10.1016/j.ejmech.2019.04.038
21-22.
9.
Huart A.-S., Saxty B., Merritt A., Nekulova M., Le-
25.
Ершов О.В., Михайлов Д.Л., Бардасов И.Н., Иев-
wis S., Huang Y., Vojtesek B., Kettleborough C.,
лев М.Ю., Беликов М.Ю. ЖОрХ. 2017, 53, 869-873.
Hupp T.R. Bioorg. Med. Chem. Lett. 2013, 23, 5578-
[Ershov O.V., Mikhailov D.L., Bardasov I.N., Iev-
5585. doi 10.1016/j.bmcl.2013.08.046
lev M.Yu., Belikov M.Yu. Russ. J. Org. Chem. 2017,
10.
Shi J., Xu G., Zhu W., Ye H., Yang S., Luo Y., Han J.,
53, 886-890.] doi 10.1134/S1070428017060124
Yang J., Li R., Wei Y., Chen L. Bioorg. Med. Chem. Lett.
26.
Ершов О.В., Иевлев М.Ю., Беликов М.Ю., Макси-
2010, 20, 4273-4278. doi 10.1016/j.bmcl.2010.04.083
мова В.Н. ЖОрХ. 2018, 54, 871-875. [Ershov O.V.,
11.
Zhao B., Li Y., Xu P., Dai Y., Luo C., Sun Y., Ai J.,
Ievlev M.Yu., Belikov M.Yu., Maksimova V.N. Russ.
Geng M., Duan W. ACS Med. Chem. Lett. 2016, 7,
J. Org. Chem. 2018, 54, 873-877.] doi 10.1134/
629-634. doi 10.1021/acsmedchemlett.6b00066
S1070428018060088
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ И ОПТИЧЕСКИЕ СВОЙСТВА
759
27. Tranfić M., Halambek J., Cetina M., Jukić M. J.
28. El-Sayed A.A., Amr A.E., El-Ziaty A.K.,
Mol. Struct.
2011,
1001,
145-151. doi
10.1016/
Elsayed E.A. Molecules.
2019,
24,
1965. doi
j.molstruc.2011.06.033
10.3390/molecules24101965
Synthesis and Optical Properties of 3,4-Diamino-
6-aryl-1H-pyrazolo[3,4-b]pyridine-5-carbonitriles
R. А. А. Al-Shuaeeba, A. U. Alekseevab, N. N. Yaschenkob, S. V. Zhitarb,
E. A. Mel’nikc, and I. N. Bardasovb, *
a Al-Kitab University, Altoun kopri, Kirkuk, 36015 Iraq
b I.N. Ul’yanov Chuvash State University, Moskovskii prosp., 15, Cheboksary, 428015 Russia
c Kurnakov Institute of General and Inorganic Chemistry, Russian Academy of Sciences,
Leninsky prosp., 31, Moscow, 119991 Russia
*e-mail: bardasov.chem@mail.ru
Received November 29, 2021; revised December 14, 2021; accepted December 18, 2021
Previously unknown 3,4-diamino-6-aryl-1H-pyrazolo[3,4-b]pyridine-5-carbonitriles were obtained by reacting
hydrazine with 4-amino-2-bromo-6-arylpyridine-3,5-dicarbonitriles. The study of the spectral-luminescent
properties showed the fluorescence in solutions with a maximum in the region of 484-548 nm and a quantum
yield of 0.9-3.9%.
Keywords: pyrazolo[3,4-b]pyridine, nucleophilic substitution, fluorescence
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022