ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 7, с. 760-766
УДК 547.46.052
СИНТЕЗ (Z)-2-АМИНО-4-(2-АРИЛ-1-ЦИАНОВИНИЛ)-
6-(ПИПЕРИДИН-1-ИЛ)ПИРИДИН-3,5-ДИКАРБОНИТРИЛОВ
И ИССЛЕДОВАНИЕ ИХ ОПТИЧЕСКИХ СВОЙСТВ
© 2022 г. И. Н. Бардасов*, А. Ю. Алексеева
ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»,
Россия, 428015 Чебоксары, Московский просп., 15
*e-mail: bardasov.chem@mail.ru
Поступила в редакцию 14.01.2022 г.
После доработки 10.02.2022 г.
Принята к публикации 13.02.2022 г.
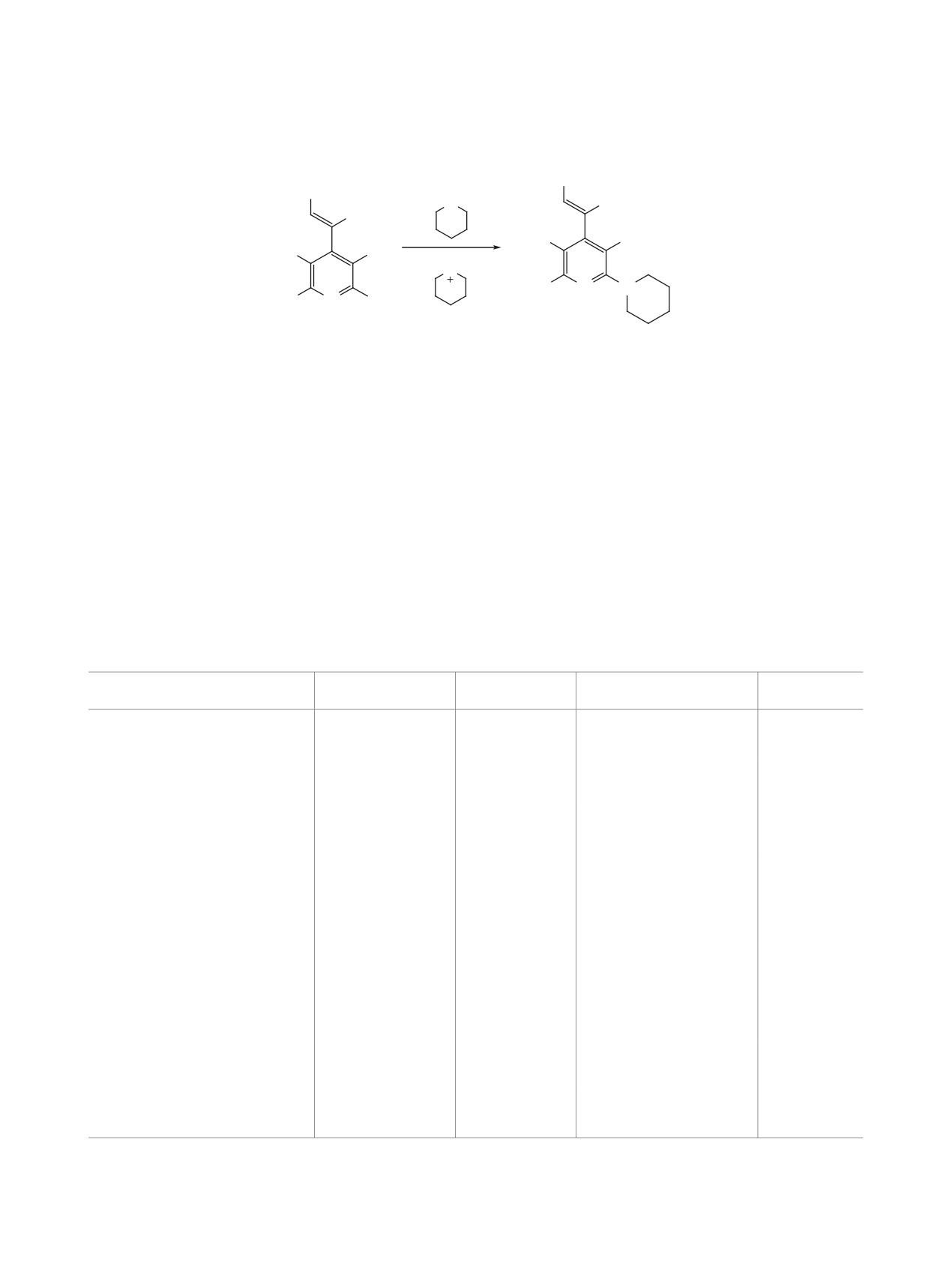
(Z)-2-Амино-4-(2-арил-1-циановинил)-6-(пиперидин-1-ил)пиридин-3,5-дикарбонитрилы были получены
путем взаимодействия пиперидина с (Z)-2-амино-4-(2-арил-1-циановинил)-6-хлорпиридин-3,5-дикар-
бонитрилами. Исследование спектрально-люминесцентных свойств показало наличие флуоресценции в
твердом состоянии с максимумом в области 472-564 нм и практически полное отсутствие ее в растворах.
Ключевые слова: α-цианостильбазолы, нуклеофильное замещение, твердофазная флуоресценция
DOI: 10.31857/S0514749222070096, EDN: CZLEIJ
ВВЕДЕНИЕ
центных свойств производных соединений 1 - (Z)-
2-амино-4-(2-арил-1-циановинил)-6-(пиперидин-
После открытия люминогенов с эмиссией, вы-
1-ил)пиридин-3,5-дикарбонитрилов 2.
званной агрегацией (AIE-гены), таких как 1,1-за-
мещенные 2,3,4,5-тетрафенилсилолы [1, 2], явле-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ние AIE начало широко исследоваться с перспек-
Атом галогена в синтезированных соединениях
тивой применения данных соединений в органи-
1, по аналогии со структурными аналогами, дол-
ческих светодиодах (OLED) [3-6], красителей для
жен легко вступать в реакции нуклеофильного за-
биовизуализации [7-9] и в качестве хемосенсоров
мещения [19-23]. Для введения дополнительной
[7, 9-11]. α-Цианостильбены и их азотсодержащие
донорной составляющей нами были изучена реак-
структурные аналоги α-цианостильбазолы явля-
ция с вторичными аминами на примере пипериди-
ются типичными AIE-генами. Классическим мето-
на (схема 1). Замещение протекало при нагревании
дом их синтеза является конденсация различных
в избытке пиперидина с образованием соедине-
альдегидов с арилацетонитрилами [3, 8, 9, 12-14].
ний 2 с выходом 86-96%.
Недавно нашим коллективом был опубликован
новый метод синтеза производных α-цианостиль-
В спектрах ЯМР 1Н наблюдаются сигналы
базола - (Z)-2-амино-4-(2-арил-1-циановинил)-6-
протонов арильного заместителя, аминогруппы
хлорпиридин-3,5-дикарбонитрилов 1 [15], осно-
в виде уширенного синглета, С-H стирильного
ванный на гетероциклизации илиденпроизводных
фрагмента в виде синглета при 7.62-8.09 м.д. и
тримера малононитрила [16-18]. Синтезированные
СН2 фрагментов пиперидина в виде мультиплетов.
соединения практически не флуоресцируют в рас-
ИК спектры представлены полосами поглощения
творах, но флуоресцируют в твердом состоянии. В
С=С стирильного фрагмента при 1615-1662 см-1,
данной статье нами представлены результаты по
сопряженных цианогрупп при 2201-2222 см-1, а
синтезу и исследованию спектрально-люминес-
также аминогрупп в области 3216-3480 см-1. В
760
СИНТЕЗ (Z)-2-АМИНО-4-(2-АРИЛ-1-ЦИАНОВИНИЛ)-6-ХЛОРПИРИДИН-3,5-ДИКАРБОНИТРИЛОВ
761
Схема 1
Ar
Ar
H
N
CN
CN
NC
CN
NC
CN
H2
Cl-
N
−
H2N
N
N
H2N
N Cl
1
2
Ar = Ph (a), 2-ClC6H4 (b), 4-MeOC6H4 (c), 3,4-diMeOC6H3 (d), 4-Me2NC6H4 (e).
масс-спектрах всех соединений максимальный
При исследовании спектрально-люминесцент-
пик с m/z 277 соответствует фрагментному иону
ных свойств соединений 2а-е выяснилось, что
[M - Ar]+.
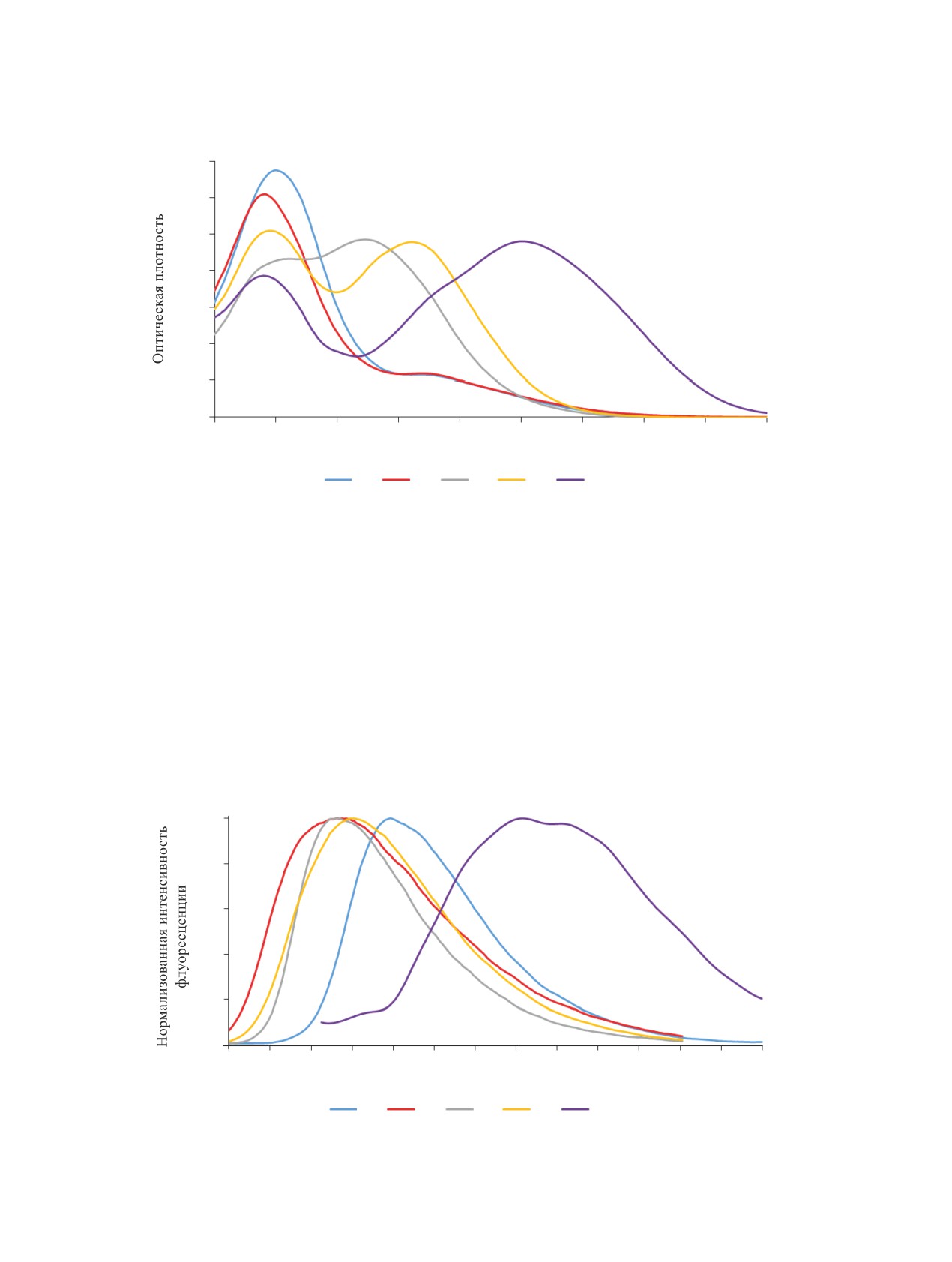
заместители в бензольном кольце не оказывают
влияние на положение коротковолнового максиму-
Синтезированные соединения 2a-e представля-
ма поглощения (табл. 2, рис. 2). Длинноволновый
ют собой кристаллические вещества светло-жел-
же максимум поглощения значительно сдвигается
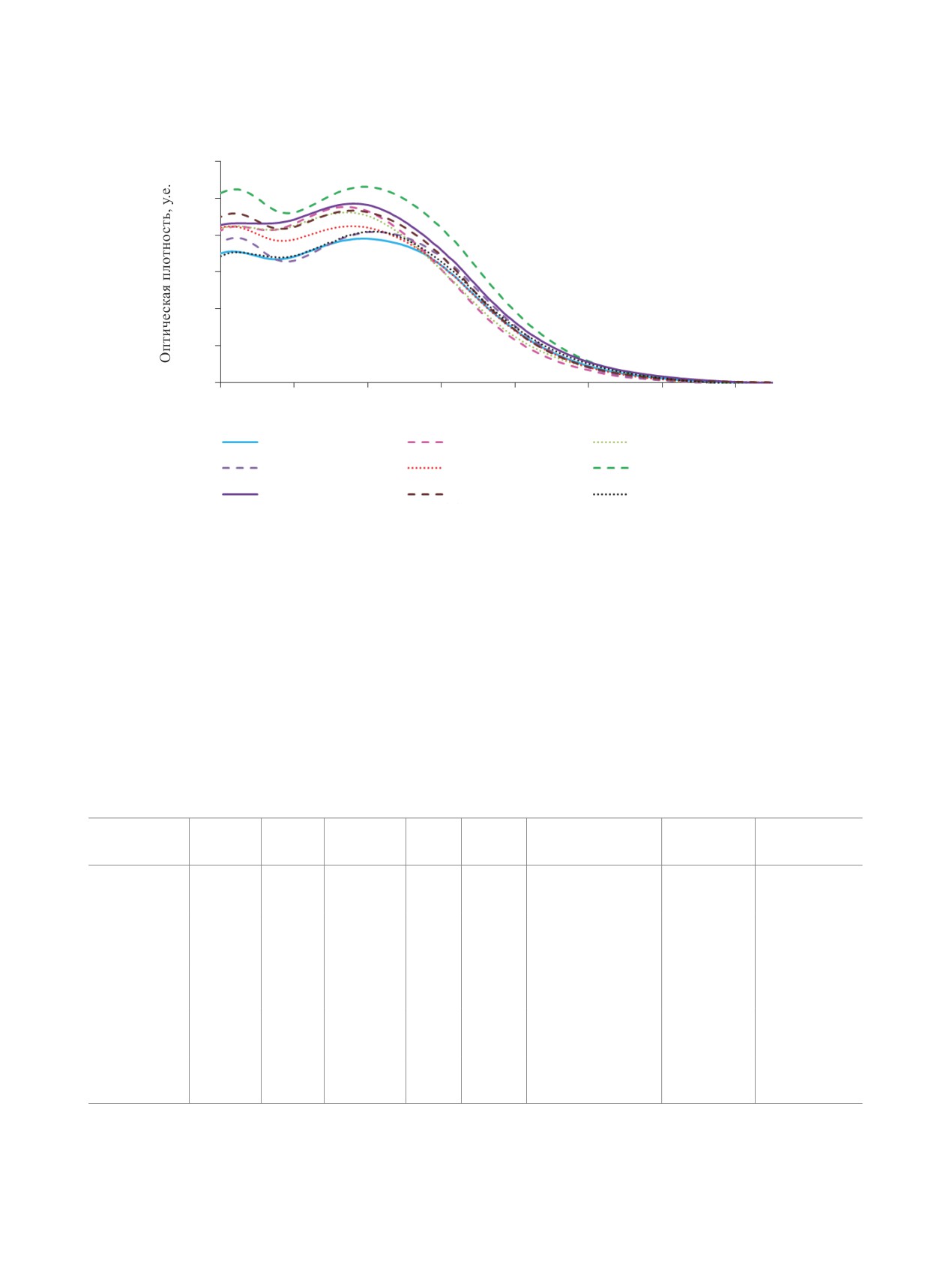
того цвета. Сольватохромные свойства были изу-
лишь при наличии диметиламиногруппы в бензо-
чены на примере соединения 2с (табл. 1, рис. 1).
льном кольце, однако обладает высокой интенсив-
Было обнаружено, что природа растворителя
ностью в случае всех соединений, содержащих до-
не оказывает существенного влияния на интен-
норные заместители. В растворе соединения 2а-е
сивность и положение максимума поглощения.
также практически не флуоресцируют, заметная
Флуоресценция в растворах соединения 2с прак-
флуоресценция наблюдалась лишь в случае соеди-
тически не наблюдается.
нений 2d, е.
Таблица 1. Оптические свойства соединения 2c в разных растворителях
Растворитель
λabs, нм
A
ε, M-1 см-1
lg ε
304
0.262
26200
4.42
Дихлорметан
339
0,266
26600
4.42
304
0.177
17700
4.25
Пиридин
341
0.205
20500
4.31
303
0.212
21200
4.33
Уксусная кислота
336
0.212
21200
4.33
305
0.212
21200
4.33
Ацетонитрил
334
0.231
23100
4.36
303
0.178
17800
4.25
Этанол
339
0.195
19500
4.29
306
0.216
21600
4.33
ДМСО
336
0.243
24300
4.38
304
0.212
21200
4.33
Этилацетат
335
0.238
23800
4.38
305
0.196
19600
4.29
Бензол
342
0.204
20400
4.31
304
0.229
22900
4.36
Диоксан
336
0.233
23300
4.37
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
762
БАРДАСОВ, АЛЕКСЕЕВА
0.30
0.25
0.20
0.15
0.10
0.05
0.00
300
320
340
360
380
400
420
440
Длина волны, нм
Этанол
Этилацетат
Ацетонитрил
Бензол
Уксусная кислота
Хлористый метилен
ДМСО
Диоксан
Пиридин
Рис. 1. Спектры поглощения соединения 2с в различных растворителях
Соединения 2 хорошо испускают в твердом
(суспензия в вазелиновом масле). Спектры ЯМР
состоянии. Из заместителей в бензольном кольце
1Н и
13C зарегистрированы на спектрометре
лишь наличие диметиламиногруппы оказывает
Bruker DRX-400 (США) в ДМСО-d6, внутренний
значительное влияние на положение максимума
стандарт ТМС. Масс-спектры записаны на прибо-
твердофазной флуоресценции, сильно сдвигая его
ре Shimadzu GCMS-QP2020 (Япония) (ионизация
в длинноволновую область, при этом значительно
ЭУ, 70 эВ). Элементный анализ выполнен на CHN-
уменьшается относительная интенсивность флуо-
анализаторе vario Micro cube (Германия). Спектры
ресценции (рис. 3).
поглощения сняты на спектрофотометре Cary 60
(США). Спектры флуоресценции сняты на при-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
боре Cary Eclipse (США). Температуры плавления
ИК спектры зарегистрированы на Фурье-
определены на автоматическом приборе OptiMelt
спектрометре ФСМ-1202 (Россия) в тонком слое
MPA100 (США). Контроль за ходом реакций и
Таблица 2. Оптические свойства соединений 2
Стоксов сдвиг,
Соединение
λabs, нм
A
ε, M-1 см-1
lg ε
λem, нм
λem.sol., нма
Отн. инт., у.е.b
см-1 (нм)
300
0.338
33800
4.53
2a
-
-
499
332
360
0.058
5800
3.76
295
0.305
30500
4.48
2b
-
-
475
271
360
0.059
5900
3.77
306
0.216
21600
4.33
2с
-
-
472
1721
336
0.243
24300
4.39
298
0.255
25500
4.41
2d
519
8822 (163)
480
595
356
0.239
23900
4.38
295
0.193
19300
4.29
2e
526
5989 (126)
564
5
400
0.243
24300
4.38
a Максимум флуоресценции в твердом состоянии
b Относительная интенсивность флуоресценции в твердом состоянии
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ (Z)-2-АМИНО-4-(2-АРИЛ-1-ЦИАНОВИНИЛ)-6-ХЛОРПИРИДИН-3,5-ДИКАРБОНИТРИЛОВ
763
0.35
0.30
0.25
0.20
0.15
0.10
0.05
0.00
275
300
325
350
375
400
425
450
475
500
Длина волны, нм
2a
2b
2c
2d
2e
Рис. 2. Спектры поглощения соединений 2a-e
чистотой синтезированных соединений осущест-
в течение 4 ч. После окончания реакции (ТСХ), ре-
влён методом ТСХ на пластинах Sorbfil ПТСХ-
акционную массу охлаждали до комнатной темпе-
АФ-А-УФ, элюент EtOAc, проявление УФ облуче-
ратуры, добавляли 10 мл воды, выпавший осадок
нием, парами иода и термическим разложением.
отфильтровывали, промывали дистиллированной
Соединения (1) были синтезированы по методике
водой, перекристаллизовывали из 1,4-диоксана.
[15]. Пиперидин, ч - коммерческий продукт.
Выход 0.340 г (96%), т.пл. 213-214°С (разл.). ИК
(Z)-2-Амино-6-(пиперидин-1-ил)-4-(2-фенил-
спектр, ν, см-1: 3480, 3362, 3224 (NH2), 2220, 2203
1-циановинил)пиридин-3,5-дикарбонитрил
(CN), 1615 (C=C). Спектр ЯМР 1Н (ДМСО-d6), δ,
(2a). Смесь 0.306 г (1 ммоль) (Z)-2-амино-6-хлор-
м.д.: 1.48-1.78 м [6H, (СН2)3], 3.63-3.88 м [4H,
4-(2-фенил-1-циано-винил)пиридин-3,5-дикарбо-
(СН2)2], 7.53-7.86 м (5H, С6Н5, NH2), 7.89-8.02
нитрила 1 и 0.255 г (3 ммоль) пиперидина в 5 мл
м (3H, С6Н5, СH). Масс-спектр, m/z (Iотн, %): 354
1,4-диоксана перемешивали при температуре 70°С
(21), 277 (100). Найдено, %: C 71.32; H 5.06; N
1
0.8
0.6
0.4
0.2
0
420
440
460
480
500
520
540
560
580
600
620
640
660
680
Длина волны, нм
2a
2b
2c
2d
2e
Рис. 3. Спектры твердофазной флуоресценции соединений 2a-e
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
764
БАРДАСОВ, АЛЕКСЕЕВА
23.62. C21H18N6. Вычислено, %: C 71.17; H 5.12; N
66.65; H 5.35; N 20.28. M 414.47.
23.71. M 354.42.
(Z)-2-Амино-4-{2-[4-(диметиламино)фенил]-
Соединения 2b-e получали аналогично.
1-циановинил}-6-(пиперидин-1-ил)пиридин-
3,5-дикарбонитрил (2e). Выход 90%, т.пл. 230-
(Z)-2-Амино-6-(пиперидин-1-ил)-4-[2-(2-
231°С (разл.). ИК спектр, ν, см-1: 3432, 3335 (NH2),
хлорфенил)-1-циановинил]пиридин-3,5-ди-
2201, 2222 (CN), 1629 (C=C). Спектр ЯМР 1Н
карбонитрил (2b). Выход 90%, т.пл. 210-211°С
(ДМСО-d6), δ, м.д.: 1.56-1.70 м [6H, (СН2)3], 3.07 с
(разл.). ИК спектр, ν, см-1: 3360, 3216 (NH2), 2220
[6H, N(СH3)2], 3.70-3.80 м [4H, (СН2)2], 6.85 д (2H,
(CN), 1620 (C=C). Спектр ЯМР 1Н (ДМСО-d6), δ,
С6Н4, J 9.2 Гц), 7.53 уш.с (2H, NH2), 7.62 с (1H,
м.д.: 1.58-1.73 м [6H, (СН2)3], 3.71-3.84 м [4H,
CH), 7.88 д (2H, С6Н4, J 9.2 Гц). Спектр ЯМР 13С
(СН2)2], 7.52-7.87 м (5H, С6Н4, NH2), 7.95 д.д (1H,
(ДМСО-d6), δ, м.д.: 24.49, 26.22, 40.22, 48.97, 80.84,
С6Н4, J 6.7, J 2.7 Гц), 8.09 с (1H, CH). Масс-спектр,
81.31, 95.45, 112.27, 116.19, 117.82, 118.00, 120.07,
m/z (Iотн, %): 388 (14), 277 (100). Найдено, %: C
132.68, 152.43, 153.48, 156.76, 160.46, 161.05. Масс-
64.97; H 4.36; N 21.55. C21H17ClN6. Вычислено, %:
спектр, m/z (Iотн, %): 397 (100), 277 (53). Найдено,
C 64.86; H 4.41; N 21.61. M 388.86.
%: C 69.38; H 5.90; N 24.73. C23H23N7. Вычислено,
(Z)-2-Амино-4-[2-(4-метоксифенил)-1-циано-
%: C 69.50; H 5.83; N 24.67. M 397.49.
винил]-6-(пиперидин-1-ил)-пиридин-3,5-дикар-
ЗАКЛЮЧЕНИЕ
бонитрил
(2c). Выход
86%, т.пл.
224-225°С
Были синтезированы (Z)-2-амино-4-(2-арил-1-
(разл.). ИК спектр, ν, см-1: 3436, 3334,
3226
циановинил)-6-(пиперидин-1-ил)пиридин-3,5-ди-
(NH2), 2211, 2222 (CN), 1634 (C=C). Спектр ЯМР
карбонитрилы 2 и исследованы их спектраль-
1Н (ДМСО-d6), δ, м.д.: 1.55-1.70 м [6H, (СН2)3],
но-люминесцентные свойства. Как и ожидалось,
3.70-3.82 м [4H, (СН2)2], 3.87 с (3H, ОСH3), 7.18
исходя из их строения, соединения 2 флуоресци-
д (2H, С6Н4, J 8.9 Гц), 7.62 уш.с (2H, NH2), 7.83
руют в твердом состоянии с максимумами в диапа-
с (1H, CH), 7.98 д (2H, С6Н4, J 8.9 Гц). Спектр
зоне 472-564 нм и практически не флуоресцируют
ЯМР 13С (ДМСО-d6), δ, м.д.: 24.46, 26.22, 48.90,
в растворах. Нами планируется дальнейшее изуче-
56.30, 80.99, 81.26, 100.79, 115.53, 115.95, 116.90,
ние данных соединений, в том числе исследование
117.62,
125.53,
132.47,
152.21,
155.88,
160.28,
AIE и влияния амина на оптические свойства.
160.61, 163.16. Масс-спектр, m/z (Iотн, %): 384 (32),
277 (100). Найдено, %: C 68.60; H 5.30; N 21.92.
ФОНДОВАЯ ПОДДЕРЖКА
C22H20N6O. Вычислено, %: C 68.73; H 5.24; N
Исследование проведено в рамках гранта
21.86. M 384.44.
Президента Российской Федерации для государ-
(Z)-2-Амино-4-[2-(3,4-диметоксифенил)-1-
ственной поддержки молодых российских ученых
циановинил]-6-(пиперидин-1-ил)пиридин-3,5-
МК-115.2021.1.3 (соглашение № 075-15-2021-081).
дикарбонитрил (2d). Выход 88%, т.пл. 226-227°С
ИНФОРМАЦИЯ ОБ АВТОРАХ
(разл.). ИК спектр, ν, см-1: 3439, 3379, 3220 (NH2),
Бардасов Иван Николаевич, ORCID: https://
2208, 2221 (CN), 1662 (C=C). Спектр ЯМР 1Н
orcid.org/0000-0002-5843-3381
(ДМСО-d6), δ, м.д.: 1.58-1.69 м [6H, (СН2)3], 3.71-
3.79 м [4H, (СН2)2], 3.84 с (3H, ОСH3), 3.88 с (3H,
Алексеева Анастасия Юрьевна, ORCID: https://
ОСH3), 7.20 д (1H, С6Н3, J 8.5 Гц), 7.58 д.д (1H,
orcid.org/0000-0001-5607-6969
С6Н3, J 8.5, J 2.2 Гц), 7.61 уш.с (2H, NH2), 7.70 д
КОНФЛИКТ ИНТЕРЕСОВ
(1H, С6Н3, J 2.1 Гц), 7.80 с (1H, CH). Спектр ЯМР
Авторы заявляют об отсутствии конфликта ин-
13С (ДМСО-d6), δ, м.д.: 24.46, 26.22, 48.91, 56.13,
тересов.
56.48, 80.96, 81.26, 100.68, 112.14, 112.58, 115.94,
117.04,
117.62,
125.60,
125.73,
149.44,
152.52,
СПИСОК ЛИТЕРАТУРЫ
153.16, 155.86, 160.31, 160.68. Масс-спектр, m/z
1. Tang B.Z., Zhan X., Yu G., Sze Lee P.P., Liu Y.,
(Iотн, %): 414 (17), 277 (100). Найдено, %: C 66.77;
Zhu D. J. Mater. Chem. 2001, 11, 2974-2978. doi
H 5.28; N 20.21. C23H22N6O2. Вычислено, %: C
10.1039/B102221K
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
СИНТЕЗ (Z)-2-АМИНО-4-(2-АРИЛ-1-ЦИАНОВИНИЛ)-6-ХЛОРПИРИДИН-3,5-ДИКАРБОНИТРИЛОВ
765
2.
Luo J., Xie Z., Lam J.W.Y., Cheng L., Tang B.Z.,
14.
Zhou S., Lu Q., Sun Y., Liu Z., Yu X. J. Photochem.
Chen H., Qiu C., Kwok H.S., Zhan X., Liu Y.,
Photobiol. A Chem. 2020, 389, 112212. doi 10.1016/
Zhu D. Chem. Commun.
2001,
1740-1741. doi
j.jphotochem.2019.112212
10.1039/b105159h
15.
Bardasov I.N., Alekseeva A.U., Ershova A.I.,
3.
Kumari B., Paramasivam M., Dutta A., Kanvah S.
Ershov O.V. Tetrahedron Lett. 2021, 76, 153232. doi
ACS Omega. 2018, 3, 17376-17385. doi 10.1021/
10.1016/j.tetlet.2021.153232
acsomega.8b02775
16.
Bardasov I.N., Alekseeva A.U., Tafeenko V.A.,
4.
Xu Z., Gu J., Huang J., Lin C., Li Y., Yang D., Qiao X.,
Qin A., Zhao Z., Tang B.Z., Ma D. Mater. Chem. Front.
Ershov O.V. Tetrahedron Lett. 2017, 58. doi 10.1016/
2019, 3, 2652-2658. doi 10.1039/C9QM00539K
j.tetlet.2017.09.012
5.
Venkatramaiah N., Kumar G.D., Chandrasekaran Y.,
17.
Alekseeva A.U., Dianov N.P., Yashchenko N.N.,
Ganduri R., Patil S. ACS Appl. Mater. Interfaces. 2018,
Zhitar’ S.V., Bardasov I.N. Russ. J. Org. Chem. 2020,
10, 3838-3847. doi 10.1021/acsami.7b11025
56, 763-767. doi 10.1134/S1070428020050061
6.
Zhang J., Bai Y., Wei Q., Cao L., Wang T., Ge Z.
18.
Bardasov I.N., Alekseeva A.Y., Mel’nik E.A., Ersho-
J. Mater. Chem. C. 2020, 8, 11771-11777. doi 10.1039/
va A.I., Ershov O.V. Russ. J. Org. Chem. 2021, 57,
d0tc02566f
1063-1067. doi 10.1134/S1070428021070058
7.
Li M., Huang Y., Song S., Shuang S., Dong C. Bioorg.
Chem. 2021, 105484. doi 10.1016/j.bioorg.2021.105484
19.
Fedoseev S.V., Ershova A.I., Lipin K.V., Mel’nik E.A.,
Ershov O.V. Russ. J. Org. Chem. 2021, 57, 1361-1364.
8.
Mukherjee T., Soppina V., Ludovic R., Mély Y.,
Klymchenko A.S., Collot M., Kanvah S. Org. Biomol.
doi 10.1134/S1070428021080170
Chem. 2021, 19, 3389-3395. doi 10.1039/d0ob02378g
20.
Bardasov I.N., Alekseeva A.Y., Mel’nik E.A., Ersho-
9.
Ren H., Huo F., Yin C. New J. Chem. 2021, 45, 4724-
va A.I., Ershov O.V. Russ. J. Org. Chem. 2021, 57,
4728. doi 10.1039/d0nj05807f
1063-1067. doi 10.1134/S1070428021070058
10.
Jang M., Kang S., Han M.S. Dye. Pigm. 2019, 162,
21.
Bardasov I.N., Alekseeva A.Y., Mikhailov D.L.,
978-983. doi 10.1016/j.dyepig.2018.11.031
Ershova I., Ershov O.V. Russ. J. Org. Chem. 2020, 56,
11.
Lim N.Y., Ahn J., Won M., Choi W., Kim J.S., Jung J.H.
1491-1494. doi 10.1134/S1070428020080230
ACS Appl. Bio Mater. 2019, 2, 936-942. doi 10.1021/
22.
Bardasov I.N., Alekseeva A.Y., Mikhailov D.L.,
acsabm.8b00796
Ershova A.I., Ershov O.V. Russ. J. Org. Chem. 2020,
12.
Jia J., Wen J. Tetrahedron Lett. 2020, 61, 151577. doi
56, 1501-1504. doi 10.1134/S1070428020080266
10.1016/j.tetlet.2019.151577
23.
Ershov O.V., Mikhailov D.L., Bardasov I.N., Iev-
13.
Jana P., Paramasivam M., Khandelwal S., Dutta A.,
Kanvah S. New J. Chem. 2020, 44, 218-230. doi
lev M.Y., Belikov M.Y. Russ. J. Org. Chem. 2017, 53,
10.1039/c9nj03693h
886-890. doi 10.1134/S1070428017060124
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022
766
БАРДАСОВ, АЛЕКСЕЕВА
Synthesis of (Z)-2-Amino-4-(2-aryl-1-cyanovinyl)-
6-(piperidin-1yl)pyridine-3,5-dicarbonitriles
and Study of their Optical Properties
I. N. Bardasov* and A. U. Alekseeva
Chuvash State University named after I.N. Ulyanov, Moskovskii prosp., 15, Cheboksary, 428015 Russia
*e-mail: bardasov.chem@mail.ru
Received January 14, 2022; revised February 10, 2022; accepted February 13, 2022
(Z)-2-Amino-4-(2-aryl-1-cyanovinyl)-6-(piperidin-1-yl)pyridine-3,5-dicarbonitriles were obtained via reaction
of piperidine with (Z)-2-amino- 4-(2-aryl-1-cyanovinyl)-6-chloropyridine-3,5-dicarbonitriles. The study of the
spectral-luminescent properties showed the presence of fluorescence in the solid state with a maximum in the
region of 472-564 nm and its almost complete absence in solutions.
Keywords: α-cyanostilbazoles, nucleophilic substitution, solid state fluorescence
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 7 2022