ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 8, с. 851-861
Памяти академика РАН А.И. Коновалова
УДК 547.639.5 + 541.64
СИНТЕЗ И КОМПЛЕКСООБРАЗУЮЩИЕ СВОЙСТВА
НОВЫХ ЛЮМИНЕСЦЕНТНЫХ ГИДРОХИНОН-
ФОРМАЛЬДЕГИДНЫХ ГЕКСАМЕРОВ
© 2022 г. Л. И. Махмутова, Д. Н. Шурпик*, Д. И. Стойков, Н. Р. Лачугина,
А. А. Ханнанов, О. А. Мостовая, И. И. Стойков**
ФГАОУ ВО «Казанский (Приволжский) федеральный университет», Химический институт им. А.М. Бутлерова,
420008, Россия, Казань, ул. Кремлевская, 18
*e-mail: dnshurpik@mail.ru
**e-mail: ivan.stoikov@mail.ru
Поступила в редакцию 29.05.2022 г.
После доработки 20.06.2022 г.
Принята к публикации 23.06.2022 г.
Впервые поликонденсаций 1,4-бис(2-бромэтокси)бензола с параформом синтезирован гексамерный про-
дукт, обладающий флуоресцентными свойствами. Предложен метод функционализации соответствую-
щего гексамера полярными имидазолиевыми фрагментами с получением водорастворимого соединения.
Обнаружено наличие в фосфатном буфере при pH 7.4 самоассоциатов водорастворимого гексамера с
гидродинамическим диаметром 141 нм. Изучены закономерности влияния макроциклических платформ
пиллар[5]арена, пиллар[6]арена и их немакроциклического аналога, содержащих имидазолиевые фраг-
менты, на взаимодействие с белками: лизоцимом, бычьим сывороточным альбумином и гемоглобином.
Методом спектрофотометрического титрования установлены стехиометрия ассоциата водораствори-
мого гексамера с бычьим сывороточным альбумином (2:1) и константы ассоциации: K1:1 5166 М-1,
K2:1 102334 М-1. По данным флуоресцентной спектроскопии, образующиеся ассоциаты гексамер/белок
способны к флуоресценции при облучении в широком диапазоне длин волн (λвозб 290-380 нм).
Ключевые слова: гидрохинон-формальдегидные смолы, макроциклы, системы доставки лекарственных
средств, флуоресценция, пиллар[n]арены
DOI: 10.31857/S0514749222080092, EDN: DCLUKV
ВВЕДЕНИЕ
В последние годы одним из активно изучаемых
типов макроциклов являются пиллар[n]арены [3].
Одной из актуальных задач на стыке орга-
С момента первого получения [4] пиллар[n]арены
нической и супрамолекулярной химии является
показали свою эффективность при создании си-
получение полифункциональных соединений с
стем для адсорбции молекул, в качестве ионных
флуоресцентными свойствами, а также способно-
каналов, в катализе, а также в качестве перено-
стью селективно связывать различные по природе
счиков лекарственных средств [5-15]. Пиллар[n]-
аналиты [1]. В то же время макроциклы находят
арены представляют собой фрагменты п-гидро-
применение в качестве биосенсоров в иммуноло-
хинона, соединенные между собой метиленовы-
гическом тестировании, а также при создании сти-
ми мостиками [4]. Основным методом получения
мул - чувствительных динамических систем для
пиллар[n]аренов является термодинамически и
адресной доставки лекарственных средств [2].
кинетически контролируемая реакция макро-
851
852
МАХМУТОВА и др.
Схема 1
Br
Br
Br
Br
Br
Br
O
O
O
O
O
(CH2O)
O
n
Me(SO3)H
+
+
CHCl3
4
O
O
5
O
6
O
O
O
Br
Br
Br
Br
Br
Br
1
2
3
4 (89%)
циклизации отдельных O-замещенных гидрохино-
В представленной работе решена задача син-
новых фрагментов в присутствии параформа [8].
теза ациклического аналога пиллар[6]арена, со-
Для пиллар[n]аренов характерно напряжение ма-
держащего 2-бромэтоксильные фрагменты. Также
кроциклической системы, что обуславливает необ-
были изучены спектральные и агрегационные
ходимость преодоления энергетического барьера
свойства водорастворимого олигомера, пиллар[5]-
для замыкания линейного олигомера в процессе
арена и пиллар[6]арена, содержащих фрагменты
макроциклизации [16]. В отличие от пиллар[5]-
N-метилимидазола, а также оценена их способ-
арена, синтезируемого в условиях термодинами-
ность к ассоциации с модельными белками: лизо-
ческого равновесия, синтез пиллар[6]аренов кон-
цимом, бычьим сывороточным альбумином (БСА)
тролируется термодинамикой и кинетикой [17].
и гемоглобином.
Протекание макроциклизации часто сопрово-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ждается образованием олигомеров нециклической
Удобным методом получения пиллар[n]аренов
структуры [4], изучение свойств которых в лите-
является поликонденсация 1,4-диалкоксибензолов
ратуре практически не описано. Так, основным
с параформальдегидом в присутствии в качестве
побочным продуктом в синтезе пиллар[n]аренов
катализатора кислот Льюиса. Данный процесс со-
являются аналоги гидрохинонформальдегидных
провождается образованием линейных олигоме-
смол [18]. Гидрохинон-формальдегидные смолы
ров, которые затем циклизуются в макроцикличе-
находят широкое применение в качестве синте-
скую систему [21].
тических редокс-ионитов поликонденсационно-
го типа [19]. В то же время хорошо известно, что
В качестве исходного соединения нами был вы-
ациклические полифункциональные аналоги ма-
бран коммерчески доступный 1,4-бис(2-бромэток-
кроциклов - поданды, обладают конформационно
си)бензол (схема 1), который широко используется
более подвижной структурой, что позволяет реа-
для получения перзамещенных пиллар[n]аренов
лизовывать принцип индуцированного соответ-
[22]. Реакцию 1,4-бис(2-бромэтокси)бензола с па-
ствия при распознавании целевых аналитов [20].
раформальдегидом в присутствии метансульфо-
В связи с этим нами была высказана гипотеза, что
кислоты проводили в хлороформе. Как и ожида-
линейный аналог пиллар[n]арена может быть ис-
лось, при уменьшении времени синтеза помимо
пользован в качестве такой конформационно гиб-
целевых пента-, гекса- и гептамерных макро-
кой структуры при распознавании целевых анали-
циклических продуктов в реакционной смеси рас-
тов, а варьирование условий (температуры и вре-
тет содержание целевого ациклического олигомер-
мени протекания) реакции 1,4-диалкоксибензола
ного продукта. Варьирование времени проведения
с формальдегидом позволит получить его с хоро-
взаимодействия
1,4-бис(2-бромэтокси)бензола с
шим выходом.
параформальдегидом (30 мин-2 ч) показало, что
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
СИНТЕЗ И КОМПЛЕКСООБР
АЗУЮЩИЕ СВОЙСТВА
853
8
6
ɇɚɣɞɟɧɨ
2044.8 [M + K]+
4
Br
Br
Br
Br
Br
Br
ȼɵɱɢɫɥɟɧɨ
2
O
O
O
O
O
O
2005.5 [M]+
0
O
O
O
O
O
O
0.1
1
10
100
1000
Br
Br
Br
Br
Br
Br
Ɋɚɡɦɟɪ d ɧɦ
Рис. 2. Размерное распределение частиц по интенсив-
ности в хлороформе гексамера 4 (1×10-3 М)
объясняется ограничением внутримолекулярных
вращений, колебаний или движений молекул либо
их фрагментов в агрегированном состоянии [25].
900
1300 1700 2100 2500 2900 3300 3700
m/z, Da
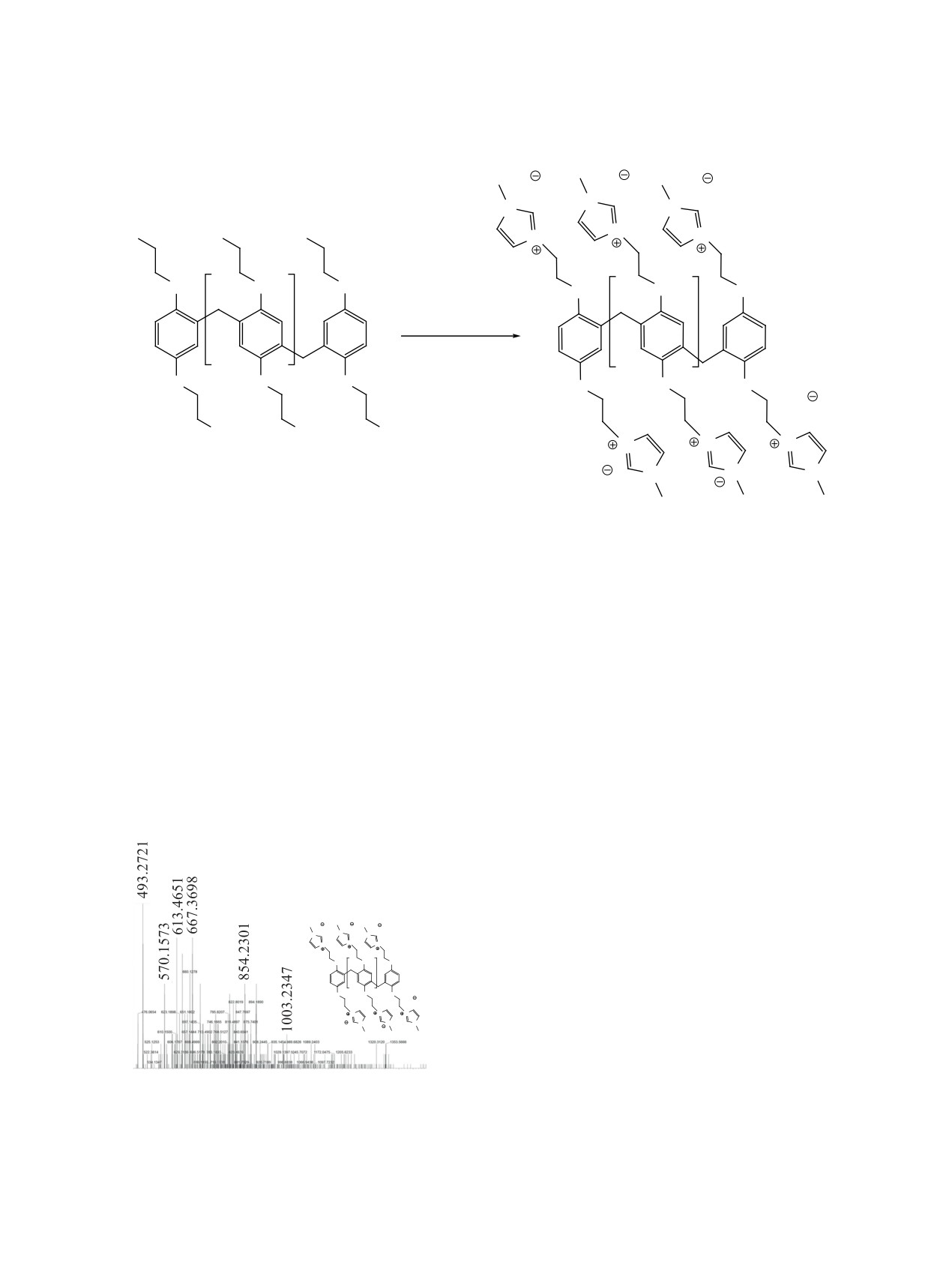
С целью подтверждения этой гипотезы нами
Рис. 1. МАЛДИ масс-спектр (2,5-дигидроксибензой-
были проведены исследования самоассоциации
ная кислота) соединения 4
гексамера 4 в растворе трихлорметана с помощью
максимальная концентрация целевого продукта
метода динамического светорассеяния (ДСР).
4 достигается через 1 ч. Гексамер 4 был выделен
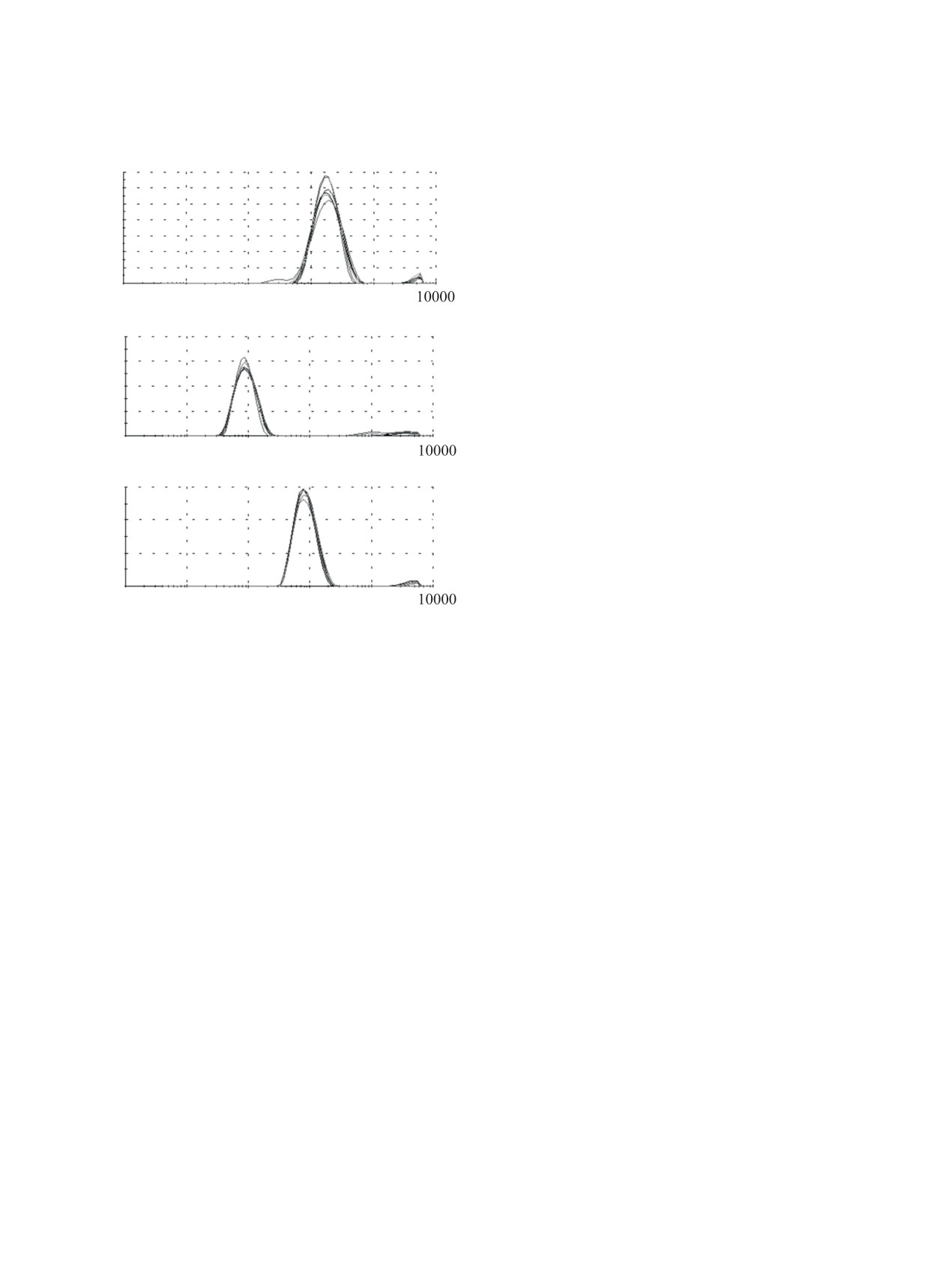
Было обнаружено, что гексамер 4 образует ассо-
при помощи колоночной хроматографии с выхо-
циаты (рис. 2) в изученном диапазоне концентра-
дом 89%. Структура продукта 4 была полностью
ций (10-3-10-5 М). Так, при концентрации 10-3 М
подтверждена комплексом физических методов:
кривая распределения гидродинамических раз-
одномерной ЯМР 1Н и 13С, ИК спектроскопией,
меров образца 4 имеет бимодальный характер.
масс-спектрометрией, а состав подтвержден дан-
Первый максимум соответствует среднему ди-
ными элементного анализа.
аметру частиц 3 нм, а второй пик 50 нм, индекс
полидисперсности системы (ИПД) составляет
Анализ масс-спектра МАЛДИ гексамера
4
0.45. Следует отметить, что при уменьшении кон-
(рис. 1) показал наличие пика 2444.2 единиц m/z,
центрации гексамера 4 наблюдается возрастание
соответствующего пику молекулярного иона гек-
среднего гидродинамического диаметра частиц до
самера 4 с ионом калия [M + K]+. Пик молекуляр-
700 нм. При этом значение полидисперсности так-
ного иона в масс-спектре МАЛДИ гексамера 4
соответствует наличию шести ди(бромалкокси)-
же резко возрастает до 1.
бензольных звеньев в его структуре.
Наличие АИЭ ассоциатов соединения 4 дела-
ет возможным использование подобных веществ
Изучение свойств продукта 4 методом спектро-
в качестве флуоресцентных меток визуализации
скопии электронного поглощения показало, что
гексамер поглощает в области λ 200-300 нм с длин-
процессов трансформации биологически актив-
новолновым максимумом при 290 нм. Методом
ных веществ или процессов, происходящих в жи-
флуоресцентной спектроскопии было показа-
вых системах [26]. В связи с нерастворимостью
но, что при возбуждении светом с длиной волны
гексамера 4 в водных системах вследствие его ги-
290 нм гексамер 4 способен к флуоресценции с
дрофобности в структуре олигомера атомы брома
максимумом испускания при 450 нм. Флуорес-
были замещены на фрагменты N-метилимидазолия
центные свойства гексамера 4 могут быть объ-
(схема 2). Так, N-метилимидазол был использован
яснены специфическим эффектом - агрегацион-
как удобный реагент введения полярных аммоние-
но-индуцированной эмиссией (АИЭ) [23]. Агре-
вых фрагментов в структуру гексамера 4. Реакцию
гационно-индуцированная эмиссия - это фотофи-
проводили в безводном ДМФА при температу-
зическое явление, связанное с агрегацией хромо-
ре 100°С. Выход соединения 5 составил
90%
форов, которое было обнаружено Тангом с соавто-
(схема 2), и оно оказалось растворимым в водно-
рами в 2001 г. [24]. В настоящее время эффект АИЭ
буферных системах.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
854
МАХМУТОВА и др.
Схема 2
Br
Br
Br
N
N
N
N
Br
Br
Br
N
N
O
O
O
O
O
O
N Ɇɟɬɢɥɢɦɢɞɚɡɨɥ
ȾɆɎȺ/100°C
4
4
O
O
O
O
O
O
Br
Br
Br
Br
N
N
N
N
N
N
Br
Br
4
5 (90%)
На рис. 3 представлен ESI масс-спектр высоко-
понимания [26]. Модельные белки активно приме-
го разрешения соединения 5. Анализ масс-спектра
няются в области тканевой инженерии для созда-
показал наличие пика 667.3698 единиц m/z, соот-
ния прототипов полимерных микро- или наноча-
ветствующий пику четырехзарядного молекуляр-
стиц для доставки лекарств или больших молекул,
ного иона гексамера 5 [M - 4Br]4+.
таких как белки или факторы роста, в системе in
vitro или in vivo [27], благодаря своей хорошей
Наноразмерные супрамолекулярные системы,
биосовместимости и способности к биологиче-
содержащие в своем составе белки, используются
скому разложению. В связи с этим создание новых
в различных областях медицины, пищевой про-
уникальных супрамолекулярных систем на осно-
мышленности и фармации [27]. Наличие флуорес-
ве белков, способных к управляемой самосборке
ценции у таких систем позволяет визуализировать
и обладающих флуоресцентными свойствами, яв-
процессы, происходящие на поверхности клеточ-
ляется актуальной задачей в области современной
ных мембран и внутри клетки, что важно для их
медицины и клеточной инженерии. Транспортные
белки, такие как лизоцим, БСА и гемоглобин, ча-
сто используются в качестве модельных биополи-
ɇɚɣɞɟɧɨ
меров благодаря хорошо известной и всесторонне
667.3698 [M - 4Br]4+
ȼɵɱɢɫɥɟɧɨ
изученной структуре [28].
2989.1507 [M]+
Для получения самособирающейся супрамо-
Br
Br
Br
N
N
N
лекулярной системы визуализации процессов,
N
N
N
O
O
O
происходящих в живых системах, в качестве флу-
оресцентной компоненты нами был выбран гекса-
4
O
O
O
Br
мер 5, а в качестве транспортного биополимера:
N
N
N
Br
N
N
N
лизоцим, БСА и гемоглобин.
Br
Стоит отметить, что в литературе достаточно
подробно описано взаимодействие белков с различ-
500
700
900
1100
1300
m/z, Da
ными видами макроциклов [30, 31]. Отмечалось,
что макроциклы взаимодействуют с белками за
Рис. 3. HR-ESI-ToF масс-спектр высокого соедине-
ния 5
счет своей полифункциональной предорганизо-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
СИНТЕЗ И КОМПЛЕКСООБР
АЗУЮЩИЕ СВОЙСТВА
855
Схема 3
N
Br
N
Br
O
O
N
N
CH3CN/150°C
O
5
O
5
Br
N
N
Br
2
6 (94%)
N
Br
Br
N
O
O
N
N
CH3CN/150°C
O
6
6
O
Br
N
N
Br
3
7 (93%)
ванной структуры и макроциклической полости,
ков нами по литературным методикам [32] были
в которую встраиваются фрагменты аминокислот,
синтезированы имидазолиевые производные пил-
входящих в состав пептидов. Однако гексамеры 4
лар[5]арена 6 и пиллар[6]арена 7 (схема 3).
и 5 не имеют жесткой пространственно предорга-
Далее методом ДСР были изучены процессы
низованной структуры и объемной макроцикличе-
самоассоциации макроциклов 6 и 7, а также гек-
ской полости, которая может участвовать в связы-
самера 5. Было обнаружено, что только гексамер
вании с субстратом, как у их макроциклических
5 образует самоассоциаты (рис. 4, а) в изученном
аналогов.
диапазоне концентраций (1×10-3-1×10-5 М) в фос-
С целью изучения влияния макроциклической
фатном буфере (pH 7.4). Так, при концентрации
полости на процесс связывания модельных бел-
1×10-4 М образуются монодисперсные ассоциаты
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
856
МАХМУТОВА и др.
света, что выражается подъемом базовой линии,
(a)
обусловленным процессами ассоциации гексаме-
12
ра 5 с БСА.
8
Стоит отметить, что гексамер 5 в фосфатном бу-
фере (pH 7.4), как и его предшественник 4 (рис. 5,
4
а), оказался флуоресцентно активным при облуче-
0
нии светом с длиной волны λ 320 нм, при котором
0.1
1
10
100
1000
наблюдается заметное испускание с максимумом
(b)
при 450 нм (рис. 5, а). Поэтому для установления
20
характеристик связывания 5 с белком был выбран
15
метод флуоресцентной спектроскопии. Так, при
10
добавлении БСА к гексамеру 5 наблюдается зна-
5
чительное тушение эмиссии (рис. 5, b). На основе
данных флуоресцентного титрования системы, в
0
0.1
1
10
100
1000
которой при постоянной концентрации 5 (10-5 M)
(c)
варьировалась концентрация БСА, удалось опре-
15
делить константу ассоциации.
10
Обработка результатов проводилась на основе
анализа изотерм связывания, для чего было ис-
5
пользовано приложение BindFit [33]. Было уста-
0
новлено, что стехиометрия образующихся ассоци-
0.1
1
10
100
1000
атов (гексамер 5/БСА) составила 2:1. Оказалось,
Рис. 4. Размерное распределение частиц по интенсив-
что константы ассоциации 5 с БСА составляют:
ности в фосфатном буфере (pH 7.4): (а) - гексамера 5
K1:1 5166 М-1, K2:1 102334 М-1. Дополнительно
(1×10-4 М), (b) - БСА (1×10-4 М), (c) - 5 (2×10-4 М)/
стехиометрия комплекса подтверждалась обсче-
БСА (1×10-4 М)
том кривых титрования в предположении моделей
(ИПД 0.26) со средним гидродинамическим ди-
связывания в соотношении «хозяин-гость» = 1:1 и
аметром 141 нм. Также было замечено, что при
1:2. Однако в этих случаях константа ассоциации
уменьшении концентрации гексамера 5 происхо-
определяется с большой ошибкой (> 10%).
дит монотонное увеличение гидродинамического
Для подтверждения гипотезы о супрамолеку-
диаметра частиц (194-820 нм). При этом значе-
лярной самосборке системы 5/БСА, обладающей
ние полидисперсности также растет (0.26-0.82).
флуоресцентными свойствами, методом ДСР были
Наличие процессов самоассоциации только у гек-
изучены ассоциаты 5/БСА в соотношении 2:1, 1:1,
самера 5 подтверждает ранее выдвинутую гипоте-
1:2 в диапазоне концентраций (1×10-3-1×10-5 М).
зу об АИЭ и может привести к наличию флуорес-
Так, в случае БСА средний гидродинамический
центных свойств у гексамера 5.
диаметр частиц в фосфатном буфере (pH 7.4) со-
Далее методами ДСР, УФ и флуоресцентной
ставил 8 нм с ИПД 0.21 (рис. 4, b). Стоит отметить,
спектроскопии было изучено взаимодействие со-
что ассоциация БСА с 5 сопровождается образо-
единений 5-7 с белками: лизоцимом, БСА и ге-
ванием монодисперсных наноразмерных систем
моглобином.
в широком диапазоне концентраций
(1×10-3-
Методом УФ спектроскопии было показано,
1×10-4 М). Минимальные значения ИПД (0.15)
что только гексамер 5 склонен взаимодействовать
были зафиксированы для соотношения 5/БСА =
с БСА. Так, при добавлении соединения 5 к БСА в
2:1 [С(5) = 2×10-4 М, С(БСА) = 1×10-4 М] со сред-
фосфатном буфере (pH 7.4) сдвига максимумов по-
ним гидродинамическим диаметром 80 нм (рис. 4,
глощения в УФ спектрах не наблюдается, но при-
c), что хорошо согласуется с данными флуоресцент-
сутствует гипохромный эффект в области 290 нм.
ного титрования. Высокие значения ζ-потенциала
Спектральная картина осложняется рассеянием
системы 5/БСА = 2:1 (ζ = +32.4 mV) дополнитель-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
СИНТЕЗ И КОМПЛЕКСООБР
АЗУЮЩИЕ СВОЙСТВА
857
(a)
(b)
450
400
4
800
μɆ
700
350
5
600
ȻɋȺ
300
500
250
400
P0
200
300
200
150
100
100
0
400
450
500
550
600
50
Ⱦɥɢɧɚ ɜɨɥɧɵ ɧɦ
0
400
420
440
460
480
Ⱦɥɢɧɚ ɜɨɥɧɵ ɧɦ
(c)
ɗɦɢɫɫɢɹ ɧɦ
Рис. 5. (а) - Спектры флуоресценции 5 (1×10-5 M) при различных концентрациях БСА (10-2×10-3 M) в фосфатном буфере
(pH 7.4); (b) - спектры флуоресценции олигомеров 4 (1×10-5 M) λвозб 290 нм в хлороформе и 5 (1×10-5 M) λвозб 320 нм
в фосфатном буфере (pH 7.4); (c) - интенсивность эмиссии ассоциата 5/БСА при различных длинах волн возбуждения в
фосфатном буфере (pH 7.4)
но подтверждают образование стабильной супра-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
молекулярной системы. Исследование нанораз-
Спектры ЯМР 1Н, 13C записывали на спектро-
мерных ассоциатов 5/БСА = 2:1 [С(5) = 2×10-4 М,
метре Bruker Avance 400 (Швейцария) на рабо-
С(БСА) = 1×10-4 М] методом флуоресцентной
чих частотах 400.0, 100.0 МГц соответственно.
спектроскопии показало, что данная система
Химические сдвиги определяли относительно
способна к интенсивной флуоресценции (λ 420-
сигналов остаточных протонов дейтерированного
520 нм) при облучении широким спектром длин
растворителя (СDCl3, D2O). Концентрация анали-
волн (300-380 нм) (рис. 5, c). Таким образом, об-
ладая данными спектральными характеристиками,
зируемых растворов составляла 3-5% (по массе).
полученная супрамолекулярная система может
ИК спектры нарушенного полного внутреннего от-
быть применена для изучения процессов, происхо-
ражения регистрировали на Фурье-спектрометре
дящих в живых системах с участием белков.
Spectrum 400 (Perkin Elmer) с приставкой НПВО
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
858
МАХМУТОВА и др.
Алмаз KRS-5: разрешение 1 см-1, накопление
ставляла 1 см, ширина щели - 1 нм. Для приготов-
64 скана, время регистрации 16 с, в интервале вол-
ления фосфатного буфера (pH 7.4) использовали
новых чисел 400-4000 см-1. Элементный анализ
деионизированную воду с удельным сопротив-
кристаллических образцов выполняли на приборе
лением > 18.0 MΩ cm. Деионизированную воду
Perkin Elmer 2400 Series II.
получали из системы очистки Millipore-Q. Запись
спектров поглощения олигомера 5 и соединений
Масс-спектры ионизации электрораспылени-
6, 7 с БСА (1×10-5-1×10-4 М) проводили через
ем (ИЭР или ESI) получены на масс-спектроме-
10 мин после смешивания растворов при 293 K.
тре AmazonX (Bruker Daltonik GmbH, Бремен,
Для каждой серии было проведено по три незави-
Германия). Измерения проводились в режиме ре-
симых эксперимента.
гистрации положительных ионов в диапазоне m/z
от 100 до 2800. Напряжение на капилляре -4500
Динамическое рассеяние света (ДРС). Размер
В. В качестве газа-осушителя использовался азот
частиц определяли с помощью прибора Zetasizer
с температурой 300°С и расходом 10 л∙мин-1.
Nano ZS при 298 K. Прибор содержит гелий-не-
Соединения растворяли в воде до концентрации
оновый лазер мощностью 4 мВт, работающий на
10-6 г/л. Данные обрабатывались с помощью про-
длине волны 633 нм, и встроенную оптику неин-
граммы DataAnalysis 4.0 (Bruker Daltonik GmbH,
вазивного обратного рассеяния (NIBS). Измерения
Бремен, Германия).
проводились при угле обнаружения 173°, и про-
Спектры МАЛДИ регистрировали на масс-спек-
граммное обеспечение автоматически опреде-
трометре Ultraflex III. В качестве матрицы была
ляло положение измерения в кварцевой кювете.
использована 2,5-дигидроксибензойная кислота.
Соотношения концентраций олигомера/ БСА со-
Температуру плавления веществ определяли на
ставляли 1:1, 2:1, 1:2, а концентрация соедине-
нагревательном столике «Boetius». Контроль чи-
ний варьировалась в диапазоне 1×10-3-1×10-5 М.
стоты соединений проводили по температурам ки-
Эксперименты проводились для каждого образца
пения и плавления, а также по спектрам ЯМР 1Н.
не менее трех раз.
Дополнительно чистоту веществ контролировали
Дзета (ζ) потенциалы измеряли на Zetasizer
методом ТСХ на пластинках Silica 200 μm, UV
Nano ZS от Malvern Instruments. Образцы готовили
254. ТСХ-пластинки проявляли облучением при λ
так же, как и для измерений DLS, и переносили
254 нм.
шприцем в одноразовую складчатую капиллярную
Спектры флуоресценции регистрировали на лю-
ячейку для измерения. Дзета-потенциалы измеря-
минесцентном спектрометре LS-55 (PerkinElmer)
ли с использованием метода Malvern M3-PALS и
с использованием термостата для кюветы Пельтье
усредняли по трем измерениям.
RTR1. Длина волны возбуждения варьировалась
Макроциклы 2, 3, 6 и 7 были синтезированы по
от 300 до 380 нм. Диапазон сканирования длин
литературной методике [29].
волн составлял 400-650 нм. Щели монохрома-
торов возбуждения и испускания были выбраны
Гексамер
1,4-бис(2-бромэтокси)бензола c
1 нм. Использовались кварцевые кюветы с длиной
формальдегидом
(4). В круглодонную колбу,
оптического пути 10 мм. Для предотвращения воз-
снабженную магнитной мешалкой, помещали
никновения эффекта внутреннего фильтра кювета
0.09 г (3 ммоль) параформальдегида, 17.5 мл хло-
размещалась во фронтальной позиции. Спектры
роформа, 0.5 г (1.5 ммоль) 1,4-бис(2-бромэтокси)-
флуоресценции в буфере для системы гексамер
бензола и 0.3 мл (4.5 ммоль) метансульфокислоты.
(2×10-4 М)/БСА (1×10-5 М) регистрировали при
Реакцию проводили при 0°C в течение 1 ч. Затем
298 K. Растворы исследуемых систем измеряли
полученную смесь промывали дистиллированной
после часовой инкубации при комнатной темпера-
водой (2×30 мл), органический слой отделяли на
туре. Спектры соединения 4 в хлороформе запи-
делительной воронке и концентрировали при по-
сывались в аналогичных условиях.
ниженном давлении. Продукт олигомеризации
Спектры УФ регистрировали на спектрометре
был выделен при помощи колоночной хроматогра-
Shimadzu UV-3600. Длина оптического пути со-
фии (петролейный эфир-хлористый метилен, 1:2).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
СИНТЕЗ И КОМПЛЕКСООБР
АЗУЮЩИЕ СВОЙСТВА
859
Выход 0.6 г (89%), т.пл. 98°C. ИК спектр, ν, см-1:
диаметром 141 нм и ИПД = 0.26. Изучены зако-
2948 (ArH), 2804 (CH2), 1254 (Ar-O-CH2), 768
номерности влияния макроциклических платформ
[Br-(CH2)2]. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.55-
пиллар[5]аренов, пиллар[6]аренов и их ацикличе-
1.59 м (6H, CH2CH3), 3.46-3.60 м (24H, CH2Br),
ского аналога, содержащих имидазолиевые фраг-
3.82-3.94 м (12H, Ar-CH2-Ar), 4.09-4.21 м (24H,
менты, на взаимодействие с белками: лизоцимом,
OCH2), 6.64-6.75 м
(12H, ArH). Спектр ЯМР
БСА и гемоглобином. Выявлены преимущества
13C (CDCl3), δ, м.д.: 30.38, 69.23, 115.72, 128.80,
при связывании с БСА имидазолиевых произво-
150.47. Масс-спектр (MALDI-TOF), m/z: 2044.8
дных, обладающих конформационно более под-
[M + K]+. Найдено, %: C 38.98; H 3.81; Br 47.01.
вижной ациклической структурой, по сравнению
C68H78Br12O12. Вычислено, %: C 39.92; H 3.84; Br
с соответствующими макроциклическими ана-
46.86. M 2005.5.
логами. Методом флуоресцентного титрования
Методика фунционализации гексамера
4
установлена стехиометрия образующихся ассоци-
атов 5/БСА (2:1) с константами ассоциации: K1:1
N-метилимидазолом (5). В круглодонную кол-
бу, снабженную магнитной мешалкой, помещали
5166 М-1, K2:1 102334 М-1. Анализ результа-
0.28 мл (3 ммоль) N-метилимидазола, 2 мл ДМФА
тов ДСР показал наличие устойчивых ассоци-
и 0.1 г (0.05 ммоль) продукта 4. Реакцию проводи-
атов 5/БСА = 2:1 [С(5) = 2×10-4 М, С(БСА) =
ли при 100°C в течение 48 ч. Затем темно-корич-
1×10-4 М] со средним гидродинамическим ди-
невую реакционную смесь охлаждали до комнат-
аметром 80 нм и ИПД = 0.15. По данным флуо-
ной температуры и выливали в диэтиловый эфир
ресцентной спектроскопии ассоциаты 5/БСА = 2:1
(10 мл). Выпавший осадок собирали фильтрова-
обладают интенсивной флуоресценцией при об-
нием, промывали диэтиловым эфиром и сушили
лучении широким интервалом длин волн (λ 290-
в эксикаторе при пониженном давлении. Выход
380 нм). Полученные результаты открывают воз-
0.34 г (90%), т.пл. 105°C. ИК спектр, ν, см-1: 1726
можность использования подобных флуоресцент-
[C(O)-NH], 1465 (С=О), 1243 (C-O-C). Спектр
ных гидрохинон-формальдегидных соединений в
ЯМР 1H (D2O), δ, м.д.: 3.64-3.69 м (12H, Ar-CH2-
области тканевой инженерии для создания прото-
Ar), 4.04-4.46 м (24H, O-CH2-CH2), 4.24-4.54
типов систем визуализации и доставки лекарств
м (24H, O-CH2-CH2), 6.41 уш.с (12H, ArH), 7.33
или больших молекул, таких как белки или факто-
с (12H, CHимидазол), 7.41 с (12H, CHимидазол). 7.89
ры роста in vitro или in vivo.
с (12H, CHимидазол). Спектр ЯМР 13C (D2O), δ,
ФОНДОВАЯ ПОДДЕРЖКА
м.д.: 39.60, 46.45, 66.87, 114.50, 116.87, 117.15,
124.36, 125.38, 129.78, 137.48, 152.72. Масс-спектр
Работа выполнена при финансовой поддержке
(MALDI-TOF), m/z: 667.3698 [M - 4Br]4+. Найдено,
РНФ, проект № 22-13-00070.
%: C 66.89; H 7.15; N 16.01. C116H150N24O12. Вы-
Регистрация ЯМР и масс-спектров проводилась
числено, %: C 67.22; H 7.30; N 16.22. M 2989.1507.
за счет средств Программы стратегического акаде-
ЗАКЛЮЧЕНИЕ
мического лидерства Казанского (Приволжского)
федерального университета («Приоритет-2030»).
Взаимодействием
1,4-бис(2-бромэтокси)бен-
зола с параформом впервые синтезирован гидро-
ИНФОРМАЦИЯ ОБ АВТОРАХ
хинон-формальдегидный гексамер 4 - немакро-
Махмутова Ляйсан Илдусовна, ORCID: https://
циклический аналог пиллар[6]арена. Методом
orcid.org/0000-0002-8971-6536
флуоресцентной спектроскопии выявлены флуо-
ресцентные свойства гексамера 4, с максимумом
Шурпик Дмитрий Николаевич, ORCID: https://
испускания при 450 нм. Предложен метод полу-
orcid.org/0000-0002-7914-6533
чения соответствующего водорастворимого гек-
Стойков Даниил Иванович, ORCID: https://
самера 5, содержащего полярные имидазолиевые
orcid.org/0000-0001-9849-3349
фрагменты. Методом ДСР продемонстрировано
наличие самоассоциатов гексамера 5 в фосфатном
Лачугина Наталья Романовна, ORCID: https://
буфере (pH 7.4) со средним гидродинамическим
orcid.org/0000-0002-3352-4463
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
860
МАХМУТОВА и др.
Ханнанов Артур Айдарович, ORCID: https://
5. Zhou Y., Jie K., Zhao R., Li E., Huang F. J. Am. Chem.
orcid.org/0000-0001-5119-8449
Soc. 2020, 142, 6957-6961. doi 10.1021/jacs.0c02684
6. Jie K., Zhou Y., Li E., Zhao R., Liu M., Huang F.
Мостовая Ольга Александровна, ORCID:
J. Am. Chem. Soc. 2018, 140, 3190-3193. doi 10.1021/
jacs.7b13156
7. Ogoshi T., Saito K., Sueto R., Kojima R., Hamada Y.,
orcid.org/0000-0002-3019-7866
Akine S., Moeljadi A., Hirao H., Kakuta T., Yamagi-
shi T.-a. Chem., Int. Ed. 2018, 57, 1592-1595. doi
КОНФЛИКТ ИНТЕРЕСОВ
10.1002/anie.201711575
Авторы заявляют об отсутствии конфликта ин-
8. Wang K., Jordan J.H., Velmurugan K., Tian X., Zuo M.,
тересов.
Hu X.-Y., Wang L. Angew. Chem., Int. Ed. 2020, 59,
2-12. doi 10.1002/anie.202010150
СПИСОК ЛИТЕРАТУРЫ
9. Li H., Chen D.-X., Sun Y.-L., Zheng Y. B., Tan L.-L.,
1. Антипин И.С., Алфимов М.В., Арсланов В.В.,
Weiss P.S., Yang Y.-W. J. Am. Chem. Soc. 2013, 135,
Бурилов В.А., Вацадзе С.З., Волошин Я.З., Вол-
1570-1576. doi 10.1021/ja3115168
чо К.П., Горбачук В.В., Горбунова Ю.Г., Гро-
10. Zhang M., Zhu P.-P., Xin P., Si W., Li Z.-T., Hou J.-L.
мов С.П., Дудкин С.В., Зайцев С.Ю., Захарова Л.Я.,
Angew. Chem., Int. Ed. 2017, 56, 2999-3003. doi
Зиганшин М.А., Золотухина А.В., Калинина М.А.,
10.1002/anie.201612093
Караханов Э.А., Кашапов Р.Р., Койфман О.И., Ко-
11. Chang Y., Chen J.-Y., Yang J., Lin T., Zeng L., Xu J.-F.,
новалов А.И., Коренев В.С., Максимов А.Л., Ма-
Hou J.-L., Zhang X. ACS Appl. Mater. Interfaces. 2019,
мардашвили Н.Ж., Мамардашвили Г.М., Марты-
11, 38497-38502. doi 10.1021/acsami.9b13492
нов А.Г., Мустафина А.Р., Нугманов Р.И., Овсянни-
12. Kuzin Y., Kappo D., Porfireva A., Shurpik D., Stoi-
ков А.С., Падня П.Л., Потапов А.С., Селектор С.Л.,
kov I., Evtugyn G., Hianik T. Sensors. 2018, 18, 3489.
Соколов М.Н., Соловьева С.Е., Стойков И.И., Сту-
doi 10.3390/s18103489
жин П.А., Суслов Е.В., Ушаков Е.Н., Федин В.П.,
Федоренко С.В., Федорова О.А., Федоров Ю.В.,
13. Шурпик Д.Н., Стойков И.И. ЖОрХ. 2016, 86, 752-
Чвалун С.Н., Цивадзе А.Ю., Штыков С.Н., Шур-
755. [Shurpik D.N., Stoikov I.I. Russ. J. Org. Chem.
пик Д.Н., Щербина М.А., Якимова Л.С. Усп. Хим.
2016, 86, 752-755.] doi 10.1134/S1070363216030439
2021, 90, 895-1107. [Antipin I.S., Alfimov M.V.,
14. Shurpik D.N., Padnya P.L., Basimova L.T., Evtugin V.G.,
Arslanov V.V., Burilov V.A., Vatsadze S.Z., Volo-
Plemenkov V.V., Stoikov I.I. Mendeleev Commun. 2015,
shin Y.Z., Volcho K.P., Gorbatchuk V.V., Gorbuno-
6, 432-434. doi S0959943615002096?via%3Dihub
va Y.G., Gromov S.P., Dudkin S.V., Zaitsev S.Yu.,
15. Stoikova E.E., Sorvin M.I., Shurpik D.N., Budni-
Zakharova L.Ya., Ziganshin M.A., Zolotukhina A.V.,
kov H.C., Stoikov I.I., Evtugyn G.A. Electroanalysis.
Kalinina M.A., Karakhanov E.A., Kashapov R.R.,
2015, 27, 440-449. doi 10.1002/elan.201400494
Koifman O.I., Konovalov A.I., Korenev V.S., Mak-
16. Da Pian M., De Lucchi O., Strukul G., Fabris F., Scar-
simov, A.L., Mamardashvili N.Zh., Mamardashvi-
so A. RSC Adv. 2016, 6, 48272-48275. doi 10.1039/
li G.M., Martynov A.G., Mustafina A.R., Nugma-
C6RA07164C
nov R.I., Ovsyannikov A.S., Padnya P.L., Potapov A.S.,
Selektor S.L., Sokolov M.N., Solovieva S.E., Stoi-
17. Mirzaei S., Wang D., Lindeman S.V., Sem C.M.,
kov I.I., Stuzhin P.A., Suslov E.V., Ushakov E.N., Fe-
Rathore R. Org. Lett. 2018, 20, 6583-6586. doi
din V.P., Fedorenko S.V., Fedorova O.A., Fedorov Y.V.,
10.1021/acs.orglett.8b02937
Chvalun S.N., Tsivadze A.Yu., Shtykov S.N., Shur-
18. Zhao S., Xue T., Pei D., Song Q., Pei Z., Nie J.,
pik D.N., Shcherbina M.A., Yakimova L.S. Russ. Chem.
Chang, Y. Org. Lett. 2021, 23, 1709-1713. doi 10.1021/
Rev. 2021, 90, 895-1107.] doi 10.1070/RCR5011/meta
acs.orglett.1c00131
2. Ma X., Zhao Y. Chem. Rev. 2015, 115, 7794-7839. doi
19. Zeng S., Guo L., Zhang L., Cui F., Zhou J., Gao Z.,
10.1021/cr500392w
Chen Y., Shi J. Macromol. Chem. Phys. 2010, 211,
3. Chen Y.Y., Jiang X.M., Gong G.F., Yao H., Zhang Y.M.,
845-853. doi 10.1002/macp.200900534
Wei T.B., Lin Q. Chem. Commun. 2021, 57, 284-301.
20. Schneider H.J. Angew. Chem. Int. Ed. 2009, 48, 3924-
doi 10.1039/D0CC05776B
3977. doi 10.1002/anie.200802947
4. Ogoshi T., Kanai, S., Fujinami S., Yamagishi T.-a.,
21. Wang K., Tan L.L., Chen D.X., Song N., Xi G.,
Nakamoto Y. J. Am. Chem. Soc. 2008, 130, 5022-5023.
Zhang S.X.A., Li Ch., Yang Y.W. Org. Biomol. Chem.
doi 10.1021/ja711260m
2012, 10, 9405-9409. doi 10.1039/C2OB26635K
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
СИНТЕЗ И КОМПЛЕКСООБР
АЗУЮЩИЕ СВОЙСТВА
861
22. Jie K., Yao Y., Chi X., Huang, F. Chem. Commun. 2014,
J. Mol. Liq.
2019,
275,
232-240. doi
10.1016/
50, 5503-5505. doi 10.1039/C4CC01704H
j.molliq.2018.11.082
23. Hu R., Kang Y., Tang B.Z. Polym. J. 2016, 48, 359-
29. Xing L., Sun J., Tan H., Yuan G., Li J., Jia Y.,
370. doi 10.1038/pj.2016.1
Xiong D., Chen G., Lai J., Ling Z., Chen Y., Niu X.
24. Luo J., Xie Z., Lam J.W., Cheng L., Chen H., Qiu C.,
Int. J. Biol. Macromol. 2019, 127, 340-348. doi
Kwok H.S., Zhan X., Liu Y., Zhu D., Tang B.Z.
S0141813018343988
Chem. Commun. 2001, 18, 1740-1741. doi 10.1039/
B105159H
30. Li G., Li Y.M. Aggregate. 2022, e161. doi 10.1002/
25. Würthner F. Angew. Chem. Int. Ed. 2020, 59, 14192-
agt2.161
14196. doi 10.1002/anie.202007525
31. Escobar L., Ballester P. Chem. Rev. 2021, 121, 2445-
26. Ding D., Li K., Liu B., Tang B.Z. Acc. Chem. Res.
2514. doi 10.1021/acs.chemrev.0c00522
2013, 46, 2441-2453. doi 10.1021/ar3003464
32. Kaizerman-Kane D., Hadar M., Joseph R., Logvi-
27. Ding C., Xu Y., Zhao Y., Zhong H., Luo X. ACS
niuk D., Zafrani Y., Fridman M., Cohen Y. ACS Infect.
Appl. Mater. Int. 2018, 10, 8947-8954. doi 10.1021/
Dis. 2021, 7, 579-585. doi 10.1021/acsinfecdis.0c00662
acsami.7b18493
28. Samarkina D.A., Gabdrakhmanov D.R., Lukashen-
33. Hibbert D.B., Thordarson P. Chem. Commun. 2016, 52,
ko S.S., Nizameev I.R., Kadirov M.K., Zakharova L.Y.
12792-12805. doi 10.1039/C6CC03888C
Synthesis and Complexing Properties of New Luminescent
Hydroquinone-formaldehyde Hexamers
L. I. Makhmutova, D. N. Shurpik*, D. I. Stoikov, N. R. Lachugina, A. A. Khannanov,
O. A. Mostovaya, and I. I. Stoikov**
Kazan Federal University, A.M. Butlerov Chemistry Institute, ul. Kremlyovskaya, 18, Kazan, 420008 Russia
*e-mail: dnshurpik@mail.ru
**e-mail: ivan.stoikov@mail.ru
Received May 29, 2022; revised June 20, 2022; accepted June 23, 2022
A hexameric product with fluorescent properties was synthesized for the first time by polycondensation of
1,4-bis(2-bromoethoxy)benzene with paraform. The method for functionalization of the corresponding hexamer
with polar imidazolium fragments to obtain a water-soluble compound was proposed. The presence of self-as-
sociates of a water-soluble hexamer with a hydrodynamic diameter of 141 nm was found in phosphate buffer
at pH 7.4. The regularities of the influence of macrocyclic platforms pillar[5]arene, pillar[6]arene and their
non-macrocyclic analog containing imidazolium fragments on the interaction with proteins: lysozyme, bovine
serum albumin and hemoglobin were studied. The stoichiometry of the associate of the water-soluble hexamer
with bovine serum albumin (2:1) and association constants were established by spectrophotometric titration:
K1:1 5166 M-1, K2:1 102334 M-1. According to fluorescence spectroscopy, the resulting hexamer/protein asso-
ciates are capable of fluorescence upon irradiation in a wide wavelength range (λex 290-380 nm).
Keywords: hydroquinone-formaldehyde resins; macrocycles; drug delivery systems; fluorescence; pillar[n]
arenes
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022