ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 8, с. 886-896
Памяти академика РАН А.И. Коновалова
УДК 547.72 + 547.279
ОПТИЧЕСКИ АКТИВНЫЕ БИСТИОЭФИРЫ
И ДИСУЛЬФОНЫ НА ОСНОВЕ 2(5H)-ФУРАНОНА
И ДИТИОЛОВ: СИНТЕЗ И СТРОЕНИЕ
© 2022 г. А. М. Хабибрахмановаa, Э. С. Раббаниеваa, Д. П. Герасимоваb, Д. Р. Исламовc,
Л. З. Латыповаa, с, О. А. Лодочниковаa, b, А. Р. Курбангалиеваa, *
a ФГАОУ ВО «Казанский (Приволжский) федеральный университет»,
Россия, 420008 Казань, ул. Кремлевская, 18
b Институт органической и физической химии им. А.Е. Арбузова - обособленное структурное подразделение
ФГБУН «Федеральный исследовательский центр «Казанский научный центр РАН»,
Россия, 420088 Казань, ул. Академика Арбузова, 8
с ФГБУН «Федеральный исследовательский центр «Казанский научный центр РАН»,
Россия, 420008 Казань, ул. Лобачевского, 2/31
*e-mail: akurbang@kpfu.ru
Поступила в редакцию 07.06.2022 г.
После доработки 22.06.2022 г.
Принята к публикации 23.06.2022 г.
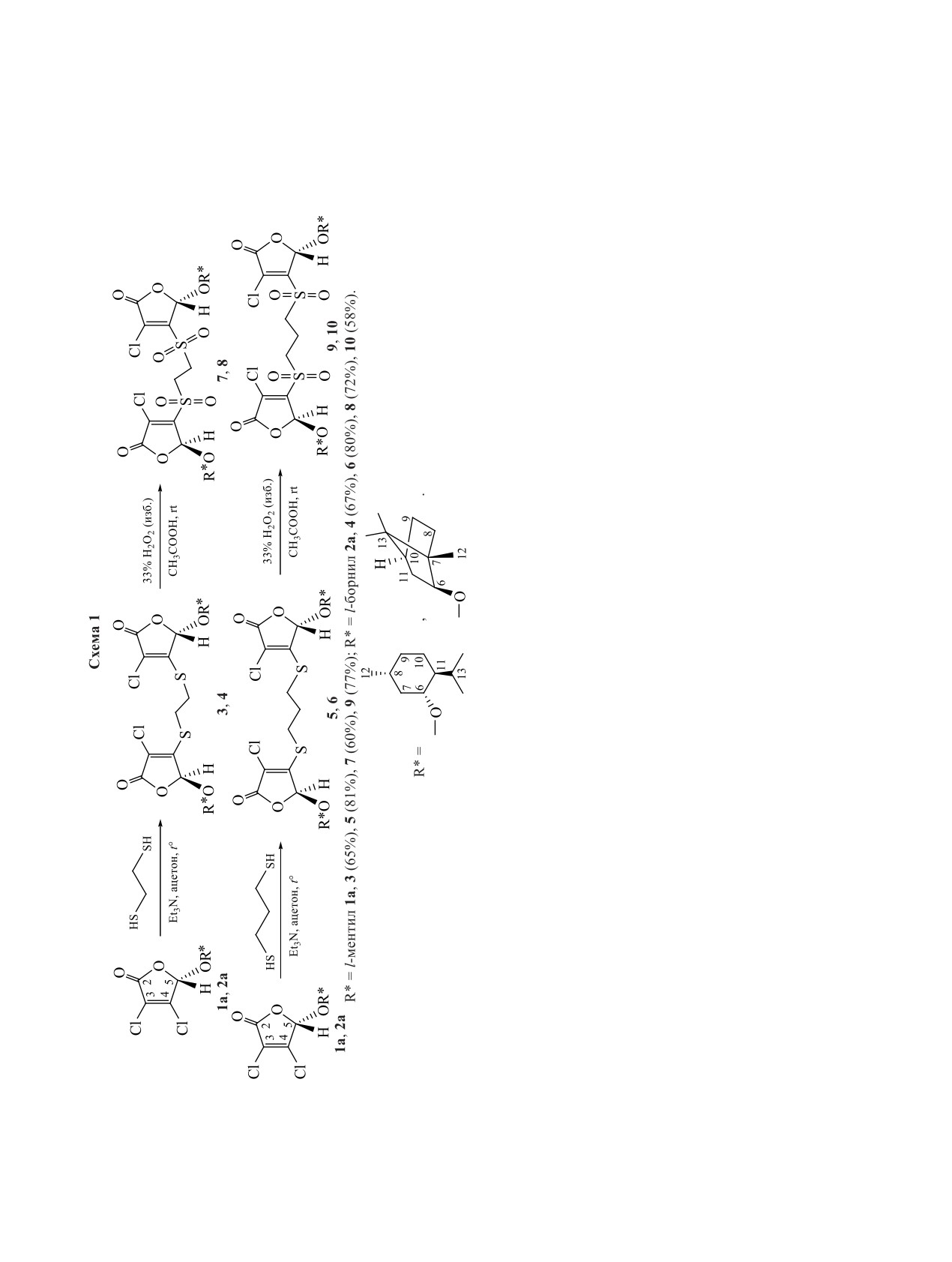
Разработаны методы синтеза новых оптически активных бистиоэфиров и дисульфонов 2(5Н)-фураноно-
вого ряда. При взаимодействии 5(S)-(l-ментилокси)- и 5(S)-(l-борнилокси)-2(5Н)-фуранонов с этан-1,2-ди-
тиолом и пропан-1,3-дитиолом в присутствии триэтиламина получены бистиоэфиры, в молекулах кото-
рых фрагмент дитиола соединяет два γ-лактонных цикла по атомам углерода С4. В реакциях окисления
дитиопроизводных фуранона пероксидом водорода в уксусной кислоте выделены хиральные дисульфоны
с фрагментом монотерпеновых спиртов в 5 положении γ-лактонного цикла. Строение пяти новых серо-
содержащих производных фуранона охарактеризовано методом рентгеноструктурного анализа.
Ключевые слова: 2(5H)-фураноны, лактоны, тиилирование, этан-1,2-дитиол, пропан-1,3-дитиол, бис-
тиоэфиры, дисульфоны, рентгеноструктурный анализ
DOI: 10.31857/S0514749222080122, EDN: IRGJIH
ВВЕДЕНИЕ
и т.д. [3, 4, 6, 8-10]. Кроме того, ненасыщенный
γ-лактон является одним из незаменимых строи-
Пятичленные кислородсодержащие гетеро-
тельных блоков в дизайне и разработке различных
циклы ряда 2(5H)-фуранона играют значитель-
биологически активных структур, в том числе но-
ную роль в органической и медицинской химии.
вых лекарственных средств [1, 4, 8, 11-13].
Данные гетероциклы, особенно в энантиомер-
но чистой форме, составляют структурное ядро
Сочетание в молекуле фуранонового кольца и
многочисленных природных соединений, обла-
сульфонильной группы также позволяет повысить
дающих большим разнообразием биологически
либо разнообразить проявляемую биологическую
активных свойств [1-8]. В ряду производных
активность [14, 15]. Хорошо известно, что сульфо-
2(5Н)-фуранона выявлены вещества с противоо-
нилсодержащие соединения все чаще используют-
пухолевым, противогрибковым и противовоспа-
ся в синтезе природных и биологически активных
лительным действием, бактерициды, антибиотики
веществ благодаря доступности, высокой реакци-
886
ОПТИЧЕСКИ АКТИВНЫЕ БИСТИОЭФИРЫ И ДИСУ
ЛЬФОНЫ
887
онной способности и возможности легкого удале-
2а были выделены с помощью дробной перекри-
ния на запланированной стадии [16-18]. Сульфоны
сталлизации из гексана.
находят широкое применение в качестве раствори-
Далее фураноны 1а и 2а были вовлечены в ре-
телей, полимеров, фармацевтических препаратов
акции с этан-1,2-дитиолом и пропан-1,3-дитиолом
и агрохимикатов [19].
в условиях основного катализа. Синтезы проводи-
Дисульфоны, которым характерна гибкость
ли в кипящем ацетоне в присутствии триэтилами-
связей C-S, легкость восстановления и окисле-
на с использованием соотношения фуранон-ди-
ния, способность выступать в роли как электро-
тиол-основание, равное 2:1:2 (схема 1). В резуль-
фильных, так и нуклеофильных реагентов, а также
тате были выделены новые оптически активные
доноров или акцепторов в различных реакциях
бистиоэфиры 3-6, в молекулах которых фрагмент
циклоприсоединения, эффективно используются
дитиола соединяет два фураноновых кольца по
в органическом синтезе в качестве универсаль-
атомам углерода С4. Строение полученных про-
ных и ценных промежуточных соединений [17]. В
дуктов подтверждено методами спектроскопии
связи с этим, получение новых дисульфонильных
ИК, ЯМР 1Н и 13С{1H}.
производных на основе химически и биологиче-
В ИК спектрах бистиоэфиров 3-6 отметим при-
ски значимых гетероциклов ряда 2(5Н)-фуранона
сутствие полос поглощения валентных колебаний
является актуальной задачей. Особый интерес
С-H связей в области 2800-3000 см-1, С=С связи
вызывают стереоизомерно чистые производные
лактонного фрагмента в области 1592-1605 см-1,
2(5Н)-фуранона, что обусловлено, в первую оче-
а также сигнала в области 1718-1782 см-1, харак-
редь, потребностями фармацевтической промыш-
терного валентным колебаниям карбонильной
ленности. Как правило, биологическая активность
группы.
рацемических веществ связана с действием лишь
одного из стереоизомеров, тогда как второй мо-
В спектрах ЯМР 1Н бистиоэфиров 3-6 присут-
жет проявлять менее выраженную активность или
ствуют синглет метинового протона у атома угле-
быть совсем неактивным, или даже обладать силь-
рода С5 лактонного цикла при δ 5.7-5.8 м.д. и две
ным токсическим эффектом.
группы сигналов от фрагментов алифатических
дитиолов: для бистиоэфиров 3 и 4 на основе этан-
Ранее нами были разработаны методы получе-
дитиола - два сложных мультиплета SCH2 прото-
ния моно- и дитиопроизводных 3,4-дихлор-2(5Н)-
нов в области δ 3.3-3.5 и 3.5-3.7 м.д., а в случае
фуранона различного структурного типа [20-26],
бистиоэфиров 5 и 6 на основе пропандитиола -
а также продуктов их окисления [27-29]. Целью
квинтет С-СН2-C протонов при δ 2.13-2.14 м.д. с
данной работы явился синтез новых оптически
КССВ 3J 7.2 Гц и сложный мультиплет SCH2 про-
активных серосодержащих производных 2(5Н)-
тонов в области δ 3.3-3.4 м.д. Что касается про-
фуранона на основе 5(S)-l-ментилокси- и 5(S)-l-
тонов ментильного и борнильного заместителей,
борнилоксифуранонов и двух алифатических ди-
то в спектре проявляются сигналы протонов от
тиолов - этан-1,2-дитиола и пропан-1,3-дитиола.
трех метильных групп в области сильных полей (δ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
0.8-1.0 м.д.), сложные мультиплеты от диастере-
В качестве исходных соединений выбраны
отопных метиленовых протонов в области δ 0.7-
оптически активные
5(S)-l-ментилокси-2(5Н)-
2.4 м.д., а сигнал от метинового протона у атомов
фуранон (1а) и 5(S)-l-борнилокси-2(5Н)-фуранон
углерода С6 проявляется в виде отдельного муль-
(2а), которые синтезировали из мукохлорной кис-
типлета в области 3.5-4.1 м.д. Детальный анализ
лоты и l-ментола или l-борнеола в условиях кис-
двумерных спектров ЯМР 1H-1H COSY и 1H-13C
лотного катализа [14, 30-32]. В проведенных реак-
HSQC позволил провести полное соотнесение на-
циях в обоих случаях сначала была получена смесь
блюдаемых сигналов атомов углерода с сигналами
диастереомеров в соотношении 1:1, различающих-
соответствующих атомов водорода ментильного
ся конфигурацией атома углерода С5 γ-лактонного
и борнильного остатков и фрагментов дитиолов в
цикла. Индивидуальные (S)-стереоизомеры 1а и
молекулах бистиоэфиров 3-6.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
888
ХАБИБРАХМАНОВА и др.
Выделенные (S,S)-стереоизомеры бистиоэфи-
ров 3-6 на следующем этапе были окислены до
соответствующих дисульфонов. При взаимодей-
ствии дитиопроизводных 3-6 c избытком перокси-
да водорода (10 экв) в уксусной кислоте при ком-
натной температуре получены новые оптически
активные дисульфоны фуранонового ряда 7-10
в виде бесцветных твердых веществ (схема 1). О
наличии в молекулах выделенных соединений SO2
группы судили по появлению в ИК спектрах со-
единений 7-10 новых узких интенсивных полос
поглощения в двух областях (1326-1358 и 1131-
1152 см-1), присущих антисимметричным и сим-
метричным колебаниям сульфонильной группы.
Спектры ЯМР 1Н и 13С{1H} бистиоэфиров 3-6
и соответствующих дисульфонов
7-10 содер-
жат одинаковое количество сигналов. В качестве
устойчивой тенденции отметим сдвиг в слабые
поля (Δδ = 0.3-0.4 м.д.) синглета от метинового
атома водорода у атома углерода С5 лактонного
цикла в спектрах ЯМР 1Н дисульфонов 7-10.
Методом рентгеноструктурного анализа оха-
рактеризована молекулярная структура бистио-
эфиров 3-5, а также дисульфонов 7 и 8 (см. рису-
нок). Структура полученных соединений расшиф-
рована в моноклинной P21 (соединения 3, 4 и 7) и
орторомбической P212121 (соединения 5 и 8) хи-
ральных пространственных группах. Дисульфон 8
кристаллизуется в виде кристаллосольвата с хло-
роформом состава 1:1. Асимметрическая часть
ячейки кристаллов всех исследованных соеди-
нений представлена единственной молекулой
(Z' = 1). Пятичленный цикл во всех молекулах
плоский. Конформационная гибкость фрагмента
-SCH2CH2S- позволяет молекулам соединений,
полученных на основе этан-1,2-дитиола, прини-
мать в кристалле различные конформации. Так, в
кристалле бистиоэфира 3 соединительный мостик
-SCH2CH2S- находится в гош-конформации, а в
кристаллах соединений 4, 7 и 8 наблюдается тран-
соидная конформация. В кристалле соединения
5 на основе пропан-1,3-дитиола соединительный
мостик -SCH2СH2CH2S- находится полностью
в трансоидной конформации. По данным метода
РСА атом углерода С5 лактонных циклов всех изу-
ченных соединений имеет (S)-конфигурацию.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
ОПТИЧЕСКИ АКТИВНЫЕ БИСТИОЭФИРЫ И ДИСУ
ЛЬФОНЫ
889
(a)
(b)
Cl1A
C12B
C14B
C9A C10A
C15B
O2A
C12A C8A
C8B
C9B
C13B
C15A
C3A
C11A
C12B
C2A
C14A
C7B
C10B
C10B
C7B
C4A
C7A
C13A
O1A
C11B
C9B
C6B
S1A
C6A
C8B C11B C6B
C5A
C13B
O5A
O5B
C16AO5A
C15B
O9B
O5B
C16B
C6A
C9A
C11A
C14B
C5B
O1A
C5A
C5B
O1B
C10A
S1A
C4B
C7A
O2B
C8A
C13A
S1B
C4B
S1B
C3B
C15A
C2A
C4A
C2B
C12A
C3B
C14A
C16A
C3A
O2A
C16B
O2B
Cl1B
Cl1B
Cl1A
(c)
C15B
C15A
C10A
C14B
C10BC9B
C9A
C13A
C14A
C13B
C11A
C11B
C8B
C8A
C6B
C6A
C12A
O5B
C12B
C7A
O6A
C7B
C16A
C16b
C5B
C17
C5A
S1B
S1A
O1B
O1A
C4B
C4A
C2B
C2A
C3A
C3B
Cl1A
O2B
O2A
Cl1B
(d)
(e)
C14B
C9A
C9B
C10A
C10B
C13B
C15B
C14B
C12A
C14A
C15A
C15A
C13B
C9B
C15B
C14A
C13A
C8B
C10B
C8A
C13A
C11B
C8B
C11A
C10A
C7A
C11B
C6A
O4B
C6B
C12B
C8A
C12A
C7A
C9A
C12B C7B
C7B
C6B
O5B
O5A
C6A
5B
O4A
C11A
O
5B
C
O5A
O3A
O1B
C5A
S1B
C5B
O1A
C16B
Cl1
S1A
O1B
O2B
Cl2
C5A S1A
C16A
C4B
C4B
C4A
Cl3
C2A
C4A
C2B
O3B
C2B
O1A
C16A
C3B
C1
S1B
C3B
O4A
C3A
O3A
C2A
C16B
O2A
C3A
O2B
Cl1A
Cl1A
Cl1B
Cl1B
O2A
Геометрия молекул соединений 3 (a), 4 (b), 5 (c), 7 (d) и 8 (e) в кристалле
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тодом НПВО. Спектры ЯМР 1Н, 13С{1Н}, 1Н-1Н
COSY и 1Н-13С HSQC регистрировали на приборе
ИК спектры получали на фурье-спектрометре
«Bruker Tensor-27» (Германия) в диапазоне волно-
«Bruker Avance III 400» (Германия) с рабочей ча-
вых чисел 4000-400 см-1. Регистрацию спектров
стотой 400.17 (1Н) и 100.62 (13С) МГц при темпе-
проводили на приставке PikeMIRacle (США) ме-
ратуре 20°С для растворов в CDCl3. Химический
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
890
ХАБИБРАХМАНОВА и др.
сдвиг определялся относительно сигналов оста-
Кристаллографические данные структур со-
точных протонов дейтерорастворителя (δH 7.26,
единений 3-5, 7 и 8 депонированы в Кембриджском
δC 77.16 м.д.). Масс-спектры высокого разреше-
банке структурных данных [CCDC 2174932 (3),
ния получали на тандемном квадруполь-время-
2174935 (4), 2174934 (5), 2174933 (7), 2174936 (8)],
пролетном масс-спектрометре с электроспрейной
важнейшие характеристики приведены в таблице.
ионизацией «Agilent 6550 iFunnel Q-TOF LC/MS».
(1R,2S,5R)-Ментол,
(1S,2R,4S)-борнеол, этан-
Анализ методом ТСХ проводили на пластинах
1,2-дитиол и пропан-1,3-дитиол (все
- Acros
«Sorbfil ПТСХ-АФ-А-УФ», элюент: смесь эти-
Organics) использовали без дополнительной
лацетат-гексан (1:1), пятна проявляли в УФ све-
очистки. Все остальные реагенты и органические
те при 254 нм. Для колоночной хроматографии
растворители очищали и сушили перед использо-
использовали силикагель 60 Å (0.060-0.200 мм,
ванием по стандартным методикам [37].
Acros Organics). Температуры плавления измеряли
на нагревательном столике «Boetius» и не коррек-
5(S)-[(1R,2S,5R)-2-Изопропил-5-метилцикло-
тировали. Измерение оптического вращения про-
гексилокси]-3,4-дихлор-2(5Н)-фуранон
(1а)
[14,
водили на поляриметре «Perkin-Elmer Model 341»
30] и 3,4-дихлор-5(S)-[(1S,2R,4S)-1,7,7-триметил-
в CHCl3 с использованием кювет на 1 или 3 мл при
бицикло[2.2.1]гептан-2-илокси]-2(5Н)-фуранон
температуре 20°С на D-линии натрия (λ 589 нм) (с
(2а) [31, 32] синтезировали по известным методи-
дана в г/100 мл).
кам.
Кристаллы соединения 3 получены из смеси
4,4'-(Этан-1,2-диилдисульфандиил)бис{5(S)-
гексан - CCl4 (2:1), соединения 4 - из CDCl3, со-
[(1R,2S,5R)-2-изопропил-5-метилциклогексил-
единения 5 - из смеси гексан-CCl4 (3:1), соеди-
окси]-3-хлор-2(5Н)-фуранон} (3). В трехгорлой
нения 7 - из смеси гексан-CHCl3 (3:1), соедине-
колбе на 100 мл, снабженной магнитной мешал-
ния 8 - из смеси гексан-CHCl3 (5:1).
кой, обратным холодильником и газоподводя-
щей трубкой для подачи аргона, к раствору 2.09 г
Монокристальное рентгеноструктурное иссле-
(6.8 ммоль) фуранона 1а в ацетоне (15 мл) при
дование соединений 3 и 5 выполнено на автома-
тическом трехкружном дифрактометре «Rigaku
интенсивном перемешивании добавили раствор
XtaLab Synergy S» [λ(CuKα) = 1.54184 Å] при тем-
0.29 мл (3.4 ммоль) этан-1,2-дитиола в ацето-
пературе T = 100(2) K. Монокристальное рентгено-
не (5 мл), а затем по каплям раствор 0.95 мл
структурное исследование соединений 4, 7 и 8 вы-
(6.8 ммоль) триэтиламина в ацетоне
(7 мл).
полнено на автоматическом трехкружном дифрак-
Наблюдали постепенное образование осадка
тометре «Bruker D8 QUEST» с двумерным детекто-
(C2H5)3N·HCl. Реакционную смесь кипятили в те-
ром PHOTON III и микрофокусной рентгеновской
чение 18 ч, об окончании реакции судили по дан-
трубой IμS DIAMOND (λ[MoKα] = 0.71073 Å) при
ным метода спектроскопии ЯМР 1H. Выпавший
T = 100(2) K. Сбор, редактирование данных и уточ-
осадок соли отфильтровали, промыли холодным
нение параметров элементарных ячеек проводили
ацетоном. Фильтрат досуха вакуумировали, по-
с использованием пакета программ CrysAlisPro и
лученный коричневый маслянистый остаток пе-
APEX3. Структуры расшифрованы прямым мето-
рекристаллизовали из смеси гексан-CCl4 (2:1).
дом с использованием SHELXT [33] и уточнены
Выход 1.41 г (65%), бесцветные кристаллы, т.пл.
полноматричным методом наименьших квадратов
129°С, Rf 0.61, [α]D20 +11.3 (c 1.0, CHCl3). ИК
по F2 вначале в изотропном, затем в анизотропном
спектр, ν, см-1: 2960, 2948, 2937, 2929, 2879, 2866
приближении (для всех неводородных атомов) c
(С-Н), 1782, 1718 (С=О), 1605 (С=С лакт.). Спектр
использованием программ SHELXL [34] в пакете
ЯМР 1Н, δ, м.д.: 0.81 д [3Н, CH3 (i-Pr), 3J 7.0 Гц],
программ Olex2 [35]. Координаты атомов водоро-
0.93 д (3Н, CH3, H12, 3J 6.5 Гц), 0.94 д [3Н, CH3
да рассчитаны на основании стереохимических
(i-Pr), 3J 7.0 Гц], 0.76-1.16 м (3Н, H7, H9, H10),
критериев и уточнены по соответствующим моде-
1.29-1.48 м (2Н, H8, H11), 1.61-1.73 м (2Н, H9, H10),
лям наездника. Анализ межмолекулярных взаимо-
2.14-2.29 м (2Н, H7, H13), 3.41-3.52 м (2Н, SCH2),
действий и рисунки выполнены с использованием
3.53-3.66 м (3Н, Н6, SCH2), 5.80 с (1Н, H5). Спектр
программы PLATON [36].
ЯМР 13С{1H}, δ, м.д.: 16.02 [CН3 (i-Pr)], 21.16,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
ОПТИЧЕСКИ АКТИВНЫЕ БИСТИОЭФИРЫ И ДИСУ
ЛЬФОНЫ
891
Основные кристаллографические параметры структур 3-5, 7 и 8 по рентгенодифракционным данным для монокри-
сталлов
Соединение
3
4
5
7
8
Брутто-формула
C30H44Cl2O6S2
C30H40Cl2O6S2
C31H46Cl2O6S2
C
H44Cl2O10S2
C
H40Cl2O10S2, CHCl3
30
30
Молекулярная
635.67
631.64
649.70
699.67
815.01
масса
Кристаллогра-
моноклинный
моноклинный
орторомбический
моноклинный
орторомбический
фический класс
Пространст-
P21 (no. 4)
P21 (no. 4)
P212121 (no. 19)
P21 (no. 4)
P212121 (no. 19)
венная группа
Параметры эле-
8.33950(10),
10.1040(4),
8.1215(5),
9.33550(10),
ментарной ячей-
19.2734(2),
14.5378(7),
15.3194(12),
7.8449(2), 15.5543(5),
12.1125(2),
ки: a, b, c, Å;
10.67710(10);
10.5895(4);
14.0071(11);
29.9604(9)
29.9674(3)
α, β, γ, град
108.7640(10)
92.8080(10)
99.165(3)
Объем элементар-
1624.93(3)
1553.62(11)
3388.60(7)
1720.5(2)
3655.83(19)
ной ячейки, Å3
Z/Z'
2/1
2/1
4/1
2/1
4/1
Вычисленная
1.299
1.350
1.273
1.351
1.481
плотность, г см-3
Коэффициент по-
3.320
0.384
3.194
0.362
0.565
глощения, мм-1
F(000)
676
668
1384
740
1696
Диапазон сбора
4.373-76.545
1.925-30.059
2.949-76.646
1.984-30.040
1.887-30.070
отражений, град
-10 ≤ h ≤ 10,
-14 ≤ h ≤ 14,
-10 ≤ h ≤ 11,
-11 ≤ h ≤ 11,
-11 ≤ h ≤ 10,
Диапазон
-23 ≤ k ≤ 23,
-20 ≤ k ≤ 20,
-15 ≤ k ≤ 15,
-21 ≤ k ≤ 21,
-21 ≤ k ≤ 21,
индексов
–13 ≤ l ≤ 13
-14 ≤ l ≤ 14
-37 ≤ l ≤ 21
-19 ≤ l ≤ 19
-42 ≤ l ≤ 42
Общее число/
26250/6561
46486/9093
19224/6902
59361/10088
независимых
59502/10703 (0.0531)
(0.0413)
(0.0360)
(0.0485)
(0.0501)
отражений (Rint)
Rσ
0.0343
0.0277
0.0501
0.0364
0.0433
Tmax/Tmin
1.000/0.564
0.7460/0.6947
1.000/0.456
0.7460/0.6831
0.7460/0.6711
Число наблюдае-
мых отражений
6443
8694
6559
9186
9124
[I > 2σ(I)]
Количество отра-
жений/число кон-
6561/1/367
9093/1/367
6902/0/376
10088/1/403
10703/0/439
стрейнов/число
параметров
GooF
1.069
1.034
1.070
1.028
1.033
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
892
ХАБИБРАХМАНОВА и др.
Таблица. (продолжение).
Соединение
3
4
5
7
8
R1 0.0306,
R1 0.0249,
R1 0.0358,
R1 0.0303,
R1 0.0381,
R [I > 2σ(I)]
wR2 0.0803
wR2 0.0605
wR2 0.0922
wR2 0.0682
wR2 0.0927
R (по всем
R1 0.0310,
R1 0.0273,
R1 0.0383,
R1 0.0365,
R1 0.0511,
отражениям)
wR2 0.0806
wR2 0.0618
wR2 0.0938
wR2 0.0707
wR2 0.0988
Параметр Флака
-0.008(9)
0.000(13)
-0.012(8)
0.017(17)
-0.021(19)
Остаточные
экстремумы
0.246 и -0.300
0.278 и -0.151
0.280 и -0.260
0.227 и -0.359
0.715 и -0.489
электронной
плотности, eÅ-3
CCDC
2174932
2174935
2174934
2174933
2174936
22.22 [CН3 (i-Pr), С12], 22.90 (С10), 25.49 (С13), 30.62
(1.92 г, 6.2 ммоль), пропан-1,3-дитиола (0.31 мл,
(2SCH2), 31.78 (С8), 34.00 (С9), 42.40 (С7), 48.21
3.1 ммоль) и триэтиламина (0.87 мл, 6.2 ммоль).
(С11), 83.69 (С6), 102.39 (С5), 120.20 (С3), 152.42
Реакционную смесь кипятили в течение 16 ч.
(С4), 164.71 (C2). Масс-спектр, m/z: 657.1849 [M +
Перекристаллизация из смеси гексан-CCl4 (3:1).
Na]+. С30Н44Cl2NaO6S2. M + Na 657.1849.
Выход 1.64 г (81%), бесцветные кристаллы, т.пл.
95°С, Rf 0.59, [α]D20 -0.1 (c 1.0, CHCl3). ИК спектр,
4,4'-(Этан-1,2-диилдисульфандиил)бис[5(S)-
ν, см-1: 2970, 2958, 2928, 2876 (C-H), 1759 (С=О),
{(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]геп-
1592 (С=С лакт.). Спектр ЯМР 1Н, δ, м.д.: 0.80 д
тан-2-илокси}-3-хлор-2(5Н)-фуранон] (4) синте-
[3Н, CH3 (i-Pr), 3J 6.9 Гц], 0.93 д (3Н, CH3, H12, 3J
зировали аналогично соединению 3 из фуранона
6.5 Гц), 0.94 д [3Н, CH3 (i-Pr), 3J 7.0 Гц], 0.77-1.15
2a (2.04 г, 6.7 ммоль), этан-1,2-дитиола (0.28 мл,
м (3Н, H7, H9, H10), 1.29-1.48 м (2Н, H8, H11), 1.61-
3.3 ммоль) и триэтиламина (0.93 мл, 6.7 ммоль).
1.73 м (2Н, H9, H10), 2.14 квинтет (2Н, CН2СН2CН2,
Реакционную смесь кипятили в течение 19 ч.
3J 7.2 Гц), 2.18-2.31 м (2Н, H7, H13), 3.36 д.т (2Н,
Перекристаллизация из смеси гексан-CCl4 (1:4).
А-часть АВХ2-системы, SCH2, 2JAB -13.5, 3JAX
Выход 1.41 г (67%), бесцветные кристаллы, т.пл.
7.2 Гц), 3.43 д.т (2Н, В-часть АВХ2-системы, SCH2,
168°С, Rf 0.65, [α]D20 +58.3 (c 1.1, CHCl3). ИК
2JAB -13.5, 3JВX 7.2 Гц), 3.56 д.д.д (1Н, Н6, 3J 10.7,
спектр, ν, см-1: 2990, 2963, 2942, 2885 (С-Н), 1764
3J 10.7, 3J 4.4 Гц), 5.77 с (1Н, H5). Спектр ЯМР
(С=О), 1593, 1582 (C=C лакт.). Спектр ЯМР 1Н, δ,
13С{1H}, δ, м.д.: 16.04 [CН3 (i-Pr)], 21.17, 22.23
м.д.: 0.87 с [6Н, 2CH3 (i-Pr)], 0.91 с (3Н, CH3, Н12),
[CН3 (i-Pr), С12], 22.90 (С10), 25.43 (С13), 28.56
1.18-1.34 м (3Н, Н8, Н9, Н11), 1.64-1.79 м (2Н, Н8
(2SCH2), 30.97 (CH2CH2CH2), 31.78 (С8), 34.03
или Н9, Н10), 1.80-1.92 м (1Н, Н8 или Н9), 2.22-
(С9), 42.40 (С7), 48.21 (С11), 83.66 (С6), 102.42 (С5),
2.35 м (1Н, Н11), 3.37-3.49 м (2Н, SCH2), 3.54-3.66
119.42 (С3), 153.30 (С4), 165.02 (C2). Масс-спектр,
м (2Н, SCH2), 3.97-4.06 м (1Н, Н6), 5.82 с (1Н, Н5).
m/z: 671.2005 [M + Na]+. C31H46Cl2NaO6S2. M + Na
Спектр ЯМР 13С{1H}, δ, м.д.: 14.22 (С12), 18.91,
671.2005.
19.74
[CН3 (i-Pr)], 26.79, 28.10 (С8, С9),
30.54
4,4'-(Пропан-1,3-диилдисульфандиил)бис-
(2SCH2), 37.18 (С11), 44.95 (С10), 47.87 (С7), 49.75
[5(S)-{(1S,2R,4S)-1,7,7-триметилбицикло[2.2.1]-
(С13), 89.14 (С6), 102.71 (С5), 120.17 (С3), 152.62
гептан-2-илокси}-3-хлор-2(5Н)-фуранон]
(6)
(С4), 164.45 (С2). Масс-спектр, m/z: 653.1544 [M +
синтезировали аналогично соединению 3 из фу-
Na]+. C30H40Cl2NaO6S2. M + Na 653.1536.
ранона 2a (2.52 г, 8.2 ммоль), пропан-1,3-дитио-
4,4'-(Пропан-1,3-диилдисульфандиил)бис-
ла (0.41 мл, 4.1 ммоль) и триэтиламина (1.15 мл,
{5(S)-[(1R,2S,5R)-2-изопропил-5-метилцикло-
8.2 ммоль). Реакционную смесь кипятили в те-
гексилокси]-3-хлор-2(5Н)-фуранон} (5) синтези-
чение 15 ч. Полученный после вакуумирования
ровали аналогично соединению 3 из фуранона 1a
желтый маслянистый остаток очищали методом
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
ОПТИЧЕСКИ АКТИВНЫЕ БИСТИОЭФИРЫ И ДИСУ
ЛЬФОНЫ
893
колоночной хроматографии на силикагеле (элю-
48.41 (С11), 48.59 (2SCH2), 84.80 (С6), 101.43 (С5),
ент - CH2Cl2). Основную фракцию с Rf 0.45 до-
137.05 (С3), 146.92 (С4), 162.09 (C2). Масс-спектр,
суха вакуумировали, остаток перекристаллизо-
m/z: 721.1639 [M + Na]+. C30H44Cl2NaO10S2. M +
вали из смеси гексан-CCl4 (1:2). Выход 2.13 г
Na 721.1645.
(80%), бесцветное твердое вещество, т.пл. 106°С,
1,2-Бис{[5(S)-{(1S,2R,4S)-1,7,7-триметил-
Rf 0.64, [α]D20 +49.5 (c 1.2, CHCl3). ИК спектр, ν,
бицикло[2.2.1]гептан-2-илокси}-3-хлор-2(5Н)-
см-1: 2960, 2886 (С-Н), 1776 (С=О), 1593 (C=C
фуранонил]сульфонил}этан (8) синтезировали
лакт.). Спектр ЯМР 1Н, δ, м.д.: 0.87 с [6Н, 2CH3 (i-
аналогично соединению 7 из фуранона 4 (0.63 г,
Pr)], 0.91 с (3Н, CH3, Н12), 1.17-1.37 м (3Н, Н8, Н9,
1.0 ммоль) и 33%-ного раствора пероксида водо-
Н11), 1.63-1.80 м (2Н, Н8 или Н9, Н10), 1.81-1.96 м
рода (1.00 мл, 10.0 ммоль) в 15 мл ледяной уксус-
(1Н, Н8 или Н9), 2.13 квинтет (2Н, CН2СН2CН2, 3J
ной кислоты. Реакционную смесь перемешивали в
7.2 Гц), 2.21-2.37 м (1Н, Н11), 3.33 д.т (2Н, А-часть
течение 7 сут. Перекристаллизация из смеси гек-
АВХ2-системы, SCH2, 2JAB -13.1, 3JAX 7.2 Гц),
сан-CHCl3 (5:1). Выход 0.50 г (72%), бесцветные
3.40 д.т (2Н, В-часть АВХ2-системы, SCH2, 2JAB
кристаллы, т.пл. 129°С, Rf 0.66, [α]D20 +133.1 (c 1.0,
-13.1, 3JВX 7.2 Гц), 3.95-4.07 м (1Н, Н6), 5.81 с
CHCl3). ИК спектр, ν, см-1: 2989, 2960, 2891, 2881
(1Н, Н5). Спектр ЯМР 13С{1H}, δ, м.д.: 14.07 (С12),
(С-Н), 1803 (С=О), 1635 (C=C лакт.), 1358 (SO2
18.82, 19.65 [CH3 (i-Pr)], 26.66, 28.01 (С8, С9), 28.60
асимм.), 1135 (SO2 симм.). Спектр ЯМР 1Н, δ, м.д.:
(CH2CH2CH2), 30.15 (2SCH2), 37.06 (С11), 44.86
0.87, 0.88 с [6Н, 2CH3 (i-Pr)], 0.93 с (3Н, CH3, Н12),
(С10), 47.72 (С7), 49.63 (С13), 88.63 (С6), 102.43
1.13-1.38 м (3Н, Н8, Н9, Н11), 1.57-1.68 м (1Н, Н8
(С5), 118.94 (С3), 153.91 (С4), 164.64 (С2). Масс-
или Н9), 1.69-1.85 м (2Н, Н8 или Н9, Н10), 2.24-
спектр, m/z: 662.2131 [M + NH4]+. C31H46Cl2NO6S2.
2.40 м (1Н, Н11), 3.65-3.89 м (4Н, SCH2), 4.08-4.21
M + NH4 662.2138.
H},
м (1Н, Н6), 6.15 с (1Н, Н5). Спектр ЯМР 13С{1
1,2-Бис[{5(S)-[(1R,2S,5R)-2-изопропил-5-
δ, м.д.: 13.93 (С12), 18.88, 19.67 [CН3 (i-Pr)], 27.10,
метилциклогексилокси]-3-хлор-2(5Н)-фурано-
28.13 (С8, С9), 36.70 (С11), 44.89 (С10), 48.00 (С7),
нил}сульфонил]этан (7). В плоскодонной колбе
48.65 (2SCH2), 49.90 (С13), 91.65 (С6), 102.46 (С5),
на 100 мл, снабженной магнитной мешалкой, к
137.38 (С3), 146.65 (С4), 162.07 (С2). Масс-спектр,
раствору 0.72 г (1.1 ммоль) фуранона 3 в 15 мл ле-
m/z: 717.1327 [M + Na]+. C30H40Cl2NаO10S2. M +
дяной уксусной кислоты при перемешивании при-
Na 717.1332.
лили 1.14 мл (11.0 ммоль) 33%-ного раствора пе-
1,3-Бис[{5(S)-[(1R,2S,5R)-2-изопропил-
роксида водорода. Реакционную смесь перемеши-
5-метилциклогексилокси]-3-хлор-2(5Н)-фура-
вали в течение 7 сут при комнатной температуре,
об окончании реакции судили по данным метода
нонил}сульфонил]пропан
(9)
синтезировали
аналогично соединению 7 из фуранона 5 (0.65 г,
спектроскопии ЯМР 1Н. Далее реакционную смесь
досуха вакуумировали, остаток перекристаллизо-
1.0 ммоль) и 33%-ного раствора пероксида водоро-
вали из смеси гексан-CHCl3 (3:1). Выход 0.48 г
да (1.00 мл, 10.0 ммоль) в 15 мл ледяной уксусной
(60%), бесцветные кристаллы, т.пл. 178°С, Rf 0.58,
кислоты. Реакционную смесь перемешивали в те-
[α]D20 +119.3 (c 1.0, CHCl3). ИК спектр, ν, см-1:
чение 5 сут. Перекристаллизация из смеси гексан-
2954, 2929, 2877 (С-Н), 1806 (С=О), 1637 (C=C
CCl4 (2:1). Выход 0.55 г (77%), бесцветное твердое
лакт.), 1355 (SO2 асимм.), 1131 (SO2 симм.). Спектр
вещество, т.пл. 142°С, Rf 0.51, [α]D20 +73.6 (c 1.0,
ЯМР 1Н, δ, м.д.: 0.82 д [3Н, CH3 (i-Pr), 3J 6.9 Гц],
CHCl3). ИК спектр, ν, см-1: 2964, 2953, 2929, 2910,
0.94 д [3Н, CH3 (i-Pr), 3J 6.6 Гц], 0.95 д (3Н, CH3,
2877, 2855 (С-Н), 1805, 1787 (С=О), 1641, 1632
H12, 3J 6.0 Гц), 0.76-1.12 м (3Н, H7, H9, H10), 1.23-
(C=C лакт.), 1347, 1326 (SO2 асимм.), 1152, 1137
1.34 м (1Н, H11), 1.35-1.52 м (1Н, H8), 1.62-1.77 м
(SO2 симм.). Спектр ЯМР 1Н, δ, м.д.: 0.82 д [3Н,
(2Н, H9, H10), 2.12 септ.д (1Н, Н13, 3J 7.0, 3J 2.5 Гц),
CH3 (i-Pr), 3J 6.9 Гц], 0.93 д [3Н, CH3 (i-Pr), 3J
2.14-2.22 м (1Н, H7), 3.58-3.80 м (5Н, Н6, SCH2),
6.7 Гц], 0.95 д (3Н, CH3, H12, 3J 6.1 Гц), 0.73-1.16 м
6.21 с (1Н, H5). Спектр ЯМР 13С{1H}, δ, м.д.: 15.70
(3Н, H7, H9, H10), 1.28-1.38 м (1Н, H11), 1.38-1.51 м
[CН3 (i-Pr)], 21.21, 22.19 [CН3 (i-Pr), С12], 22.70
(1Н, H8), 1.63-1.75 м (2Н, H9, H10), 2.09-2.26 м (2Н,
(С10), 25.42 (С13), 31.85 (С8), 33.73 (С9), 42.50 (С7),
H7, Н13), 2.46 квинтет (2Н, CН2СН2CН2, 3J 7.2 Гц),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
894
ХАБИБРАХМАНОВА и др.
3.44 д.т (2Н, А-часть системы АВХ2, SCH2, 2JAB
нилокси)-2(5Н)-фуранонов с этан-1,2-дитиолом
-14.3, 3JAX 7.2 Гц), 3.56 д.т (2Н, В-часть системы
и пропан-1,3-дитиолом в присутствии основа-
АВХ2, SCH2, 2JAB -14.3, 3JВX 7.2 Гц), 3.72 д.д.д
ния приводят к образованию бистиоэфиров фу-
(1Н, Н6, 3J 10.7, 3J 10.7, 3J 4.4 Гц), 6.21 с (1Н, H5).
ранона, в молекулах которых два ненасыщенных
Спектр ЯМР 13С{1H}, δ, м.д.: 14.55 (CН2СН2CН2),
γ-лактонных фрагмента связаны посредством
15.69 [CН3 (i-Pr)], 21.26, 22.22 [CН3 (i-Pr), С12],
-S-(CH2)n-S- цепочки по атомам углерода С4.
22.72 (С10), 25.35 (С13), 31.81 (С8), 33.92 (С9), 42.25
Полученные бистиоэфиры под действием избытка
(С7), 48.33 (С11), 53.87 (2SCH2), 84.63 (С6), 101.57
раствора пероксида водорода в уксусной кислоте
(С5), 136.12 (С3), 147.90 (С4), 162.49 (C2). Масс-
превращаются в соответствующие хиральные ди-
спектр, m/z: 735.1796 [M + Na]+. C31H46Cl2NаO10S2.
сульфоны, несущие фрагмент l-ментола или l-бор-
M + Na 735.1802.
неола в 5 положении лактонного цикла.
1,3-Бис{[5(S)-{(1S,2R,4S)-1,7,7-триметил-
ФОНДОВАЯ ПОДДЕРЖКА
бицикло[2.2.1]гептан-2-илокси}-3-хлор-2(5Н)-
Работа выполнена при финансовой поддерж-
фуранонил]сульфонил}пропан
(10) синтези-
ке Программы стратегического академическо-
ровали аналогично соединению 7 из фуранона 6
го лидерства Казанского (Приволжского) фе-
(0.72 г, 1.1 ммоль) и 33%-ного раствора перокси-
дерального университета
(«Приоритет-2030»).
да водорода (1.12 мл, 11.2 ммоль) в 15 мл ледяной
Рентгеноструктурные исследования выполнены за
уксусной кислоты. Реакционную смесь переме-
счет государственного задания ФИЦ КазНЦ РАН.
шивали в течение 5 сут. Полученный после вакуу-
мирования бесцветный твердый остаток очищали
ИНФОРМАЦИЯ ОБ АВТОРАХ
методом колоночной хроматографии на силикаге-
Хабибрахманова Алсу Мунавировна, ORCID:
ле (элюент: этилацетат-петролейный эфир, 1:1).
Основную фракцию с Rf 0.63 досуха вакууми-
Герасимова Дарья Павловна, ORCID: https://
ровали, растирали в петролейном эфире. Выход
orcid.org/0000-0001-9770-196X
0.46 г (58%), бесцветное твердое вещество, т.пл.
92°С, [α]D20 +84.5 (c 1.0, CHCl3). ИК спектр, ν, см-1:
2985, 2959, 2936, 2916, 2883 (С-Н), 1802 (С=О),
orcid.org/0000-0002-5988-1012
1633 (C=C лакт.), 1349 (SO2 асимм.), 1137 (SO2
Латыпова Лилия Зиннуровна, ORCID: https://
симм.). Спектр ЯМР 1Н, δ, м.д.: 0.87, 0.88 с [6Н,
orcid.org/0000-0001-7838-732X
2CH3 (i-Pr)], 0.94 с (3Н, CH3, Н12), 1.18-1.40 м (3Н,
Н8, Н9, Н11), 1.64-1.84 м (3Н, Н8, Н9, Н10), 2.24-
Лодочникова Ольга Александровна, ORCID:
2.39 м (1Н, Н11), 2.50 квинтет (2Н, CН2СН2CН2,
3J 7.2 Гц), 3.49 д.т (2Н, А-часть АВХ2-системы,
Курбангалиева Альмира Рафаэловна, ORCID:
SCH2, 2JAB -14.3, 3JAX 7.2 Гц), 3.62 д.т (2Н, В-часть
АВХ2-системы, SCH2, 2JAB -14.3, 3JВX 7.2 Гц),
4.09-4.18 м (1Н, Н6), 6.15 с (1Н, Н5). Спектр ЯМР
КОНФЛИКТ ИНТЕРЕСОВ
13С{1H}, δ, м.д.: 13.87 (С12), 14.76 (CН2СН2CН2),
Авторы заявляют об отсутствии конфликта ин-
18.87, 19.66 [CН3 (i-Pr)], 27.05, 28.10 (С8, С9), 36.61
тересов.
(С11), 44.88 (С10), 47.95 (С7), 49.88 (С13), 53.91
СПИСОК ЛИТЕРАТУРЫ
(2SCH2), 91.05 (С6), 102.52 (С5), 136.17 (С3), 147.48
(С4), 162.50 (С2). Масс-спектр, m/z: 731.1484 [M +
1. De Souza M.V.N. Mini-Rev. Org. Chem. 2005, 2, 139-
Na]+. C31H42Cl2NаO10S2. M + Na 731.1489.
145. doi 10.2174/1570193053544427
2. Mao B., Fañanás-Mastral M., Feringa B.L. Chem.
ЗАКЛЮЧЕНИЕ
Rev.
2017,
117,
10502-10566. doi
10.1021/
Синтезированы и спектрально охарактеризо-
acs.chemrev.7b00151
ваны первые представители оптически активных
3. Rossi R., Lessi M., Manzini C., Marianetti G., Belli-
бистиоэфиров и дисульфонов 2(5Н)-фуранонового
na F. Curr. Org. Chem. 2017, 21, 964-1018. doi 10.2174/
ряда. Реакции 5(S)-(l-ментилокси)- и 5(S)-(l-бор-
1385272821666170111151917
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
ОПТИЧЕСКИ АКТИВНЫЕ БИСТИОЭФИРЫ И ДИСУ
ЛЬФОНЫ
895
4. Villamizar-Mogotocoro A.-F., León-Rojas A.-F.,
18. Wang Z., Zhang Z., Zhao W., Sivaguru P., Zanoni G.,
Urbina-González J.-M. Mini-Rev. Org. Chem. 2020,
Wang Y., Anderson E.A., Bi X. Nat. Commun. 2021,
17, 922-945. doi 10.2174/1570193X1766620022013
12, 5244. doi 10.1038/s41467-021-25593-5
0735
19. Ahmad I., Shagufta. Int. J. Pharm. Pharm. Sci. 2015,
5. Бадовская Л.А., Посконин В.В., Тюхтенева З.И.,
7, 19-27.
Кожина Н.Д. ЖОХ. 2021, 91, 167-189. [Badovs-
20. Kurbangalieva A.R., Devyatova N.F., Bogdanov A.V.,
kaya L.A., Poskonin V.V., Tyukhteneva Z.I., Kozhi-
Berdnikov E.A., Mannafov T.G., Krivolapov D.B.,
na N.D. Russ. J. Gen. Chem. 2021, 91, 133-153.] doi
Litvinov I.A., Chmutova G.A. Phosphorus Sulfur
10.1134/S1070363221020018
Silicon Relat. Elem. 2007, 182, 607-630. doi 10.1080/
10426500601015989
6. Kumar S., Garg R., Kabra A. World J. Pharm. Res.
Technol. 2013, 1, 83-94.
21. Девятова Н.Ф., Косолапова Л.С., Курбангалиева А.Р.,
Бердников Е.А., Лодочникова О.А., Литвинов И.А.,
7. Husain A., Khan S.A., Iram F., Iqbal M.A., Asif M.
Чмутова Г.A. ЖОрХ. 2008, 44, 1237-1244. [Devyato-
Eur. J. Med. Chem. 2019, 171, 66-92. doi 10.1016/
va N.F., Kosolapova L.S., Kurbangalieva A.R.,
j.ejmech.2019.03.021
Berdnikov E.A., Lodochnikova O.A., Litvinov I.A.
8. Khatri H.R., Bhattarai B., Kaplan W., Li Z.Z.,
Chmutova G.A. Russ. J. Org. Chem. 2008, 44, 1225-
Long M.J.C., Aye Y., Nagorny P. J. Am. Chem. Soc.
1232.] doi 10.1134/S1070428008080204
2019, 141, 4849-4860. doi 10.1021/jacs.8b12870
22. Курбангалиева А.Р., Девятова Н.Ф., Косолапо-
9. Singh S., Sharma P.K., Kumar N., Dudhe R. J. Pharm.
ва Л.С., Лодочникова О.А., Бердников Е.А., Литви-
Sci. 2011, 2, S51-S61.
нов И.А., Чмутова Г.A. Изв. АН. Сер. хим. 2009,
10. Kayumov A.R., Sharafutdinov I.S., Trizna E.Y.,
58, 126-133. [Kurbangalieva A.R., Devyatova N.F.,
Bogachev M.I. New and Future Developments
Kosolapova L.S., Lodochnikova O.A., Berdnikov E.A.,
in Microbial Biotechnology and Bioengineering.
Litvinov I.A., Chmutova G.A. Russ. Chem. Bull. 2009,
Microbial Biofilms: Current Research and Future
58, 126-133.] doi 10.1007/s11172-009-0019-1
Trends. Ed. M.K. Yadav, B.P. Singh. Amsterdam:
23. Kurbangalieva A.R., Lodochnikova O.A., Devyato-
Elsevier, 2020, 6, 77-89. doi 10.1016/B978-0-444-
va N.F., Berdnikov E.A., Gnezdilov O.I., Litvinov I.A.,
64279-0.00006-2
Chmutova G.A. Tetrahedron. 2010, 66, 9945-9953. doi
11. Davis D.C., Hoch D.G., Wu L., Abegg D., Martin B.S.,
10.1016/j.tet.2010.10.047
Zhang Z.-Y., Adibekian A., Dai M. J. Am. Chem. Soc.
24. Хоанг Т.Л., Курбангалиева А.Р., Ежова А.С., Берд-
2018, 140, 17465-17473. doi 10.1021/jacs.8b07652
ников Е.А., Чмутова Г.А. Бутлеров. Cообщ. 2015,
42, 33-40. [Hoang T.L., Kurbangalieva A.R., Yezho-
12. Xia F., Li W.-Y., Yang X.-W., Yang J., Li X., Nian Y.,
va A.S., Berdnikov E.A., Chmutova G.A. Butlerov
Xu G. Org. Lett. 2019, 21, 5670-5674. doi 10.1021/
Commun. 2015, 42, 33-40.]
acs.orglett.9b01527
25. Хоанг Т.Л., Курбангалиева А.Р., Ежова А.С., Лодоч-
13. Trost B.M., Gnanamani E., Kalnmals C.A., Hung C.-I.
никова О.А., Чмутова Г.А. Бутлеров. Cообщ. 2016,
“Joey”, Tracy J.S. J. Am. Chem. Soc. 2019, 141, 1489-
45, 52-58. [Hoang T.L., Kurbangalieva A.R., Yezho-
1493. doi 10.1021/jacs.8b13367
va A.S., Lodochnikova O.A., Chmutova G.A. Butlerov
14. Sharafutdinov I.S., Trizna E.Y., Baydamshina D.R.,
Commun. 2016, 45, 52-58.]
Ryzhikova M.N., Sibgatullina R.R., Khabibrakhmano-
26. Курбангалиева А.Р., Хоанг Л.Т., Лодочникова О.А.,
va A.M., Latypova L.Z., Kurbangalieva A.R., Rozhi-
Кузьмичева М.Ю., Прадипта А.Р., Танака К., Чму-
na E.V., Klinger-Stobel M., Fakhrullin R.F., Pletz M.W.,
това Г.A. Изв. АН. Сер. хим. 2016, 65, 1278-1284.
Bogachev M.I., Kayumov A.R., Makarewicz O.
[Kurbangalieva A.R., Hoang L.T., Lodochnikova O.A.,
Front. Microbiol.
2017,
8,
2246. doi
10.3389/
Kuzmicheva M.Yu., Pradipta A.R., Tanaka K.,
fmicb.2017.02246
Chmutova G.A. Russ. Chem. Bull. 2016, 65, 1278-
15. Yang K., Yang J.-Q., Luo S.-H., Mei W.-J., Lin J.-Y.,
1284.] doi 10.1007/s11172-016-1448-2
Zhan J.-Q., Wang Z.-Y. Bioorg. Chem. 2021, 107,
27. Девятова Н.Ф., Курбангалиева А.Р., Янилкин В.В.,
104518. doi 10.1016/j.bioorg.2020.104518
Чмутова Г.А. Изв. АН. Сер. хим. 2009, 58, 889-899.
16. Прилежаева Е.Н. Усп. хим. 2000, 69, 403-446.
[Devyatova N.F., Kurbangalieva A.R., Yanilkin V.V.,
[Prilezhaeva E.N. Russ. Chem. Rev. 2000, 69, 367-
Chmutova G.A. Russ. Chem. Bull. 2009, 58, 908-919.]
408.]
doi 10.1007/s11172-009-0114-3
17. Trost B.M., Kalnmals C.A. Chem. Eur. J. 2019, 25,
28. Латыпова Л.З., Сайгитбаталова Е.Ш., Чулакова Д.Р.,
11193-11213. doi 10.1002/chem.201902019
Лодочникова О.А., Курбангалиева А.Р., Бердни-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022
896
ХАБИБРАХМАНОВА и др.
ков Е.А., Чмутова Г.А. ЖОрХ. 2014, 50, 532-545.
ka K., Trizna E.Y., Baidamshina D.R., Bogachev M.I.,
[Latypova L.Z., Saigitbatalova, E. Sh., Chulakova D.R.,
Kayumov A.R. New Microbiol. 2019, 42, 29-36.
Lodochnikova O.A., Kurbangalieva A.R., Berdni-
33. Sheldrick G.M. Acta Crystallogr., Sect. A. 2015, 71,
kov E.A., Chmutova G.A. Russ. J. Org. Chem. 2014,
3-8. doi: 10.1107/S2053273314026370
50, 521-534.] doi 10.1134/S1070428014040149
34. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
29. Латыпова Л.З., Сайгитбаталова Е.Ш., Курбангалие-
3-8. doi 10.1107/S2053229614024218
ва А.Р., Лодочникова О.А., Чмутова Г.А. Бутлеров.
35. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Сообщ. 2016, 46, 89-96. [Latypova L.Z., Saigitbatalo-
ward J.A.K., Puschmann H. J. Appl. Crystallogr. 2009,
va E.S., Kurbangalieva A.R., Lodochnikova O.A.,
42, 339-341. doi 10.1107/S0021889808042726
Chmutova G.A. Butlerov Commun. 2016, 46, 89-96.]
36. Spek A.L. Acta Crystallogr., Sect. D. 2009, 65, 148-
30. Fenske D., Merzweiler K. Z. Naturforsch. 1989, 44b,
155. doi 10.1107/S090744490804362X
879-883. doi 10.1515/znb-1989-0803
37. Гордон А., Форд Р. Спутник химика: Физико-хи-
31. Chen Q.H., Huang B. Chin. Chem. Lett. 1993, 4, 675-
мические свойства, методики, библиография. М.:
678.
Мир, 1976. [Gordon A.J., Ford R.A. The Chemist’s
32. Sharafutdinov I.S., Pavlova A.S., Khabibrakhmano-
companion: A handbook of practical data, techniques,
va A.M., Faizova R.G., Kurbangalieva A.R., Tana-
and references. New York: Wiley, 1973.]
Optically Active Bisthioethers and Disulfones Based
on 2(5H)-Furanone and Dithiols: Synthesis and Structure
A. M. Khabibrakhmanovaa, E. S. Rabbanievaa, D. P. Gerasimovab, D. R. Islamovc,
L. Z. Latypovaa, c, O. A. Lodochnikovaa, b, and A. R. Kurbangalievaa, *
a Kazan (Volga Region) Federal University, ul. Kremlyovskaya, 18, Kazan, 420008 Russia
b Arbuzov Institute of Organic and Physical Chemistry, FRC Kazan Scientific Center, Russian Academy of Sciences,
ul. Akademika Arbuzova, 8, Kazan, 420088 Russia
c Federal Research Center “Kazan Scientific Center of the Russian Academy of Sciences”,
ul. Lobachevskogo, 2/31, Kazan, 420008 Russia
*e-mail: akurbang@kpfu.ru
Received June 7, 2022; revised June 22, 2022; accepted June 23, 2022
The methods for the synthesis of novel optically active bisthioethers and disulfones of the 2(5H)-furanone series
were developed. Bisthioethers, in the molecules of which the dithiol fragment links two γ-lactone cycles at the
C4 carbon atoms, were obtained under the interaction of 5(S)-(l-menthyloxy)- and 5(S)-(l-bornyloxy)-2(5H)-
furanones with ethane-1,2-dithiol and propane-1,3-dithiol in the presence of triethylamine. Chiral disulfones
with a fragment of monoterpene alcohols in the 5 position of the γ-lactone ring were isolated from the oxidation
reactions of the dithio derivatives of furanone with hydrogen peroxide in acetic acid. The structure of five new
sulfur-containing derivatives of furanone was characterized by single crystal X-ray diffraction.
Keywords: 2(5H)-furanones, lactones, thiylation, ethane-1,2-dithiol, propane-1,3-dithiol, bisthioethers, disul-
fones, X-ray analysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 8 2022