ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 9, с. 913-925
УДК 547.6, 547.4, 547.636.3
ТРИФТОРЭТОКСИЛИРОВАНИЕ СТИРОЛОВ
С ПОМОЩЬЮ ФОТОРЕДОКС-КАТАЛИЗИРУЕМОЙ
РЕАКЦИИ МЕЕРВЕЙНА
© 2022 г. А. Д. Харламоваa, А. С. Абельa, *, А. Д. Аверинa, b, И. П. Белецкаяa, b
a ФГБОУ «Московский государственный университет им. М.В. Ломоносова», химический факультет,
Россия, 119991 Москва, Ленинские горы, 1, стр. 3
b ФГБУН «Институт физической химии и электрохимии им. А.Н. Фрумкина РАН»,
Россия, 119071 Москва, Ленинский просп., 31/4
*e-mail: antonabel@list.ru
Поступила в редакцию 21.04.2022 г.
После доработки 04.05.2022 г.
Принята к публикации 05.05.2022 г.
Фоторедокс катализ при облучении видимым светом за последние несколько лет стал широко используе-
мым синтетическим методом. Исследована фоторедокс-катализируемая реакция Меервейна с использова-
нием 2,2,2-трифторэтанола в качестве нуклеофила. Показано, что целевые продукты арил-трифторэток-
силирования стирола удается получить с умеренными выходами 32-53%. Лучшие результаты показала
каталитическая система [Ru(bpy)3](PF6)2 в присутствии NaH2PO4 в ацетонитриле.
Ключевые слова: фоторедокс катализ, трифторэтоксилирование, стирол, реакция Меервейна, соли
диазония
DOI: 10.31857/S0514749222090014, EDN: JKWWMM
ВВЕДЕНИЕ
В связи с этим разработка методов введения
2,2,2-трифторэтокси группы в структуру молеку-
Разработка методов синтеза новых фтор-содер-
лы - актуальная задача. В последнее время разра-
жащих органических соединений - одна из важ-
ботано много каталитических методов трифтор-
ных задач современной химии, так как такие ве-
этоксилирования аренов и гетероаренов [9-15],
щества находят широкое применение в составе ле-
однако число методов синтеза
2,2,2-трифтор-
карственных средств, пестицидов, инсектицидов
этоксизамещенных алифатических соединений
и т.п. [1-3]. Обычно такие соединения содержат в
ограничено. Реакции бифункционализации крат-
своем составе в качестве заместителя фтор и/или
ных связей - удобный и перспективный под-
трифторметильную группу. Наличие этих групп
ход к синтезу сложных молекул, при этом правиль-
позволяет осуществлять настройку таких важных
ный выбор катализатора позволяет осуществлять
свойств молекулы как растворимость [4] и липо-
реакции с высокой регио- и энантио-селективно-
фильность [5], может влиять на конформацию моле-
стью [16, 17]. Например, в применении к интере-
кулы [6] и ее способность участвовать в гидрофоб-
сующему нас процессу, в работе [18] авторами для
ных взаимодействиях [7]. 2,2,2-Трифторэтокси-
синтеза трифторэтиловых простых эфиров пред-
замещенные соединения проявляют разнообраз-
ложены условия Co(II)-катализируемого региосе-
ную биологическую активность, они входят в
лективного гидротрифторэтоксилирования алке-
состав различных фармацевтических препаратов
нов. В последнее время активно развиваются син-
(Флекаиндид, Лансопразол, Силодозин) и пе-
тетические методы, основанные на процессах с
стицидов (трифлоксисульфурон натрия)
[8].
участием радикалов [19-21], что стало возможным
913
914
ХАРЛАМОВА и др.
во многом благодаря применению фоторедокс-ка-
нитробензол 1а (продукт восстановления), 4-ни-
тализа под действием видимого света, который по-
тростильбен 1b и продукт присоединения ацето-
зволяет генерировать радикальные интермедиаты
нитрила с последующим гидролизом 1с.
в мягких условиях. Реакция Меервейна (редокс
Механизм реакции, а также пути образования
катализируемое анион-арилирование алкенов) -
побочных продуктов представлены на схеме 3.
удобный метод дифункционализации алкенов с
В ходе реакции в результате переноса электрона
участием солей диазония, которые легко образу-
от возбужденного фотокатализатора образуется
ют арил-радикалы в результате одноэлектронного
арил-радикал, который может присоединиться к
переноса [22-23]. Внедрение фоторедокс-катализа
стиролу с образованием дизамещенного алкиль-
под действием видимого света значительно рас-
ного радикала. Перенос электрона от получен-
ширило возможности данной реакции, что позво-
ного радикала к окисленной форме катализатора
лило присоединять в качестве нуклеофилов эфиры
приводит к образованию карбкатиона, который
енолов [24], ацетонитрил [25], ДМФА [26], цианид
далее подвергается нуклеофильной атаке с обра-
[27] и тиоцианат [28], а также донорные арены
зованием продукта. Отметим, что на каждом этапе
[29]. В настоящей работе приведены предвари-
реакции образующиеся интермедиаты могут всту-
тельные результаты нашего исследования возмож-
пать в различные побочные процессы, что ведет
ности введения в молекулу с помощью реакции
к снижению выхода целевого продукта (схема 3).
Меервейна важной с точки зрения биологической
Также в реакционной смеси присутствует кетон
активности трифторэтокси-группы, демонстриру-
1d, который образуется в результате окисления
ющие основные факторы, влияющие на протека-
целевого продукта, примеры окисления простых
ние реакции.
бензиловых эфиров в соответствующие кетоны
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
описаны в литературе [31-32]. В качестве окисли-
Ранее в работе [30] было показано, что арил-
теля, по-видимому, в нашем случае выступает соль
метоксилирование стиролов можно осуществить
диазония, так как реакция проводится в бескисло-
только при использовании солей диазония, содер-
родных условиях в атмосфере аргона. Отметим,
жащих электроноакцепторные группы в аромати-
что указанные побочные продукты наблюдаются
ческом ядре. Мы продемонстрировали хорошую
и при использовании других спиртов, а их выхо-
воспроизводимость методики и осуществили
ды могут достигать более 40%. Оптимизация ус-
арилметоксилирование стирола тетрафторбора-
ловий должна обеспечить преобладание нужного
том 4-нитрофенилдиазония с использованием на-
направления реакции на каждой стадии. Большое
шего фотореактора в смеси ацетонитрил-метанол
количество параметров, влияющих на ход реак-
в присутствии комплекса Ru(bpy)32+, в результате
ции, требует многофакторной оптимизации усло-
чего выход продукта присоединения составил 55%
вий, которая стала неизбежной для исследований в
(схема 1).
этой области. Фторсодержащие спирты обладают
пониженной нуклеофильностью, что затрудняет
Далее нами была изучена возможность арил-
протекание последней стадии реакции и снижает
трифторэтоксилирования стирола в аналогичных
выход продукта.
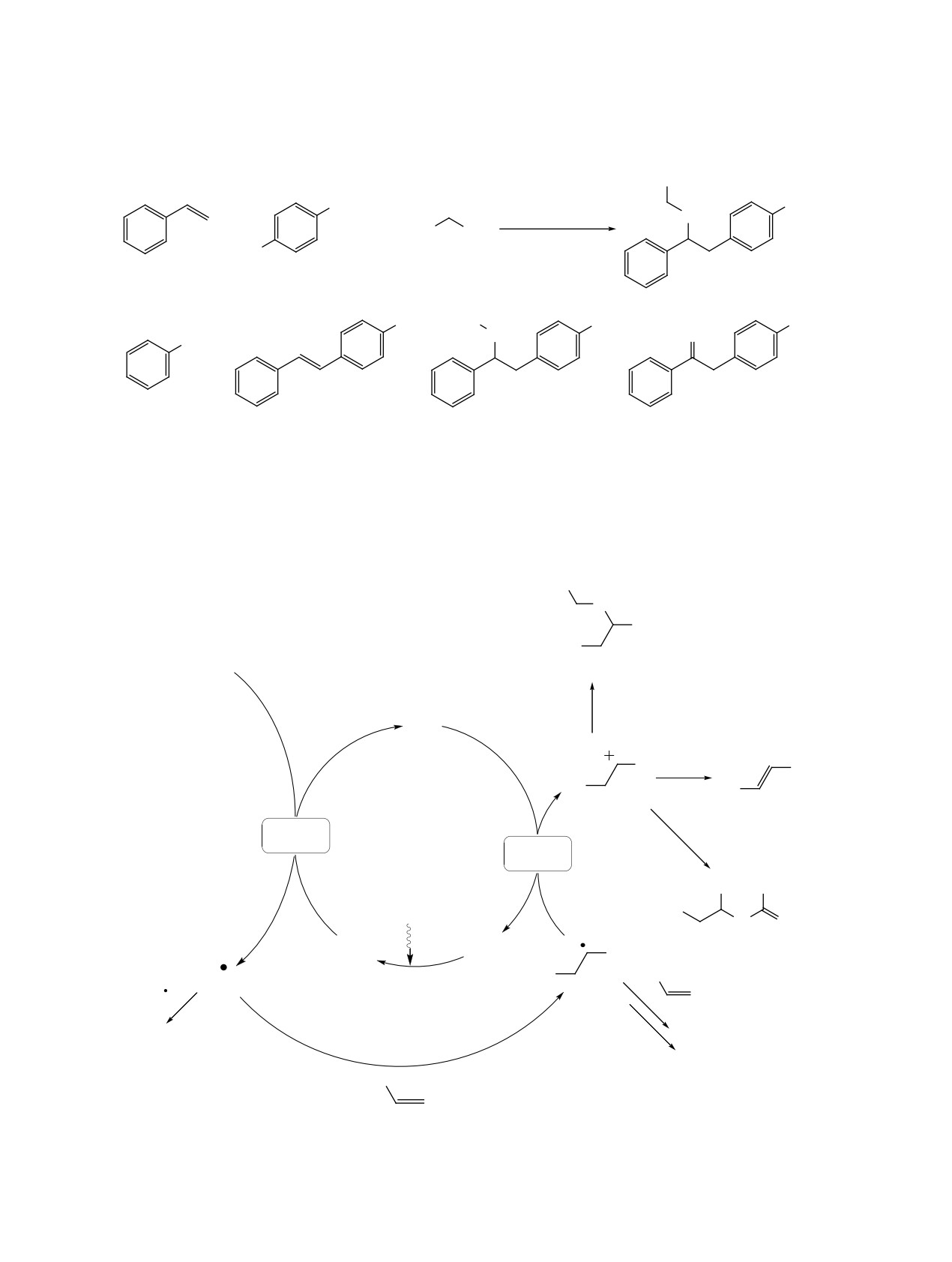
условиях (схема 2). Обнаружено, что кроме це-
левого продукта 1, также в реакционной смеси
Повысить выход целевого продукта можно
присутствуют побочные продукты: полимеры,
либо увеличив нуклеофильность спирта за счет
Схема 1
Me
-
2+
NO2
ɦɨɥ
N2+ BF4
O
ɫɢɧɢɣ ɰɜɟɬ
+
MeCN/MeOH 1:1
O2N
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
ТРИФТОРЭТОКСИЛИРОВАНИЕ СТИРОЛОВ
915
Схема 2
CF3
–
N2+ BF4
ɮɨɬɨɤɚɬɚɥɢɡɚɬɨɪ
NO2
ɫɢɧɢɣ ɫɜɟɬ
O
+
+ F3C
OH
ɨɫɧɨɜɚɧɢɟ
O2N
ɪɚɫɬɜɨɪɢɬɟɥɶ
1
ɉɨɛɨɱɧɵɟ ɩɪɨɞɭɤɬɵ
NO2
Ac
NO2
NO
2
NH
O
NO
2
1a
1b
1c
1d
депротонирования и правильного выбора раство-
бочного продукта 1b. Авторы работы [33] пока-
рителя, либо за счет повышения динамической
зали, что активация спирта при арилалкоксили-
концентрации электрофила. Однако добавление
ровании с использованием солей диарилйодония
основания также способствует образованию по-
может быть достигнута с использованием кислот
Схема 3
F3C
O
Ph
+
Ar
1
CF3CH2OH
H+
ɎɄ+
-H+
R
Ph
Ar
Ar
1b
SET
MeCN
SET
H2O
-N2
Ph Me
Ar
N
O
hȞ
H
ɎɄ
ɎɄ
Ph
1c
Ar
Ar
Ph
[H ]
ɬɟɥɨɦɟɪɢɡɚɰɢɹ
Ar H
ɩɨɥɢɦɟɪɢɡɚɰɢɹ
Ph
ɎɄ ɮɨɬɨɤɚɬɚɥɢɡɚɬɨɪ
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
916
ХАРЛАМОВА и др.
t-Bu
t-Bu
N
N N
N N
N
N
N
Ru2+
Ir
+
N
Ir
N
N
N
N
2X
PF6
Ru(bpy)3(PF6)2 X = PF6-
fac-Ir(ppy)
3
Ir(ppy)2(dpbpy)
Ru(bpy)3Cl2
X = Cl-
t-Bu
t-Bu
N
N N
N
N
F
CF3
C
C
COOH
+
Ir
N
Br
Br
N
N
F
N
HO
O
O
F
N
Br
Br
F
PF6
CF3
Ir[dF(CF3)ppy]2(dtbbpy)
ɗɨɡɢɧ <
4CzIPN
Фотокатализаторы, использованные в данной работе
Льюиса. Таким образом, при оптимизации усло-
неудачных экспериментов, которые не привели к
вий с целью выявления оптимального сочетания
образованию целевого продукта, исключены из
факторов нами варьировались природа фотоката-
обсуждения.
лизатора, растворитель, соотношение реагентов,
Наиболее наглядные результаты оптимизации
количество фотокатализатора и добавки основа-
условий реакции приведены в табл. 1. Хотя во
ний или кислот Льюиса.
всех случаях наблюдалась полная конверсия соли
Важную роль играет выбор фоторедокс-ка-
диазония, выход целевого продукта реакции из-
тализатора. Сочетание таких параметров, как
менялся в очень широком диапазоне. Необходимо
коэффициент поглощения, время жизни возбуж-
отметить, что одной из главных особенностей дан-
денного состояния, а также потенциалы окисле-
ной реакции выступает использование большого
ния и восстановления, определяет концентрацию
избытка трифторэтанола, поэтому одна из задач
и активность каталитически активных частиц и
оптимизации - снижение количества дорогостоя-
интермедиатов в реакционной смеси, что в свою
щего фторсодержащего спирта. Задача осложняет-
очередь позволяет путем выбора фотокатализато-
ся пониженной нуклеофильностью 2,2,2-трифтор-
ра управлять ходом всего процесса [34, 35]. В дан-
этанола. Так, при использовании 9.3 экв трифтор-
ном исследовании использовались шесть фотока-
этанола продукта реакции не наблюдалось ни при
тализаторов, которые ранее продемонстрировали
0.5, ни при 1 мол % фотокатализатора (табл. 1,
наибольшую эффективность в реакциях бифунк-
оп. 1, 2).
ционализации (рис. 1). Ниже будут обсуждены
наиболее наглядные эксперименты, которые де-
Увеличение избытка спирта до 46 экв, что соот-
монстрируют основные тенденции. Большинство
ветствует ранее описанным условиям арилалкокси-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
ТРИФТОРЭТОКСИЛИРОВАНИЕ СТИРОЛОВ
917
Таблица 1. Арилтрифторэтоксилирование стирола тетрафторборатом 4-нитрофенилдиазония
Опытa
Катализатор (мол %)
Растворитель
Количество спирта, экв
Выход, %
1
Ru(bpy)3(PF6)2 (0.5%)
MeCN
9.3
0
2
Ru(bpy)3(PF6)2 (1%)
MeCN
9.3
0
3
Ru(bpy)3(PF6)2 (1%)
MeCN
14
7
4
Ru(bpy)3(PF6)2 (1%)
MeCN
23
14
5
Ru(bpy)3(PF6)2 (1%)
MeCN
46.3
20
6b
Ru(bpy)3(PF6)2 (1%)
MeCN
46.3
9
7c
Ru(bpy)3(PF6)2 (1%)
MeCN
46.3
5
8d
Ru(bpy)3(PF6)2 (1%)
MeCN
46.3
0
9e
Ru(bpy)3(PF6)2 (1%)
MeCN
46.3
20
10f
Ru(bpy)3(PF6)2 (1%)
MeCN
46.3
53
11
Ru(bpy)3(PF6)2 (1%)
ДМСО
9.3
0
12
Ru(bpy)3(PF6)2 (1%)
ДХЭ
9.3
0
13
Ru(bpy)3(PF6)2 (1%)
ДМФА
9.3
0
14
Ru(bpy)3(PF6)2 (1%)
ТГФ
9.3
0
15
Ru(bpy)3(PF6)2 (1%)
диоксан
9.3
33
16
Ru(bpy)3(PF6)2 (1%)
CF3CH2OH
46.3
0
17
4CzIPN (5%)
MeCN
46.3
21
18
Eosin Y (5%)
MeCN
46.3
21
19g
Eosin Y (5%)
MeCN
46.3
0
20
Ir(ppy)3 (1%)
MeCN
46.3
25
21
Ir(ppy)2(dtpbpy)(PF6) (1%)
MeCN
46.3
31
22
Ir[dF(CF3)ppy]2(dtbbpy) (1%)
MeCN
46.3
42
23
Ir[dF(CF3)ppy]2(dtbbpy) (0.5%)
MeCN
46.3
13
24
Ir[dF(CF3)ppy]2(dtbbpy) (2%)
MeCN
46.3
17
a Условия реакции: 0.3 ммоль 4-O2N-Ph-N2BF4, 0.6 ммоль стирола, 1 мл растворителя, облучение синим светом (450 нм), комн.
темп., 2 ч
b добавка K2CO3 (1 экв)
c добавка АсОNa (1 экв)
d добавка K3PO4 (1 экв)
e добавка Na2HPO4 (1 экв)
f добавка Na2HPO4 (20 мол %)
g Облучали смесь зеленым светом (530 нм)
лирования [30], позволило поднять выход продук-
K3PO4) при малом количестве трифторэтанола
та лишь до 20% (табл. 1, оп. 3-5). В реакционной
привело к снижению выхода продукта (табл. 1,
смеси наблюдались побочные продукты 1с и 1d,
оп. 6-8). Использование в качестве основания
выходы которых достигали 30-40%. Добавление
NaH2PO4 (1 экв) не повлияло на выход продукта
1 экв оснований различной силы (K2CO3, АсОNa,
присоединения (табл. 1, ср оп. 5 и 9), однако сни-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
918
ХАРЛАМОВА и др.
жение количества данного основания до 20 мол %
Отметим, что исходная соль диазония обладает
неожиданно привело к заметному увеличению вы-
плохой растворимостью в диоксане, что приводит
хода до 53% (табл. 1, оп. 10). Интересно, что про-
к ее более медленному расходованию в ходе реак-
ведение реакции в присутствии 10, 40 и 60 мол %
ции. По-видимому, это факт существенно влияет
NaH2PO4 привело к меньшим выходам (26-37%).
на селективность процесса. Однако, в тетрагидро-
Проведение реакции при пониженной концентра-
фуране и дихлорэтане, в которых соли диазония
ции трифторэтанола (2.8 ммоль, 9.3 экв) в различ-
также плохо растворимы, образования продукта не
ных растворителях (табл. 1, оп. 11-15) показало,
наблюдалось. В диоксане как при увеличении, так
что в присутствии фотокатализатора Ru(bpy)32+
и при уменьшении загрузки фотокатализатора на-
продукт образуется только в диоксане. При этом
блюдалось некоторое уменьшение выхода продук-
выход 33% был достигнут при использовании
та присоединения (табл. 2, оп. 1, 2, 5). Увеличение
9.3 экв спирта (табл. 1, оп. 11-14). Использование
загрузки трифторэтанола до 14 экв позволило до-
большинства других фотокатализаторов в ацето-
стичь выхода продукта 45% (табл. 2, оп. 3), даль-
нитриле при повышенной концентрации спирта
нейшее увеличение избытка спирта не привело к
(табл. 1, оп. 17-22) не позволило существенно уве-
росту выхода (табл. 2, оп. 4). Уменьшение загрузки
личить выход целевого продукта, при этом, если
катализатора (табл. 2, оп. 5) привело к снижению
стандартная загрузка Ru- и Ir-содержащих фото-
выхода. Другие фотокатализаторы в диоксане так-
катализаторов составляла 1 мол %, органические
же не обеспечивают удовлетворительного выхода
фотокатализаторы использовались в количестве
продукта (табл. 2, оп. 6-12). Добавление в реак-
5 мол %. Следует отметить, что при использова-
цию различных количеств оснований или кислот
нии Эозина Y образование продукта наблюдалось
Льюиса при различных соотношениях также при-
только при облучении именно синим светом, не-
вело лишь к снижению выхода (табл. 2, оп. 13-18).
смотря на то что максимум поглощения этого со-
Таким образом, нами было найдено три набо-
единения соответствует зеленой области спектра
ра условий реакции (i, ii и iii), которые позволяют
(табл. 1, оп. 18, 19). Дорогостоящий катализатор
осуществить 4-нитрофенил трифторэтоксилиро-
Ir[dF(CF3)ppy]2(dtbbpy) обеспечил выход целевого
вание стирола с удовлетворительными выхода-
продукта 42% (табл. 1, оп. 22). Для данного ката-
ми 42-45% (схема 4). Далее мы изучили влия-
лизатора была осуществлена попытка провести
ние природы реагентов на протекание реакции.
реакцию с уменьшенным (0.5 мол %) и увеличен-
Тетрафторборат 3-нитрофенилдиазония образует
ным (2 мол %) количеством катализатора. В обоих
продукт 2 с выходами 22, 20 и 40% при использо-
случаях наблюдалось сильное падение выходов
вании протоколов i, ii и iii, соответственно. В слу-
(табл. 1, оп. 23-24). Таким образом, наибольший
чае менее электронодефицитных солей диазония,
выход целевого продукта в ацетонитриле обеспе-
содержащих другие заместители (4-фторфенил,
чивается системой Ru(bpy)32+ (1%)/NaH2PO4 (20%)
4-хлорфенил-, 4-бромфенил-, фенил- и 4-метокси-
в ацетонитриле в присутствии 46.3 экв трифтор-
фенил), соединения 3-7 образуются только в при-
этанола. Необходимость именно каталитических
сутствии основания в условиях iii. Соединения 6 и
количеств основания, по-видимому, обусловлена
7 не удалось отделить от побочных продуктов ре-
тем, что большая его концентрация приводит к об-
акции, они были охарактеризованы лишь в смеси.
разованию продукта 1b. В отсутствие основания
Следует отметить, что для данного типа реак-
тетрафторборная кислота, образовавшаяся в ходе
ций характерны более высокие выходы для элек-
реакции, критически препятствует присоедине-
тронодефицитных солей диазония [27, 30], однако
нию спирта. Использование других источников
в нашем случае пара-метоксизамещенный продукт
арил-радикалов (арилгалогенидов и солей арил-
7 удалось получить с сопоставимым выходом 32%.
йодония) не привело к увеличению выхода.
Арилтрифторэтоксилирование 4-бром- и 4-хлор-
С целью поиска условий реакции, позволяю-
стирола удалось осуществить только в условиях ii
щих уменьшить избыток трифторэтанола, была
и iii, при этом условия iii обеспечили значительно
проведена оптимизация условий трифторэтокси-
более высокие выходы. В случае 4-трет-бутил-
лирования стирола в диоксане (табл. 2).
стирола при реакции тетрафторборатом 4-нитро-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
ТРИФТОРЭТОКСИЛИРОВАНИЕ СТИРОЛОВ
919
Таблица 2. Арилтрифторэтоксилирование стирола в диоксане
Опытa
Катализатор (мол %)
Добавка
Количество спирта, экв
Выход, %
1
Ru(bpy)3(PF6)2 (1%)
-
9.3
33
2
Ru(bpy)3(PF6)2 (2%)
-
9.3
26
3
Ru(bpy)3(PF6)2 (1%)
-
14
45
4
Ru(bpy)3(PF6)2 (1%)
-
23
42
5
Ru(bpy)3(PF6)2 (0.5%)
-
14
24
6
Eosin Y (5%)
-
14
17
7b
Eosin Y (5%)
-
14
9
8
4CzIPN (1%)
-
14
13
9
Ru(bpy)3Cl2 (1%)
-
14
24
10
fac-Ir(ppy)3 (1%)
-
14
17
11
Ir(ppy)2(dpbpy) (1%)
-
14
14
12
Ir[dF(CF3)ppy]2(dtbbpy) (1%)
-
46
20
13
Ru(bpy)3(PF6)2 (1%)
АсОNa (1 экв)
14
0
14
Ru(bpy)3(PF6)2 (1%)
DMAP (1 экв)
14
0
15
Ru(bpy)3(PF6)2 (1%)
Na2HPO4 (1 экв)
14
26
16
Ru(bpy)3(PF6)2 (1%)
K3PO4 (1 экв)
14
11
17
Ru(bpy)3(PF6)2 (1%)
Zn(OAc)2 (20%)
14
0
18
Ru(bpy)3(PF6)2 (1%)
Cu(OAc)2 (10%)
14
18
a Условия реакции: 0.3 ммоль 4-O2N-Ph-N2BF4, 0.6 ммоль стирола, 1 мл диоксана, облучение синим светом (450 нм), комн. темп.,
2 ч
b Облучали смесь зеленым светом (530 нм)
фенилдиазония продукт трифторэтоксилирования
коммерчески доступные реактивы марки Aldrich,
10 был получен только в условиях iii.
Alfa Aesar и ABCR. Катализаторы Ru(bpy)3(PF6)2,
fac-Ir(ppy)3 и Ir(ppy)2(dpbpy)(PF6) синтезирова-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ли по стандартным методикам [36]. Катализатор
Для облучения реакционной смеси использо-
4CzIPN получали по описанному методу [37]. Соли
валась светодиодная лента LP IP65 5050/60, мак-
диазония были получены из соответствующих
симум излучения при 455 нм (синий свет) или
анилинов по описанной методике [38] и очищены
530 нм (зеленый свет) общей мощностью 12 Вт, ох-
путем осаждения диэтиловым эфиром из раствора
лаждаемая внешним вентилятором. Схема реакто-
в ацетоне. Осторожно! Несмотря на то, что дан-
ра приведена в работе [27]. Спектры ЯМР 1Н, 13С и
ной работе не наблюдалось каких-либо осложне-
19F регистрировали на приборе Bruker Avance-400
ний, соли диазония в твердом виде - потенциально
(рабочие частоты 400, 100.6 и 376.5 МГц соот-
взрывоопасны. Работа с ними должна осущест-
ветственно). Спектры регистрировали в CDCl3,
вляться в небольших количествах с максимальной
в качестве внутреннего стандарта использовали
осторожностью и аккуратностью. Растворители
сигналы остаточных протонов дейтерированных
очищали с использованием стандартных методик.
растворителей. Для препаративной колоночной
хроматографии использовали силикагель марки
Фторедокс-катализируемое арилтрифтор-
«Merck» (40/60). В исследовании использовались
этоксилирование стиролов (общая методика). В
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
920
ХАРЛАМОВА и др.
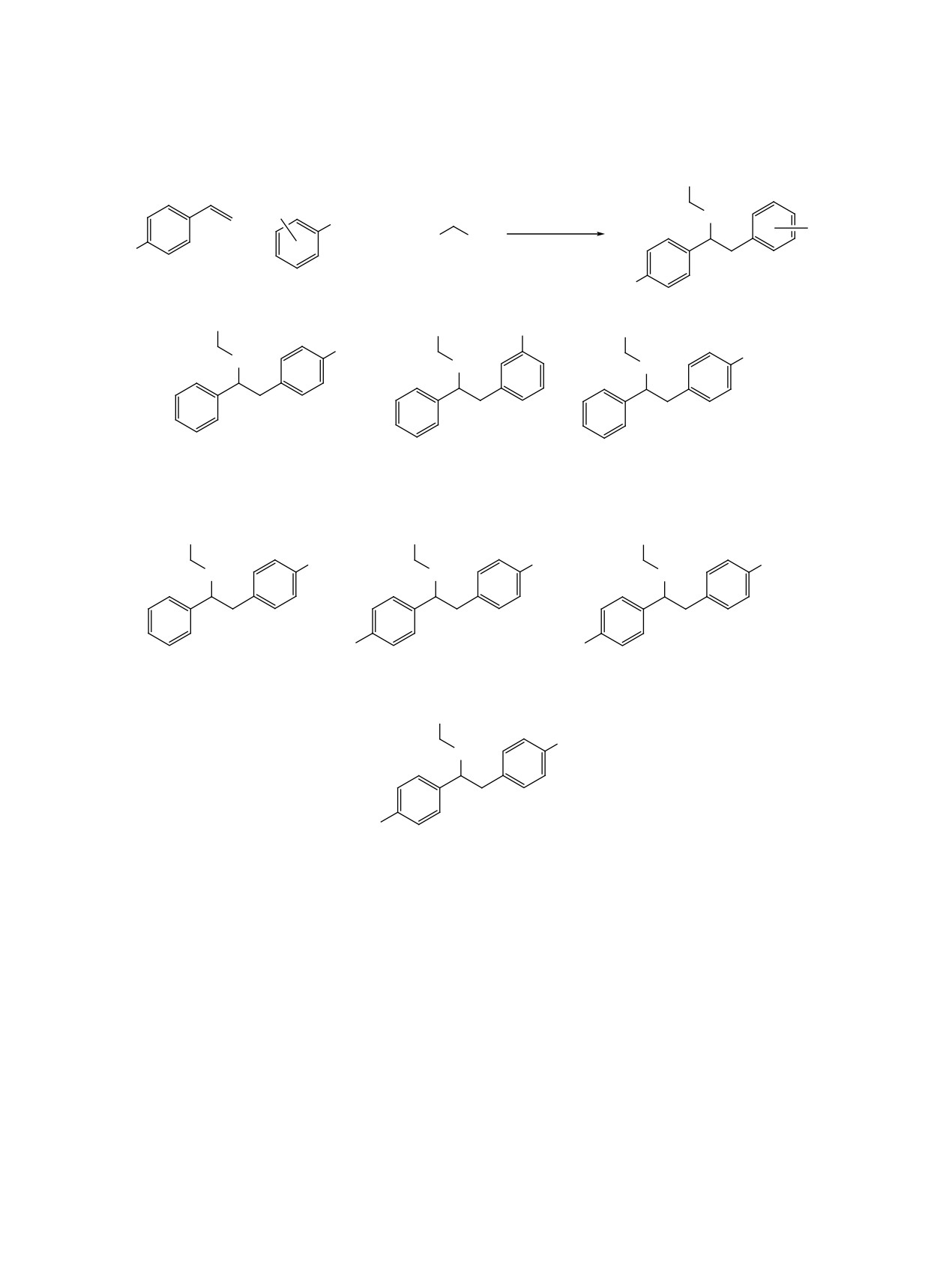
Схема 4
CF3
R2
O
N2+ BF–
i, ii ɢɥɢ iii
R2
+
+
F3C
OH
ɫɢɧɢɣ ɫɜɟɬ
R1
R1
1-10
CF3
CF3
NO2
CF3
NO2
2
R
O
O
O
1
i
2
i
3, R2
)
iii
ii
ii
4, R2
&O
iii
iii
iii
5, R2
%U
iii
CF3
CF3
CF3
R2
NO2
NO
2
O
O
O
Br
Cl
6, R2
+
iii
8
ii
9
ii
7, R2
20H
iii
iii
iii
CF3
NO2
O
t %X
10
iii
i ɞɢɨɤɫɚɧ 5X ES\32+
ɷɤɜ &)3CH2OH; ii 0H&1 ,U>G) &)3 SS\@2 GWEES\
ɷɤɜ &)3CH2OH; iii 0H&1 5X ES\32+
1D+2PO4
ɦɨɥ
ɷɤɜ &)3CH2OH.
сосуд Шленка, снабженный магнитной мешалкой,
ровали дихлорметаном (3×15 мл), объединенные
вносили катализатор (0.5-5 мол %), соль диазо-
органические вытяжки сушили над сульфатом на-
ния (0.3 ммоль), стирол (0.6 ммоль), растворитель
трия и упаривали, остаток хроматографировали на
(1 мл) и 2,2,2-трифторэтанол (0.2-1 мл) и основа-
силикагеле с использованием последовательности
элюентов петролейный эфир-СH2Cl2 5:1-1:1.
ние. Смесь дегазировали методом «заморозка-ва-
куумирование-разморозка» («freeze-pump-thaw») в
1-Нитро-4-[2-фенил-2-(2,2,2-трифторэток-
вакууме масляного насоса (3 цикла). Далее смесь
си)этил]бензол (1). Синтезировали по общей ме-
перемешивали при комнатной температуре при
тодике из 72 мг (0.3 ммоль) 4-нитрофенилдиазония
облучении синим светом в течение двух часов. К
тетрафторбората, 63 мг (0.6 ммоль) стирола, 0.3 мл
смеси добавляли 10 мл воды, продукт экстраги-
(4.2 ммоль) 2,2,2-трифторэтанола в 1 мл ацетони-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
ТРИФТОРЭТОКСИЛИРОВАНИЕ СТИРОЛОВ
921
трила в присутствии 9 мг (20 мол %) Na2HPO4 и
ный эфир-СH2Cl2, 5:1. Выход 23 мг (26%), жел-
3 мг (1 мол %) Ru(bpy)3(PF6)2. Элюент петролей-
тое масло. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 2.92
ный эфир-СH2Cl2, 3:1. Выход 51 мг (53%), желтое
д.д (1H, CH2-Ar, 2JHH 13.9, 3JHH 5.7 Гц), 3.16 д.д
масло. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 3.05 д.д (1H,
(1H, CH2-Ar, 2JHH 13.9, 3JHH 7.5 Гц), 3.56 д.к (1H,
CH2-Ar, 2JHH 13.9, 3JHH 5.1 Гц), 3.24 д.д (1H, CH2-
CH2CF3, 2JHH 12.0, 3JHF 8.5 Гц), 3.69 д.к (1H,
Ar, 2JHH 13.9, 3JHH 7.8 Гц), 3.54 д.к (1H, CH2CF3,
CH2CF3, 2JHH 12.0, 3JHF 8.9 Гц), 4.52 м (1H, CH-O),
2JHH 12.1, 3JHF 8.4 Гц), 3.69 д.к (1H, CH2CF3, 2JHH
6.92 т [2H, H2, H6 (Ph-F), Jнабл 8.7 Гц], 7.06 д.д (2H,
12.1, 3JHF 8.8 Гц), 4.59 д.д (1H, CH-O, 3JHH 7.8,
H3, H5 (Ph-F), 3JHH 8.3, 4JHF 5.5 Гц], 7.21-7.23 м
5.1 Гц), 7.20-7.30 м [4H, H3, H5 (Ph-NO2), H3, H5
[2H, H2, H6 (Ph)], 7.31-7.37 м [3H, H3, H4, H5 (Ph)].
(Ph)], 7.32-7.78 м [3H, H2, H4, H6 (Ph)], 8.10 д [2H,
Спектр ЯМР 13С (CDCl3), δ, м.д.: 43.7 (CH2), 65.9
H2, H6 (Ph-NO2), Jнабл 8.6 Гц]. Спектр ЯМР 13С
к (CH2CF3, 2JCF 34.1 Гц), 84.6 (CH2O), 114.8 д
(CDCl3), δ, м.д.: 44.3 (CH2), 65.8 к (CH2CF3, 2JCF
[2С, С2, С6 (Ph-F), 2JCF 21.2 Гц], 123.9 к (CF3, 1JCF
34.3 Гц), 83.7 (CH2O), 123.3 (2С), 123.8 к (CF3,
278.8 Гц), 126.8 (2С), 128.3, 128.6 (2С), 131.0 д
1JCF 279.6 Гц), 126.6 (2С), 128.7, 128.8 (2С), 130.5
[С3, С5 (Ph-F), 3JCF 7.9 Гц], 114.8 д [С4 (Ph-F), 4JCF
(2С), 139.0, 145.3, 146.7 (C-NO2). Спектр ЯМР 19F
3.1 Гц], 139.7. Спектр ЯМР 19F (CDCl3), δ, м.д.:
(CDCl3), δ, м.д.: -74.0 т (3F, 3JFH 8.6 Гц).
-74.0 т (3F, CF3, 3JFH 8.7 Гц), -116.8 т.т (1F, Ph-F,
3JFH 8.7, 4JHF 5.5 Гц).
1-Нитро-3-[2-фенил-2-(2,2,2-трифторэток-
си)этил]бензол (2). Синтезировали по общей ме-
1-Хлор-4-[2-фенил-2-(2,2,2-трифторэтокси)-
тодике из 72 мг (0.3 ммоль) 3-нитрофенилдиазония
этил]бензол (4). Синтезировали по общей мето-
тетрафторбората, 63 мг (0.6 ммоль) стирола, 0.3 мл
дике из 71 мг (0.3 ммоль) 4-хлорфенилдиазония
(4.2 ммоль) 2,2,2-трифторэтанола в 1 мл ацетни-
тетрафторбората, 63 мг (0.6 ммоль) стирола, 1 мл
трила в присутствии 9 мг (20 мол %) Na2HPO4 и
(14 ммоль) 2,2,2-трифторэтанола в 1 мл ацетони-
3 мг (1 мол %) Ru(bpy)3(PF6)2. Элюент петролей-
трила в присутствии 9 мг (20 мол %) Na2HPO4 и
ный эфир-СH2Cl2, 3:1. Выход 39 мг (40%), желтое
3 мг (1 мол %) Ru(bpy)3(PF6)2. Элюент петролей-
масло. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 3.04 д.д (1H,
ный эфир-СH2Cl2, 5:1. Выход 30 мг (32%), желтое
CH2-Ar, 2JHH 14.0, 3JHH 5.0 Гц), 3.24 д.д (1H, CH2-
масло. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 2.91 д.д (1H,
Ar, 2JHH 14.0, 3JHH 8.1 Гц), 3.54 д.к (1H, CH2CF3,
CH2-Ar, 2JHH 13.9, 3JHH 5.6 Гц), 3.15 д.д (1H, CH2-
2JHH 12.1, 3JHF 8.4 Гц), 3.70 д.к (1H, CH2CF3, 2JHH
Ar, 2JHH 13.8, 3JHH 7.6 Гц), 3.56 д.к (1H, CH2CF3,
12.1, 3JHF 8.8 Гц), 4.59 д.д (1H, CH-O, 3JHH 8.1,
2JHH 12.1, 3JHF 8.5 Гц), 3.68 д.к (1H, CH2CF3, 2JHH
5.0 Гц), 7.20-7.25 м [2H, H3, H5 (Ph)], 7.30-7.40
12.0, 3JHF 8.9 Гц), 4.48-4.54 м (1H, CH-O), 7.04 д
м [3H, H2, H4, H6 (Ph)], 7.41 т [1H, H5 (Ph-NO2),
[2H, H3, H5 (Ph-Cl), Jнабл 8.3 Гц], 7.20-7.23 м [4H,
3JHH 7.9 Гц], 7.46 д.т [1H, H4 (Ph-NO2), 3JHH 7.6,
H2, H3, H5, H6 (Ph)], 7.33-7.38 м [3H, H4 (Ph), H6
4JHH 1.3 Гц], 8.01 т [1H, H2 (Ph-NO2), 4JHH 1.6 Гц],
H2 (Ph-Cl)]. Спектр ЯМР 13С (CDCl3), δ, м.д.: 43.9
8.08 д.д.д [1H, H6 (Ph-NO2), 3JHH 8.1, 4JHH 2.1, 4JHH
(CH2), 66.1 к (CH2CF3, 2JCF 34.2 Гц), 84.4 (CH2O),
1.4 Гц]. Спектр ЯМР 13С (CDCl3), δ, м.д.: 44.1
123.9 к (CF3, 1JCF 279.2 Гц), 126.7 (2С), 128.2 (2С),
(CH2), 66.0 к (CH2CF3, 2JCF 34.8 Гц), 83.9 (CH2O),
128.4, 128.7 (2С), 130.9 (2С), 132.3 (C-Cl), 136.0,
121.4, 124.4, 126.6 (2С), 128.7, 128.9 (3С), 136.0,
139.5. Спектр ЯМР 19F (CDCl3), δ, м.д.: -74.0 т (3F,
139.1, 139.6, 148.1 (C-NO2). Сигнал CF3-группы не
3JFH 8.6 Гц).
наблюдается из-за низкой интенсивности. Спектр
1-Бром-4-[2-фенил-2-(2,2,2-трифторэтокси)-
ЯМР 19F (CDCl3), δ, м.д.: -74.0 т (3F, 3JFH 8.6 Гц).
этил]бензол (5). Синтезировали по общей мето-
1-Фтор-4-[2-фенил-2-(2,2,2-трифторэтокси)-
дике из 81 мг (0.3 ммоль) 4-бромфенилдиазония
этил]бензол (3). Синтезировали по общей мето-
тетрафторбората, 63 мг (0.6 ммоль) стирола, 1 мл
дике из 63 мг (0.3 ммоль) 4-фторфенилдиазония
(14 ммоль) 2,2,2-трифторэтанола в 1 мл ацетони-
тетрафторбората, 63 мг (0.6 ммоль) стирола, 1 мл
трила в присутствии 9 мг (20 мол %) Na2HPO4 и
(14 ммоль) 2,2,2-трифторэтанола в 1 мл ацетони-
3 мг (1 мол %) Ru(bpy)3(PF6)2. Элюент петролей-
трила в присутствии 9 мг (20 мол %) Na2HPO4 и
ный эфир-СH2Cl2, 5:1. Выход 38 мг (35%), жел-
3 мг (1 мол %) Ru(bpy)3(PF6)2. Элюент петролей-
тое масло. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 2.90
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
922
ХАРЛАМОВА и др.
д.д (1H, CH2-Ar, 2JHH 13.9, 3JHH 5.6 Гц), 3.14 д.д
1-Бром-4-[2-(4-нитрофенил)-1-(2,2,2-три-
(1H, CH2-Ar, 2JHH 13.9, 3JHH 7.6 Гц), 3.56 д.к (1H,
фторэтокси)этил]бензол (8). Синтезировали по
CH2CF3, 2JHH 12.0, 3JHF 8.5 Гц), 3.68 д.к (1H,
общей методике из 72 мг (0.3 ммоль) 4-нитрофе-
CH2CF3, 2JHH 12.0, 3JHF 8.9 Гц), 4.48-4.54 м (1H,
нилдиазония тетрафторбората, 110 мг (0.6 ммоль)
CH-O), 6.98 д [2H, H3, H5 (Ph-Br), Jнабл 8.3 Гц],
4-бромстирола, 1 мл (14 ммоль) 2,2,2-трифтор-
7.22-7.23 м [2H, H2, H6 (Ph)], 7.33-7.37 м [5H,
этанола в 1 мл ацетонитрила в присутствии 9 мг
H3, H4, H5 (Ph), H2, H6 (Ph-Br)]. Спектр ЯМР 13С
(20 мол %) Na2HPO4 и 3 мг (1 мол %) Ru(bpy)3(PF6)2.
(CDCl3), δ, м.д.: 43.9 (=CH2), 65.9 к (CH2CF3, 2JCF
Элюент петролейный эфир-СH2Cl2, 5:1. Выход
33.9 Гц), 84.3 (CH2O), 120.4 (C-Br), 123.9 к (CF3,
46 мг
(38%), желтое масло. Спектр ЯМР 1Н
1JCF 278.5 Гц), 126.7 (2С), 128.4, 128.7 (2С), 131.2
(CDCl3), δ, м.д.: 3.05 д.д (1H, CH2-Ar, 2JHH 13.9,
(2С), 131.3 (2С), 136.5, 139.5. Спектр ЯМР 19F
3JHH 5.1 Гц), 3.24 д.д (1H, CH2-Ar, 2JHH 13.9, 3JHH
(CDCl3), δ, м.д.: -74.0 т (3F, 3JFH 8.6 Гц).
7.8 Гц), 3.48-3.60 м (1H, CH2CF3), 3.63-3.75 м (1H,
CH2CF3), 4.59 д.д (1H, CH-O, 3JHH 7.8, 5.1 Гц),
2-Фенил-2-(2,2,2-трифторэтокси)этилбен-
7.20-7.30 м [4H, H2, H6 (Ph-NO2), H3, H5 (Ph)],
зол (6). Синтезировали по общей методике из
7.32-7.78 м [2H, H2, H6 (Ph)], 8.10 д [2H, H3, H5
58 мг (0.3 ммоль) фенилдиазония тетрафторбо-
(Ph-NO2), Jнабл 8.6 Гц]. Спектр ЯМР 13С (CDCl3), δ,
рата, 63 мг (0.6 ммоль) стирола, 1 мл (14 ммоль)
м.д.: 44.2 (CH2), 66.1 к (CH2CF3, 2JCF 34.4 Гц), 83.1
2,2,2-трифторэтанола в
1 мл ацетонитрила в
(CH2O), 122.7 (C-Br), 124.4 (2C), 123.7 к (CF3, 1JCF
присутствии 9 мг (20 мол %) Na2HPO4 и 3 мг
278.7 Гц), 128.3 (2С), 130.5 (2С), 132.1 (2С), 138.1,
(1 мол %) Ru(bpy)3(PF6)2. Элюент петролейный
144.7, 146.9 (C-NO2). Спектр ЯМР 19F (CDCl3),
эфир-СH2Cl2, 5:1. Соединение получено в смеси.
δ, м.д.: -74.0 т (3F, 3JFH 8.6 Гц), -74.0 т (3F, 3JFH
Выход 24 мг (28%), желтое масло. Спектр ЯМР
8.6 Гц).
1Н (CDCl3), δ, м.д.: 2.94 д.д (1H, CH2-Ph, 2JHH
13.7, 3JHH 5.9 Гц), 3.21 д.д (1H, CH2-Ph, 2JHH 13.2,
1-Хлор-4-[2-(4-нитрофенил)-1-(2,2,2-три-
3JHH 7.3 Гц), 3.57 д.к (1H, CH2CF3, 2JHH 12.0, 3JHF
фторэтокси)этил]бензол (9). Синтезировали по
8.4 Гц), 3.67 д.к (1H, CH2CF3, 2JHH 12.2, 3JHF
общей методике из 72 мг (0.3 ммоль) 4-нитрофе-
8.4 Гц), 4.55-4.58 м (1H, CH-O), 7.11 д [2H, H2, H6
нилдиазония тетрафторбората, 83 мг (0.6 ммоль)
(Ph), Jнабл 6.4 Гц], 7.20-7.25 м (4H, Ph), 7.31-7.37 м
4-хлорстирола, 1 мл (14 ммоль) 2,2,2-трифтор-
(4H, Ph). Спектр ЯМР 19F (CDCl3), δ, м.д.: -74.0 т
этанола в 1 мл ацетонитрила в присутствии 9 мг
(3F, 3JFH 8.6 Гц).
(20 мол %) Na2HPO4 и 3 мг (1 мол %) Ru(bpy)3(PF6)2.
Элюент петролейный эфир-СH2Cl2, 5:1. Выход
1-Метокси-4-[2-фенил-2-(2,2,2-трифторэток-
45 мг (42%), желтое масло. Спектр ЯМР 1Н (CDCl3),
си)этил]бензол (7). Синтезировали по общей ме-
δ, м.д.: 3.02 д.д (1H, CH2-Ar, 2JHH 13.8, 3JHH 5.3 Гц),
тодике из 67 мг (0.3 ммоль) 4-метоксифенилдиа-
3.21 д.д (1H, CH2-Ar, 2JHH 13.8, 3JHH 7.8 Гц), 3.54
зония тетрафторбората, 63 мг (0.6 ммоль) стирола,
д.к (1H, CH2CF3, 2JHH 12.1, 3JHF 8.4 Гц), 3.67 д.к
1 мл (14 ммоль) 2,2,2-трифторэтанола в 1 мл аце-
(1H, CH2CF3, 2JHH 12.1, 3JHF 8.8 Гц), 4.58 д.д (1H,
тонитрила в присутствии 9 мг (20 мол %) Na2HPO4
CH-O, 3JHH 7.8, 5.3 Гц), 7.15 [2H, H2, H6 (Ph-Cl),
и 3 мг (1 мол %) Ru(bpy)3(PF6)2. Элюент петролей-
Jнабл 8.4 Гц],
7.26
[2H, H2, H6 (Ph-NO2), Jнабл
ный эфир-СH2Cl2, 5:1. Соединение получено в
8.6 Гц], 7.33 [2H, H3, H5 (Ph-Cl), Jнабл 8.4 Гц], 8.11
смеси. Выход 30 мг (32%), желтое масло. Спектр
д [2H, H3, H5 (Ph-NO2), Jнабл 8.6 Гц]. Спектр ЯМР
ЯМР 1Н (CDCl3), δ, м.д.: 2.88 д.д (1H, CH2-Ar,
13С (CDCl3), δ, м.д.: 44.2 (CH2), 66.0 к (CH2CF3,
2JHH 13.9, 3JHH 5.8 Гц), 3.15 д.д (1H, CH2-Ar, 2JHH
2JCF 34.3 Гц), 83.0 (CH2O), 123.4 (2С), 123.7 к
13.9, 3JHH 7.3 Гц), 3.57 д.к (1H, CH2CF3, 2JHH 11.9,
(CF3, 1JCF 278.9 Гц), 128.0 (2С), 129.1 (2С), 130.5
3JHF 8.6 Гц), 3.64-3.76 м (1H, CH2CF3), 3.79 c (3H,
(2С), 134.6 (C-Cl), 137.5, 144.7, 146.9 (C-NO2).
OCH3), 4.50-4.53 м (1H, CH-O), 6.78 д [2H, H2,
Спектр ЯМР 19F (CDCl3), δ, м.д.: -74.0 т (3F, 3JFH
H6 (Ph-OMe), Jнабл 8.6 Гц], 7.01 д [2H, H3, H5 (Ph-
8.6 Гц).
OMe), Jнабл 8.5 Гц], 7.22-7.24 м [2H, H2, H6 (Ph)],
7.29-7.36 м [3H, H3, H4, H5 (Ph)]. Спектр ЯМР 19F
1-трет-Бутил-4-[2-(4-нитрофенил)-1-(2,2,2-
(CDCl3), δ, м.д.: -74.0 т (3F, 3JFH 8.6 Гц).
трифторэтокси)этил]бензол
(10). Синтезирова-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
ТРИФТОРЭТОКСИЛИРОВАНИЕ СТИРОЛОВ
923
ли по общей методике из 72 мг (0.3 ммоль)
ФОНДОВАЯ ПОДДЕРЖКА
4-нитрофенилдиазония тетрафторбората,
96 мг
Работа выполнена при финансовой поддержке
(0.6
ммоль)
4-трет-бутилстирола,
1
мл
РНФ (грант № 20-73-00103, оптимизация условий,
(14 ммоль) 2,2,2-трифторэтанола в 1 мл ацето-
синтез соединений 1, 2, 8-10, и грант № 19-13-
нитрила в присутствии 9 мг (20 мол %) Na2HPO4
00223П, синтез соединений 3-7).
и 3 мг (1 мол %) Ru(bpy)3(PF6)2. Элюент петролей-
ный эфир-СH2Cl2, 5:1. Выход 43 мг (38%), желтое
ИНФОРМАЦИЯ ОБ АВТОРАХ
масло. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.32 с (9H,
Харламова Алиса Дмитриевна, ORCID: https://
t-Bu), 3.02 д.д (1H, CH2-Ar, 2JHH 13.9, 3JHH 4.7 Гц),
orcid.org/0000-0001-6887-5311
3.22 д.д (1H, CH2-Ar, 2JHH 13.9, 3JHH 8.2 Гц), 3.54
Абель Антон Сергеевич, ORCID: http://
д.к (1H, CH2CF3, 2JHH 12.1, 3JHF 8.5 Гц), 3.67 д.к
orcid.org/0000-0002-2951-4529
(1H, CH2CF3, 2JHH 12.1, 3JHF 8.9 Гц), 4.56 д.д (1H,
CH-O, 3JHH 8.2, 4.7 Гц), 7.15 д [2H, H2, H6 (Ph-t-
Аверин Алексей Дмитриевич, ORCID: http://
Bu), Jнабл 8.3 Гц], 7.30 д [2H, H2, H6 (Ph-NO2), Jнабл
orcid.org/0000-0001-6757-8868
8.7 Гц], 7.38 д [2H, H3, H5 (Ph-t-Bu), Jнабл 8.3 Гц],
Белецкая Ирина Петровна, ORCID: http://
8.11 д [2H, H3, H5 (Ph-NO2), Jнабл 8.7 Гц]. Спектр
orcid.org/0000-0001-9705-1434
ЯМР 13С (CDCl3), δ, м.д.: 31.3 (3С, CH3), 34.6
[C(CH3)3],
44.3 (CH2),
65.8 к (CH2CF3,
2JCF
КОНФЛИКТ ИНТЕРЕСОВ
34.3 Гц), 83.5 (CH2O), 123.3 (2С), 123.7 к (CF3,
Авторы заявляют об отсутствии конфликта ин-
1JCF 278.9 Гц), 125.7 (2С), 126.3 (2С), 130.4 (2С),
тересов.
136.0,
145.6,
146.7 (C-NO2),
151.8 (C-t-Bu).
Спектр ЯМР 19F (CDCl3), δ, м.д.: -74.0 т (3F, 3JFH
СПИСОК ЛИТЕРАТУРЫ
8.7 Гц).
1. Purser S., Moore P.R., Swallow S., Gouverneur V.
Chem. Soc. Rev. 2008, 37, 320-330. doi 10.1039/
ЗАКЛЮЧЕНИЕ
b610213c
Изучено влияние различных факторов на про-
2. Hagmann W.K. J. Med. Chem. 2008, 51, 4359-4369.
текание трифторэтоксилирования стирола солями
doi 10.1021/jm800219f
диазония в условиях фоторедокс-катализируемой
3. Yamazaki T., Taguchi T., Ojima I. Fluorine in Medici-
реакции Меервейна. Показано, что в наибольшей
nal Chemistry and Chemical Biology. 2009, 1-46. doi
степени на выход целевого продукта влияют вы-
10.1002/9781444312096.ch1
бор фоторедокс-катализатора, наличие основания,
4. Ishikawa M., Hashimoto Y. J. Med. Chem. 2011, 54,
количество трифторэтанола и природа раствори-
1539-1554. doi 10.1021/jm101356p
теля. В большинстве условий реакцию удается
5. Wan Z.-K., Chenail E., Xiang J., Li H.-Q., Ipek M.,
осуществить только с использованием нитрозаме-
Bard J., Svenson K., Mansour T.S., Xu X., Tian X.,
щенных солей арилдиазония. Продукты нитрофе-
Suri V., Hahm S., Xing Y., Johnson C.E., Li X., Qad-
нил трифторэтоксилирования стирола может быть
ri A., Panza D., Perreault M., Tobin J.F., Saiah E. J. Med.
как в ацетонитриле в присутствии катализатора
Chem. 2009, 52, 5449-5461. doi 10.1021/jm900639u
Ir[dF(CF3)ppy]2(dtbbpy), так и в диоксане в присут-
6. O’Hagan D. J. Org. Chem. 2012, 77, 3689-3699. doi
ствии катализатора [Ru(bpy)3](PF6)2. В последнем
10.1021/jo300044q
случае количество 2,2,2-трифторэтанола может
7. Barbarich T.J., Rithner C.D., Miller S.M., Ander-
быть снижено в 3 раза относительно стандартного
son O.P., Strauss S.H. J. Am. Chem. Soc. 1999, 121,
без потери выхода. Использование каталитической
4280-4281. doi 10.1021/ja983552e
системы [Ru(bpy)3](PF6)2 в ацетонитриле в при-
8. Pethő B., Novák Z. Asian J. Org. Chem. 2019, 8, 568-
сутствии дигидрофосфата натрия (20 мол %) обе-
575. doi 10.1002/ajoc.201800414
спечивает наибольшие выходы целевых веществ,
9. Pethő B., Zwillinger M., Csenki J.T., Káncz A.E.,
на примере 10 соединений продемонстрирована
Krámos B., Müller J., Balogh G.T., Novák Z.
возможность получения продуктов арилтрифтор-
Chem. Eur. J. 2017, 23, 15628-15632. doi 10.1002/
этоксилирования с выходами до 53%.
chem.201704205
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
924
ХАРЛАМОВА и др.
10. Yang L., Li S., Cai L., Ding Y., Fu L., Cai Z., Ji H.,
25. Prasad Hari D., Hering T., König B. Angew. Chem. Int.
Li G. Org. Lett. 2017, 19, 2746-2749. doi 10.1021/
Ed. 2014, 53, 725-728. doi doi 10.1002/anie.201307051
acs.orglett.7b01103
26. Yao C.-J., Sun Q., Rastogi N., König B. ACS Catalysis.
11. Zhang K., Xu X.-H., Qing F.-L. J. Fluorine Chem.
2015, 5, 2935-2938. doi 10.1021/acscatal.5b00314
2017, 196, 24-31. doi 10.1016/j.jfluchem.2016.07.008
27. Abel A.S., Kharlamova A.D., Averin A.D., Belets-
12. Li J., Wang Z., Lu X., Lin J., Liu L., Zhao Y. Lett. Org.
kaya I.P. Mendeleev Commun. 2021, 31, 815-817. doi
Chem. 2019, 16, 485-490. doi 10.2174/157017861566
6181108111232
10.1016/j.mencom.2021.11.015
13. Ruyet L., Poisson T., Besset T. Eur. J. Org. Chem.
28. Hoque I.U., Chowdhury S.R., Maity S. J. Org. Chem.
2021, 2021, 3407-3410. doi 10.1002/ejoc.202100580
2019, 84, 3025-3035. doi 10.1021/acs.joc.8b03155
14. Luo Y., Hu M., Ge J., Li B., He L. Org. Chem. Front.
29. Ouyang X.-H., Cheng J., Li J.-H. Chem. Commun.
2022, 9, 1593-1598. doi 10.1039/D1QO01319J
2018, 54, 8745-8748. doi 10.1039/C8CC04526G
15. Terrett J.A., Cuthbertson J.D., Shurtleff V.W.,
30. Yamaguchi E., Tanaka W., Itoh A. Chem. Asian J. 2019,
MacMillan D.W.C. Nature. 2015, 524, 330-334. doi
14, 121-124. doi 10.1002/asia.201801211
10.1038/nature14875
31. Lindroth R., Ondrejková A., Wallentin C.-J. Org. Lett.
16. Nájera C., Beletskaya I.P., Yus M. Chem. Soc. Rev.
2019, 48, 4515-4618. doi 10.1039/C8CS00872H
2022, 24, 1662-1667. doi 10.1021/acs.orglett.2c00231
17. Beletskaya I.P., Nájera C., Yus M. Russ. Chem. Rev.
32. Palav A., Misal B., Ganwir P., Badani P., Chaturb-
2020, 89, 250-274. doi 10.1070/rcr4916
huj G. Tetrahedron Lett.
2021,
73,
153094. doi
18. Shigehisa H., Kikuchi H., Hiroya K. Chem. Pharm.
10.1016/j.tetlet.2021.153094
Bull. 2016, 64, 371-374. doi 10.1248/cpb.c15-01024
33. Fumagalli G., Boyd S., Greaney M.F. Org. Lett. 2013,
19. Kostromitin V.S., Zemtsov A.A., Kokorekin V.A.,
15, 4398-4401. doi 10.1021/ol401940c
Levin V.V., Dilman A.D. Chem. Commun. 2021, 57,
34. Prier C.K., Rankic D.A., MacMillan D.W.C. Chem.
5219-5222. doi 10.1039/D1CC01609A
Rev. 2013, 113, 5322-5363. doi 10.1021/cr300503r
20. Wang P.-Z., Gao Y., Chen J., Huan X.-D., Xiao W.-J.,
Chen J.-R. Nature Commun. 2021, 12, 1815. doi
35. Zilate B., Fischer C., Sparr C. Chem. Commun. 2020,
10.1038/s41467-021-22127-x
56, 1767-1775. doi 10.1039/C9CC08524F
21. Gao P., Niu Y.-J., Yang F., Guo L.-N., Duan X.-H.
36. Zhang J., Li Y., Zhang F., Hu C., Chen Y. Angew.
Chem. Commun. 2022, 58, 730-746. doi 10.1039/
Chem. Int. Ed. 2016, 55, 1872-1875. doi 10.1002/
D1CC05730H
anie.201510014
22. Babu S.S., Muthuraja P., Yadav P., Gopinath P. Adv.
37. Huang H., Li X., Yu C., Zhang Y., Mariano P.S.,
Synth. Catal. 2021, 363, 1782-1809. doi 10.1002/
Wang W. Angew. Chem. Int. Ed. 2017, 56, 1500-1505.
adsc.202100136
doi 10.1002/anie.201610108
23. Diesendorf N., Heinrich M.R. Synthesis. 2022, 54,
1951-1963. doi 10.1055/s-0040-1719893
38. Erb W., Hellal A., Albini M., Rouden J., Blanchet J.
24. Hering T., Hari D.P., König B. J. Org. Chem. 2012, 77,
Chem. Eur. J. 2014, 20, 6608-6612. doi 10.1002/
10347-10352. doi 10.1021/jo301984p
chem.201402487
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
ТРИФТОРЭТОКСИЛИРОВАНИЕ СТИРОЛОВ
925
Trifluoroethoxylation of Styrenes
via Photoredox-Catalyzed Meerwein Reaction
A. D. Kharlamovaa, A. S. Abela, *, A. D. Averina, b, I. P. Beletskayaa, b
a M.V. Lomonosov Moscow State University, Department of Chemistry, Leninskie gory, 1/3, Moscow, 119991 Russia
b A.N. Frumkin Institute of Physical Chemistry and Electrochemistry RAS,
Leninskii prosp., 31/4, Moscow, 119991 Russia
*e-mail: antonabel@list.ru
Received April 21, 2022; revised May 4, 2022; accepted May 5, 2022
Photoredox catalysis under visible light irradiation has become a widely used synthetic method over the past
few years. A photoredox-catalyzed Meerwein reaction using 2,2,2-trifluoroethanol as a nucleophile has been
studied. It has been shown that the target products of aryltrifluoroethoxylation of styrene can be obtained in
moderate yields of 32-53%. The best results were shown by the [Ru(bpy)3](PF6)2 catalytic system in the pres-
ence of NaH2PO4 in acetonitrile.
Keywords: photoredox catalysis, trifluoroethoxylation, styrene, Meerwein reaction, diazonium salts
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022