ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 9, с. 936-950
УДК 547.316 + 547.326 + 547.661 + 547.772 + 547.787
2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ КАК
ЭЛЕКТРОФИЛЬНЫЕ И НУКЛЕОФИЛЬНЫЕ
СТРУКТУРНЫЕ БЛОКИ ДЛЯ СОЗДАНИЯ ФРАГМЕНТОВ
1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ. ПРИМЕНЕНИЕ
В СИНТЕЗЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
© 2022 г. И. В. Минеева*
Белорусский государственный университет, Беларусь, 220030 Минск, просп. Независимости, 4
*e-mail: i.mineyeva@yandex.ru
Поступила в редакцию 02.11.2021 г.
После доработки 24.11.2021 г.
Принята к публикации 26.11.2021 г.
Разработан эффективный метод получения новых гетероциклических соединений на основе 2-замещен-
ных функционализированных аллилбромидов как предшественников электрофильных и нуклеофильных
строительных блоков для создания фрагментов 1,3-дикарбонильных соединений.
Ключевые слова: 1,3-дикарбонильные соединения, 2-замещенные аллилбромиды, метил-3-бромме-
тил-3-бутеноат, 2-(бромметил)-4,4-диэтоксибут-1-ен, пиразол, оксазол, бензо[f]кумарин, мультикомпо-
нентные реакции
DOI: 10.31857/S0514749222090038, EDN: JLDJQI
ВВЕДЕНИЕ
идного артрита и псориатического артрита, оказы-
вающим антипролиферативное, иммуномодули-
1,3-Дикарбонильные соединения проявля-
рующее и противовоспалительное действие [3].
ют себя как полезные удобные и перспективные
Валдекоксиб (5), селективный ингибитор ЦОГ-2,
структурные блоки в синтезе пиразолов, оксазо-
нестероидный противовоспалительный препарат,
лов, изоксазолов, кумаринов и многих других ге-
используемый при лечении остеоартрита, ревма-
тероциклических соединений [1-3], являющихся
тоидного артрита [3].
востребованными лекарственными препаратами
Содержащий кумариновое ядро варфарин (6)
(схема 1).
является антикоагулянтом непрямого действия
Так, содержащий пиразольное ядро целекок-
[10]. Скопарон (7) - природное органическое со-
сиб (1), ингибитор ЦОГ-2, является эффективным
единение из китайской травы Artemisia scoparia,
и безопасным для желудочно-кишечного тракта
обладает свойствами иммуносупрессора и вазо-
анальгетиком и противовоспалительным сред-
релаксатора, антитромботического агента, пода-
ством [4-7]. Лоназолак (2) - нестероидный проти-
вляющего высвобождение арахидоновой кислоты
вовоспалительный препарат [8]. Римонабант (3)
[11]. Хлорихромен (8) уменьшает размер инфаркта
является первым селективным блокатором рецеп-
миокарда после ишемического реперфузионного
торов CB1 и использовался в качестве лекарствен-
повреждения in vivo, ингибирует фактор некроза
ного средства против ожирения до 2009 г. [9].
опухоли-альфа (схема 1) [12].
Изоксазольный гетероцикл находится в лефлу-
По данным литературы существует большое ко-
номиде (4), применяющимся для лечения ревмато-
личество методов получения 1,3-дикарбонильных
936
2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
937
Схема 1
O
F3C
HO
Cl
N
N
O
H
Cl
N N
N N
N N
Cl
SO2NH
2
Cl
1
2
3
ɐɟɥɟɤɨɤɫɢɛ
Ʌɨɧɚɡɨɥɚɤ
Ɋɢɦɨɧɚɛɚɧɬ
CF3
O
SO2NH2
N
H
N O
N O
4
5
Ʌɟɮɥɭɧɨɦɢɞ
ȼɚɥɶɞɟɤɨɤɫɢɛ
MeO
NEt2
OH
O
EtO
MeO
O
O
O
O O
O
Cl
O O
6
7
8
ȼɚɪɮɚɪɢɧ
ɋɤɨɩɚɪɨɧ
ɏɥɨɪɢɯɪɨɦɟɧ
соединений [1-3]. В данной работе предлагается
соединений. Следует отметить, что примеров эф-
новый подход, основанный на раскрытии мезилата
фективного применения 1,3-кетоацеталей в син-
циклопропанола 9 в 2-замещенные аллилбромиды
тезе гетероциклических соединений весьма мало
10 и 11а, b - электрофильные или нуклеофильные
вследствие того, что образуются смеси изомерных
структурные блоки [12, 13], затем их модификации
продуктов [14-20].
в 1,3-дикарбонильные соединения структурного
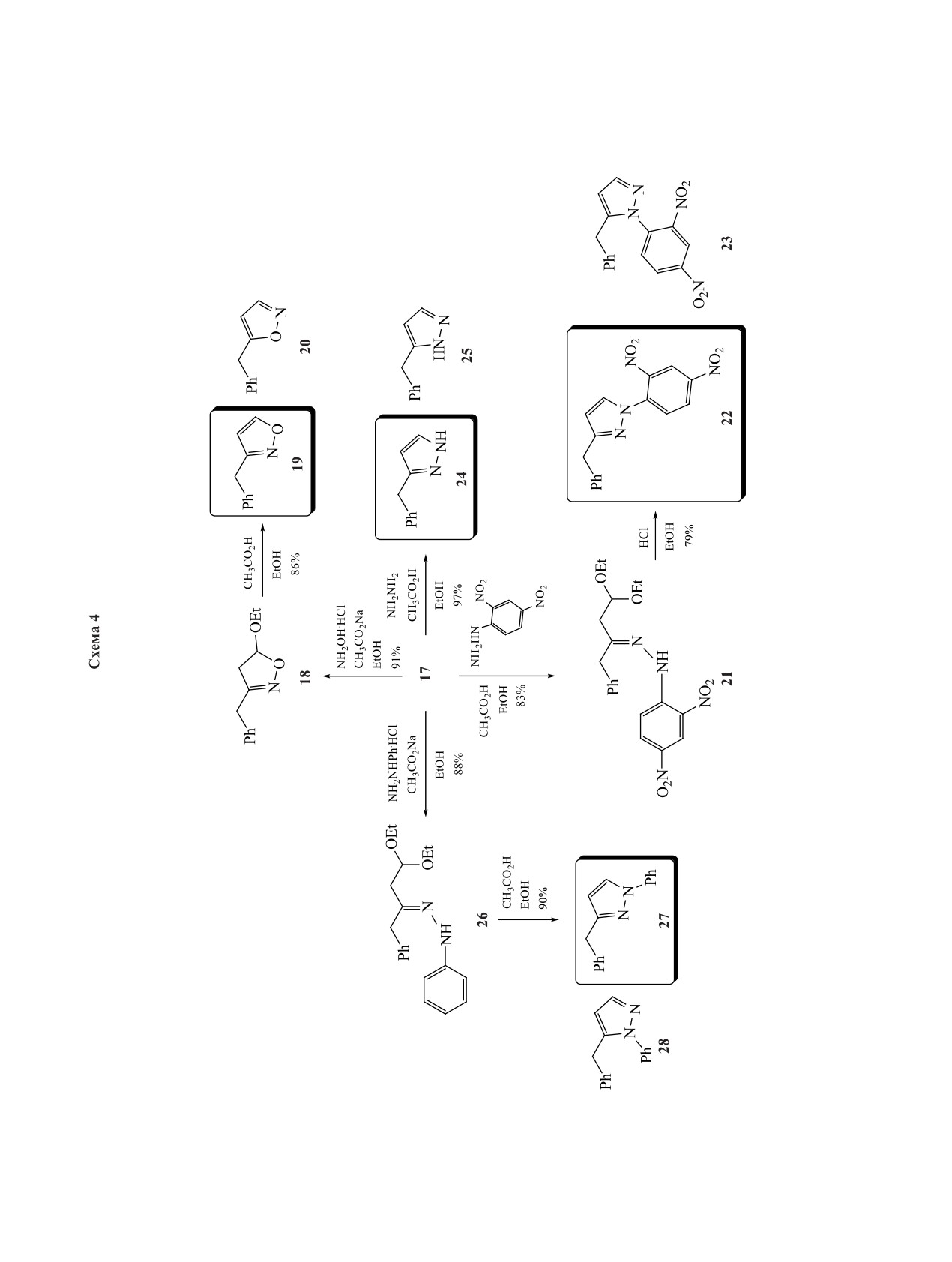
При взаимодействии соединения 17 с соляно-
типа 12 и 13, которые далее превращали в пиразо-
кислым гидроксиламином и ацетатом натрия как
лы, оксазолы и кумарины 14, 15 (схема 2).
основанием промежуточно образовывался ацеталь
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
18, который после продолжительного гидролиза в
Аллилбромид 10 как электрофильный строи-
присутствии уксусной кислоты привел к новому
тельный блок был введен в сочетание с фенилмаг-
изоксазолу 19 (схема 4). Структура соединения
ния бромидом в присутствии соли одновалентной
19 была доказана методом спектроскопии ЯМР,
меди. Полученный ненасыщенный ацеталь 16 по-
его спектральные характеристики не совпадали с
сле озонолиза был превращен в кетоацеталь 17, ра-
таковыми ранее описанного в литературе изомера
нее не описанный в литературе (схема 3).
20 [21]. Кипячение ацеталя 17 с 2,4-динитрофе-
Далее планировалось вовлечь кетоацеталь 17
нилгидразином в этаноле при катализе уксусной
как скрытую форму 1,3-дикарбонильного соеди-
кислотой дало устойчивый ацеталь 21, который
нения в реакции с различными нуклеофилами с
был превращен в пиразол 22 при действии концен-
целью синтеза пятичленных гетероциклических
трированной соляной кислоты в кипящем этаноле.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
938
МИНЕЕВА и др.
Схема 2
H2O2
HCl
OEt
OEt
OEt
OMs
MgBr2
ROH
OR2
R1
Br
Br
Et2O
EtO
MgBr2
O
OEt
OEt
O
88%
CHCl3
12
10
9
11a, b
[13]
[12]
O
OR2
R3
R1
R3
O
O
N X
O O
14
15
13
X = O, NH, NR; R1 = Ph (14); R2 = Me (11a), 49%; R2 = Et (11b), 47%;
R3 = i-Pr, Ph, CH2CO2Et, Ph(OTBS)CH.
В спектре ЯМР 1Н реакционной смеси наблюда-
Аллилбромид 11а как электрофильный участник
лись следовые сигналы изомерного продукта 23.
реакции сочетания с реагентами Гриньяра образо-
Взаимодействие ацеталя 17 с гидразином проте-
вал эфиры 33 и 34, после озонолитического рас-
кало быстро, и без затруднений был получен пи-
щепления кратной связи которых были получены
разол 24. В этой реакции возможно формирова-
замещенные ацетоуксусные эфиры 35, 36 с высо-
ние изомера 25, но спектральные характеристики
кими выходами. Алкилирование малонового эфи-
соединения 24 не совпали с таковыми известного
ра 37 аллилбромидом 11а и серия последующих
и описанного в литературе пиразола 25 [22]. При
несложных трансформаций позволила получить
взаимодействии ацеталя 17 с солянокислым фе-
замещенные эфиры 39 и 40 (схема 6).
нилгидразином и ацетатом натрия как основанием
Аллилбромид 11b как нуклеофильный стро-
с последующим продолжительным гидролизом
ительный блок был введен в реакцию Барбье с
промежуточного соединения 26 в присутствии
бензальдегидом 41 и гексаналем 29, а полученные
уксусной кислоты был синтезирован пиразол 27.
ненасыщенные эфиры 42 и 43 в серии несложных
Спектральные характеристики соединения 27 со-
превращений были превращены в функционализи-
впали со спектральными характеристиками, опи-
рованные эфиры 44-46 (схема 6).
санными в литературе [23], и не совпали с таковы-
ми возможного изомера 28 [24].
Синтезированные по схеме 6 замещенные аце-
тоуксусные эфиры 35, 36, 40, 44-46 могут найти
Аллилбромид 10 был вовлечен в реакцию со-
применение в синтезе замещенных бензокумари-
четания как нуклеофильный строительный блок
нов (схема 7), которые обладают биологической
(схема 5) при конденсации с гексаналем (29) в ус-
активностью и используются в качестве базовых
ловиях реакции Барбье. Последующий озонолиз
соединений для создания новых сильнодействую-
спирта 30 и циклизация соединения 31 в кислой
щих лекарственных средств [25-27].
среде позволили получить пиранон 32.
Далее аллилбромиды 11а, b были применены
Были протестированы различные основания
для создания замещенных ацетоуксусных эфиров.
и растворители для получения бензокумаринов
Схема 3
OEt
OEt
PhMgBr, CuI
1. O3, CH2Cl2
Ph
Ph
10
ɌȽɎ,
78°C
2. PPh3
OEt
O OEt
98%
96%
16
17
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
939
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
940
МИНЕЕВА и др.
Схема 5
O
10, Zn
C5H11
OEt
1. O3, CH2Cl2
C5H11
OEt
C5H11
H
ɌȽɎ
OH
OEt
2. PPh3
OH
O
OEt
79%
85%
29
30
31
O
HCl
ɌȽɎ
72%
C5H11
O
32
(см. таблицу), лучший результат показала система
растворителей. Спектры ЯМР 1H и 13С 5-10%-ных
5 мол % пиперидина в этаноле при перемешива-
растворов синтезированных соединений в дейте-
нии в течение 12 ч при комнатной температуре.
рохлороформе (CDCl3) были получены на приборе
Bruker Avanсe-500 (Германия) с рабочей частотой
Далее в мультикомпонентную реакцию полу-
500 и 125 МГц соответственно. Химические сдви-
чения кумаринов удалось вовлечь и другие моди-
ги измеряли по шкале δ сигнала остаточных про-
фицированные
1,3-дикарбонильные соединения
тонов дейтерохлороформа (δ 7.26 и 77.16 м.д. для
(схема 8). Во всех случаях применяли наилуч-
13С соответственно). ИК спектры веществ запи-
шим образом зарекомендовавшую себя систему:
саны в пленке на спектрофотометре Bruker FT-IR
5 мол % пиперидина при комнатной температуре в
Alpha (Германия). Масс-спектры были получены
этаноле. Таким образом были получены новые бен-
на Agilent 8860 gс System (США) масс-спектро-
зокумарины 48-51 с умеренным и высоким выхо-
метре с ионизацией электронным ударом 70 эВ,
дом. В случае эфира 44, содержащего незащищен-
колонка Agilent 1990 1s-433е, hp-5 ms от -60 до
ную гидроксильную группу, образовывалась смесь
350°С. Температуру плавления определяли на при-
продуктов неустановленного состава. Ацетат 45
боре Stuart SMP 50 Cole-Parmer (Великобритания).
отличался лабильностью, уже при хроматографи-
ровании и при хранении согласно спектру ЯМР 1Н
[2-(2-Этокси-3-метоксипропил)проп-2-ен-
заметны следы енолизации и перемещения ацетат-
1-ил]бензол (16). К раствору 2.37 г (10 ммоль)
ной группы на енольную гидроксильную группу,
аллилбромида 10 в 20 мл ТГФ, 0.19 г (1 ммоль)
что привело к хроматографически неделимой сме-
СuI добавляли при -78°С в атмосфере аргона
си продуктов, ожидаемый продукт 52 не образо-
20 мл 1 М раствора фенилмагния бромида в ТГФ
вывался.
(20 ммоль) в течение 20 мин. После перемешива-
ния в течение 1 ч реакционную массу нагревали
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
до комнатной температуры, обрабатывали 45 мл
Использованные в ходе работы реактивы и
насыщенного водного раствора NH4Cl, продукт
растворители имели квалификацию «чистые» и
из водного слоя экстрагировали Et2O (3×20 мл) и
«чистые для анализа». Оценку индивидуальности
объединенные вытяжки сушили Na2SO4. После
синтезируемых веществ и наблюдение за ходом
удаления растворителя при пониженном давлении
проводимых реакций осуществляли методом ТСХ
продукты выделяли хроматографически (элюент -
на пластинках «Sorbfil». В качестве элюента ис-
смесь петролейного эфира и EtOAc, 80:1). Выход
пользованы смеси растворителей - петролейный
2.29 г (98%). ИК спектр, ν, см-1: 1126 с (С-О), 1053
эфир и этилацетат в различных соотношениях.
с (С-О), 1029 с (С-О). Спектр ЯМР 1H, δ, м.д.: 1.25
Выделение индивидуальных веществ осуществля-
т (6Н, ОСН2СН3, J 7.1 Гц), 2.36 д (2Н, СН2СН, J
ли методом колоночной хроматографии на сили-
5.5 Гц), 3.46 уш.с (2Н, CH2Рh), 3.50-3.56 м (2Н,
кагеле (70-230 меш) производства фирмы Merck с
OCH2CH3), 3.65-3.71 м (2Н, OCH2CH3), 4.66 т [1Н,
использованием в качестве элюентов смесей тех же
СН(ОС2Н5)2, J 5.8 Гц], 4.90 уш.с (1Н, СН2=), 5.01
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
941
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
942
МИНЕЕВА и др.
Схема 7
CHO
ɭɫɥɨɜɢɹ
O
OEt
OHɢɡ ɬɚɛɥɢɰɵ
+
O O
O O
35
47
48
Условия модельной реакции конденсации 2-оксинафтойного альдегида 47 с эфиром 35а
Основание
Растворитель
Температура, °С
Время, ч
Выход продукта 48, %
Пиперидин
- [28]
20
0.083
42
РhI(OAc)2
EtOH [29]
40
3
71
Пиперидин
Py [30]
100
1
56
Пиперидин
ЕtОН [31]
20
2
75
Пиперидин
CH2Cl2 [32]
20
4
60
Пиперидин
ЕtОН [33, 34]
80
1
68
Пиперидин
ДМФА [35]
20
1
40
Пиперидин
CH3CN
20
3
37
L-Пролин
EtOH
20
3
20
L-Пролин
EtOH
80
2
26
Пиперидин
бензол
20
6
15
Пиперидин
EtOH
20
12
95
а На 1 ммоль альдегида 47 и 1 ммоль эфира 35 использовали 2 мл растворителя и 5 мол % основания
уш.с (1Н, СН2=), 7.24-7.36 м (5Н, CH2Рh). Спектр
нии вносили 1.05 г (8.9 ммоль) PPh3 и нагревали
ЯМР 13С, δ, м.д.: 15.2 (2С), 39.5, 43.5, 61.1 (2С),
до комнатной температуры в течение 3 ч. После
102.0, 114.0, 126.1, 128.2 (2С), 129.1 (2С), 139.5,
отгонки растворителя при пониженном давлении
144.6. Масс-спектр, m/z (Iотн, %):
188
(50.93),
продукт реакции выделяли колоночной хромато-
159 (16.39), 145 (15.60), 144 (13.97), 143 (51.62),
графией (элюент - смесь петролейного эфира и
142 (47.29), 141 (24.12), 131 (38.32), 129 (40.85),
EtOAc, 40:1). Выход 0.91 г (96%). ИК спектр, ν,
128 (31.91), 127 (12.46), 117 (18.22), 116 (32.51),
см-1: 1714 с (С=О), 1119 с (С-О), 1090 с (С-О),
115 (53.48), 103 (100.00), 97 (18.04), 92 (11.44),
1054 с (С-О), 1029 с (С-О). Спектр ЯМР 1H, δ, м.д.:
91 (90.62), 77 (12.01), 75 (59.19), 69 (24.22), 65
1.11 т (6Н, ОСН2СН3, J 7.1 Гц), 2.70 д (2Н, СН2СН,
(22.37), 47 (47.70), 45 (11.24), 41 (19.13), 39 (13.98),
J 5.8 Гц), 3.42-3.48 м (2Н, OCH2CH3), 3.55-3.61 м
31 (15.24). Найдено, %: С 76.96; Н 9.37. C15H22O2.
(2Н, OCH2CH3), 3.68 уш.с (2Н, CH2Рh), 4.83 т [1Н,
Вычислено, %: С 76.88; Н 9.46.
СН(ОС2Н5)2, J 5.8 Гц], 7.12-7.28 м (5Н, CH2Рh).
4-Этокси-5-метокси-1-фенилпентан-2-он
Спектр ЯМР 13С, δ, м.д.: 15.3 (2С), 46.8, 51.2 (2С),
(17). Через охлажденный до -78°С раствор 0.94 г
62.5, 100.1, 127.1, 128.7 (2С), 129.6 (2С), 133.8,
(4 ммоль) соединения 16 в 30 мл CH2Cl2 пропуска-
205.3. Масс-спектр, m/z (Iотн, %): 145 (11.25), 119
ли О3/О2 смесь в течение 1 ч до появления устой-
(7.59), 103 (21.53), 99 (100.00), 92 (7.20), 91 (70.94),
чивого синего окрашивания, после чего пропуска-
89 (11.60), 75 (13.94), 71 (88.94), 65 (20.22), 47
ли через смесь кислород для удаления избытка О3.
(9.41), 43 (12.14), 31 (8.26). Найдено, %: С 71.27;
Далее порциями при интенсивном перемешива-
Н 8.46. C14H20O3. Вычислено, %: С 71.16; Н 8.53.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
943
Схема 8
CHO
ɩɢɩɟɪɢɞɢɧ
O
OR1
5 ɦɨɥ %
R2
OH
R2
+
EtOH, 20°C, 12 ɱ
O O
O O
35, 36, 40, 44-46
47
48-51
45
ɩɢɩɟɪɢɞɢɧ
5 ɦɨɥ %
EtOH, 20°C, 12 ɱ
O OAc
C5H11
ɨɠɢɞɚɟɦɵɣ ɩɪɨɞɭɤɬ
O O
52
R1 = Et, R2 = i-Pr (35); R1 = Et, R2 = Ph (36); R1 = Et, R2 = CH2CO2Et (40); R1 = Me, R2 = C5H11(OH)CH (44);
Ph
R1 = Me, R2 = C5H11(OAc)CH (45); R1 = Me, R2 =
(46).
OTBS
Ph
R2 = i-Pr (48), 95%; R2 = Ph (49), 92%; R2 = CH2CO2Et (50), 96%; R2 =
(51), 90%;
OTBS
3-Бензил-5-этокси-4,5-дигидроизоксазол
раствором аммиака, продукт реакции из водного
(18). Раствор 0.23 г (1 ммоль) ацеталя 17, 0.08 г
слоя экстрагировали ЕtОАс (3×10 мл), объеди-
(1.2 ммоль) солянокислого гидроксиламина, 0.10 г
ненные органические вытяжки сушили Na2SO4.
(1.2 ммоль) ацетата натрия в 5 мл ЕtОН кипятили
После удаления растворителя при пониженном
8 ч. После обрабатывали 45 мл насыщенного во-
давлении продукт выделяли хроматографически
дного раствора NH4Cl, продукт из водного слоя
(элюент - смесь петролейного эфира и EtOAc,
экстрагировали Et2O (3×20 мл) и объединенные
80:1). Выход 0.07 г (86%). ИК спектр, ν, см-1:
вытяжки сушили Na2SO4. После удаления раство-
1563 ср (С=N), 1416 ср (С=N), 1074 с (С-О), 1051
рителя при пониженном давлении продукт выде-
ср (С-О). Спектр ЯМР 1H, δ, м.д.: 4.06 уш.с (2Н,
ляли хроматографически (элюент - смесь петро-
CH2Рh), 6.11 уш.с (1Н, CH=CHO), 7.24-7.36 м (5Н,
лейного эфира и EtOAc, 80:1). Выход 0.19 г (91%).
CH2Рh), 8.30 уш.с (1Н, CH=CHO). Спектр ЯМР
Спектр ЯМР 1H, δ, м.д.: 1.12 т (3Н, ОСН2СН3, J
13С, δ, м.д.: 32.1, 104.3, 126.9 (3С), 128.7, 128.8,
7.1 Гц), 2.58 д.д (1Н, CH2CHO, J1 17.6, J2 1.6 Гц),
137.1, 158.4, 161.9. Масс-спектр, m/z (Iотн, %): 159
2.82 д.д (1Н, CH2CHO, J1 17.6, J2 6.7 Гц), 3.43-3.49
(41.45) [М]+, 158 (9.86), 131 (8.27), 130 (37.20), 92
м (1Н, OCH2CH3), 3.62 д (1Н, CH2Рh, J 15.1 Гц),
(8.39), 91 (100.00), 89 (8.25), 77 (8.23), 65 (18.36),
3.72 д (1Н, CH2Рh, J 15.1 Гц), 3.75-3.81 м (1Н,
51 (8.60). Найдено, %: С 75.56; Н 5.60. C10H9NО.
OCH2CH3), 5.40 д.д (1Н, CH2CHO, J1 6.7, J2
Вычислено, %: С 75.45; Н 5.70.
1.6 Гц), 7.14-7.28 м (5Н, CH2Рh). C12H15O2.
4,4-Диэтокси-1-фенилбутан-2-она
(2,4-ди-
3-Бензилизоксазол (19). К раствору 0.10 г
нитрофенил)гидразин (21). К раствору 0.10 г
(0.5 ммоль) соединения 18 в 3 мл ЕtОН добавля-
(0.5 ммоль) соединения 17 в 3 мл ЕtОН добавляли
ли 0.15 мл ледяной уксусной кислоты и кипятили
0.15 г (0.75 ммоль) (2,4-динитрофенил)гидрази-
6 ч. Кислоту нейтрализовали 10%-ным водным
на, 0.15 мл ледяной уксусной кислоты и кипятили
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
944
МИНЕЕВА и др.
8 ч. Кислоту нейтрализовали 10%-ным водным
теля при пониженном давлении продукт выделяли
раствором аммиака, продукт реакции из водного
хроматографически (элюент - смесь петролейно-
слоя экстрагировали ЕtОАс (3×10 мл), объеди-
го эфира и EtOAc, 20:1). Выход 0.09 г (97%). ИК
ненные органические вытяжки сушили Na2SO4.
спектр, ν, см-1: 1563 ср (С=N), 1416 ср (С=N), 1074
После удаления растворителя при пониженном
с (С-О), 1051 ср (С-О). Спектр ЯМР 1H, δ, м.д.:
давлении продукт выделяли хроматографически
4.06 уш.с (2Н, CH2Рh), 6.10 уш.с (1Н, СН=СНN),
(элюент - смесь петролейного эфира и EtOAc,
7.22-7.34 м (5Н, CH2Рh), 7.45 уш.с (1Н, СН=СНN),
20:1). Выход 0.17 г (83%). Спектр ЯМР 1H, δ, м.д.:
9.9 уш.с (1Н, NН). Спектр ЯМР 13С, δ, м.д.: 33.3,
1.16 т (6Н, ОСН2СН3, J 7.1 Гц), 2.71 д (2Н, СН2СН,
104.3, 126.4, 128.5 (2С), 128.6 (2С), 133.6, 139.0,
J 5.1 Гц), 3.47-3.53 м (2Н, OCH2CH3), 3.62-3.68 м
147.6. Масс-спектр, m/z (Iотн, %): 159 (11.41) [М +
(2Н, OCH2CH3), 3.79 уш.с (2Н, CH2Рh), 4.40 т [1Н,
Н]+, 158 (100.00) [М]+, 157 (52.59), 130 (45.81), 128
СН(ОС2Н5)2, J 5.1 Гц], 7.26-7.36 м (5Н, CH2Рh),
(9.89), 103 (9.23), 91 (10.05), 81 (15.72), 77 (9.82),
7.97 д (1Н, СНСNН, J 9.6 Гц), 8.29 д.д.д (1Н,
65 (8.18), 51 (9.13). Найдено, %: С 76.01; Н 6.29.
СН=СНСНNО2, J1 9.6, J2 2.6, J3 0.6 Гц), 9.13 д (1Н,
C10H10N2. Вычислено, %: С 75.92; Н 6.37.
СНСNО2, J 2.6 Гц), 11.71 уш.с (1Н, NН). Спектр
4,4-Диэтокси-1-фенилбутан-2-она фенилги-
ЯМР 13С, δ, м.д.: 15.1 (2С), 35.7, 45.5, 62.6 (2С),
дразон (26). Раствор 0.23 г (1 ммоль) ацеталя 17,
100.6, 116.6, 123.5, 127.2, 128.8 (2С), 129.2 (2С),
0.19 г (1.3 ммоль) солянокислого фенилгидразина,
129.3, 129.6, 136.3, 137.5, 145.6, 157.5. C20H24N4O6.
0.11 г (1.3 ммоль) ацетата натрия в 7 мл ЕtОН кипя-
3-Бензил-1-(2,4-динитрофенил)-1H-пиразол
тили 8 ч. После обрабатывали 40 мл насыщенного
(22). К раствору 0.25 г (0.6 ммоль) соединения 21
водного раствора NH4Cl, продукт из водного слоя
в 4 мл ЕtОН добавляли 0.10 мл концентрирован-
экстрагировали ЕtОАс (3×10 мл) и объединенные
ной НСl и кипятили 6 ч. Кислоту нейтрализовали
вытяжки сушили Na2SO4. После удаления раство-
10%-ным водным раствором аммиака, продукт
рителя при пониженном давлении продукт выде-
реакции из водного слоя экстрагировали ЕtОАс
ляли хроматографически (элюент - смесь петро-
(3×10 мл), объединенные органические вытяжки
лейного эфира и EtOAc, 80:1). Выход 0.29 г (88%).
сушили Na2SO4. После удаления растворителя при
Спектр ЯМР 1H, δ, м.д.: 1.13 т (6Н, ОСН2СН3, J
пониженном давлении продукт выделяли хромато-
7.1 Гц), 2.71 д (2Н, СН2СН, J 5.5 Гц), 3.43-3.49
графически (элюент - смесь петролейного эфира
м (2Н, OCH2CH3), 3.54-3.60 м (2Н, OCH2CH3),
и EtOAc, 40:1). Выход 0.15 г (79%). ИК спектр, ν,
3.69 уш.с (2Н, CH2Рh), 4.84 т [1Н, СН(ОС2Н5)2, J
см-1: 1563 ср (С=N), 1416 ср (С=N), 1074 с (С-О),
5.8 Гц], 7.13-7.31 м (5Н, CH2Рh), 7.37-7.63 м (5Н,
1051 ср (С-О). Спектр ЯМР 1H, δ, м.д.: 4.02 уш.с
NРh), 7.76 уш.с (1Н, NН).
(2Н, CH2Рh), 6.30 уш.с (1Н, СН=СНN), 7.22-7.33 м
3-Бензил-1-фенил-1H-пиразол (27). К раство-
(5Н, CH2Рh), 7.68 уш.с (1Н, СН=СНN), 7.81 д (1Н,
ру 0.23 г (0.7 ммоль) соединения 26 в 4 мл ЕtОН
СНСNН, J 8.7 Гц), 8.48 д.д.д (1Н, СН=СНСНNО2,
добавляли 0.1 мл ледяной уксусной кислоты и
J1 8.7, J2 2.6, J3 2.2 Гц), 8.66 уш.с (1Н, СНСNО2).
кипятили 8 ч. Кислоту нейтрализовали 10%-ным
Спектр ЯМР 13С, δ, м.д.: 34.6, 109.8, 121.1, 125.1,
водным раствором аммиака, продукт реакции из
126.5, 127.3, 128.6 (2С), 128.8 (2С), 130.2, 137.3,
водного слоя экстрагировали ЕtОАс (3×10 мл),
138.4, 142.6, 145.0, 157.0. Найдено, %: С 59.37; Н
объединенные органические вытяжки сушили
3.62. C16H12N4O3. Вычислено, %: С 59.26; Н 3.73.
Na2SO4. После удаления растворителя при по-
3-Бензил-1H-пиразол (24). К раствору 0.14 г
ниженном давлении продукт выделяли хромато-
(0.6 ммоль) соединения 17 в 3 мл ЕtОН добавляли
графически (элюент - смесь петролейного эфира
0.26 г (0.8 ммоль) гидразина, 0.1 мл ледяной ук-
и EtOAc, 20:1). Выход 0.15 г (90%). ИК спектр,
сусной кислоты и кипятили 8 ч. Кислоту нейтра-
ν, см-1: 1599 ср (С-N), 1527 ср (С-N), 1495 ср
лизовали 10%-ным водным раствором аммиака,
(С-N), 1384 ср (С-N), 1074 с (С-О), 1004 ср (С-О).
продукт реакции из водного слоя экстрагировали
Спектр ЯМР 1H, δ, м.д.: 4.04 уш.с (2Н, CH2Рh),
ЕtОАс (3×10 мл), объединенные органические вы-
6.13 уш.с (1Н, СН=СНN), 7.15-7.27 м (5Н, CH2Рh),
тяжки сушили Na2SO4. После удаления раствори-
7.36-7.40 м (3Н, NРh), 7.61-7.63 м (2Н, NРh), 7.76
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
945
уш.с (1Н, СН=СНN). Спектр ЯМР 13С, δ, м.д.: 34.8,
4.90 т [1Н, (CH3CH2О)2СН, J 5.6 Гц]. Спектр ЯМР
107.0, 119.0, 126.0 (2С), 126.2 (2С). 127.5, 128.4
13С, δ, м.д.: 14.0, 15.2 (2С), 22.6, 25.1, 31.7, 36.4,
(2С), 128.8 (2С), 129.3, 139.7, 140.2, 153.8. Масс-
48.1, 50.7, 62.4 (2С), 67.6, 99.8, 207.0. Найдено,
спектр, m/z (Iотн, %): 235 (17.40) [М + Н]+, 234
%: С 64.62; Н 10.79. C14H28О4. Вычислено, %: С
(100.00) [М]+, 233 (35.69), 206 (9.06), 157 (25.40),
64.58; Н 10.84.
131 (13.00), 130 (31.52), 117 (10.48), 104 (8.63), 103
2-Пентил-2,3-дигидро-4H-пиран-4-он (32). К
(7.05), 91 (20.99), 89 (8.48), 77 (31.87), 65 (11.52),
раствору 0.31 г (1.2 ммоль) соединения 31 в 10 мл
51 (12.82). Найдено, %: С 82.14; Н 5.92. C16H14N2.
ТГФ добавляли 0.10 мл конц. НСl и кипятили 4 ч.
Вычислено, %: С 82.02; Н 6.02.
Кислоту нейтрализовали 10%-ным водным рас-
2-(2,2-Диэтоксиэтил)нон-1-ен-4-ол
(30).
К
твором аммиака, продукт реакции из водного слоя
смеси 1.82 г (7.7 ммоль) замещенного аллилбро-
экстрагировали ЕtОАс (3×10 мл), объединенные
мида 10 в 5 мл ТГФ и 0.77 г (7.7 ммоль) альдегида
органические вытяжки сушили Na2SO4. После
29 добавляли 0.55 г (8.5 ммоль) цинкового порош-
удаления растворителя при пониженном давлении
ка, несколько капель дибромэтана и кипятили при
продукт выделяли хроматографически (элюент -
перемешивании в течение 30 мин. После обработ-
смесь петролейного эфира и EtOAc, 40:1). Выход
ки 40 мл насыщенного водного раствора NH4Cl ор-
0.15 г (72%). ИК спектр, ν, см-1: 1597 с (С=О), 1261
ганический слой отделяли, продукт реакции из во-
с (С-О), 1232 с (С-О), 1203 с (С-О), 1094 с (С-О),
дного слоя экстрагировали Et2O (3×15 мл) и объе-
1040 с (С-О). Спектр ЯМР 1H, δ, м.д.: 0.90 т [3Н,
диненные органические вытяжки сушили Na2SO4.
(СН2)4СН3, J 6.7 Гц], 1.25-1.53 м [6Н, (СН2)3СН3],
После удаления растворителя при пониженном
1.61-1.87 м [2Н, CH2(СН2)3СН3], 2.42 д.д (1Н,
СН2С=О, J1 16.6, J2 4.1 Гц), 2.51 д.д (1Н, СН2С=О,
давлении продукт выделяли хроматографически
(элюент - смесь петролейного эфира и EtOAc,
J1 16.6, J2 13.3 Гц), 4.34-4.43 м (1Н, СН2СНО),
5.39 д.д (1Н, СНС=О, J1 5.9, J2 1.0 Гц), 7.36 д (1Н,
20:1). Выход 1.42 г (79%). ИК спектр, ν, см-1: 3353
=СНО, J 6.7 Гц). Спектр ЯМР 13С, δ, м.д.: 14.0,
ср (ОН), 1181 с (С-О), 1071 с (С-О). Спектр ЯМР
22.5, 24.4, 31.5, 34.3, 41.8, 79.6, 106.9, 163.3, 191.0.
1H, δ, м.д.: 0.89 т [3Н, (СН2)4СН3, J 6.7 Гц], 1.20
Найдено, %: С 71.44; Н 9.53. C10H16О2. Вычислено,
т [6Н, (CH3CH2О)2СН, J 7.2 Гц], 1.24-1.66 м [8Н,
%: С 71.39; Н 9.59.
(СН2)4СН3], 2.08 д.д (1Н, СН2СНОН, J1 13.8, J2
9.5 Гц), 2.21-2.44 м (3Н, СН2СНОН, СНCH2С=),
Этил-3-изобутилбут-3-еноат
(33). Получен
2.27 уш.с (ОН), 3.46-3.57 м (2Н, CH3CH2О),
аналогично соединению 16, применяли 2.07 г
3.63-3.77 м (3Н, CH3CH2О, СНОН), 4.64 т [1Н,
(10 ммоль) аллилбромида 11b, применяли 0.19 г
(CH3CH2О)2СН, J 5.9 Гц], 4.96 с (1H, СН2=), 4.99
(1 ммоль) СuI, 20 мл 1 М раствор изо-пропил-
с (1H, CH2=). Спектр ЯМР 13С, δ, м.д.: 14.0, 15.2
магний бромида в ТГФ. Выход 1.63 г (96%). ИК
(2С), 22.6, 25.8, 31.9, 37.1, 39.8, 45.4, 61.2, 61.5,
спектр, ν, см-1: 1733 о.с (С=О), 1150 о.с (С-О),
69.1, 102.4, 115.4, 142.6. Найдено, %: С 69.81; Н
1107 о.с (С-О), 1033 ср (С-О). Спектр ЯМР 1H, δ,
11.02. C15H30О3. Вычислено, %: С 69.72; Н 11.07.
м.д.: 0.86 с [3Н, СН(СН3)2], 0.88 с [3Н, СН(СН3)2],
1.25 т (3Н, ОСН2СН3, J 7.1 Гц), 1.72-1.80 м [3Н,
1,1-Диэтокси-5-гидроксидекан-3-он (31). По-
СН(СН3)2], 1.96 д (2Н, СНСН2С=, J 7.4 Гц), 2.99
лучен аналогично кетону 17 из 1.04 г (4 ммоль)
уш.с (2Н, CH2CО2), 4.13 к (2Н, OCH2CH3, J 7.1 Гц),
спирта 30. Выход 0.88 г (85%). ИК спектр, ν, см-1:
4.89 уш.с (1Н, СН2=), 4.91 уш.с (1Н, СН2=). Спектр
3453 ср (ОН), 1714 с (С=О), 1377 ср (С-О), 1261
ЯМР 13С, δ, м.д.: 14.1, 22.3 (2С), 25.8, 41.7, 45.7,
с (С-О), 1121 с (С-О), 1061 с (C-О). Спектр ЯМР
60.5, 114.7, 141.4, 171.5. Масс-спектр, m/z (Iотн,
1H, δ, м.д.: 0.88 т [3Н, (СН2)4СН3, J 6.7 Гц], 1.19
%): 109 (5.94), 59 (12.95), 55 (5.85), 44 (43.67), 43
т [6Н, (CH3CH2О)2СН, J 6.9 Гц], 1.23-1.62 м [8Н,
(10.31), 41 (11.51), 40 (25.55), 39 (5.12), 32 (100.00),
(СН2)4СН3], 2.55 д.д (1Н, СН2СНОН, J1 17.4, J2
31 (5.81). Найдено, %: С 70.63; Н 10.57. C10H18О2.
9.2 Гц), 2.66 д.д (1Н, СН2СНОН, J1 17.4, J2 2.8 Гц),
Вычислено, %: С 70.55; Н 10.66.
2.76 д.д (2Н, СНСН2С=О, J1 5.6, J2 1.5 Гц), 3.00
уш.с (1Н, ОН), 3.47-3.56 м (2Н, CH3CH2О), 3.62-
Этил-3-бензилбут-3-еноат
(34).
Получен
3.71 м (2Н, CH3CH2О), 3.99-4.08 м (1Н, СНОН),
аналогично соединению 16, применяли
2.07 г
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
946
МИНЕЕВА и др.
(10 ммоль) аллилбромида 11b, применяли 0.19 г
дного слоя экстрагировали ЕtОАс (3×10 мл), объе-
(1 ммоль) СuI, 20 мл 1 М раствор фенилмагний
диненные органические вытяжки сушили Na2SO4.
бромида в ТГФ. Выход 1.98 г (97%). ИК спектр,
После удаления растворителя при пониженном
ν, см-1: 1732 с (С=О), 1244 с (С-О), 1153 с (С-О),
давлении продукт выделяли хроматографически
1031 с (С-О). Спектр ЯМР 1H, δ, м.д.: 1.26 т (3Н,
(элюент - смесь петролейного эфира и EtOAc,
ОСН2СН3, J 7.1 Гц), 2.98 уш.с (2Н, CH2CО2), 3.46
40:1). Выход 5.03 г (88%). ИК спектр, ν, см-1:
уш.с (2Н, СН2Рh), 4.12 к (2Н, OCH2CH3, J 7.1 Гц),
1729 с (С=О), 1146 с (С-О), 1032 с (С-О). Спектр
4.95 уш.с (1Н, СН2=), 5.00 уш.с (1Н, СН2=), 7.19-
ЯМР 1H, δ, м.д.: 1.19-1.24 м (9Н, ОСН2СН3), 2.69
7.32 м (5Н, CH2Рh). Спектр ЯМР 13С, δ, м.д.: 14.1,
д [2Н, СН2СН(СО2Еt)2, J 7.8 Гц], 3.03 уш.с (2Н,
41.1, 42.7, 60.6. 115.6, 126.3, 128.3 (2С), 129.1 (2С),
CH2CО2), 3.58 т [1Н, СН2СН(СО2Еt)2, J 7.8 Гц],
138.7, 141.9, 171.3. Масс-спектр, m/z (Iотн, %): 205
4.08-4.12 м (2Н, OCH2CH3), 4.12-4.17 м (4Н,
(6.14) [М + Н]+, 204 (42.77) [М]+, 159 (16.43), 158
ОСН2СН3), 4.93 уш.с (1Н, СН2=), 4.94 уш.с (1Н,
(31.48), 132 (11.30), 131 (100.00), 130 (29.49), 129
СН2=). Спектр ЯМР 13С, δ, м.д.: 13.9 (2С), 14.0,
(41.41), 128 (13.48), 117 (11.52), 116 (22.34), 115
34.5, 41.8, 50.3, 60.6, 61.4 (2 С), 115.9, 138.6, 168.7
(33.13), 91 (62.22), 77 (6.21), 65 (15.59), 39 (6.33).
(2С), 170.8. Масс-спектр, m/z (Iотн, %): 240 (29.59),
Найдено, %: С 76.55; Н 7.81. C13H16О2. Вычислено,
195 (45.61), 194 (94.26). 167 (76.52), 139 (79.38),
%: С 76.44; Н 7.90.
122 (68.32), 121 (84.68), 67 (83.33), 55 (68.63), 45
(45.14), 44 (86.34), 43 (70.25), 39 (48.65). 32 (89.36),
Этил-5-метил-3-оксогексаноат (35). Получен
31 (100.00). Найдено, %: С 58.81; Н 7.68. C14H22О6.
аналогично кетону 17 из 0.68 г (4 моль) эфира 33.
Вычислено, %: С 58.73; Н 7.74.
Выход 0.62 г (90%). Полученные спектры ЯМР
совпали с приведенными в литературе [36]. ИК
Диэтил-3-метиленгександиоат (39). К раство-
спектр, ν, см-1: 1742 с (С=О), 1715 с (С=О), 1234
ру 5.15 г (18 ммоль) эфира 38 в 30 мл ДМСО добав-
с (С-О), 1152 с (С-О), 1030 с (С-О). Масс-спектр,
ляли 0.4 мл воды и 0.85 г (20 ммоль) LiСl и кипя-
m/z (Iотн, %): 264 (35.00), 250 (18.76), 249 (100.00),
тили 5 ч. После обработки водой (50 мл) продукт
221 (17.70), 207 (14.26), 165 (39.96), 151 (24.34),
реакции из водного слоя экстрагировали гексаном
124 (16.65), 123 (19.15), 109 (24.07), 95 (13.44),
(3×20 мл), объединенные органические вытяжки
91 (14.16), 81 (17.68), 79 (13.88), 69 (11.63), 67
сушили Na2SO4. После удаления растворителя при
(11.81), 57 (12.43), 55 (17.37), 43 (28.29), 41 (30.94),
пониженном давлении продукт выделяли хромато-
32 (16.24). Найдено, %: С 62.81; Н 9.31. C9H16О3.
графически (элюент - смесь петролейного эфира
Вычислено, %: С 62.77; Н 9.36.
и EtOAc, 40:1). Выход 2.85 г (74%). ИК спектр, ν,
Этил-3-оксо-4-фенилбутаноат (36). Получен
см-1: 1730 с (С=О), 1147 с (С-О), 1033 с (С-О).
аналогично кетону 17 из 0.82 г (4 моль) эфира 34.
Спектр ЯМР 1H, δ, м.д.: 1.26 т (3Н, ОСН2СН3, J
Выход 0.76 г (92%). Полученные спектры ЯМР
7.1 Гц), 1.27 т (3Н, ОСН2СН3, J 7.1 Гц), 2.41-2.51 м
совпали с приведенными в литературе [37]. ИК
(4Н, СН2СН2СО2Еt), 3.07 уш.с (2Н, =ССН2СО2Еt),
спектр, ν, см-1: 1714 с (С=О), 1203 с (С-О), 1155
4.12-4.18 м (4Н, ОСН2СН3), 4.94 уш.с (1Н, СН2=),
с (С-О), 1096 с (С-О), 1026 с (С-О). Масс-спектр,
4.95 уш.с (1Н, СН2=). Спектр ЯМР 13С, δ, м.д.: 14.2
m/z (Iотн, %): 206 (3.23) [М]+, 192 (19.11), 119 (8.57),
(2С), 30.7, 32.4, 42.2, 60.4, 60.7, 114.1, 140.9, 171.1,
118 (33.47), 101 (27.51), 92 (24.52), 91 (100.00), 89
172.9. Масс-спектр, m/z (Iотн, %):
169
(67.94),
(8.61), 69 (9.47), 65 (21.96), 59 (18.13), 44 (12.56), 43
168 (65.98), 141 (30.47), 122 (57.43), 112 (51.36),
(14.24), 39 (7.68), 32 (20.72). Найдено, %: С 62.83;
95 (54.29), 71 (42.24), 69 (45.54), 68 (55.89), 67
Н 9.29. C9H16О3. Вычислено, %: С 62.77; Н 9.36.
(100.00), 55 (46.36), 53 (39.85), 43 (58.15),
41
(70.92), 39 (59.22). Найдено, %: С 61.74; Н 8.39.
Триэтил-3-метиленбутан-1,1,4-трикарбокси-
C11H18О4. Вычислено, %: С 61.66; Н 8.47.
лат (38). К раствору 3.2 г (20 ммоль) малоново-
го эфира (37) и 4.97 г (24 ммоль) аллилбромида
Диэтил-3-оксогександиоат (40). После охлаж-
11а в 25 мл ацетона добавляли 3.31 г (24 ммоль)
дения до -78°С через раствор 3.85 г (18 ммоль)
К2СО3 и кипятили при перемешивании 8 ч. После
эфира 39 в 100 мл CH2Cl2 пропускали О3/О2 смесь
обработки водой (50 мл) продукт реакции из во-
в течение 1 ч до появления устойчивого синего
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
947
окрашивания, после чего пропускали через смесь
раствора NаHCО3 органический слой отделяли,
кислород для удаления избытка О3. Далее порци-
продукт реакции из водного слоя экстрагировали
ями при интенсивном перемешивании вносили
CH2Cl2 (3×10 мл) и объединенные органические
4.48 г (38.0 ммоль) PPh3 и нагревали до комнат-
вытяжки сушили Na2SO4. После удаления раство-
ной температуры в течение 3 ч. После удаления
рителя при пониженном давлении остаток раство-
растворителя при пониженном давлении продукт
ряли в 50 мл CH2Cl2, реакционную смесь охлаж-
выделяли хроматографически (элюент - смесь пе-
дали до -78°С и пропускали О3/О2 смесь в течение
тролейного эфира и EtOAc, 100:1). Выход 3.50 г
30 мин до появления устойчивого синего окраши-
(90%). Полученные спектральные характеристи-
вания, после чего пропускали через смесь кис-
ки совпали с приведенными в литературе [38].
лород для удаления избытка О3. Далее порциями
Альтернативно вещество можно синтезировать по
при интенсивном перемешивании вносили 2.36 г
методике [39].
(38.0 ммоль) PPh3 и нагревали до комнатной тем-
пературы в течение 1 ч. После удаления раство-
Эфиры 42, 43 (общая методика). К смеси
рителя при пониженном давлении продукт выде-
2.43 г (12.6 ммоль) аллилбромида 11b и 1.2 г
ляли хроматографически (элюент - смесь петро-
(12 ммоль) гексаналя (29) или 1.27 г (12 ммоль)
лейного эфира и EtOAc, 100:1). Спектр ЯМР 1H,
бензальдегида (41), 2.60 г (40 ммоль) цинкового
δ, м.д.: 0.87 т [3Н, (СН2)4СН3, J 7.1 Гц], 1.21-1.58
порошка в 30 мл ТГФ при интенсивном перемеши-
м [8Н, (СН2)4СН3], 2.00 уш.с (3Н, CH3С=О), 2.75
вании добавляли по каплям 10 мл насыщенного во-
д.д (1Н, СН2СO2, J1 16.7, J2 5.5 Гц), 2.81 д.д (1Н,
дного раствора NH4Cl. После окончания реакции
СН2СO2, J1 16.7, J2 7.1 Гц), 3.45 д (1Н, СН2СO, J
(контроль по ТСХ) органический слой отделяли,
15.7 Гц), 3.49 д (1Н, СН2СO, J 15.7 Гц), 3.73 уш.с
продукт реакции из водного слоя экстрагировали
(3Н, CH3О), 5.19-5.24 м (1Н, СНОС=О). C13H22О5.
Et2O (3×15 мл) и объединенные органические вы-
тяжки сушили Na2SO4. После удаления раствори-
Метил-5-[(трет-бутилдиметилсилил)окси]-
теля при пониженном давлении продукт выделяли
3-оксо-5-фенилпентаноат (46). К охлажденно-
хроматографически (элюент - смесь петролейного
му до 0°С раствору 0.51 г (2.3 ммоль) эфира 43 в
эфира и EtOAc, 35:1).
5 мл CH2Cl2 добавляли 0.3 г (4.6 ммоль) имидазо-
ла, 0.4 г (2.7 ммоль) трет-бутилдиметилсилилхло-
Метил-3-(2-гидроксигептил)бут-3-еноат (42).
рида (TBSCl). После окончания реакции (контроль
Выход 2.29 г (89%). C12H22О3. Полученные спек-
по ТСХ) реакционную смесь обрабатывали 10 мл
тральные характеристики совпали с приведенны-
насыщенного водного раствора NаHCО3, органи-
ми в литературе [40].
ческий слой отделяли, продукт реакции из водного
Метил-3-(2-гидрокси-2-фенилэтил)бут-2-
слоя экстрагировали CH2Cl2 (3×50 мл), объединен-
еноат (43). Выход 2.09 г (79%). C13H16О3. По-
ные органические вытяжки сушили Na2SO4. После
лученные спектральные характеристики совпали с
удаления растворителя при пониженном давлении
приведенными в литературе [12].
продукт выделяли хроматографически (элюент -
Метил-5-гидрокси-3-оксодеканоат (44). По-
смесь петролейного эфира и EtOAc, 100:1). Выход
лучен аналогично кетону 17 из 0.86 г (4 моль) эфи-
промежуточного эфира 0.71 г (92%). Спектр ЯМР
ра 42. Выход 0.75 г (87%). C11H20О4. Полученные
1Н, δ, м.д.: -0.13 с (3Н, СН3Si), 0.06 с (3Н, СН3Si),
спектры ЯМР совпали с приведенными в литрату-
0.91 с [9Н, (СН3)3СSi], 2.48 д.д (1Н, СН2=ССН2,
ре [40].
J
13.8, J2 7.7 Гц), 2.55 д.д (1Н, СН2=ССН2, J1
1
13.8, J2 7.7 Гц), 3.1 уш.с (2Н, СН2С=СН2), 3.72 с
Метил-5-(ацетокси)-3-оксодеканоат
(45). К
(3Н, СН3О), 4.80-4.84 м (1Н, СНОTBS), 4.95 уш.с
раствору 2.16 г (10 ммоль) эфира 42 в 20 мл CH2Cl2
(1Н, =СН), 5.00 уш.с (1Н, =СН), 7.33 м (5Н, Ph).
при охлаждении до 0°С при интенсивном переме-
C19H30О3Si.
шивании добавляли 1.20 г (15 ммоль) пиридина
и по каплям 0.94 г (12 ммоль) АсСl. После окон-
Через раствор 0.48 г (1.4 ммоль) промежуточ-
чания реакции (контроль по ТСХ) реакционную
ного эфира в 10 мл CH2Cl2 при -78°С пропускали
смесь обрабатывали 40 мл насыщенного водного
O3/O2 смесь в течение 20 мин до появления устой-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
948
МИНЕЕВА и др.
чивого синего окрашивания, после чего пропуска-
с (С-О), 1178 с (С-О). Спектр ЯМР 1H, δ, м.д.: 4.47
ли через смесь кислород для удаления избытка
уш.с (2Н, СН2С=О), 7.16-7.26 м (5Н, CH2Рh), 7.35
озона. Порциями при интенсивном перемешива-
д (1Н, Рh, J 9.0 Гц), 7.49-7.52 м (1Н, Рh), 7.62-7.65
нии вносили 0.57 г (2.2 ммоль) Ph3P и нагревали
м (1Н, Рh), 7.80 д (1Н, Рh, J 8.4 Гц), 7.97 д (1Н,
смесь до комнатной температуры. После удаления
Рh, J 9.0 Гц), 8.19 д (1Н, Рh, J 8.4 Гц), 9.17 уш.с
растворителя при пониженном давлении продукт
(1Н, СН=СС=О). Спектр ЯМР 13С, δ, м.д.: 48.5,
выделяли хроматографически (элюент - смесь пе-
112.8, 116.4, 121.8, 122.3, 126.6, 127.1, 128.5 (2С),
тролейного эфира и EtOAc, 100:1). Выход проме-
129.2 (2С), 129.7, 129.9 (2С), 130.1, 134.0, 136.0,
жуточного эфира 0.41 г (88%). Спектр ЯМР 1Н, δ,
143.7, 156.0, 159.3, 195.5. Масс-спектр, m/z (Iотн,
м.д.: -0.14 с (3Н, СН3Si), 0.06 с (3Н, СН3Si), 0.89
%): 281 (5.90), 239 (11.24), 238 (65.11), 224 (14.36),
с [9Н, (СН3)3СSi], 2.71 д.д (1Н, СН2СНOTBS, J1
223 (100.00), 210 (6.55), 208 (5.25), 207 (28.52), 195
15.2, J2 8.8 Гц), 3.07 д.д (1Н, СН2СНOTBS, J1 15.2,
(16.30), 195 (11.75), 168 (10.10), 140 (11.59), 139
J2 8.8 Гц), 3.51 с (2Н, ССН2С), 3.76 с (3Н, СН3О),
(66.06), 43 (5.25), 32 (14.02). Найдено, %: С 80.30;
5.22 т (1Н, СН2СНOTBS, J 8.8 Гц), 7.36-7.46 м
Н 4.41. C21H14О3. Вычислено, %: С 80.24; Н 4.49.
(5Н, Ph). C18H28О4Si.
Этил-4-оксо-4-(3-оксо-3H-бензо[f]хромен-2-
Мультикомпонентная реакция получения
ил)бутаноат (50). Выход 0.62 г (96%), т.пл. 141-
бензокумаринов
48-51 (общая методика). К
142°С. ИК спектр, ν, см-1: 1729 с (С=О), 1703 с
раствору 0.34 г (2 ммоль) альдегида 47, 0.34 г
(С=О), 1557 с (С=О), 1202 с (С-О), 1159 с (С-О),
(2 ммоль) эфира 35 или 0.41 г (2 ммоль) эфира 36
1135 с (С-О). Спектр ЯМР 1H, δ, м.д.: 1.28 т (3Н,
или 0.43 г (2 ммоль) эфира 40 или 0.43 г (2 ммоль)
ОСН2СН3, J 7.1 Гц), 2.76 т (2Н, CH2СН2СО2, J
эфира 44 или 0.52 г (2 ммоль) эфира 45 или 0.67 г
6.4 Гц), 3.52 т (2Н, CH2СН2СО2, J 6.4 Гц), 4.18 к
(2 ммоль) эфира 46 в 4 мл ЕtОН добавляли 0.08 г
(2Н, OCH2CH3, J 7.1 Гц), 7.46 д (1Н, Рh, J 9.0 Гц),
(0.1 ммоль) пиперидина и перемешивали 13 ч при
7.72-7.75 м (1Н, Рh), 7.59-7.62 м (1Н, Рh), 7.92 д
комнатной температуре. После окончания реакции
(1Н, Рh, J 8.0 Гц), 8.09 д (1Н, Рh, J 9.0 Гц), 8.32 д
полученный осадок отфильтровывали, промывали
(1Н, Рh, J 8.4 Гц), 9.31 уш.с (1Н, СН=СС=О). Спектр
ЕtОН (2 мл) и сушили на воздухе.
ЯМР 13С, δ, м.д.: 14.2, 28.4, 37.6, 60.6, 112.8, 116.4,
121.6, 122.0, 126.6, 129.2 (2С), 129.8, 130.2, 136.3,
2-(3-Метилбутаноил)-3H-бензо[f]хромен-3-
он (48). Выход 0.53 г (95%), т.пл. 114-116°С. ИК
143.1, 156.1, 159.2, 172.8, 196.1. Масс-спектр, m/z
спектр, ν, см-1: 1725 о.с (С=О), 1681 с (С=О),
(Iотн, %): 324 (16.36) [М]+, 281 (10.49), 279 (7.88),
1554 с (С-О), 1183 с (С-О). Спектр ЯМР 1H, δ,
278 (12.71), 253 (6.19), 252 (5.90), 251 (27.74), 224
м.д.: 1.01 с [3Н, СН(СН3)2], 1.02 с [3Н, СН(СН3)2],
(15.98), 223 (100.00), 208 (8.49), 207 (41.01), 140
2.26-2.34 м [3Н, СН(СН3)2], 3.10 д (2Н, СН2С=О,
(5.89), 139 (39.68), 73 (5.75), 55 (5.26). Найдено, %:
J 6.7 Гц), 7.48 д (1Н, Рh, J 6.7 Гц), 7.60-7.63 м (1Н,
С 70.41; Н 4.92. C19H16О5. Вычислено, %: С 70.36;
Рh), 7.74-7.77 м (1Н, Рh), 7.93 д (1Н, Рh, J 8.0 Гц),
Н 4.97.
8.10 д (1Н, Рh, J 9.0 Гц), 8.38 д (1Н, Рh, J 8.7 Гц),
2-(3-{[трет-Бутил(диметил)силил]окси}-
9.31 уш.с (1Н, СН=СС=О). Спектр ЯМР 13С, δ,
3-фенилпропаноил)-3H-бензо[f]хромен-3-он
м.д.: 22.7 (2С), 24.6, 51.2, 112.9, 116.5, 121.7, 123.0,
(51). Выход
0.82
(90%), т.пл. 159-160°С. ИК
126.6, 129.1, 129.2, 129.9, 130.2, 136.1, 143.2, 156.0,
спектр, ν, см-1: 1736 с (С=О), 1669 с (С=О), 1552 с
159.2, 197.8. Масс-спектр, m/z (Iотн, %): 281 (11.00)
(С=О), 1249 с (С-О), 1079 с (С-О), 1063 с (С-О),
[М + Н]+, 280 (24.71) [М]+, 265 (31.85), 238 (26.21),
1004 с (С-О). Спектр ЯМР 1H, δ, м.д.: -0.18 с (3Н,
224 (16.20), 223 (100.00), 207 (23.15), 197 (6.89),
СН3Si), -0.03 с (3Н, СН3Si), 0.79 с [9Н, (СН3)3СSi],
196 (22.74), 168 (11.72), 151 (6.62), 140 (8.99), 139
3.42 д.д (1Н, СН2СН, J1 16.0, J2 3.5 Гц), 3.70 д.д
(58.28), 41 (6.10). Найдено, %: С 77.21; Н 5.68.
(1Н, СН2СН, J1 16.0, J2 8.7 Гц), 5.38 д.д (1Н, СНО,
C18H16О3. Вычислено, %: С 77.12; Н 5.75.
J
8.70, J2 3.5 Гц), 7.22-7.44 м (5Н, Рh), 7.49 д (1Н,
1
2-(Фенилацетил)-3H-бензо[f]хромен-3-он
Рh, J 9.0 Гц), 7.61-7.64 м (1Н, Рh), 7.75-7.78 м (1Н,
(49). Выход
0.58
(92%), т.пл. 199-200°С. ИК
Рh), 7.94 д (1Н, Рh, J 8.4 Гц), 8.11 д (1Н, Рh, J 9.0 Гц),
спектр, ν, см-1: 1704 о.с (С=О), 1552 с (С=О), 1286
8.36 д (1Н, Рh, J 8.4 Гц), 9.24 уш.с (1Н, СН=СС=О).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
949
Спектр ЯМР 13С, δ, м.д.: -5.2, -4.8, 17.9, 25.7 (3С),
8. Bhavanarushi S., Luo Z.-B., Bharath G., Rani J.V.,
53.1, 71.7, 112.8, 116.5, 121.6, 123.1, 126.1, 126.6
Khan I., Xu Y., Liu B., Xie J. J Heterocycl. Chem.
2020, 57, 751-760. doi 10.1002/jhet.3816
(2С), 127.3, 128.2 (2С), 129.2, 129.8, 130.1, 130.2,
136.1, 143.2, 144.5, 156.0, 159.2, 195.8. Найдено,
9. Fong T.M., Heymsfield S.B. Int. J. Obes. 2009, 33,
%: С 73.40; Н 6.54. C28H30О4Si. Вычислено, %: С
947-955. doi 10.1038/ijo.2009.132
73.33; Н 6.59.
10. Priyanka, Sharma R.K., Katiyar D. Synthesis. 2016, 48,
2303-2322. doi 10.1055/s-0035-1560450
ЗАКЛЮЧЕНИЕ
11. Corsini E., Lucchi L., Binaglia M., Viviani B., Bevilac-
Функционализированные 2-замещенные аллил-
qua C., Monastra G., Marinovich M., Galli C.L. Eur. J.
бромиды были использованы как электрофильные
Pharmacol. 2001, 418, 231-238. doi 10.1016/s0014-
и нуклеофильные участники реакций, создающих
2999(01)00910-4
фрагменты 1,3-дикарбонильных соединений, на
12. Минеева И.В., Кулинкович О.Г. ЖOрХ. 2008, 44,
основе которых реализован синтез новых уникаль-
1277-1282. [Mineeva I.V., Kulinkovich O.G. Russ.
ных гетероциклических соединений, в том числе
J. Org. Chem. 2008, 44, 1261-1266.] doi 10.1134/
содержащих бензо[f]кумариновый фрагмент.
S1070428008090029
13. Минеева И.В., Кулинкович О.Г. ЖOрХ. 2009, 45,
ИНФОРМАЦИЯ ОБ АВТОРАХ
1634-1643. [Mineeva I.V., Kulinkovich O.G. Russ.
Минеева Ирина Владимировна, ORCID: https://
J. Org. Chem. 2009, 45, 1623-1632.] doi 10.1134/
orcid.org/0000-0002-6422-1967
S1070428009110086
КОНФЛИКТ ИНТЕРЕСОВ
14. Ciufolini M.A., Xi N. Chem. Сommun. 1994, 16,
1867-1868. doi 10.1039/C39940001867
Авторы заявляют об отсутствии конфликта ин-
15. Poupardin O., Greck C., Genêt J.-P. Synlett. 1998, 11,
тересов.
1279-1281. doi 10.1055/s-1998-1921
СПИСОК ЛИТЕРАТУРЫ
16. Padwa A., Brodney M.A., Lynch S.M., Rashatasak-
hon P., Wang Q., Zhang H. J. Org. Chem. 2004, 69,
1. Kel’in A.V., Maioli A. Curr. Org. Chem. 2003, 7, 1855-
3735-3745. doi 10.1021/jo049808i
1886. doi 10.1002/chin.200432286
17. Hobuß D., Laschat S., Baro A. Synlett. 2005, 1, 123-
2. Шокова Э.А., Ким Ж.К., Ковалев В.В. ЖОрХ. 2015,
124. doi 10.1055/s-2004-835620
51, 773-847. [Shokova E.A., Kim J.K., Kovalev V.V.
Russ. J. Org. Chem. 2015, 51, 755-830.] doi 10.1134/
18. Padwa A., Wang Q. J. Org. Chem. 2006, 71, 3210-
S1070428015060019
3220. doi 10.1021/jo060238r
3. Bondarenko O.B., Zyk N.V. Chem. Heterocycl. Compd.
19. Lee S., Kim T., Lee B.H., Yoo S., Lee K., Yi K.Y.
2020, 56, 694-702. doi 10.1007/s10593-020-02718-0
Bioorg. Med. Chem. Lett. 2007, 17, 1291-1295. doi
4. Hashimoto H., Imamura K., Haruta J.-I., Wakitani K.
10.1016/j.bmcl.2006.12.012
J. Med. Chem. 2002, 45, 1511-1517. doi 10.1021/
20. Kuwano R., Hashiguchi Y., Ikeda R., Ishizuka K.
jm010484p
Angew. Chem. Int. Ed. 2015, 54, 2393-2396. doi
5. Habeeb A.G., Rao P.N.P., Knaus E.E. J. Med. Chem.
10.1002/anie.201410607
2001, 44, 3039-3042. doi 10.1021/jm010153c
21. He Y., Xie Y.-Y., Wang Y.-C., Bin X.-M., Hu D.-C.,
6. Ranatunge R.R., Earl R.A., Garvey D.S., Janero D.R.,
Wang H.-S., Pan Y.-M. RSC Adv. 2016, 6, 58988-
Letts L.G., Martino A.M., Murty M.G., Richard-
58993. doi 10.1039/C6RA11099A
son S.K., Schwalb D.J., Young D.V., Zemtseva I.S.
22. Yi F., Zhao W., Wang Z., Bi X. Org. Lett. 2019, 21,
Bioorg. Med. Chem. Lett. 2004, 14, 6049-6052. doi
3158-3161. doi 10.1021/acs.orglett.9b00860
10.1016/j.bmcl.2004.09.073
23. Martin R., Rivero M.R., Buchwald S.L. Angew.
7. Sakya S.M., DeMello K.M.L., Minich M.L., Rast B.,
Chem. Int. Ed. 2006, 45, 7079-7082. doi 10.1002/
Shavnya A., Rafka R.J., Koss D.A., Cheng H., Li J.,
anie.200602917
Jaynes B.H., Ziegler C.B., Mann D.W., Petras C.F.,
24. Menozzi G., Mosti L., Schenone P. J. Heterocycl. Chem.
Seibel S.B., Silvia A.M., George D.M., Lund L.A.,
1987, 24, 1669-1675. doi 10.1002/jhet.5570240634
Denis S.St., Hickman A., Michelle L., Haven M.L.,
Lynch M.P. Bioorg. Med. Chem. Lett. 2006, 16, 288-
25. El-Ansary S.L., Abbas S.E., Mikhael A.N., El-Ban-
292. doi 10.1016/j.bmcl.2005.10.006
na H.A. Egypt. J. Pharm. Sci. 1992, 33, 639-650.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
950
МИНЕЕВА и др.
26. Musa M.A., Badisa V.L., Latinwo L.M., Cooper-
34. Salar U., Khan K.M., Muhammad H., Fakhri M.I.,
wood J., Sinclair A., Abdullah A. Anticancer Res. 2011,
Sanaullah, Perveen S., Choudhary M.I. Lett. Drug
31, 2017-2022.
Design Discov. 2018, 15, 353-362. doi 10.2174/1570
27. Salem M.A., Marzouk M.I., El-Kazak A.M. Molecu-
180814666170619121844
les. 2016, 21, 249-269. doi 10.3390/molecules21020249
35. Alizadeh A., Ghanbaripour R., Zhu L.-G. Synlett.
28. Sugino T., Tanaka K. Chem. Lett. 2001, 30, 110-111.
2013, 24, 2124-2126. doi 10.1055/s-0033-1339521
doi 10.1246/cl.2001.110
29. Khan D., Mukhtar S., Alsharif M.A., Alahmdi M.I.,
36. Davis J.M., Truong A., Hamilton A.D. Org. Lett. 2005,
Ahmed N. Tetrahedron Lett. 2017, 58, 3183-3187. doi
7, 5405-5408. doi 10.1021/ol0521228
10.1016/j.tetlet.2017.07.018
37. Maurya R.A., Min K.-I., Kim D.-P. Green Chem. 2014,
30. Murthi G.S.S., Basak M. J. Ind. Chem. Soc. 1993, 70,
16, 116-120. doi 10.1039/C3GC41226A
170- 171.
38. Murphy P.V., O’Sullivan T.J., Geraghty N.W.A. J.
31. Dholariya H.R., Patel K.S., Patel J.C., Patel A.K.,
Chem. Soc. Perkin Trans. 1. 2000, 13, 2109-2119. doi
Patel K.D. Med. Chem. Res. 2013, 22, 5848-5860. doi
10.1007/s00044-013-0576-6
10.1039/B001393P
32. Kumar J.A., Saidachary M., Sridhar J., Nishant Ka-
39. Wilen S.H., Shen D., Licata J.M., Baldwin E., Rus-
livendi S.V., Rao V.J., Raju B.C. Eur. J. Med. Chem.
sell C.S. Heterocycles. 1984, 22, 1747-1757. doi
2013, 65, 389-402. doi 10.1016/j.ejmech.2013.03.042
10.3987/R-1984-08-1747
33. Murata C., Masuda T., Kamochi Y., Todoroki K.,
40. Минеева И.В. ЖOрХ. 2013, 49, 995-1001. [Minee-
Yoshida H., Nohta H., Yamaguchi M., Takadate A.
va I.V. Russ. J. Org. Chem. 2013, 49, 979-985.] doi
Chem. Pharm. Bull. 2005, 53, 750-758. doi 10.1248/
cpb.53.750
10.1134/S107042801307004X
2-Substituted Allyl Bromides as Electrophilic and Nucleophilic
Building Blocks for Creating Fragments of 1,3-Dicarbonyl
Compounds. Applications in the Synthesis
of Heterocyclic Compounds
I. V. Mineyeva*
Belarusian State University, prosp. Nezavisimosti, 4, Minsk, 220030 Belarus
*e-mail: i.mineyeva@yandex.ru
Received November 2, 2021; revised November 24, 2021; accepted November 26, 2021
An efficient method has been developed for the preparation of new heterocyclic compounds based on 2-substi-
tuted functionalized allyl bromides as precursors of electrophilic and nucleophilic building blocks for creating
fragments of 1,3-dicarbonyl compounds.
Keywords: 1,3-dicarbonyl compounds, 2-substituted allyl bromides, methyl 3-bromomethyl-3-butenoate,
2-(bromomethyl)-4,4-diethoxybut-1-ene, pyrazole, oxazole, benzo[f]coumarin, multicomponent reactions
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022