ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 9, с. 965-974
УДК 547.831.3
СИНТЕЗ И АНТИКОАГУЛЯНТНАЯ АКТИВНОСТЬ
НОВЫХ ФУНКЦИОНАЛЬНО ЗАМЕЩЕННЫХ
4Н-ПИРРОЛО[3,2,1-ij]ХИНОЛИН-2-ОНОВ
© 2022 г. Н. П. Новичихинаa, З. Э. Ашрафоваa, И. В. Леденеваa, Н. А. Подоплеловаb,
М. А. Пантелеевс, Х. С. Шихалиевa, *
а ФГБОУ ВО «Воронежский государственный университет», Россия, 394018 Воронеж, Университетская пл., 1
b ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии
и иммунологии им. Дмитрия Рогачева» Минздрава России, Россия, 117997 Москва, ул. Саморы Машела, 1
c ФГБУН «Центр теоретических проблем физико-химической фармакологии» РАН,
Россия, 109029 Москва, ул. Средняя Калитниковская, 30
*e-mail: shikh1961@yandex.ru
Поступила в редакцию 18.11.2021 г.
После доработки 13.12.2021 г.
Принята к публикации 18.12.2021 г.
Установлено, что восстановление 4,4,6-триметил-4H-пирроло[3,2,1-ij]хинолин-1,2-дионов водным рас-
твором гидразингидрата протекает селективно с участием β-карбонильной группы и приводит к соответ-
ствующим 4,4,6-триметил-4H-пирроло[3,2,1-ij]хинолин-2-онам в течение нескольких часов. Конденсация
последних с альдегидами и ацетоном идет с образованием новых 1-[(гет)арилиден]- и 1-(пропан-2-или-
ден)-4H-пирроло[3,2,1-ij]хинолин-2-онов с выходами 59-78%. Взаимодействием 4H-пирроло[3,2,1-ij]-
хинолин-2-онов с диметилацеталем N,N-диметилформамида и последующим переаминированием пер-
вичными аминами синтезированы 1-{[(гет)ариламино]метилен}-4H-пирроло[3,2,1-ij]хинолин-2-оны с
выходами 65-83%. Антикоагулянтную активность полученных соединений изучали с помощью модель-
ного теста ингибирования активности в отношении факторов свертывания крови Xa и XIa.
Ключевые слова: 4Н-пирроло[3,2,1-ij]хинолин-2-он, реакция Вольфа-Кижнера, антикоагулянтная
активность, факторы Xa и XIa
DOI: 10.31857/S0514749222090051, EDN: JLPMHH
ВВЕДЕНИЕ
Недавно нами сообщалось, что среди про-
изводных
4Н-пирроло[3,2,1-ij]хинолин-2-онов
Органические соединения, имеющие в своей
выявлены соединения, которые демонстриру-
структуре пирроло[3,2,1-ij]хинолиновый фраг-
ют ингибирующую активность в отношении
мент, зачастую обладают высокой биологической
факторов свертывания крови Xa и XIa [14-18].
активностью. Так, например, в ряду производных
Таким образом, поиск новых ингибиторов фак-
пирроло[3,2,1-ij]хинолинов найдены соединения,
торов свертывания крови в ряду производных
проявляющие антибактериальные [1-4] и проти-
4Н-пирроло[3,2,1-ij]хинолин-2-онов представля-
воопухолевые свойства [5], диуретики [6-7], инги-
ет значительный интерес. Направленный синтез
биторы альдостероновой синтетазы [8], агонисты
разнообразно замещенных 4Н-пирроло[3,2,1-ij]-
и антагонисты мелатониновых рецепторов [9], ве-
хинолин-2-онов открывает широкие возможно-
щества, перспективные для лечения лимфомы че-
сти функциональной диверсификации данной ма-
ловека [10], диабета [11], астмы [12], эпилепсии и
трицы, что может оказать существенное влияние
ожирения [13].
на вид и эффективность физиологического дей-
965
966
НОВИЧИХИНА и др.
ствия синтезированных соединений на их осно-
Нами было установлено, что, как и в случае из-
ве.
атинов, для 4Н-пирроло[3,2,1-ij]хинолин-1,2-ди-
онов данная реакция протекает селективно с уча-
Таким образом, целью настоящей работы яв-
лялся синтез и in vitro биоскрининг ингибирую-
стием β-карбонила, не затрагивая амидную карбо-
щей активности в отношении факторов свертыва-
нильную группу гетероцикла. Процесс проводили
ния крови Xa и XIa функционально замещенных
кипячением
4,4,6-триметил-4Н-пирроло[3,2,1-ij]-
4Н-пирроло[3,2,1-ij]хинолин-2-онов, содержащих
хинолин-1,2-дионов (ПХД) 1a-d с водным рас-
заместители в положении 1 данной гетероцикли-
твором гидразингидрата в течение 2 ч, в резуль-
ческой системы.
тате чего с выходами 67-82% были получены
4Н-пирроло[3,2,1-ij]хинолин-2-оны 2a-d (схема 1).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для целенаправленного синтеза 4H-пирроло-
Полученные соединения представляют собой
[3,2,1-ij]хинолин-2-оновой матрицы используют
белые или бледно-желтые вещества, хорошо рас-
синтетические процедуры, заключающиеся в цик-
творимые в хлороформе, ацетоне, изопропиловом
лизации N-замещенных и 8-замещенных хиноли-
спирте, N,N-диметилформамиде. В спектрах ЯМР
нов в целевые 4H-пирроло[3,2,1-ij]хинолин-2-оны
1Н продуктов 2a-d по сравнению с исходными
[19-26]. Одним из наиболее применяемых спо-
ПХД 1a-d наблюдается появление сигналов про-
собов получения данных систем служит реак-
тонов метиленовой группы в виде синглета в об-
ция внутримолекулярного алкилирования по
ласти ~ 3.43-3.45 м.д. В спектрах ЯМР 13С соеди-
Фриделю-Крафтсу галогенацетил производных
нений 2b, d зафиксировано исчезновение сигнала
хинолина. Так, известен синтез 1,2,5,6-тетраги-
β-карбонильной группы при 160 м.д. и появление
дро-4H-пирроло[3,2,1-ij]хинолин-2-она в ходе цик-
сигнала СН2 группы при 56 м.д.
лизации 1-(хлорацетил)-1,2,3,4-тетрагидрохиноли-
Структурные особенности синтезированных
на в присутствии хлорида алюминия в о-дихлор-
4Н-пирроло[3,2,1-ij]хинолин-2-онов, в частности,
бензоле [21-22]. Однако, в нашем случае исполь-
наличие метиленактивной группы, позволяют вво-
зование данного подхода может усложняться тем,
дить их в хорошо известные реакции конденсации
что в таких условиях 1-(галогенацетил)-2,2,4-три-
с различными карбонильными соединениями по
метил-1,2-дигидрохинолин параллельно будет
вступать в реакцию алкилирования Фриделя-
аналогии с работами [27-29, 31-34], получая но-
Крафтса в положении С4 1,2-дигидрохинолина.
вые 1-замещенные производные данных систем.
В то же время, селективное восстановление
Нами на основании этого опыта изучено взаи-
4Н-пирроло[3,2,1-ij]хинолин-1,2-дионов водным
модействие
4Н-пирроло[3,2,1-ij]хинолин-2-онов
раствором гидразингидрата представляет собой
2a-c с ароматическими и гетероциклическими
удобный одностадийный метод синтеза 4Н-пир-
альдегидами, а также ацетоном. Взаимодействия
роло[3,2,1-ij]хинолин-2-онов. При использовании
проводили при кипячении реагентов в среде эти-
такой процедуры ранее были получены произво-
лового спирта в присутствии пиперидина в каче-
дные индолин-2-она и его N-алкилированных ана-
стве основного катализатора. В результате в тече-
логов [27-30].
ние 2-5 ч нагревания после стандартных препа-
Схема 1
Me
Me
R1
R1
NH2NH2ÂH2O
Me
Me
'
N
N
Me
Me
67 82%
O
O
O
1a-d
2a-d
1a-d, 2a-d, R1 = H (a), R1 = CH3 (b), R1 = CH3O (c), R1 = C2H5 (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
СИНТЕЗ И АНТИКОАГУЛЯНТНАЯ АКТИВНОСТЬ
967
Схема 2
Me
Me
R1
R1
EtOH,
O
1 2 dUops pipeU.
Me
Me
+
N
N
'
Me
R2
R3
Me
59 78%
2
R
O
O
3
R
2a-d
3
4a-g
2a-c, R1 = H (a), R1 = CH3 (b), R1 = CH3O (c); 3a-f, R2 = H, R3 ɢɧɞɨɥɢɧ ɢɥ a),
R2 = H, R3 ɬɢɨɮɟɧ ɢɥ b); R2 = H, R3 ɩɢɪɢɞɢɧ ɢɥ c), R2 = H, R3
&+3O)2 &6H3 (d),
R2 = H, R3
%U &6H4 (e), R2 = R3 = CH3 (f); 4a-g, R1 = R2 = H, R3 ɢɧɞɨɥɢɧ ɢɥ a),
R1 = CH3, R2 = H, R3 ɬɢɨɮɟɧ ɢɥ b), R3 ɩɢɪɢɞɢɧ ɢɥ c), R3
&+3O)2 &6H3 (d),
R3
%U &6H4 (e), R1 = R2 = R3 = CH3 (f), R1 = CH3O, R2 = R3 = CH3 (g).
ративных процедур были получены с хорошими
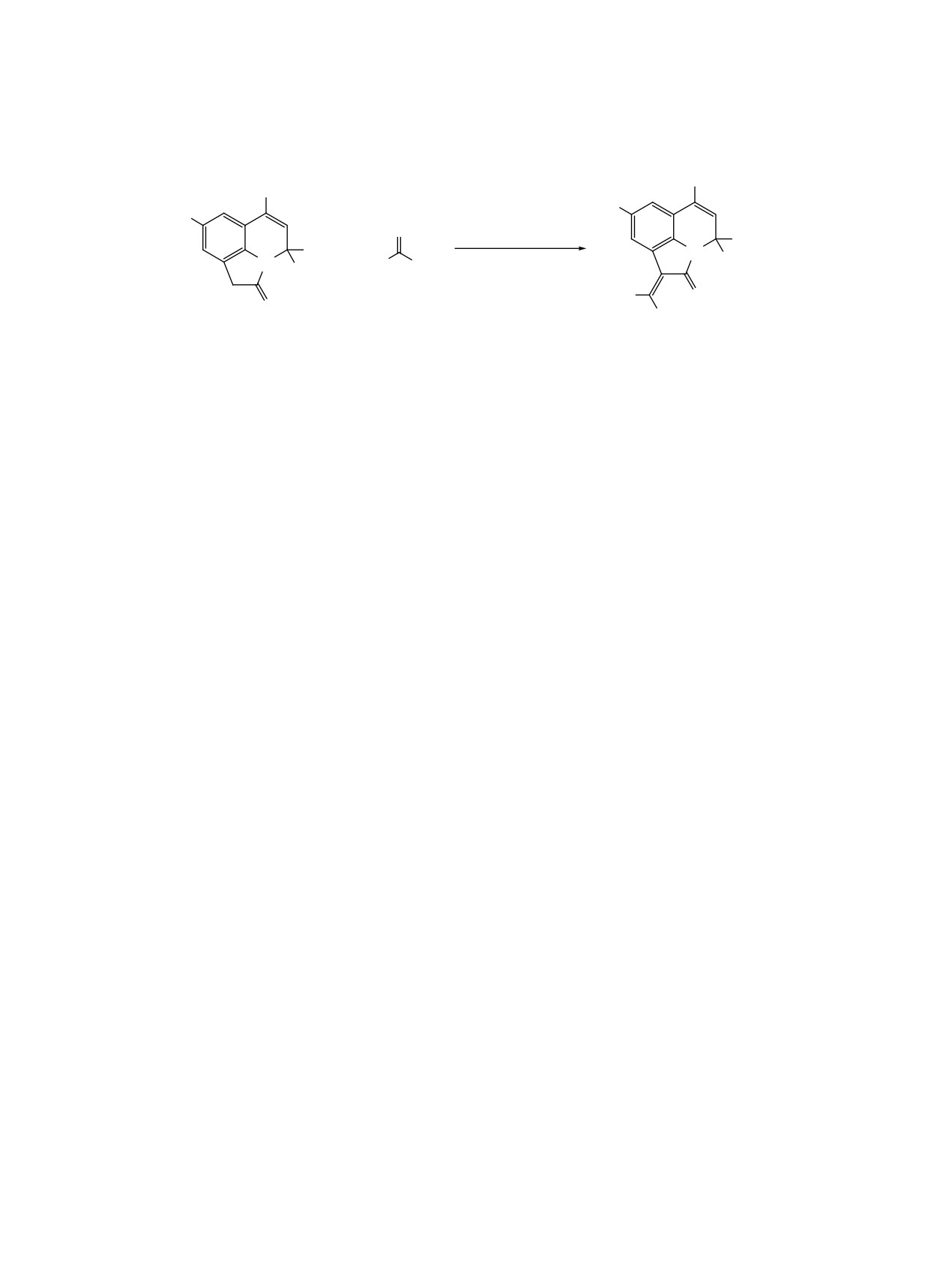
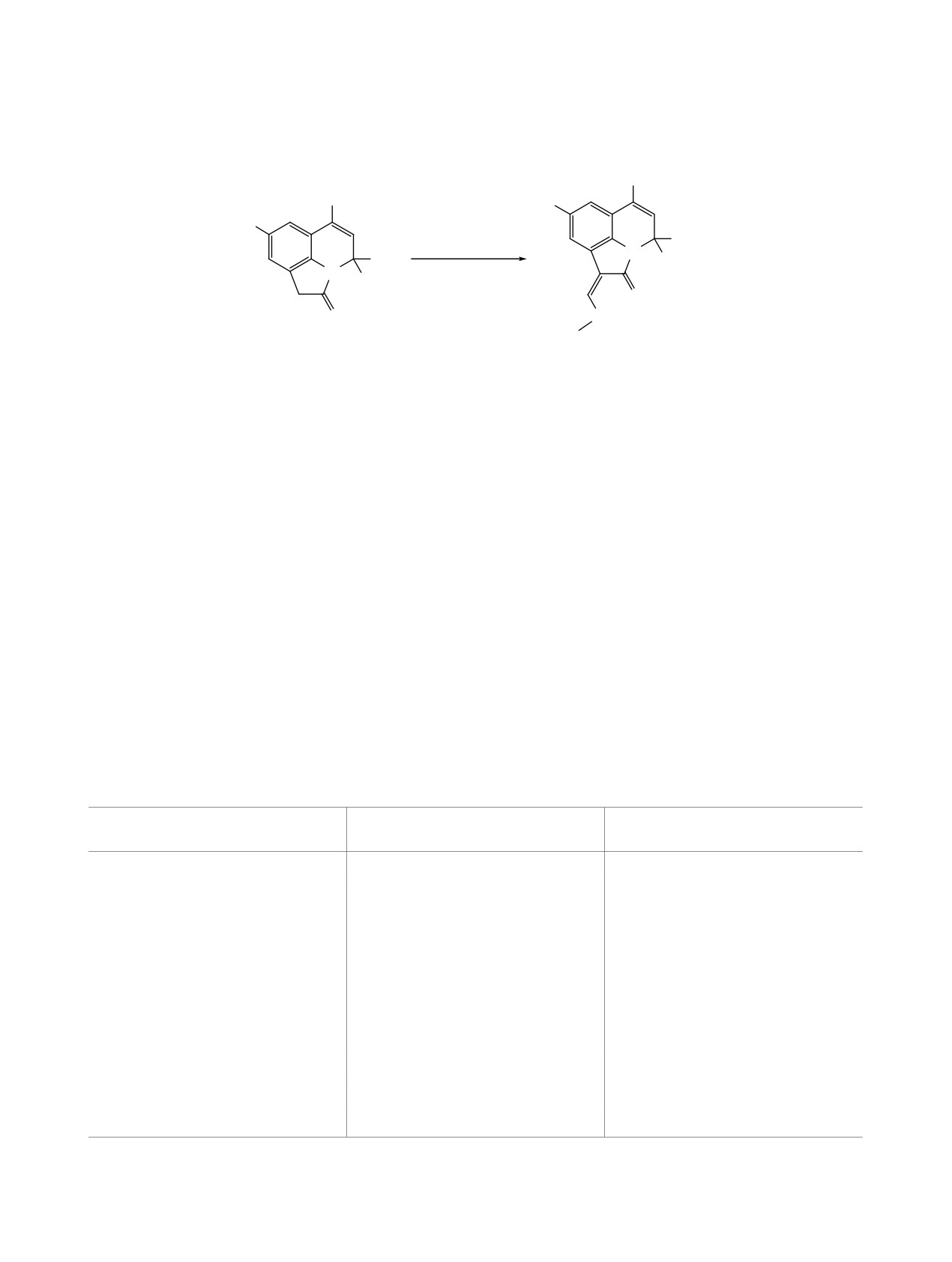
Установлено, что реакция протекает неселек-
выходами (59-78%) 1-[(гет)арилиден]- и 1-(про-
тивно, и приводит к образованию продуктов пере-
пан-2-илиден)-4H-пирроло[3,2,1-ij]хинолин-2-
аминирования 5а-f, большинство из которых были
оны 4a-g (схема 2). Полученные соединения 4a-g
выделены согласно данным ВЭЖХ МС и ЯМР 1Н
представляют собой ярко окрашенные порошки
спектроскопии в виде смеси Z/E изомеров. Так, в
красного и оранжевого цвета.
спектрах ЯМР 1Н соединений 5a-f, наряду с сиг-
налами, характерными для пирролохинолин-2-
Строение соединений 4a-g подтверждено дан-
онов, появляются дополнительные сигналы остат-
ными ЯМР 1Н спектроскопии. В спектрах продук-
ка соответствующих аминов в области ароматики,
тов 4a-e отсутствуют сигналы метиленовой груп-
синглет илиденового протона при 7.2-7.3 м.д. и
пы в области ~ 3.4 м.д. и зафиксировано появление
дублет NH-группы в диапазоне 9-11 м.д. Исходя
синглета протона при илиденовой связи С=СН в
из очевидного факта о возможности стабилизации
области 7.58-8.15 м.д., а также все сигналы до-
Z-изомера в результате образования внутримолеку-
полнительных ароматических протонов при 7.1-
лярной водородной связи между NH-фрагментом
8.8 м.д. В случае соединений 4f-g вместо сигналов
енамина и циклической карбонильной группой
метиленовой группы исходных соединений на-
пирролохинолин-2-она, при отнесении сигналов
блюдается появление дополнительных синглетов
к соответствующим изомерам мы предположили,
при 2.27-2.29 м.д., соответствующих двум метиль-
что Z-изомер образуется в виде мажорного продук-
ным группам при кратной связи.
та. В зависимости от заместителей соотношение
Одним из широко используемых реагентов для
Z/E изомеров варьируется от 3:1 до 6:1.
построения гетероциклических систем является
Для полученной серии соединений 4a-g и 5a-f
диметилацеталь N,N-диметилформамида (ДМА-
осуществлен первичный скрининг in vitro с целью
ДМФА), который представляет собой источник
выявления соединений лидеров и определения их
одноуглеродного синтона. Нами это было исполь-
относительной ингибирующей активности в отно-
зовано в реакции пирроло[3,2,1-ij]хинолин-2-
шении факторов свертывания крови Xa и XIa. Как
онов с ДМА-ДМФА. При этом установлено, что
оказалось и вопреки нашим ожиданиям большин-
при кипячении реагентов в о-ксилоле с легкостью
ство исследуемых веществ не проявляет антикоа-
образуются диметиламинометиленпроизводные,
гулянтной активности, и только соединения 4a и
которые легко переаминируются первичными
5b являются умеренными ингибиторами фактора
аминами с образованием 1-{[(гет)ариламино]ме-
Xa (см. таблицу).
тилен}-4H-пирроло[3,2,1-ij]хинолин-2-онов 5a-f.
Реакции с аминами проводили при кипячении реа-
На основе полученных данных предполагаются
гентов в о-ксилоле в присутствии уксусной кисло-
дальнейшие исследования в рамках рационально-
ты в качестве катализатора (схема 3).
го молекулярного дизайна эффективных антикоа-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
968
НОВИЧИХИНА и др.
Схема 3
Me
Me
R1
R1
1. ȾɆȺ ȾɆɎȺ
Me
2. R2
NH2
N
Me
Me
N
'
Me
65 83%
O
O
NH
R2
2
5a-f
2b-c, R1 = CH3 (b), R1 = CH3O (c); 5a-f, R1 = Me, R2 ɛɟɧɡɢɦɢɞɚɡɨɥ ɢɥ a ɩɢɪɢɞɢɧ ɢɥ b),
0H2 &6H4 (c
0H2 &6H4 (d
>& 2 &+3@ &6H4 (e), R1 = MeO, R2 = CH2C6H5 (f).
гулянтов свертывания крови класса производных
EC-C18 (4.6×50 мм, 2.7 мкм), термостат 28°С, ио-
пирроло[3,2,1-ij]хинолин-2-онов.
низация электрораспылением (капилляр - 3.5 кВ;
фрагментор +191 В; OctRF +66 В-положительная
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
полярность). Температуры плавления определены
Спектры ЯМР зарегистрированы на спетро-
на приборе Stuart SMP30. Контроль за индивиду-
метрах Bruker DRX-500 и Agilent MR 400+ (500
альностью реагентов и полученных веществ, а так-
и 400 МГц для 1Н, и 125 и 101 МГц для 13С) в
же за ходом реакции осуществляли методом ТСХ
ДМСО-d6. В качестве внутреннего стандарта ис-
на пластинах Merck TLC Silica gel 60 F254 в систе-
пользованы сигналы протонов ТМС. Анализ мето-
ме CHCl3-MeОН, 10:1 (проявление хроматограмм
дом ВЭЖХ-МС проведен на жидкостном хрома-
в УФ свете и парах иода). Исходные соединения
тографе Agilent Infinity 1260 с масс-селективным
1a-d получены по методике [35]. Все соединения
детектором Agilent 6230 TOF. Условия разделе-
были синтезированы из коммерчески доступных
ния: подвижная фаза 0.1% муравьиная кислота в
реагентов (Acros Organics, ВЕКТОН).
MeCN (элюент А)/0.1% муравьиная кислота в воде
(элюент В), градиент 0-100%: А, 3.5 мин, 50%; А,
Для исследования ингибирования факторов
1.5 мин, 50-100%; В, 3.5 мин, 50%; В, 1.5 мин,
свертывания Ха и XIa различными соединениями
50-0%; поток 0.4 мл/мин, колонка-Poroshell 120
измеряли кинетику гидролиза специфичных по от-
Активность факторов Xa и XIa в присутствии полученных соединений 4a, b, d, e и 5a-c, e, f по отношению к актив-
ности в их отсутствие, %
Соединение
Фактор Xa
Фактор XIa
4a
49±2
96±5
4b
85±4
105±6
4d
80±5
89±2
4e
83±4
96±5
5a
83±1
116±9
5b
57±3
91±6
5c
98±4
101±4
5e
87±6
128±13
5f
71±2
85±4
Ривароксабан
6±1
92±5
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
СИНТЕЗ И АНТИКОАГУЛЯНТНАЯ АКТИВНОСТЬ
969
ношению к каждому их этих ферментов субстра-
Выход 1.60 г (75%), белый порошок, т.пл. 117-
тов в присутствии тестируемых веществ. В случае
119°C. Спектр ЯМР 1Н (400 МГц, ДМСО-d6),
фактора Xa использвали специфичный низкомоле-
δ, м.д.: 1.55 с [6Н, 4-(СH3)2], 1.93 неразр.д (3Н,
кулярный хромогенный субстрат S2765 (Z-D-Arg-
6-СH3, J 1.2 Гц), 3.41 c (2H, CH2), 5.29 неразр.д
Gly-Arg-pNA·2HCl, Chromogenix, Instrumentation
(1H, H-5, J 1.2 Гц), 6.82 д.д (1H, H-9, J 7.3, 1.2 Гц),
Laboratory Company, Lexington, MA 02421, USA), а
6.85 д.д (1H, H-9, J 7.2, 1.1 Гц), 7.03 т (1H, H-8, J
для фактора XIa субстрат S2366 (pyroGlu-Pro-Arg-
7.5 Гц). Масс-спектр, m/z (Iотн, %): 214.1232 [М +
pNA·HCl, Chromogenix, Instrumentation Laboratory
Н]+. C14H15NO. М + Н 214.1227.
Company, Lexington, MA 02421, USA).
4,4,6,8-Тетраметил-4H-пирроло[3,2,1-ij]хи-
В лунки 96-луночного планшета вносили бу-
нолин-2-он (2b). Получен из 2.41 г соединения
фер, содержащий 140 mМ NaCl, 20 mM HEPES,
1b. Выход 1.52 г (67%), белый порошок, т.пл. 107-
0.1% ПЭГ (6000), рН 8.0, добавляли фактор Ха (ко-
109°C. Спектр ЯМР 1Н (500 МГц, ДМСО-d6), δ,
нечная концентрация - 2.5 нМ) или XIa (конечная
м.д.: 1.58 с [6Н, 4-(СH3)2], 1.95 c (3Н, 6-СH3), 2.24
концентрация 0.8 нМ), субстрат S2765 (конечная
c (3Н, 8-СH3), 3.44 c (2H, CH2), 5.32 c (1H, H-5),
концентрация - 200 мкМ) или S2366 (конечная
6.87 c (1H, H-7), 6.88 c (1H, H-9). Спектр ЯМР 13С
концентрация - 200 мкМ) соответственно, а так-
(125 МГц, ДМСО-d6), δ, м.д.: 16.9, 20.9, 27.2, 36.4,
же ингибиторы в концентрации 30 мкМ, ДМСО
56.1, 117.9, 121.2, 121.7, 124.1, 124.8, 130.1, 130.5,
не более 2%. С помощью микропланшетного ри-
138.0, 174.6. Масс-спектр, m/z (Iотн, %): 228.1379
дера THERMOmax Microplate Reader (Molecular
[М + Н]+. C15H17NO. М + Н 228.1384.
Devices Corporation, Sunnyvale, California) была
измерена кинетика образования п-нитроанилина
8-Метокси-4,4,6-триметил-4H-пирроло-
(pNA) по поглощению конечным раствором света
[3,2,1-ij]хинолин-2-он (2c). Получен из 2.57 г со-
с длиной волны 405 нм. Начальная скорость рас-
единения 1с. Выход 1.99 г (82%), бежевые кристал-
щепления субстрата была определена по началь-
лы, т.пл. 112-115°C. Спектр ЯМР 1Н (400 МГц,
ному наклону кривой образования pNA. Скорость
ДМСО-d6), δ, м.д.: 1.54 с [6Н, 4-(СH3)2], 1.97 c (3Н,
расщепления субстрата ферментом в присутствии
6-СH3), 3.44 c (2H, CH2), 3.73 с (3H, CH3O), 5.32 c
ингибитора была нормирована на скорость расще-
(1H, H-5), 6.89 c (1H, H-7), 7.06 c (1H, H-9). Масс-
пления в отсутствие ингибитора. Полученные зна-
спектр, m/z (Iотн, %): 244.1336 [М + Н]+. C15H17NO2.
чения приведены в таблице. Обработка результатов
М + Н 244.1333.
осуществлялась с помощью программ GraphPad
8-Этил-4,4,6-триметил-4H-пирроло[3,2,1-ij]-
Prism (GraphPad, 2365 Northside Dr, San Diego, CA
хинолин-2-он (2d). Получен из 2.55 г соединения
92108, USA) и OriginPro 8 (OriginLab Corporation,
1d. Выход 0.1.88 г (78%), бежевый порошок, т.пл.
One Roundhouse Plaza, Suite 303 Northampton, MA
135-137°C. Спектр ЯМР 1Н (400 МГц, ДМСО-d6),
01060 USA).
δ, м.д.: 1.13 т (3Н, CH2CH3, J 7.6 Гц), 1.56 с [6Н,
8-R1-4,4,6-Триметил-4H-пирроло[3,2,1-ij]хи-
4-(СH3)2], 1.94 неразр.д (3Н, 6-СH3, J 1.2 Гц), 2.51
нолин-2-оны 2а-d (общая методика). К 10 ммоль
к (2H, CH2CH3, J 7.7 Гц), 3.43 c (2H, CH2), 5.30
8-R1-4,4,6-тетраметил-4H-пирроло[3,2,1-ij]хино-
неразр.д (1H, H-5, J 1.2 Гц), 6.84 c (1H, H-7), 6.89 c
лин-1,2-диона прибавляли 10 мл гидразингидрата
(1H, H-9). Спектр ЯМР 13С (101 МГц, ДМСО-d6),
(64%) и кипятили при 115°С в течение 1-3 ч. По
δ, м.д.: 16.7, 17.4, 27.6, 28.7, 36.8, 56.5, 118.3, 120.6,
завершении реакции, реакционную массу охла-
122.1, 123.4, 125.3, 130.5, 137.7, 138.6, 175.1. Масс-
ждали и избыточное количество гидразингидра-
спектр, m/z (Iотн, %): 242.1544 [М + Н]+. C16H19NO.
та концентрировали при пониженном давлении.
М + Н 242.1540.
После чего, к реакционной массе добавляли хо-
лодную воду. Выпавший осадок отфильтровыва-
8-R1-1-(R2,R3-Илиден)-4,4,6-триметил-4H-
ли, промывали водой, высушивали и перекристал-
пирроло[3,2,1-ij]хинолин-2-оны 4a-g (общая ме-
лизовывали из смеси гексан-этилацетат (4:1).
тодика). К раствору 2.4 ммоль 4H-пирроло[3,2,1-
4,4,6-Триметил-4H-пирроло[3,2,1-ij]хино-
ij]хинолин-2-она в этиловом спирте добавляли
лин-2-он (2a). Получен из 2.27 г соединения 1a.
2.4 ммоль альдегида или кетона, каталитическое-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
970
НОВИЧИХИНА и др.
количество пиперидина и кипятили в течение 2-
с (3Н, 8-СH3), 3.869 с (3H, CH3O), 3.873 с (3H,
5 ч. По окончании реакции, реакционную смесь
CH3O), 5.41 неразр.д (1H, H-5, J 1.5 Гц), 6.69-6.72
охлаждали, выпавший осадок отфильтровывали,
м (1Н, Ar), 6.70 с (1H, Ar), 6.90 c (1Н, Ar), 7.17 с
высушивали. Полученные продукты перекристал-
(1H, Ar), 7.64 с (1H, С=CH), 7.66 д.д (1H, Ar, J 6.5,
лизовывали из изопропилового спирта.
2.7 Гц). Масс-спектр, m/z (Iотн, %): 376.1905 [М +
Н]+. C24H25NO3. М + Н 376.1908.
1-[(1H-Индол-3-ил)метилен]-4,4,6-триметил-
4H-пирроло[3,2,1-ij]хинолин-2-он (4a). Получен
1-(3-Бромобензилиден)-4,4,6,8-тетраметил-
из 0.51 г соединения 2a. Выход 0.53 г (65%), жел-
4H-пирроло[3,2,1-ij]хинолин-2-он (4e). Получен
тый порошок, т.пл. 234-236°C. Спектр ЯМР 1Н
из 0.54 г соединения 2b. Выход 0.69 г (73%), крас-
(500 МГц, ДМСО-d6), δ, м.д.: 1.71 с [6Н, 4-(СH3)2],
ный порошок, т.пл. 120-122°C. Спектр ЯМР 1Н
2.0 неразр.д (3Н, 6-СH3, J 1.3 Гц), 5.41 неразр.д
(500 МГц, ДМСО-d6), δ, м.д.: 1.63 с [6Н, 4-(СH3)2],
(1H, H-5, J 1.5 Гц), 6.95 т (1H, Н-8, J 7.5 Гц), 6.99
1.97 неразр.д (3Н, 6-СH3, J 1.3 Гц), 2.17 с (3Н,
неразр.д.д (1H, Ar, J 6.7 Гц), 7.24-7.26 м (2Н, Ar),
8-СH3), 5.43 неразр.д (1H, H-5, J 1.5 Гц), 6.95 с (1H,
7.52-7.55 м (1Н, Ar), 7.72 д.д (1Н, Ar, J 7.4, 1.1 Гц),
Ar), 7.08 c (1Н, Ar), 7.50 т (1H, Ar, J 7.9 Гц), 7.58 c
8.15 с (1Н, С=CH), 8.16-8.19 м (1Н, Ar), 9.44 д (1Н,
(1Н, С=CH), 7.68-7.70 м (1Н, Ar), 7.71 д (1Н, Ar, J
Ниндол, J 2.9 Гц), 12.1 с (1Н, NH). Масс-спектр, m/z
7.8 Гц), 7.88 с (1Н, Ar). Масс-спектр, m/z (Iотн, %):
(Iотн, %): 341.1645 [М + Н]+. C23H20N2O. М + Н
394.0806 [М + Н]+. C22H20BrNO. М + Н 394.0802.
341.1649.
4,4,6,8-Тетраметил-1-(пропан-2-илиден)-4H-
4,4,6,8-Тетраметил-1-(тиофен-2-илметилен)-
пирроло[3,2,1-ij]хинолин-2-он (4f). Получен из
4H-пирроло[3,2,1-ij]хинолин-2-он (4b). Получен
0.54 г соединения 2b. Выход 0.50 г (78%), жел-
из 0.54 г соединения 2b. Выход 0.58 г (75%), оран-
тый порошок, т.пл. 182-184°C. Спектр ЯМР 1Н
жевый порошок, т.пл. 200-202°C. Спектр ЯМР 1Н
(500 МГц, ДМСО-d6), δ, м.д.: 1.62 с [6Н, 4-(СH3)2],
(500 МГц, ДМСО-d6), δ, м.д.: 1.63 с [6Н, 4-(СH3)2],
1.98 с (3Н, 6-СH3), 2.17 с (3Н, 8-СH3), 2.27 с (3Н,
1.99 неразр.д (3Н, 6-СH3, J 1.4 Гц), 2.33 с (3Н,
2СH3), 5.41 с (1H, H-5), 6.91 с (1H), 7.04 c (1Н,
8-СH3), 5.43 неразр.д (1H, H-5, J 1.5 Гц), 6.99
Ar). Масс-спектр, m/z (Iотн, %): 268.1895 [М + Н]+.
с (1H, Ar), 7.32 д.д (1H, Ar, J 5.1, 3.7 Гц), 7.78 с
C18H21NO. М + Н 268.1897.
(1Н, С=CH), 7.81-7.82 м (2Н, Ar), 8.00 д (1Н, Ar, J
8-Метокси-4,4,6-триметил-1-(пропан-2-или-
5.0 Гц). Масс-спектр, m/z (Iотн, %): 322.1264 [М +
ден)-4H-пирроло[3,2,1-ij]хинолин-2-он (4g). По-
Н]+. C20H19NOS. М + Н 322.1261.
лучен из 0.58 г соединения 2с. Выход 0.48 г (71%),
4,4,6,8-Тетраметил-1-(пиридин-3-илмети-
желтый порошок, т.пл. 163-165°C. Спектр ЯМР 1Н
лен)-4H-пирроло[3,2,1-ij]хинолин-2-он (4c). По-
(500 МГц, ДМСО-d6), δ, м.д.: 1.60 с [6Н, 4-(СH3)2],
лучен из 0.54 г соединения 2b. Выход 0.45 г (59%),
1.97 c (3Н, 6-СH3), 2.29 с (3Н, 2СH3), 3.75 c (3H,
оранжевый порошок, т.пл.
136-138°C. Спектр
CH3O), 5.40 c (1H, H-5), 6.65 неразр.д (1H, H-7, J
ЯМР 1Н (500 МГц, ДМСО-d6), δ, м.д.: 1.63 с [6Н,
1.95 Гц), 6.93 неразр.д (1H, H-9, J 1.9 Гц). Спектр
4-(СH3)2], 1.98 с (3Н, 6-СH3), 2.31 с (3Н, 8-СH3),
ЯМР 13С (125 МГц, ДМСО-d6), δ, м.д.: 17.1, 22.2,
5.39 с (1H, H-5), 6.92 с (1H, Ar), 7.36 с (1H, Ar), 7.48
24.8, 27.1, 55.8, 107.1, 109.1, 118.1, 120.4, 122.9,
д.д (1H, Ar, J 7.8, 5.1 Гц), 7.75 с (1Н, С=CH), 8.58
124.7, 130.6, 131.1, 155.0, 155.4, 166.9. Масс-
д (1Н, Ar, J 4.8 Гц), 8.83-8.85 м (1Н, Ar), 9.15 не-
спектр, m/z (Iотн, %): 284.1649 [М + Н]+. C18H21NO2.
разр.д (1Н, Ar, J 1.9 Гц). Масс-спектр, m/z (Iотн, %):
М + Н 284.1646.
317.1647 [М + Н]+. C21H20N2O. М + Н 317.1649.
1-{[(Гет)ариламино]метилен}-4H-пирроло-
1-(2,4-Диметоксибензилиден)-4,4,6,8-тетра-
[3,2,1-ij]хинолин-2-оны
5a-f (общая методи-
метил-4H-пирроло[3,2,1-ij]хинолин-2-он
(4d).
ка). Смесь 2.4 ммоль пирролохинолин-2-она и
Получен из 0.54 г соединения 2b. Выход 0.60 г
2.5 ммоль ДМА-ДМФА в 10 мл о-ксилола кипя-
(67%), желтый порошок, т.пл. 166-168°C. Спектр
тили с обратным холодильником в течение часа.
ЯМР 1Н (500 МГц, ДМСО-d6), δ, м.д.: 1.62 с [6Н,
Затем в реакционную массу добавляли 2.4 моль
4-(СH3)2], 1.97 неразр.д (3Н, 6-СH3, J 1.2 Гц), 2.2
соответствующего амина, 1-2 капли уксусной кис-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
СИНТЕЗ И АНТИКОАГУЛЯНТНАЯ АКТИВНОСТЬ
971
лоты и кипятили дальше. По окончании реакции,
J 12.8 Гц). Масс-спектр, m/z (Iотн, %): 361.1907
выпавший осадок отфильтровывали, высушивали
[М + Н]+. C23H24N2O2. М + Н 361.1912.
и перекристаллизовали из петролейного эфира с
1-{[(4-Метоксифенил)амино]метилен}-
добавлением изопропилового спирта.
4,4,6,8-тетраметил-4H-пирроло[3,2,1-ij]хино-
1-[{(1H-Бензо[d]имидазол-2-ил)амино}мети-
лин-2-он (5d). Получен из 0.54 г соединения 2b.
лен]-4,4,6,8-тетраметил-4H-пирроло[3,2,1-ij]-
Выход 0.66 г (77%), Z/E смесь 6/1, желтый поро-
хинолин-2-он (5a). Получен из 0.54 г соедине-
шок, т.пл. 264-266°C. Спектр ЯМР 1Н (500 МГц,
ния 2b. Выход 0.68 г (77%), Z/E смесь 3/1, жел-
ДМСО-d6), δ, м.д.: 1.611 и 1.65 с (6H, 4-Me2), 1.971
тый порошок, т.пл. 232-234°C. Спектр ЯМР 1Н
и 1.98 неразр.д (3H, 6-Me, J 1.2 Гц), 2.29 и 2.331
(500 МГц, ДМСО-d6), δ, м.д.: 1.631 и 1.68 с [6Н,
с (3H, 8-Me), 3.801 и 3.81 с (3H, OCH3), 5.341 и
4-(СH3)2], 1.971 и 1.99 с (3Н, 6-СH3), 2.29 и 2.321 с
5.37 неразр.д (1H, H-5, J 1.4 Гц), 6.64 и 6.671 д.д
(3H, 8-Me), 5.341 и 5.40 с (1H, H-5), 6.741 и 6.79 c
(1H, Ar, J 8.2, 2.3 Гц), 6.71 и 6.761 с (1H, Ar), 6.95
(1H, Ar), 7.09-7.12 м (2Н, Ar), 7.30 с (1H, С=CH),
и 6.971 д.д (1H, Ar, J 8.0, 2.2 Гц), 7.04 т (1H, Ar,
7.351 и 7.41 д (1Н, Ar, J 7.0 Гц), 7.44 д (1Н, Ar, J
J 2.2 Гц), 7.251 и 7.27 c (1H, С=СН), 7.28-7.29 м
7.1 Гц), 7.601 с (1H, Ar), 8.221 с (1H, Ar), 8.311 с
(1H, Ar), 7.631 с (1H, Ar), 7.751 д (1H, Ar, J 13.6 Гц),
(1H, Ar), 8.52 д (1Н, Ar, J 11.4 Гц), 11.14 д (1Н, NH,
8.56 д (1H, Ar, J 12.6 Гц), 9.31 и 10.68 д (1H, NH, J
J 11.8 Гц), 11.9 с (1Н, NHбензимидазол). Масс-спектр,
12.6 Гц). Масс-спектр, m/z (Iотн, %): 361.1909 [М +
m/z (Iотн, %): 371.1872 [М + Н]+. C23H22N4O. М + Н
Н]+. C23H24N2O2. М + Н 361.1912.
371.1867.
1-{[(4-Ацетилфенил)амино]метилен}-
4,4,6,8-Тетраметил-1-[(пиридин-2-иламино)-
4,4,6,8-тетраметил-4H-пирроло[3,2,1-ij]хино-
метилен]-4H-пирроло[3,2,1-ij]хинолин-2-он
лин-2-он (5e). Получен из 0.54 г соединения 2b.
(5b). Получен из 0.54 г соединения 2b. Выход
Выход 0.67 г (75%), Z/E смесь 5/1, желтый поро-
0.64 г (81%), Z/E смесь 4/1, желтый порошок, т.пл.
шок, т.пл. 208-210°C. Спектр ЯМР 1Н (500 МГц,
178-180°C. Спектр ЯМР 1Н (400 МГц, ДМСО-d6),
ДМСО-d6), δ, м.д.: 1.621 и 1.66 с (6H, 4-Me2), 1.98
δ, м.д.: 1.591 и 1.64 с (6H, 4-Me2), 1.96 неразр.д
с (3H, 6-СН3), 2.30 и 2.341 с (3H, 8-СН3), 2.54
(3H, 6-Me), 2.27 и 2.321 с (3H, 8-Me), 5.331 и 5.36
с [3H, С(О)CH3], 5.361 и 5.38 с (1H, H-5), 6.75 и
неразр.д (1H, H-5), 6.73 и 6.761 с (1H, Ar), 7.05 д.д
6.801 с (1H, Ar), 7.3 с (1Н, С=СН), 7.501 и 7.52 д
(1H, Ar, J 8.0 Гц), 7.23 c (1H, С=СН), 7.35 д (1H,
(2H, Ar, J 7.9 Гц), 7.71 с (1H, Ar), 7.811 д (1H, Ar,
Ar, J 8.0 Гц), 7.681 c (1H, Ar), 7.77 т (1H, Ar, J
J 13.8 Гц), 7.97 и 7.991 д (2H, Ar, J 8.3 Гц), 8.63
4.0 Гц), 8.31 и 8.331 д.д (1H, Ar, J 8.0, 4.0 Гц), 8.561
д (1H, Ar, J 12.3 Гц), 9.561 и 10.84 д (1H, NH, J
д (1H, Ar, J 12.0 Гц), 8.72 д (1H, Ar, J 8.0 Гц), 9.741
12.3 Гц). Масс-спектр, m/z (Iотн, %): 373.1915 [М +
д (1H, NH, J 12.0 Гц), 10.86 д (1H, NH, J 8.0 Гц).
Н]+. C24H24N2O2. М + Н 373.1912.
Масс-спектр, m/z (Iотн, %): 332.1763 [М + Н]+.
C21H21N3O. М + Н 332.1758.
1-[(Бензиламино)метилен]-8-метокси-4,4,6-
триметил-4H-пирроло[3,2,1-ij]хинолин-2-он
1-{[(2-Метоксифенил)амино]метилен}-
(5f). Получен из 0.58 г соединения 2c. Выход
4,4,6,8-тетраметил-4H-пирроло[3,2,1-ij]хино-
0.64 г (74%), светло-желтый порошок, т.пл. 152-
лин-2-он (5c). Получен из 0.54 г соединения 2b.
154°C. Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ,
Выход 0.72 г (83%), желтый порошок, т.пл. 208-
м.д.: 1.65 с [6Н, 4-(СH3)2], 1.98 неразр.д (3Н, 6-СH3,
210°C. Спектр ЯМР 1Н (500 МГц, ДМСО-d6),
J 1.3 Гц), 3.87 с (3H, OCH3), 4.42 с (2H, CH2), 5.37
δ, м.д.: 1.65 с [6Н, 4-(СH3)2], 1.98 неразр.д (3Н,
неразр.д (1H, H-5, J 1.5 Гц), 6.73 c (1H, С=СН),
6-СH3, J 1.3 Гц), 2.29 с (3H, 8-Me), 3.93 с (3H,
7.03-7.05 м (1Н, Ar), 7.07 т (1H, Ar, J 1.9 Гц), 7.11
OCH3), 5.37 неразр.д (1H, H-5, J 1.5 Гц), 6.70 c (1H,
д.д (1Н, Ar, J 7.4, 1.7 Гц), 7.17 д.д (1Н, Ar, J 7.9,
Ar), 7.01-7.06 м (2Н, Ar), 7.11 д.д (1Н, Ar, J 7.9,
1.6 Гц), 7.27 c (1H, С=СН), 7.64 д.д (1Н, Ar, J 7.8,
1.6 Гц), 7.64 д.д (1Н, Ar, J 7.8, 1.8 Гц), 8.60 д (1Н, Ar,
J 12.8 Гц), 10.82 д (1Н, NH, J 12.8 Гц). Масс-спектр,
1.8 Гц), 8.60 д (1Н, Ar, J 12.8 Гц), 10.88 д (1Н, NH,
m/z (Iотн, %): 361.1910 [М + Н]+. C23H24N2O2. М +
1 Сигналы E-изомер.
Н 361.1912.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
972
НОВИЧИХИНА и др.
ЗАКЛЮЧЕНИЕ
Davies D.T., Esken J.M., Giordano I., Hoover J.L.,
Jones G.E., Sukmar S.K.K., Markwell R.E., Min-
Изучена реакция селективного восстановле-
thorn E.A., Rittenhouse S., Gwynn M.N., Pearson N.D.
ния β-карбонильной группы пирроло[3,2,1-ij]хи-
Bioorg. Med. Chem. Lett. 2016, 26, 2464-2469. doi
нолин-1,2-дионов с образованием производных
10.1016/j.bmcl.2016.03.106
4H-пирроло[3,2,1-ij]хинолин-2-онов
- удобных
2. Schrader K. K., Avolio F., Andolfi A., Cimmino A.,
блоков для конструирования гибридных молекул
Evidente A. J. Agric. Food Chem. 2013, 61, 1179-
на их основе, и исследованы пути их дальней-
1183. doi 10.1021/jf304586j
шей функционализации. Осуществлен первич-
3. Tsuji K., Tsubouchi H., Ishikawa H. Chem. Pharm.
ный скрининг in vitro ингибирующей активно-
Bull. 1995, 43, 1678-1682. doi 10.1248/cpb.43.1678
сти серии новых функционально замещенных
4. Ishikawa H., Uno T., Miyamoto H., Ueda H., Tamao-
4H-пирроло[3,2,1-ij]хинолин-2-онов в отношении
ka H., Tominaga M., Nakagawa K Chem. Pharm. Bull.
факторов свертывания крови Xa и XIa. Показано,
1990, 38, 2459-2462. doi 10.1248/cpb.38.2459
что большинство исследуемых веществ не прояв-
5. Al-Said N.H., Shawakfeh K.Q., Abdullah W.N.
ляет антикоагулянтной активности, и только со-
Molecules. 2005, 10, 1446-1457. doi 10.3390/10121446
единения 4a и 5b являются умеренными ингибито-
6. Ukrainets I.V., Golik M.Y., Sidorenko L.V., Korniyen-
рами фактора Xa
ko V.I., Grinevich L.A., Sim G., Kryvanych O.V. Sci.
БЛАГОДАРНОСТИ
Pharm. 2018, 86, 31. doi 10.3390/scipharm86030031
7. Ishichi Y., Sasaki M., Setoh M., Tsukamoto T.,
Масс-спектры высокого разрешения получе-
Miwatashi S., Nagabukuro H., Okanishi S., Imai S.,
ны с помощью научно-технической базы ЦКПНО
Saikawa R., Doi T., Ishihara Y. Bioorg. Med. Chem.
ВГУ.
2005, 13, 1901-1911. doi 10.1016/j.bmc.2005.01.022
ФОНДОВАЯ ПОДДЕРЖКА
8. Yin L., Hu Q., Hartmann R.W. J. Med. Chem. 2013, 56,
460-470. doi 10.1021/jm301408t
Исследование выполнено за счет гранта
9. Tsotinis A., Panoussopoulou M., Eleutheriades A., Da-
Российского научного фонда
№ 18-74-10097,
vidson K., Sugden D. Eur. J. Org. Chem. 2007, 42,
1004-1013. doi 10.1016/j.ejmech.2007.01.005
ИНФОРМАЦИЯ ОБ АВТОРАХ
10. Matesic L., Locke J.M., Vine K.L., Ranson M., Brem-
Новичихина Надежда Павловна, ORCID: https://
ner J.B., Skropeta D. Tetrahedron. 2012, 68, 6810-
orcid.org/0000-0001-8167-6093
6819. doi 10.1016/j.tet.2012.06.049
11. Layek M., Reddy A.M., Rao A.V.D., Alvala M.,
Ашрафова Зейнаб Эльман кызы, ORCID: https://
Arunasree M.K., Islam A., Mukkanti K., Iqbal J.,
orcid.org/0000-0001-7785-3595
Pal M. Org. Biomol. Chem. 2011, 9, 1004-1007. doi
Леденева Ирина Владимировна, ORCID: https://
10.1039/C0OB00771D
orcid.org/0000-0002-4277-5838
12. Paris D. Cottin M., Demonchaux P., Augert G.,
Dupassieux P., Lenoir P., Peck M.J., Jasserand D.
Подоплелова Надежда Александровна, ORCID:
J. Med. Chem. 1995, 38, 669-685. doi 10.1021/
jm00004a013
Пантелеев Михаил Александрович, ORCID:
13. Isaac M., Slassi A., O’Brien A., Edwards L., Mac-
Lean N., Bueschkens D., Lee D.K.H., McCallum K.,
De Lannoy I., Demchyshyn L., Kamboj R. Bioorg.
Шихалиев Хидмет Сафарович, ORCID: https://
Med. Chem. Lett. 2000, 10, 919-921. doi 10.1016/
orcid.org/0000-0002-6576-0305
S0960-894X(00)00141-4
КОНФЛИКТ ИНТЕРЕСОВ
14. Ilin I., Lipets E., Sulimov A., Kutov D., Shikha-
liev Kh, Potapov A., Krysin M., Zubkov F., Saprono-
Авторы заявляют об отсутствии конфликта ин-
va L. Ataullakhanov F., Sulimov V. J. Mol. Graph. Mod.
тересов.
2019, 89, 215-224. doi 10.1016/j.jmgm.2019.03.017
СПИСОК ЛИТЕРАТУРЫ
15. Sulimov V.B., Gribkova I.V., Kochugaeva M.P.,
1. Miles T.J., Hennessy A.J., Bax B., Brooks G.,
Katkova E.V., Sulimov A.V., Kutov D.C., Shikha-
Brown B.S., Brown P., Cailleau N., Chen D., Dabbs S.,
liev Kh.S., Medvedeva S.M., Krysin M.Yu., Sinauri-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
СИНТЕЗ И АНТИКОАГУЛЯНТНАЯ АКТИВНОСТЬ
973
dze E.I., Ataullakhanov F.I. BioMed Res. Int. 2015,
25. Axon J., Boiteau L., Boivin J., Forbes J.E., Zard S.Z.
Article ID 120802. doi 10.1155/2015/120802
Tetrahedron Lett.
1994,
35,
1719-1722. doi
16. Медведева С.М., Потапов А.Ю., Грибкова И.В.,
10.1016/0040-4039(94)88328-9
Каткова Е.В., Сулимов В.Б., Шихалиев Х.С. Хим.-
26. Nakamura S., Kozuka M., Bastow K.F., Tokuda H.,
фарм. ж. 2017, 51, 19-23. [Medvedeva S.M., Pota-
Nishino H., Suzuki M., Tatsuzaki J., Natschke S.L.M.
pov A.Yu., Gribkova I.V., Katkova E.V., Sulimov V.B.,
Kuoc S.-C., Lee K.-H. Bioorg. Med. Chem. 2005, 13,
Shikhaliev Kh.S. Pharm. Chem. J. 2018, 51, 975-979.]
4396-4401. doi 10.1016/j.bmc.2005.04.078
doi 10.1007/s11094-018-1726-4
27. Singh G., Kalra P., Arora A., Singh A., Sharma G.,
17. Novichikhina N., Ilin I., Tashchilova A., Suli-
Sanchita S., Satija P. New J. Chem. 2018, 42, 16902-
mov A., Kutov D., Ledenyova I., Krysin M., Shikha-
16910. doi 10.1039/C8NJ02884B
liev Kh., Gantseva A., Gantseva E., Podoplelova N.,
28. Lozinskaya N.A., Babkov D.A., Zaryanova E.V.,
Sulimov V. Molecules. 2020, 25, 1889. doi 10.3390/
Bezsonova E.N., Efremov A.M., Tsymlyakov M.D.,
molecules25081889
Anikina L.V., Zakharyascheva O.Yu., Borisov A.V.,
18. Новичихина Н.П., Скопцова А.А., Шестаков А.С.,
Perfilova V.N., Tyurenkov I.N., Proskurnina M.V.,
Потапов А.Ю., Кошелева Е.А., Козадеров О.А., Ле-
Spasov A.A. Bioorg. Med. Chem. 2019, 27, 1804-1817.
денева И.В., Подоплелова Н.А., Пантелеев М.А.,
doi 10.1016/j.bmc.2019.03.028
Шихалиев Х.С. ЖОрХ.
2020,
56,
1376-1384.
[Novichikhina N.P., Skoptsova A.A., Shestakov A.S.,
29. Zhang C., Xu J., Zhao X., Kang C. J. Chem. Res. 2017,
Potapov A.Y., Kosheleva E.A., Kozaderov O.A., Le-
41, 537-540. doi 10.3184/174751917X150408919747
denyova I.V., Shikhaliev Kh.S., Podoplelova N.A.,
76
Panteleev M.A. Russ. J. Org. Chem. 2002, 56, 1550-
30. Crestini C., Saladino R. Synth. Commun. 1994, 24,
1556.] doi 10.1134/S1070428020090080
2835-2841. doi 10.1080/00397919408010603
19. Hardtmann G.E. Пат. US 4015005 A. 1977. США.
31. Jeankumar V.U., Alokam R., Sridevi J.P., Suryadeva-
20. Kajino H., Michida M., Takahashi Y., Kuwahara Y.
ra P., Matikonda S.S., Peddi S., Sahithi S., Alvala M.,
Пат. US 2016/0137644 A1 (2016). США.
Yogeeswari P., Sriram D. Chem. Biol. Drug. Des. 2014,
21. Журавлева Ю.А., Зимичев А.В., Земцова М.Н., Кли-
83, 498-506. doi 10.1111/cbdd.12265
мочкин Ю.Н. ЖОрХ. 2011, 47, 610-611. [Zhuravle-
32. Sun L., Tran N., Tang F., App H., Hirth P., McMa-
va Yu.A., Zimichev A.V., Zemtsova M.N., Klimoch-
hon G., Tang C. J. Med. Chem. 1998, 41, 2588-2603.
kin Yu.N. Russ. J. Org. Chem. 2011, 47, 617-618.] doi
doi 10.1021/jm980123i
10.1134/S1070428011040270
33. Sharma P., Thummuri D., Reddy T.S., Senwar K.R.,
22. Земцова М.Н., Головко Ю.А., Грузд Ю.А., Куле-
Naidu V.G.M., Srinivasulu G., Bharghava S.K.,
мина С.В., Баймуратов М.Р., Климочкин Ю.Н.
Shankaraiah N. Eur. J. Org. Chem. 2016, 122, 584-
ЖОрХ. 2021, 57, 728-736. [Zemtsova M.N., Golov-
600. doi 10.1016/j.ejmech.2016.07.019
ko Y.A., Gruzd Y.A., Kulemina S.V., Baimuratov M.R.,
Klimochkin Yu.N. Russ. J. Org. Chem. 2021, 57, 793-
34. Spencer J., Chowdhry B.Z., Hamid S., Mendham A.P.,
800.] doi 10.1134/S1070428021050055
Male L., Coles S.J., Hursthouse M.B. Acta
23. McAllister L.A.; McCormick R.A., James K.M.,
Crystallogr., Sect. C. 2010, 66, o71-o78. doi 10.1107/
S0108270109054134
Brand S., Willetts N., Procter D.J. Chem. Eur. J. 2007,
13, 1032-1046. doi 10.1002/chem.200601429
35. Лещева Е.В., Медведева С.М., Шихалиев Х.С. Ж.
24. Bass R.J., Koch R.C., Richards H.C., Thorpe J.E. J.
Орг. Фарм. Хім. 2014, 12, 15-20. [Leschcheva E.V.,
Agric. Food Chem. 1981, 29, 576-579. doi 10.1021/
Medvedeva S.M., Shikhaliev Kh.S. J. Org. Pharm.
jf00105a036
Chem. 2014, 12, 15-20.] doi 10.24959/ophcj.14.798
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
974
НОВИЧИХИНА и др.
Synthesis and Anticoagulant Activity of New Functionally
Substituted 4H-Pyrrolo[3,2,1-ij]quinolin-2-ones
N. P. Novichikhinaa, Z. E. Ashrafovaa, I. V. Ledenyovaa, N. A. Podoplelovab,
M. A. Panteleevc, and Kh. S. Shikhalieva, *
а Voronezh State University, Universitetskaya pl., 1, Voronezh, 394018 Russia
b Federal Research and Clinical Center of Pediatric Hematology, Oncology and Immunology,
ul. Samory Mashela, 1, Moscow, 117997 Russia
c Center for Theoretical Problems of Physicochemical Pharmakology,
ul. Average Kalitnikovskaya, 30, Moscow, 109029 Russia
*e-mail: shikh1961@yandex.ru
Received November 18, 2021; revised December 13, 2021; accepted December 18, 2021
It was found that the reduction of 4,4,6-trimethyl-4H-pyrrolo[3,2,1-ij]quinoline-1,2-diones with an aqueous
solution of hydrazine hydrate proceeds selectively at the β-carbonyl group and leads to the corresponding
4,4,6-trimethyl-4H-pyrrolo[3,2,1-ij]quinolin-2-ones for a few hours. The condensation of ones with aldehydes
and acetone proceeds with the formation of new 1-[(het)arylidene]- and 1-(propan-2-ylidene)-4H-pyrrolo[3,2,1-
ij]quinoline-2-ones with yields of 59-78%. The 1-{[(het)arylamino]methylene}-4H-pyrrolo[3,2,1-ij]quino-
lin-2-ones were synthesized by reaction of 4H-pyrrolo[3,2,1-ij]quinolin-2-ones with N,N-dimethylformamide
dimethyl acetal and subsequent transamination with primary amines with yields 65-83% .The anticoagulant
activity of the obtained compounds was studied using a model test of inhibition of activity against blood coag-
ulation factors Xa and XIa.
Keywords: 4H-pyrrolo[3,2,1-ij]quinolin-2-one, Wolf-Kizhner reaction, anticoagulant activity, factors Xa and
XIa
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022