ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2022, том 58, № 9, с. 1007-1011
КРАТКИЕ СООБЩЕНИЯ
УДК 547.92-542.022.1
СИНТЕЗ 1,2,3-[3,2-b]ТИАДИАЗОЛОВ
ДИПТЕРОКАРПОЛА И ХОЛЛОНГДИОНА
© 2022 г. И. Е. Смирнова*
Уфимский Институт химии - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
Россия, 450054 Уфа, просп. Октября, 71
*e-mail: si8081@yandex.ru
Поступила в редакцию 24.03.2022 г.
После доработки 10.04.2022 г.
Принята к публикации 14.04.2022 г.
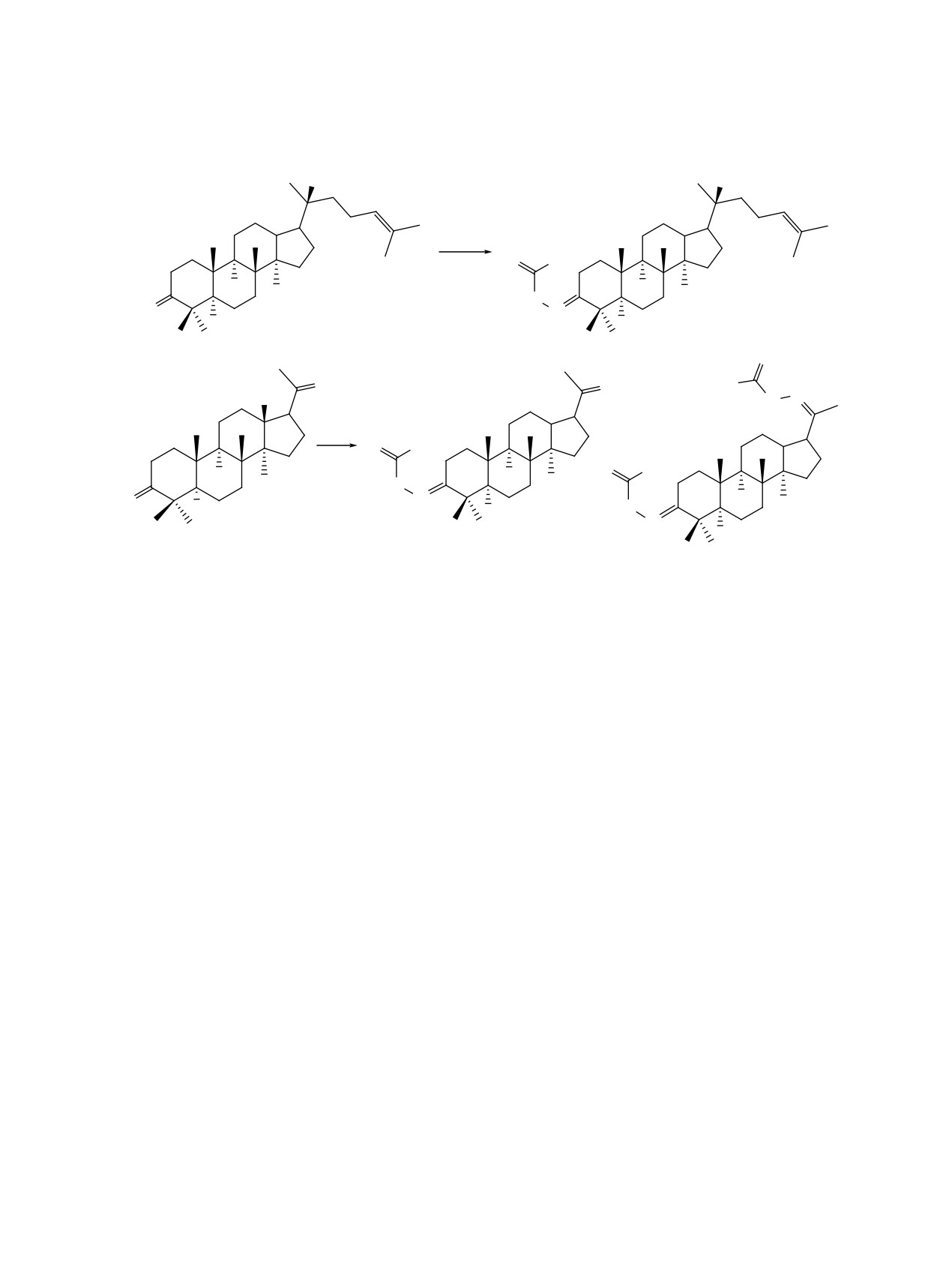
С использованием реакции Харда-Моури из 3-семикарбазонов диптерокарпола и холлонгдиона синте-
зированы новые тритерпеновые 1,2,3-тиадиазолы.
Ключевые слова: даммарановые тритерпеноиды, диптерокарпол, холлонгдион, реакция Харда-Моури,
1,2,3-тиадиазолы
DOI: 10.31857/S0514749222090105, EDN: JMSYNY
В последние годы внимание химиков сосредо-
ко порядков [6]. Гетероциклические производные
точено на синтезе пролекарств на основе метабо-
даммаранового тритерпеноида диптерокарпола с
литов растений, обладающих широким спектром
пиразиновым фрагментом обладали противови-
биологической активности. Гетероциклические
русной активностью при низкой цитотоксичности
соединения, содержащие фрагменты оксо - и тиа-
[7]. Азепанодиптерокарпол проявил противорако-
диазола обладают разнообразной биологической
вую активность в отношении широкого спектра
активностью: противовоспалительной, антибак-
опухолевых клеток человека и противовирусное
териальной и антифунгицидной [1], что позволя-
действие в отношении вируса гриппа H1N1 [8, 9].
ет их широко использовать в фармацевтических и
Модификация кольца А тритерпеноидов и, в
агрохимических препаратах [2].
частности, диптерокарпола путем введения гете-
роциклических фрагментов является перспектив-
Конденсированные с различными гетероцикли-
ным направлением в поиске биологически актив-
ческими фрагментами по кольцу А тритерпенои-
ных соединений.
ды [2,3-изоксазолоцикломусаленон,
2,3-индоло-
луп-20(29)-ен-28-овая кислота и ее метиловый
В качестве исходных соединений использова-
эфир] обладают антидиабетической активностью
ли даммарановые тритерпеноиды - диптерокар-
[3]. 1,2,3-Тиадиазолы на основе бетулоновой кис-
пол 1, выделенный из смолы тропического дерева
лоты и бутилового эфира 3-оксоглицирретовой
Dipterocarpus alatus [10], и холлонгдион 2, полу-
кислоты описаны в работах [4, 5]. [2,3]-Пиразоло-
ченный из диптерокарпола 1 в несколько стадий
28-оксо-аллобетулон и 2,3-индоло-диптерокарпол
[11]. Конденсацией соединений 1 и 2 с гидрохло-
ингибировали фермент α-глюкозидазу со значени-
ридом семикарбазида в присутствии ацетата на-
ями IC50 6.14 и 37.5 μМ, превосходя по своему ан-
трия в этаноле получены С3 семикарбазоны 3-5 с
тидиабетическому действию акарбозу на несколь-
выходами 35-79% (схема 1). В случае холлонгди-
1007
1008
СМИРНОВА
Схема 1
OH
OH
i
O
NH2
H
H
HN
O
N
H
H
1
3, 79%
O
O
O
H2N
H
N
N
H
i
O
NH2
+
O
NH2
H
H
HN
O
N
H
H
HN
H
N
H
2
4, 51%
5, 35%
Ɋɟɚɝɟɧɬɵ ɢ ɭɫɥɨɜɢɹ i, NH2NHCONH2Â+&O $F21D (W2+
ɋ
она выделены моно и бис-замещенные семикарба-
С использованием реакции Харда-Моури на
зоны по положениям С3 или С3 и С20. Строение
основе даммарановых тритерпеноидов диптеро-
соединений
3-5 подтверждено методом ЯМР-
карпола и холлонгдиона синтезированы новые
спектроскопии. В спектрах ЯМР 13C соединений
1,2,3-тиадазолы.
3-5 сигналы С3 углеродных атомов наблюдались
Общая методика синтеза соединений 3-5.
при δ 162.70, 156.08 и 157.26 м.д., соответствен-
К раствору 0.44 г (1 ммоль) соединения 1 или
но, что указывает на образование единственного
0.36 г (1 ммоль) соединения 2 в 10 мл этанола до-
стереоизомера по положению С3. Сигналы атомов
бавляли при перемешивании 10 мл 1.2 М водно-
углерода карбонил-амидного фрагмента резони-
го раствора семикарбазида гидрохлорида, 0.5 г
ровали в области δ 179.09-177.98 м.д., в спектрах
NaОAc·3H2O и перемешивали при 40°С в течение
ЯМР 1Н сигналы протонов данного фрагмента
6 ч. Реакционную массу выливали в 100 мл воды,
обнаруживались в области δ 6.11-6.54 и 8.59-
выпавший осадок отфильтровывали, промыва-
9.05 м.д. в виде уширенных синглетов. В спектре
ли до нейтральной среды, сушили на воздухе,
ЯМР 13С бис-производного 5 сигнал углерода С20
остаток очищали колоночной хроматографией на
наблюдался при δ 163.73 м.д., сигналы атома С17
SiO2, элюент ПЭ-этилацетат, 10:1, 5:1, 1:1, СHCl3,
равной интенсивности резонировали при δ 55.53 и
СHCl3-этанол 40:1, соответственно.
55.49 м.д., что подтверждает образование диасте-
Диптерокарпол-3-семикарбазон
(3). Выход
реоизомеров по положению С20.
0.34 г (79%), Rf 0.51, т.пл. 119-120°С, [α]D20 +43.0°
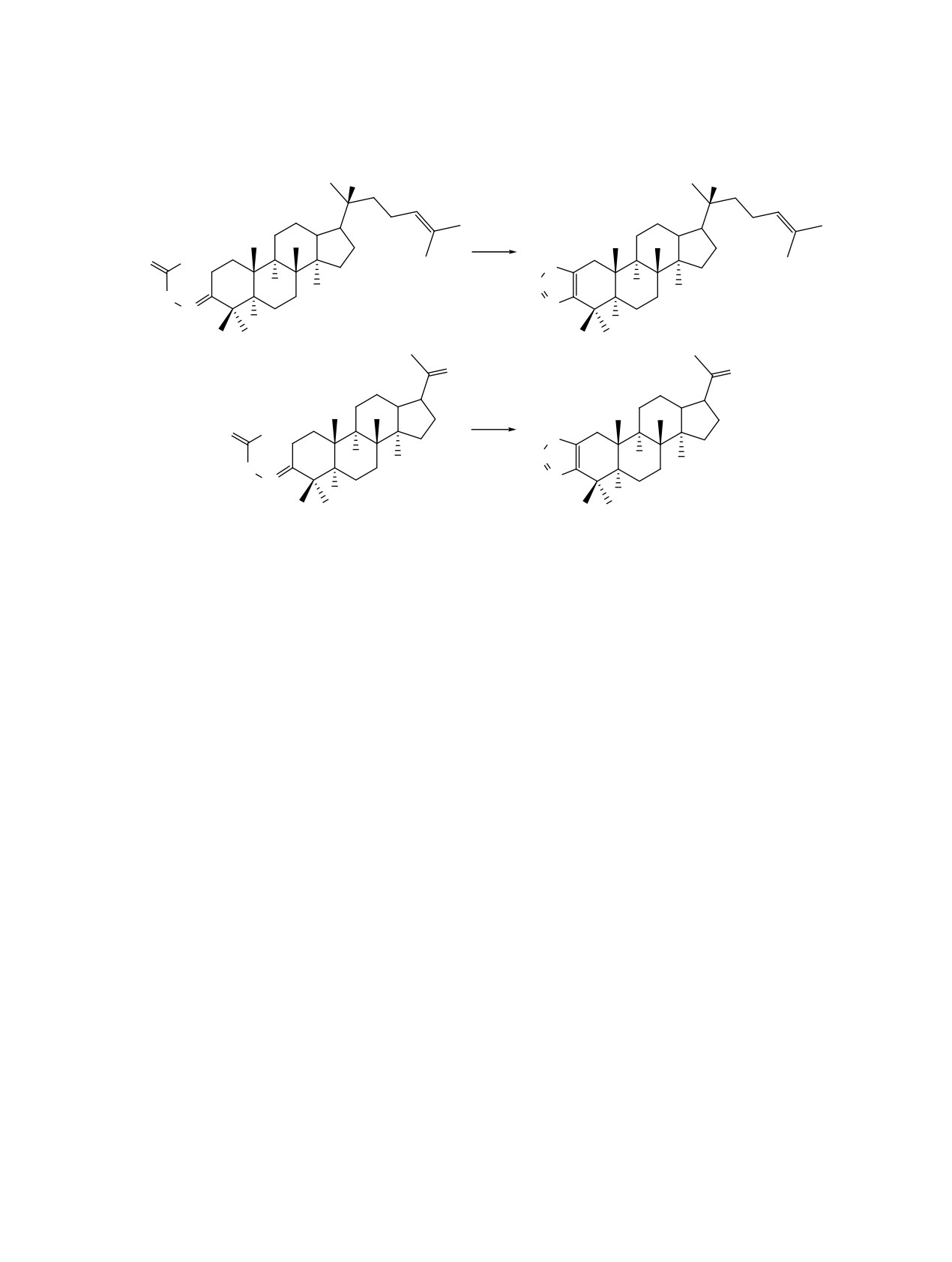
В условиях реакции Харда-Моури взаимодей-
(с 0.01, CHCl3). Спектр ЯМР 1Н (СDCl3), δ, м.д.:
ствие семикарбазонов 3, 4 с тионилхлоридом в
0.86, 0.90, 0.97, 1.02, 1.10, 1.61, 1.67 c (21H, 7CH3),
CH2Cl2 привело к образованию 1,2,3-[3,2-b]тиа-
1.12-2.42 м (26Н, СН, СН2), 2.23-2.45 м (2Н, С2Н2),
диазолов 6, 7 с выходами 75 и 62% (схема 2). В
5.12 м (1H, Н24, 3J24-23 7.1, 4J24-26 1.5, 3J24-27 1.5 Гц),
спектрах данных производных ЯМР 13C сигналы
6.21 уш.с (2Н, NH2), 8.63 уш.с (1Н, NH). Спектр
атомов углерода двойной связи С2-С3 резонирова-
ЯМР 13C (СDCl3), δ, м.д.: 15.31, 15.85, 16.33, 17.73,
ли в области δ 150.01-148.65 м.д.
19.59, 19.95, 21.93, 22.57, 23.28, 24.79, 25.49, 25.76,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
СИНТЕЗ 1,2,3-[3,2-b]ТИАДИАЗОЛОВ ДИПТЕРОКАРПОЛА И ХОЛЛОНГДИОНА
1009
Схема 2
OH
OH
i
O
NH2
S
H
N
H
HN
N
N
H
H
3
6, 75%
O
O
i
O
NH2
S
H
N
H
HN
N
N
H
H
4
7, 62%
Ɋɟɚɝɟɧɬɵ ɢ ɭɫɥɨɜɢɹ
i, SOCl2, CH2Cl2
ɋ
28.40, 31.12, 34.64, 36.92, 38.77, 40.27, 40.33, 40.48,
(C20), 177.98 (NHCONH2), 178.20 (NHCONH2).
41.87, 42.30, 49.75, 49.99, 50.27, 55.51, 131.68 (C24),
Найдено, %: C 65.84; H 9.15; N 17.11; С26Н44N6O2.
124.66 (C25), 75.39 (C20), 179.09 (NHCONH2),
Вычислено, %: C 66.07; H 9.38; N 17.78. M 472.35.
162.70 (C3). Найдено, %: C 74.24; H 10.25; N 8.11;
Общая методика синтеза соединений 6, 7. К
С31Н53N3O2. Вычислено, %: C 74.50; H 10.69; N
раствору 0.50 г (1 ммоль) соединения 3 или 0.42 г
8.41. M 499.41.
(1 ммоль) 4 в 20 мл сухого СH2Cl2 добавляли
Холлонгдион-3-семикарбазон (4). Выход 0.18 г
1.45 мл (2 ммоль) свежеперегнанного SOCl2 и пе-
(51%), Rf 0.35, т.пл. 100-101°С, [α]D20 +10.0° (с 0.01,
ремешивали при комнатной температуре в течение
CHCl3). Спектр ЯМР 1Н (СDCl3), δ, м.д.: 0.72, 0.89,
4 ч. В реакционную массу добавляли 5 мл H2O,
0.96, 1.00, 1.02 c (15H, 5CH3), 1.09-2.61 м (20Н, СН,
промывали Na2CO3 (3×10 мл), H2O (3×10 мл) до
СН2), 2.11 c (3H, C21H3), 6.48 уш.с (2Н, NH2), 8.59
нейтральной среды, органический слой сушили
уш.с (1Н, NH). Спектр ЯМР 13C (СDCl3), δ, м.д.:
над CaCl2, упаривали в вакууме, остаток очищали
15.29, 15.96, 16.07, 20.05, 21.72, 25.13, 25.53, 25.58,
колоночной хроматографией на SiO2, элюент ПЭ-
25.96, 26.70, 28.44, 30.02, 34.05, 34.75, 38.84, 39.92,
этилацетат 40:1, 20:1, 10:1, соответственно.
45.10, 45.31, 50.02, 50.10, 55.34, 55.53, 156.08 (C3),
178.83 (NHCONH2), 212.22 (C20). Найдено, %: C
1,2,3-Тиадиазоло[3,2-b]диптерокарпол
(6).
71.97; H 9.76; N 10.01; С25Н41N3O2. Вычислено, %:
Выход 0.38 г (75%), Rf 0.75, т.пл. 78-80°C, [α]D20
C 72.25; H 9.94; N 10.11. M 415.32.
+35.0° (с 0.01, CHCl3). Спектр ЯМР 1H (СDCl3), δ,
м.д.: 0.80, 0.91, 0.98, 1.06, 1.12, 1.57, 1.62 c (21H,
Холлонгдион-3,20-дисемикарбазон (5). Выход
7CH3), 1.20-2.50 м (26H, CH, CH2), 5.10-5.14 м
0.13 г (35%), Rf 0.25, т.пл. 111-112°С, [α]D20 +25.0°
(с 0.01, CHCl3). Спектр ЯМР 1Н (СDCl3), δ, м.д.:
(1H, H24). Спектр ЯМР 13C (СDCl3), δ, м.д.: 14.77,
0.82, 0.86, 0.96, 1.01, 1.03 c (15H, 5CH3), 1.12-2.48
15.98, 16.32, 17.74, 20.39, 22.27, 22.29, 22.57, 23.54,
м (23Н, СН, СН2), 6.85 уш.с (2Н, NH2), 7.15 уш.с
24.80, 25.36, 25.77, 27.64, 29.41, 31.15, 33.40, 34.10,
(2Н, NH2), 9.10 уш.с (1Н, NH), 9.10 уш с (1Н, NH).
37.54, 40.60, 42.40, 45.18, 48.37, 49.79, 50.43, 53.25,
Спектр ЯМР 13C (СDCl3), δ, м.д.: 15.08, 15.19, 15.59,
75.41 (C20), 124.70 (C24), 131.65 (C25), 149.70 (С2),
15.81, 19.47, 21.64, 22.90, 25.02, 26.41, 28.12, 31.45,
153.58, (C3). Найдено, %: C 74.01; H 9.75; N 5.63;
34.81, 36.91, 38.82, 39.72, 40.40, 41.79, 45.31, 48.90,
C30H48N2O5. Вычислено, %: C 74.33; H 9.98; N
49.39, 50.14, 55.49 и 55.53 (С17), 157.26 (C3), 163.73
5.78. M 484.35.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
1010
СМИРНОВА
1,2,3-Тиадиазоло[3,2-b]холлонгдион (7). Вы-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ход 0.26 г (62%), Rf 0.83, т.пл. 90-92°C, [α]D20 +43.0°
Смирнова Ирина Евгеньевна, ORCID: https://
(с 0.01, CHCl3). Спектр ЯМР 1H (СDCl3), δ, м.д.:
orcid.org/0000-0001-7176-505X
0.76, 0.80, 0.92, 0.96, 1.01, 1.69 с (15Н, 5СН3), 1.09-
КОНФЛИКТ ИНТЕРЕСОВ
1.76 м (6Н, СН, СН2), 1.80-2.01 м (12Н, СН, СН2),
2.13 с (3H, C21H3). Спектр ЯМР 13С (СDCl3), δ,
Автор заявляет об отсутствии конфликта инте-
м.д.: 15.55, 15.78, 15.93, 17.14, 18.98, 21.47, 22.77,
ресов.
24.73, 25.49, 26.05, 27.21, 31.64, 34.94, 37.12, 38.22,
СПИСОК ЛИТЕРАТУРЫ
38.94, 40.14, 40.42, 44.95, 46.22, 50.31, 55.77 (С17),
148.65 (С2), 150.01 (C3). Найдено, %: С 71.58; H
1. Fan Z.J., Liu B., Liu X.F., Zhong B., Liu C.L., Li Z.M.
8.92; N 6.76. C24H36N2O2. Вычислено, %: С 71.95;
Chem. J. Chin. Univ. 2004, 25, 663-666.
H 9.06; N 6.99.
2. Hu D.Y. Song B.A., He W. Chin. J. Synth. Chem.
2006, 14, 319-328.
Температуры плавления определяли на ми-
3. Smirnova I.E., Kazakova O.B., Do Quoc Viet,
кростолике
«Boetius». Оптическое поглощение
Nguyen Thi Thu, Pham Thyu Linh, Do Thi Thu Huong.
измеряли на поляриметре
«Perkin-Elmer
241
Med. Chem. Res. 2015, 24, 2177-2182. doi 10.1007/
MC» (Германия) в трубке длиной 1 дм. ТСХ-
s00044-014-1292-6
анализ проводили на пластинках Сорбфил (ЗАО
4. Flekhter O.B., Tret’yakova E.V., Medvedeva N.I.,
Сорбполимер, Россия), используя систему раство-
Baltinax L.A., Galin F.Z., Tolstikov G.A., Baku-
рителей хлороформ-этилацетат, 40:1. Вещества
lev V.A. Rus. J. Org. Chem. 2004, 40, 90-92. doi
обнаруживали 10% раствором серной кислоты с
10.1002/chin.200437186
последующим нагреванием при 100-120°С в тече-
5. Baltina L.A., Shayakhmetova D.M., Baltina, L.A.,
ние 2-3 мин. Элементный анализ осуществляли на
Nugumanov, T.R. Chem. Nat. Compd. 2019, 55, 692-
СHNS-анализаторе EuruEA-3000, основной стан-
695. doi 10.1007/s10600-019-02780-x
дарт ацетанилид. Колоночную хроматографию
6. Khusnutdinova E.F., Smirnova I.E., Giniyatullina G.V.,
проводили на SiO2 (Silica 60, Macherey-Nagel).
Medvedeva N.I., Yamansarov E.Yu., Kazakov D.V.,
Спектры ЯМР 1Н и 13С и зарегистрированы на
Kazakova O.B., Pham Thuy Linh, Do Quoc Viet,
Do T.H. Nat. Prod. Comm. 2016, 11, 33-35. doi
импульсном спектрометре «Bruker» Avance III с
10.1177/1934578X1601100112
рабочей частотой 500.13 (1H) и 125.47 (13C) МГц
7. Zorina A.D., Nikiforova N.S., Zarubaev V.V., Marchen-
с использованием 5 мм датчика с Z-градиентом
ko S.A., Selivanov S.I., Starova G.L., Mehtiev A.R.,
PABBO при постоянной температуре образца
Rodionov E.I., Rodionova A.A., Trifonov R.E.
298 K. Химические сдвиги в спектрах ЯМР 1Н и
Mendeleev Commun. 2019, 29, 500-502. doi 10.1016/
13С приведены в м.д. относительно сигнала вну-
j.mencom.2019.09.007
треннего стандарта тетраметилсилана (ТМС).
8. Смирнова И.Е., Петрова А.В., Казакова О.Б. ХПС.
ЗАКЛЮЧЕНИЕ
2019, 55, 760-765. [Smirnova I.E., Petrova A.V.,
Kazakova O.B. Chem. Nat. Compd. 2019, 55, 883-
На основе даммарановых тритерпеноидов с
889.] doi 10.1007/s10600-019-02838-w
использованием реакции Харда-Моури осущест-
9. Smirnova I, Petrova A., Lobov A., Minnibaeva E.,
влен синтез 1,2,3-тиадиазолов диптерокарпола и
Tran Thi Phoung T., Tran Van L., Khine M.M., Esaul-
холлонгдиона.
kova I., Slita A., Zarubaev V., Kazakova O. J. Antibiot.
2022. doi 10.1038/s41429-022-00514-w
БЛАГОДАРНОСТИ
10. Do T.T.H., Tran T.T.T., Tran T.H., Nguyen T.T.,
Спектры ЯМР 1H, 13C получены с использова-
Nguyen Q.T., Smirnova I.E., Kazakova O.B., Minnibae-
нием оборудования Центра коллективного пользо-
va E.M., Tolstikov G.A. Chem. Nat. Compd. 2013, 49,
вания «Химия» и «Агидель» УФИЦ РАН.
58-65. doi 10.1007/s10600-013-0505-4
11. Smirnova I.E., Kazakova O.B., Do T.T.H, Minnibae-
ФОНДОВАЯ ПОДДЕРЖКА
va E.M., Lobov A.N., Suponitsky K.Yu. Nat.
Работа выполнена по теме Госзадания
Prod. Comm.
2014,
9,
1417-1420. doi
10.1177/
№ 1021062311392-9-1.4.1.
1934578X1400901005
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022
СИНТЕЗ 1,2,3-[3,2-b]ТИАДИАЗОЛОВ ДИПТЕРОКАРПОЛА И ХОЛЛОНГДИОНА
1011
Synthesis of 1,2,3-[3,2-b]Thiadiazoles
of Dipterocarpol and Hollongdione
I. E. Smirnova*
Ufa Institute of Chemistry of the Ufa Federal Research Centre of the Russian Academy of Science,
prosp. Octyabrya, 71, Ufa, 450054 Russia
*e-mail: si8081@yandex.ru
Received March 24, 2022; revised April 10, 2022; accepted April 14, 2022
Using the Hurd-Mori reaction, new triterpene 1,2,3-thiadiazoles were synthesized from 3-semicarbazones of
dipterocarpol and hollongdione.
Keywords: dammarane triterpenoids, dipterocarpol, hollongdione, Hurd-Mori reaction, 1,2,3-thiadiazole
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 58 № 9 2022