ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 1, с. 7-37
ОБЗОРНАЯ СТАТЬЯ
УДК 547.443
НОВЫЕ НАПРАВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
В СИНТЕЗЕ ПОЛИГЕТЕРОЦИКЛИЧЕСКИХ
СОЕДИНЕНИЙ
© 2023 г. А. В. Великородовa, b, *, А. С. Зухайраеваb, Э. Н. Кутлалиеваa, b,
Е. А. Шустоваb, С. Б. Носачевa
a ФГБОУ ВО «Астраханский государственный университет», Россия, 414000 Астрахань, пл. Шаумяна, 1
b ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России,
Россия, 414000 Астрахань, ул. Бакинская, 121
*e-mail: avelikorodov@mail.ru
Поступила в редакцию 27.03.2022 г.
После доработки 05.04.2022 г.
Принята к публикации 13.04.2022 г.
В обзоре продемонстрированы новые направления применения нингидрина в качестве универсального
реагента в органическом синтезе для конструирования широкого ряда полициклических соединений
с бензофурановым, пирролиновым, пиррольным, имидазольным, пиримидиновым, пропеллановым и
другими фрагментами.
Ключевые слова: нингидрин, мультикомпонентные реакции, аддукты нингидрина с фенолами, ами-
нами, енаминами, N-гидроксимочевинами, N,N'-диалкилмочевинами, N-алкокси-N'-арилмочевинами,
имидазо[1,5-a]пиридинами
DOI: 10.31857/S0514749223010019, EDN: PEVSCV
ВВЕДЕНИЕ
1. СИНТЕЗ ПОЛИГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ НА ОСНОВЕ МУЛЬТИКОМПОНЕНТНЫХ
РЕАКЦИЙ С УЧАСТИЕМ НИНГИДРИНА
2. СИНТЕЗ ПОЛИГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ НА ОСНОВЕ РЕАКЦИЙ НИНГИДРИНА С
ПРОИЗВОДНЫМИ АЛИФАТИЧЕСКИХ, АЛИЦИКЛИЧЕСКИХ, АРОМАТИЧЕСКИХ И ГЕТЕРОЦИКЛИЧЕСКИХ
СОЕДИНЕНИЙ
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
онной способности. Наличие 3 последовательных
электроноакцепторных карбонильных групп, свя-
Дизайн и синтез различных молекулярных
занных с бензольным кольцом, делает эту молеку-
объектов с использованием вицинальных трикар-
лу очень интересной в структурном отношении,
бонильных соединений являются перспективной
областью исследования органической и меди-
вследствие чего растет интерес к её применению
цинской химии [1]. Среди других трикарбонилов
в мультикомпонентных реакциях для создания
нингидрин занимает особое положение благодаря
сложно построенных полициклических систем.
низкой стоимости, доступности и высокой реакци-
Некоторые из синтезированных соединений про-
7
8
ВЕЛИКОРОДОВ и др.
являют высокую биологическую активность и
ной связи, активируемое нитрогруппой в 3-ни-
обладают противоопухолевой, противовоспали-
тро-2-(трифторметил)- и 3-нитро-2-фенил-2H-хро-
тельной, антибактериальной и противовирусной
менах 1 при нагревании в EtOH. Эта реакция дает
активностью.
высокие выходы эндоспиро(хромено[3,4-a]пир-
Описано множество реакций нингидрина [2-4],
ролизидин-11,2'-инден)-1',3'-дионов 2 (схема 1),
представляющих интерес для медицинской химии.
приводящих к получению широкого ряда карбо- и
Образование региоизомерных аддуктов не проис-
гетероциклических соединений. В данном обзоре
основное внимание уделено современным дости-
ходит из-за неблагоприятного диполь-дипольного
жениям в области синтеза полигетероцикличе-
взаимодействия, возникающего между C=O и NO2
группами в переходном состоянии.
ских соединений на основе мультикомпонентных
реакций с участием нингидрина, а также на осно-
Конденсированные полициклические пирро-
ве реакций нингидрина с 1,3-дикарбонильными
лины являются одним из самых важных классов
соединениями, фенолами, аминами, енаминами,
гетероциклических соединений, являющихся ос-
N-гидроксимочевинами, N,N'-диалкилмочевинами,
новой многих лекарственных препаратов, напри-
N-алкокси-N'-арилмочевинами, имидазо[1,5-a]пи-
мер, пеметрекседа, моксифлоксацина и зопиклона,
ридинами и другими соединениями.
которые проявляют противоопухолевую, антибак-
1. СИНТЕЗ ПОЛИГЕТЕРОЦИКЛИЧЕСКИХ
териальную или обезболивающую активность [7].
СОЕДИНЕНИЙ НА ОСНОВЕ
Инданоны проявляют противоопухолевые, ан-
МУЛЬТИКОМПОНЕНТНЫХ РЕАКЦИЙ
тигипертензивные, противоаллергические свой-
С УЧАСТИЕМ НИНГИДРИНА
ства и др. Полигидроксилированные инденопир-
Мультикомпонентные реакции являются эф-
ролы действуют как мощные ингибиторы гликози-
фективным инструментом конструирования слож-
даз, интеркаляторы ДНК и являются эстрогенны-
но построенных соединений, в которых нинги-
ми средствами [8].
дрину принадлежит роль привилегированного
Сообщалось об удобном one-pot синтезе но-
синтона [5]. Такие реакции могут приводить к об-
вых полизамещенных производных 2-ариламино-
разованию конденсированных с инденовым фраг-
дигидроксиинденопирролов 4 трехкомпонентной
ментом гетероциклов, спироинданонсодержащих
реакцией нингидрина, N-метил-1-(метилтио)-
N-гетероциклов, спироинденопиранов, инденохи-
2-нитроэтенамина (3) и ароматических аминов
наксолинов, спироинденохиноксалинсодержащих
(схема 2), предложен вероятный механизм ре-
гетероциклов, пропелланов и ряда других соеди-
акций, включающий образование интермедиа-
нений.
тов А-С [9].
Проведено
[6] регио- и стереоселективное
1,3-диполярное циклоприсоединение стабилизи-
Данный процесс характеризуется мягкими ус-
рованных азометинилидов, образованных in situ
ловиями реакции, использованием легкодоступ-
из нингидрина и пролина, происходящее по двой-
ных реагентов, отсутствием катализаторов, корот-
Схема 1
O
O
R'
NO2
OH
N
EtOH
O
+
+
H
R'
O R
N CO2H
50°C, 1 ɱ
H
OH
H2O, CO2
NO2
R"
O
O
R
R"
1
2, 84-90%
R = CF3; R', R" = H, Me, MeO, EtO, Cl, Br, NO2.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПРАВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
9
Схема 2
O
O
O
O
OH
OH N+
SMe
SMe
O
O
+
H
O
HN
CH3
SMe
2N
O
NO2
N
N
HO
O
CH3
CH
3
3
A
B
O
O
O
O
OH
OH
N
N
ArNH2
O
O
MeSH
NH
HO
N
NHAr
HO
N
SMe
Ar
H3C
H3C
C
4, 67-85%
кой продолжительностью реакции и хорошими
минона H, который реагирует с нингидрином с
выходами.
образованием интермедиата I, циклизующегося в
индено[1,2-b]пиррол 8.
Удалось разработать [10] удобный и эффек-
тивный метод синтеза новых индено[1,2-b]-
Трехкомпонентная реакция нингидрина, 2-гид-
фуран-3-карбоксамидов 6 и индено[1,2-b]пиррол-
рокси-1,4-нафтохинона и гетероароматических
3-карбоксамида 8 из легкодоступных исходных
аминов в отсутствие растворителя и катализато-
компонентов. Оба one-pot процесса выполняются
ра при нагревании в течение 10-60 мин при 75°С
в нейтральных условиях в отсутствие катализа-
приводит к получению производных 1,3-диок-
торов и приводят к образованию соответственно
со-2,3-дигидро-1Н-инден-2-ил)нафталин-1,4-ди-
индено[1,2-b]фурана
6 и индено[1,2-b]пирро-
онов 9a-j c выходом 80-87% (схема 4) [11].
ла 8. Предложен вероятный механизм реакции
Разработан удобный трехкомпонентный синтез
(схема 3).
индено[1,2-b]пиррол-4(1H)-онов 10a-g, основан-
Первая стадия начинается с нуклеофильного
ный на реакции нингидрина с 1,3-дикарбонильны-
ми соединениями и первичными аминами в при-
присоединения аминогруппы к 4-метилиденоксе-
сутствии PPh3 в MeCN при комнатной температу-
тан-2-ону (5) с последующим раскрытием цикла
ре (схема 5) [12].
и переносом водорода с образованием оксобута-
намида D, который находится в равновесии с ено-
Вероятный механизм образования соединений
лом E, атакующем карбонильную группу в нинги-
10a-g был предложен на примере пиррола 10a.
дрине с образованием интермедиата F, который в
Енаминон J, образующийся из пентан-2,4-диона
свою очередь подвергается таутомеризации в со-
и метиламина, как нуклеофил атакует нингидрин
единение G, гетероциклизующееся в индено[1,2-
с образованием интермедиата K, который после
b]фуран 6.
элиминирования воды превращается в интермеди-
ат L. Реакция интермедиата L с PPh3 дает цвит-
Первой стадией синтеза индено[1,2-b]пир-
тер-ион M, отщепление от которого трифенилфос-
рол-3-карбоксамидов 8 является нуклеофильное
финоксида приводит к образованию продукта 14a
присоединение амина к 4-метилиденоксетан-2-
(схема 6).
ону (5) с последующим раскрытием цикла и пере-
носом протона с образованием оксобутанамида D.
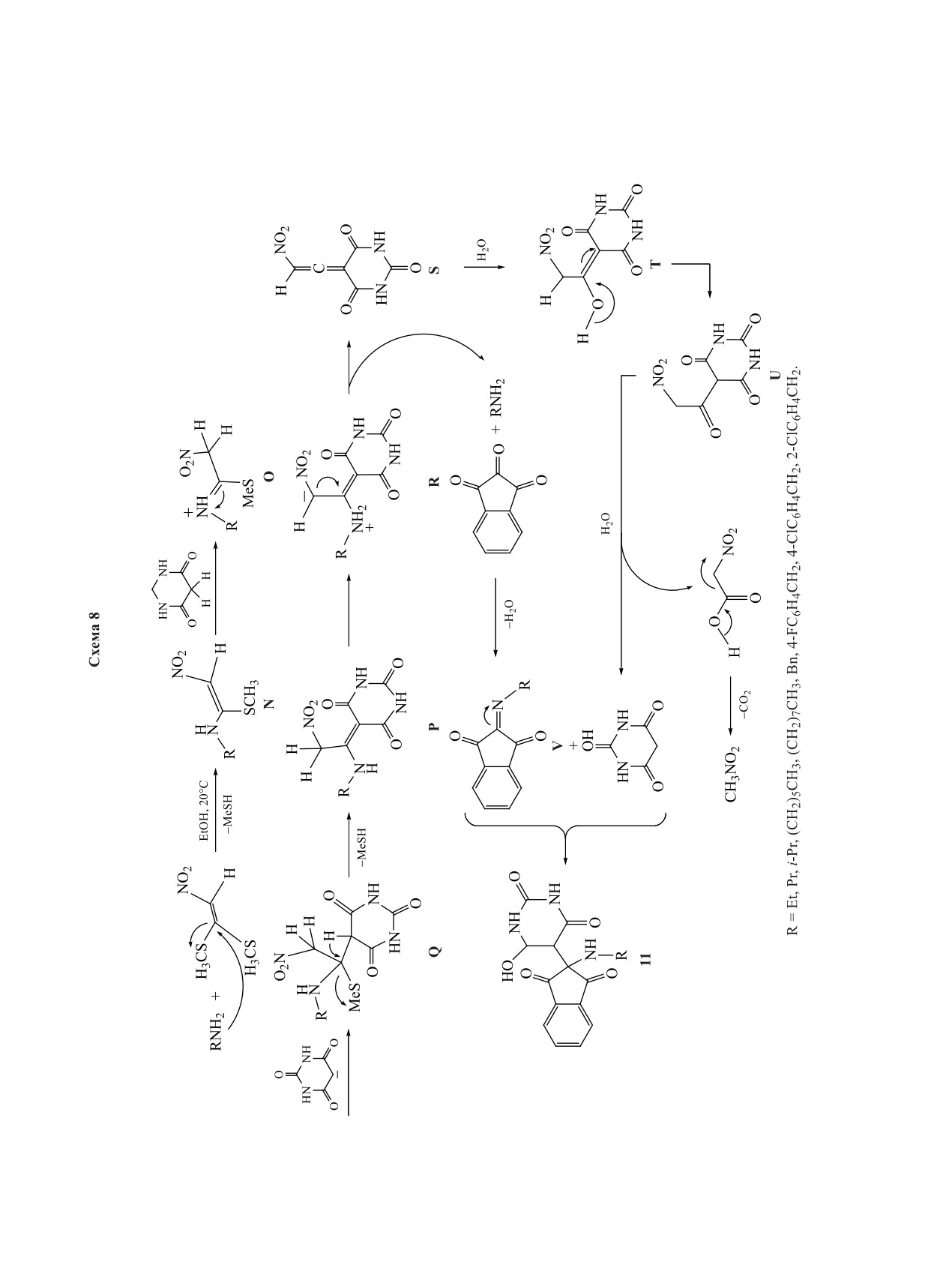
Осуществлена [13] one-pot реакция между пер-
Далее другой первичный амин 7 конденсируется
вичными аминами,
1,1-бис(метилтио)-2-нитро-
с кетоновым фрагментом с образованием β-ена-
этеном, нингидрином и барбитуровой кислотой
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
10
ВЕЛИКОРОДОВ и др.
Схема 3
Me
O
R
O
O
Me
R
HO
O
NH
N
HO
Me
OH
HO
H
O
O
O
O
O
OH
O HN
R
6, 73-91%
G
F
O
R NH2
O
O
O
O
+
OH
O
O
R
R
O
Me
N
Me
N
H
H
5
D
E
R'
NH2
7
R'
R'
N
O
NH
O
R
R
Me
N
Me
N
H
H
H
O
R'
R'
NH
O
HO
O
R
N
Me
Me
NH
O
HO
O
O
OH
O
O
HN
R
I
8, 74-81%
R = i-Bu, Et, Bu, ɰɢɤɥɨ ɋ5ɇ9, Bn, Pr; R' = Pr, Bu, Et, i-Bu.
Схема 4
O
O
Het
O
OH
OH
O
OH
NH
+
+ HetNH2
OH
O
O
O O
9a-j
+HW
ɦɟɬɢɥɩɢɪɢɧ ɢɥ a ɩɢɪɢɞɢɧ ɢɥ b ɦɟɬɢɥɩɢɪɢɞɢɧ ɢɥ ɫ),
ɦɟɬɢɥɩɢɪɢɞɢɧ ɢɥ d ɩɢɪɢɞɢɧ ɢɥ ɟ ɩɢɪɢɞɢɧ ɢɥ f ɝɢɞɪɨɤɫɢɩɢɪɢɞɢɧ
ɢɥ g),
ɩɢɪɢɦɢɞɢɧ ɢɥ h), 1ɇ ɛɟɡɢɦɢɞɚɡɨɥ ɢɥ i
ɬɢɚɡɨɥ ɢɥ j).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
11
Схема 5
1
O
O R
O
OH
O O
PPh
3
+
+ R2NH
2
MeCN
OH
Me
R1
Me
3 ɱ
N
O
R2
10a-g, 78-92%
R1 = R2 = Me (a); R1 = Me, R2 = Et (b); R1 = Me, R2 = Ph (c); R1 = Me, R2 = Bn (d); R1 = Me,
R2 = 4-MeOC6H4CH2 (e); R1 = OEt, R2 = ɧ-Pr (f); R1 = OEt, R2 = 4-MeOC6H4 (g).
в качестве енолизуемого C-H-активированного
ем стабильного енолята и интермедиата O, взаи-
соединения, которая обеспечивает простой метод
модействие между которыми приводит к интерме-
получения
5-[2-(алкиламино)-1,3-диоксо-2,3-ди-
диату P, а последующее элиминирование CH3SH
гидро-1H-инден-2-ил]-6-гидроксипиримидин-2,4-
приводит к интермедиату Q. Соединение Q за счет
(1H,3H)-диона (11) (схема 7).
переноса протона при участии амина превращает-
ся в промежуточное соединение R, а последующее
Образование продукта 11, возможно, происхо-
отщепление амина дает интермедиат S, который
дит в соответствии с механизмом, показанным на
при участии воды вначале превращается в нитро-
схеме 8.
енол T, а затем в α-нитрокетон U, гидролизую-
Интермедиат N может депротонировать кислот-
щийся до барбитуровой кислоты и нитрометана.
ный водород барбитуровой кислоты с образовани-
Высвободившийся первичный амин конденсиру-
Схема 6
O
O O
O NHMe
OH
+ CH3NH2
+
Me
Me
Me
Me
OH
O
J
O Me
O Me
Me
NMe
Me
NMe
OH
O
O
+ PPh3
O
O
H2O
K
L
O
Me
Me
Ph3P+
N Me
10a, 92%
O
P=O
Ph3
O
M
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
12
ВЕЛИКОРОДОВ и др.
Схема 7
HO
O
O
NH
O
O
MeS SMe
OH
EtOH, 20°C
NH
RNH2
+
+
+
HN NH
MeSH
OH
H NO2
CH3NO2
NH O
O
O
O
O R
11, 67-92%
R = Et, Pr, i-Pr, (CH2)5Me, (CH2)7Me, Bn, 4-FC6H4CH2, 4-ClC6H4CH2, 2-ClC6H4CH2.
ется с более реакционноспособным центром в по-
Вероятный механизм включает взаимодействие
ложении 2 нингидрина с образованием основания
амина с диэфиром с образованием промежуточ-
Шиффа V. Далее барбитуровая кислота присоеди-
ного енаминэфира Y, который подвергает нукле-
няется к интермедиату V с получением целевого
офильной атаке карбонильную группу в положе-
соединения 11.
нии 2 нингидрина с образованием интермедиа-
та Z, при дегидратации которого образуется интер-
Новый удобный метод синтеза [14] пента-
медиат A', превращающийся в результате внутри-
циклических азотсодержащих гетероциклов
12
молекулярной циклизации в целевой продукт 13
основан на последовательной реакции о-фени-
(схема 12).
лендиамина, арилизотиоцианата и нингидрина.
Синтетическая стратегия, включающая образова-
Для получения индено[1,2-b]индолона 14 был
ние N,N'-дизамещенного тиоамида W в качестве
использован композит (C@TiO2-SO3H-IL1) в
интермедиата, является экологически чистой, про-
присутствии ионной жидкости. Реакцию нинги-
стой и позволяет получить продукты с хорошим
дрина, анилина и димедона в воде осуществляли
выходом с использованием дешевых и коммерче-
в присутствии вышеупомянутого катализатора
ски доступных реагентов (схема 9).
(схема 11) [17]. Этот недавно разработанный ката-
лизатор показал высокую активность и стабиль-
Вероятный механизм реакции образования со-
ность в воде, а также обеспечивал отличный выход
единения 12а показан на схеме 10.
продукта. Экологически безопасный метод позво-
Промежуточное соединение W, образованное
ляет легко регенерировать катализатор после 5 ци-
из о-фенилендиамина и фенилизотиоцианата,
клов работы без значительной потери активности.
легко реагирует с нингидрином с образованием
содержащего 2 нуклеофильных и 2 электрофиль-
Использована простая one-pot четырехкомпо-
ных центра интермедиата X, который подвергает-
нентная реакция нингидрина, первичного амина,
ся гетероциклизации с получением продукта 12а
хлорангидрида и тиоцианата аммония для получе-
[15]. При R1 = H, Cl или Me и R2 = H; R3 = Cl или
ния производного инденотиазола 15 в отсутствие
R1 = H, Cl и R2 = Cl; R3 = Cl образуется только
растворителя (схема
11)
[18]. Предполагаемый
один тиоамид, который является не очень актив-
механизм этого превращения представлен на
ным и действует региоселективно при реакции с
схеме 13.
нингидрином с образованием только одного про-
Первоначально реакция тиоцианата аммония
дукта. При R1 = Me, R2 = R3 = Cl нуклеофильный
и хлорангидрида, вероятно, приводит к образова-
и электрофильный центры являются активными,
нию алканоилизотиоцианата B', который подвер-
что обуславливает возможность образования
2
гается нуклеофильной атаке амином с образовани-
тиоамидов и 2 продуктов реакции.
ем тиомочевины C'. Далее тиомочевина C' атакует
Синтезирован [16] дигидроинденопиррол
13
атом углерода карбонильной группы в положении
взаимодействием нингидрина, анилина и диэти-
2 нингидрина с образованием интермедиата D',
лацетилендикарбоксилата в смеси ПЭГ-400-вода
который подвергается гетероциклизации в инде-
(схема 11).
нотиазол 15.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
13
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
14
ВЕЛИКОРОДОВ и др.
Схема 9
R3
O
O
R
2
R2
1
R
NH2
HO
N
20°C
O
N S
+
C
W
OH
DCM
CH3CN, 20°C
S
NH
2
R3
N
R1
R1
12a-i, 90-97%
R1 = R2 = R3 = H (a); R1 = Cl, R2 = R3 = H (b); R1 = Me, R2 = R3 = H (c); R1 = R2 = H, R3 = Cl (d);
R1 = R3 =Cl, R2 = H (e); R1 = Me, R2 = H, R3 = Cl (f); R1 = H, R2 = R3 = Cl (g);
R1 = R2 = R3 = Cl (h); R1 = Me, R2 = R3 = Cl (i).
Разработан метод синтеза спироинденопирро-
ции нингидрина с пролином или саркозином и
лидинов 16a-k, заключающийся во взаимодей-
N-алкилэтинилазаиндолом в качестве диполяро-
ствии халкона с нитротиофеновым фрагментом,
фила (схема 15) [20].
нингидрина и саркозина в отсутствие растворите-
Предложен простой «зеленый» one-pot способ
ля при микроволновом облучении (схема 14) [19].
получения спиропирролизидинового гетероцик-
Успешно получен спиропирролидиновый ске-
ла 19 на основе хинолона с помощью последова-
лет с азаиндольным фрагментом 17, 18 по реак-
тельной четырехкомпонентной реакции нингидри-
Схема 10
NCS
NH2
NH2
N
NH NH
CH2Cl2
+
20°C
S
S
NH2
NH2
NH2
W
O
O
O
O
O
W
+
O
NH
NH
NH
O NH2 NH
HO
NH
O
S
S
O
O
HN
S
O NH
O
12a
HN
H2O
N
S
NH
N
X
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
15
Схема 11
O
HO
EtOOC
N OH
EtOOC
Ar
13, 76-97%
Ar = C6H5, 3-MeC6H4, 4-MeC6H4, 4-i-PrC6H4, 4-t-BuC6H4, 3,4-Me2C6H3,
4-MeOC6H4, 4-ClC6H4, 4-BrC6H4, 3-(COOH)C6H4, 4-(COOH)C6H4, 3-NO2C6H4.
COOEt
NH2
ɉɗȽ-400 ɜɨɞɚ, 2 ɱ
Ar
COOEt
O
OH
O
OH
O
Me
RNH2
O
NH4SCN
O
R1
Cl
Me
R NH2
C@TiO2-SO3H-IL1
70°C, 8 ɱ
O, 60°C, 1 ɱ
H2
O
O
O
HO
OH
Me
S
N
OH
HO
N
Me
NR
R
14, 90-93%
O R1
15, 75-95%
R = C6H5, 4-MeC6H4, 4-MeOC6H4, 2-OMeC6H4.
= C6H5, 4-MeC6H4,
R = Me, Et, ɧ-Bu, t-Bu; R1
4-MeOC6H4, 4-BrC6H4, t-Bu.
на, L-пролина, 2-хлорхинолин-3-карбальдегида и
Предложен интересный подход к получению
трифенилфосфанилидена (схема 15) [21].
спироинданонпирролидина 21, конденсированно-
го с нитрокумарином, основанный на трехкомпо-
Использование хромен-3-карбальдегида вместо
нентной реакции нингидрина, L-пролина/пипеко-
2-хлорхинолин-3-карбальдегида давало соответ-
линовой кислоты и 2-фенилнитрохромена в каче-
ствующий спиропирролизидиновый гетероцикл 20
стве диполярофила (схема 16) [22]. Этот простой
с хроменовым фрагментом (схема 15). Реакция
метод демонстрирует образование циклоаддук-
протекает с высокой диастереоселективностью.
тов 21 с отличной регио- и стереоспецифичностью
Предложен вероятный механизм реакции, включа-
при микроволновом облучении, а также при обыч-
ющий реакцию Виттига с соответствующими аль-
ном нагреве.
дегидами, приводящими к образованию халконов,
которые далее реагируют в качестве диполярофи-
Спироинданон, конденсированный с пирроли-
лов с азометинилидами, образующимися в резуль-
зином и циклопропановой системой 22, содержа-
тате реакции нингидрина с L-пролином, с получе-
щий 4 стереоцентра, получен с помощью реакции
нием желаемых продуктов 19, 20.
1,3-диполярного циклоприсоединения к цикло-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
16
ВЕЛИКОРОДОВ и др.
Схема 12
O
OH
O
COOEt
OH
H COOEt
Ar
OH NH2Ar
O
H+/+H+
+
NH2
EtOOC
NHAr
COOEt
COOEt
O COOEt
Y
Z
EtOOC
O
COOEt
HO
OH
OH NHAr
H+/+H+
N
H2O
Ar
COOEt
OH
O COOEt
O
A'
13
Ar = C6H5, 3-MeC6H4, 4-MeC6H4, 4-i-PrC6H4, 4-t-BuC6H4, 3,4-Me2C6H3, 4-MeOC6H4,
4-ClC6H4, 4-BrC6H4, 3-(COOH)C6H4, 4-(COOH)C6H4, 3-NO2C6H4.
Схема 13
O
S
O
NH4SCN
O
NH2 R
C
R
R1
N
N
R1
Cl
R1
N C S
H
H
B'
C'
O
OH
S
15
O
NR
HN
R1
O
D'
Схема 14
R
O
O
O
Hc
O
Hb
OH
MW
Hd
H
+
+
R
N
S
OH Me
OH
N
Me
S
NO2
O
O2N
O
HaO
16a-k, 78-92%
R = 4-Me (a), H (b), 4-OH (c), 4-Cl (d), 3-OH (e), 4-Br (f), 4-MeO (g), 4-F (h), 4-NO2 (i), 3-Br (j), 2-Cl (k).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
17
Схема 15
X
O Me
O
N
N
H
O
O
N
N
R
R
N
N
18, 69-78%
17, 37-79%
R = H, Me, Et, Bn.
X = CH2, S; R = H, Me, Et, Bn.
N
N
N
R
N
R
Me
OH
MeOH, 2 3 ɱ
N
MeOH, 2 3 ɱ
H
X
COOH
O
NH
O
OH
OH
Ph3P
O
COOH
O
COOH
N
H
N
Ph3P
O
H
O
CHO
CHO
R
O
EtOH
EtOH
R'
N Cl
R
O
O
OO
O
N
N O
O
R'
O
N Cl
20, 85%
19, 90-95%
R = H, Cl; R' = H, Me.
пропенам азометинилида, образованного с участи-
ческого альдегида с получением производных
ем нингидрина и L-пролина (схема 16) [23].
диспиропирролидина 23 (схема 16) [24]. Реакция
происходит быстро, завершается в течение 1-1.5 ч
Найдено, что наночастицы силиката магния
при микроволновом облучении. Синтезированные
(MgSiO3NPs) эффективно катализируют много-
соединения 23 проявляют антибактериальную и
компонентную реакцию нингидрина, саркозина,
антипролиферативную активность в отношении
N,N-диметилбарбитуровой кислоты и аромати-
протестированных клеточных линий.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
18
ВЕЛИКОРОДОВ и др.
Схема 16
O
n
N
2
NO
O
R3
H
N H
O
O
R4
Ph
R1
O Ph
R2
R1
NO2
Ph
Ph
21, 70-75%
22, 84%
R1 = H, Cl, OMe, Br, OH ;
O
Ph
Ph
R2 = H,OMe, OEt, Cl, Br;
R2
R3
R3 = R4 = H, OMe;
COOH
R4
ɩɪɨɥɢɧ n = 1);
EtOH, 80°C
N
10 ɱ
n
H
COOH
ɩɢɩɟɤɨɥɢɧɨɜɚɹ ɤɢɫɥɨɬɚ n = 2) MW
NH
O
OH
OH
O
O
NH
COOH
O
Me
S
O
O
MeN
CN
ArCHO
MgSiO3NPs
EtOH/MW
EtOH
O
N O
CN
Me
Me
O
O
O
S
O
O
N
O
N
O
Me
N
O
H2N CN
O
Ar
O
Me
24, 64%
23, 65-88%
Ar = C6H5, 2-NOC6H4, 4-NOC6H4, 2-MeC6H4, 4-BrC6H4, 2,3-F2C6H3, 3-Cl,4-OMeC6H3,
1-Cl,4-OPhC6H3, 2-Me,4-ClC6H3, 4-CNC6H4 ɩɢɪɢɞɢɧ ɢɥ ɛɢɮɟɧɢɥ
Новое производное спиротиопиранопира-
на, гидразингидрата и 1,4-диоксаспиро[4,5]дека-
на 24 получено по реакции дигидро-2H-тиопи-
нов 25а-е (схема 17) или (3Е,5Е)-3,5-диарилиден-
ран-3(4H)-он-1,1-диоксида, нингидрина и мало-
1-метилпиперидин-4-онов 26а-е (схема 18) в каче-
нонитрила (схема 16) [25]. Высокая реакционная
стве диполярофилов [26, 27].
способность кетосульфона обеспечивала высокую
В обоих случаях предложен механизм реак-
скорость образования продукта реакции 24.
ции, включающий образование азометинилида,
Синтезированы новые гибридные спироинде-
1,3-диполярное циклоприсоединение по одной
нохиноксалинпирролидины
27a-e, соединения
экзоциклической двойной связи диполярофилов
28a-e получены с помощью пятикомпонентных
25, 26 и, наконец, циклизацию с участием гидра-
реакций нингидрина, о-фенилендиамина, саркози-
зингидрата, приводящую к спиросоединениям 27,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
19
Схема 17
H O H
O
R
R
OH
O
O
OH
H3C
N
R
O
N
MeOH, '
N
25a-e
N
HN
+
CH3
NH2
NH CH2CO2H
R
NH2 NH2
H2O
O O
NH
2
27a-e, 79-88%
R = Ph (a), 4-MeOC6H4 (b), 4-ClC6H4 (c), 4-BrC6H4 (d), 4-FC6H4 (e).
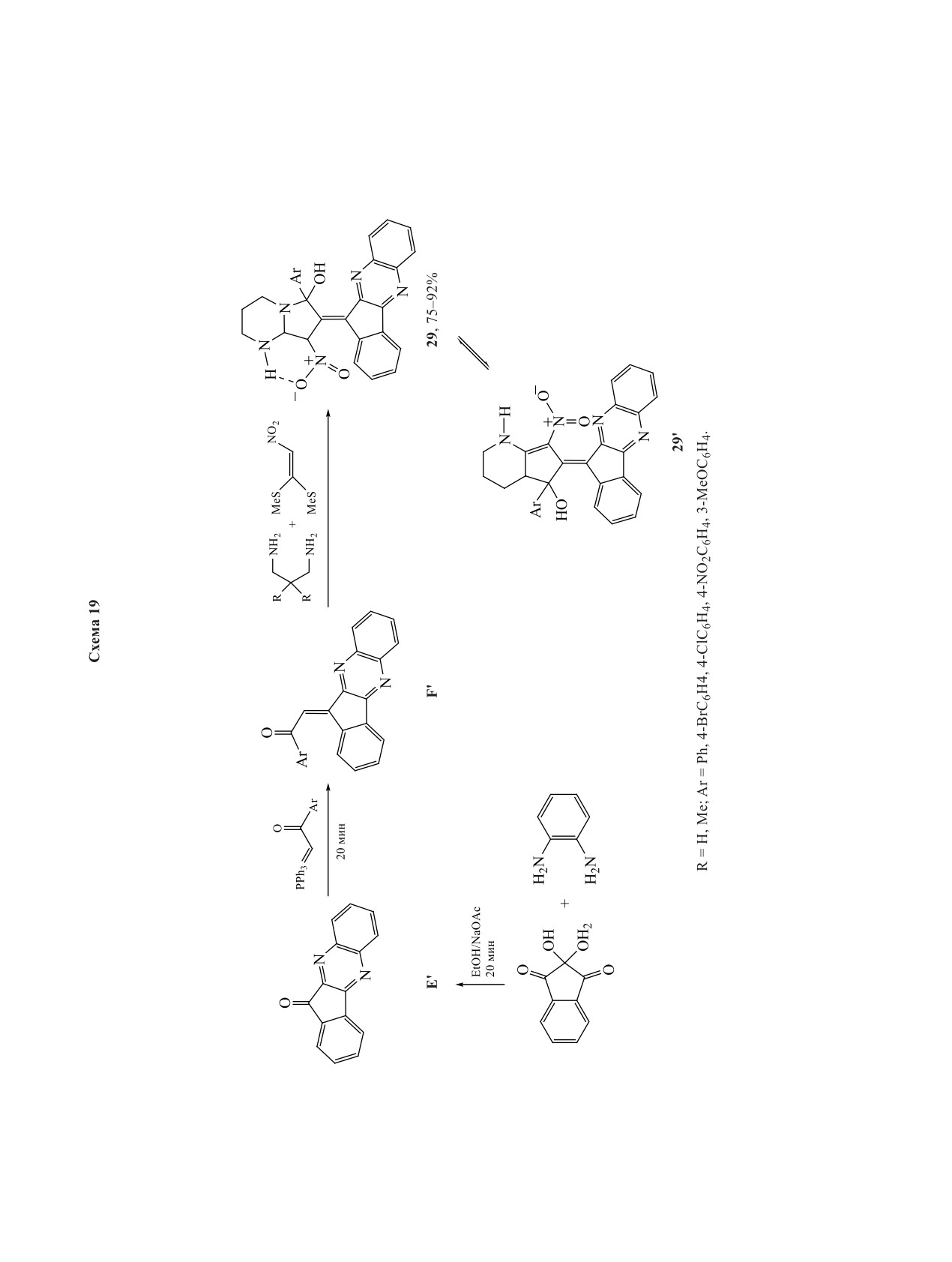
28. Азометинилид генерируется из инденохинок-
Синтезированы спироинденохиноксалинпир-
салин-11-она - продукта взаимодействия нинги-
ролизины 30 реакцией нингидрина, замещенного
дрина и о-фенилендиамина, и саркозина.
о-фенилендиамина, пролина и различных хино-
линзамещенных халконов в качестве диполярофи-
Предложен региоселективный «зеленый» под-
лов (схема 20) [29].
ход к получению новых инденохиноксалиновых
соединений, содержащих пирролопиримидиновые
Позже получены производные пирролотиазо-
ла 31 с использованием тиазолидин-2-карбоновой
каркасы 29 (схема 19) [28]. Вероятный механизм
реакции включает образование инденохиноксали-
кислоты вместо пролина (схема 20). Полученные
соединения были протестированы на антиокси-
на E' из нингидрина и о-фенилендиамина, кото-
дантную активность in vitro и цитотоксическую
рый далее реагирует с 1-арил-2-(1,1,1-трифенил-
активность in vivo в отношении линии клеток рака
λ5-фосфанилиден)этан-1-оном с получением про-
молочной железы MCF-7 и клеточной линии аде-
изводных (E)-инденохиноксалинарилэтанона F'.
нокарциномы A-549 [30].
Интермедиат F' реагирует далее с диамином и
1,1-бис(метилтио)-2-нитрометиленом при ульт-
Новые спироинденохиноксалиновые пирроли-
развуковом облучении с образованием конечного
дины/пирролизидины с индольным фрагментом
соединения 29, находящегося в равновесии с со-
32, 33 были синтезированы 5-компонентной реак-
единением 29'.
цией с использованием нингидрина, о-фенилен-
Схема 18
H O H
R
R
O
OH
N
H3C
OH
N
CH3
R
N
O
MeOH, '
26a-e
N
N
+
HN
NH2
CH3
NH CH2CO2H
R
N
NH2
NH2 NH2
H2O
CH3
28a-e, 82-88%
R = Ph (a), 4-ClC6H4 (b), 4-MeC6H4 (c), 4-MeOC6H4 (d ɮɟɪɪɨɰɟɧ ɢɥ e).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
20
ВЕЛИКОРОДОВ и др.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
21
Схема 20
O
O
1
H2N
R
R
OH
+
+
OH
H2N
R2
N
Cl
O
R3
S
COOH
COOH
MeOH
MeOH
NH
NH
R1
R
R2
H
R
S
H
O
N
N
R3
Cl
N
H
N N
N
N
Cl
N
R3
O
R2
31, 70-91%
R1
30, 75-92%
R = H, COC6H5; R1, R2, R3 = H, CH3, OCH3.
диамина, аминокислот, 3-цианоацетилиндолов и
нингидрин, о-фенилендиамин и производные
арилальдегидов в EtOH (схема 21) [31].
изоксазола вступали в реакцию [3+2]-циклоприсо-
единения. Показано, что природа заместителей и
Продукт реакции Кнёвенагеля, образованный
их положение в ароматических кольцах изоксазо-
из 3-цианоацетилиндолов и арилальдегидов, вы-
ла (диполярофила), бензиламинов и о-фениленди-
ступил в этом превращении в качестве диполяро-
амина влияют на диастереоселективность реакции
фила (схема 21). Примечательно, что использова-
(схема 22).
ние в этой реакции первичных аминокислот, таких
как глицин или фенилаланин, не дало целевого
Описан синтез новых диспиропирролидиновых
продукта.
гетероциклических гибридов 36 с использованием
ионной жидкости [bmim]Br [34]. Вероятный ме-
Разработан удобный 4-компонентный подход
ханизм реакции включает образование in situ азо-
к изоксазол-связанным спироинденохиноксали-
метинилида из инденохиноксалинона и L-трипто-
новым пирролизинам 34 с участием нингидрина,
фана, реакцию 1,3-диполярного циклоприсоеди-
замещенного о-фенилендиамина, L-пролина/тио-
пролина и 3-метил-4-нитро-5-стирилизоксазолов
нения к бис-арилиденпиперидону, протекающую
в МеОН (схема 22) [32]. Предложенная методика
региоселективно с образованием гибридного ге-
характеризуется простотой, отсутствием катализа-
тероцикла 36 (схема 22). Полученные соединения
тора, высокой региоселективностью и малой про-
протестированы на биологическую активность,
должительностью реакции.
выявлена ингибирующая активность в отношении
холинэстеразы (активность AChE и BChE).
Удалось получить соединения с изоксазольным
фрагментом в боковой цепи 35 посредством 4-ком-
Подробно рассмотрены современные достиже-
понентной реакции, протекающей с высокой ре-
ния в синтезе спироиндено[1,2-b]хиноксалинов
гио- и диастереоселективностью [33]. Бензиламин,
[35].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
22
ВЕЛИКОРОДОВ и др.
Схема 21
O CN
O
H2N
O
OH
+
+
Ar-CHO
+
Ar
OH
H2N
N
CN
O
R
H
R
N
H
NH
Me
CO2H
COOH
NH
O
EtOH
EtOH
H
H
Ar
Ar
N
Me
N
N
CN
R
N
CN
R
N
N
O
O
N
N
32, 55-79%
33, 69-93%
Ar = Ph, 4-FC6H4, 4-ClC6H4, 4-BrC6H4, 4-NO2C6H4,
Ar = Ph, 4-FC6H4, 4-ClC6H4,
4-OMeC6H4, 4-MeC6H4, 2-ClC6H4, 3-NO2C6H4,
4-BrC6H4, 4-NO2C6H4, 3-NO2C6H4,
3-ClC6H4, 2,3-(OMe)2C6H3, 2,4-ClC6H3,
3-ClC6H4, 2,3-(OMe)2C6H3,
ɬɢɟɧ ɢɥ ɧɚɮɬɢɥ
ɬɢɟɧ ɢɥ 5
+
0H
0H
Предложен 4-компонентный подход к получе-
разованием интермедиата J'. Наконец, метанолиз
нию дигидроиндолизино[8,7-b]индолов 37, вклю-
(внутримолекулярная циклизация соединения J')
чающих нингидрин, замещенный триптамин,
дает желаемый продукт 38 с превосходной диасте-
эфир ацетиленовой кислоты и различные алифати-
реоселективностью. В этой реакции происходит
ческие спирты (схема 22) [36]. Превращение, веро-
внедрение азота с образованием изохинолиноно-
ятно, протекает через реакции Пикте-Шпенглера,
вого каркаса. Стереохимия продукта подтвержде-
Михаэля и нуклеофильное присоединение, приво-
на методом РСА (CCDC 1588852) [37].
дящее к образованию C-C и C-N связей в среде
Разработан удобный тандемный one-pot подход
MeCN. Примечательно, что гетероцикл формиру-
к получению производных пиридо[1,2-b]изохино-
ется в результате двойной тандемной циклизации
лина 39 с использованием легкодоступных нинги-
в присутствии катализатора CF3COOH.
дрина, пролина и алкинов (схема 24) [38].
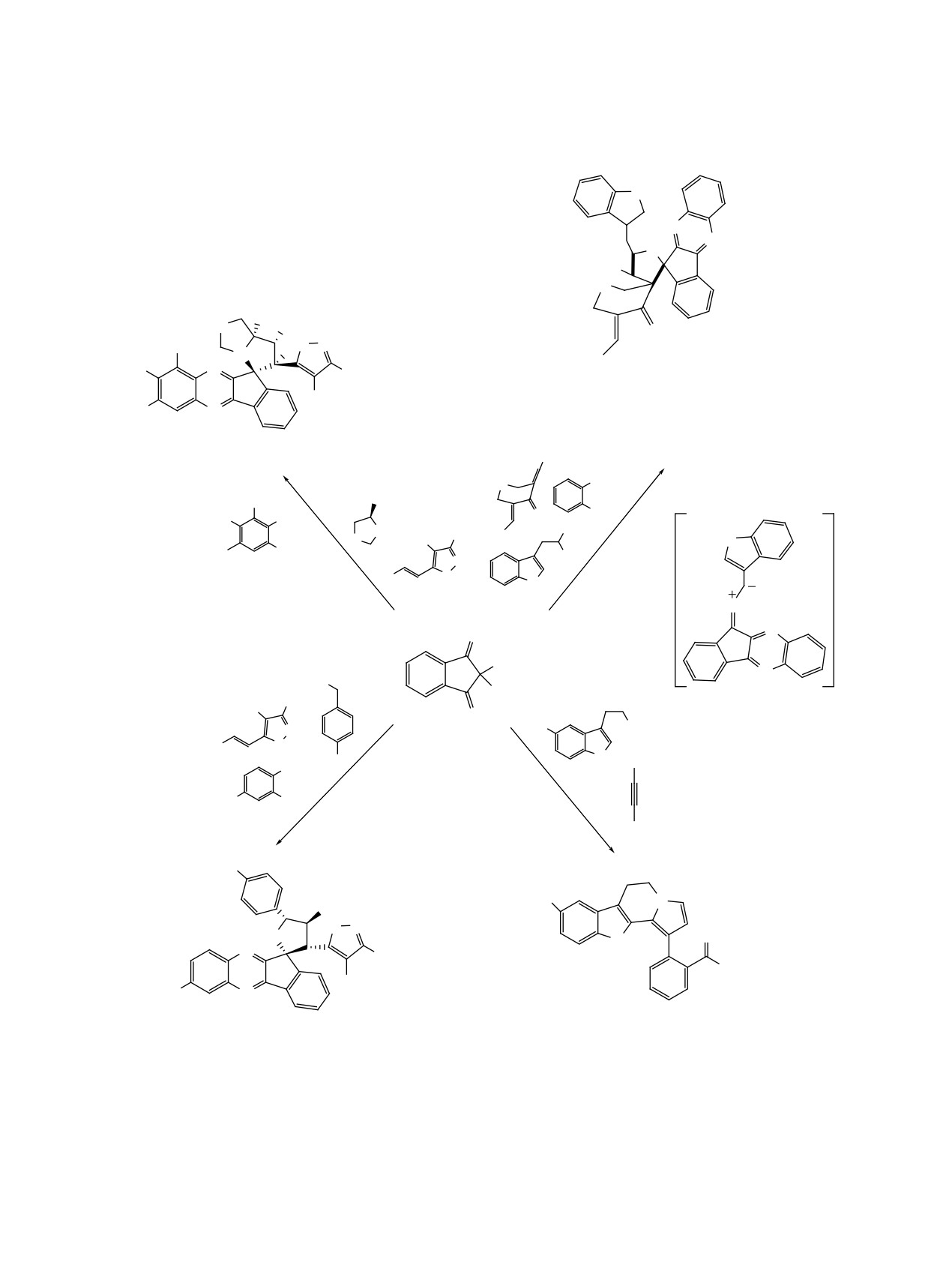
Изучена трехкомпонентная диастереоселектив-
Этот подход включает реакцию [3+2]-цикло-
ная реакция нингидрина, анилинов и ацетилено-
присоединения между алкинами и 1,3-диполем,
вых эфиров с образованием N-арилзамещенных
образованным in situ из нингидрина и пролина.
дигидроизохинолин-2-(1H)-онов
38 в МеОН
Важно отметить, что 2 новые связи C-N, 3 связи
(схема 23) [37].
C-C и 3 новых кольца образуются в одну стадию.
Первоначально реакция амина и эфиров аце-
Предложен синтез 3,3-дизамещенного изохро-
тиленовой кислоты дает промежуточное соедине-
ман-1,4-диона 40 с участием нингидрина, вторич-
ние G', которое затем реагирует с нингидри-
ного амина и N-метил-C-фенилнитрона (схема 25)
ном с образованием интермедиата H'. Внутримо-
[39].
лекулярная циклизация интермедиата H' дает
промежуточное соединение I', которое затем пре-
Фактически нитрон действует как донор атома
терпевает пинаколиновую перегруппировку с об-
кислорода, давая целевой продукт 40 и имин в ка-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
23
Схема 22
NH
N
H
N
N
Ar
HN
H
X
Ar
O
Ar = 4-BrC6H4, 4-OMeC6H4,
R3
O
N
N
H
4-NO2C6H4, 4-FC6H4,
Ar
R2
N
4-MeC6H4, 4-ClC6H4,
Me
36, 78-89%
2-ClC6H4, 2,4-Cl2C6H4;
NO2
Ar = Ph, 4-BrC6H4, 2-ClC6H4, 4-ClC6H4,
R1, R2, R3 = H, Cl, Me;
R1
N
2,4-ClC6H3, 2-MeC6H4, 3-MeC6H4,
X = CH2, S.
4-MeC6H4, 4-OMeC6H4, 3-NO2C6H4.
34, 80-92%
Ar
NH2
HN
R3
COOH
O
NH2
R2
NH2
NH
Me
Ar
COOH
X
O2N
HN
R1
NH2
NH2
N
Ar
O
MeOH, 2 3 ɱ
N
[bmim]Br, 100°C
H
HN
N
O
OH
N
H2N
OH
Me
ɚɡɨɦɟɬɢɧ ɢɥɢɞ
O
2N
O
X
NH2
N
Ar
O
2
N
R
E
NH2
H
1
R OH,
R
NH2
MeOH, 2 3 ɱ
TFA, MeCN, 120°C
E
R2
X
N
Ar
O
N
HN
O
N
N
H
Me
OR
NO2
R1
N
35, 70-92%
37, 65-87%
Ar = Ph, 4-FC6H4, 4-ClC6H4, 2-ClC6H4, 4-BrC6H4, 2-BrC6H4,
X = H, OMe; R = Me, Et, Pr;
4-NO2C6H4, 4-OMeC6H4, 2-OEtC6H4 ɚɧɬɪɚɰɟɧɢɥ
E = COOMe, COOEt.
ɮɭɪɢɥ ɬɢɟɧɢɥ 51 = H, Me, NO2; R2 = H, F, OMe.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
24
ВЕЛИКОРОДОВ и др.
Схема 23
MeOOC OH
O
E
NH2
E
E
OH
MeOH
+
+
N
8 ɱ
OH
E
O
X
O
X
38, 68-82%
E = COOMe, COOEt; X = H, 4-F, 4-Br, 4-I, 4-Me, 2-F, 3,4-Me2, 3,5-Me2, 4-OCF3.
Ar
NH COOMe
Ar-NH
2
+
MeOOC
COOMe
MeOOC
G'
O
O
O
OH
OH
COOMe
COOMe
OH
G'
COOMe
OH
HO N
OMe
O HN
O
Ar
Ar
O
H'
I'
O
MeOOC OH
COOMe
OH
MeOH
COOMe
COOMe
N
Ar
OMe
O
N
O
Ar
OH
37
J'
Ar = Ph, 4-FC6H4, 4-BrC6H4, 4-IC6H4, 4-MeC6H4,
2-FC6H4, 3,4-(Me)2C6H3, 3,5-(Me)2C6H3, 4-OCF3C6H4.
честве побочного продукта. Интересно, что боль-
фуран-3-карбоксилата (41) с почти количествен-
шинство производных изохроман-1,4-диона 40 в
ным выходом [40]. В продолжение этих иссле-
растворе проявляли флуоресценцию с высокими
дований разработан
«зеленый» синтез
4-ме-
квантовыми выходами.
тил-1,2,5,6-тетразафлуорантен-3(2Н)-она (42) кон-
денсацией соединения 41 с гидразин-гидратом в
2. СИНТЕЗ ПОЛИГЕТЕРОЦИКЛИЧЕСКИХ
воде (схема 26) [41].
СОЕДИНЕНИЙ НА ОСНОВЕ РЕАКЦИЙ
НИНГИДРИНА С ПРОИЗВОДНЫМИ
При действии на соединение
42 реаген-
АЛИФАТИЧЕСКИХ, АЛИЦИКЛИЧЕСКИХ,
та Лоуссона получен тетраазафлуорантен-3-
АРОМАТИЧЕСКИХ И ГЕТЕРОЦИКЛИЧЕСКИХ тион (43). Алкилированием соединений 42, 43 по
СОЕДИНЕНИЙ
атому азота или серы получены соответствующие
алкилированные производные 44, 45 (схема 27).
Известно, что взаимодействие при комнатной
температуре нингидрина с этилацетоацетатом в
Циклические гемикетали 46, полученные вза-
воде приводит к образованию этилиндено[1,2-b]-
имодействием фенолов с нингидрином, представ-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
25
Схема 24
O
O
R1
R
OH
MeCN
+
COOH
+
R1
OH
N
50°C, 1 ɱ
N
H
R
O
O
39, 67-90%
R = Ph, 3-OMeC6H4, 4-FC6H4, 4-ClC6H4, 4-BrC6H4, 4-CFC6H4, 2-CF3C6H4, 4-NO2C6H4,
4-MeC6H4, 4-t-BuC6H4, 4-OMeC6H4, 4-EtC6H4, 3-NH2C6H4 ɬɢɟɧ ɢɥ ɬɢɟɧ ɢɥ 6L0H3;
R1 = H, COOMe, COOEt.
Схема 25
O
O
Me
O
Me
OH
O
ɌȽɎ
N
N
+
+
+
N
8 ɱ, N2
OH
N
Ph
H Ph
N
O
H
O
40, 70-85%
N NH,
=
NH, Me N NH, O NH, Ph N NH
,
N
Ph
H
S
,
,
,
H
Ph
Ph Me
Ph
N
Ph
N
H
ляют значительный интерес для конструирования
Среди пропелланов найдены антибиотики
различных гетероциклических скаффолдов, вклю-
[53, 54], а также препараты для терапии нейро-
чая производные спиробензофураноизобензофу-
дегенеративных заболеваний, таких как болезнь
рана (47) [42], бензодиазонина (48a) [43], 2,5-бен-
Альцгеймера и болезнь Паркинсона [54].
зодиазоцин-1(2Н)она (48b) [44], фталимида (49)
Процесс образования пропелланов, вероятно,
[45, 46], хиноксалина (50) [47], пиридазина [48],
начинается с образования 1,3-диполярного соеди-
изоиндола (51) [49, 50] и пропеллана (52) [51, 52].
нения К' (из PPh3 и ацетиленового соединения) с
Взаимодействием изоиндола 51 с моноброммало-
последующим его протонированием, приводящем
нонитрилом в ДМФА в присутствии карбоната ка-
к катиону винилфосфония L'. Нуклеофильная ата-
лия и с малононитрилом в этаноле в присутствии
ка сопряженного основания M' на L' приводит к об-
Et3N получены производные 53 и спиросоедине-
разованию интермедиата N'. Пропеллановый кар-
ния 54 (схема 28) [49].
кас 52 образовывался в результате внутримолеку-
Схема 26
O
O O
O
N
N
O
Me
OH
OH
NH2 NH2
H2O
Me
OEt
OH
H2O, 20°C, 15 ɦɢɧ
OEt
', 10 ɦɢɧ
O
HO
O
O
Me
N NH
41
42, 54%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
26
ВЕЛИКОРОДОВ и др.
Схема 27
N
N
N
N
N
N
Me
Me
Me
RX, K2CO3
MeCOMe, ȾɆɎȺ
O
R
Y
S
N N
N NH
N
N
R
42, 43
44a-e, 65-85%
45a, b, e, 79-90%
Y = O (41), Y = S (43); 44, 45 5 ɚɥɥɢɥ a), Bn (b),
CH2(CO)Ph (c), CH2(CH2)3CH3 (d), CH2CO2Et (e).
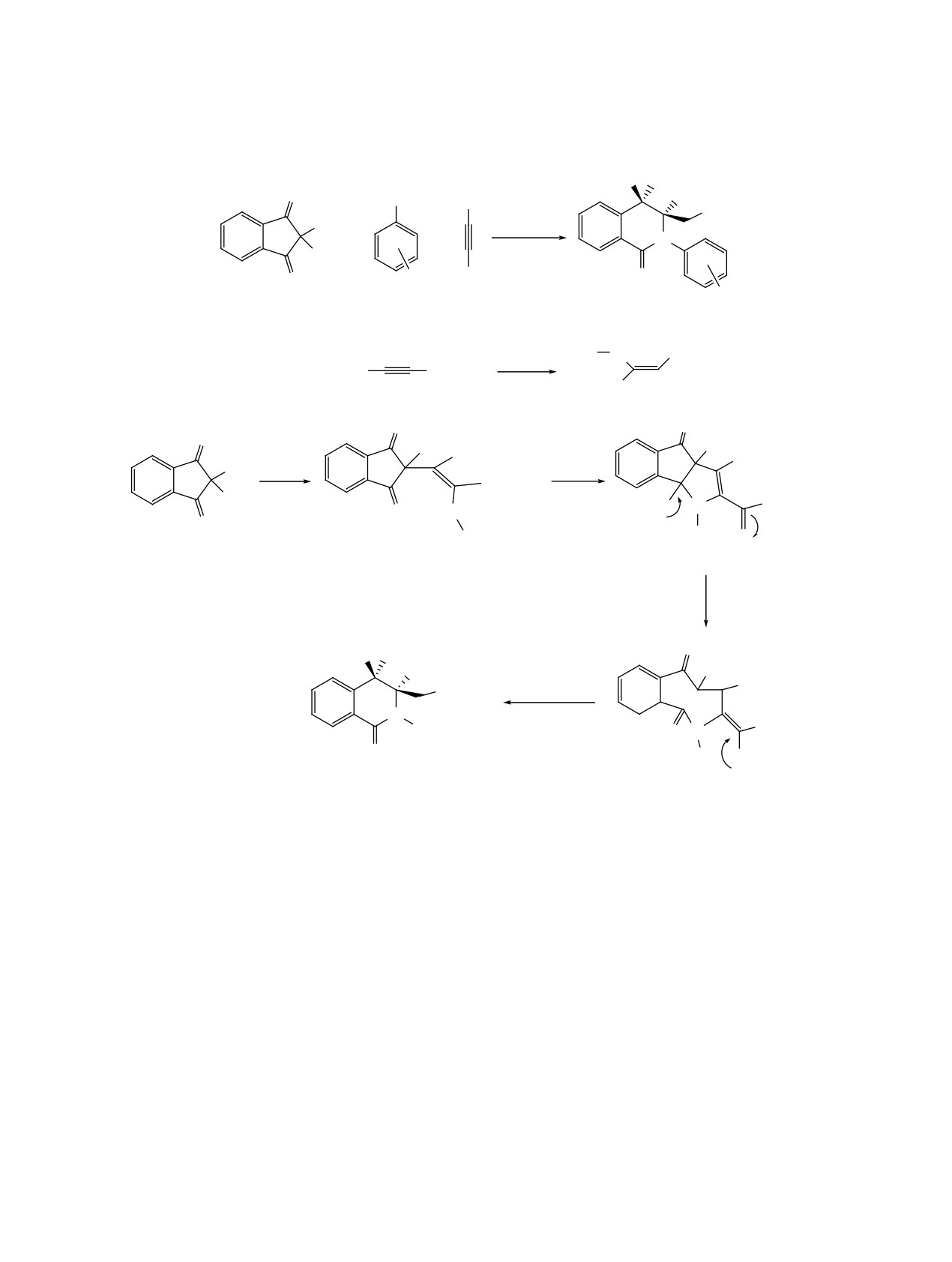
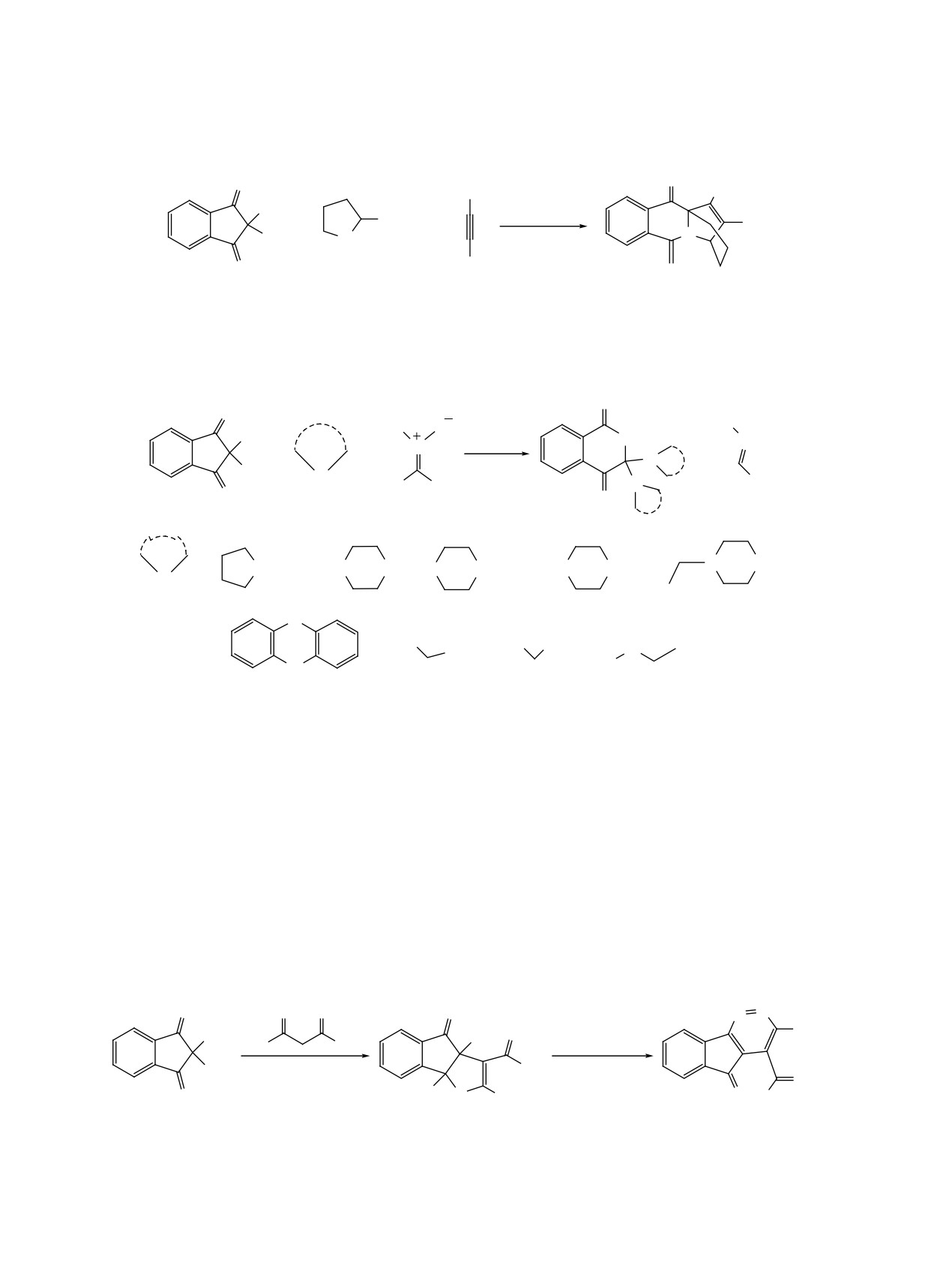
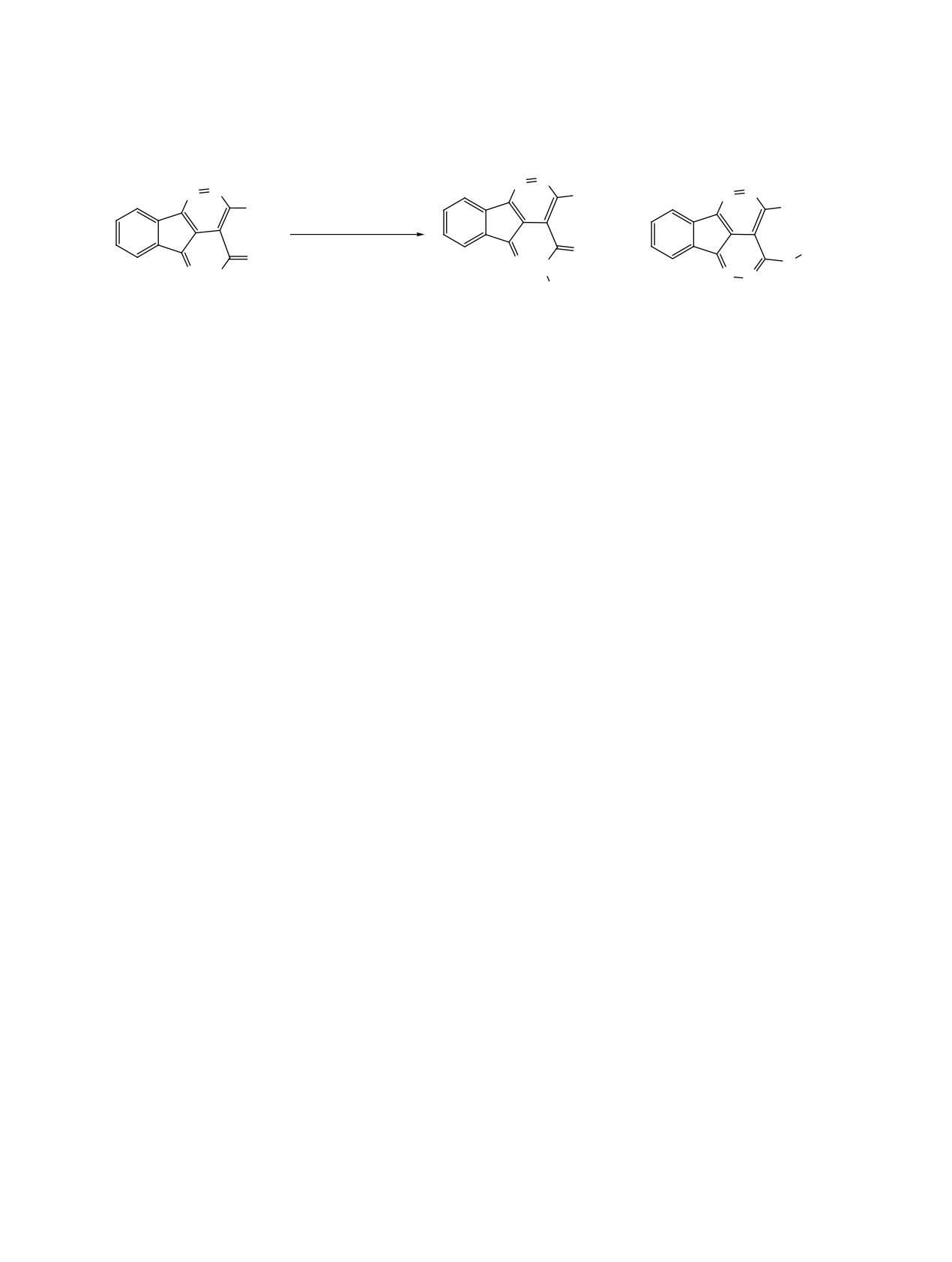
лярной 6-эндо-триг-циклизации. Примечательно,
является получение in situ промежуточного енами-
что в этой реакции был получен только один сте-
нона (или енаминоэфира), енаминоны применяют
реоизомер, однако не удалось определить точную
в качестве компонентов реакции с нингидрином
геометрию (E или Z) сложноэфирных групп в ко-
[55]. Осуществлен [61, 62] синтез продуктов 57 с
нечных соединениях 52 (схема 29).
использованием молочной кислоты в качестве ка-
тализатора.
Описана [54] циклоконденсация с участием
нингидрина и пиримидин-4-тиола (55) в водном
Соединение 57a получено в присутствии ката-
растворе карбоната натрия с получением тиенопи-
литического количества AcOH с выходом 41%, а
римидина 56, вероятно, образующегося из интер-
в присутствии каталитического количества молоч-
медиата O', схема 30).
ной кислоты выход увеличился до 46%. Опытным
путем [61] было установлено необходимое коли-
Реакция протекает в результате дегидратации с
чество молочной кислоты для достижения макси-
последующим присоединением меркаптогруппы
мального выхода продукта 87%. В последующем
по карбонильной группе, что приводит к циклиза-
молочную кислоту использовали в качестве ката-
ции с образованием тиено[2,3-d]пиримидина 56 с
лизатора для синтеза множества других продуктов
выходом 65%.
с конденсированными кольцами 57b-j (схема 31).
Синтез полициклических органических мо-
Синтезированы [63] новые производные спи-
лекул с конденсированными гетероциклами име-
роизобензофурана 58, 59 с хорошими выходами
ет большое значение благодаря их структурно-
последовательной конденсацией/реакцией окисле-
му сходству с природными соединениями [1, 2].
ния нингидрина 4-амино-1,2-нафтохинонами или
4b,9b-Дигидрокси-4b,5,6,7,8,9b-гексагидроинде-
2-амино-1,4-нафтохинонами (схема 32). Все реак-
но[1,2-b]индол-9,10-дионы 57 представляют со-
ции были выполнены one pot в 2 стадии. Стадию
бой класс гетероциклических молекул с конден-
конденсации проводили в уксусной кислоте при
сированной полициклической структурой инде-
70-100°C, а стадию окисления проводили в при-
но[1,2-b]индола, которые, как известно, обладают
сутствии H5IO6 при комнатной температуре.
различными видами биологической активности
Основываясь на химии нингидрина как цикли-
[55, 56]. Поэтому синтезу таких конденсирован-
ческого поликетона и потенциальной 1,3-бину-
ных гетероциклических соединений в последние
клеофильной природе енаминонов, таких как
годы уделяется значительное внимание.
4-(алкил/ариламино)нафталин-1,2-дионы, можно
В настоящее время синтез соединения 57 осу-
ожидать образования 6b,11b-дигидроксибензо[g]-
ществляется преимущественно реакцией нингид-
индено[1,2-b]индола P' в результате реакции кон-
рина с аминопроизводными 1,3-дикарбонильных
денсации нингидрина с енаминонами. Для дока-
соединений [57], алкилпропиолатов [58], диалки-
зательства этого промежуточные диолы P' были
лацетилендикарбоксилатов [59] или 1,1-бис(ме-
выделены для продуктов 58b и 59e. Впоследст-
тилтио)-2-нитроэтеновыми соединениями
[60].
вии окислительное расщепление соединения P'
Поскольку общей особенностью всех этих методов
с использованием перйодной кислоты привело
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
27
Схема 28
R
R
O
HO
O
OH
N
H
OH
H
OH
N
N
R
O O
O
O
O
NH
47, 71-87%
O
R
OH
N
O
HO
O
H
SSA
49, 50-65%
48a, 42-58%
48b, 73-78%
NH
2
80°C, 3 ɱ
1-BuOH,
', 3 ɱ
H2N(CH2)nNH2
n = 2, 3
O
20°C, 3 ɱ
NH2
OH
NH2
R
E
E
HO(CH2)2OH/Et3N
HO
O
OH
PPh3, MeCOMe
R
', 30 ɦɢɧ
E
20°C, 24 ɱ
46
E
NH
O
O
N
NH4OAc, AcOH
O
', 1 2 ɱ
O
O
R
50, 63-78%
Br
52, 18-71%
O
O
NC
CN
NC
CN
O
K2CO3, ȾɆɎȺ
EtOH, Et3N
NH2
NH
N N
20°C, 2 ɱ
20°C, 2 ɱ
R
O
CN
HO
O N
NH2
H O
OH
R
R
54, 73-88%
51, 64-75%
53, 70-78%
47, R = 2-Me, 4-Me, 4-F, 2-Cl, 4-Cl, 2,4-Cl2, 4-Cl, 3-Me, 4-Br, 4-OMe, 4-Ph, 4-i 3U
ɛɟɧɡɨ
ɛɟɧɡɨ
48a 5
+
0H
0H
20H
20H &O &O
%U 48b, R = 3-NHCO2Me, 4-NHCO2Me, 5-NHCO2Me,
3,5-(t-Bu)2 $G
0H 49 5
20H
20H
0H + &O &O
%U 50, R = H, 2-Me, 3-Me, 4-Me,
20H
20H
20H &O &O
%U 51, 53, 54, R = H, 2-Me, 3-Me, 4-Me, 4-F, 2-Cl, 4-Cl, 4-Br, 4-Cl, 3-Me,
2,4-Cl2, 2-Ph, 4-OMe, 4-CO20H
ɛɟɧɡɨ
ɛɟɧɡɨ
52 5
+ ɛɟɧɡɨ
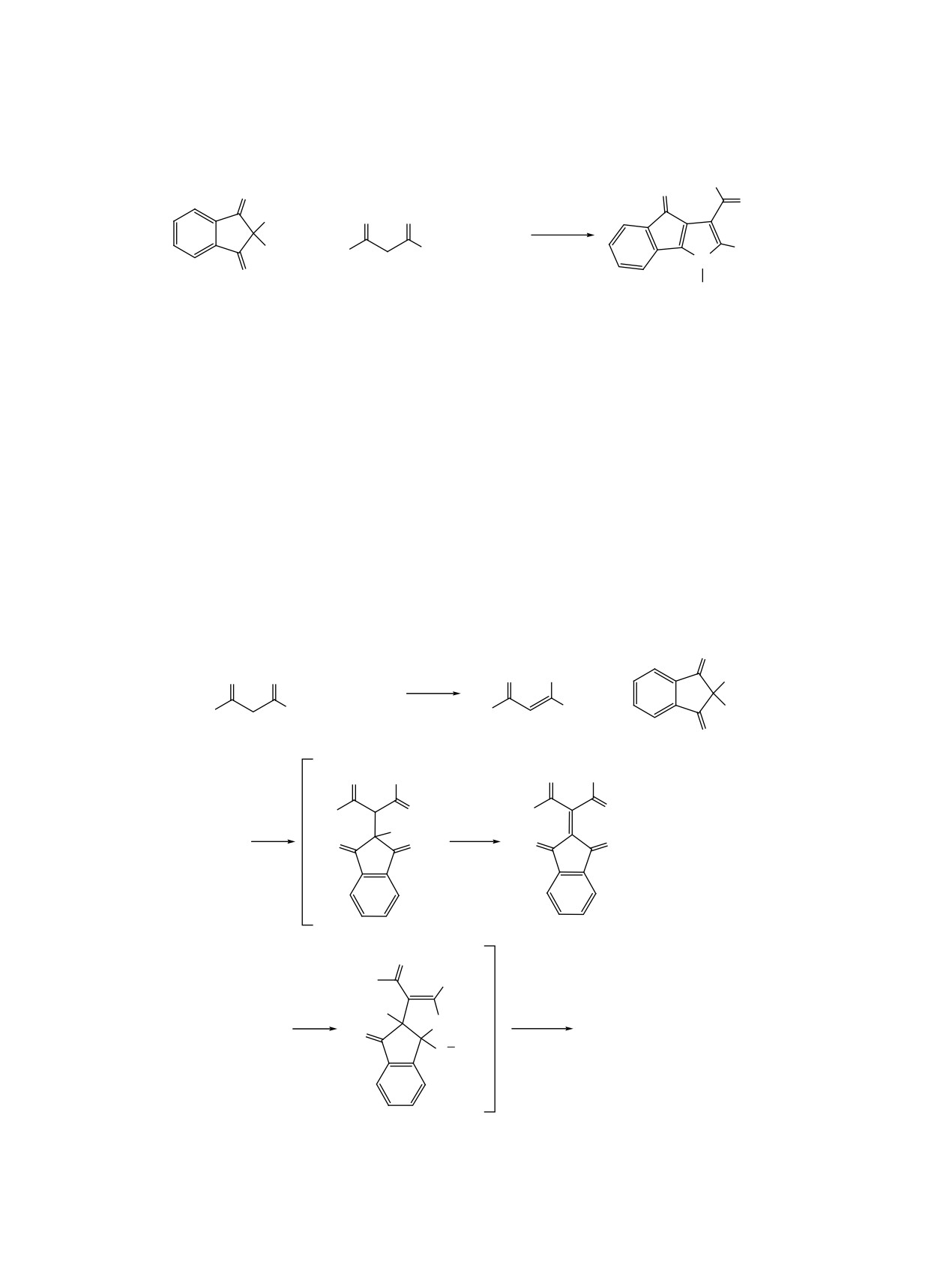
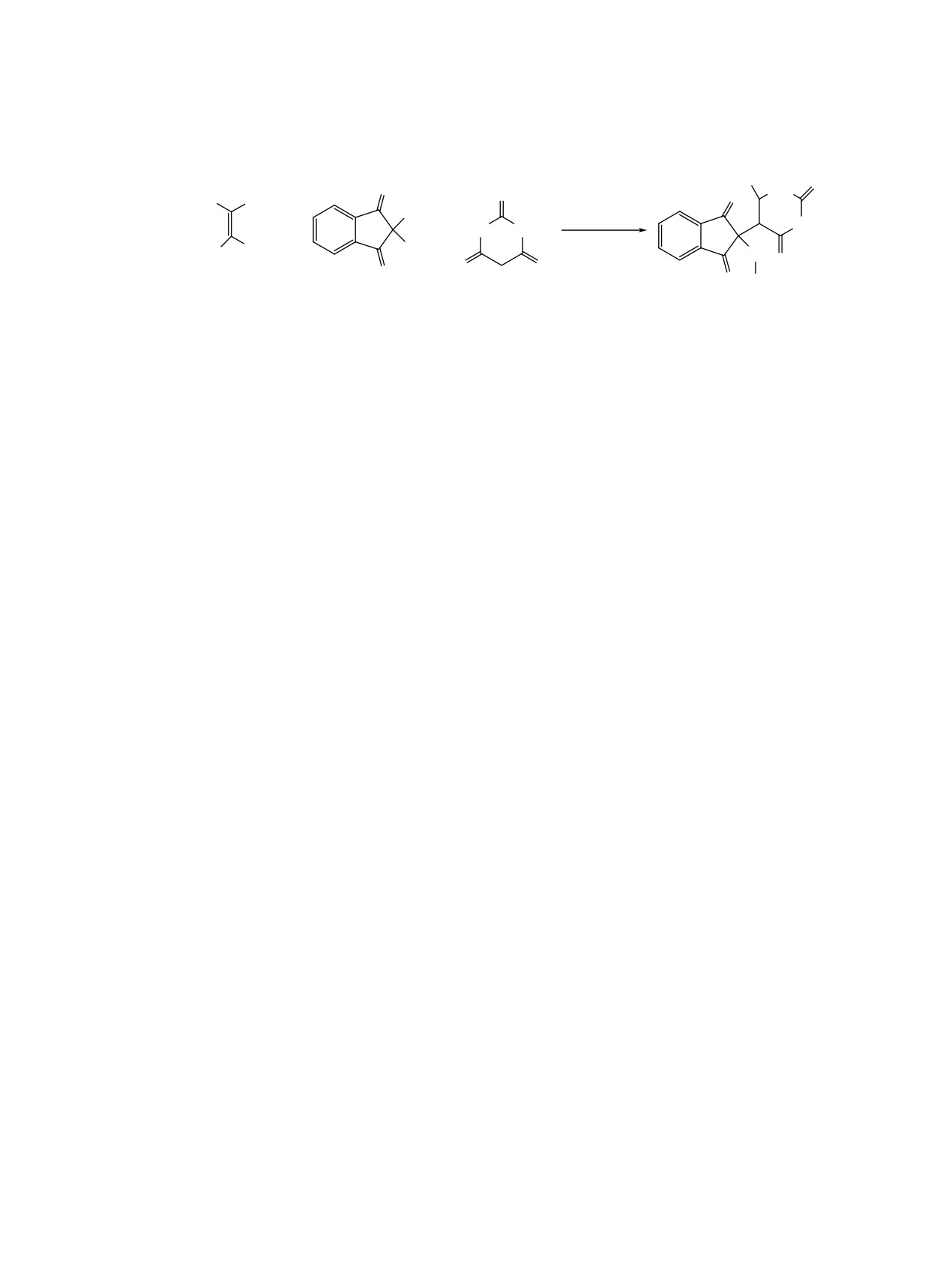
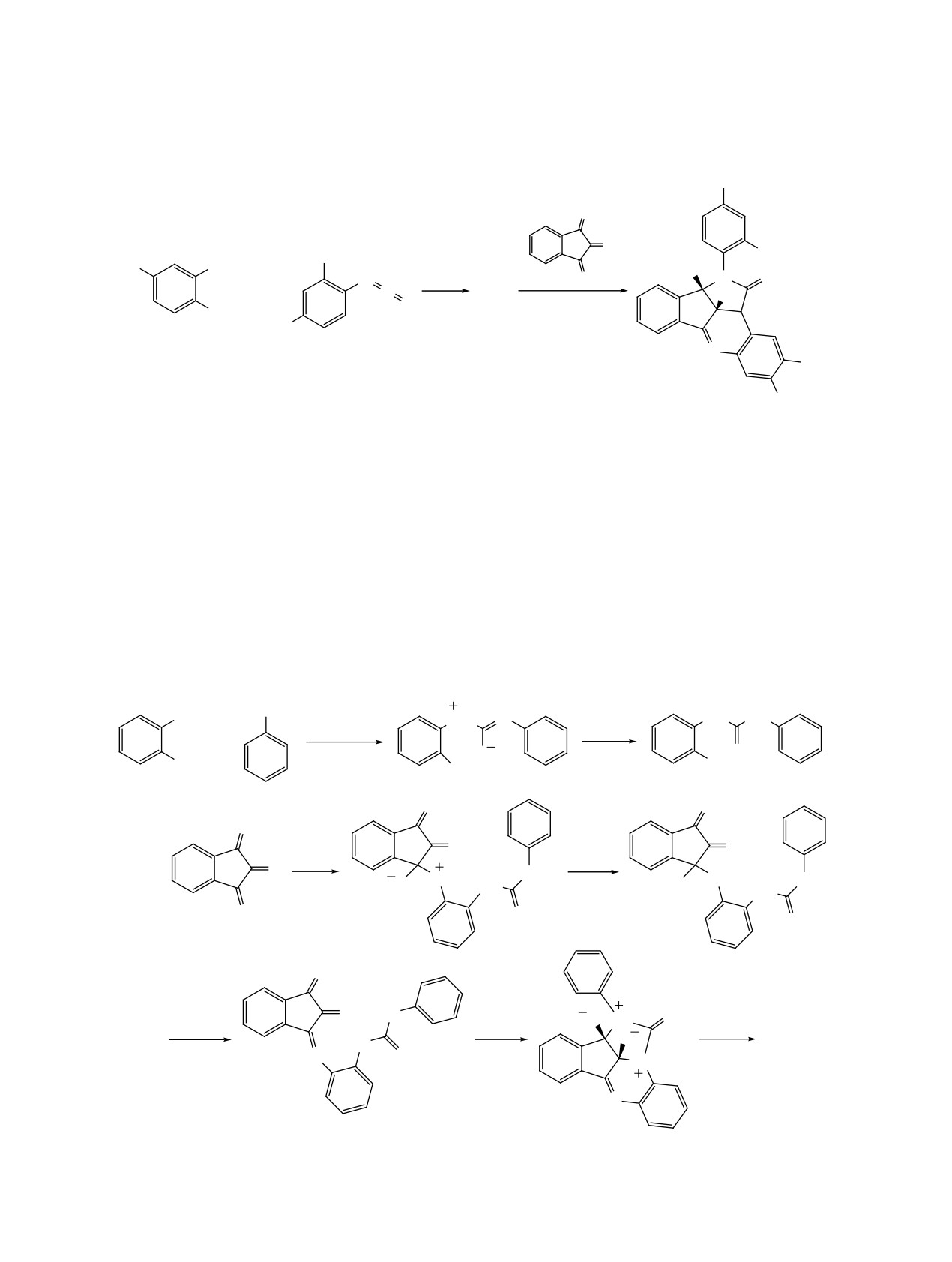
4-t-Bu, 3-OH, E = CO2Et, CO2Me.
к образованию бензо[f]нафто[1,2-b]азоцинов Q'
заряд на атом N, соединения бензо[f]нафто[1,2-b]-
(схема 33).
азоцины Q' склонны к гидролизу с образова-
нием соответствующих
2-(2-бензо[g]индолил)-
Из-за относительно сильного притяжения меж-
ду атомом азота и карбонильной группой в положе-
бензойных кислот S'. Продукты 58a-j образуются
нии C8, которое вносит больший положительный
в результате реакции циклизации промежуточных
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
28
ВЕЛИКОРОДОВ и др.
Схема 29
O
E
O
OH
E
E
OH
Ph3P
E
+
Ph3P
HO O
H
O
O
R
R
L'
M'
46
K'
PPh3 +
E
E
O-ɜɢɧɢɥɢɪɨɜɚɧɢɟ
E
O
E
OH
O
6-ɷɧɞɨ-ɬɪɢɝ ɰɢɤɥɢɡɚɰɢɹ
O
O
O O
E
R
O
E
R
52
N'
E = CO2Me, CO2Et.
Схема 30
O
OH
O
O
O
OH
O
O
HO
O
HN
HO
Na2CO3, H2O
HN
HN
O
OH
H
2N
N
SH
S
H2N
N
H
2N
N
SH
55
O'
56
Схема 31
O
O
OH
O
O
OH
OH
H3C
CO2H
+
R2
2
10 ɦɢɧ
R
OH
HN
HO
N
R2
R2
O
R1
R1
57a-j, 82-87%
57, R1 = Ph, R2 = Me (a); R1 = Bn, R2 = Me (b); R1 = H, R2 = Me (c); R1 = Ph, R2 = H (d);
R1 = 4-MeC6H4, R2 = H (e); R1 = 3-ClC6H4, R2 =H (f); R1 = Bn, R2 = H (g); R1 = i-Pr, R2 = H (h);
R1 = HO(CH2)2, R2 = H (i); R1 = R2 = H (j).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
29
Схема 32
O
O
O
O
O O
O
N
R
O
HN
1. AcOH, 50°C
OH
R
2. H5IO6, 20°C
58a-j, 85-95%
+
ɢɥɢ
O
OH
O
O
O
O O
N
HN
R O
R
O
59a-j, 78-95%
58, R = Ph (a), 4-BrC6H4 (b), 4-IC6H4 (c), 4-MeC6H4 (d), 3,5-(Me)2C6H3 (e), 3-C2H5OC6H4 (f),
3-MeOC6H4 (g), 2,5-(MeO)2C6H3 (h), 4,5-(Me)2C6H3 (i), 2-MeC6H4 (j); 59, R = Ph (a), 3,4-(Me)2C6H3 (b),
4-MeC6H4 (c), 3,5-(Me)2C6H3 (d), 1-CH2C10H7 (e), 3,4,5-(MeO)3C6H2 (g),
4,5-(Me)3C6H3 (h), Bn (i), 2-ClC6H4CH2 (j).
Схема 33
O
O
O
O
OH
O
OH
O
+
H2O
OH
HO
N
O
NHR
R
P'
O O
O
O
OH
O
O
O
O
H5IO6
H2O
HO
HIO3
N
N
O R
R
Q'
S'
O
O
O
O
O
O O
O
O
O
N
N
R
R
R'
58a-j
R = Ph, 4-BrC6H4, 4-IC6H4, 4-MeC6H4, 3,5-(Me)2C6H3, 3-OEtC6H4, 3-OMeC6H4, 2,5-(Me)2C6H3,
3,4-(Me)2C6H3, 2-MeC6H4, CH2CH23K ɩɢɪɢɞɢɧ ɢɥ
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
30
ВЕЛИКОРОДОВ и др.
Схема 34
O
O
OH
O
O
R
NaIO
4
N
O
N N
OH
HO
N
R
O
R'
OH
R'
N
O
60, 85-90%
61, 65-75%
HO
N
O
O
H
RHN
NHR'
OH
62, 98% H2N
NHOH
OR
N
O
O
HO N
AcOH
ArHN
NHOR
O
Ar
O
67-72, 80-99%
O
OH
AcOH
Ar =4-MeC6H4, R =Bu (66),
R = Me (67); Ar = 4-BrC6H4,
OH
R = Pr (68), R = Bu (69), R = Bn (70);
O
Ar = Ph, R = Bn (71).
MeHN
NHOPr
NafH2CHN
NHOEt
H2N
NHOR
O
AcOH
O
O
AcOH
AcOH
O
O
O
OH
OH
OH
O
OPr
OR
OR
N
OH
N
+
N
OEt
HO
N
N
O
HO N
HO N
O
O
Me
H
H
HO N
O
73, 59%
63a-66a
63b-66b
NafH2C
74, 92%
R = Et, Pr, ɰɢɤɥɨ ɋ3H5, Ph; R' = Ph, 4-EtC6H4, 4-NO2C6H4, 2-ClC6H4, 2-EtC6H4,
2,6-(Et)2C6H3, 2,4-(OMe)2C6H3 (61); R = Me (63), Et (64), ɧ-Bu (65), Bn (66).
продуктов S', проходящей через ускоренное кисло-
ны 61, проявляющие противосудорожную актив-
той образование цвиттер-ионных промежуточных
ность (схема 34) [64].
продуктов R'. По сравнению с другими раствори-
Реакция нингидрина с N-гидроксимочевиной
телями более короткое время реакции и большая
в AcOH при комнатной температуре приводит к
эффективность реакций в уксусной кислоте выя-
получению
1,3а,8а-тригидрокси-1,3,3а,8а-тетра-
вили необходимость кислотных условий для обра-
гидроксииндено[1,2-d]имидазол-2,8-диона (62) в
зования промежуточных продуктов P' и R'.
виде единственного цис-3а(НО),8а(НО)-диастере-
Установлено, что нингидрин взаимодействует
омера (схема 34). N-Алкоксимочевины реагируют
с мочевиной, N,N'-диалкилмочевинами с образо-
с нингидрином в уксусной кислоте с образова-
ванием аддуктов 60, которые при окислении пер-
нием смеси цис/транс-диастереомеров 1-алкок-
иодатом натрия превращаются в спирогидантои-
си-3аS,8aR-дигидрокси-1,3,3а,8а-тетрагидроинде-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
31
Схема 35
O
N
N HO
O
N
R
O
Me
75, 40-86%
O
N
HO
R = Me, Et, i-Bu, Bn, Ph, 4-ClC6H4.
O
N
78, 55%
N
HO
N
+
O
R
CH3
CH2Cl2
76, 84%
O
N
N
N
N
O
N
N
CH2Cl2
OH
CH2Cl2
OH
OH
O
CO2H
O
79, 14%
O
O HN
N
Ph
EtO
Me
Ph
NH2
S
N
N
EtOH, '
N
CH2Cl2
O
2 ɷɤɜ ɧɢɧɝɢɞɪɢɧɚ
CO2H
N Ph
Ph
S
N
N
O
N
O
HO
OH
Me
N
HO
N
O
OH
HO
O
O
CO2Et
81, 73%
77, 63%
OH
O
80, 75%
но[1,2-d]имидазол-2,8-дионов 63a-66a и 63a-66b
Нингидрин реагирует с N-пропилокси-N'-ме-
в соотношении 1:10 с выходом 89-99%. Найдены
тилмочевиной в АсОН при комнатной температуре
условия получения цис-диастереомеров 63a-66a с
с образованием одного из возможных диастерео-
меров - 3аS,8aR-дигидрокси-3-метил-1-пропилок-
выходом 67-98% [65].
си-1,3,3а,8а-тетрагидроксииндено[1,2-d]имида-
Реакция нингидрина с N-алкокси-N'-арил-
зол-2,8-дионов (73). Установлено также, что взаи-
мочевинами в AcOH при комнатной температуре
модействие нингидрина с N-этокси-N'-(1-нафтил)-
приводит к получению одного из возможных ди-
метилмочевиной приводит к получению лишь
астереомеров - 1-алкокси-3-арил-2аS,8aR-дигид-
одного диастереомера - 1-этокси-3а,8а-дигидрок-
рокси-1,3,3а,8а-тетрагидроиндено[1,2-d]имида-
си-3-(1-нафтил)метил-1,3,3а,8а-тетрагидроинде-
зол-2,8-дионов 67-72 (схема 34) [66].
но[1,2-d]имидазол-2,8-диона (74) (схема 34) [67].
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
32
ВЕЛИКОРОДОВ и др.
Реакция нингидрина с 3-(замещенными)ими-
дов образуются хиназолины 84, а в присутствии
дазо[1,5-a]пиридинами сопровождается нуклео-
других заместителей происходит образование 11-
фильным присоединением атома С1 гетероцикла
гидрокси-11,11а-дигидробензо[e]индено[2,1-b]-
по карбонильной группе в положении 2 нинги-
[1,4]диазепин-10,12-диона 86 (схема 36) [74].
дрина с образованием соответствующих продук-
Установлено, что реакция нингидрина с 3-ами-
тов 75. Аналогично реакция протекает с (1-ме-
но-4,6-диарилтиено[2,3-b]пиридин-2-карбоксами-
тилзамещенным)имидазо[1,5-a]пиридином с по-
дами в АсОН в присутствии серной кислоты при-
лучением соединения 76. При взаимодействии
водит к получению соответствующих 3',7',9'-три-
имидазо[1,5-a]пиридина с 2 экв нингидрина при
арил-1'Н-спиро(индено-2,2'-пиридо[3',2':4,5]ти-
комнатной температуре образуется 2,2'-(имида-
ено[3,2-d]пиримидин)1,3,4'(3'H)-трионов
87a-f
зо[1,5-a]пиридин-1,3-диил)бис[2-гидрокси-1Н-ин-
(схема 36) [75].
ден-1,3(2Н)дион]
(77). Реакция эквимолярных
количеств нингидрина и незамещенного имида-
Осуществлена реакция нингидрина с арилги-
зо[1,5-a]пиридина приводит к получению смеси
дразонами в отсутствие растворителя с исполь-
продуктов 78, 79 (схема 35) [68].
зованием нанокатализатора [76], завершающаяся
получением изокумаринов, конденсированных с
Установлено, что нингидрин взаимодействует
пиразолом 88 (схема 36).
с
4-{[(2Z)-4-этокси-4-оксобут-2-ен-2-ил]амино}-
бензойной кислотой с образованием производного
Недавние исследования [77] показали, что ре-
дигидроиндено[1,2-b]пиррола 80 (схема 35) [69].
акция нингидрина с фенилэтиламином дает спи-
ро[фуран-2,1'-изоиндолин] 89 (схема 37).
Получено [70] новое полициклическое соеди-
нение 81 с выходом 73% взаимодействием нин-
ЗАКЛЮЧЕНИЕ
гидрина с 2-амино-3-бензил-6-(бензилтио)пири-
В обзоре показана важность нингидрина как
мидин-4(3Н)-оном при перемешивании в ДМФА
универсального реагента в органическом син-
в течение 2 ч и после добавления воды в течение
тезе, поскольку благодаря ему получен доступ
6 ч (схема 35).
к сложным циклическим системам в реакциях с
Установлено, что N,N'-(тио)мочевины реаги-
коммерчески доступными исходными реагента-
руют с нингидрином с образованием гемикета-
ми в мягких условиях. Для создания разнообраз-
лей 82 с почти количественным выходом, которые
ных органических скелетов были задействованы
при нагревании при 65-80°С с кремнеземсерной
различные типы аддуктов нингидрина, включая
кислотой (SiO2-OSO3H или SSA) подвергаются
N-замещенные соединения, спирогетероциклы,
окислительной перегруппировке и превращаются
полициклические соединения, пропелланы, ци-
в соответствующие спироимидазолидин-4,1'-изо-
клоаддукты и т.д. Также было продемонстриро-
бензофураны 83 (схема 36) [71].
вано несколько примеров стереоселективного/
Установлено, что о-аминобензамиды реагиру-
асимметричного синтеза. Полученные соединения
ют с нингидрином в присутствии каталитических
могут быть использованы в различных отраслях,
количеств йода в ионной жидкости с образованием
многие из них являются важными полупродукта-
спиропроизводных хиназолина 84 (схема 36) [72].
ми для дальнейшего синтеза различных органиче-
ских структур.
Установлено [73], что в реакции изатового ан-
гидрида с первичными аминами и далее с нин-
ИНФОРМАЦИЯ ОБ АВТОРАХ
гидрином в диоксане в присутствии HCl при
Великородов Анатолий Валериевич, ORCID:
90-100°С образуется изохинолино[2,3-a]хиназо-
лин-5,7,12-трионы 85 (схема 36).
Кутлалиева Эльвина Нуритдиновна, ORCID:
Показано, что структура продуктов реакции ан-
траниламидов с нингидрином в кипящей воде в от-
сутствие катализаторов зависит от природы амид-
Шустова Екатерина Александровна, ORCID:
ного атома азота. В случае о-замещенных анили-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
33
Схема 36
Ar
X
N
X = S; Ar = Ph, 4-MeC6H4, 4-MeOC6H4,
O
2,4-Cl2C6H3; R = Bn, CH2CH2Ph,
N
R
4-FC6H4CH2, 4-MeC6H4CH2, ɧ-Bu,
O
ɰɢɤɥɨɩɪɨɩɢɥ ɰɢɤɥɨɝɟɤɫɢɥ ɚɥɥɢɥ
ɩɢɪɢɞɢɧ ɢɥ
-90%).
O
83
SSA, '
O
X = O; Ar = Ph, 4-MeC6H4;
O
OH
Ar
R = 4-MeC6H4CH2, 4-ClC6H4CH2,
H
ɩɢɪɢɞɢɧ ɢɥ ɰɢɤɥɨɝɟɤɫɢɥ
N
N
ɰɢɤɥɨɩɪɨɩɢɥ
-85%).
HO
N
N
X
O
R
R
O
O
82, 95-99%
84, 82-92%
OH
NH2
RHN
NH2
N
R = Alk, Ar, NH2.
N R'
X
NHR
NHR'
HN
R
O
O
O
Ar
I2, [bmim]Br, 50°C
H2O, 100°C
CHCl3, '
O
R
Ph
86, 30-94%
OH
,
R' = H, Ph, 3-HOC6H4
N
Ar'
O
3-MeC6H4, 4-MeC6H4,
OH
R'
Bn; R = H, Br, NO2.
S
NH2
O
O
N
O
O NHAr'
H
AcOH, H2SO4
H
RNH2, H+
N
Ph
N
Ar
Fe3O4-CNT-In
Ph
Ar'
100°C
O
O
O
N
O
NH
N
S
N R
O
N
O Ar" O
Ar
O
87a-f, 51-75%
R'
N N
85, 52-76%
Ar' = 4-MeC6H4 $U
3K a);
Ph
R' = H, Br; R = Alk, Ar.
Ar' = 4-MeOC6H4, Ar" = 2-MeC6H4
b);
88, 85-94%
Ar' = 4-MeOC6H4, Ar" = 5-Cl-2-MeC6H3
c);
Ar = Ph, 2-ClC6H4, 4-ClC6H4,
Ar' = 4-MeOC6H4, Ar" = 2-NO2C6H4
d);
4-NO2C6H4, 3-NO2C6H4,
Ar' = 4-MeOC6H4, Ar" = 2-Br-4-NO2C6H3
e);
3-MeO-4-OHC6H3, 3-OHC6H4,
Ar' = 4-BrC6H4, Ar" = 2-MeC6H4
f).
4-OHC6H4, 4-MeC6H4,
4-MeOC6H4.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
34
ВЕЛИКОРОДОВ и др.
Схема 37
O
O
MeOH
N
O
+
O
NH2
O
O
89
Носачев Святослав Борисович, ORCID: https://
11. Olyaei A., Taheri N., Sadeghpour M. Res. Chem.
orcid.org/0000-0001-8469-5425
Intermed. 2021, 47, 1211-1219 doi 10.1007/s11164-
020-04325-2
КОНФЛИКТ ИНТЕРЕСОВ
12. Karami H., Hossaini Z., Sabbaghan M., Rostami-
Авторы заявляют об отсутствии конфликта ин-
Charati F. Chem. Heterocycl. Compd. 2018, 54, 1040-
тересов.
1044. doi 10.1007/s10593-018-2388-6
СПИСОК ЛИТЕРАТУРЫ
13. Kochia K., Bayat M., Nasri S., Mohammadi A. Mol.
Divers. 2020, 24, 1015-1024. doi 10.1007/s11030-
1. Ijaj F., Shafqat S.S., Ahamd H.A., Munawar M.A.,
019-10009-w
Khan M.A. J. Heterocycl. Chem. 2019, 56, 1231-1238.
doi 10.1002/jhet.3506
14. Alizadeh A., Sanjari E., Roosta A., Halvagar M.R. Mol.
Divers. 2021, 25, 2063-2072. doi 10.1007/s11030-
2. Sahu K., Banerjee M., Ghosh S., Maity A., Mondal S.,
020-10097-z
Paira R., Hazra A., Karmakar S., Samanta A., Mon-
dal N. Med. Chem. Res. 2013, 22, 2023-2037. doi
15. Alizadeh A., Noaparast Z., Sabahnoo H., Zohreh N.
10.1007/s00044-012-0202-z
Synlett. 2010, 10, 1469-1472. doi 10.1055/s-0029-
3. Li X., Yang L., Peng C., Xie X., Leng H.-J., Wang B.,
1219934
Tang Z.-W., He G., Ouyang L., Huang W., Han B.
16. Mal K., Naskar B., Mondal A., Goswami S., Prod-
Chem. Commun. 2013, 49, 8692-8694. doi 10.1039/
han C., Chaudhuri K., Mukhopadhyay C. Org. Biomol.
c3cc44004
Chem. 2018, 16, 5920-5931. doi 10.1039/c8ob01411f
4. Yao W., Liu Q., Shi Y., Tang J. Heterocycles. 2012, 85,
17. Kaur M., Bhardwaj M., Sharma H., Paul S., Clark J.H.
1077-1088. doi 10.3987/COM-12-12427
New J. Chem. 2017, 41, 5521-5532. doi 10.1039/
5. Das S. RSC Adv. 2020, 10, 18875-18906. doi 10.1039/
C7NJ00361G
d0ra02930k
18. Moradi A.V. J. Chem. Res. 2017, 41, 403-405. doi
6. Коротаев В., Кутяшев И., Барков А., Сосновских В.
10.3184/174751917X14967701767021
ХГС. 2017, 53, 1192-1198. [Korotaev V., Kutyashev I.,
19. Kalluraya B., Mallya S., Kumar A.K. J. Heterocycl.
Barkov A., Sosnovskikh V. Chem. Heterocycl. Compd.
Chem. 2018, 55, 2075-2081. doi 10.1002/JHET.3247
2017, 53, 1192-1198.] doi 10.1007/s10593-018-2193-
20. Narayanarao M., Koodlur L., Gopal S., Reddy S.Y.,
2
Kamila S. Synth. Commun. 2018, 48, 2441-2451. doi
7. Su T.L., Lee T.C., Kakadiya R. Eur. J. Med. Chem.
10.1080/00397911.2018.1508722
2013, 69, 609-621. doi 10.1016/j.ejmech.2013.09.016
21. Alizadeh A., Roosta A., Halvagar M. ChemistrySelect.
8. Kashyap M., Das D., Preet R., Mohapatra P., Satapa-
2019, 4, 71-74. doi 10.1002/SLCT.201803418
thy S.R., Siddharth S., Kundu C.N., Guchhait S.K.
Bioorg. Med. Chem. Lett. 2012, 22, 2474-2479. doi
22. Nayak S., Panda P., Mohapatra S., Raiguru B., Baral N.
10.1016/j.bmcl.2012.02.007
J. Heterocycl. Chem. 2019, 56, 1757-1770. doi 10.1002/
9. Rahimi F., Hosseini H., Bayat M. Tetrahedron Lett.
jhet.3534
2018, 59, 818-822. doi 10.1016/j.tetlet.2018.01.050
23. Filatov A.S., Wang S., Khoroshilova O.V., Lozovs-
10. Rezvanian A., Moradi F., Zadsirjan V., Mohammadne-
kiy S.V., Larina A. G., Boitsov V.M., Stepakov A.V.
jad M., Heravi M.M. Mol. Divers. 2020, 24, 1313-
J. Org. Chem. 2019, 84, 7017-7036. doi 10.1021/
1325. doi 10.1007/s11030-019-09996-7
acs.joc.9b00753
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
35
24. Hegde S.G., Koodlur L., Narayanarao M. Synth.
42. Debnath K., Pathak S., Pramanik A. Tetrahedron Lett.
Commun.
2019,
49,
3453-3464. doi
10.1080/
2014, 55, 1743-1748. doi 10.1016/j.tetlet.2014.01.109
00397911.2019.1672746
43. Das S., Dutta A. Heterocycles. 2016, 92, 701-707. doi
25. Palchykov V.A., Chabanenko R.M., Konshin V.V.,
10.3987/COM-15-13385
Dotsenko V.V., Krivokolysko S.G., Chigorina E.A.,
44. Великородов А.В., Степкина Н.Н., Осипова В.П., Зу-
Horak Y.I., Lytvyn R.Z., Vakhula A.A., Obushak M.D.,
хайраева А.С., Шустова Е.А. ЖОрХ. 2021, 57, 562-
Mazepa A.V. New J. Chem. 2018, 42, 1403-1412. doi
570. [Velikorodov A.V., Stepkina N.N., Osipova V.P.,
10.1039/C7NJ03846A
Zukhairaeva A.S., Shustova E.A. Russ. J. Org. Chem.
26. Deivasigamani G., Rajukrishnan S.B.A. Synth.
2021, 57, 575-581.] doi 10.1134/S1070428021040114
Commun.
2021,
51,
2063-2076. doi
10.1080/
45. Das S., Dutta A., Maity S.,Ghosh P., Mahali K. Synlett.
00397911.2021.1919901
2018, 29, 581-584. doi 10.1055/s-0036-1589146
27. Deivasigamani G., Rajukrishnan S.B.A. Synth.
46. Das S., Das P., Maity S., Ghosh P., Dutta A.
Commun.
2020,
50,
3820-3829. doi
10.1080/
J. Mol. Struct. 2020, 1224, 129033. doi 10.1016/
00397911.2020.1812081
j.molstruc.2020.129033
28. Alizadeh A., Ghasemzadeh H., Roosta A., Halva-
47. Malti S., Roy N., Thilak Babu L., Moharana P., Athi-
gar M.R. ChemistrySelect. 2019, 4, 4483-4486. doi
ra S.S., Sreedhar E.D., De S., Kumar S.K.A., Pai-
10.1002/SLCT.201900639
ra P. New J. Chem. 2020, 44, 920-931. doi 10.1039/
29. Mani K.S., Kaminsky W., Rajendran S.P. New J. Chem.
C9NJ03131F
2018, 42, 301-310. doi 10.1039/C7NJ02993D
48. Великородов А.В., Зухайраева А.С., Чабакова А.К.,
30. Mani K.S., Murugesapandian B., Kaminsky W.,
Ковалев В.Б. ЖОрХ. 2018, 54, 1497-1502. [Ve-
Rajendran S.P. Tetrahedron Lett. 2018, 59, 2921-2929.
likorodov A.V., Zukhairaeva A.S., Chabakova A.K.,
doi 10.1016/j.tetlet.2018.06.035
Kovalev V.B. Russ. J. Org. Chem. 2018, 54, 1509-
31. Wen R., Cen L., Ma Y., Wang J., Zhu S. Tetrahedron Lett.
1514.] doi 10.1134/S1070428018100123
2018, 59, 1686-1690. doi 10.1016/j.tetlet.2018.03.059
49. Kundu A., Pathak S., Debnath K., Pramanik A.
32. Gupta S., Khurana J.M. ChemistrySelect. 2019, 4,
Tetrahedron Lett. 2014, 55, 3960-3968. doi 10.1016/
7200-7203. doi 10.1002/slct.201901531
j.tetlet.2014.04.027
33. Reddy M.S., Chowhan L.R., Kumar N.S., Ramesh P.,
50. Kundu A., Pramanik A. Terahedron Lett. 2014, 55,
Mukkamala S.B. Tetrahedron Lett. 2018, 59, 1366-
4466-4474. doi 10.1016/j.tetlet.2014.06.064
1371. doi 10.1016/j.tetlet.2018.02.044
51. Das S., Dutta A. ChemistrySelect. 2020, 5, 11361-
34. Arumugan N., Almansour A.I., Kumar R.S., Kotre-
11377. doi 10.1002/slkt.202003245
sha D., Saiswaroop R., Venketesh S. Bioorg. Med. Chem.
52. Sirouspour M., Souri S. J. Heterocycl. Chem. 2016, 53,
2019, 27, 2621-2638. doi 10.1016/j.bmc.2019.03.058
147-152. doi 10.1002/jhet.2283
35. Singh R., Bhardwaj D., Saini M.R. RSC Adv. 2021, 11,
53. Tang Y.Z., Liu Y.H., Chen J.X. Mini-Rev Med Chem.
4760-4804. doi 10.1039/d0ra09130h
2012, 12, 53-61. doi 10.2174/138955712798868968
36. Shirsat P.K., Narasimhulu V., Kumbhare R.M.
54. El-Sayed H.A., Assy M.G., Mahmoud W.M., El-
ChemistrySelect. 2019, 4, 8550-8553. doi 10.1002/
Sheakh A.A., Morsy H.A. J. Heterocyclic. Chem.
slct.201901831
2019, 57, 1-8. doi 10.1002/jhet.3825
37. Shirsat P.K., Khomane N.B., Meshram S.H., Sridhar B.,
55. Huang J.-M., Yokoyama R., Yang C.-S., Fukuyama Y.
Meshram H.M., Kumbhare R.M. Synthesis. 2019, 51,
Tetrahedron Lett. 2000, 41, 6111-6114. doi 10.1016/
1473-1481. doi 10.1055/s-0037-1610999
S0040-4039(00)01023-6
38. Shinde S.S., Laha S., Tiwari D.K., Sridhar B., Lik-
56. Lobo G., Monasterios M., Rodrigues J., Camboa N.,
har P.R. Org. Biomol. Chem. 2019, 17, 4121-4128. doi
Capparelli M. V., Martínez-Cuevas J., Lein M.,
10.1039/C9OB00560A
Jung K., Abramjuk C., Charris J. Eur. J. Med. Chem.
39. Sathi V., Deepthi A., Thomas N.V. J. Heterocycl. Chem.
2015, 96, 281-295. doi 10.1016/j.ejmech.2015.04.023
2019, 56, 2333-2340. doi 10.1002/jhet.3619
57. Gozzi G. J., Bouaziz Z., Winter E., Daflon-Yunes N.,
40. Boraei A.T.A. Arkivoc. 2016, 2016, 71-81. doi 10.3998/
Aichele D., Nacereddine A., Marminon C., Valdame-
ark.5550190.p009.399
ri G., Zeinyeh W., Bollacke A., Guillon J., Lacoud-
41. Boraei A.T.A., Ghabbour H.A., Sarhan A.A.M.,
re A., Pinaud N., Cadena S.M., Jose J., Le Borgne M.,
Barakat A. ACS Omega. 2020, 5, 5436-5442. doi
Di Pietro A. J. Med. Chem. 2015, 58, 265-277. doi
10.1021/acsomega.0c00045
10.1021/jm500943z
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
36
ВЕЛИКОРОДОВ и др.
58. Rostami-Charati F. Chin. Chem. Lett. 2014, 25, 169-
68. El-Abadelah M.M., Awwadi F.F., Abdullah A.H.,
171. doi 10.1016/j.cclet.2013.09.016
Voelter W. Z. Naturforsch. 2020, 75, 559-565. doi
10.1515/znb.2020-0027
59. Azizian J., Hatamjafari F., Karimi A.R., Shaabanza-
deh M. Synthesis. 2006, 37, 765-767. doi 10.1055/s-
69. Hamed E.O., Assy M.G., Galahom M.M. Russ.
2006-926327
J. Org. Chem. 2020, 56, 1062-1069. doi 10.1134/
S1070428020060159
60. Yavari I., Seyfi S., Nematpour M., Hossaini Z. Helv.
Chim. Acta.
2010,
93,
1413-1417. doi
10.1002/
70. El-Sayed H.A., Assy M.G., Mahmoud W.M., El-
Sheakt A.A., Morsy H.A. Russ. J. Org. Chem. 2020,
hlca.200900408
90, 148-153. doi 10.1134/S1070363220010235
61. Hemmerling H.-J., Reiss G. Synthesis. 2009, 40, 985-
71. Mandal S., Pramanik A. Tetrahedron. 2019, 76, 130817.
999. doi 10.1055/s-0028-1087983
doi 10.1016/j.tet.2019.130817
62. Liu C.-Z., Han Y., Qi W.-J., Yan C.-G. Heterocycl.
72. Wang J., Zhang M.M., Wang X.S. Res. Chem. Intermed.
Commun. 2016, 22, 301-306. doi 10.1515/hc-2016-
2017, 43, 2985-3005. doi 10.1007/s11164-016-2807-1
0123
73. Marthy V.N., Nikumbh S.P., Kumar S.P., Chiranjee-
63. Mousavi S.H., Mohammadizadeh M.R., Roshan Z.,
vi Y., Rao L.V., Raghunadh A. Synlett. 2016, 27, 2362-
Jamaleddini A., Arimitsu S. ACS Omega. 2020, 5,
2367. doi 10.1055/s-0035-1562465
18273-18288. doi 10.1021/acsomega.0c01934
74. Devi R.V., Garande A.M., Maity D.K., Bhate P.M.
64. Yang C., Schanne F.A.X., Yoganathan S., Stepha-
J. Org. Chem. 2016, 81, 1689-1695. doi 10.1021/
ni R.A. Bioorg. Med. Chem. Lett. 2016, 26, 2912-2914.
acs.joc.5b02327
doi 10.1016/j.bmcl.2016.04.040
75. Доценко В.В., Муравьев В.С., Лукина Д.Ю., Стрел-
65. Shtamburg V.G., Shtamburg V.V., Anishchenko A.A.,
ков В.Д., Аксенов Н.А., Аксенова И.В., Крапи-
Shishkina S.V., Mazepa A.V., Konovalova I.S. Eur.
вин Г.Д., Дядюченко Л.В. ЖОХ. 2020, 90, 843-847.
Chem. Bull.
2020,
95,
125-131. doi
10.17628/
[Dotsenko V.V., Muraviev V.S., Lukina D.Yu., Strel-
ecb.2020.125-131
kov V.D., Aksenov N.A., Aksenova I.V., Krapivin G.D.,
66. Shtamburg V.G., Shtamburg V.V., Anishchenko A.A.,
Dyadyuchenko L.V. Russ. J. Gen. Chem. 2020, 90,
Mazepa A.V., Rusanov E.B. J. Mol. Struct. 2021, 1248,
948-960.] doi 10.1134/S1070363220060043
131443. doi 10.1016/j.molstruc.2021.131443
76. Akbarzadeh P., Koukabi N. Appl. Organometall. Chem.
67. Shtamburg V.G., Shtamburg V.V., Anishchenko A.A.,
2020, e5746. doi 10.1002/aoc.5474
Rusanov E.B., Kravchenko S.V. J. Chem. Technol. 2021,
77. Gonzalez-Onate A., Quevedo R. J. Chem. Sci. 2020,
29, 232-239. doi 10.15421/jchemtech.v29i2.231195
132, 49. doi 10.1007/s12039-020-1751-1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
НОВЫЕ НАПР
АВЛЕНИЯ ПРИМЕНЕНИЯ НИНГИДРИНА
37
New Applications of Ninhydrin in the Synthesis
of Polyheterocyclic Compounds
A. V. Velikorodova, b, *, A. S. Zukhairaevab, E. N. Kutlalievaa, b,
E. A. Shustovab, and S. B. Nosacheva
a Astrakhan State University, pl. Shahumyana, 1, Astrakhan, 414000 Russia
b Astrakhan State Medical University, ul. Bakinskaya, 121, Astrakhan, 414000 Russia
*e-mail: avelikorodov@mail.ru
Received March 27, 2022; revised April 5, 2022; accepted April 13, 2022
The review demonstrates new areas of application of ninhydrin as a universal reagent in organic synthesis for
the construction of a wide range of polycyclic compounds with benzofuran, pyrroline, pyrrole, imidazole, py-
rimidine, propellanic and other fragments.
Keywords: ninhydrin, multicomponent reactions, ninhydrin adducts with phenols, amines, enamines, N-hy-
droxyureas, N,N'-dialkylureas, N-alkoxy-N'-arylureas, imidazo[1,5-a]pyridines, pyrimidine derivatives, poly-
heterocyclic compounds
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023