ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 1, с. 38-50
УДК 547.1’123 + 547.461.3’052.2 + 547.594.1 + 547.814.1 + 547.818.1 + 548.82 + 548.737
ТРЕХКОМПОНЕНТНЫЙ СИНТЕЗ
И КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ПРОИЗВОДНЫХ
2-АМИНО-3-ЦИАНО-4H-ПИРАНОВ И ТИОПИРАНА
© 2023 г. И. В. Дяченкоa, В. Д. Дяченкоa, П. В. Дороватовскийb, В. Н. Хрусталевc, d,
Д. Г. Ривераe, В. Г. Ненайденкоf, *
a Луганский государственный педагогический университет, Украина, 91011 Луганск, ул. Оборонная, 2
b Национальный исследовательский центр «Курчатовский институт»,
Россия, 123182 Москва, ул. Академика Курчатова, 1
c ФГАОУ ВО «Российский университет дружбы народов», Россия, 117198 Москва, ул. Миклухо-Маклая, 6
d ФГБУН Институт органической химии им. Н.Д. Зелинского, Россия 119991, Москва, Ленинский просп., 47
e Университет Гаваны, Куба, 10400 Гавана
f ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
Россия, 119991 Москва, Ленинские горы 1, стр. 3
*e-mail: nenajdenko@gmail.com
Поступила в редакцию 25.05.2022 г.
После доработки 10.06.2022 г.
Принята к публикации 12.06.2022 г.
На основе трехкомпонентной реакции альдегидов, димедона и CH-кислот синтезированы производные
2-амино-3-циано-4H-пирана и тиопирана. Их молекулярная и кристаллическая структура изучена ме-
тодом РСА.
Ключевые слова: трехкомпонентная реакция, димедон, малононитрил, цианотиоацетамид, селенамид,
4H-пиран, тиопиран, фуран, рентгеноструктурный анализ
DOI: 10.31857/S0514749223010020, EDN: PEWDUQ
ВВЕДЕНИЕ
протекающая в этаноламине при 20°С. При этом
получены производные конденсированные пира-
Производные 2-амино-3-циано-4H-пиранов из-
ны 4a и b.
вестны выраженной биологической активностью,
например, ингибирование SARS-Cov-2 [1], холин-
Вероятная схема этой реакции включает об-
эстеразы [2], бактерий Staphylococcus aureus [3, 4],
разование на первой стадии продуктов конден-
опухолей [5-7], ацетилхолинэстеразы [8] и тубер-
сации Кнёвенагеля - алкенов A, к которым про-
кулеза [9]. Представители этого класса гетероци-
исходит присоедиение по Михаэлю димедона 1.
клов способны проявлять антиоксидантную [10-
Образующиеся аддукты B претерпевают вну-
12] и противовоспалительную [13-15] активности.
тримолекулярную циклизацию, давая с выхода-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ми 81-88% производные пирана 4a, b (схема 1).
Этаноламин в данном процессе, по-видимому, вы-
Учитывая высокую практическую значимость
полняет роль основного катализатора. Ранее эти
замещенных
2-амино-3-циано-4H-пиранов и в
гетероциклы получали с использованием в каче-
продолжение работ по химии этих органических
стве основания пиперидина [21] и морфолина [22].
соединений [16-20] нами изучена трехкомпонент-
ная конденсация димедона 1 с малононитрилом 2
Обработка пирана 4a бромом в метаноле при
и бензальдегидом 3a, или 2-фенилпропаналем 3b,
облучении реакционной массы лампой на 500 Вт
38
ТРЕХКОМПОНЕНТНЫЙ СИНТЕЗ
39
Схема 1
O
R
CN
OH NH2
CN
+
+
RCHO
H2O
CN
CN
O
1
2
3a, b
A
1
O
Ph
O
R
O
R
Br
CN
CN
Br2/MeOH
CN
O NH
OH
2
O NH2
MeO
N
C
4a, b
B
Br
O
Ph
Ph
O
O
Ph
Br
Br
CN
Br
CN
CN
Br
Br
HBr,
O
HCN
O
O
NH
OH
MeO NH
MeO
MeO
OMe
MeO
D
E
5
3, 4, R = Ph (a), PhCH2CH2 (b).
привела к получению с выходом 45% произво-
3-селеноксопропаноата 6 привело к образованию
дного бензофурана 5. По-видимому, на первой
производного пирана 7. Взаимодействие проте-
стадии реакции происходит образование интерме-
кает в абсолютном этаноле при 20°С в атмосфере
диата C, затем реализуется бромирование второй
аргона в присутствии эквимолярного количества
двойной связи, приводящее к 3,3a-дибромпроиз-
N-метилморфолина. Предположительно, первой
водному D. Последующее раскрытие пиранового
стадией реакции является образование алкена
цикла приводит к образованию циклогексанона E,
Кнёвенагеля F, к которому по Михаэлю присое-
трансформирующегося далее в конечную струк-
диняется CH-кислота 6. Образовавшийся аддукт
туру 5 путем сужения цикла (схема 1). Отметим,
хемоселективно циклизуется с элиминированием
что ранее показано, что пираны типа 4 под дей-
селеноводорода, давая продукт 7 (схема 2).
ствием брома в метаноле способны раскрывать ге-
тероцикл до образования метилового эфира 3-(4-
Неожиданный результат был получен нами при
гидроксифенил)-3-(4,4-диметил-2,6-диоксоцикло-
изучении трехкомпонентной реакции димедона 1,
гекс-1-ил)-2-цианакриловой кислоты
[23], под
цианотиоацетамида
8 и
3-циклогексенкарбаль-
действием серной кислоты в кипящей муравьи-
дегида 9, протекающей в этаноламине при 20°С.
ной до 3-арил-3-(4,4-диметил-2-гидрокси-6-оксо-
Реакция приводит к образованию производного
циклогекс-1-ен-1-ил)пропионовой кислоты
[24]
4H-тиопирана 10. Этот результат можно объяснить
и под действием окислителей - 1-хлорпирроли-
тем, что на стадии образования аддукта Михаэля
дин-2,5-диона, йода, хлората натрия или гипохло-
реализуется конкурентная реакция. Вместо диме-
рита натрия - до алкил-3-арил-6,6-диметил-4-ок-
дона 1 происходит присоединение по Михаэлю
со-3-октагидробензофуран-2-карбоксилатов [25].
второго моля CH-кислоты 8, после чего протекает
Вовлечение в схожую конденсацию с димедо-
хемоселективная внутримолекулярная циклиза-
ном 1 n-хлорбензальдегида 5 и метил-3-амино-
ция в тиопиран 10. Максимальный выход соедине-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
40
ДЯЧЕНКО и др.
Схема 2
Cl
COOMe
Cl
Cl
,
Se
NH2
CHO
5
6
6
1
O
COOMe
COOMe
CN
Se
NH2
OH NH2 ,
OH
Se
NH2
F
G
H2N
S
CHO
8
9
H2Se
Cl
O
NC
CN
NC
CN
H2S
COOMe
S
NH2
S
NH2
H2N
S
NH2
O NH
2
H
10
7
ния 10 был достигнут при соотношении реаген-
единения 4b и соответствующая нумерация ато-
тов 8 и 9 соответственно 2:1, что подтвержда-
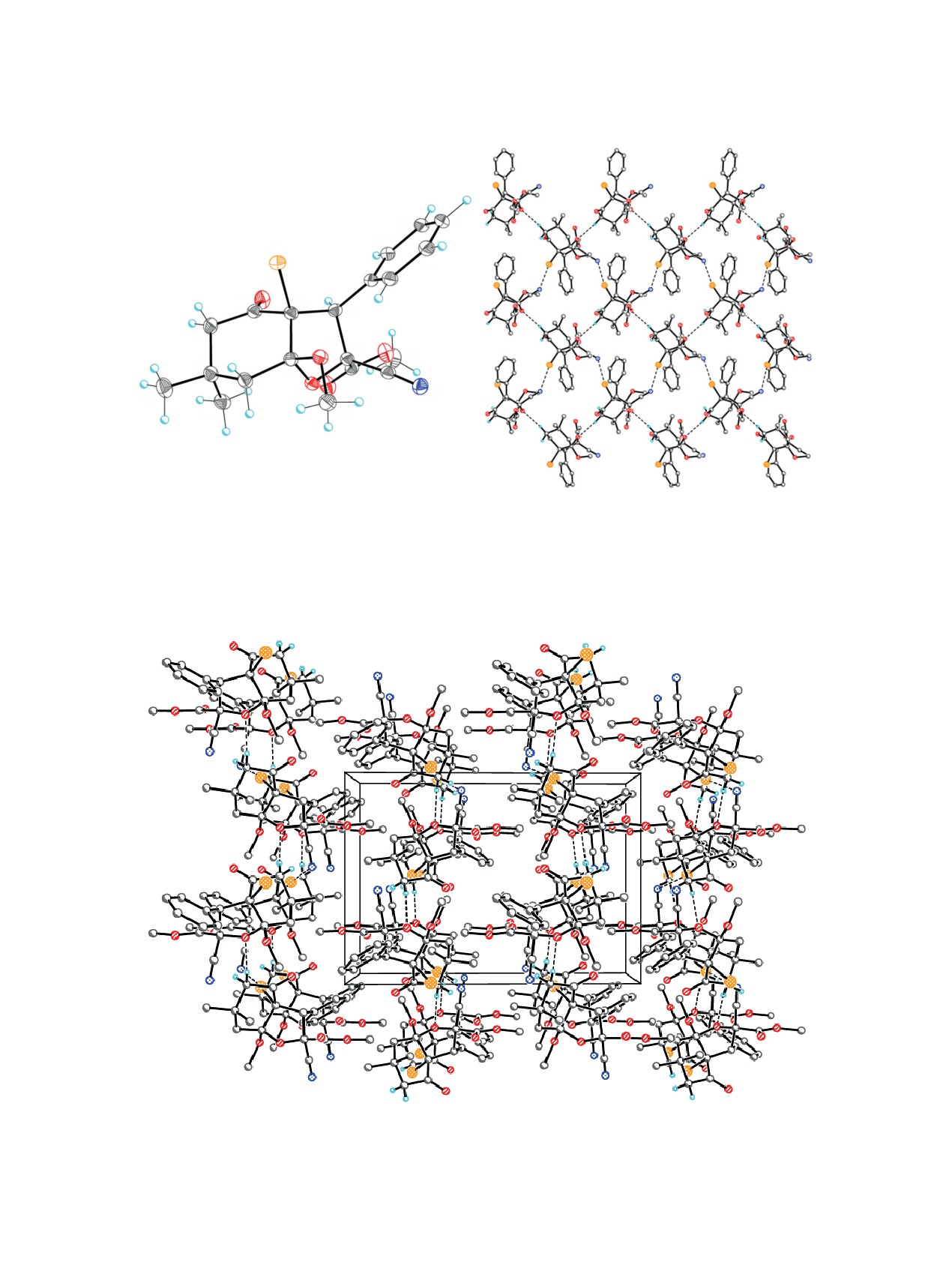
мов представлены на рис. 1.
ет предложенную схему реакции (схема
2).
γ-Пирановый цикл основного бициклического
Отметим, что соединение 10 получено нами ра-
хроменового фрагмента в молекуле 4b принимает
нее путем взаимодействия малононитрила 2 с
конформацию сильно уплощенной ванны с откло-
цианотиоацетамидом
8 и циклогексенкарбаль-
нением атомов кислорода O1 и углерода C4 от ба-
дегидом 9 в этаноле в присутствии морфолина
зальной плоскости, проходящей через остальные
[26].
атомы цикла, на 0.092(2) и 0.208(2)°, соответствен-
Спектральные характеристики подтверждают
но. Циклогексеновый цикл хроменового бицикла
строение синтезированных соединений 4a, b, 5,
обладает конформацией несимметричной полуван-
7, 10. В ИК спектрах наблюдаются характеристи-
ны с отклонением атомов углерода C7 и C8 от ба-
ческие полосы поглощения валентных колебаний
зальной плоскости, проходящей через остальные
функциональных групп их молекул. В спектрах
атомы цикла, на 0.752(3) и 0.187(3)°, соответствен-
ЯМР 1H присутствуют сигналы всех протонов
но. Фенилэтильный заместитель имеет транс-кон-
заместителей и циклов в характерных областях
формацию этиленового мостика [торсионный угол
δ. Спектры ЯМР 13C содержат сигналы всех ато-
C4-C9-C10-C11 равен -169.47(13)°] и занимает ме-
мов углерода в соответствующих областях δ (экс-
нее стерически предпочтительное псевдо-аксиаль-
периментальная часть). С целью однозначного
ное положение, с углом 63.41(7)° между плоско-
установления направления протекания изученных
стью бензольного цикла и базальной плоскостью
многокомпонентных конденсаций и выяснения
γ-пиранового цикла. Атом азота N2 имеет триго-
их механизма строение соединений 4b, 5, 7 и 10
нально-планарную конфигурацию [сумма валент-
изучено методом РСА. Строение молекулы со-
ных углов равна 359(5)°]. Молекула соединения 4b
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
ТРЕХКОМПОНЕНТНЫЙ СИНТЕЗ
41
C14
C15
C13
C16
a
C12
C11
C10
C9
O2
C5
17
C4
C
N1
C6
C1
C3
0
c
C4A
C7
b
C8
C18
C2
C8A
O1
N2
Рис. 1. Молекулярная и кристаллическая структура соединения 4b, демонстрирующая H-связанные ленты вдоль направ-
ления [010]. Штрихами показаны межмолекулярные водородные связи.
содержит асимметрический центр при атоме угле-
В кристалле, молекулы соединения 5 образуют
рода C4.
гофрированные слои, паралллельные плоскости
(001), за счет слабых межмолекулярных водород-
Кристалл соединения 4b представляет рацемат.
ных связей C-H∙∙∙O (табл. 1) и невалентных взаи-
В кристалле, молекулы соединения 4b образуют
модействий Br1∙∙∙N1 [0.5-x, 0.5+y, 0.5-z] 3.097(3)°
ленты в направлении кристаллографической оси
(рис. 3). Далее слои расположены на ван-дер-ва-
b за счет достаточно прочных межмолекулярных
альсовых расстояниях (рис. 4).
водородных связей N-H∙∙∙N и N-H∙∙∙O (табл. 1,
рис. 2). Ленты расположены на ван-дер-ваальсо-
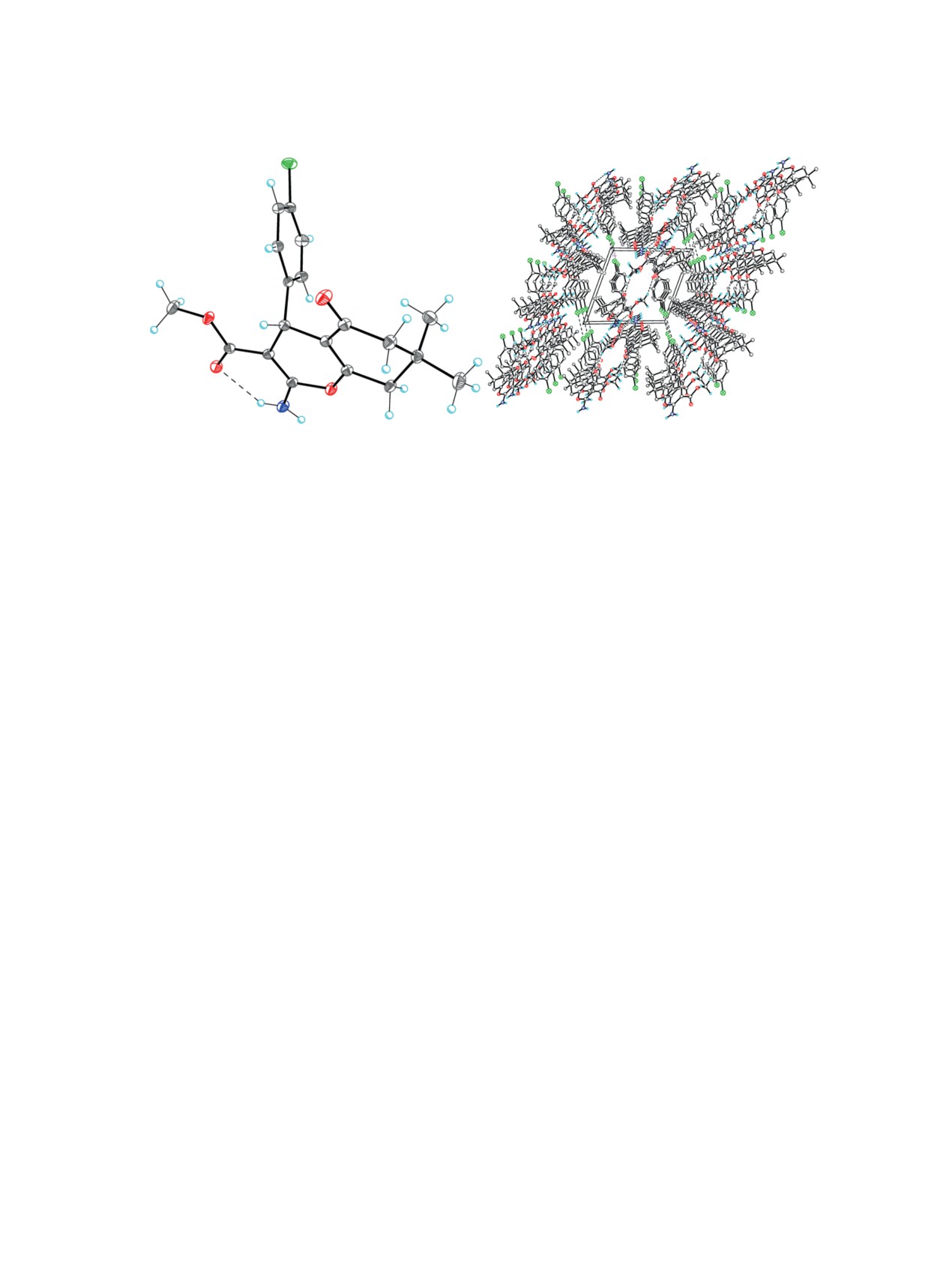
Строение молекулы соединения 7 и соответ-
вых расстояниях.
ствующая нумерация атомов представлены на
рис. 5. Строение молекулы соединения 7 полностью
Строение молекулы соединения 5 и соответ-
аналогично строению молекулы соединения 4b.
ствующая нумерация атомов представлены на
Так, γ-пирановый цикл основного бициклического
рис. 3. Циклогексановый и тетрагидрофурановый
хроменового фрагмента в молекуле 7 также при-
циклы центрального октагидробензофуранового
нимает конформацию сильно уплощенной ванны
бицикла в молекуле соединения 5 принимают ти-
пичные конформации слегка искаженного кресла
с отклонением атомов кислорода O1 и углерода C4
(базальная плоскость C4-C5/C7-C8) и конверта
от базальной плоскости, проходящей через осталь-
(базальная плоскость O1-C2-C3-C4), соответ-
ные атомы цикла, на 0.089(2) и 0.181(2)°, соответ-
ственно. Шестичленный и пятичленный циклы
ственно. Циклогексеновый цикл хроменового би-
имеют цис-сочленение с углом между базальны-
цикла обладает конформацией несимметричной
ми плоскостями 70.60(2)°. Молекула соединения 5
полуванны с отклонением атомов углерода C7 и
содержит четыре асимметрических центра при
C8 от базальной плоскости, проходящей через
атомах углерода C2, C3, C4 и C9. Кристалл соедине-
остальные атомы цикла, на 0.706(3) и 0.121(3)°,
ния 5 представляет рацемат с относительной конфи-
соответственно. п-Хлорфенильный заместитель
гурацией хиральных центров - 2SR,3SR,4RS,9RS.
занимает менее стерически предпочтительное
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
42
ДЯЧЕНКО и др.
Таблица 1. Водородные связи в структурах 4b, 5, 7 и 10 (Å и град)
D-H∙∙∙A
d(D-H)
d(H∙∙∙A)
d(D∙∙∙A)
Угол (DHA)
Соединение 4b
N2-H2A∙∙∙N1a
0.92(2)
2.25(2)
3.101(2)
153.8(18)
N2-H2B∙∙∙O2b
0.89(2)
1.98(2)
2.8528(19)
169.2(19)
Соединение 5
C6-H6A∙∙∙O1c
0.99
2.50
3.487(3)
173
Соединение 7
N1-H1A∙∙∙O2
0.897(18)
2.069(18)
2.6930(16)
125.8(14)
N1-H1A∙∙∙O2d
0.897(18)
2.164(18)
2.9579(15)
147.2(15)
N1-H1B∙∙∙Cl1b
0.850(18)
2.927(18)
3.7347(13)
159.4(15)
C9-H9A∙∙∙O4e
0.98
2.44
3.3882(17)
164
Соединение 10
N1-H1A∙∙∙N3f
0.90
2.22
3.118(3)
176
N1-H1B∙∙∙N2b
0.90
2.53
3.229(3)
135
N4-H4A∙∙∙N2g
0.90
2.12
2.995(3)
165
N4-H4B∙∙∙N3b
0.90
2.30
3.150(3)
157
a Кристаллографические операции для генерации симметрически эквивалентных атомов: -x+1/2, y+1/2, -z+3/2
b Кристаллографические операции для генерации симметрически эквивалентных атомов: x, y+1, z
c Кристаллографические операции для генерации симметрически эквивалентных атомов: -x+3/2, y+1/2, -z+1/2
d Кристаллографические операции для генерации симметрически эквивалентных атомов: -x+2, -y+2, -z+1
e Кристаллографические операции для генерации симметрически эквивалентных атомов: -x+1, -y+1, -z+1;
f Кристаллографические операции для генерации симметрически эквивалентных атомов: x+1/2, -y+1/2, z+1/2
g Кристаллографические операции для генерации симметрически эквивалентных атомов: x-1/2, -y+1/2, z-1/2
Рис. 2. H-связанная лента 4b. Штрихами показаны межмолекулярные водородные связи.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
ТРЕХКОМПОНЕНТНЫЙ СИНТЕЗ
43
C16
C15
C17
Br1
12
C14
C
O4
C3
C13
C5
C4
C6
O5
O3
C2
C11
C7
C8
N1
C9
C10
O2
C1
19
O1
C
C18
C20
Рис. 3. Молекулярная структура 5 в представлении атомов эллипсоидами анизотропных смещений с 50% вероятностью.
Справа показано строение слоя соединения 5. Штриховыми линиями показаны межмолекулярные водородные связи
C-H∙∙∙O и невалентные взаимодействия Br∙∙∙N.
псевдо-аксиальное положение, с углом 77.45(5)°
базальной плоскости γ-пиранового цикла [меж-
между плоскостью бензольного цикла и базаль-
плоскостной угол равен 6.50(13)°]. Такое распо-
ной плоскостью γ-пиранового цикла. Ацетильный
ложение стабилизируется внутримолекулярной
заместитель расположен практически копланарно
водородной связью N-H∙∙∙O (табл. 1). Атом азота
a
c
0
b
Рис. 4. Кристаллическая структура соединения 5, демонстрирующая гофрированные слои, параллельные плоскости (001).
Штриховыми линиями показаны межмолекулярные водородные связи C-H∙∙∙O и невалентные взаимодействия Br∙∙∙N.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
44
ДЯЧЕНКО и др.
Cl1
C13
C12
C14
C11
a
0
c
C15
C10
O3
C17
C9
C4
C5
C4A
b
6
C
C1
C3
C7
C16
O2
2
C8A
C
O1
C8
N1
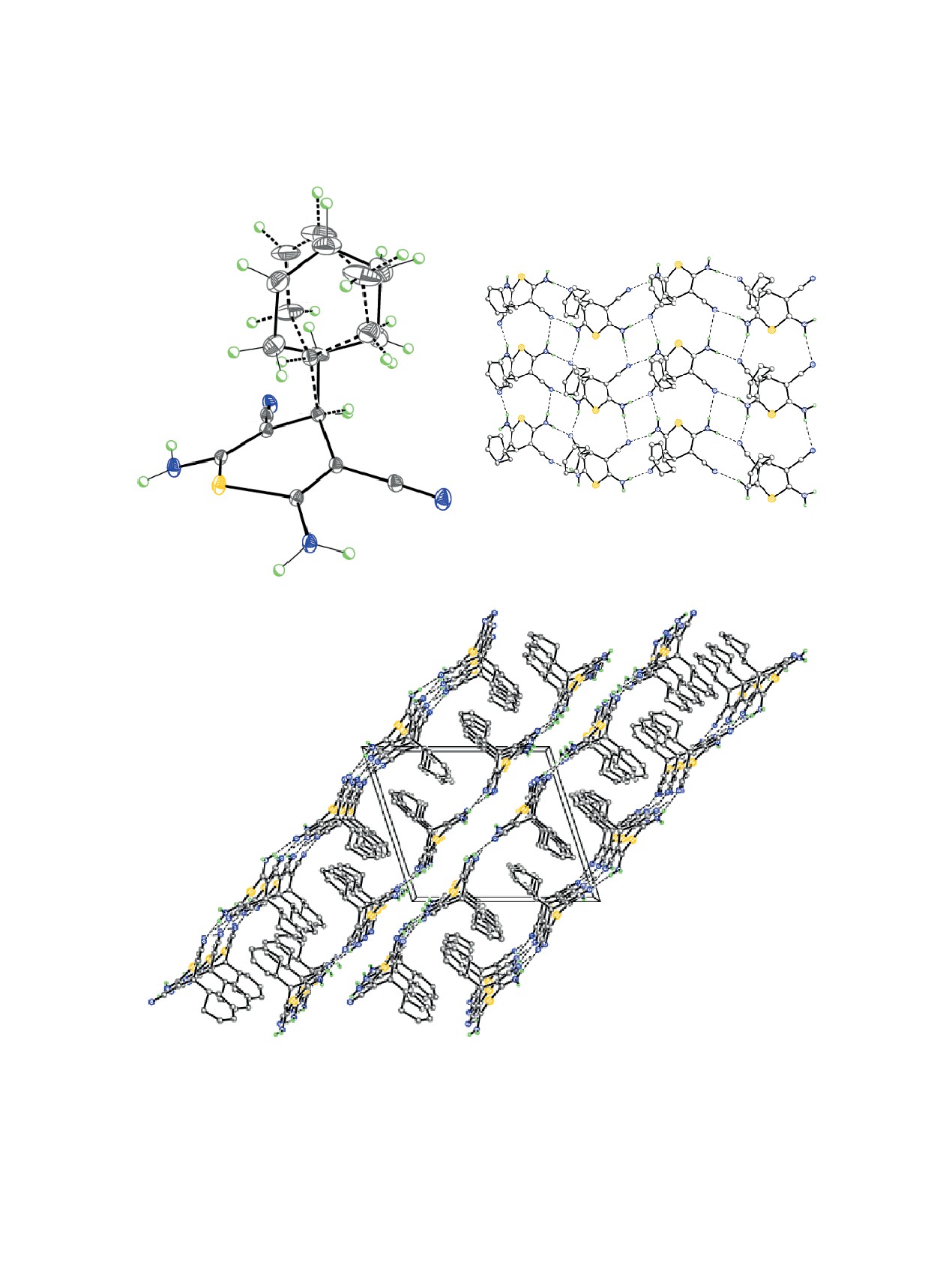
Рис. 5. Молекулярная структура соединения 7 в представлении атомов эллипсоидами анизотропных смещений с 50% ве-
роятностью. Справа дана кристаллическая структура соединения 7, демонстрирующая двухъярусные слои, параллельные
плоскости (001). Штриховыми линиями показаны межмолекулярные водородные связи и невалентные взаимодействия
Cl∙∙∙Cl.
N1 имеет тригонально-планарную конфигурацию
межмолекулярных водородных связей N-H∙∙∙N
[сумма валентных углов равна 359(4)°]. Так же,
(табл. 1, рис. 6, b). Слои расположены на ван-дер-
как и молекула 4b, молекула соединения 7 содер-
ваальсовых расстояниях и упакованы по типу за-
жит асимметрический центр при атоме углерода
стежка «молния» (рис. 6, c).
C4. Кристалл соединения 7 представляет рацемат.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В кристалле, однако, в отличие от соединения 4b,
молекулы соединения 7 образуют двухъярусные
ИK спектры получали на приборе Varian Vertex
слои, параллельные плоскости (001), за счет ме-
70 в таблетках KBr. Спектры ЯМР 1H и 13C реги-
жмолекулярных водородных связей N-H∙∙∙Cl,
стрировали на спектрофотометре Varian VXR-400
N-H∙∙∙O и C-H∙∙∙O (табл. 1, рис. 5). Далее слои свя-
(399.97 и 100 МГц соответственно) в растворах
заны в трехмерный каркас посредством невалент-
DMSO-d6, внутренний стандарт - TMC. Масс-
ных взаимодействий Cl∙∙∙Cl 3.4432(7)°.
спектры получали на масс-спектрометре высоко-
го разрешения Orbitrap Elite. Образец для HRMS
Строение молекулы соединения 10 и соответ-
растворяли в 1 мл ДМСО, разбавляли в 100 раз
ствующая нумерация атомов представлены на
1%-ной HCOOH в CH3CN, вводили шприцевым
рис. 6. Центральный 4H-тиопирановый цикл в
насосом со скоростью 40 мкл/мин в источник
молекуле 10 принимает конформацию ванны с
ионизации электрораспылением. Потоки газов
отклонением атомов серы S1 и углерода C4 от ба-
источника были отключены, напряжение на игле
зальной плоскости, проходящей через остальные
составляло 3.5 кВ, температура капилляра 275°С.
атомы цикла, на 0.435(4) и 0.505(4)°, соответ-
ственно. Циклогексеновый заместитель занимает
Масс-спектр регистрировали в режимах положи-
менее стерически предпочтительное аксиальное
тельных и отрицательных ионов в орбитальной
положение. Атом азота N1 имеет тригонально-пла-
ловушке с разрешением 480000. Внутренние кали-
нарную конфигурацию (сумма валентных углов
бранты - ион 2ДМСО + Н+ (m/z 157.03515) в по-
равна 359.3°), в то время как атом азота N4 - три-
ложительных ионах и додецилсульфат-анион (m/z
гонально-пирамидальную (сумма валентных углов
265.14789) в отрицательных ионах. Элементный
равна 352.6°). Молекула соединения 10 содержит
анализ осуществляли на приборе Perkin Elmer
асимметрический центр при атоме углерода C4.
CHN-analyser. Температуры плавления определя-
Кристалл соединения 10 представляет рацемат.
ли на блоке Кофлера. Ход реакции и чистоту по-
В кристалле, молекулы соединения 10 образу-
лученных соединений контролировали методом
ют слои, паралллельные плоскости (10¯1), за счет
ТСХ на пластинках Silufol UV-254 в системе аце-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
ТРЕХКОМПОНЕНТНЫЙ СИНТЕЗ
45
(a)
(b)
C11'
C11
C12'
C10'
C10
C12
C13'
C9
C9'
C13
C8
C8'
N3
C14
C4
C5
C6
C3
C7
C2
N2
N4
S1
N1
(c)
a
0
c
b
Рис. 6. Молекулярная структура соединения 10 в представлении атомов эллипсоидами анизотропных смещений с 50%
вероятностью (a). Штриховыми линиями показана альтернативная позиция разупорядоченного циклогексенового заме-
стителя. Строение слоя соединения 10 (b). Штриховыми линиями показаны межмолекулярные водородные связи N-H∙∙∙N.
Справа (c) дана кристаллическая структура соединения 10, демонстрирующая H-связанные слои, параллельные плоскости
(1 01). Штриховыми линиями показаны межмолекулярные водородные связи N-H∙∙∙N.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
46
ДЯЧЕНКО и др.
тон-гексан (3:5), проявление парами йода и УФ-
мов, длин связей, валентных и торсионных углов
облучением.
и анизотропных параметров смещения для соеди-
нений 4b, 5, 7 и 10 депонированы в Кембриджском
Параметры элементарных ячеек и интенсивно-
Банке Структурных Данных, номера депониро-
сти отражений для кристаллов соединений 4b, 7 и
вания - CCDC 2143982 (4b), CCDC 2143983 (5),
10 измерены на дифрактометре Bruker D8 QUEST
CCDC 2143984 (7) и CCDC 2143985 (10).
PHOTON-III CCD (графитовый монохроматор, φ-
и ω-сканирование). Обработка экспериментальных
2-Амино-7,7-диметил-5-оксо-4-фенил-
данных проведена с помощью программы SAINT
5,6,7,8-тетрагидро-4H-хромен-3-карбонитрил
[27]. Для полученных данных проведен учет по-
(4a). Смесь 1.0 мл (10 ммоль) бензальдегида 3a
глощения рентгеновского излучения по программе
и 0.66 г (10 ммоль) малононитрила 2 в 15 мл эта-
SADABS [28]. Параметры элементарной ячейки
ноламина при 20°С перемешивали 25 мин и при-
и интенсивности отражений для кристалла сое-
бавляли 1.4 г (10 ммоль) димедона 1, перемеши-
динения 5 измерены на синхротронной станции
вали 25 мин и оставляли. Через 48 ч реакционную
«РСА» Национального исследовательского центра
смесь разбавляли равным объемом воды и отфиль-
«Курчатовский институт», используя двухкоорди-
тровывали образовавшийся осадок. Промывали
натный детектор Rayonix SX165 CCD (φ-сканиро-
водой, этанолом и гексаном. Выход 3.6 г (88%),
вание с шагом 1.0°). Обработка эксперименталь-
бесцветные кристаллы, т.пл. 238-240°С (EtOH),
ных данных проведена с помощью программы
237-238°С [21].
iMOSFLM, входящей в комплекс программ CCP4
2-Амино-7,7-диметил-5-оксо-4-(2-фенил-
[29]. Для полученных данных проведен учет по-
этил)-5,6,7,8-тетрагидро-4H-хромен-2-карбони-
глощения рентгеновского излучения по програм-
трил (4b). Получали аналогично соединению 4a
ме Scala [30]. Основные кристаллоструктурные
при соответствующем использовании 1.34 г 3-фе-
данные и параметры уточнения представлены в
нилпропионового альдегида 3b. Выход 2.6 г (81%),
табл. 2.
бесцветные кристаллы, т.пл. 197-198°С (EtOH),
199-200°С [22]. Спектр ЯМР 13С, δ, м.д.: 23.2, 24.5,
Структуры определены прямыми методами и
25.5, 26.8, 27.9, 32.3, 46.3, 51.2, 108.5, 116.3, 121.9
уточнены полноматричным методом наименьших
(2C), 124.4 (2C), 124.6 (2C), 137.9, 156.2, 159.5,
квадратов по F2 в анизотропном приближении для
192.6. Масс-спектр (HRMS, ESI), m/z: 323.1759
неводородных атомов. Циклогексеновый цикл в
[M + H]+. C20H22N2O2. M + H 323.1681.
соединении 10 разупорядочен по двум положе-
ниям с равными заселенностями. Атомы водоро-
Метил
3a-бром-6,6-диметил-7a-метокси-4-
да амино-групп в соединениях 4b и 7 выявлены
оксо-3-фенил-2-цианооктагидробензофуран-2-
объективно в разностных Фурье-синтезах и уточ-
карбоксилат (5). В перемешиваемую на магнит-
нены изотропно с фиксированными параметрами
ной мешалке и облучаемую лампой на 500 Вт
смещения [Uизо(H) = 1.2Uэкв(N)]. Атомы водорода
смесь 2.94 г (10 ммоль) пирана 4a в 30 мл мета-
амино-групп в соединении 10 выявлены объек-
нола при комнатной температуре прикапывали
тивно в разностных Фурье-синтезах и включены
0.51 мл (10 ммоль) брома со скоростью исчезно-
в уточнение с фиксированными позиционными
вения розовой окраски в реакционной смеси, на
параметрами (модель наездника) и изотропными
что понадобилось 15 мин. Затем перемешивание
параметрами смещения [Uизо(H) = 1.2Uэкв(N)].
продолжали в течение 60 мин и оставляли в холо-
Положения остальных атомов водорода во всех
дильнике. Через 24 ч реакционную смесь разбав-
соединениях рассчитаны геометрически и включе-
ляли равным объемом воды и оставляли еще на
ны в уточнение с фиксированными позиционными
24 ч при комнатной температуре. Образовавшийся
параметрами (модель наездника) и изотропными
бесцветный иглообразный осадок отфильтровы-
параметрами смещения [Uизо(H) = 1.5Uэкв(C) для
вали, последовательно промывали водой, мета-
CH3-групп и 1.2Uэкв(C) для остальных групп]. Все
нолом и гексаном. Выход 1.9 г (45%), т.пл. 208-
расчеты проведены с использованием комплекса
210°С. ИК спектр, ν, см-1: 2245 (C≡N), 1715 (C=O),
программ SHELXTL [31]. Таблицы координат ато-
1702 (C=O). Спектр ЯМР 1Н, δ, м.д. (J, Гц): 1.01
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
ТРЕХКОМПОНЕНТНЫЙ СИНТЕЗ
47
Таблица 2. Кристаллоструктурные данные для соединений 4b, 5, 7 и 10
Соединение
4b
5
7
10
Элементный состав
C20H22N2O2
C20H22BrNO5
C19H20ClNO4
C13H14N4S
Молекулярная масса
322.40
436.29
361.81
258.34
λ, Å
0.71073
0.79313
0.71073
0.71073
T, K
100(2)
100(2)
100(2)
100(2)
Размеры монокристалла, мм
0.12×0.15×0.15
0.15×0.15×0.20
0.12×0.15×0.15
0.09×0.12×0.15
Сингония
Моноклинная
Моноклинная
Триклинная
Моноклинная
Пространственная группа
С2/c
P21/n
P-1
P21/n
a, Å
17.9068(7)
10.462(2)
8.4306(7)
13.1978(12)
b, Å
7.7842(3)
11.383(2)
10.3027(9)
6.6851(6)
c, Å
25.0934(10)
16.001(3)
11.1579(10)
15.2544(14)
α, град
90
90
108.614(2)
90
β, град
102.5820(10)
92.75(3)
107.192(2)
108.248(3)
γ, град
90
90
91.954(2)
90
V, Å3
3413.8(2)
1903.4(6)
868.54(13)
1278.2(2)
Z
8
4
2
4
dc, г·см-3
1.255
1.523
1.383
1.342
F(000)
1376
896
380
544
μ, мм-1
0.082
2.865
0.244
0.241
2θмакс, град
2.87-32.63
2.45-31.00
2.70-32.66
2.46-30.63
Измеренных отражений
30093
21259
14998
19149
Независимых отражений, Rint
6228, 0.107
4338, 0.044
6327, 0.040
3891, 0.098
Наблюденных отражений [с I > 2 σ(I)]
3701
3978
4654
2586
Уточняемых параметров
225
248
235
217
R1 [I > 2σ(I)]
0.060
0.044
0.045
0.072
wR2 (все данные)
0.143
0.106
0.110
0.192
GOF по F2
1.037
1.032
1.045
1.027
Tмин; Tмакс
0.975; 0.987
0.561; 0.636
0.954; 0.963
0.959; 0.972
Коэффициент экстинкции
-
0.0072(7)
-
-
Δρмакс; Δρмин, eÅ-3
0.350; -0.321
0.656; -0.949
0.422; -0.339
0.680; -0.366
с (3H, Ме), 1.12 с (3H, Ме), 2.06 д (1Н, CH2, 2J
δ, м.д.: 26.1, 32.2, 32.7, 48.5, 50.2, 54.3, 55.1, 66.2,
14.8), 2.25 д (1Н, CH2, 2J 14.8), 3.21 д (1Н, CH2, 2J
80.04, 111.6, 115.5, 128.4 (2C), 129.2, 133.0 (2C),
17.8), 3.27 д (1Н, CH2, 2J 17.8), 3.50 с (3H, МеO),
135.2, 165.4, 199.2, 207.5. Масс-спектр (HRMS,
3.84 с (3H, MeOCO), 4.95 с (1Н, Н3), 7.28-7.41 м
ESI), m/z: 437.0681 [M + H]+. C20H22BrNO5. M +
(3Наром), 7.53-7.62 м (2Наром). Спектр ЯМР 13С,
437.0597.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
48
ДЯЧЕНКО и др.
Метил-2-амино-7,7-диметил-5-оксо-4-(4-
ФОНДОВАЯ ПОДДЕРЖКА
хлорфенил)-5,6,7,8-тетрагидро-4H-хромен-3-
Работа выполнена при финансовой поддержке
карбоксилат (7). К перемешиваемой смеси 1.4 г
РФФИ (проект № 18-53-34002) и Министерства на-
(10 ммоль) 4-хлорбензальдегида 5 в 20 мл абсо-
уки и высшего образования Российской Федерации
лютного этанола при 20°С под аргоном прибав-
(проект № 075-03-2020-223 (FSSF-2020-0017)).
ляли 1.81 г (10 ммоль) CH-кислоты 6 и 1.1 мл
ИНФОРМАЦИЯ ОБ АВТОРАХ
(10 ммоль) N-метилморфолина, перемешивали
30 мин и прибавляли 1.4 г (10 ммоль) димедо-
Дяченко Иван Владимирович, ORCID: https://
на 1, продолжая перемешивание еще 1 ч. Затем ре-
orcid.org/0000-0001-7255-3446
акционную смесь оставляли на 24 ч и образовав-
Дяченко Владимир Данилович, ORCID: https://
шийся осадок отфильтровывали, промывали эта-
orcid.org/0000-0002-0993-4091
нолом и гексаном. Выход 2.8 г (78%), бесцветные
кубические кристаллы, т.пл. 173-175°С (EtOH).
Хрусталев Виктор Николаевич, ORCID: https://
ИК спектр, ν, см-1: 3408, 3345, 3241 (NH2), 1696,
orcid.org/0000-0001-8806-2975
1713 (C=O), 1649 (δNH2). Спектр ЯМР 1Н, δ, м.д.
Ненайденко Валентин Георгиевич, ORCID:
(J, Гц): 0.85 с (3H, Ме), 1.00 с (3H, Ме), 2.03 д (1Н,
CH2, 2J 16.1), 2.23 д (1Н, CH2, 2J 16.1), 2.45 д (1Н,
КОНФЛИКТ ИНТЕРЕСОВ
CH2, 2J 17.6), 2.47 д (1Н, CH2, 2J 17.6), 3.47 с (3H,
МеO), 4.48 с (1Н, Н4), 7.10 д (2Hаром, J 8.4), 7.23 д
Авторы заявляют об отсутствии конфликта ин-
(2Наром, J 8.4), 7.59 уш.с (2H, NH2). Спектр ЯМР
тересов.
13С, δ, м.д.: 26.9, 29.1, 32.3, 33.3, 50.3, 51.0, 77.6,
СПИСОК ЛИТЕРАТУРЫ
115.6, 128.2 (2C), 128.6, 129.8, 130.8 (2C), 145.8,
1. Nesaragi A.R., Kamble R.R., Hoolageri S.R., Mavaz-
159.7, 162.7, 168.6, 196.2. Масс-спектр (HRMS,
zan A., Madar S.F., Anand A., Joshi S.D. Appl.
ESI), m/z: 362.1162 [M + H]+. C19H20ClNO4. M + H
Organomet. Chem. 2021, 10, 1-21. doi 10.1002/
362.1081.
aoc.6469
2,6-Диамино-4-(3-циклогексен-1-ил)-4H-
2. Eghtedari M., Sarrafi Y., Nadri H., Mahdavi M.,
тиопиран-3,5-дикарбонитрил (10). К перемеши-
Moradi A., Moghadam F.H., Emami S., Firoozpour L.,
ваемому раствору 0.94 мл (10 ммоль) альдегида 9
Asadipour A., Sabzevari O., Foroumadi A. Eur.
J. Med. Chem. 2017, 128, 237-246. doi 10.1016/
в 15 мл этаноламина при 20°С прибавляли 2.0 г
j.ejmech.2017.01.042
(20 ммоль) CH-кислоты 8, перемешивали 2 ч и
3. Abd-El-Aziz A.S., El-Agrody A.M., Bedair A.H.,
оставляли. Через 24 ч реакционную смесь раз-
Corkery T.C., Ata A. Heterocycles. 2004, 63, 1793-
бавляли равным объемом воды и отфильтровы-
1812. doi 10.3987/COM-04-10089
вали образовавшийся осадок. Промывали после-
4. Mishriky N., Girgis A.S., Asaad F.M., Ibrahim Y.A.,
довательно водой, этанолом и гексаном. Выход
Sobien U.I., Fawzy N.G. Boll. Chim. Farmac. 2001,
1.83 г (71%), желтые кристаллы, т.пл. 199-201°С
140, 129-139.
(AcOH), 199-201°С [26]. Спектр ЯМР 13С, δ, м.д.:
5. Recio R., Vengut-Climent E., Mouillac B., Orcel H.,
25.1, 26.3, 29.0, 44.5, 70.7, 71.1, 120.2, 126.2 (2C),
López-Lázaro M., Calderón-Montaño J.M., Álvarez E.,
127.1 (2C), 153.2, 153.3. Масс-спектр (HRMS, ESI),
Khiar N., Fernández I. Eur. J. Med. Chem. 2017, 138,
m/z: 259.1012 [M + H]+. C13H14N4S. M + H 259.0939.
644-660. doi 10.1016/j.ejmech.2017.06.056
6. Wardakhan W.W., Samir E.M., El-Arab E.E. Bull.
ЗАКЛЮЧЕНИЕ
Chem. Soc. Ethiop. 2018, 32, 259-270. doi 10.4314/
При взаимодействии димедона, малонони-
bcse.v32i2.7
трила и альдегидов в этаноламине образуются
7. Azzam R.A., Mohareb R.M. Chem. Pharm. Bull. 2015,
производные пирана, молекулярная и кристалли-
63, 1055-1064. doi 10.1248/cpb.c15-00685
ческая структура которых изучена методом РСА.
8. Marco-Contelles J., León R., López M.G., García A.G.,
Бромирование в метаноле приводит к сужению пи-
Villarroya M. Eur. J. Med. Chem. 2006, 41, 1464-1469.
ранового цикла в фурановый.
doi 10.1016/j.ejmech.2006.06.016
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
ТРЕХКОМПОНЕНТНЫЙ СИНТЕЗ
49
9. Thanh N.D., Hai D.S., Ha N.T.T., Tung D.T., Le C.T.,
Chem. 2005, 75, 952-960.] doi 10.1007/s11176-005-
Van H.T.K., Toan V.N., Toan D.N., Dang L.H. Bioorg.
0351-6
Med. Chem. Lett. 2019, 29, 164-171. doi 10.1016/
20. Дяченко В.Д., Пугач Ю.Ю. ЖОХ. 2012, 82, 844-849.
j.bmcl.2018.12.009
[Dyachenko V.D., Pugach Yu.Yu. Russ. J. Gen. Chem.
10. Saundane A.R., Vijaykumar K., Vaijinath A.V. Bioorg.
2012, 82, 921-926.] doi 10.1134/S1070363212050209.
Med. Chem. Lett. 2013, 23, 1978-1984. doi 10.1016/
21. Suáreza M., Salfrán E., Verdecia Y., Ochoa E., Alba L.,
j.bmcl.2013.02.036
Martın N., Martınez R., Quinteiro M., Seoane C.,
11. Boulebd H., Ismaili L., Bartolini M., Bouraiou A.,
Novoa H., Blaton N., Peeters O.M. Ranter C.
Andrisano V., Martin H., Bonet A., Moraleda I.,
Tetrahedron. 2002, 58, 953-960. doi 10.1016/S0040-
Iriepa I., Chioua M., Belfaitah A., Marco-Contelles J.
4020(01)01189-9
Molecules.
2016,
21,
1-16. doi
10.3390/
22. Дяченко В.Д., Чернега А.Н. ЖОрХ.
2006,
42,
molecules21040400
585-593. [Dyachenko V.D., Chernega A.N. Russ.
12. Al-Omar M.A., Youssef K.M., El-Sherbeny M.A.,
J. Org. Chem. 2006, 42, 567-576.] doi 10.1134/
Awadalla S.A.A., El-Subbagh H.I. Arch. Pharm. 2005,
S1070428006040142
338, 175-180. doi 10.1002/ardp.200400953
23. Дяченко В.Д. ЖОХ. 2004, 74, 1575-1576. [Dyachen-
13. AbdEl-Azim M.H.M., Aziz M.A., Mounier S.M., El-
ko V.D. Russ. J. Gen. Chem. 2004, 74, 1463-1464.] doi
10.1007/s11176-005-0035-2
Farargy A.F., Shehab W.S. Arch. Pharm. 2020, 354,
1-13. doi 10.1002/ardp.202000084
24. Andin A.N. Russ. J. Org. Chem. 2018, 53, 804-806. doi
10.1134/S1070428018050251
14. Mahmoud N.F.H., Balamon M.G. J. Heterocycl. Chem.
2020, 57, 3056-3070. doi 10.1002/jhet.4011
25. Chennapuram M., Emmadi N.R., Bingi C., Nanubo-
lu J.B., Atmakur K. Green Chem. 2014, 16, 3237-3246.
15. Ismail M.M.F., Khalifa N.M., Fahmy H.H., Nos-
doi 10.1039/C4GC00388H
sier E.S., Abdulla M.M. J. Heterocycl. Chem. 2014,
51, 450-458. doi 10.1002/jhet.1757
26. Дяченко В.Д. ЖОХ. 2005, 75, 1612-1619. [Dyachen-
ko V.D. Russ. J. Gen. Chem. 2005, 75, 1537-1544.] doi
16. Дяченко В.Д., Пугач Ю.Ю. ЖОХ. 2013, 83, 845-848.
10.1007/s11176-005-0463-z
[Dyachenko V.D., Pugach Yu.Yu. Russ. J. Gen. Chem.
2013, 83, 979-982.] doi 10.1134/S1070363213050162
27. SAINT, Bruker AXS Inc., Madison, WI, 2013.
17. Дяченко В.Д., Русанов Э.Б. ХГС.
2004,
51,
28. Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D.
270-281. [Dyachenko V.D., Rusanov E.B. Chem.
J. Appl. Crystallogr. 2015, 48, 3-10. doi 10.1107/
Heterocycl. Compd.
2004,
40,
231-240.] doi
S1600576714022985
10.1023/B:COHC.0000027898.06493.c5
29. Battye T.G.G., Kontogiannis L., Johnson O., Po-
18. Дяченко В.Д., Русанов Э.Б. ЖОрХ.
2006,
42,
well H.R., Leslie A.G.W. Acta Crystallogr., Sect. D.
1390-1394. [Dyachenko V.D., Rusanov E.B. Russ.
2011, 67, 271-281. doi 10.1107/S0907444910048675
J. Org. Chem. 2006, 42, 1374-1379.] doi 10.1134/
30. Evans P.R. Acta Crystallogr., Sect. D. 2006, 62, 72-82.
S1070428006090211
doi 10.1107/S0907444905036693
19. Дяченко В.Д., Чернега А.Н. ЖОХ. 2005, 75, 1007-
31. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
1016. [Dyachenko V.D., Chernega A.N. Russ. J. Gen.
3-8. doi 10.1107/S2053229614024218
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
50
ДЯЧЕНКО и др.
Three-Component Synthesis and Crystalline Structure
of 2-Amino-3-cyano-4H-pyran and Thiopyran Derivatives
I. V. Dyachenkoa, V. D. Dyachenkoa, P. V. Dorovatovskiib, V. N. Khrustalevc, d,
D. G. Riverae, and V. G. Nenajdenkof, *
a Lugansk State Pedagogical University, ul. Oboronnaya, 2, Lugansk, 91011 Ukraine
b National Research Center “Kurchatov Institute”, ul. Academika Kurchatova, 1, Moscow, 123182 Russia
c Peoples’ Friendship University of Russia (RUDN University), ul. Miklukho-Maklaya, 6, Moscow, 117198 Russia
d Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences, Leninsky prosp., 47, Moscow, 119991 Russia
e Gavana University, Gavana, 10400 Cuba
f Lomonosov Moscow State University, Leninskie Gory, 1/3, Moscow, 119991 Russia
*e-mail: nenajdenko@gmail.com
Received May 25, 2022; revised June 10, 2022; accepted June 12, 2022
Derivatives of 2-amino-3-cyano-4H-pyran and thiopyran were synthesized by three-component condensation
of aldehydes, dimedone and CH-acids. Their molecular and crystal structure was studied by X-ray diffraction
analysis.
Keywords: three-component reaction, dimedone, malononitrile, cyanothioacetamide, selenamide, 4H-pyrans,
thiopyran, furan, X-ray
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023