ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 1, с. 62-72
УДК 547.73 + 543.51
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ:
XXIV.1 ИССЛЕДОВАНИЕ N-[3-АЛКОКСИ-
И 3-(1Н-ПИРРОЛ-1-ИЛ)-2-ТИЕНИЛ]-
ИМИДОТИОКАРБАМАТОВ МЕТОДАМИ
ЭЛЕКТРОННОЙ И ХИМИЧЕСКОЙ ИОНИЗАЦИИ
© 2023 г. Л. В. Клыба*, Е. Р. Санжеева, Н. А. Недоля, О. А. Тарасова
ФГБУН «Иркутский институт химии им. А.Е. Фаворского СО РАН», Россия, 664033 Иркутск, ул. Фаворского, 1
*e-mail: klyba@irioch.irk.ru
Поступила в редакцию 11.03.2022 г.
После доработки 28.03.2022 г.
Принята к публикации 01.04.2022 г.
Впервые изучены свойства широкого ряда ранее неизвестных N-(2-тиенил)имидотиокарбаматов, синте-
зированных в одну препаративную стадию из гетерозамещённых алленов (метокси-, 1-этоксиэтокси- и
1Н-пиррол-1-илалленов) и алифатических, циклоалифатических и ароматических изотиоцианатов, при
электронной (70 эВ) и химической (газ-реагент - метан) ионизации. При ионизации электронами иссле-
дуемые соединения образуют неустойчивый молекулярный ион, основное направление фрагментации
которого связано с разрывом связи C-N в имидоформамидном фрагменте с локализацией заряда на
иминном атоме азота. Аналогичный канал распада молекулярного иона наблюдается и в масс-спектрах
химической ионизации исследуемых соединений. При этом характеристические, но малоинтенсивные
ионы в спектрах электронной ионизации N-(3-метокси-2-тиенил)имидотиокарбаматов становятся доми-
нирующими в спектрах химической ионизации. В спектрах химической ионизации N-[3-(1Н-пиррол-1-
ил)-2-тиенил]имидотиокарбаматов пик максимальной интенсивности принадлежит иону [M - SMe]+. Для
N-[3-(1-этоксиэтокси)-2-тиенил]имидотиокарбамата максимальную интенсивность имеет пик иона, обра-
зующегося при последовательном элиминировании из иона [M + H]+ молекул этоксиэтена и метантиола.
Ключевые слова: N-(3-метокси-2-тиенил)-, N-[3-(1-этоксиэтокси)-2-тиенил]- и N-[3-(1Н-пиррол-1-
ил)-2-тиенил]имидотиокарбаматы, электронная и химическая ионизация, масс-спектры, молекулярные
ионы, фрагментация
DOI: 10.31857/S0514749223010044, EDN: PFEXNU
ВВЕДЕНИЕ
тарилзамещённые [25-36], представляют большой
Тиофены и их производные являются одним
практический интерес в качестве ценных интер-
из наиболее важных классов в гетероциклической
медиатов в синтезе разнообразных гетероцикли-
химии [2-4] и находят широкое применение в ма-
ческих структур, органических катализаторов,
териаловедении [5-11], фармакологии [12-19], ме-
комплексообразователей, а также препаратов для
дицине [20, 21], органическом синтезе [22, 23] и
лечения ВИЧ и родственных вирусных заболева-
других областях [24].
ний, ингибиторов NO синтазы, агонистов и анта-
гонистов гистаминных и NMDA рецепторов, про-
В свою очередь, тиомочевины и изотиомочеви-
тивораковых, бактерицидных, гипотензивных и
ны (имидотиокарбаматы), в том числе арил- и ге-
противовоспалительных препаратов, гербицидов,
1 Сообщение XXIII см. [1].
фунгицидов и др. [37-44].
62
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXIV
63
Отсюда создание оригинальных методологий
ное влияние на характер фрагментации молеку-
однореакторной сборки из простых и доступных
лярного и осколочных ионов.
реагентов новых семейств и новых классов функ-
В отличие от ранее исследованных 2-тиенила-
ционализированных тиофенов, в том числе с ими-
минов [45], обладающих высокой устойчивостью к
дотиокарбаматными заместителями, - перспек-
ионизации электронами, N-(3-метокси-2-тиенил)-
тивных субстанций и структурных блоков для ди-
имидотиокарбаматы 1a-n образуют слабоинтен-
зайна лекарственных препаратов, катализаторов и
сивный молекулярный ион (Iотн 1-4%), основ-
функциональных материалов различного назначе-
ное направление фрагментации которого связа-
ния, а также изучение их свойств - важная задача.
но с разрывом связи C-N в имидоформамидном
фрагменте с локализацией заряда на иминном
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
атоме азота (схема 2, табл. 1). Образующийся
В настоящей работе в продолжение исследо-
ион [MeSC≡NR2]+ (ион A) далее легко отщепля-
ваний масс-спектров новых классов функциона-
ет молекулу алкена (CnH2n), превращаясь в ион
лизированных тиофенов [1, 45], получаемых из
[MeSС≡NH]+ с m/z 74 (ион B).
изотиоцианатов и ацетиленовых или алленовых
Из данных табл. 1 видно, что интенсивность пи-
карбанионов, мы впервые изучили распад ранее
ков ионов A и B зависит от стабильности иона A,
неизвестных метил-N-(3-метокси-2-тиенил)- 1a-n,
которая, в свою очередь, определяется природой и
N-[3-(1-этоксиэтокси)-2-тиенил]- (2) и N-[3-(1Н-
строением заместителя R2. Так, максимальную ин-
пиррол-1-ил)-2-тиенил]- 3a, b имидотиокарбама-
тенсивность пик иона A имеет в спектрах соедине-
тов в условиях электронной (70 эВ) и химической
ний, в которых элиминирование молекулы алкена
(газ-реагент - метан) ионизации. Соединения 1-3
невозможно (когда R2 = Me, Ph, 4-FC6H4) или энер-
синтезированы в одну препаративную стадию из
гетически менее выгодно (R2 = Et) по сравнению с
α-литиированных метокси-,
1-этоксиэтокси- и
более объёмными алкильными заместителями. И
1Н-пиррол-1-илалленов и алифатических, цикло-
напротив, когда R2 = i-Pr, н-Bu и цикло-C5H9, то
алифатических и ароматических изотиоцианатов
есть выброс молекул алкена легко реализуется, ин-
[метил-, этил-, изопропил-, н-бутил, циклопентил-,
тенсивность пика иона A снижается до 35-72%, а
фенил- и 4-фторфенилизотиоцианатов] по разра-
интенсивность пика иона B соответственно растёт
ботанной нами методике (схема 1) [46].
и достигает 100%.
В структуре исследуемых соединений имеют-
Несмотря на то, что расщепление связи C-N
ся многочисленные гетероатомы (5 - в структурах
в имидоформамидном фрагменте молекулярного
соединений 1 и 3; 6 - в структуре соединения 2),
иона соединений 1 является доминирующим на-
каждый из которых (наряду с π-системой) может
правлением фрагментации, в спектрах присутству-
стать потенциальным центром локализации заряда
ют также пики характеристических ионов неболь-
и неспаренного электрона и оказывать существен-
шой интенсивности альтернативных каналов рас-
Схема 1
R
1. BuLi, ɌȽɎ ɝɟɤɫɚɧ
R1
R
N
C
S
2. R1N=C=S
R2
3. t-BuOK-ȾɆɋɈ
N
MeS
4. R2N=C=S
5. MeI
1a-n-3a-b
1, R = OMe: R1 = R2 = Me (a), R1 = Me, R2 = i-Pr (b), R1 = R2 = Et (c), R1 = Et, R2 = ɧ-Bu (d),
R1 = i-Pr, R2 = Me (e), R1 = R2 = i-Pr (f), R1 = ɧ-Bu, R2 = Me (g), R1 = ɧ-Bu, R2 = Et (h),
R1 = R2 = ɧ-Bu (i), R1 = ɰɢɤɥɨ-C5H9, R2 = Me (j), R1 = R2 = ɰɢɤɥɨ-C5H9 (k), R1 = R2 = Ph (l),
R1 = 4-FC6H4, R2 = Me (m), R1 = R2 = 4-FC6H4 (n);
2, R = OCH(Me)OEt, R1 = Me, R2 = Et; 3, R = 1H-pyrrol-1-yl: R1 = R2 = Et (a), ɧ-Bu (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
64
КЛЫБА и др.
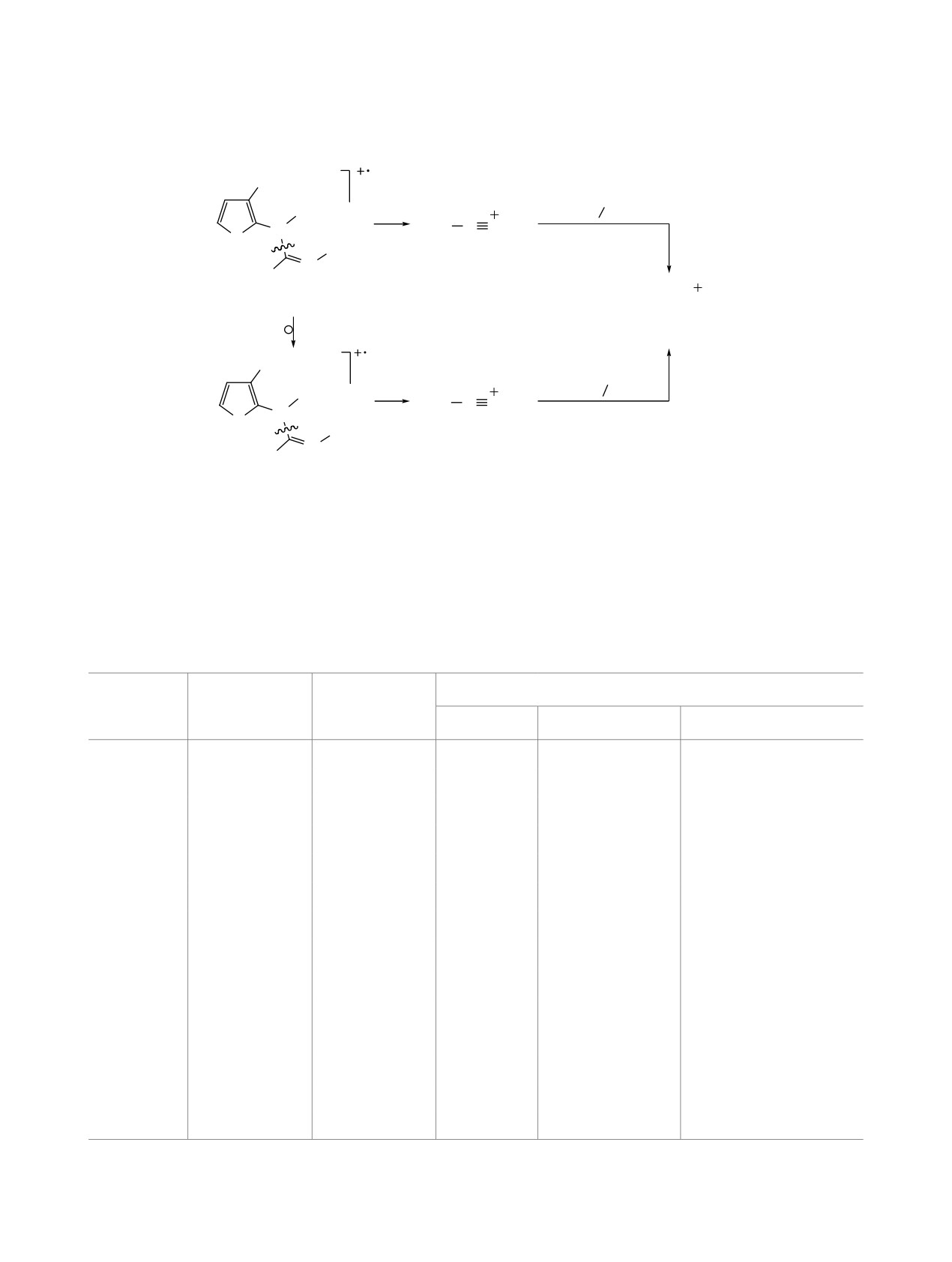
Схема 2
OMe
Ɉɫɧɨɜɧɨɣ ɤɚɧɚɥ ɪɚɫɩɚɞɚ
R1
ɞɥɹ R2 = Me, Ar
2
N
MeS
C
N R
S
-CnH2n
R2
A
N
MeS
1a-n, M+•
MeS C NH
B, m/z 74
OMe
Ɇɢɧɨɪɧɵɣ ɤɚɧɚɥ ɪɚɫɩɚɞɚ
R2
ɞɥɹ R1 = Me, Ar
MeS
C
N R1
N
-CnH2n
S
A1
R1
N
MeS
1', M1+•
пада M+•. Появление этих ионов объясняется как
табл. 2). Подтверждением этого предположения
простым разрывом связи C-О (ион [М - OMe]+),
является присутствие в спектрах исследуемых со-
так и протеканием перегруппировочных процес-
единений 1 (где R1 ≠ R2) пиков иона [MeSC≡NR1]+
сов в молекулярном ионе в момент ионизации с
(ион A1) (табл. 2), а также иона B с m/z 74 - в спек-
образованием изомерного иона (1', M1+•) (схема 2,
трах соединений 1e, g, j (схема 2).
Таблица 1. Молекулярные и основные характеристические ионы в масс-спектрах N-(3-метокси-2-тиенил)имидотио-
карбаматов 1a-n (ионизация электронами, 70 эВ)
Ион, m/z (Iотн, %)
Соединение
R1
R2
M+•
[MeSC≡NR2]+, A
[MeSС≡NH]+, B, m/z 74
1a
Me
Me
230 (1)
88 (100)
(-)
1b
Me
i-Pr
258 (2)
116 (72)
(100)
1c
Et
Et
258 (1)
102 (100)
(77)
1d
Et
н-Bu
286 (1)
130 (70)
(100)
1e
i-Pr
Me
258 (4)
88 (100)
(36)
1f
i-Pr
i-Pr
286 (1)
116 (35)
(100)
1g
н-Bu
Me
272 (1)
88 (100)
(8)
1h
н-Bu
Et
286 (1)
102 (100)
(86)
1i
н-Bu
н-Bu
314 (1)
130 (68)
(100)
1j
цикло-C5H9
Me
284 (1)
88 (100)
(17)
1k
цикло-C5H9
цикло-C5H9
338 (1)
142 (47)
(100)
1l
Ph
Ph
354 (1)
150 (100)
(-)
1m
4-FC6H4
Me
310 (1)
88 (100)
(-)
1n
4-FC6H4
4-FC6H4
390 (1)
168 (100)
(-)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXIV
65
Таблица 2. Перегруппировочные и минорные характеристические ионы в масс-спектрах N-(3-метокси-2-тиенил)-
имидотиокарбаматов 1a-n (ионизация электронами, 70 эВ)
m/z (Iотн, %)
Ион
1a
1b
1c
1d
1e
1f
1g
1h
1i
1j
1k
1l
1m
1n
88a
102a
102
116
116a
130
130
130a
142
142a
150a
168
168a
-
(100)
(100)
(12)
(66)
(35)
(25)
(18)
(68)
(35)
(47)
(100)
(7)
(100)
199
227
227
255
227
241
255
283
253
-
-
-
-
-
(10)
(5)
(7)
(7)
(16)
(11)
(9)
(5)
(5)
a По массе совпадает с ионом [MeSC≡NR2]+, A
Кроме перечисленных в табл. 1 и 2 характери-
пиррольный цикл 3а, b не оказывает влияния на
стических ионов, в спектрах соединений 1 при-
основное направление распада молекулярного
сутствуют достаточно интенсивные пики и других
иона (схема 3). Тем не менее природа заместителя
осколочных ионов (табл. 3).
определяет появление в спектрах этих соедине-
Замена в соединениях 1 метоксигруппы в по-
ний дополнительных серий ионов. Так, N-[3-(1-
ложении 3 гетероцикла на ацетальную (2) или
этоксиэтокси)-2-тиенил]имидотиокарбамат 2 при
Таблица 3. Осколочные ионы в масс-спектрах N-(3-метокси-2-тиенил)имидотиокарбаматов 1b-n (ионизация элек-
тронами, 70 эВ)
Соединение
R1
R2
Ионы, m/z (Iотн, %)
1b
Me
i-Pr
142 (10), 128 (12), 86 (14), 70 (19), 58 (15)
1c
Et
Et
139 (7), 86 (10), 57 (17)
1d
Et
н-Bu
86 (8), 57 (34), 56 (11)
1e
i-Pr
Me
156 (7), 153 (15), 128 (17), 67 (23), 58 (10)
1f
i-Pr
i-Pr
156 (11), 140 (5), 139 (10), 128 (10), 114 (12), 96 (9), 88 (13), 70 (16), 58 (8)
1g
н-Bu
Me
153 (7)
1i
н-Bu
н-Bu
57 (30)
1j
цикло-C5H9
Me
153 (8), 128 (12), 114 (4), 67 (16)
1k
цикло-C5H9
цикло-C5H9
139 (6), 128 (4), 114 (5), 69 (14), 67 (9)
1l
Ph
Ph
135 (16), 104 (4), 86 (6), 77 (26), 58 (5)
1m
4-FC6H4
Me
122 (4), 58 (11)
1n
4-FC6H4
4-FC6H4
153 (29), 122 (5), 95 (13), 86 (8), 58 (10)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
66
КЛЫБА и др.
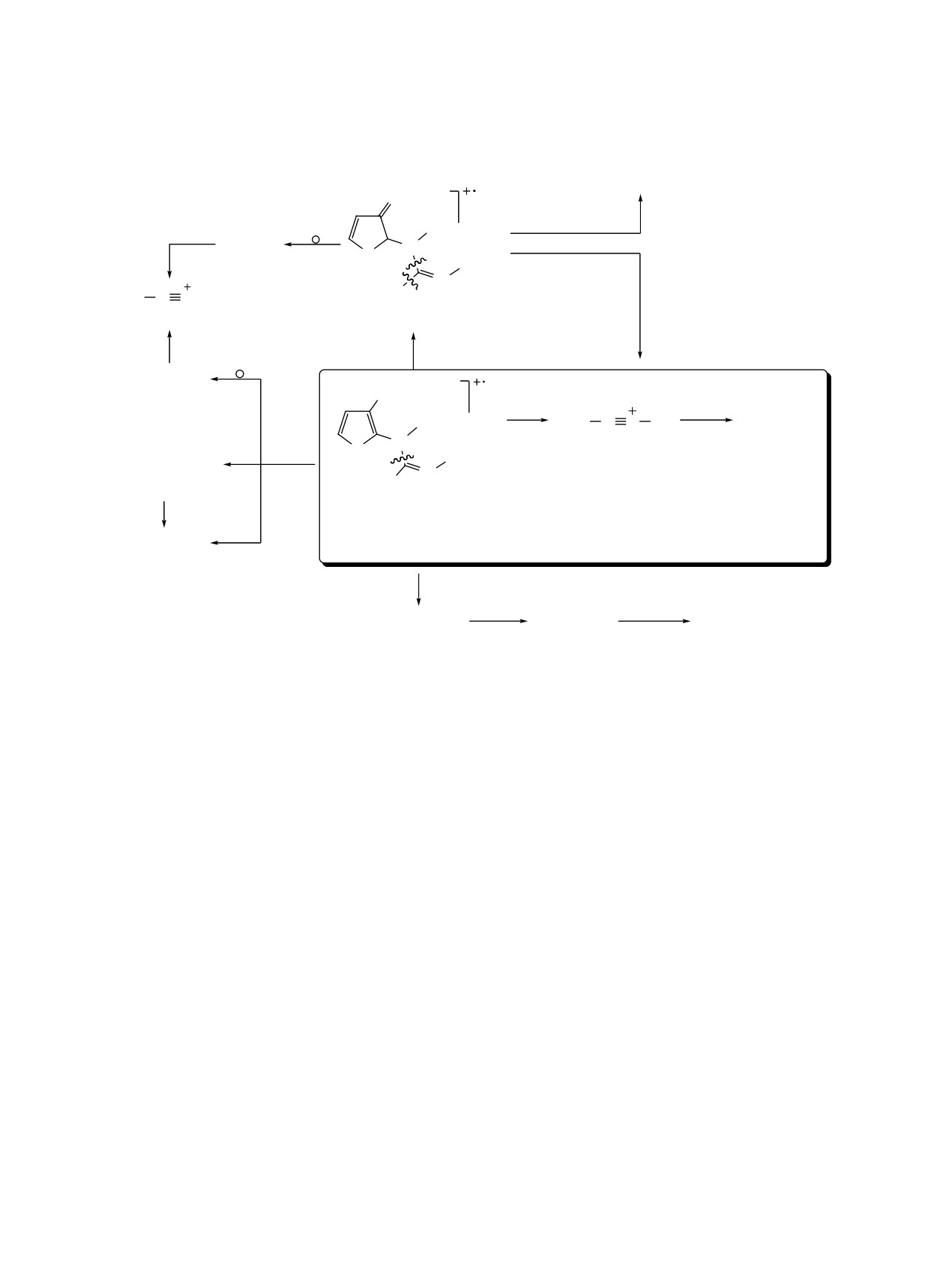
Схема 3
m/z 183 (5)
O
-SMe•
Me
M2+•
N
S
Et
N
MeS
MeS
C
N Me
m/z 88 (22)
C, m/z 230 (7)
Ⱦɥɹ 2
CH2=CHOEt
M1+•
R
R1
MeS
C
N R2
[MeSCNH]+
-CnH2n
N
A
B
Ⱦɥɹ 2
S
R2
[EtOCH(Me)]+
m/z 102 (100)
m/z 74
N
m/z 73 (23)
MeS
m/z 102 (100)
(83, 100, 37)
m/z 130 (70)
2, 3, M+•, 302 (-), 293 (-), 349 (-)
R = OCH(Me)OEt, R1 = Me, R1 = Et (2);
[EtO]+
R = 1H-pyrrol-1-yl, R1 = R2 = Et (3a), ɧ-Bu (3b).
m/z 45 (96)
Ⱦɥɹ 3a
-SMe•
m/z 246 (13)
m/z 217 (7)
m/z 189 (9)
–Et•
C2H4
ионизации легко отщепляет молекулу этоксиэте-
токсизамещённых имидотиокарбаматов 1, ни со-
на с образованием катион-радикала C с m/z 230.
единений 2 и 3b. Последующий распад его связан
Такой процесс наблюдался нами ранее при изуче-
с последовательным элиминированием этильного
нии масс-спектров (1-этоксиэтокси)замещённых
радикала [ион с m/z 217 (Iотн 7%)] и молекулы эте-
2,3-дигидропиридинов, пиридинов, 4,5-дигидро-
на [ион с m/z 189 (Iотн 9%)].
азепинов, пирролов и тиофенов [47, 48]. Как и при
В отличие от электронной ионизации спектры
фрагментации молекулярных ионов соединений 2
химической ионизации N-(3-метокси-2-тиенил)-
и 3, основным направлением распада иона С яв-
имидотиокарбаматов 1 характеризуются интенсив-
ляется расщепление связи C-N в имидоформамид-
ными пиками молекулярных ионов (Iотн 8-31%),
ном фрагменте с образованием иона А (m/z 102).
ионов [М + Н]+ (Iотн 52-100%) и фрагментных ио-
Появление минорного иона с m/z 183 (Iотн 5%) свя-
нов (схема 4, табл. 4).
зано с элиминированием радикала SMe [С - SMe]+.
Кроме этого, для соединения 2, имеющего разные
Следует отметить, что при ионизации метаном
алкильные радикалы (R1 ≠ R2) в имидоформамид-
для соединений 1 с расщеплением связи C-N в
ном фрагменте, фиксируется ион [MeSC≡NR1]+
имидоформамидном
фрагменте
(ион
(A1, m/z 88), образование которого возможно из
[MeSC≡NR2]+) (Iотн 70-100%) конкурируют раз-
изомерных молекулярных ионов M1+• и M2+•. При
рывы связей C-SМе (ион [М - SMe]+) (Iотн 60-
деструкции ацетальной группы [EtOCH(Me)] об-
100%), C-OMe (ион [М - OMe]+) (Iотн 5-31%) и
разуются ионы заметной интенсивности с m/z 73
C-Н (ион [M - H]+) (Iотн 10-38%). Наряду с иона-
и 45 (схема 3).
ми, образующимися в результате реакции отрыва
При ионизации N-[3-(1Н-пиррол-1-ил)-2-тие-
аниона, в спектрах проявляются пики ионов [М +
нил]имидотиокарбамата 3a образуется ион [М -
Et]+, обусловленных реакцией электрофильного
SMe]+, который не наблюдался в спектрах ни 3-ме-
присоединения (табл. 4).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXIV
67
Схема 4
OMe
2 +
R1
+
CH4
MeS
C
N
R
N
S
H
OMe
OMe
+
MeSH
+
CH4
N
C N R2
+
S
R1
CH5
R1
N
S
R2
[M OMe]+
+
MeOH
+
CH4
N
MeS
1a-n
[M Me]+
+
2 CH4
[M H]+ + H2 + CH4
В отличие от 3-метоксианалогов 1, соединения
тенсивности в спектрах N-[3-(1Н-пиррол-1-ил)-2-
2 и 3 при ионизации метаном не вступают в ре-
тиенил]имидотиокарбаматов 3 принадлежит иону
акцию перезарядки и в их спектрах отсутствуют
[M - SMe]+ (табл. 5). Для N-[3-(1-этоксиэтокси)-2-
пики молекулярных ионов. Пик максимальной ин-
тиенил]имидотиокарбамата 2 - это ион с m/z 183,
Таблица 4. Молекулярные и основные характеристические ионы в масс-спектрах химической ионизации N-(3-
метокси-2-тиенил)имидотиокарбаматов 1a-n (газ-реагент - метан)
m/z (Iотн, %)
Ион
1a
1b
1c
1d
1e
1f
1g
1h
1i
1j
1k
1l
1m
1n
230
258
258
286
258
286
272
286
314
284
338
354
310
390
М+•
(12)
(30)
(15)
(16)
(14)
(8)
(15)
(16)
(14)
(16)
(13)
(16)
(31)
(31)
231
259
259
287
259
287
273
287
315
285
339
355
311
391
[M + H]+
(57)
(100)
(73)
(87)
(64)
(52)
(91)
(91)
(75)
(89)
(73)
(70)
(81)
(70)
229
257
257
285
257
285
271
285
313
283
337
353
309
389
[M - H]+
(23)
(38)
(23)
(33)
(31)
(15)
(35)
(31)
(33)
(31)
(29)
(-)
(10)
(-)
199
227
227
255
227
255
241
255
283
253
307
323
279
359
[М - OMe]+
(25)
(15)
(31)
(19)
(14)
(5)
(26)
(22)
(17)
(10)
(-)
(7)
(13)
(5)
183
211
211
239
211
239
225
239
267
237
291
307
263
343
[М - SMe]+
(100)
(100)
(93)
(88)
(100)
(61)
(100)
(93)
(73)
(97)
(60)
(83)
(60)
(70)
88
116
102
130
88
116
88
102
130
88
142
150
88
168
[MeSC≡NR2]+, A
(75)
(100)
(100)
(100)
(80)
(100)
(70)
(100)
(100)
(72)
(100)
(100)
(100)
(100)
a
88
102a
102
116
116a
130
130
130a
142
142a
150a
168
168a
[MeSC≡NR1]+, А1
-
(75)
(100)
(5)
(38)
(100)
(26)
(18)
(100)
(77)
(100)
(100)
(7)
(100)
259
287
287
315
287
315
301
315
343
313
367
383
339
419
[М + Et]+
(12)
(15)
(10)
(8)
(5)
(5)
(13)
(9)
(7)
(6)
(3)
(7)
(9)
(15)
243
243
271
271
271
299
[М - Me]+
-
-
-
-
-
-
-
-
(36)
(9)
(6)
(17)
(10)
(7)
a По массе совпадает с ионом [R2N≡CSMe]+, A
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
68
КЛЫБА и др.
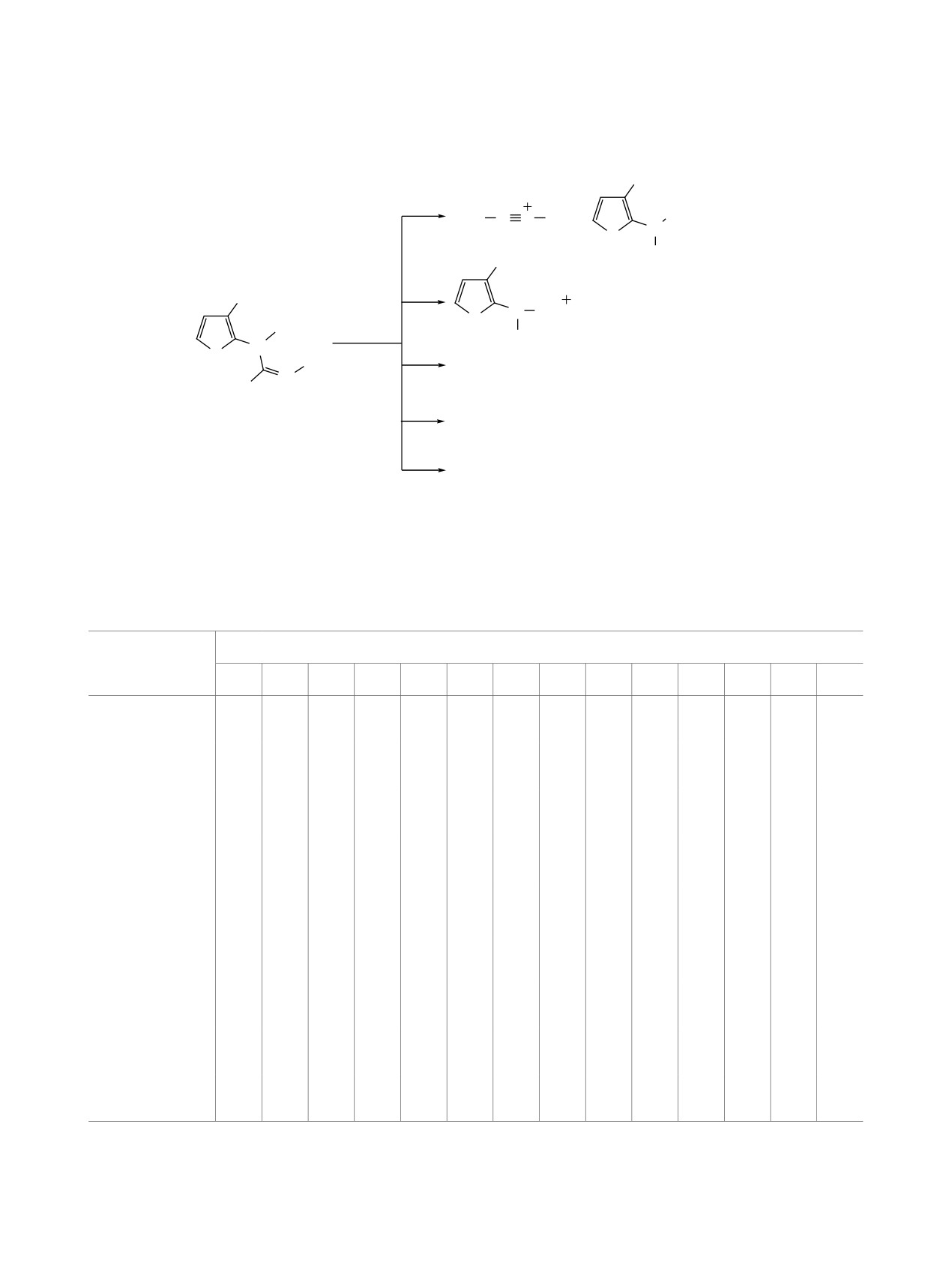
Схема 5
[M + H]+
m/z 259 (14)
OC2H4
m/z 303 (31)
CH2=CHOEt
OEt
Me
Et
Et
OH
O
O
OH2
N
N
CH5+
Me
Me
MeSH
N
N
N
N
S
S
S
S
Et
Et
Me
Me
N
N
m/z 183 (100)
MeS
MeS
m/z 231 (77)
2
[MeSC NEt]+
m/z 74 (10)
C2H4
A, m/z 102 (74)
[M]+•
m/z 302 (-)
[MeCHOEt]+
m/z 55 (12)
C
2H4
m/z 73 (27)
-SMe•
-OEt•
m/z 255 (18)
m/z 257 (17)
образующийся при последовательном элиминиро-
спектры положительных ионов электронной ио-
вании из иона [M + H]+ молекул этоксиэтена и ме-
низации (70 эВ) исследуемых соединений зареги-
тантиола (cхема 5). Конкурирующим направлени-
стрированы на приборе Shimadzu GCMS-QP5050A
ем распада соединений 2 и 3 остаётся разрыв связи
(Япония) с системой прямого ввода образца DI-50
C-N в имидоформамидном фрагменте, ведущий
(масс-анализатор квадрупольный, диапазон детек-
к иону А, [MeSC≡NR2]+ (Iотн 70-74%) (схема 5,
тируемых масс 34-650 Дa). Температуру ионного
табл. 5).
источника и ввода образца подбирали так, чтобы
обеспечить получение качественного масс-спек-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тра, исключив при этом термическую деструкцию
Соединения 1-3 (с чистотой > 98%) синтезиро-
вещества. Масс-спектры химической ионизации
ваны по разработанной нами методике [46]. Масс-
положительных ионов зарегистрированы на при-
Таблица 5. Молекулярные и основные характеристические ионы в масс-спектрах химической ионизации N-[3-(1Н-
пиррол-1-ил)-2-тиенил]имидотиокарбаматов 3a, b (газ-реагент - метан)
, %)
m/z (Iотн
Ион
3a
3b
М+•
293 (-)
349 (-)
[M - H]+
292 (8)
348 (12)
[M - SMe]+
246 (100)
302 (100)
[M - MeSC≡NR2]+
193 (13)
-
[(M - SMe) - R1]+•
217 (5)
245 (15)
[MeSC≡NR2]+, A
102 (74)
130 (70)
[MeSC≡NH]+, B, m/z 74
-
(5)
[M + H]+
294 (96)
350 (68)
[M + Et]+
322 (7)
378 (12)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXIV
69
боре Agilent 5975С (США), газ-реагент - метан.
БЛАГОДАРНОСТИ
Ввод образцов осуществляли через хромато-
Работа выполнена с использованием оборудо-
граф Agilent 6890N (США). Разделение осущест-
вания Байкальского аналитического центра кол-
вляли на хроматографической колонке HP-5MS
лективного пользования СО РАН.
(30 м×0.25 мм×0.25 мкм) при постоянной ско-
рости потока, газ-носитель - гелий, режим про-
ИНФОРМАЦИЯ ОБ АВТОРАХ
граммирования: от 60 до 180°C со скоростью
Клыба Людмила Васильевна, ORCID: https://
5 град/мин.
orcid.org/0000-0002-5521-3201
ЗАКЛЮЧЕНИЕ
Санжеева Елена Ринчиновна, ORCID: https://
При ионизации электронами исследуемые N-(2-
orcid.org/0000-0002-9776-2794
тиенил)имидотиокарбаматы
1-3 образуют неу-
стойчивый молекулярный ион (Iотн 0-4%), доми-
orcid.org/0000-0003-2614-7265
нирующим направлением фрагментации которого
Тарасова Ольга Анатольевна, ORCID: https://
является разрыв связи C-N в имидоформамидном
orcid.org/0000-0003-4895-3217
фрагменте с образованием иона [MeSC≡NR2]+,
пик которого имеет высокую интенсивность (Iотн
КОНФЛИКТ ИНТЕРЕСОВ
35-100%). Последний легко элиминирует молеку-
Авторы заявляют об отсутствии конфликта ин-
лу алкена из заместителя R2 (когда R2 ≠ Me, Ar)
тересов.
с образованием иона [MeSС≡NH]+ с m/z 74 (Iотн
77-100%). Природа заместителя (метокси-, 1-эток-
СПИСОК ЛИТЕРАТУРЫ
сиэтокси- и 1Н-пиррол-1-ил-группа) в положении
1. Клыба Л.В., Недоля Н.А., Санжеева Е.Р., Тарасо-
3 тиофенового цикла не оказывает существенно-
ва О.А. ЖОрХ. 2021, 57, 1669-1683. [Klyba L.V.,
го влияния на общий характер фрагментации мо-
Nedolya N.A., Sanzheeva E.R., Tarasova O.A. Russ.
лекулярных ионов при ионизации электронами.
J. Org. Chem. 2021, 57, 1901-1912.] doi 10.1134/
Одновременно в масс-спектре 1-этоксиэтокси-за-
S1070428021120022
мещённого N-(2-тиенил)имидотиокарбамата
2
2. Joule J.A. Topics in Heterocyclic Chemistry. Eds.
наблюдается ещё один значимый канал фрагмен-
B.U.W. Maes, J. Cossy, S. Polanc. Heidelberg, New
тации молекулярного иона, обусловленный элими-
York, Dordrecht, London: Springer Cham. 2015, 39,
нированием молекулы этоксиэтена с образовани-
1-5. doi 10.1007/7081_2014_130
ем катион-радикала N-(3-оксо-2,3-дигидро-2-тие-
3. Besson T., Thiéry V. Top. Heterocycl. Chem. 2006, 1,
нил)имидотиокарбамата. При химической иониза-
59-78. doi 10.1007/7081_008
ции метаном соединения 1-3 вступают в реакции
4. Mancuso R., Gabriele B. Molecules. 2014, 19, 15687-
протонирования и электрофильного присоедине-
15719. doi 10.3390/molecules191015687
ния, а соединения 1 - ещё и в реакции перезаряд-
5. Mishra A., Ma C.-Q., Bäuerle P. Chem. Rev. 2009, 109,
ки. Масс-спектры характеризуются интенсивны-
1141-1276. doi 10.1021/cr8004229
ми пиками значительного числа фрагментных
6. Klingstedt T., Nilsson K.P.R. Biochem. Soc. Trans.
ионов, в отличие от масс-спектров ионизации
2012, 40, 704-710. doi 10.1042/BST20120009
электронами. Это свидетельствует о протека-
7. Cheylan S., Fraleoni-Morgera A., Puigdollers J., Voz C.,
нии перегруппировочных процессов при фраг-
Setti L., Alcubilla R., Badenes G., Costa-Bizzarri P.,
ментации молекулярных ионов. Из полученных
Lanzi M. Thin Solid Films. 2006, 497, 16-19. doi
результатов очевидно, что масс-спектры хими-
10.1016/j.tsf.2005.09.177
ческой ионизации выгодно отличаются от спек-
8. Ong B.S., Wu Y., Li Y., Liu P., Pan H. Chem. Eur. J.
тров электронной ионизации метил-N-(2-ти-
2008, 14, 4766-4778. doi 10.1002/chem.200701717
енил)имидотиокарбаматов
1-3 и позволяют
9. Abd-El-Aziz A.S., Afifi T.H. Dyes Pigm. 2006, 70,
надёжно определять не только молекулярную
8-17. doi 10.1016/j.dyepig.2005.03.004
массу, но и структуру анализируемых соедине-
10. Nassar H.S. Int. J. Text. Sci. 2015, 4, 102-112. doi
ний.
10.5923/j.textile.20150405.02
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
70
КЛЫБА и др.
11. Wu, L.-H., Wang Y.-C., Hsu C.-S. Liq. Cryst. 2001, 27,
Molecules.
2019,
24,
3391.
doi
10.3390/
1503-1513. doi 10.1080/026782900750018672
molecules24183391
12. Mishra R., Jha K.K., Kumar S., Tomer I. Pharma
30. Sabolova D., Kristian P., Kozurkova M. J. Appl.
Chem. 2011, 3, 38-54.
Toxicol. 2018, 38, 1377-1387. doi 10.1002/jat.3622
13. Chaudhary A., Jha K.K., Kumar S. J. Adv. Sci. Res.
31. Siddiqui N., Alam M.S., Sahu M., Naim M.J.,
2012, 3, 3-10.
Yar M.S., Alam O. Bioorg. Chem. 2017, 71, 230-243.
14. Mabkhot Y.N., Kheder N.A., Barakat A., Choudha-
doi 10.1016/j.bioorg.2017.02.009
ry M.I., Yousufe S., Frey W. RSC Adv. 2016, 6, 63724-
32. Tiratsuyan S.G., Hovhannisyan A.A., Karapetyan A.V.,
63729. doi 10.1039/C6RA09883E
Gomktsyan T.A., Yengoyan A.P. Russ. J. Plant Physiol.
15. Mishra R., Sharma P.K., Verma P., Mishra I. Eur. Chem.
2016, 63, 656-662. doi 10.1134/S1021443716050125
Bull. 2016, 5, 399-407. doi 10.17628/ECB.2016.5.399
33. Bandi N., Veerachamy A., Chitra K. Drug Res. 2020,
16. Wilson R., Kumar P., Parashar V., Vilchèze C., Veyron-
70, 348-355. doi 10.1055/a-0991-7617
Churlet R., Freundlich J.S., Barnes S.W., Walker J.R.,
34. Boddapati S.N.M., Kurmarayuni C.M., Mutchu B.R.,
Szymonifka M.J., Marchiano E., Shenai S., Colange-
Tamminana R., Bollikolla H.B. Org. Biomol. Chem.
li R., Jacobs W.R., Jr, Neiditch M.B., Kremer L., Al-
2018, 16, 6889-6894. doi 10.1039/c8ob02018c
land D. Nat. Chem. Biol. 2013, 9, 499-509. doi 10.1038/
35. Cannito A., Perrissin M., Luu Duc C., Huguet F.,
nchembio.1277
Gaultier C., Narcisse G. Eur. J. Med. Chem. 1990, 25,
17. Lu X., Wan B., Franzblau S.G., You Q. Eur. J.
635-639. doi 10.1016/0223-5234(90)90128-P
Med. Chem.
2011,
46,
3551-3563. doi
10.1016/
36. Katritzky A.R., Witek R.M., Rodriguez-Garcia V.,
j.ejmech.2011.05.018
Mohapatra P.P., Rogers J.W., Cusido J., Abdel-Fat-
18. Puterová Z., Krutošíková A., Végh D. Nova Biotechnol.
tah A.A.A., Steel P.J. J. Org. Chem. 2005, 70, 7866-
2009, 9, 167-173. doi 10.36547/nbc.1274
7881. doi 10.1021/jo050670t
19. Briel D., Rybak A., Kronbach C., Unverferth K.
37. Biswas A., Mondal H., Maji M.S. J. Heterocycl. Chem.
Eur. J. Med. Chem. 2010, 45, 69-77. doi 10.1016/
2020, 57, 3818-3844. doi 10.1002/jhet.4119
j.ejmech.2009.09.025
38. Maiti R., Xu J., Yan J.-L., Mondal B., Yang X., Chai H.,
20. Sperry J.B., Wright D.L. Curr. Opin. Drug Discov. Dev.
Hao L., Jin Z., Chi Y.R. Org. Chem. Front. 2021, 8,
2005, 8, 723-740.
743-747. doi 10.1039/d0qo01380c
21. Corral C., Lissavetzky J., Manzanares I., Darias V.,
39. Koronkiewicz M., Romiszewska A., Chilmonczyk Z.,
Exposito-Orta M.A., Martin Conde J.A., Sanchez-
Kazimierczuk Z. Med. Chem. 2015, 11, 364-372. doi
Mateo C. Bioorg. Med. Chem. 1999, 7, 1349-1359. doi
10.2174/1573406410666141203124329
10.1016/S0968-0896(99)00070-X
40. Pucko E., Matyja E., Koronkiewicz M., Ostrowski R.P.,
22. Yang S.-M., Fang J.-M. Tetrahedron. 2007, 63, 1421-
Kazimierczuk Z. Anticancer Res. 2018, 38, 2691-2705.
1428. doi 10.1016/j.tet.2006.11.080
doi 10.21873/anticanres.12511
23. Yang S.-M., Nandy S.K., Selvakumar A.R., Fang J.-M.
41. Lambert W.T., Goldsmith M.E., Sparks T.C. Pest
Org. Lett. 2000, 2, 3719-3721. doi 10.1021/ol006628w
Manage. Sci. 2017, 73, 743-751. doi 10.1002/ps.4353
24. Schatz J., Brendgen T., Schühle D. Compr. Heterocycl.
42. Narendhar B., Chitra K., Alagarsamy V. Pharm. Chem.
Chem. III. 2008, 3, 931-974.
J. 2021, 55, 54-59. doi 10.1007/s11094-021-02371-7
25. Liu M., Zeng M.-T., Xu W., Chang C.-z., Liu X.,
43. Narendhar B., Chitra K., Alagarsamy V. Int. J. Res.
Zhu H., Li Y.-s., Dong Z.B. J. Chem. Res. 2017, 41,
Pharm. Sci. 2019, 10, 2186-2193. doi 10.26452/
165-167. doi 10.3184/174751917X14878812592733
ijrps.v10i3.1414
26. Ma C., Wu A., Wu Y., Ren X., Cheng M. Archiv
44. Uckun F.M., Tibbles H.E., Venkatachalam T.K., Er-
Pharm. (Weinheim, Germany). 2013, 346, 891-900.
beck D. Arzneim.-Forsch. 2007, 57, 483-496. doi
doi 10.1002/ardp.201300276
10.1055/s-0031-1296636
27. Sulthana M.T., Alagarsamy V., Chitra K. Med. Chem.
45. Клыба Л.В., Недоля Н.А., Санжеева Е.Р., Тара-
(Sharjah, United Arab Emirates). 2021, 17, 352-368.
сова О.А. ЖОрХ. 2019, 55, 620-627. [Klyba L.V.,
doi 10.2174/1573406416666200817153033
Nedolya N.A. Sanzheeva E.R., Tarasova O.A. Russ.
28. Lei X., Wang Y., Fan E., Sun Z. Org. Lett. 2019, 21,
J. Org. Chem. 2019, 55, 518-524.] doi 10.1134/
1484-1487. doi 10.1021/acs.orglett.9b00275
S1070428019040171
29. Padilla-Martinez I.I., Gonzalez-Encarnacion J.M.,
46. Недоля Н.А., Тарасова О.А., Клыба Л.В., Дмитрие-
Garcia-Baez E.V., Cruz A., Ramos-Organillo A.A.
ва Г.В., Трофимов Б.А. Сборник тезисов III Между-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXIV
71
народной конференции «Химия гетероциклических
Russ. J. Org. Chem. 2005, 41, 1544-1550.] doi 10.1007/
соединений», посвященной 95-летию со дня рожде-
s11178-005-0380-y
ния профессора Алексея Николаевича Коста (18-
48. Клыба Л.В., Недоля Н.А., Тарасова О.А., Жан-
21 октября 2010 г.), Москва, 2010, 146.
чипова Е.Р., Волостных О.Г. ЖОрХ.
2010,
46,
47. Клыба Л.В., Недоля Н.А., Шляхтина Н.И., Жанчи-
224-231. [Klyba L.V., Nedolya N.A., Tarasova O.A.,
пова Е.Р. ЖОрХ. 2005, 41, 1576-1582. [Klyba L.V.,
Zhanchipova E.R., Volostnykh O.G. Russ. J. Org. Chem.
Nedolya N.A., Shlyakhtina N.I., Zhanchipova E.R.
2010, 46, 218-225.] doi 10.1134/S107042801002013
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
72
КЛЫБА и др.
Mass-Spectra of New Heterocycles:
XXIV. Electron Impact and Chemical Ionization Study
of N-[3-Alkoxy- and 3-(1Н-Pyrrol-1-yl)-2-thienyl]-
imidothiocarbamates
L. V. Klyba*, E. R. Sanzheeva, N. A. Nedolya, and O. A. Tarasova
Favorsky Irkutsk Institute of Chemistry, Siberian Branch, Russian Academy of Sciences,
ul. Favorskogo, 1, Irkutsk, 664033 Russia
*e-mail: klyba@irioch.irk.ru
Received March 11, 2022; revised March 28, 2022; accepted April 1, 2022
The behavior of a wide range of previously unknown N-(2-thienyl)imidothiocarbamates synthesized in a single
preparative step from heterosubstituted allenes (methoxy-, 1-ethoxyethoxy- and 1H-pyrrol-1-ylallenes) and
aliphatic, cycloaliphatic, and aromatic isothiocyanates was studied under conditions of electron (70 eV) and
chemical (reagent gas - methane) ionization. Under the electron impact, the studied compounds form an un-
stable molecular ion, the main direction of fragmentation of which is associated with the breaking of the C-N
bond in the imidoformamide fragment with charge localization at the imine nitrogen atom. A similar decay
channel of a molecular ion is also observed in the chemical ionization mass spectra of the studied compounds.
In this case, characteristic, but low-intensity ions in the electron ionization spectra of N-(3-methoxy-2-thienyl)-
imidothiocarbamates become dominant in the chemical ionization spectra. In the chemical ionization spectra of
N-[3-(1H-pyrrol-1-yl)-2-thienyl]imidothiocarbamates, the maximum intensity peak belongs to the [M - SMe]+
ion. For N-[3-(1-ethoxyethoxy)-2-thienyl]imidothiocarbamate, the peak of the ion formed upon successive
elimination of ethoxyethene and methanethiol molecules from the [M + H]+ ion has the maximum intensity.
Keywords: N-(3-methoxy-2-thienyl)-, N-[3-(1-ethoxyethoxy)-2-thienyl]- and N-[3-(1Н-pyrrol-1-yl)-2- thienyl]-
imidothiocarbamates, electron and chemical ionization, mass spectra, molecular ions, fragmentation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023