ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 1, с. 106-118
УДК 547.368.2; 547.1-32-304.2; 547.914.2
СИНТЕЗ СУЛЬФОНАМИДОВ
ДЕГИДРОАБИЕТАНОВОГО ТИПА С ФРАГМЕНТАМИ
ЭФИРОВ И ГИДРАЗИДОВ L-АМИНОКИСЛОТ
© 2023 г. Е. С. Изместьевa, *, Д. В. Петуховb, С. В. Пестоваa, С. А. Рубцоваa
a Институт химии Коми НЦ УрО РАН (Коми НЦ УрО РАН),
Россия, 167000 Сыктывкар, ул. Первомайская, 48
b ФГБОУ ВО «Вятский государственный университет», Россия, 610000 Киров, ул. Московская, 36
*e-mail: evgeniyizmestev@rambler.ru
Поступила в редакцию 18.03.2022 г.
После доработки 22.03.2022 г.
Принята к публикации 24.03.2022 г.
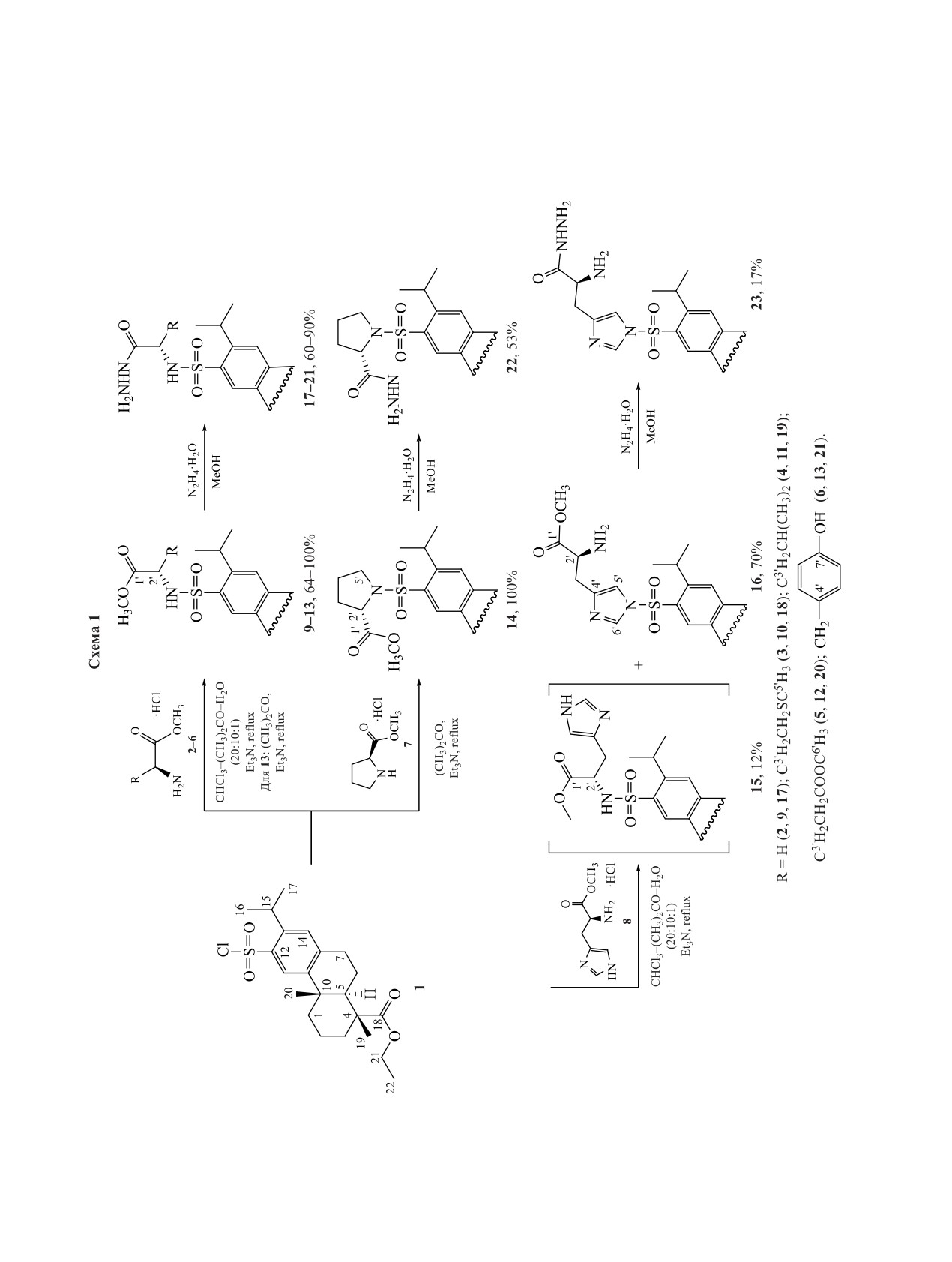
Взаимодействием этилового эфира 12-хлорсульфодегидроабиетиновой кислоты с метиловыми эфирами
глицина, метионина, лейцина, глутаминовой кислоты, тирозина, пролина, гистидина впервые получены
соответствующие сульфонамиды, сложноэфирную COOMe группу которых селективно перевели в ги-
дразидную COONHNH2, не затрагивая этильную группу, связанную с фрагментом дегидроабиетиновой
кислоты. В случае с глутаминовой кислотой впервые получены соответствующие дигидразиды. Реакция
этилового эфира 12-хлорсульфодегидроабиетиновой кислоты с диметиловым эфиром цистина привела
к образованию биссульфонамида в качестве единственного продукта, а проведение подобной реакции в
среде, содержащей ацетон, сопровождалось разрывом дисульфидной связи фрагмента цистина и обра-
зованием тиокеталя. Проведены реакции полученных биссульфонамида и тиокеталя с диоксидом хлора,
в результате которых в обоих случаях селективно получен сульфохлорид.
Ключевые слова: сульфонамиды, аминокислоты, гидразиды, сложные эфиры, сульфохлориды
DOI: 10.31857/S0514749223010093, EDN: PGADBV
ВВЕДЕНИЕ
с аминами, однако участие свободных аминокис-
лот в качестве аминной компоненты ограничено
Дегидроабиетиновая кислота - дитерпеновая
их чрезвычайно низкой растворимостью в боль-
смоляная кислота природного происхождения, ко-
шинстве органических растворителей. Поэтому в
торая, наряду с ее производными, проявляет ши-
целом сульфонамиды дегидроабиетанового типа,
рокий спектр биологической активности [1-4].
содержащие фрагменты аминокислот, несмотря
Особое место уделяют изучению противораковой
на проявляемый к ним интерес, остаются малоиз-
активности ее кислород- и азотсодержащих про-
ученными. Кроме того, является актуальным полу-
изводных, так как известно, что многие из них
чение сульфонамидов с фрагментами модифици-
способны ингибировать рост опухолевых клеток
рованных аминокислот, главным образом гидра-
на разных этапах развития, вызывать их апоптоз
зидов, производные которых, например 1,3,4-ок-
[5-7]. Некоторые сульфонамидные производные
садиазолы, используются для получения веществ,
дегидроабиетанового типа, содержащие фраг-
обладающих противогрибковой, анти-ВИЧ [9] и
менты природных аминокислот, способны взаи-
противомалярийной [10] активностью.
модействовать с рецепторами мембран раковых
клеток, подавляя их миграцию и пролиферацию
Целью настоящей работы является получение
[8]. Классическим методом введения сульфона-
новых сульфонамидных производных дегидроаби-
мидной группы является реакция сульфохлоридов
етинового типа, содержащих фрагменты эфиров и
106
СИНТЕЗ СУ
ЛЬФОНАМИДОВ ДЕГИДРОАБИЕТАНОВОГО ТИПА
107
гидразидов аминокислот в ароматическом кольце
шал 20%. Оптимальным растворителем для син-
в положении С12.
теза сульфонамидов 9-12 является смесь CHCl3-
(CH3)2CO-H2O (20:10:1), позволяющая проводить
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
реакцию в гомогенной среде. Реакционные смеси
Ранее нами был описан способ получения суль-
в обозначенных условиях кипятили в течение 4-
фонамидов по реакции дегидроабиетан-18-суль-
12 ч. Сульфонамиды 9-12 при этом были выделе-
фохлорида с различными алифатическими, арома-
ны с выходами 64-95% (схема 1).
тическими и гетероциклическими аминами. При
Высокореакционные сульфохлориды легко ги-
этом сульфонамиды вследствие низкой устойчи-
дролизуются, однако даже длительное кипячение
вости сульфохлорида были получены с умеренны-
сульфохлорида 1 с метиловыми эфирами амино-
ми выходами [11]. Нами показан [12] синтез более
кислот в присутствии воды в большинстве случа-
устойчивого этилового эфира 12-хлорсульфодеги-
ев не приводило к образованию соответствующей
дроабиетиновой кислоты 1, в котором сульфохло-
сульфокислоты в качестве побочного продукта.
ридная группа соединена с бензольным кольцом
Исключением являлся аминоэфир 2, который мед-
по атому С12. Данный сульфохлорид 1 впервые
ленно взаимодействовал с сульфохлоридом в сме-
использован для получения сульфонамидных про-
си растворителей CHCl3-(CH3)2CO-H2O (20:10:1)
изводных, содержащих фрагмент лизина.
и требовал более длительного кипячения (12 ч).
В настоящей работе изучено взаимодействие
Выход сульфонамида в данных условиях составил
описанного нами ранее сульфохлорида 1 с метило-
64%, сульфокислоты - 25% (конверсия сульфохло-
выми эфирами глицина (2), метионина (3), лейцина
рида 95%). Низкую скорость образования сульфо-
(4), глутаминовой кислоты (5), тирозина (6), про-
намида 9 можно объяснить малой растворимостью
лина (7) и гистидина (8), которые предварительно
эфира 2, которая повышалась при добавлении дву-
синтезированы из L-аминокислот по их реакции с
кратного объема воды, однако это вызывало осаж-
метанолом в присутствии SOCl2. Так как реакция
дение сульфохлорида и значительное снижение
протекает в кислой среде, то эфиры образуются в
выхода сульфонамида до 39%. В этих условиях
виде гидрохлоридов.
выход сульфокислоты уменьшался до 13% (кон-
Проведение реакции между сульфохлоридом 1
версия сульфохлорида 53%).
и аминоэфирами 2-8 осложняется их различной
Образование сульфонамидов 10-12 в системе
растворимостью. Так, сульфохлорид, содержащий
растворителей CHCl3-(CH3)2CO-H2O
(20:10:1)
объемный алкильный фрагмент, растворим преи-
протекало с высокими выходами (85-95%) в те-
мущественно в неполярных или слабополярных
чение 4-5 ч с полной конверсией сульфохлорида.
растворителях, тогда как аминоэфиры 2-8 в них
Сульфонамиды 13 и 14 в данной системе не полу-
практически нерастворимы. Аминоэфиры, содер-
чали.
жащие фрагменты таких аминокислот, как глута-
миновая кислота, гистидин, глицин, тирозин, рас-
Реакцию сульфохлорида 1 с метиловым эфиром
творимы только в воде, тогда как аминокислоты с
гистидина (8) также проводили в смеси раствори-
неполярными радикалами, например лейцин, ме-
телей CHCl3-(CH3)2CO-H2O (20:10:1), однако в
тионин, пролин, умеренно растворимы в ацетоне.
данных условиях сульфонамид 15 образовывался
с низким выходом (12%). Реакция протекала преи-
Наши эксперименты показали, что проведение
мущественно по NH-протону имидазольного фраг-
реакции сульфохлорида 1 с аминоэфирами 2-8 в
мента с образованием сульфонамида 16 (70%).
хлороформе в присутствии Et3N после кипяче-
ния (16 ч) гетерогенной смеси не привело к об-
Структура сульфонамидов 9-16 подтверждена
разованию целевых сульфонамидов 9-16. Замена
методами ЯМР спектроскопии. Так, в спектрах
хлороформа на ацетон в аналогичных условиях
ЯМР 1H структур 3-13 и 15 присутствует харак-
позволила синтезировать с количественными вы-
терный дублет протона NH-группы в области
ходами только сульфонамиды 13 и 14, в то время
4.98-5.29 м.д. (J 8.0-9.5 Гц). В случае сульфонами-
как выход остальных сульфонамидов не превы-
да 9, в котором группа NH находится по соседству
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
108
ИЗМЕСТЬЕВ и др.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
СИНТЕЗ СУ
ЛЬФОНАМИДОВ ДЕГИДРОАБИЕТАНОВОГО ТИПА
109
с протонами метиленовой группы, сигнал NH-
миновой кислоты, синтезирован дигидразид 20.
протона наблюдается в виде триплета при 5.03 м.д.
Минимальный выход гидразида 23 (17%) с фраг-
(J 4.8 Гц). В спектрах структур 14 и 16, в которых
ментом гистидина при полной конверсии исходно-
сульфонильная группа связана с третичным ато-
го эфира 16 связан с его низкой устойчивостью и
мом азота, отсутствуют какие-либо сигналы про-
разрушением при хроматографировании на SiO2.
тонов аминогрупп в обозначенных выше областях.
Гидразиды 17, 22 также частично разлагаются на
В спектрах ЯМР 13С сульфонамидов 9-16 присут-
SiO2, их выходы составили 68 и 53%. Более устой-
ствуют сигналы атомов углерода, принадлежащие
чивыми оказались гидразиды 18 и 19, содержащие
аминокислотному и дегидроабиетановому фраг-
фрагменты неполярных аминокислот, их выход с
ментам. Кроме этого, в спектре каждого сульфона-
учетом частичного разложения составил 89 и 93%
мида наблюдается сигнал атома CH3 сложноэфир-
соответственно.
ной группы в области 51.70-52.67 м.д.; в случае
В спектрах ЯМР 1Н и 13С гидразидов 17-21, по-
сульфонамида 12 в спектре ЯМР 13C присутствует
лученных в CDCl3, исчезают сигналы протонов и
2 сигнала метильных групп в том же интервале хи-
атомов углерода группы OCH3, присутствовавших
мических сдвигов (51.70, 52.64 м.д.).
у исходных эфиров. Кроме того, исчезают сигналы
Структура сульфонамидов 14 и 16 также дока-
SO2NH-протонов в спектрах ЯМР 1H, по-видимо-
зана с применением метода двумерной спектро-
му, из-за образования межмолекулярных ассоци-
скопии ЯМР NOESY. В спектре NOESY сульфо-
атов невыясненной структуры, в которых данные
намида 14, содержащего фрагмент пролина, при-
протоны связаны водородной связью. Сигналы
сутствуют кросс-пики между протонами H2'-H15,
протонов гидразидной группы NHNH2 также в
H5'-H15, H2'-H11, H5'-H11, при этом атомы H2' и H5'
большинстве случаев в хлороформе обнаружены
располагаются в α-положениях по разные стороны
не были. Подобное явление, известное из литера-
от атома азота, а протоны H15 и H11 - по разные
туры [13], часто не наблюдается при регистрации
стороны от сульфогруппы, что указывает на спо-
спектров в ДМСО-d6. Действительно, в спектре
собность беспрепятственного вращения проли-
гидразида 21 в ДМСО-d6 удалось дополнительно
нового фрагмента вокруг σ(S-N)-связи и перпен-
зафиксировать 3 сигнала в виде синглетов при 9.05,
дикулярное расположение изопропильной груп-
8.33 и 4.08 м.д., принадлежащие протонам NHNH2,
пы относительно плоскости бензольного кольца
NHSO2 и NHNH2, соответственно. Спектры дру-
(схема 1). Аналогичные кросс-пики α-протонов
гих гидразидов в ДМСО-d6 не регистрировали.
наблюдаются в NOESY-спектре сульфонамида
Образование ассоциатов подтверждается и данны-
16 для имидазольного фрагмента, однако ввиду
ми ИК спектроскопии: в ИК спектрах гидразидов
близкого расположения сигналов протонов H6'
присутствуют уширенные полосы поглощения
(7.00 м.д.) и H11 (7.80 м.д.) в спектре ЯМР 1H,
при 3211-3296 см-1, характерные для аминогрупп,
кросс-пики, образованные ими, находятся в обла-
участвующих в образовании водородных связей.
сти главной диагонали и неразличимы (схема 1).
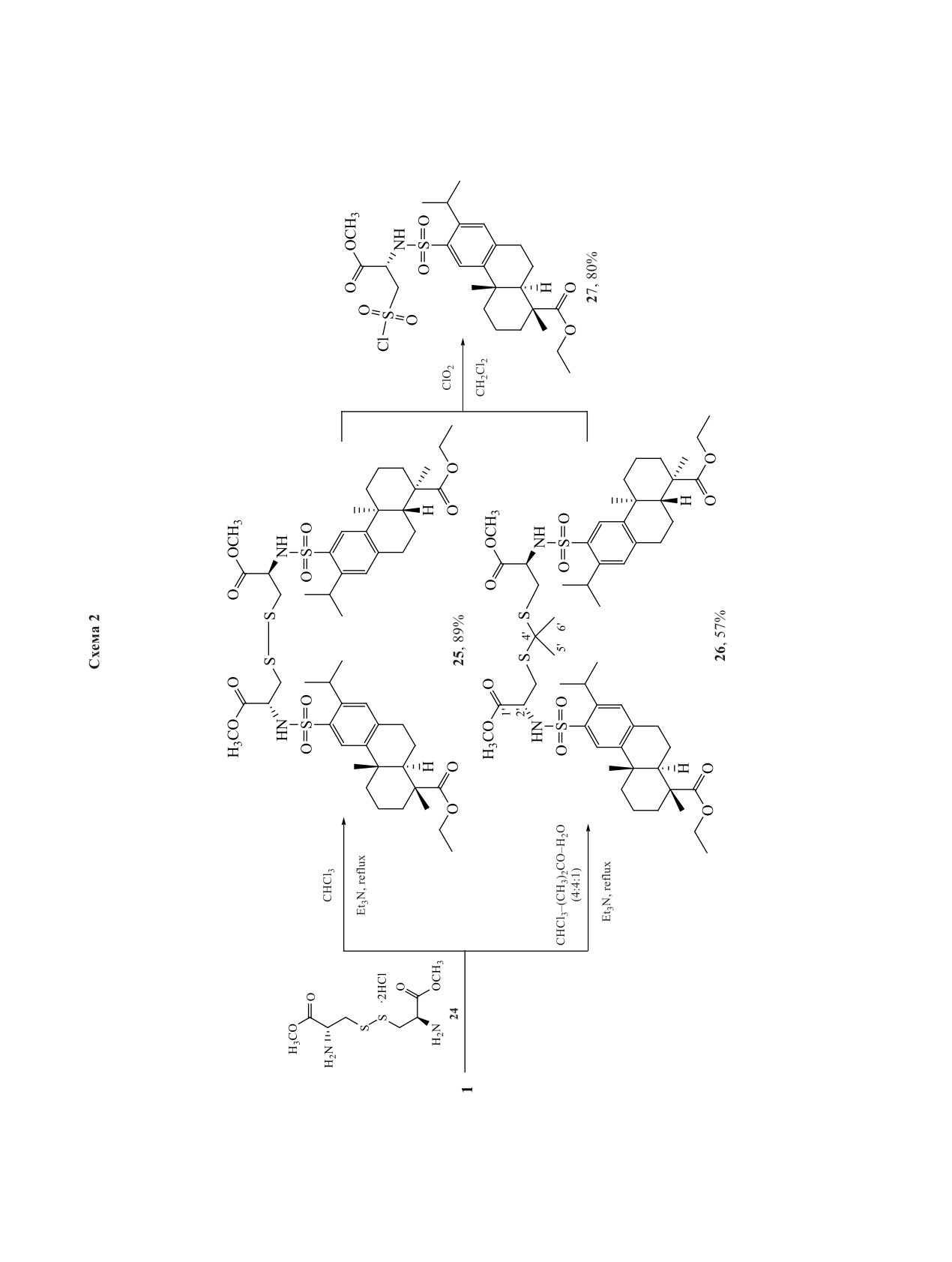
В данной работе также проведен синтез суль-
В спектрах NOESY сульфонамидов 9-13 наблюда-
фонамидов на основе диметилового эфира цисти-
ется единственный кросс-пик, образованный про-
на (24), который практически нерастворим в орга-
тонами аминокислотного (С2'H) и дегидроабиета-
нических растворителях и воде. Кипячение экви-
нового (С11H) фрагментов. Дополнительных пиков
молярных количеств эфира 24 с сульфохлоридом 1
между протонами аминокислотного радикала R и
в хлороформе (гетерогенная смесь) в присутствии
протонами дитерпенового фрагмента в спектрах
Et3N привело к образованию симметричного бис-
NOESY не наблюдалось, что указывает на их зна-
сульфонамида 25, при этом продукт монозамеще-
чительное удаление друг от друга.
ния обнаружен не был. Это можно объяснить тем,
На основе полученных сульфонамидов 9-14,
что взаимодействие неполярного сульфохлорида с
16 по их реакции с N2H4·H2O осуществлен синтез
одной аминогруппой приводит к существенному
гидразидов 17-23 с выходами 17-93%. В случае
увеличению растворимости образующегося суль-
сульфонамида 12, содержащего фрагмент глута-
фонамида, который становится более доступным в
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
110
ИЗМЕСТЬЕВ и др.
растворе для дальнейшего взаимодействия со вто-
в тонком слое или в таблетках KBr. Температуру
рой молекулой сульфохлорида, чем эфир 24. Выход
плавления определяли на приборе Gallenkamp
биссульфонамида 25 при двукратном повышении
MPD350BM3.5 фирмы Sanyo (Великобритания).
количества сульфохлорида 1 в реакционной смеси
Спектры ЯМР
1H и
13C регистрировали на
также увеличивался в 2 раза и достигал 89%. При
спектрометре Bruker
Avance-300 (Германия)
замене растворителя на CHCl3-(CH3)2CO-H2O
(300.17 МГц для 1Н и 75.48 МГц для 13С) в
(4:4:1) в присутствии Et3N происходил разрыв ди-
растворе CDCl3 или CD3OD, внутренний стан-
сульфидной связи цистинового фрагмента и обра-
дарт - сигналы хлороформа или метанола. Полное
зовывался тиокеталь 26 с выходом 57%. В этих ус-
отнесение сигналов 1Н и 13С выполняли с по-
ловиях дисульфид 25 обнаружен не был (схема 2).
мощью двумерных гомо- (1H-1H COSY, 1H-1H
NOESY) и гетероядерных экспериментов (1H-13C
Молекулы соединений 25 и 26 симметричны,
HSQC, 1H-13C HMBC). Масс-спектры регистри-
поэтому в их спектрах ЯМР 1H и 13С присутству-
ет один набор сигналов как терпенового, так и
ровали на приборе TermoFinnigan LCQ Fleet
аминокислотного фрагментов. В спектре ЯМР 1H
(США), оcнащенным МС детектором, диапазон
сканируемых масс m/z 50-2000 (ESI, 40 эВ). Угол
дисульфида 25 присутствует сигнал NH-протона
в виде дублета при 5.49 м.д. (J 8.0 Гц) и сохраня-
оптического вращения измеряли на автоматизи-
ется сигнал сложноэфирной метильной группы
рованном цифровом поляриметре Optical activity
при 3.63 м.д. В спектре тиокеталя 26 также наблю-
PolAAr 3001 (Великобритания). ТСХ осуществля-
дается сигнал метильной группы при 3.79 м.д. и
ли на пластинах Sorbfil, используя в качестве рас-
неразрешенный мультиплет (псевдосинглет) NH-
творителя CHCl3 или CHCl3-MeOH в различных
протона при 4.92 м.д. Кроме того, наблюдаются
градиентных соотношениях; в качестве прояви-
2 сигнала метильных групп изопропилиденового
теля - раствор фосфорномолибденовой кислоты.
фрагмента в сильном поле при 1.53 и 1.71 м.д. В
Элементный анализ проводили с использовани-
спектре ЯМР 13С тиокеталя 26, в отличие от ди-
ем автоматического анализатора марки ЕА 1110
сульфида 25, дополнительно присутствуют 2 сиг-
CHNS-O (Италия). Колоночную хроматографию
нала атомов углерода метильных групп при 30.43
выполняли на силикагеле Alfa Aesar (0.06-0.2 мм),
и 32.57 м.д.
используя те же системы растворителей, что и для
ТСХ.
Склонность дисульфидных производных к
окислению позволяет получать из них продук-
Исходный сульфохлорид - этил(12-хлорсуль-
ты с различной степенью окисления атома серы.
фоабиета-8,11,13-триен-18-оат)
(1) получен по
Так, при действии диоксидом хлора (ClO2) на
методике, описанной ранее [12]. Спектральные ха-
дисульфид 25 получен сульфохлорид 27 (выход
рактеристики и физико-химические свойства при-
80%). В спектре ЯМР 13С полученного сульфох-
ведены в той же работе.
лорида по сравнению с исходным дисульфидом
Гидрохлориды метиловых эфиров амино-
25 происходит смещение сигнала атома углерода
кислот 2-8 (общая методика). В 10 мл MeOH рас-
метиленовой группы, связанной с атомом серы, в
творяли 5 ммоль L-аминокислоты, охлаждали су-
слабое поле с 42.49 м.д. (регистрация в CDCl3) до
спензию на ледяной бане до 5-10°C, затем медлен-
67.18 м.д. (регистрация в CD3OD). В спектре ИК
но прикапывали 1 мл SOCl2. Доводили смесь до
сульфохлорида 27 присутствуют 2 полосы по-
комнатной температуры, наблюдали растворение
глощения сульфохлоридной группы при 1169 и
осадка. Продолжали перемешивание в течение 8 ч,
1381 см-1. Окисление тиокеталя 26 диоксидом
после чего удаляли растворитель при пониженном
хлора в аналогичных условиях приводит к тем же
давлении. Образовавшиеся эфиры 2-7 использова-
результатам, при этом выход сульфохлорида сни-
ли без дополнительной очистки. Гистидин практи-
жается незначительно (73%).
чески нерастворим в метаноле и плохо образует с
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ним эфир 8, поэтому полученную суспензию по-
ИК спектры регистрировали на ИК Фурье-
сле добавления SOCl2 кипятили в течение 12 ч, по-
спектрометре Shimadzu IR Prestige 21 (Япония)
сле чего фильтровали. Фильтрат выпаривали при
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
СИНТЕЗ СУ
ЛЬФОНАМИДОВ ДЕГИДРОАБИЕТАНОВОГО ТИПА
111
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
112
ИЗМЕСТЬЕВ и др.
пониженном давлении, остаток использовали без
1.32 м (15H, Me16, Me17, Me19, Me20, Me22), 1.37-
дополнительной очистки. Выход эфира 8 составил
1.53 м (2H, H1a, H6a), 1.62-1.86 м (5H, H2, H3, H6b),
23%. Спектральные характеристики различных
1.87-2.02 м (2H, H3'), 2.03 с (3H, Me5'), 2.16 д (1H,
эфиров приведены в литературе [14].
H5, J 12.5 Гц), 2.37 д (1H, H1b, J 12.4 Гц), 2.51 т
(2H, H4', J 7.3 Гц), 2.86-2.96 м (2H, H7), 3.60 с (3H,
Сульфонамиды 9-12, 15, 16 (общая методика).
OMe), 3.66 септет (1H, H15, J 6.6 Гц), 3.98-4.07 м
В 4 мл хлороформа растворяли 0.427 г (1 ммоль)
(1H, H2'), 4.08-4.21 м (2H, H21), 5.29 д (1H, NH, J
сульфохлорида 1, затем прибавляли 1.2 ммоль
8.0 Гц), 7.10 с (1H, H14), 7.78 с (1H, H11). Спектр
метилового эфира соответствующей аминокисло-
ЯМР 13C (CDCl3), δ, м.д.: 14.21 (С22), 15.27 (C5'),
ты 2-5, 8 в виде солянокислой соли. Прибавляли
16.41 (С20), 18.33 (C2), 21.17 (C6), 23.68 (С19), 24.55
2 мл ацетона, 0.2 мл воды и 3 капли Et3N. Смесь
(C16), 24.85 (C17), 29.24 (C15), 29.54 (С4'), 29.87
кипятили в течение 4-12 ч до завершения реакции
(C7), 32.64 (C3'), 36.60 (C3), 37.08 (C10), 37.74 (C1),
по данным ТСХ. Удаляли растворитель при пони-
44.65 (C5), 47.25 (C4), 52.67 (OMe), 54.64 (C2'),
женном давлении, остаток разделяли колоночной
60.53 (C21), 125.77 (C11), 128.51 (C14), 133.75 (С12),
хроматографией, используя элюенты, указанные в
141.12 (С8), 145.03 (С9), 147.41 (C13), 171.99 (C1'),
характеристике соответствующих соединений.
178.24 (C18). Найдено, %: C 60.69; H 7.79; N 2.57;
Синтез сульфонамидов 13 и 14 проводили ана-
S 11.52. C28H43NO6S2. Вычислено, %: C 60.73; H
логичным образом, используя в качестве раство-
7.83; N 2.53; S 11.58.
рителя хлороформ (7 мл на 1 ммоль сульфохлори-
Метил-N-[этил(абиета-8,11,13-триен-18-оат)-
да 1) без добавления воды или ацетона.
12-илсульфонил]-L-лейцинат
(11). Элюент
-
Метил-N-[этил(абиета-8,11,13-триен-18-оат)-
27
CHCl3. Выход 0.508 г (95%). Жёлтое масло, [α]D
12-илсульфонил]глицинат (9). Элюент - CHCl3.
+28.4 (с 0.98, CHCl3). ИК спектр, ν, см-1: 3281
Выход 0.307 г (64%). Белый порошок, т.пл. 175-
(NH), 2935, 1746 и 1722 (C=O), 1452, 1336 и 1177
177°C, [α]D26 +72.1 (с 0.20, CHCl3). ИК спектр, ν,
(SO2), 1246, 901. Спектр ЯМР 1Н (CDCl3), δ, м.д.:
см-1: 3368 (NH), 2932, 1734 и 1715 (С=О), 1454,
0.81 д (3H, Me6', J 6.6 Гц), 0.87 д (3H, Me5', J 6.6 Гц),
1341 и 1175 (SO2), 1219, 569. Спектр ЯМР 1Н
1.17-1.32 м (15H, Me16, Me17, Me19, Me20, Me22),
(CDCl3), δ, м.д.: 1.17-1.38 м (15H, Me16, Me17, Me19,
1.38-1.54 м (2H, H1a, H6a), 1.60-1.90 м (6H, H2, H3,
Me20, Me22), 1.40-1.57 м (2H, H1a, H6a), 1.61-1.91 м
H4', H6b), 2.15 д.д (1H, H5, J 12.5, 1.5 Гц), 2.38 д
(5H, H2, H3, H6b), 2.19 д (1H, H5, J 12.5 Гц), 2.36
(1H, H1b, J 12.5 Гц), 2.86-2.95 м (2H, H7), 3.51 с
д (1H, H1b, J 12.5 Гц), 2.88-2.98 м (2H, H7), 3.68 с
(3H, OMe), 3.66 д.т (1H, H15), 3.91 т.д (1H, H2', J
(3H, OMe), 3.64-3.81 м (3H, H2', H15), 4.04-4.24 м
9.6, 7.3 Гц), 4.04-4.23 м (2H, H21), 4.98 д (1H, NH,
(2H, H21), 5.03 т (1H, NH, J 4.8 Гц), 7.12 с (1H, H14),
J 9.5 Гц), 7.10 с (1H, H14), 7.79 с (1H, H11). Спектр
7.80 с (1H, H11). Спектр ЯМР 13C (CDCl3), δ, м.д.:
ЯМР 13C (CDCl3), δ, м.д.: 14.21 (С22), 16.42 (С20),
14.23 (С22), 16.42 (С20), 18.34 (C2), 21.19 (C6), 24.10
18.33 (C2), 21.19 (C6), 21.58 (C6'), 22.56 (C5'), 23.66
(С16, C19), 24.94 (C17), 29.05 (C15), 29.93 (C7), 36.52
(С19), 24.28 (С4'), 24.48 (C16), 24.85 (C17), 29.27
(C3), 37.11 (C10), 37.78 (C1), 43.97 (C2'), 44.54 (C5),
(C15), 29.87 (C7), 36.63 (C3), 37.08 (C10), 37.71 (C1),
47.26 (C4), 52.58 (OMe), 60.53 (C21), 125.75 (C11),
42.50 (C3'), 44.74 (C5), 47.28 (C4), 52.32 (OMe),
128.65 (C14), 133.34 (C12), 141.22 (С8), 145.09 (С9),
54.34 (C2'), 60.53 (C21), 125.77 (C11), 128.39 (C14),
147.45 (C13), 169.38 (С1'), 178.20 (C18). Найдено,
134.03 (С12), 140.93 (С8), 145.13 (С9), 147.30 (C13),
%: C 62.58; H 7.72; N 2.97; S 6.61. C25H37NO6S.
170.95 (С1'), 178.26 (C18). Найдено, %: C 64.98; H
Вычислено, %: C 62.61; H 7.78; N 2.92; S 6.68.
8.44; N 2.70; S 6.03. C29H45NO6S. Вычислено, %: C
65.02; H 8.47; N 2.61; S 5.98.
Метил-N-[этил(абиета-8,11,13-триен-18-оат)-
12-илсульфонил]-L-метионинат (10). Элюент -
Диметил-N-[этил(абиета-8,11,13-триен-18-
26
CHCl3. Выход 0.487 г (88%). Желтое масло, [α]D
оат)-12-илсульфонил]-L-глутамат (12). Элюент -
+60.4 (с 0.73, CHCl3). ИК спектр, ν, см-1: 3282
CHCl3-MeOH, 10:1. Выход 0.480 г (85%). Желтое
(NH), 2932, 1745 и 1721 (C=O), 1437, 1338 и 1176
масло, [α]D25 +42.0 (с 0.84, CHCl3). ИК спектр, ν,
(SO2), 1043. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.16-
см-1: 3283 (NH), 2949, 1780 (С=О), 1441, 1337 и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
СИНТЕЗ СУ
ЛЬФОНАМИДОВ ДЕГИДРОАБИЕТАНОВОГО ТИПА
113
1175 (SO2), 1248. Спектр ЯМР 1Н (CDCl3), δ, м.д.:
[α]D26 +11.9 (с 0.79, CHCl3). ИК спектр, ν, см-1:
1.14-1.35 м (15H, Me16, Me17, Me19, Me20, Me22),
2949, 1734 (C=O), 1721 (С=О), 1452, 1323 и 1175
1.36-1.54 м (2H, H1a, H6a), 1.59-1.88 м (5H, H2, H3,
(SO2), 1246, 757. Спектр ЯМР 1Н (CDCl3), δ, м.д.:
H6b), 1.88-2.00 м (1H, H3'a), 2.01-2.13 м (1H, H3'b),
1.17-1.31 м (15H, Me16, Me17 Me19 Me20 Me22),
2.14 д (1H, H5, J 12.4 Гц), 2.29-2.57 м (3H, H1b, H4'),
1.38-1.56 м (2H, H1a, H6a), 1.61-1.88 м (5H, H2, H3,
2.84-2.96 м (2Н, H7), 3.56 с (3H, Me6'), 3.66 с (3H,
H6b), 1.89-2.13 м (3H, H3'a, H4), 2.14-2.31 м (2H,
C1'OOCH3), 3.61-3.72 м (1H, H15), 3.95 д.д (1H, H2’,
H3'b, H5), 2.37 д (1H, H1b, J 11.7 Гц), 2.86-2.96 м
J 13.2, 8.2 Гц), 4.05-4.24 м (2H, H21), 5.28 д (1H, NH,
(2H, H7), 3.38-3.50 м (2H, H5'), 3.61 с (3H, OMe),
J 9.2 Гц), 7.09 с (1H, H14), 7.74 с (1H, H11). Спектр
3.80 септет (1H, H15, J 6.7 Гц), 4.04-4.23 м (2H,
ЯМР 13C (CDCl3), δ, м.д.: 14.20 (С22), 16.38 (С20),
H21), 4.46 д.д (1H, H2', J 8.4, 3.3 Гц), 7.11 с (1H,
18.30 (C2), 21.16 (C6), 23.51 (С19), 24.61 (C16), 24.79
H14), 7.85 с (1H, H11). Спектр ЯМР 13C (CDCl3), δ,
(C17), 28.33 (C3'), 29.24 (C15), 29.37 (C4'), 29.84 (C7),
м.д.: 14.21 (С22), 16.41 (С20), 18.40 (C2), 21.23 (C6),
36.60 (C3), 37.04 (C10), 37.71 (C1), 44.65 (C5), 47.23
23.93 (C19), 24.36 (C16), 24.85 (C4'), 24.88 (С17),
(C4), 51.70 (C1'OOCH3), 52.64 (C6'), 54.89 (C2'),
28.57 (C15), 29.92 (C7), 31.16 (C3'), 36.55 (C3), 37.09
60.53 (C21), 125.62 (C11), 128.48 (C14), 133.77 (С12),
(C10), 37.78 (C1), 44.67 (C5), 47.26 (C4), 48.39 (C5'),
141.03 (С8), 145.03 (С9), 147.39 (C13), 171.84 (С5'),
52.13 (OMe), 59.64 (C2'), 60.50 (C21), 125.91 (C11),
172.90 (C1'), 178.26 (C18). Найдено, %: C 61.48; H
128.43 (C14), 133.97 (C12), 140.75 (С8), 145.63 (С9),
7.73; N 2.44; S 5.73. C29H43NO8S. Вычислено, %: C
147.23 (C13), 172.57 (С1'), 178.24 (C18). Найдено,
61.57; H 7.66; N 2.48; S 5.67.
%: C 64.63; H 8.04; N 2.76; S 6.10. C28H41NO6S.
Вычислено, %: C 64.71; H 7.95; N 2.70; S 6.17.
Метил-N-[этил(абиета-8,11,13-триен-18-оат)-
12-илсульфонил]-L-тирозинат
(13). Элюент
-
Метил-N-[этил(абиета-8,11,13-триен-18-оат)-
CHCl3-MeOH, 20:1. Выход 0.556 г (100%). Желтое
12-илсульфонил]-L-гистидинат (15). Элюент -
масло, [α]D26 +35.3 (с 0.36, CHCl3). ИК спектр, ν,
CHCl3-MeOH, 40:1. Выделено в виде смеси с со-
см-1: 3431 (OH), 3294 (NH), 2935, 1740 и 1715
единением 16 (соотношение 16:15 = 5.8:1). В чи-
(С=О), 1516, 1445, 1337 и 1176 (SO2), 1217, 758.
стом виде выделить не удалось, сигналы атомов в
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.16-1.32 м (15H,
спектрах ЯМР вычленены из сигналов компонен-
Me16, Me17, Me19, Me20, Me22), 1.36-1.53 м (2H,
тов смеси. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.06
H1a, H6a), 1.63-1.94 м (5H, H2, H3, H6b), 2.14-2.23
д (3H, Me16, J 6.6 Гц), 1.10 д (3H, Me17, J 4.4 Гц),
м (1H, H5), 2.34 д (1H, H1b, J 11.7 Гц), 2.88-2.98
1.17-1.33 м (9H, Me19, Me20, Me22), 1.41-1.56 м
м (2H, H7), 3.00 д (2H, H3', J 5.9 Гц), 3.53 с (3H,
(2H, H1a, H6a), 1.60-1.93 м (5H, H2, H3, H6b), 2.16
OMe), 3.56-3.79 м (1H, H15), 4.05-4.24 м (3H, H2',
д (1H, H5, J 11.7 Гц), 2.34 д (1H, H1b, J 11.4 Гц),
H21), 5.11 д (1H, NH, J 8.1 Гц), 6.71 д (2H, H6', H8', J
2.88-3.06 м (4H, H3', H7), 3.51 с (3H, OMe), 3.56-
8.8 Гц), 6.94 д (2H, H5', H9', J 8.1 Гц), 7.09 с (1H,
3.69 м (2H, H2', H15), 4.04-4.26 м (2H, H21), 5.80
H14), 7.76 с (1H, H11). Спектр ЯМР 13C (CDCl3), δ,
д (1H, NH, J 8.1 Гц), 6.92 с (1H, H5'), 7.12 с (1H,
м.д.: 14.18 (С22), 16.40 (С20), 18.30 (C2), 21.17 (C6),
H14), 7.78 с (1H, H11), 7.85 с (1H, H6'). Спектр ЯМР
23.59 (С19), 24.53 (C16), 24.83 (C17), 29.14 (C15),
13C (CDCl3), δ, м.д.: 14.23 (С22), 16.44 (С20), 18.31
29.80 (C7), 33.61 (C3), 37.05 (C10), 37.68 (C1), 38.69
(C2), 21.00 (C6), 23.81 (C19), 23.84 (C16),
25.13
(C3'), 44.61 (C5), 47.31 (C4), 52.36 (OMe), 56.71 (C2'),
(С17), 28.57 (C15), 29.67 (C7), 30.05 (C3'), 36.46 (C3),
60.68 (C21), 115.48 (C6’, C8’), 125.46 (C11), 126.57
37.27 (C10), 37.75 (C1), 44.29 (C5), 47.19 (C4), 52.45
(C4'), 128.49 (C14), 130.53 (C5', C9'), 134.00 (С12),
(OMe), 55.00 (C2'), 60.59 (C21), 115.25 (C5'), 125.71
141.03 (С8), 145.03 (С9), 147.38 (C13), 155.21 (С7'),
(C11), 129.27 (C14), 132.48 (C12), 139.44 (С6'), 140.87
171.50 (С1'), 178.56 (C18). Найдено, %: C 65.69; H
(С8), 143.98 (С9), 145.81 (C4'), 148.68 (C13), 171.03
7.34; N 2.47; S 5.43. C32H43NO7S. Вычислено, %: C
(С1'), 178.01 (C18).
65.62; H 7.40; N 2.39; S 5.47.
Метил-Nτ-[этил(абиета-8,11,13-триен-18-
Метил-N-[этил(абиета-8,11,13-триен-18-оат)-
оат)-12-илсульфонил]-L-гистидинат (16). Элю-
12-илсульфонил]-L-пролинат
(14). Элюент
-
ент - CHCl3-MeOH, 40:1. Выход 0.391 г (70%).
CHCl3. Выход 0.519 г (100%). Желтоватое масло,
Желтый порошок, т.пл. 102-104°C, [α]D26 +28.6 (с
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
114
ИЗМЕСТЬЕВ и др.
0.83, CHCl3). ИК спектр, ν, см-1: 3381 и 3136 (NH),
(C18). Найдено, %: C 60.16; H 7.80; N 8.69; S 6.71.
2933, 1737 и 1721 (С=О), 1477, 1361 и 1180 (SO2),
C24H37N3O5S. Вычислено, %: C 60.10; H 7.78; N
1247, 1076. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.06
8.76; S 6.68.
д (3H, Me16, J 7.3 Гц), 1.11 д (3H, Me17, J 6.6 Гц),
N-[Этил(абиета-8,11,13-триен-18-оат)-12-ил-
1.18-1.31 м (9H, Me19, Me20, Me22), 1.38-1.57 м
сульфонил]-L-метионингидразид (18). Элюент -
(2H, H1a, H6a), 1.62-1.90 м (5H, H2, H3, H6b), 2.17
CHCl3-MeOH, 25:2. Выход 0.492 г (89%). Белый
д (1H, H5, J 11.7 Гц), 2.31 д (1H, H1b, J 12.5 Гц),
порошок, т.пл.
80-82°C,
[α]D24 +30.6 (с
0.90,
2.77-3.04 м (4H, H3', H7), 3.56-3.70 м (1H, H15),
CHCl3). ИК спектр, ν, см-1: 3278 (NH, NH2), 2934,
3.68 с (3H, OMe), 3.80 д.д (1H, H2', J 7.3, 5.1 Гц),
1720 (C=O), 1674 (С=О), 1443, 1319 и 1177 (SO2),
4.03-4.23 м (2H, H21), 7.00 с (1H, H5'), 7.11 с (1H,
1246, 1149. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.16-
H14), 7.80 с (1H, H11), 7.92 с (1H, H6'). Спектр ЯМР
1.33 м (15H, Me16, Me17, Me19, Me20, Me22), 1.39-
13C (CDCl3), δ, м.д.: 14.21 (С22), 16.41 (С20), 18.28
1.55 м (2H, H1a, H6a), 1.62-1.86 м (5H, H2, H3, H6b),
(C2), 20.98 (C6), 23.78 (C19), 23.82 (C16),
25.07
1.87-2.00 м (2H, H3'), 1.97 с (3H, Me5'), 2.18 д (1H,
(С17), 28.54 (C15), 30.00 (C7), 33.11 (C3'), 36.44 (C3),
H5, J 11.0 Гц), 2.36 д (1H, H1b, J 13.0 Гц), 2.41 т (2H,
37.23 (C10), 37.72 (C1), 44.27 (C5), 47.16 (C4), 51.98
H4', J 7.0 Гц), 2.86-2.97 м (2H, H7), 3.64 септет (1H,
(OMe), 53.93 (C2'), 60.58 (C21), 114.87 (C5'), 125.56
H15, J 6.7 Гц), 3.81-3.96 м (1H, H2'), 4.04-4.24 м
(C11), 129.20 (C14), 130.53 (С6'), 132.45 (C12), 140.53
(2H, H21), 7.12 с (1H, H14), 7.61 с (1H, NHNH2), 7.79
(С8), 143.82 (С9), 145.75 (C4'), 148.62 (C13), 175.08
с (1H, H11). Спектр ЯМР 13C (CDCl3), δ, м.д.: 14.21
(С1'), 177.99 (C18). Найдено, %: C 62.17; H 7.33; N
(С22), 15.03 (C5’), 16.42 (С20), 18.34 (C2), 21.16 (C6),
7.59; S 5.70. C29H41N3O6S. Вычислено, %: C 62.23;
24.03 (С19), 24.32 (C16), 24.99 (C17), 29.20 (C15),
H 7.38; N 7.51; S 5.73.
29.80 (С4'), 29.93 (C7), 31.82 (C3'), 36.49 (C3), 37.15
(C10), 37.77 (C1), 44.57 (C5), 47.25 (C4), 54.26 (C2'),
Гидразиды
17-23 (общая методика). Рас-
60.56 (C21), 125.69 (C11), 128.62 (C14), 133.90 (С12),
творяли 1 ммоль эфира 9-14, 16 в 10 мл MeOH.
141.40 (С8), 144.90 (С9), 147.57 (C13), 171.23 (C1'),
Затем прибавляли 0.35 мл (7 ммоль) гидразинги-
178.20 (C18). Найдено, %: C 58.48; H 7.90; N 7.65;
драта. Перемешивали реакционную смесь при
S 11.51. C27H43N3O5S2. Вычислено, %: C 58.56; H
комнатной температуре 72 ч, после чего удаляли
7.83; N 7.59; S 11.58.
растворитель при пониженном давлении, остаток
N-[Этил(абиета-8,11,13-триен-18-оат)-12-ил-
разделяли колоночной хроматографией на SiO2.
сульфонил]-L-лейцингидразид (19). Элюент -
N-[Этил(абиета-8,11,13-триен-18-оат)-12-ил-
CHCl3-MeOH, 17:1. Выход 0.497 г (93%). Жел-
сульфонил]глицингидразид
(17). Элюент
-
товатый порошок, т.пл. 96-98°C, [α]D26 +59.7 (с
CHCl3-MeOH, 10:1. Выход 0.326 г (68%). Белый
0.59, CHCl3). ИК спектр, ν, см-1: 3275 (NH, NH2),
порошок, т.пл.
86-88°C,
[α]D24 +51.2 (с
0.40,
2953, 1722 и 1676 (C=O), 1462, 1390, 1365 и 1175
CHCl3). ИК спектр, ν, см-1: 3279 (NH, NH2), 2932,
(SO2), 1246. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.58
1720 (C=O), 1686 (С=О), 1454, 1323 и 1150 (SO2),
д (3H, Me5', J 5.1 Гц), 0.76 д (3H, Me6', J 5.1 Гц),
1246. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.13-1.35 м
1.13-1.30 м (15H, Me16, Me17, Me19, Me20, Me22),
(15H, Me16, Me17, Me19, Me20, Me22), 1.38-1.53 м
1.35-1.59 м (5H, H1a, H3', H4', H6a), 1.60-1.86 м (5H,
(2H, H1a, H6a), 1.60-1.91 м (5H, H2, H3, H6b), 2.17
H2, H3, H6b), 2.17 д (1H, H5, J 11.0 Гц), 2.34 д (1H,
д (1H, H5, J 11.7 Гц), 2.32 д (1H, H1b, J 11.7 Гц),
H1b, J 11.7 Гц), 2.85-2.95 м (2H, H7), 3.57-3.73 м
2.85-2.99 м (2H, H7), 3.55-3.77 м (3H, H2', H15),
(2H, H2', H15), 4.01-4.22 м (2Н, H21), 5.89 уш.с (1H,
4.03-4.22 м (2H, H21), 7.12 с (1H, H14), 7.74 с (1H,
NH), 7.10 с (1H, H14), 7.78 с (1H, H11), 8.03 уш.с
H11), 8.20 уш.с (1H, NHNH2). Спектр ЯМР 13C
(1H, NHNH2). Спектр ЯМР 13C (CDCl3), δ, м.д.:
(CDCl3), δ, м.д.: 14.20 (С22), 16.41 (С20), 18.31 (C2),
14.15 (С22), 16.38 (С20), 18.28 (C2), 21.13 (C6), 21.29
21.13 (C6), 24.13 (C19), 24.17 (С16), 24.97 (C17),
(C5'), 22.56 (C6'), 23.51 (С19), 24.13 (C16), 24.61 (C4'),
28.94 (C15), 29.90 (C7), 36.45 (C3), 37.09 (C10), 37.77
24.95 (C17), 29.11 (C15), 29.86 (C7), 36.42 (C3), 37.05
(C1), 44.46 (C5), 44.74 (C2'), 47.23 (C4), 60.55 (C21),
(C10), 37.62 (C1), 41.97 (C3'), 44.51 (C5), 47.20 (C4),
125.61 (C11), 128.76 (C14), 133.02 (C12),
141.41
54.13 (C2'), 60.50 (C21), 125.52 (C11), 128.45 (C14),
(С8), 144.83 (С9), 147.61 (C13), 168.85 (С1', 178.20
134.21 (С12), 141.06 (С8), 144.86 (С9), 147.33 (C13),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
СИНТЕЗ СУ
ЛЬФОНАМИДОВ ДЕГИДРОАБИЕТАНОВОГО ТИПА
115
172.40 (С1'), 178.18 (C18). Найдено, %: C 62.69; H
141.41 (С8), 144.97 (С9), 147.65 (C13), 155.45 (С7'),
8.42; N 8.01; S 5.95. C28H45N3O5S. Вычислено, %:
171.05 (С1'), 178.71 (C18). Найдено, %: C 63.69; H
C 62.77; H 8.47; N 7.84; S 5.98.
7.45; N 7.10; S 5.50. C31H43N3O6S. Вычислено, %:
C 63.57; H 7.40; N 7.17; S 5.47.
N-[Этил(абиета-8,11,13-триен-18-оат)-12-ил-
сульфонил]дигидразид L-глутаминовой кис-
N-[Этил(абиета-8,11,13-триен-18-оат)-12-
лоты (20). Элюент - CHCl3-MeOH, 4:1. Выход
илсульфонил]-L-пролингидразид (22). Элюент -
0.339 г (60%). Белый порошок, т.пл. 135-137°C,
CHCl3-MeOH, 25:1. Выход 0.275 г (53%). Жел-
[α]D23 +115.3 (с 0.10, CHCl3). ИК спектр, ν, см-1:
товатое масло, [α]D23 -22.5 (с 0.50, CHCl3). ИК
3262 (NH, NH2), 2940, 1721 и 1682 (С=О), 1443,
спектр, ν, см-1: 3212 (NH, NH2), 2934, 1721 (C=O),
1369 и 1174 (SO2), 1246. Спектр ЯМР 1Н (CDCl3),
1681 (С=О), 1553, 1452, 1317 и 1141 (SO2), 1244,
δ, м.д.: 1.10-1.31 м (15H, Me16, Me17, Me19, Me20,
731. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.16-1.30
Me22), 1.35-1.52 м (2H, H1a, H6a), 1.57-1.85 м (5H,
м (15H, Me16, Me17 Me19 Me20 Me22), 1.37-1.54 м
H2, H3, H6b), 1.97 септет (1H, H3', J 7.0 Гц), 2.16
(2H, H1a, H6a), 1.61-1.96 м (8H, H2, H3, H3'a, H4',
д (1H, H5, J 12.5 Гц), 2.21-2.38 м (3H, H1b, H4'),
H6b), 2.17 д (1H, H5, J 12.5 Гц), 2.22-2.29 м (1H,
2.84-2.95 м (2H, H7), 3.54-3.78 м (1H, H15), 3.66
H3'b), 2.33 д (1H, H1b, J 13.2 Гц), 2.86-2.95 м (2H,
септет (1H, H15, J 6.5 Гц), 3.81 т (1H, H2', J 5.9 Гц),
H7), 3.16-3.30 м (1H, H5'a), 3.34-3.45 м (1H, H5'b),
4.01-4.24 м (2H, H21), 7.09 с (1H, H14), 7.72 с (1H,
3.81 септет (1H, H15, J 6.8 Гц), 4.02-4.22 м (2H,
H11), 8.05, 8.60 оба с (2H, 2NHNH2). Спектр ЯМР
H21), 4.27 д (1H, H2', J 7.3 Гц), 7.13 с (1H, H14), 7.73
13C (CDCl3), δ, м.д.: 14.23 (С22), 16.42 (С20), 18.36
с (1H, H11), 7.92 уш.с (1H, NHNH2). Спектр ЯМР
(C2), 21.17 (C6), 24.14 (С19), 24.23 (C16), 24.97 (C17),
13C (CDCl3), δ, м.д.: 14.18 (С22), 16.38 (С20), 18.30
28.61 (C3'), 29.08 (C15), 29.74 (C4'), 29.98 (C7), 36.49
(C2), 21.10 (C6), 24.20 (C19), 24.39 (C16), 24.66 (C4'),
(C3), 37.12 (C10), 37.70 (C1), 44.58 (C5), 47.25 (C4),
25.01 (С17), 28.85 (C15), 29.92 (C7), 30.21 (C3'), 36.42
54.97 (C2'), 60.56 (C21), 125.34 (C11), 128.61 (C14),
(C3), 37.07 (C10), 37.72 (C1), 44.46 (C5), 47.19 (C4),
134.06 (С12), 141.14 (С8), 144.91 (С9), 147.51 (C13),
49.05 (C5'), 60.52 (C21), 60.77 (C2'), 126.25 (C11),
171.09 (C1'), 173.19 (C5'), 178.21 (C18). Найдено,
128.74 (C14), 131.73 (C12), 141.60 (С8), 145.53 (С9),
%: C 57.27; H 7.68; N 12.40; S 5.60. C27H43N5O6S.
147.84 (C13), 171.59 (С1'), 178.11 (C18). Найдено,
Вычислено, %: C 57.32; H 7.66; N 12.38; S 5.67.
%: C 62.46; H 7.93; N 8.15; S 6.11. C27H41N3O5S.
Вычислено, %: C 62.40; H 7.95; N 8.09; S 6.17.
N-[Этил(абиета-8,11,13-триен-18-оат)-12-ил-
сульфонил]-L-тирозингидразид (21). Элюент -
Nτ-[Этил(абиета-8,11,13-триен-18-оат)-12-
CHCl3-MeOH, 10:1. Выход 0.527 г (90%). Белый
илсульфонил]-L-гистидингидразид
(23). Элю-
порошок, т.пл. 134-136°C, [α]D25 +40.5 (с 0.22,
ент - CHCl3-MeOH, 5:1. Выход 0.095 г (17%).
CHCl3). ИК спектр, ν, см-1: 3296 (NH, NH2), 2930,
Желтое масло, [α]D27 +6.4 (с 0.16, CHCl3). ИК
1720 (C=O), 1672 (С=О), 1516, 1449, 1319 и 1150
спектр, ν, см-1: 3296 (NH, NH2), 2928, 1721 и 1695
(SO2), 1250. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.13-
(С=О), 1468, 1366 и 1180 (SO2), 1246, 1074. Спектр
1.34 м (15H, Me16, Me17, Me19, Me20, Me22), 1.35-
ЯМР 1Н (CDCl3), δ, м.д.: 1.04 д (3H, Me16, J 6.6 Гц),
1.54 м (2H, H1a, H6a), 1.58-1.90 м (5H, H2, H3, H6b),
1.10 д (3H, Me17, J 6.6 Гц), 1.19-1.32 м (9H, Me19,
2.16 д (1H, H5, J 12.5 Гц), 2.29 д (1H, H1b, J 12.5 Гц),
Me20, Me22), 1.42-1.58 м (2H, H1a, H6a), 1.64-1.92
2.81-2.98 м (4H, H3', H7), 3.67 септет (1H, H15, J
(5H, H2, H3, H6b), 2.19 д (1H, H5, J 11.7 Гц), 2.33
6.6 Гц), 3.91 т (1H, H2', J 5.5 Гц), 4.05-4.24 м (2H,
д (1H, H1b, J 13.2 Гц), 2.78 д.д (1H, H3'a, J 14.7,
H21), 5.64 уш.с (1H, NH), 6.64 д (2H, H6', H8', J
8.1 Гц), 2.88-3.00 м (2H, H7), 3.05 д.д (1H, H3'b, J
7.3 Гц), 6.81 д (2H, H5', H9', J 8.1 Гц), 7.10 с (1H, H14),
14.7, 3.7 Гц), 3.56-3.76 м (2H, H2', H15), 4.05-4.23
7.75 с (1H, H11), 7.82 с (1H, NHNH2). Спектр ЯМР
м (2H, H21), 6.98 с (1H, H5'), 7.12 с (1H, H14), 7.87 с
13C (CDCl3), δ, м.д.: 14.20 (С22), 16.40 (С20), 18.27
(1H, H11), 7.94 с (1H, H6'), 8.38 уш.с (1H, NHNH2).
(C2), 21.17 (C6), 24.16 (С19), 24.25 (C16), 24.92 (C17),
Спектр ЯМР 13C (CDCl3), δ, м.д.: 14.23 (С22), 16.42
29.05 (C15), 29.76 (C7), 36.65 (C3), 37.04 (C10), 37.59
(С20), 18.28 (C2), 20.98 (C6), 23.76 (C19, C16), 25.10
(C1), 38.13 (C3'), 44.42 (C5), 47.29 (C4), 56.94 (C2'),
(С17), 28.51 (C15), 30.03 (C7), 32.73 (C3'), 36.44 (C3),
60.77 (C21), 115.81 (C6', C8'), 125.33 (C11), 126.53
37.26 (C10), 37.75 (C1), 44.26 (C5), 47.17 (C4), 54.41
(C4'), 128.58 (C14), 130.24 (C5', C9'), 133.80 (С12),
(C2'), 60.61 (C21), 114.93 (C5'), 125.74 (C11), 129.24
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
116
ИЗМЕСТЬЕВ и др.
(C14), 132.21 (C12), 134.00 (С6'), 140.96 (С8), 144.01
100:1. Выход 0.311 г (57%). Желтое масло, [α]D29
(С9), 145.74 (C4'), 148.69 (C13), 174.01 (С1'), 178.01
+6.4 (с 0.20, CHCl3). ИК спектр, ν, см-1: 3366 (NH),
(C18). Найдено, %: C 59.91; H 7.34; N 12.61; S 5.69.
2949, 1741 и 1724 (C=O), 1441, 1333 и 1177 (SO2),
C28H41N5O5S. Вычислено, %: C 60.08; H 7.38; N
1248. Спектр ЯМР 1Н (CDCl3), δ, м.д. (указаны сиг-
12.51; S 5.73.
налы одной половины симметричной молекулы):
1.14-1.35 м (15H, Me16, Me17, Me19, Me20, Me22),
Дисульфид 25 и биссульфид 26 (общая мето-
дика). Растворяли 1 ммоль (0.427 г) сульфохлори-
1.41-1.56 м (2H, H1a, H6a), 1.53 с (3H, H5'), 1.71 с
(3H, H6'), 1.60-1.90 м (5H, H2, H3, H6b), 2.19 д (1H,
да 1 и 0.5 ммоль (0.341 г) солянокислого димети-
H5, J 12.1 Гц), 2.35 д (1H, H1b, J 12.9 Гц), 2.86-2.96
лового эфира цистина 24 в 15 мл CHCl3, затем при-
м (2H, H7), 3.03 т (1H, H3'a, J 9.9 Гц), 3.44 д.д (1H,
бавляли 0.5 мл Et3N. Полученную смесь кипятили
H3'b, J 10.4, 4.7 Гц), 3.65-3.84 м (1H, H15), 3.79 с
в течение 16 ч, после чего отгоняли растворитель,
а остаток разделяли колоночной хроматографией
(3H, OMe), 4.05-4.20 м (3H, H2', H21), 4.92 с (1H,
NH), 7.12 с (1H, H14), 7.87 с (1H, H11). Спектр ЯМР
(элюент - CHCl3-MeOH, 100:1). Выход дисуль-
13C (CDCl3), δ, м.д.: 14.21 (С22), 16.42 (С20), 18.34
фида 25 в этих условиях составил 89%. Биссуль-
(C2), 21.19 (C6), 24.03 (С19), 24.09 (C16), 24.94 (C17),
фид 26 получали аналогичным образом, исполь-
29.08 (C15), 29.92 (C7), 30.43 (C6'), 32.57 (C5'), 36.48
зуя смесь растворителей СHCl3-(CH3)2CO-H2O
(4:4:1). Выход биссульфида 57%.
(C3), 37.14 (C10), 37.78 (C1), 39.09 (C4'), 40.19 (C3'),
44.52 (C5), 47.26 (C4), 52.48 (OMe), 60.52 (C21),
Диметил-N,N'-бис[этил(абиета-8,11,13-три-
64.39 (C2'), 124.45 (C11), 128.42 (C14), 136.32 (С12),
ен-18-оат)-12-илсульфонил]-L-цистинат
(25).
140.90 (С8), 144.37 (С9), 147.45 (C13), 170.21 (С1'),
Элюент - CHCl3-MeOH, 100:1. Выход 0.468 г
178.21 (C18). Найдено, %: C 60.47; H 7.51; N 2.61;
(89%). Желтый порошок, т.пл. 97-99°C, [α]D29
S 11.81. C55H82N2O12S4. Вычислено, %: C 60.52; H
+106.5 (с 0.22, CHCl3). ИК спектр, ν, см-1: 3376
7.57; N 2.57; S 11.75.
(NH), 2947, 1746 и 1721 (С=О), 1443, 1339 и 1174
Метил-3-хлорсульфо-N-[этил(абиета-8,11,13-
(SO2), 1247. Спектр ЯМР 1Н (CDCl3), δ, м.д. (ука-
триен-18-оат)-12-илсульфонил]-L-аланинат
заны сигналы одной половины симметричной
(27). К 0.5 ммоль соединения 25 (0.524 г) или 26
молекулы): 1.17-1.36 м (15H, Me16, Me17, Me19,
Me20, Me22), 1.38-1.54 м (2H, H1a, H6a), 1.61-1.93
(0.545 г) при перемешивании приливали 2 ммоль
(20 мл) раствора ClO2 в дихлорметане (концен-
м (5H, H2, H3, H6b), 2.17 д (1H, H5, J 11.5 Гц), 2.36
трация 0.1 моль/л). Перемешивали образующийся
д (1H, H1b, J 12.1 Гц), 2.92 уш.с (2H, H7), 3.09 д.д
раствор в течение 2 ч, после удаляли растворитель
(1H, H3'a, J 13.9, 5.4 Гц), 3.24 д.д (1H, H3'b, J 14.4,
при пониженном давлении. Остаток содержал 80%
4.3 Гц), 3.63 с (3H, OMe), 3.57-3.73 м (1H, H15),
4.04-4.29 м (3H, H2', H21), 5.49 д (1H, NH, J 8.0 Гц),
сульфохлорида (по данным ЯМР 1Н спектроско-
пии).
7.11 с (1H, H14), 7.78 с (1H, H11). Спектр ЯМР 13C
(CDCl3), δ, м.д.: 14.23 (С22), 16.42 (С20), 18.33 (C2),
Диоксид хлора - промышленный продукт, ис-
21.19 (C6), 23.69 (С19), 24.55 (C16), 24.91 (C17),
пользуемый для отбелки целлюлозы, производ-
29.24 (C15), 29.90 (C7), 36.60 (C3), 37.11 (C10),
ства Монди СЛПК. Поставляется в виде водного
37.80 (C1), 42.49 (C3'), 44.64 (C5), 47.26 (C4), 52.92
раствора с концентрацией 7-10 г/л. Раствор ClO2 в
(OMe), 54.73 (C2'), 60.56 (C21), 125.56 (C11), 128.64
дихлорметане получен простой экстракцией с по-
(C14), 133.85 (С12), 141.24 (С8), 145.11 (С9), 147.45
следующим осушением над Na2SO4.
(C13), 170.21 (С1'), 178.26 (C18). Масс-спектр, m/z
ИК спектр, ν, см-1: 3295 (NH), 2937,
1719
(Iотн, %): 1083.07 (100) [M - 2H+ + 2H2O], 1047.16
(С=О), 1458, 1381 и 1169 (SO2), 1248. Спектр
(84) [M - 2H]+, 690.41 (70), 654.61 (55), 556.21 (64),
ЯМР 1Н (CD3OD), δ, м.д.: 1.11-1.30 м (15H, Me16,
490.42 (96), 423.51 (57). Найдено, %: C 59.61; H
Me17, Me19, Me20, Me22), 1.32-1.50 м (2H, H1a, H6a),
7.26; N 2.62; S 12.28. C52H76N2O12S4. Вычислено,
1.55-1.93 м (5H, H2, H3, H6b), 2.12 д (1H, H5, J
%: C 59.52; H 7.30; N 2.67; S 12.22.
12.1 Гц), 2.34 д (1H, H1b, J 12.4 Гц), 2.79-2.94 м
N,N'-Бис[этил(абиета-8,11,13-триен-18-оат)-
(2H, H7), 3.63-3.94 м (5H, H3'a, Me4', H15), 4.01-
12-илсульфонил]-S,S'-изопропилиденди(O-
4.17 м (2H, H21), 4.25 д.д (1H, H2', J 14.5, 5.8 Гц),
метил)цистеин (26). Элюент - CHCl3-MeOH,
4.44 д.д (1H, H3'b, J 20.4, 7.5 Гц), 5.76 д (1H, NH, J
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
СИНТЕЗ СУ
ЛЬФОНАМИДОВ ДЕГИДРОАБИЕТАНОВОГО ТИПА
117
7.9 Гц), 7.18 с (1H, H14), 7.77 с (1H, H11). Спектр
КОНФЛИКТ ИНТЕРЕСОВ
ЯМР 13C (CD3OD), δ, м.д.: 14.64 (С22), 17.04 (С20),
Авторы заявляют об отсутствии конфликта ин-
19.48 (C2), 22.43 (C6), 24.26 (С19), 24.91 (C16), 25.42
тересов.
(C17), 30.18 (C15), 30.88 (C7), 37.91 (C3), 38.40 (C10),
3 9.22 (C1), 46.37 (C5), 50.34 (C4), 51.45 (C4'), 53.62
СПИСОК ЛИТЕРАТУРЫ
(C2'), 61.98 (C21), 67.18 (C3'), 126.67 (C11), 129.88
1. Gu W., Miao T.-T., Hua D.-W., Jin X.-Y., Tao X.-B.,
(C14), 136.05 (С12), 142.45 (С8), 146.70 (С9), 148.69
Huang Ch.-B., Wang Sh.-F. Bioorg. Med. Chem. Lett.
(C13), 169.64 (С1'), 179.98 (C18).
2017, 27, 1296-1300. doi 10.1016/j.bmcl.2017.01.028
ЗАКЛЮЧЕНИЕ
2. Gonzalez M.A. Nat. Prod. Rep. 2015, 32, 684-704. doi
Впервые осуществлен синтез сульфонамидов
10.1039/C4NP00110A
по реакции этилового эфира 12-сульфохлордеги-
3. Gonzalez M.A. Eur. J. Med. Chem. 2014, 87, 834-842.
дроабиетиновой кислоты с метиловыми эфирами
doi10.1016/j.ejmech.2014.10.023
аминокислот: глицина, метионина, лейцина, аспа-
4. Pertino M.W., Verdugo V., Theoduloz C., Schmeda-
рагиновой кислоты, тирозина, цистина, пролина и
Hirschmann G. Molecules. 2014, 19, 2523-2535. doi
гистидина. Показано, что во всех случаях, кроме
10.3390/molecules19022523
гистидина, реакция протекала по α-аминогруппе.
5. Huang X.-Ch., Wang M., Pan Y.-M., Yao G.-Y.,
В случае применения метилового эфира гистиди-
Wang H.-Sh., Tian X.-Y., Qin J.-K., Zhang Y. Eur.
на реакция протекала преимущественно по NH-
J. Med. Chem. 2013, 69, 508-520. doi 10.1016/
группе имидазольного фрагмента. При наличии
j.ejmech.2013.08.055
нескольких аминогрупп в структуре диметилового
6. Huang X.-Ch., Jin L., Wang M., Liang D., Chen Zh.-F.,
эфира цистина образовывался соответствующий
Zhang Y., Pan Y.-M., Wang H.-Sh. Eur. J. Med. Chem.
биссульфонамид. Окислением дитерпеновых про-
2015, 89, 370-385. doi 10.1016/j.ejmech.2014.10.060
изводных цистина диоксидом хлора впервые син-
7. Huang X., Huang R., Liao Zh., Pan Y., Gou Sh.,
тезирован сульфохлорид, являющийся перспек-
Wang H. Eur. J. Med. Chem. 2016, 108, 381-391. doi
тивным в химическом синтезе реагентом.
10.1016/j.ejmech.2015.12.008
ФОНДОВАЯ ПОДДЕРЖКА
8. Huang R.-Zh., Liang G.-B., Huang X.-Ch., Zhang B.,
Работа выполнена при финансовой поддерж-
Zhou M.-M., Liao Zh.-X., Wang H.-Sh. Eur. J.
ке Министерства науки и высшего образования
Med. Chem.
2017,
138,
979-992. doi
10.1016/
Российской Федерации (государственное задание
j.ejmech.2017.07.020
№ 122040600073-3) и при поддержке научно-обра-
9. Zareef M., Iqbal R., Al-Masoudi N.A., Zaidi J.H.,
зовательного центра мирового уровня «Российская
Arfan M., Shahzad S.A. Phosphorus, Sulfur
Арктика: новые материалы, технологии и методы
Silicon Relat. Elem.
2007,
182,
281-298.
исследования». Анализ синтезированных соеди-
doi10.1080/10426500600919074
нений выполнен с использованием оборудова-
10. Zareef M., Iqbal R., De Dominguez N.G., Rodrigues J.,
ния Центра коллективного пользования (ЦКП)
Zaidi J.H., Arfan M., Supuran C.T. J. Enzyme Inhib.
«Химия» Института химии ФИЦ Коми НЦ УрО
Med. Chem.
2007,
22,
301-308. doi
10.1080/
РАН.
14756360601114569
ИНФОРМАЦИЯ ОБ АВТОРАХ
11. Izmest’ev Ye.S., Pestova S.V., Lezina O.M., Rubtso-
va S.A., Kutchin A.V. ChemistrySelect.
2019,
4,
Изместьев Евгений Сергеевич, ORCID: https://
11034-11037. doi 10.1002/slct.201902600
orcid.org/0000-0001-5698-6292
12. Пестова С.В., Петухов Д.В., Изместьев Е.С., Руб-
Петухов Дмитрий Валерьевич, ORCID: https://
цова С.А. ЖОрХ. 2022, 58, 897-905. doi 10.31857/
orcid.org/0000-0002-7733-5250
S0514749222080134
Пестова Светлана Валерьевна, ORCID: https://
13. Райхардт К. Растворители и эффекты среды в ор-
orcid.org/0000-0002-8791-5996
ганической химии. М.: Мир, 1991.
Рубцова Светлана Альбертовна, ORCID: https://
14. Li J., Sha Y. Molecules. 2008, 13, 1111-1119. doi
orcid.org/0000-0003-1224-8751
10.3390/molecules13051111
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023
118
ИЗМЕСТЬЕВ и др.
Synthesis of Dehydroabietane-Derived Sulfonamides
with Fragments of L-Amino Acid Esters and Hydrazides
E. S. Izmest’eva, *, D. V. Petukhovb, S. V. Pestovaа, and S. A. Rubtsovaa
a Institute of Chemistry, Komi Scientific Center, Ural Branch of the Russian Academy of Sciences
ul. Pervomaiskaya, 48, Syktyvkar, 167000 Russia
b Vyatka State University, ul. Moskovskaya, 36, Kirov, 610000 Russia
*e-mail: evgeniyizmestev@rambler.ru
Received March 18, 2022; revised March 22, 2022; accepted March 24, 2022
Ethyl ester of 12-chlorosulfodehydroabietic acid, when reacted with the methyl esters of glycine, methionine,
leucine, glutamic acid, tyrosine, proline, histidine, for the first time yielded the corresponding sulfonamides,
the ester group (-COOMe) of which was selectively transferred to the hydrazide (-COONHNH2) without
affecting the ethyl group bounded with the dehydroabietic acid fragment. In the case of glutamic acid, the
corresponding dihydrazides were obtained. The reaction of 12-chlorosulfodehydroabietic acid ethyl ester with
cystine dimethyl ester led to the selective formation of bis-sulfonamide, while carrying out the same reaction in
an acetone-contained solution was accompanied by the cleavage of the disulfide bond of the cystine fragment
to give thioketal. The obtained bis-sulfonamide and thioketal were oxidized with chlorine dioxide to afford in
both cases sulfochloride.
Keywords: diterpenoids, sulfonamides, amino acids, hydrazides, ethers, sulfochlorides
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 1 2023