ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 11, с. 1513-1518
КРАТКИЕ СООБЩЕНИЯ
УДК 548.737; 541.124; 547.314
ДОСТУПНЫЙ СПОСОБ СИНТЕЗА E-N-ЗАМЕЩЕННЫХ-
2-ДИФЕНИЛФОСФОРИЛАЗИРИДИНОВ
© 2023 г. А. С. Бичахчянa,*, Л. В. Дердзянa, А. С. Погосянa, Г. А. Паносянb, А. Г. Аракелянa,
Г. М. Степанянa, Р. Е. Мурадянa, Г. Ц. Гаспарянa
a Научно-технологический центр органической и фармацевтической химии Национальной академии наук
Республики Армения, Институт органической химии,
Армения, 0014 Ереван просп. Азатутяна, 26
b Центр исследования строения молекул, Армения, 0014 Ереван просп. Азатутяна, 26
*e-mail: arpenikb@mail.ru
Поступила в редакцию 28.11.2022 г.
После доработки 10.12.2022 г.
Принята к публикации 11.12.2022 г.
Разработан доступный способ синтеза E-N-замещенных-2-дифенилфосфорилазиридинов с высокими
выходами взаимодействием (1,2-дибромэтил)(дифенил)фосфиноксида с рядом первичных аминов, в част-
ности, метил-,этил-, изопропил-, трет-бутил, циклогексил-, бензил-аминами при комнатной температуре
в присутствии гидроксида натрия. Изучена антибактериальная активность синтезированных соединений.
Ключевые слова: (1,2-дибромэтил)(дифенил)фосфиноксид, нуклеофильное замещение, первичные
амины, нуклеофильное присоединение, E-N-замещенные-2-дифенилфосфорилазиридины
DOI: 10.31857/S0514749223110150, EDN: NEUILE
За последние десятилетия химия, относящая-
многими типами нуклеофилов [9, 10]. Исходя из
ся к азагетероциклическим кольцам, азиридинам,
вышеизложенного, с целью синтеза азиридинов,
расширилась из-за их синтетического и биологи-
содержащих фосфорильную группу изучено взаи-
ческого значения. Интерес к функционализиро-
модействие (1,2-дибромэтил)(дифенил)фосфинок-
ванным азиридинам основан на их биологической
сида (1) с первичными аминами.
активности, в частности, они известны как проти-
В литературе стартовыми материалами для
воопухолевые препараты, ковалентно сшивающие
получения фосфорзамещенных азиридинов явля-
ДНК через образование иона азиридиния [1-5].
ются азиринфосфиноксиды, которые, в свою оче-
Известно также, что фосфорные фрагменты в со-
редь, получаются либо из 1-фосфорилвинилази-
ставе азиридина регулируют важные биологиче-
дов, либо из β-тозилоксимов, содержащих фосфо-
ские функции. Так, аминофосфоновые кислоты,
рильную группу [11, 12]. Имеются также работы
содержашие азагетероциклические кольца, введен-
в которых азиридинилзамещенные фосфонаты по-
ные в биологически активные пептиды проявляют
лучены из 1-бромвинил- и 1,2-дибромэтил-фосфо-
антибактериальные свойства [6], используются в
натов и аммиака в жестких условиях и с низкими
качестве ингибиторов ферментов [7] и гербецидов
выходами [9, 13, 14].
[8]. Наряду с биологической активностью азири-
дины являются ключевыми субстратами в синтезе
В настоящем сообщении описывается метод
ряда замещенных аминов посредством регио- и
синтеза
2-фосфорилзамещенных трехчленных
стереоселективной реакции раскрытия кольца со
азотсодержащих гетероциклов. При варьирова-
1513
1514
БИЧАХЧЯН и др.
Схема 1
Ph
Ph
Ph
Br
P
NaOH
Ph P
+
RNH2
O
N
O Br
R
1
2-7
R = CH3 (2); C2H5 (3); iso-C3H7 (4); tert-C4H9 (5); C6H11 (6); C6H5CH2 (7).
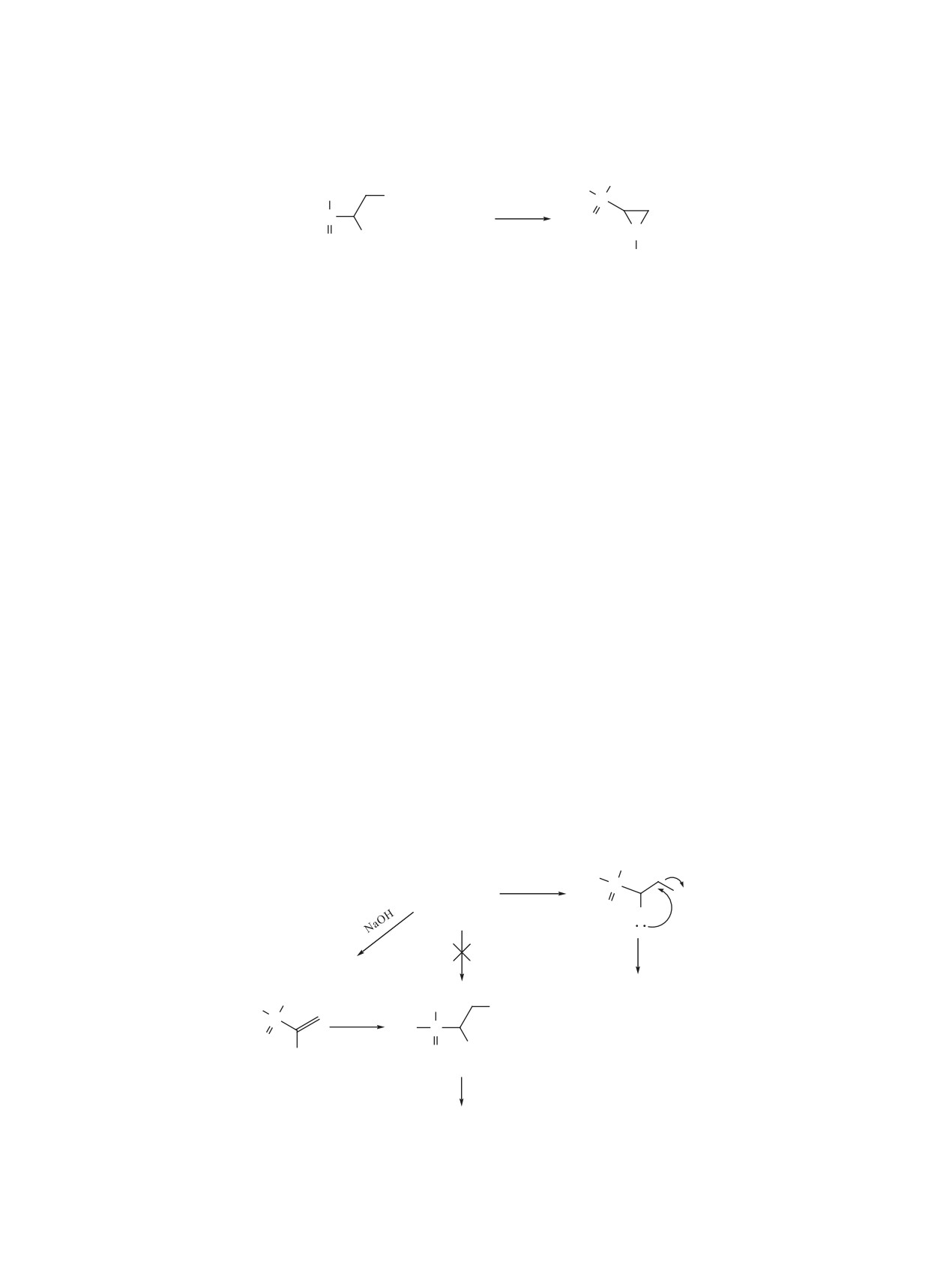
нии условий реакции установлено, что взаимо-
из
(1-бромвинил)(дифенил)фосфиноксида
[15],
действие
(1,2-дибромэтил)(дифенил)фосфин-
являющегося продуктом дегидробромирования
оксида (1) с рядом первичных аминов, в частно-
фосфинксида 1 не увенчалась успехом. В ЯМР
сти, метил-, этил-, изопропил-, трет-бутил-, ци-
31Р-спектре наряду с сигналом, характерным ази-
клогексил- и бензил-аминами в присутствии ги-
ридину (15%) наблюдались сигналы ряда фосфор-
дроксида натрия в соотношении реагентов 1:2:3,
ных продуктов. Исходя из этого можно сделать
соответственно, при комнатной температуре, в
вывод, что нуклеофильное замещение в молеку-
результате двойного нуклеофильного замеще-
ле (1,2-дибромэтил)(дифенил)фосфиноксида (1),
ния приводит к образованию E-N-замещенным-
по-видимому, начинается с атаки α-углеродного
2-дифенилфосфорилазиридинам 2-7 с высокими
атома, ибо атака по β-углеродному атому привела
выходами по схеме 1.
бы к тому же продукту, что и в случае нуклеофиль-
ного присоединения амина к (1-бромвинил)(дифе-
Следует отметить, что в случае трет-бутил-
нил)фосфиноксиду по схеме 2.
аминa, согласно данным ЯМР 1Н, проведение
реакции при комнатной температуре приводит к
Е-N-Метил-2-дифенилфосфорилазиридин
образованию смеси азиридина 5 (48%) и (1-бром-
(2). Смесь 0.3 г (0.77 ммоль) (1,2-дибромэтил)-
винил)(дифенил)фосфиноксида
(47%). Однако,
(дифенил)фосфиноксида (1), 0.1 г (1.54 ммоль)
нагревание реакционной смеси при 35-40°С в те-
хлоргидрата метиламина и 0.12 г (3.0 ммоль) ги-
чение 15 ч повышает выход азиридина 5 до 87%.
дроксида натрия в 10 мл ацетонитрила интенсивно
Такое различие в поведении, по всей вероятности,
перемешивали при комнатной температуре в тече-
обьясняется наличием в молекуле амина трет-бу-
ние 9 ч. Растворитель удаляли в вакууме, остаток
тильной группы, стерически затрудняющей после-
растворяли в хлороформе, промывали насыщен-
довательные реакции замещения и циклизации.
ным водным раствором NaCl (2×10 мл), водой и
Попытка получить вышеуказанные 2-фосфо-
сушили CaCl2. Хлороформ удаляли в вакууме,
рилзамещенные азиридины в тех же условиях
остаток промывали абсолютным эфиром и сушили
Схема 2
Ph
RNH2
Ph
P
1
Br
NaOH
O
RNH
RNH2
2-7
Ph
Ph
Ph
RNH2
NHR
P
Ph
P
O
NaOH
O
Br
Br
смесь фосфорных продуктов
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 11 2023
ДОСТУПНЫЙ СПОСОБ СИНТЕЗА
1515
в вакууме. Выход 0.17 г (85.9%), белые кристаллы,
E-N-Изопропил-2-дифенилфосфорилази-
т.пл. 120-121°С. E-конфигурация азиридина уста-
ридин (4). Получен аналогично соединению 2
новлена на основе NOE сигнала между протонами
из 0.5 г (1.3 ммоль) фосфиноксида 1, 0.25 г
метильной и метиновой групп в спектре NOESY.
(2.6 ммоль) хлоргидрата изопропиламина и 0.21 г
ИК спектр, ν, см-1: 3030 (СН, Ph), 1590 (CH=CH,
(5.2 ммоль) гидроксида натрия в 15 мл ацетони-
Ph), 1280 (P=O). Спектр ЯМР 1Н, δ, м.д: 1.57 д.д.д
трила. Выход 0.33 г (89%), вязкое бесцветное ве-
(1Н, PCHCHaHb, 3JH,H 6.7, 3JP,H 5.5, 2JH,H 1.3 Гц),
щество. ИК спектр, ν, см-1: 3030 (СН, Ph), 1595
1.84 д.д.д
(1Н, PCHCHaHb, 3JH,H 3.6, 3JP,H 8.3,
(CH=CH, Ph), 1280 (P=O). Спектр ЯМР 1Н, δ, м.д:
2JH,H 1.3 Гц), 2.03 д.д.д (1Н, PCHCHaHb, 2JP,H 20.6,
0.79 д (3Н, СН3, 3JH,H 6.2 Гц), 1.08 д (3Н, СН3, 3JH,H
3JH,H
6.7, 3JH,H 3.6 Гц), 2.41 д (3H, CH3, 4JP,H
6.2 Гц), 1.50 септет [1Н,СН(СН3)2, 3JH,H 6.2 Гц],
0.9 Гц), 7.42-7.56 м (6Н, 2Ph), 7.73-7.81 м (4Н,
1.61 д.д.д (1Н, PCHCHaHb, 3JH,H 6.7, 3JP,H 5.3, 2JH,H
2Ph). Спектр ЯМР 13С, δ, м.д.: 31.8 д (СН2, 2JP,C
1.2 Гц), 1.94 д.д.д (1Н, PCHCHaHb, 3JH,H 8.0, 3JP,H
4.7 Гц), 35.9 д (СН, 1JP,C 116.1 Гц), 47.3 д (СН3,3JP,C
3.5, 2JH,H 1.2 Гц), 2.08 д.д.д (1Н, РСНCH2, 2JP,C
5.8 Гц), 127.6 д [2Сorto, Ph(а), 2JP,C 11.6 Гц], 127.8
22.1, 3JH,H 6.7, 3JH,H 3.5 Гц), 7.43-7.56 м (6Н, 2Ph),
д [2Сorto, Ph(в), 2JP,C 11.5 Гц], 130.4 д [2Сmeta,
7.74-7.84 м (4Н, 2Ph). Спектр ЯМР 13С, δ, м.д.:
Ph(а), 3JP,C 8.9 Гц], 130.9 д [2Сmeta, Ph(в), JP,C
21.6 (СН3), 21.8 (СН3), 30.3 д (СН2, 2JP,C 4.4 Гц),
8.6 Гц], 131.0 д [2Сpara, Ph(а) и Ph(в), 4JP,C 3.5 Гц],
35.0 д (РСН, 1JP,C 115.4 Гц), 61.3 д [NСН(СН3)2,
131.2 д [Сipso, Ph(а), 1JP,C 102.5 Гц], 133.1 д [Сipso,
3JP,C 5.2 Гц], 127.6 д [2Сorto, Ph(а), 2JP,C 11.6 Гц],
Ph(в), 1JP,C 100.3 Гц]. Спектр ЯМР 31Р, δ, м.д.:
127.7 д [2Сorto, Ph(в), 2JP,C 11.6 Гц], 130.7 д [2Сmeta,
25.3. Найдено, %: С 70.28; Н 5.94; N 5.26; Р 11.85.
Ph(а), 3JP,C 8.7 Гц], 130.95 д [2Сpara, Ph(а) и Ph(в),
С15Н16NOP. Вычислено, %: С 70.04; Н 6.23; N 5.45;
4JP,C 2.5 Гц], 131.0 д [2Сmeta, Ph(в), 3JP,C 8.6 Гц],
Р 12.06.
Сipso не проявились. Спектр ЯМР 31Р, δ, м.д.:
23.7. Найдено, %: С 71.87; Н 7.41; N 5.08; Р 10.65.
E-N-Этил-2-дифенилфосфорилазиридин (3).
С17Н20NOP. Вычислено, %: С 71.58; Н 7.02; N 4.91
Получен аналогично соединению
2 из
0.3 г
Р 10.88.
(0.77 ммоль) фосфиноксида 1, 0.13 г (1.5 ммоль)
хлоргидрата этиламина и 0.12 г (3.0 ммоль) ги-
Е-N-трет-Бутил-2-дифенилфосфорилази-
дроксида натрия в 10 мл ацетонитрила. Выход
ридин (5). Получен аналогично соединению 2
0.19 г (91%), вязкое бесцветное вещество. ИК
из 0.3 г (0.77 ммоль) фосфиноксида 1, 0.11 г
спектр, ν, см-1: 3030 (СН, Ph), 1590 (CH=CH, Ph),
(1.5 ммоль) трет-бутиламина и 0.093 г (2.3 ммоль)
1285 (P=O). Спектр ЯМР 1Н, δ, м.д: 0.96 т (3Н,
гидроксида натрия в 10 мл ацетонитрила при тем-
СН2СН3, 3JH,H 7.1 Гц), 1.58 д.д.д (1Н, PCHCHaHb,
пературе 35-40°С в течение 15 ч. Выход 0.2 г
3JH,H 6.7, 3JP,H 5.5, 2JH,H 1.3 Гц), 1.93 д.д.д (1Н,
(87%), белые кристаллы, т.пл. 127°С. ИК спектр,
PCHCHaHb, 3JH,H 3.4, 3JP,H 8.2, 2JH,H 1.3 Гц), 2.16
ν, см-1: 3030 (СН, Ph), 1590 (CH=CH, Ph), 1280
д.д.д
(1Н, РСНCH2, 2JP,H 22.1, 3JH,H
6.7, 3JH,H
(P=O). Спектр ЯМР 1Н, δ, м.д: 0.82 с [9Н, С(СН3)3],
3.4 Гц), 2.27 уш.д.к [1Н, (NСHaHbСН3), 2JH,H 11.5,
1.73 д.д.д (1Н, PCHCHaHb, 3JH,H 3.1, 3JP,H 7.4, 2JH,H
3JH,H 7.1 Гц], 2.39 д.к [1Н, (NСHaHbСН3), 2JH,H
1.4 Гц), 1.83 д.д.д (1Н, PCHCHaHb, 3JH,H 6.5, 3JP,H
11.5, 3JH,H 7.1 Гц], 7.40-7.54 м (6Н, 2Ph), 7.77-
4.5, 2JH,H 1.4 Гц), 2.33 д.д.д (1Н, РСНCH2, 2JP,C
7.87м (4Н, 2Ph). Спектр ЯМР 13С, δ, м.д.: 14.1
24.0, 3JH,H 6.5, 3JH,H 3.1 Гц), 7.42-7.56 м (6Н, 2Ph),
(NСН2СН3), 30.8 д (СН2, 2JP,C 4.5 Гц), 35.0 д (РСН,
7.71-7.87 м (4Н, 2Ph). Спектр ЯМР 13С, δ, м.д.: 24.1
1JP,C 116.2 Гц), 55.2 д [(NСН2СН3), 3JP,C 5.6 Гц],
д (СН2, 2JP,C 4.8 Гц), 25.8 [С(СН3)3], 28.9 д (РСН,
127.7 д [2Сorto, Ph(а), 2JP,C 11.8 Гц], 127.9 д [2Сorto,
1JP,C 117.4 Гц], 53.0 д [С(СН3)3, 3JP,C 3.9 Гц], 127.5
Ph(в), 2JP,C 11.5 Гц], 130.7 д [2Сmeta, Ph(а), 3JP,C
д [2Сorto, Ph(а), 2JP,C 11.3 Гц], 127.7 д [2Сorto, Ph(в),
9.0 Гц], 131.1 д [2Сmeta, Ph(в), 3JP,C 9.1 Гц], 131.2
2JP,C 11.3 Гц], 130.7 д [2Сmeta, Ph(а), 3JP,C 8.8 Гц],
д [2Сpara, Ph(а) и Ph(в), 4JP,C 2.8 Гц], 131.1 д [Сipso,
130.88 д [Сpara, Ph(а), 4JP,C 3.0 Гц], 130.92 [Сpara,
Ph(а), 1JP,C 102.8 Гц], 132.6 д [Сipso, Ph(в), 1JP,C
Ph(в), 4JP,C 3.2 Гц], 131.1 д [2Сmeta, Ph(в), 3JP,C
101.0 Гц]. Спектр ЯМР 31Р, δ, м.д.: 25.6. Найдено,
8.6 Гц], 131.5 д [Сipso, Ph(а), 1JP,C 100.3 Гц], 132.9
%: С 70.57; Н 6.26; N 5.39; Р 11.19. С16Н18NOP.
д [Сipso, Ph(в), 1JP,C 100.1 Гц]. Спектр ЯМР 31Р, δ,
Вычислено, %: С 70.85; Н 6.64; N 5.17; Р 11.44.
м.д.: 24.9. Найдено, %: С 71.87; Н 7.62; N 4.25; Р
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 11 2023
1516
БИЧАХЧЯН и др.
10.69. С18Н22NOP. Вычислено, %: С 72.24; Н 7.36;
[2Сpara, Ph(а) и Ph(в), 4JP,C 2.7 Гц], 130.9 д [2Сmeta,
N 4.68; Р 10.37.
Ph(в), 3JP,C 8.8 Гц], 131.0 д
[Сipso, Ph(а), 1JP,C
102.4 Гц], 132.9 д [Сipso, Ph(в), 1JP,C 101.0 Гц],
Е-N-Циклогексил-2-дифенилфосфорилази-
137.8 (Сipso, CH2Ph). Спектр ЯМР 31Р, δ, м.д.:
ридин (6). Получен аналогично соединению 2
25.2. Найдено, %: С 75.31; Н 5.86; N 4.01; Р 9.54.
из 0.3 г (0.77 ммоль) фосфиноксида 1, 0.15 г
С21Н20NOP. Вычислено, %: С 75.68; Н 6.01; N 4.20;
(1.5 ммоль) циклогексиламина и 0.093 г (2.3 ммоль)
Р 9.31.
гидроксида натрия в 10 мл ацетонитрила. Выход
0.23 г (92%), белые кристаллы, т.пл. 108-110°С.
Антибактериальную активность фосфинокси-
ИК спектр, ν, см-1: 3030 (СН, Ph), 1585 (CH=CH,
дов 2-7 изучали методом «диффузии в агаре» [16]
Ph), 1280 (P=O). Спектр ЯМР 1Н, δ, м.д: 1.00-1.58
при бактериальной нагрузке 20 млн микробных
м (9Н, С6Н11), 1.61 д.д.д (1Н, PCHCHaHb, 3JH,H 6.7,
тел в 1 мл среды. В опытах использованы грам-
3JP,H 5.4, 2JH,H 1.3 Гц), 1.66-1.81 м (2Н, С6Н11),
положительные микроорганизмы (Staphylococcus
1.92 д.д.д (1Н, PCHCHaHb, 3JH,H 3.5, 3JP,H 8.0, 2JH,H
aureus 209 p., Bacillus subtilis 6633) и грамотрица-
1.3 Гц), 2.06 д.д.д (1Н, РСНCH2, 2JP,H 21.8, 3JH,H
тельные палочки (Shigella flexneri 6858, Esherichia
6.7, 3JH,H 3.5 Гц), 7.43-7.53 м (6Н, 2Ph), 7.73-7.84
coli 0-55). Соединения испытывали в разведении
м (4Н, 2Ph). Спектр ЯМР 13С, δ, м.д.: 23.6, 23.7,
1:20 в ДМСО в объеме 0.1 мл. Учет результатов
25.4, 31.8,
31.9 (CH2, С6Н11), 29.9 д (РСНCH2,
проводили по диаметру (d, мм) зон отсутствия
2JP,C 4.2 Гц), 34.5 д (РСНCH2, 1JP,C 115.8 Гц), 68.7
роста микроорганизмов в месте нанесения соеди-
д (NCH, 3JP,C 5.1 Гц), 127.5 д [2Сorto, Ph(а), 2JP,C
нений после суточного выращивания микроорга-
11.5 Гц], 127.7 д [2Сorto, Ph(в), 2JP,C 11.3 Гц], 130.7
низмов в термостате при 37°С. В качестве поло-
жительного контроля использовали фуразолидон
д [2Сmeta, Ph(а), 3JP,C 9.0 Гц], 130.9 д [2Сpara, Ph(а)
и Ph(в), 4JP,C 2.8 Гц], 131.0 д [2Сmeta, Ph(в), 3JP,C
[17].
8.8 Гц], 131.2 [Сipso, Ph(а), 1JP,C 101.6 Гц], 132.6
Исследования показали, что испытуемые веще-
д [Сipso, Ph(в), 1JP,C 100.5 Гц]. Спектр ЯМР 31Р, δ,
ства 2-7 обладают противомикробными свойства-
м.д.: 23.9. Найдено, %: С 74.03; Н 7.65; N 4.58; Р
ми, при этом в отношении грамположительных
9.17. С20Н24NOP. Вычислено, %: С 73.85; Н 7.38;
штаммов обладают выраженной антибактериаль-
N 4.31; Р 9.54.
ной активностью, подавляя рост микроорганиз-
мов в зоне (d = 17-25 мм), несколько уступающей
Е-N-бензил-2-дифенилфосфорилазиридин
контрольному препарату фуразолидону (d = 24-
(7). Получен аналогично соединению 2 из 0.5 г
25 мм), за исключением соединения 7, проявля-
(1.3 ммоль) фосфиноксида 1, 0.28 г (2.6 ммоль) бен-
ющую равную с контрольным препаратом ак-
зиламина и 0.15 г (3.9 ммоль) гидроксида натрия в
тивность (d = 25 мм). В отношении грамотрица-
15 мл ацетонитрила. Выход 0.3 г (69%), белые кри-
тельного штамма Shig. flexneri 6858 вещества 2-7
сталлы, т.пл. 112°С. ИК спектр, ν, см-1: 3035 (СН,
проявляют умеренную активность (d = 15-16 мм),
Ph), 1590 (CH=CH, Ph), 1285 (P=O). Спектр ЯМР
а в опытах с Esher. coli малоэффективны (d = 11-
1Н, δ, м.д: 1.78 д.д.д (1Н, РСНCHaHb, 3JH,H 6.8,
14 мм).
3JP,H 5.5, 2JH,H 1.1 Гц), 1.96 д.д.д (1Н, PCHCHaHb,
3JH,H 3.6, 3JP,H 8.4, 2JH,H 1.1 Гц), 2.34 д.д.д (1Н,
ИК спектры регистрировали на приборе
РСНCH2, 2JP,H 21.0, 3JH,H 6.8, 3JH,H 3.6 Гц), 3.50 д
Specord UR-75 (изготовленном в Германии) в хло-
(1Н, CH2Ph, 2JH,H 13.1 Гц), 3.55 уш.д (1Н, CH2Ph,
роформе. Спектры ЯМР 1Н, 13С и 31Р регистри-
2JH,H 13.1 Гц), 7.20-7.29 м (5Н, CH2Ph), 7.34-7.42
ровали на спектрометре Varian Mercury-300 (из-
м (4Н, 2Ph), 7.44-7.51 м (2Н, 2Ph), 7.61-7.69 м (4Н,
готовленном в США) [300.077 (1Н), 75.46 (13С) и
2Ph). Спектр ЯМР 13С, δ, м.д.: 30.6 д (СНCH2, 2JP,C
121.47 (31Р) МГц] при 303 K, используя в каче-
4.4 Гц), 34.80 д (СНCH2, 1JP,C 114.6 Гц), 64.2 д
стве растворителя смесь ДМСO-d6-CCl4 (1:3).
(NCH2, 3JP,C 5.3 Гц), 126.5 (Сpara, CH2Ph), 127.5 д
ДМСО-d6 (D, 99.9%) приобретен в изотопной
[2Сorto, Ph(а), 2JP,C 11.7 Гц], 127.6 (2Сorto, CH2Ph),
лаборатории Кембриджского университета. Хи-
127.8 д [2Сorto, Ph(в), 2JP,C 11.6 Гц], 127.9 (2Сmeta,
мические сдвиги приведены относительно ТМС
CH2Ph), 130.4 д [2Сmeta, Ph(а), 3JP,C 9.0 Гц], 130.8 д
(1Н) и 85%-ной Н3РО4 (31Р).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 11 2023
ДОСТУПНЫЙ СПОСОБ СИНТЕЗА
1517
ЗАКЛЮЧЕНИЕ
2.
Kafarski P., B.Lajczak B. Phosphorus, Sulfur,
Silicon, Relat. Elem.
1991,
63,
193-215. doi
В результате взаимодействия
(1,2-дибром-
10.1080/10426509108029443
этил)(дифенил)фосфиноксида
1 с первичными
3.
Allerberger F. J. Antimicrob. Chemother. 1999, 43,
аминами, в частности, метил-, этил-, изопропил-,
211-217. doi 10.1093/jac/43.2.211
трет-бутил-, циклогексил- и бензил-аминами в
4.
Degennaro L., Trinchera P., Luisi R. Chem. Rev. 2014,
присутствии гидроксида натрия при комнатной
114, 7881-7929. doi 10.1021/cr400553c
температуре с высокими выходами получены
5.
Tsuboi I., Hirohisa I., Yoshikawa E., Hiyoshi S., Yama-
Е-N-замещенные-2-дифенилфосфорилазиридины
ji E., Nakayam I., O’Hara K., Nonomiya T., Shigeno-
2-7. Показано, что для повышения выхо-
bu F., Taniguchi K., Shimizu M., Sawai T., Mizuo-
да продукта взаимодействия трет-бутилами-
ka K. Clin. Chim. Acta. 1999, 279, 175-178. doi
на с фосфиноксидом
1
→ Е-N-трет-бутил-2-
10.1016/S0009-8981(98)00168-5
дифенилфосфорилазиридина (5) необходимо наг-
6.
Sakuri H., Okamoto Y., Fukuda M. Пат. Jpn 7912364
ревание реакционной смеси при температуре 35-
(1979). Яп. C.A. 1979, 91, 20707.
40°С в течение 15 ч.
7.
Patel D.V., Rielly-Gauvin K., Ryono D.E. Tetrahedron
ИНФОРМАЦИЯ ОБ АВТОРАХ
Lett.
1990,
31,
5587-5590. doi
10.1016/S0040-
4039(00)97903-6
Бичахчян Арпеник Сейрановна, ORCID: https://
8.
Bader A. Aldrichim. Acta. 1988, 21, 15.
orcid.org/0000-0002-6883-3469
9.
Zygmunt J. Tetrahedron. 1985, 41, 4979-4982. doi
Дердзян Лиана Ваниковна, ORCID: https://
10.1016/S0040-4020(01)96741-9
orcid.org/0000-0002-9937-8120
10.
Tanner D. Angew. Chem. Int. Ed. 1994, 33, 599-619.
doi 10.1002/anie.199405991
Погосян Артавазд Сережаевич, ORCID: https://
orcid.org/0000-0002-6838-2573
11.
Palacios F., Ochoa de Retana A.M., Gil J.I., Ezpele-
ta J.M. J. Org. Chem. 2000, 65, 3213-3217. doi
Паносян Генрик Агавардович, ОRCID: https://
10.1021/jo9915426
orcid.org/0000-0001-8311-6276
12.
Palacios F., Ochoa de Retana A.M., Gil J.I. Tetrahedron
Степанян Грачия Мовсесович, ORCID: https://
Lett.
2000,
41,
5363-5366. doi
10.1016/S0040-
orcid.org/0000-0002-8677-401X
4039(00)00843-1
13.
Kowalik J., Zygmunt J., Mastalerz P. Phosphorus,
Аракелян Асмик Генриковна ORCID: https://
Sulfur, Silicon Relat. Elem. 1983, 18, 393-396. doi
orcid.org/0000-0001-7437-0790
10.1080/03086648308076048
Мурадян Рафаэль Егиазарович, ORCID: https://
14.
Moonen K., Laureyn I., Stevens C.V. Chem. Rev. 2004,
orcid.org/0000-0002-4110-9454
104, 6177-6215. doi 10.1021/cr030451c
15.
Овакимян М.Ж., Гаспарян Г.Ц., Погосян А.С., Би-
Гаспарян Гаяне Цатиковна, ORCID: https://
чахчян А.С., Дердзян Л.В. ЖОрХ. 2020, 56, 112-117.
orcid.org/0000-0002-2779-2728
[Ovakimyan M.Zh., Gasparyan G.Ts., Poghosyan A.S.,
КОНФЛИКТ ИНТЕРЕСОВ
Bichakhchyan A.S., Derdzyan L.V. Russ. J. Org. Chem.
2020, 56, 90-94.] doi 10.31857/S0514749220010152
Авторы заявляют об отсутствии конфликта ин-
16.
Руководство по проведению доклинических иссле-
тересов.
дований лекарственных средств. Ред. А.Н. Миро-
СПИСОК ЛИТЕРАТУРЫ
нов. М: Гриф и К, 2012.
1. Rajski Scott R. and Williams Robert M. Chem. Rev.
17.
Машковский М.Д. Лекарственные средства. М.:
1998, 98, 2723-2796. doi 10.1021/cr9800199
Новая волна, 2010.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 11 2023
1518
БИЧАХЧЯН и др.
Available Method for the Synthesis
of E-N-Substituted-2-diphenylphosphorylaziridines
A. S. Bichakhchyana, *, L. V. Derdzyana, A. S. Poghosyana, H. A. Panosyanb, A. G. Arakelyana,
H. M. Stepanyana, R. E. Muradyana, and G. Ts. Gasparyana
a Institute of Organic Chemistry, Scientific Technological Centre of Organic and Pharmaceutical Chemistry,
National Academy of Sciences of the Republic of Armenia, prosp. Azatutyana, 26, Yerevan, 0014 Armenia
b Molecule Structure Research Center NAS RA, prosp. Azatutyana, 26, Yerevan, 0014 Armenia
*e-mail: arpenikb@mail.ru
Received November 28, 2022; revised December 10, 2022; accepted December 11, 2022
An available method for the synthesis of 2-diphenylphosphoryl-N-substituted aziridines with high yields has
been developed by the interaction of (1,2-dibromoethyl)(diphenyl)phosphine oxide with a number of primary
amines, in particular, methyl-, ethyl-, isopropyl-, tert-butyl-, cyclohexyl- and benzylamines at room temperature
in the presence of sodium hydroxide. The antibacterial activity of obtained compounds was studied.
Keywords: (1,2-dibromoethyl)(diphenyl)phosphine oxide, nucleophilic addition, primary amines, nucleophilic
substitution, E-N-substituted-2-diphenylphosphorylaziridines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 11 2023