ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 2, с. 197-210
УДК 547.812 + 547.814.1 + 548.737
МНОГОКОМПОНЕНТНЫЙ СИНТЕЗ
ФУНКЦИОНАЛИЗИРОВАННЫХ
2-АМИНО-4Н-ПИРАНОВ, ИНИЦИИРУЕМЫЙ
РЕАКЦИЕЙ КНЁВЕНАГЕЛЯ
© 2023 г. И. В. Дяченкоa, В. Д. Дяченкоa, П. В. Дороватовскийb,
В. Н. Хрусталевc, d, В. Г. Ненайденкоe, *
a Луганский государственный педагогический университет, Украина, 91011 Луганск, ул. Оборонная, 2
b Национальный исследовательский центр «Курчатовский институт»,
Россия, 123182 Москва, ул. Академика Курчатова, 1
c ФГАОУ ВО «Российский университет дружбы народов», Россия, 117198 Москва, ул. Миклухо-Маклая, 6
d ФГБУН Институт органической химии им. Н.Д. Зелинского, Россия, 119991 Москва, Ленинский просп., 47
e ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
Россия, 119991 Москва, Ленинские горы, 1
*e-mail: nenajdenko@gmail.com
Поступила в редакцию 23.03.2022 г.
После доработки 10.04.2022 г.
Принята к публикации 12.04.2022 г.
Изучена многокомпонентная конденсация альдегидов, производных малононитрила, 1,3-дикарбонильных
соединений карбо- и гетероциклического ряда и алкилгалогенидов. Превращение инициируется реакцией
Кнёвенагеля и приводит к образованию функционально замещенных конденсированных 2-амино-4Н-пи-
ранов. Строение ряда продуктов изучено методом РСА.
Ключевые слова: многокомпонентная реакция, реакция Кнёвенагеля, CH-кислота, 4Н-пиран, рентге-
ноструктурный анализ
DOI: 10.31857/S0514749223020052, EDN: QJMTKO
ВВЕДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Многие производные
2-амино-4Н-пиранов
Мы обнаружили, что при взаимодействии бен-
проявляют широкий спектр биологической актив-
зальдегида 1a с о-метоксицианоацетанилидом 2a и
димедоном 3 в ДМФА при 20°C в присутствии мор-
ности, например, противораковую [1-3], противо-
фолина образуется 2-амино-7,7-диметил-N-(o-ме-
микробную [4-6], моллюскоцидную [7], антиок-
токсифенил)-5-оксо-4-фенил-5,6,7,8-тетрагидро-
сидантную [8, 9], антибактериальную [10, 11] и
4H-хромен-3-карбоксамид (4). Вероятный марш-
ингибирующую ферменты активность [12-14]. С
рут конденсации включает на первой стадии обра-
учетом высокой практической значимости гетеро-
зование соответствующего интермедиата реакции
циклов данного класса для создания лекарствен-
Кнёвенагеля - замещенного акрилонитрила A.
ных препаратов и в продолжение работ в данном
Затем реализуется реакция Михаэля - присоеди-
направлении [15-19] нами разработаны новые
нение димедона 3 к активированному алкену A.
варианты многокомпонентных реакций конденса-
Следующая затем внутримолекулярная циклиза-
ции, протекающих в мягких условиях с использо-
ция аддукта B приводит к образованию конечного
ванием доступных реагентов.
продукта 4 (схема 1).
197
198
ДЯЧЕНКО и др.
Схема 1
Z
O
Ph
O
O
R1
CN
Me
N
Z
N
2a-e
H
O
Me
3
H
R1CHO
Me
OMe
DMF, 20°C
CN
OH
1a-f
Me
N
O
A
B
2
R
HN
Br
O
S
N
O
H
5a, b
9
1
O Ph
O
R
R2
O
Z
R1
N
NH2
N
HN
H
Me
O
OMe
S
O
NH2
S
N
O
Me
H
N
CN
D
C
4, 72%
OH
3
O O
7
Me
NH
2
Ph
O R1
O
Z
MeO
HN
PhO
S
N
O
NH
O
N
O
N
E
S
S
1. R3Hlg
Me
O NH2
10a
O NH2
Me
2. Ac2O, t
Ɇɟɬɨɞ ɚ
10a, b
8, 78%
6, 81%
F
10b-d
O
O
R1
OR4
R1
COOEt
10b
HN
Z
Z
HN
N
Ɇɟɬɨɞ b
S
N
O NH
R3S
N
O NH2
R3S
N
O NH2
11, 69%
O
12a-f, 70-82%
13a-d, 75-83%
1, R1 = Ph (a), 3-PhOC6H4 (b), 3-MeOC6H4 (c), 3-FC6H4 (d), 4-ClC6H4 (e), CH(Me)2 (f);
2, Z = 2-MeOC6H4NHCO (a), NH2C=S (b), COOEt (c), CN (d), COO(CH2)6Me (e); 5, R2 = 4-PhC6H4 (a),
4-MeC6H4 (b); 10, R3 ɋ+2ɋŁ&+ +OJ
%U a); R3 = CH2CH=CH2, Hlg = Br (b); R3 = Et, Hlg = I (c);
R3 = PhCH2, Hlg = Cl (d); 12, R1 = Ph, R3 = CH2CH=CH2, Z = CN (a); R1 = Ph, R3 = CH2CH=CH2,
Z = COOEt (b); R1 = Ph, R3 = CH2CH=CH2, Z = COO(CH2)6Me (c); R1 = 4-ClC6H4, R3 = CH2CH=CH2,
Z = CN (d); R1 = 4-ClC6H4, R3 = CH2CH=CH2, Z = COOEt (e); R1 = Ph, R3 ɋ+2ɋŁ&+ = &1 f);
13, R1 = Ph, R3 = R4 = CH2CH=CH2, Z = COOEt (a); R1 = CH(Me)2, R3 = R4 = PhCH2, Z = CN (b); R1 =
CH(Me)2, R3 = PhCH2, R4 = CH2CH=CH2, Z = CN (c); R1 = Ph, R3 = CH2CH=CH2, R4 = Et, Z = COOEt (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
МНОГОКОМПОНЕНТНЫЙ СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ 2-АМИНО-4Н-ПИР
АНОВ
199
Четырехкомпонентная реакция конденсации
единений 13a, d по методу а замещенные пирано-
м-феноксибензальдегида
1b, цианотиоацетами-
пиримидины 13а, d получены и непосредственно
да 2b, ω-фенацилбромида 5b и димедона 3, реали-
при алкилировании производных 12b аллилбро-
зующаяся в ДМФА при 20°С в присутствии триэти-
мидом 10b и этилйодидом 1c (метод b).
ламина, завершается синтезом 2-амино-7,7-диме-
Спектральные характеристики подтвержда-
тил-4-(3-феноксифенил)-3-{4-([1,1'-бифенил]-4-
ют строение синтезированных соединений. В ИК
ил)тиазол-2-ил}-7,8-дигидро-4Н-хромен-5(6Н)-
спектрах наблюдаются характеристические поло-
она (6). По-видимому, сначала образуется соот-
сы поглощения валентных колебаний амино-, ци-
ветствующий алкен Кнёвенагеля A, из которого
ано- и карбонильной групп. В спектрах ЯМР 13С
далее по Ганчу образует замещенный тиазол C.
проявляются сигналы всех атомов углерода их мо-
К последнему по Михаэлю присоединяется СН-
лекул в соответствующих областях δ. В спектрах
кислота 3. Возникший таким путем соответству-
ЯМР 1Н, помимо сигналов протонов заместителей
ющий аддукт типа B внутримолекулярно цикли-
с характерным расщеплением, присутствуют сиг-
зуется в конденсированный 2-амино-4H-пиран 6
налы протонов аминогруппы в виде уширенного
(схема 1). Вовлечение в данную конденсацию
синглета при δ 7.03-7.94 м.д. и сигнал Н4 - про-
м-метоксибензальдегида 1c вместо соединения 1b
тона пиранового ядра при δ 4.32-4.80 м.д., что ха-
и 4-гидроксикумарина 7 вместо димедона 3 при
рактерно для вышеприведённых систем [28-31].
прочих равных условиях принципиально не из-
Кроме того, магнитная неэквивалентность прото-
менило направление реакции, давая соединение 8
нов метильных групп и фрагмента OCH2 в соеди-
(схема 1) - перспективный полупродукт для созда-
нении 13b является следствием отсутствия сво-
ния биологически активных соединений широкого
бодного вращения этих групп. Для установления
спектра действия [20-25].
направления самосборки молекул в рассмотрен-
ных многокомпонентных конденсациях строение
Пятикомпонентная конденсация м-фторбен-
соединений 6 и 8 изучено методом рентгенострук-
зальдегида 1d, цианоуксусного эфира 2c, тиобар-
битуровой кислоты 9, пропаргилбромида 10a и
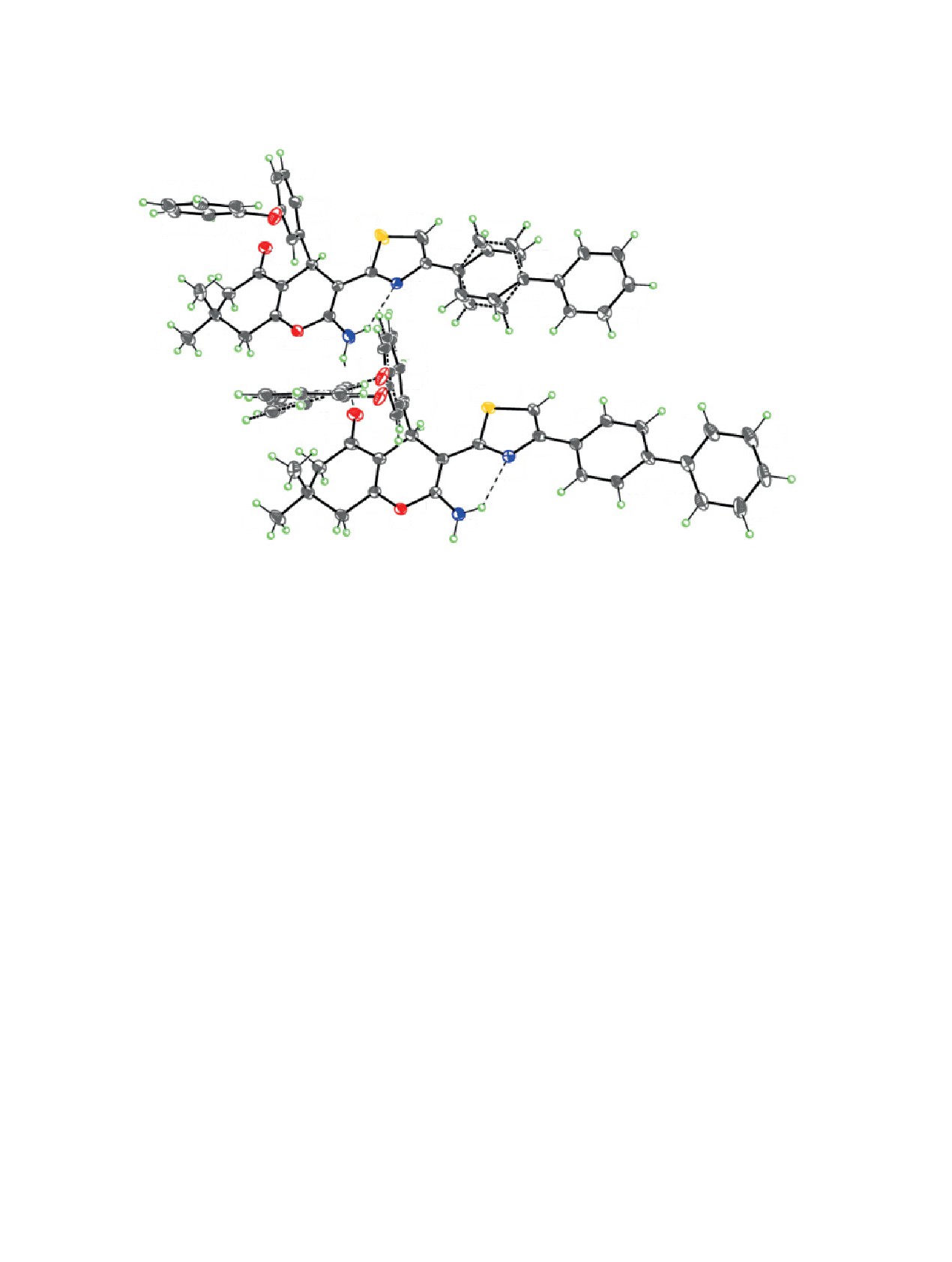
турного анализа (РСА). Строение соединения 6 и
соответствующая нумерация атомов представлены
уксусного ангидрида, протекающая в ДМФА при
на рис. 1.
20°C в присутствии эквимолярного количества
морфолина, заканчивается образованием этил-7-
Соединение 6 кристаллизуется в триклинной
ацетамидо-4-оксо-2-(проп-2-ин-1-илтио)-4,5-ди-
пространственной группе P-1 с двумя кристалло-
гидро-3H-пирано[2,3-d]пиримидин-6-карбокси-
графически независимыми молекулами A и B в
лата (11) (схема 1). Вероятный механизм данного
элементарной ячейке. Молекулы A и B представ-
взаимодействия включает первоначальное про-
ляют разные конформеры, различающиеся в кон-
текание конденсации Кнёвенагеля, затем следует
формациях бифенильного и фенилфеноксильного
присоединение СН-кислоты 9 по Михаэлю к алке-
фрагментов. Так, углы скручивания бифениль-
ну А, после чего соответствующий солеобразный
ных заместителей в молекулах A и B составляют
аддукт D региоселективно алкилируется пропар-
31.8(2)° и 18.6(4)°/17.5(4)°, соответственно, а углы
гилбромидом 10a с последующим замыканием пи-
между плоскостями бензольных циклов в фенил-
ранового цикла. Дальнейшее ацилирование ими-
феноксильных заместителях молекул A и B равны
ногруппы в интермедиате E при кипячении в
82.66(13)°/83.4(2)° и 77.63(11)°, соответственно.
Ac2O завершает данную домино-реакцию [26,
Центральные 3-(тиазол-2-ил)-7,8-дигидро-4H-хро-
27]. Использование различных альдегидов 1, СН-
мен-5(6Н)-оновые фрагменты молекул A и B име-
кислот 2 и алкилирующих реагентов 10 позволяет
ют подобное строение. γ-Пирановый цикл прини-
получить по нижеприведенной схеме производ-
мает конформацию уплощенной ванны с углом пе-
ные 12a-f, дальнейшее алкилирование которых
региба по линии O1∙∙∙C6/O4∙∙∙C44 15.6(3)°/14.5(3)°,
алкилгалогенидами 10 в ДМФА при 20°С при
соответственно, а циклогексеноновый цикл - кон-
использовании эквимолярного водного раствора
формацию софы с выходом четвертичного атома
КОН дает эфиры 13a-d (метод а) (схема 1). Для
углерода из плоскости, проведенной через осталь-
подтверждения предложенной схемы синтеза со-
ные атомы цикла (среднеквадратичные отклоне-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
200
ДЯЧЕНКО и др.
C55
C54
C60 C61
C62
C53
C56
C51
S2
C41
C59
C67'
C58C57
O6
C66'
O5
C44
C72
C52
C65
C67
C73
C46
C39
C43
C66
C47
C40
C69
C71
C45
C70
C64
C68
N3
C74
C69' C76
C49
C70'
C75
C17
C48
C50
C42
C63
C17'
O4
N4
C16'
C16
C18'
C24'
21
O3'
C18
C
19
C19'
C23C
15
C
C13
S1
C3
C24
C28
O3
C13'
14
C34
C21'C20
O2
C
C27
C29
C6
C1
C35
C8
C7
C4
C9
C33
C2
C36
C26
N1
C32
C30
C31
C38
10
C12
C4
C37
C
C25
C11
O1
N2
Рис. 1. Молекулярная структура соединения 6 в представлении атомов эллипсоидами анизотропных смещений с 40%-ной
вероятностью. Показаны 2 кристаллографически независимые молекулы. Разупорядоченные фрагменты показаны толсты-
ми штриховыми линиями, внутри- и межмолекулярные водородные связи - тонкими штриховыми линиями
ния атомов равны 0.018 и 0.014 Å), на 0.666(6)/
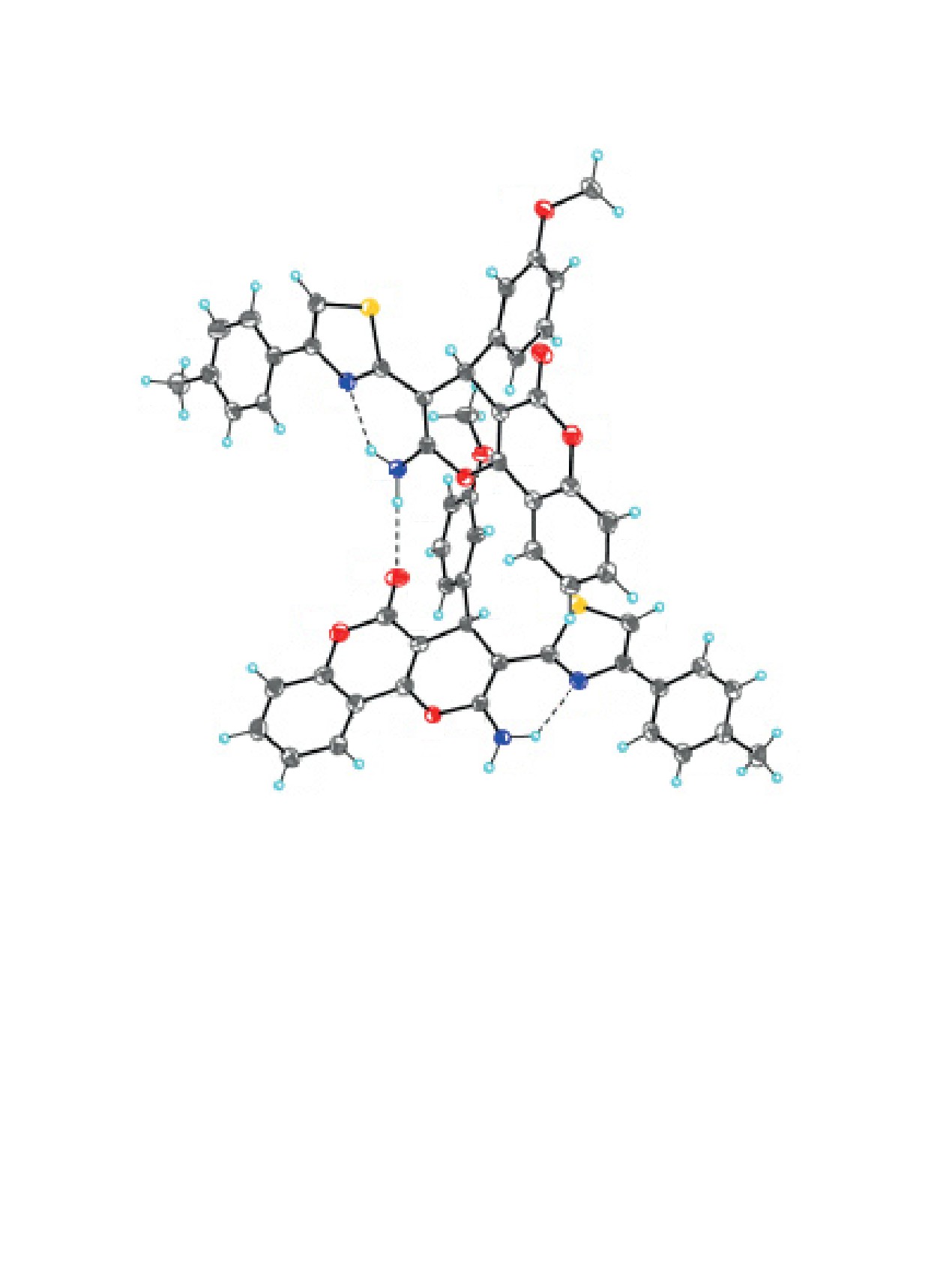
Строение соединения 8 и соответствующая ну-
0.668(6) Å, соответственно. Вследствие наличия
мерация атомов представлены на рис. 4. Так же,
прочной внутримолекулярной водородной связи
как и соединение 6, соединение 8 кристаллизует-
N-H∙∙∙N (табл. 1, рис. 1), тиазольный цикл прак-
ся в триклинной пространственной группе P-1 с
тически компланарен базальной плоскости γ-пи-
двумя кристаллографически независимыми моле-
ранового цикла (соответствующие межплоскост-
кулами A и B в элементарной ячейке. Молекулы
ные углы равны 14.4(3)° и 3.8(4)°. Атомы азота
A и B представляют разные конформеры, разли-
аминогрупп имеют слегка пирамидализованную
чающиеся в основном в конформациях 4-(п-то-
конфигурацию [суммы валентных углов равны
лил)тиазол-2-ильного (углы между плоскостя-
353(10)°/359(12)°], которая определяется присут-
ми тиазольного и бензольного циклов равны
22.53(4)° и 12.91(10)°, соответственно) и метокси-
ствием в кристалле разветвленной системы во-
дородных связей и невалентных взаимодействий.
фенильного [торсионные углы C24-C23-O23-C27 и
C51-C50-O50-C54 равны -31.8(3)° и 15.2(3)°, соот-
Молекула соединения
6 содержит асимметри-
ветственно] фрагментов.
ческий центр при атоме углерода в положении 4
7,8-дигидро-4H-хромен-5(6Н)-онового бицикла.
Центральные трициклические фрагменты мо-
Кристалл соединения
6 представляет рацемат.
лекул A и B имеют подобное строение. γ-Пирано-
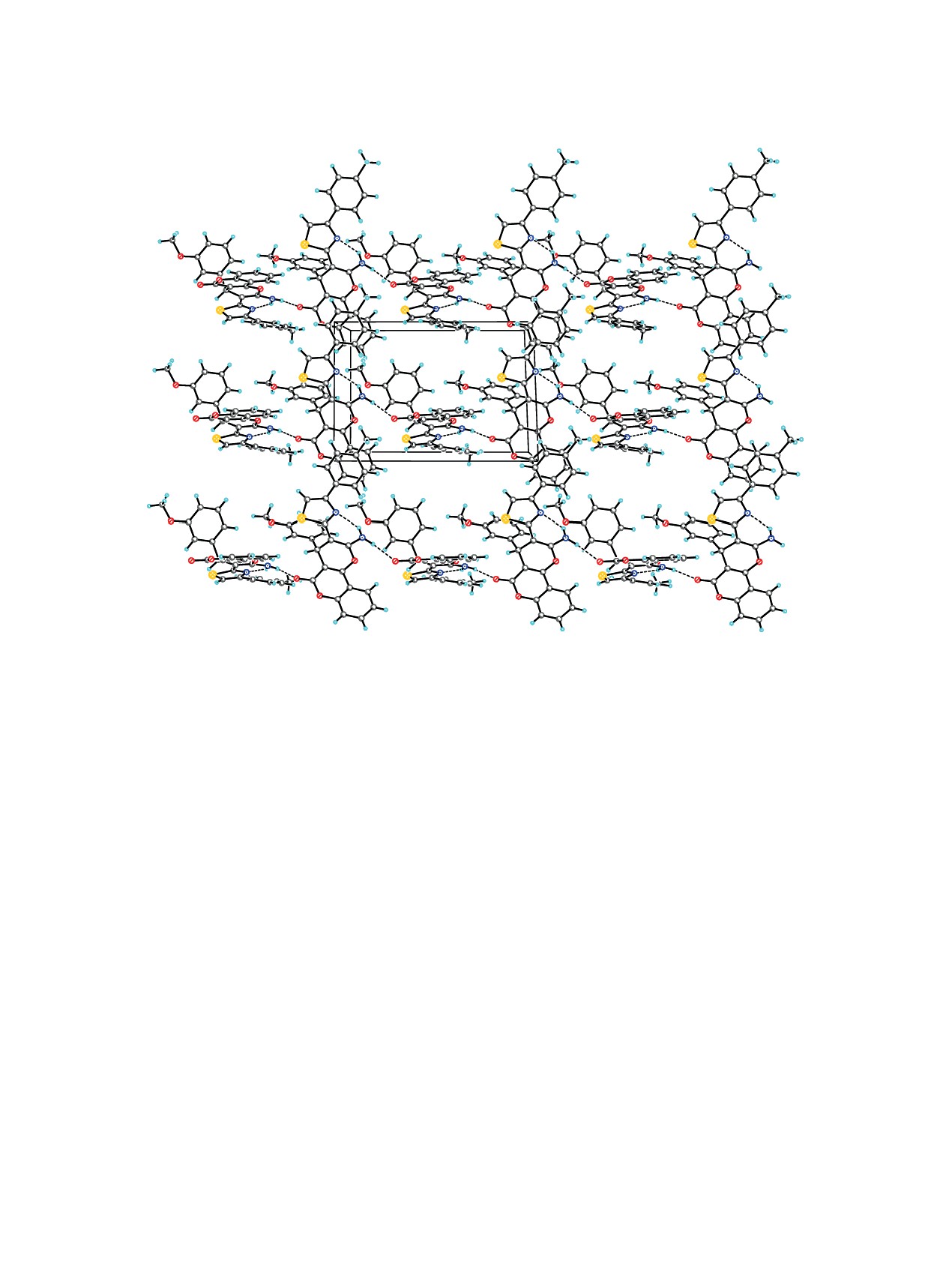
В кристалле молекулы соединения 6 образуют
вый цикл принимает конформацию существенно
H-связанные цепочки в направлении кристалло-
уплощенной ванны с углом перегиба по линии
графической оси c за счет прочных межмолекуляр-
O1∙∙∙C4/O28∙∙∙C31
15.06(5)°/11.78(16)°, соответст-
ных водородных связей N-H∙∙∙O (табл. 1, рис. 2).
венно, а циклогексадиеноновый цикл - плоский
Далее цепочки связаны в гофрированные слои,
(среднеквадратичные отклонения атомов равны
параллельные плоскости
(1
¯ 0), посредством
0.009 и 0.019 Å). Вследствие прочной внутримо-
слабых межмолекулярных водородных связей C-
лекулярной водородной связи N-H∙∙∙N (табл. 1,
H∙∙∙O (табл. 1) и невалентных взаимодействий S∙∙∙S
рис. 1) тиазольный цикл практически компланарен
(рис. 3).
базальной плоскости γ-пиранового цикла, соответ-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
МНОГОКОМПОНЕНТНЫЙ СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ 2-АМИНО-4Н-ПИР
АНОВ
201
Таблица 1. Водородные связи в структурах соединений 6 и 8
D-H∙∙∙A
d(D-H), Å
d(H∙∙∙A), Å
d(D∙∙∙A), Å
Угол (DHA), град
Соединение 6
N2-H2A∙∙∙O5a
0.88(5)
2.45(5)
3.243(4)
150(4)
N2-H2B∙∙∙N1
0.86(5)
2.17(5)
2.814(5)
132(4)
C24-H24A∙∙∙O6b
0.95
2.46
3.290(4)
146
N4-H4A∙∙∙O2
0.87(5)
2.39(5)
3.172(5)
150(5)
N4-H4B∙∙∙N3
0.79(5)
2.18(6)
2.801(5)
136(5)
C62-H62∙∙∙O3b
0.95
2.35
3.201(5)
148
Соединение 8
N2-H2B∙∙∙O32
0.90(3)
2.08(3)
2.976(2)
170(2)
N2-H2A∙∙∙N11
0.92(3)
2.00(2)
2.726(2)
135(2)
N29-H29A∙∙∙N38
0.94(3)
2.02(2)
2.727(2)
130.5(19)
N29-H29B∙∙∙O5c
0.93(2)
2.08(3)
3.009(2)
174(2)
a Кристаллографические операции для генерации симметрически эквивалентных атомов: x, y, z+1
b Кристаллографические операции для генерации симметрически эквивалентных атомов: -x, -y+1, -z+1
c Кристаллографические операции для генерации симметрически эквивалентных атомов: x, y+1, z
ствующие межплоскостные углы равны 10.19(3)°
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
и 8.21(10)°. Атомы азота аминогрупп имеют слег-
Параметры элементарной ячейки и интенсив-
ка пирамидализованную конфигурацию [суммы
ности отражений для кристалла соединения
6
валентных углов равны 354(5)°/354(5)°], которая
измерены на дифрактометре Bruker D8 QUEST
определяется присутствием в кристалле развет-
PHOTON-III CCD [T = 100 K, λ(MoKα) = 0.71073 Å,
вленной системы водородных связей. Молекула
соединения 8 содержит асимметрический центр
при атоме углерода в положении 4 пирано[3,2-c]-
хромен-5(4Н)-онового трицикла. Кристалл соеди-
нения 8 представляет собой рацемат. В кристалле
молекулы соединения 8 образуют H-связанные це-
почки в направлении кристаллографической оси
c
b за счет прочных межмолекулярных водородных
0
b
связей N-H∙∙∙O (табл. 1, рис. 5). Цепочки располо-
жены на ван-дер-ваальсовых расстояниях.
a
Рис. 3. Кристаллическая структура соединения 6, де-
Рис.
2.
H-Связанные цепочки соединения
6.
монстрирующая гофрированные слои, параллельные
Штриховыми линиями показаны водородные связи N-
плоскости (1 1¯ 0). Штриховыми линиями показаны
H∙∙∙O и N-H∙∙∙N, пунктирными линиями - невалент-
водородные связи N-H∙∙∙O, N-H∙∙∙N и C-H∙∙∙O и нева-
ные взаимодействия S∙∙∙S
лентные взаимодействия S∙∙∙S
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
202
ДЯЧЕНКО и др.
C27
O23
C23
C13
C24
C22
S1
C19
C21
C25
C18
C14
11
C4
C
O5
C12
C26
C3
C5
C17
C15
C54
N11
C20
C16
C4A
O6
O60
C10B
C2
N2
O1
C6A
C51
C50
C10A
C52
C7
C49
O32
C8
C10
C53
C48
C9
C32
S2
O33
C31
C40
C30C38
C31A
C33A
C41
C46
C37B
C39
C34
N38
C45
C37A
C35
C42
C29
C44
O28
C37
N
29
C47
C43
C36
Рис. 4. Молекулярная структура соединения 8 в представлении атомов эллипсоидами анизотропных смещений с 40%-
ной вероятностью. Показаны 2 кристаллографически независимые молекулы. Штриховыми линиями показаны внутри- и
межмолекулярные водородные связи
графитовый монохроматор, φ- и ω-сканирование].
помощью программы iMOSFLM, входящей в ком-
Обработка экспериментальных данных проведена
плекс программ CCP4 [34]. Для полученных дан-
с помощью программы SAINT [32]. Для получен-
ных проведен учет поглощения рентгеновского
ных данных проведен учет поглощения рентге-
излучения по программе Scala [35]. Основные кри-
новского излучения по программе SADABS [33].
сталлоструктурные характеристики и параметры
Параметры элементарной ячейки и интенсивности
уточнения структуры соединений представлены в
отражений для кристалла соединения 8 измерены
табл. 2. Структуры определены прямым методом и
на синхротронной станции «РСА» Национального
уточнены полноматричным методом наименьших
исследовательского центра
«Курчатовский ин-
квадратов по F2 в анизотропном приближении для
ститут» с использованием двухкоординатного
неводородных атомов. Фенильный цикл в одной
детектора Rayonix SX165 CCD (T = 100 K, λ =
из 2 кристаллографически независимых молекул
0.78790 Å, φ-сканирование с шагом 1.0°). Обра-
соединения 6 и фенилфеноксильный заместитель
ботка экспериментальных данных проведена с
в другой разупорядочены по 2 положениям с за-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
МНОГОКОМПОНЕНТНЫЙ СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ 2-АМИНО-4Н-ПИР
АНОВ
203
c
b
0
a
Рис. 5. Кристаллическая структура соединения 8, демонстрирующая H-связанные цепочки в направлении кристаллогра-
фической оси b. Штриховыми линиями показаны водородные связи N-H∙∙∙O и N-H∙∙∙N
селенностями 0.65:0.35 и 0.60:0.40, соответствен-
(399.97 и 100 МГц соответственно) в растворах
но. Атомы водорода аминогрупп в соединениях 6
ДМСО-d6, внутренний стандарт - TMC, для со-
и 8 выявлены объективно в разностных Фурье-
единений 4 и 6 - в растворах CDCl3. Масс-спектры
синтезах и уточнены изотропно с фиксированны-
соединений 8, 12с, e, f, 13a-d снимали на спек-
ми параметрами смещения [Uизо(H) = 1.2Uэкв(N)].
трометре Agilent 1100 Series с селективным де-
Положения остальных атомов водорода в обоих
тектором Agilent LS/MSDLS (образцы вводили
соединениях рассчитаны геометрически и включе-
в матрице CH3COOH, ионизация ЭУ, 70 эВ). Для
остальных соединений масс-спектры получали на
ны в уточнение с фиксированными позиционными
масс-спектрометре высокого разрешения Orbitrap
параметрами (модель «наездника») и изотропны-
Elite. Образец для HRMS растворяли в 1 мл ДМСО,
ми параметрами смещения [Uизо(H) = 1.5Uэкв(C)
разбавляли в 100 раз 1%-ной HCOOH в CH3CN,
для CH3-групп и 1.2Uэкв(C) для остальных групп].
вводили шприцевым насосом со скоростью
Все расчеты проведены с использованием ком-
40 мкл/мин в источник ионизации электрораспы-
плекса программ SHELXTL [36]. Таблицы коорди-
лением. Потоки газов источника были отключены,
нат атомов, длин связей, валентных и торсионных
напряжение на игле составляло 3.5 кВ, температу-
углов и анизотропных параметров смещения для
ра капилляра 275°С. Масс-спектр регистрировали
соединений 6 и 8 депонированы в Кембриджском
в режимах положительных и отрицательных ионов
банке структурных данных, номера депонирова-
в орбитальной ловушке с разрешением 480000.
ния - CCDC 2160323 (6) и CCDC 2160324 (8).
Внутренние калибранты - ион 2ДМСО+Н+ (m/z
ИK спектры получали на приборе Varian Vertex
157.03515) в положительных ионах и додецилсуль-
70 в таблетках KBr. Спектры ЯМР 1H и 13C реги-
фат-анион (m/z 265.14789) в отрицательных ионах.
стрировали на спектрофотометре Varian VXR-400
Элементный анализ осуществляли на приборе
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
204
ДЯЧЕНКО и др.
Таблица 2. Кристаллографические данные, параметры эксперимента и уточнения структуры соединений 6 и 8
Соединение
Характеристика
6
8
Брутто-формула
C38H32N2O3S
C29H22N2O4S
Молекулярная масса
596.72
494.55
Размеры монокристалла, мм
0.20×0.20×0.24
0.06×0.08×0.12
Сингония
Триклинная
Триклинная
Пространственная группа
P-1
P-1
a, Å
11.3466(7)
10.7065(15)
b, Å
16.3571(10)
14.9768(8)
c, Å
18.1173(11)
15.2109(14)
α, град
110.387(2)
88.730(6)
β, град
94.213(2)
74.210(10)
γ, град
106.243(2)
88.506(14)
V, Å3
2971.0(3)
2345.9(4)
Z
4
4
dc, г·см-3
1.334
1.400
F(000)
1256
1032
μ, мм-
0.152
0.230
2имакс, град
2.19-27.52
1.51-30.77
Измеренных отражений
36316
46577
Независимых отражений, Rint
13493, 0.061
10477, 0.034
Отражений с I > 2σ(I)
8875
8707
Число уточняемых параметров
782
666
R1 [I > 2σ(I)]
0.103
0.049
wR2 (все отражения)
0.215
0.145
GOF по F2
1.034
1.041
Tмин; Tмакс
0.959; 0.963
0.960; 0.975
Коэффициент экстинкции
-
0.0157(15)
Δρмакс; Δρмин, eÅ-3
0.660; -0.613
0.615; -0.395
Perkin Elmer CHN-analyser. Температуру плавле-
Страна-производитель приборов - США, а ре-
ния определяли на блоке Кофлера. Ход реакции и
активов (Aldrich) - США.
чистоту полученных соединений контролирова-
2-Амино-7,7-диметил-N-(о-метоксифенил)-5-
ли методом ТСХ на пластинках Silufol UV-254 в
оксо-4-фенил-5,6,7,8-тетрагидро-4H-хромен-3-
системе ацетон-гексан (3:5), проявление парами
карбоксамид (4). К перемешиваемому раствору
йода и УФ-облучением.
1 мл (10 ммоль) бензальдегида 1a в 15 мл ДМФА
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
МНОГОКОМПОНЕНТНЫЙ СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ 2-АМИНО-4Н-ПИР
АНОВ
205
при 20°C прибавляли 1.9 г (10 ммоль) о-метокси-
J 8.4 Гц), 7.44 т (2Hаром, J 7.8 Гц), 7.64-7.75 м
цианоацетанилида 2a и 1 каплю морфолина, пере-
(5Hаром), 7.95 д (2Hаром, J 8.4 Гц), 8.02 уш.с (2H,
мешивали 2 ч и прибавляли 1.4 г (10 ммоль) диме-
NH2). Спектр ЯМР 13С, δ, м.д.: 26.2, 28.8, 31.9
дона 3, после чего перемешивали 6 ч и оставляли.
(2С), 37.1, 50.2, 81.5, 108.8, 114.6,
118.4
(2С),
Через 24 ч реакционную смесь разбавляли равным
118.8, 119.2, 123.3, 123.4, 126.5 (3С), 126.6 (2С),
объемом воды и отфильтровывали образовавший-
127.1, 129.0 (3С), 130.0 (3С), 133.2, 139.5, 139.6,
ся осадок. Промывали водой, этанолом и гекса-
146.6, 152.2, 152.6, 156.1, 156.6, 162.0, 168.2, 195.8.
ном. Выход 3.0 г (72%), желтый порошок, т.пл.
Масс-спектр (HRMS, ESI), m/z: 597.2223 [M + H]+.
148-150°C (BuOH), при УФ-облучении флуорес-
C38H32N2O3S. M + H: 597.2134.
цирует. ИК спектр, ν, см-1: 3415, 3342, 3244 (NH,
2-Амино-4-(3-метоксифенил)-3-[4-(п-толил)-
NH2), 1718 (C=O), 1672 (CONH), 1645 (δNH2).
тиазол-2-ил]пирано[3,2-c]хромен-5(4Н)-он
(8)
Спектр ЯМР 1Н, δ, м.д.: 0.80 с (3H, Me), 1.01 с (3H,
получали аналогично соединению 6 при соот-
Me), 2.04 д (1H, H8, 2J 16.2 Гц), 2.25 д (1H, H8, 2J
ветствующем использовании 1.22 мл (10 ммоль)
16.2 Гц), 2.41 д (1H, H6, 2J 17.5 Гц), 2.54 д (1H,
альдегида 1с, 2.13 г (10 ммоль) α-бромкетона 5b и
H6, 2J 17.5 Гц), 3.80 с (3H, MeО), 4.53 с (1Н, H4),
1.62 г (10 ммоль) СН-кислоты 7. Выход 3.9 г (78%),
6.81 т (1Hаром, J 6.1 Гц), 6.83-6.99 м (2Hаром), 7.15
желтые кристаллы, т.пл.
213-215°C (i-BuOH).
т (1Hаром, J 6.5 Гц), 7.25-7.36 м (4Hаром), 7.80 уш.с
ИК спектр, ν, см-1: 3470, 3325, 3200 (NH2), 1712
(1H, CONH), 7.95 уш.с (2H, NH2), 8.15 д (1Hаром, J
(C=O), 1647 (δNH2). Спектр ЯМР 1Н, δ, м.д.: 2.27
7.8 Гц). Спектр ЯМР 13С, δ, м. д.: 26.3, 28.6, 31.9
с (3H, Me), 3.67 с (3H, MeО), 4.68 с (1H, H4), 6.73
(2С), 34.2, 50.0, 55.6, 79.4, 110.5, 115.2, 118.8, 120.4,
д (1Hаром, J 7.5 Гц), 6.92 д (2Hаром, J 8.0 Гц), 7.13
122.6, 126.7, 128.0, 128.2 (4С), 144.7, 147.8, 158.6,
д (1Наром, J 7.8 Гц), 7.21 д (2Hаром, J 8.0 Гц), 7.42
161.5, 166.5, 195.6. Масс-спектр (HRMS, ESI), m/z:
д (1Hаром, J 8.4 Гц), 7.44 т (1Наром, J 7.8 Гц), 7.49
419.1969 [M + H]+. C25H26N2O4. M + H 419.1893.
,
с (1Hаром), 7.65 т (1Наром, J 7.5 Гц), 7.68 д (2Hаром
2-Амино-7,7-диметил-4-(3-феноксифенил)-3-
J 8.0 Гц), 7.78 д (1Наром, J 8.0 Гц), 8.14 уш.с (2H,
{4-([1,1'-бифенил]-4-ил)тиазол-2-ил}-7,8-дигид-
NH2). Спектр ЯМР 13С, δ, м.д.: 21.8, 29.5, 56.9, 81.8,
ро-4H-хромен-5(6Н)-он (6). К перемешиваемому
93.2, 93.7, 97.6, 102.0, 103.4, 106.2, 109.6, 113.3,
раствору 2.0 г (10 ммоль) м-феноксибензальдеги-
115.2, 122.6, 126.5, 127.1 (2С), 129.9 (3С), 132.1,
да 1b в 20 мл ДМФА при 20°C прибавляли 1.0 г
138.0, 144.2, 151.9, 152.1, 153.2, 153.4, 159.8, 161.5.
(10 ммоль) цианотиоацетамида 2b и 1 каплю
Масс-спектр, m/z (Iотн, %): 495.2 (100) [M + 1]+.
триэтиламина, перемешивали 2 ч и прибавляли
Найдено, %: С 70.35; H 4.38; N 5.59. C29H22N2O4S.
2.75 г (10 ммоль) ω-4-фенилфенацилбромида 5a,
Вычислено, %: С 70.43; H 4.48; N 5.66. М 494.6.
после чего смесь перемешивали 3 ч и оставляли.
Этил-7-ацетиламино-4-оксо-2-(проп-2-ин-
Через 24 ч к перемешиваемой реакционной сме-
си последовательно прибавляли 1.4 г (10 ммоль)
1-илтио)-5-(3-фторфенил)-4,5-дигидро-3H-пи-
СН-кислоты 3 и 1.5 мл (10 ммоль) триэтиламина,
рано[2,3-d]пиримидин-6-карбоксилат (11). К пе-
перемешивали 1 ч и оставляли. Через 24 ч смесь
ремешиваемой смеси 1.1 мл (10 ммоль) м-фторбен-
разбавляли равным объемом воды и отфильтровы-
зальдегида 1а и 1.1 мл (10 ммоль) цианоуксусного
вали образовавшийся осадок. Промывали водой,
эфира 2с в 20 мл ДМФА при 20°C прибавляли 1
этанолом и гексаном. Выход 4.8 г (81%), желтые
каплю морфолина, перемешивали 2 ч и прибавля-
кристаллы, т.пл. 215-217°C (BuOH), при УФ-
ли 1.44 г (10 ммоль) тиобарбитуровой кислоты 9 и
облучении флуоресцируют. ИК спектр, ν, см-1:
0.9 мл (10 ммоль) морфолина. Затем реакционную
3466, 3334, 3198 (NH2), 1715 (C=O), 1642 (δNH2).
смесь перемешивали 3 ч и оставляли. Через 24 ч
Спектр ЯМР 1Н, δ, м.д.: 0.81 с (3H, Me), 1.03 с (3H,
при перемешивании прибавляли 1 мл (10 ммоль)
Me), 2.08 д (1H, H8, 2J 16.2 Гц), 2.33 д (1H, H8, 2J
пропаргилбромида 10а, перемешивали 3 ч и остав-
16.8 Гц), 2.43 д (1H, H6, 2J 17.4 Гц), 2.58 д (1H, H6,
ляли. Через 24 ч реакционную смесь разбавляли
2J 17.6 Гц), 4.51 с (1H, H4пирана), 6.76 д (1Hаром, J
равным объемом воды и отфильтровывали образо-
7.9 Гц), 6.91 т (3Hаром, J 7.7 Гц), 7.02-7.13 м
вавшийся осадок. Промывали водой, этанолом и
(2Hаром), 7.22 т (1Наром, J 7.9 Гц), 7.34 т (3Hаром,
гексаном. После высушивания осадок кипятили в
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
206
ДЯЧЕНКО и др.
25 мл Ac2O с обратным холодильником 2 ч. После
36.7, 57.9, 97.7, 119.1, 120.1, 127.2, 127.8 (2С),
остывания осадок отфильтровывали и промыва-
128.8 (2С), 131.9, 133.2, 144.6, 150.1, 159.6, 162.4.
ли эфиром. Выход 3.0 г (69%), желтый порошок,
Масс-спектр (HRMS, ESI), m/z: 339.0916 [M + H]+.
т.пл. 128-130°C (AcOH). ИК спектр, ν, см-1: 3300
C17H14N4O2S. M + H 339.0837.
(NH), 1714 (C=O), 1668 (CONH). Спектр ЯМР
Этил-2-аллилтио-7-амино-4-оксо-5-фенил-
1Н, δ, м.д.: 1.05 т (3H, Me, J 7.0 Гц), 1.87 с (3H,
4,5-дигидро-1H-пирано[2,3-d]пиримидин-6-
MeCО), 3.19 с (2H, SCH2), 3.91 с (1H, ≡CH), 3.97 к
карбоксилат (12b). Выход 3.0 г (78%), бесцвет-
(2H, OCH2, J 7.0 Гц), 4.80 с (1H, H5пиранопиримидина),
ный порошок, т.пл. 230-232°C (AcOH). ИК спектр,
6.98 т (1Наром, J 7.3 Гц), 7.09 д (1Hаром, J 7.5 Гц),
ν, см-1: 3418, 3300, 3212 (NH, NH2), 1722 (C=O),
7.14 д (1Наром, J 7.3 Гц), 7.21-7.23 м (1Hаром), 10.42
1680 (CONH), 1645 (δNH2). Спектр ЯМР 1Н, δ,
уш.с (1H, NHCOCH3), 12.44 уш.с (1H, NH). Спектр
м.д.: 1.05 т (3H, Me, J 7.0 Гц), 3.77 д (2H, SCH2,
ЯМР 13С, δ, м.д.: 14.3, 18.9, 21.5, 23.7, 36.3, 60.6,
J 6.8 Гц), 3.93 к (2H, OCH2, J 7.0 Гц), 4.64 с (1H,
74.5, 79.7, 99.4, 100.1, 113.9, 114.7, 124.1, 130.5,
H5пиранопиримидина), 5.16 д (1H, =CH2, Jцис 10.0 Гц),
146.6, 146.7, 161.2, 163.6, 165.2, 169.1, 172.4.
5.33 д (1H, =CH2, Jтранс 17.0 Гц), 5.77-5.99 м (1H,
Масс-спектр (HRMS, ESI), m/z: 443.1039 [M + H]+.
CH=), 7.08-7.26 м (5Hаром), 7.72 уш.с (2H, NH2),
C21H18FN3O5S. M + H 443.0951.
12.85 уш.с (1H, NH). Спектр ЯМР 13С, δ, м. д.: 14.2,
2-Алкилтио-7-амино-4-R1-6-Z-5H-пирано-
32.3, 34.2, 58.9, 77.1, 85.0, 106.2, 112.3, 118.8, 126.1,
[2,3-d]пиримидин-4(3H)-оны 12a-f (общая ме-
127.7 (2С), 127.9 (2С), 133.4, 145.9, 158.4, 159.9,
тодика). К перемешиваемому раствору 1.1 мл
167.8. Масс-спектр (HRMS, ESI), m/z: 386.1193
(10 ммоль) бензальдегида 1а, или соответствен-
[M + H]+. C19H19N3O4S. M + H 386.1096.
но 1.73 мл (10 ммоль) 3-феноксибензальдегида
Гептил-2-аллилтио-7-амино-4-оксо-5-фенил-
1b, 1.22 мл (10 ммоль) 3-метоксибензалдегида 1с,
4,5-дигидро-3Н-пирано[2,3-d]пиримидин-6-
1.1 мл (10 ммоль) 3-фторбензальдегида 1d и
карбоксилат (12с). Выход 3.2 г (70%), бесцветные
4-хлорбензальдегида 1e, и 1.1 мл (10 ммоль) ци-
кристаллы, т.пл. 180-182°C (AcOH). ИК спектр,
аноуксусного эфира 2с, или 0.66 г (10 ммоль)
ν, см-1: 3425, 3332, 3150 (NH, NH2), 1716, 1680
малононитрила 2d в 20 мл ДМФА при 20°C при-
(C=O), 1652 (δNH2). Спектр ЯМР 1Н, δ, м.д.: 0.84 т
бавляли 1 каплю морфолина, перемешивали 2 ч
(3H, Me, J 7.0 Гц), 1.02-1.13 м (2H, СH2), 1.15-1.18
и прибавляли 1.44 г (10 ммоль) тиобарбитуровой
м [4Н, (СН2)2], 1.21-1.28 м (2H, СH2), 1.30-1.42 м
кислоты 9 и 0.9 мл (10 ммоль) морфолина, после
(2H, СH2), 3.76 д (2H, SCH2, J 6.5 Гц), 3.81-3.98
чего перемешивали 1 ч и оставляли. Через сутки
м (2H, ОСH2), 4.61 с (1H, H4), 5.14 д (1H, =CH2,
к перемешиваемой реакционной смеси прибавля-
J
10.0 Гц), 5.30 д (1H, =CH2, Jтранс 17.1 Гц),
цис
ли 1 мл (10 ммоль) пропаргилбромида 10a, или
5.82-6.01 м (1H, CH=), 7.02-7.22 м (5Hаром), 7.75
0.85 мл (10 ммоль) аллилбромида 10b, переме-
уш.с (2H, NH2), 12.84 уш.с (1H, NH). Масс-спектр,
шивали 4 ч и разбавляли равным объемом воды.
m/z (Iотн, %): 456.2 (100) [M + 1]+. Найдено, %: С
Образовавшийся осадок отфильтровывали и про-
63.18; H 6.33; N 9.14. C24H29N3O4S. Вычислено, %:
мывали водой, этанолом и гексаном.
С 63.27; H 6.42; N 9.22. М 455.6.
2-Аллилтио-7-амино-4-оксо-5-фенил-4,5-ди-
2-Aллилтио-7-амино-4-оксо-5-(4-хлорфе-
гидро-3H-пиран[2,3-d]пиримидин-6-карбони-
нил)-4,5-дигидро-3Н-пирано[2,3-d]пиримидин-
трил (12a). Выход 2.8 г (82%), бесцветный поро-
6-карбонитрил (12d). Выход 2.6 г (70%), бес-
шок, т.пл. 238-240°C (AcOH). ИК спектр, ν, см-1:
цветный порошок, т.пл. 231-233°C (BuOH). ИК
3459, 3300, 3188 (NH, NH2), 2205 (C≡N), 1679
спектр, ν, см-1: 3476, 3327, 3202 (NH, NH2), 2201
(CONH), 1650 (δNH2). Спектр ЯМР 1Н, δ, м.д.: 3.75
(C≡N), 1670 (CONH), 1646 (δNH2). Спектр ЯМР
д (2H, SCH2, J 7.0 Гц), 4.32 с (1H, H5пиранопиримидина),
1Н, δ, м.д.: 3.74 д (2H, SCH2, J 6.8 Гц), 4.35 с (1H,
5.13 д (1H, =CH2, Jцис 5.3 Гц), 5.28 д (1H, =CH2,
H5пиранопиримидина), 5.11 д (1H, =CH2, Jцис 10.1 Гц),
Jтранс 16.3 Гц), 5.83-5.87 м (1H, CH=), 7.16-7.19 м
5.27 д (1H, =CH2, Jтранс 17.0 Гц), 5.77-5.86 м (1Н,
(5Н, Наром + NH2), 7.22 д (2Наром, J 8.5 Гц), 12.80
СН=), 7.17 д (2Наром, J 6.6 Гц), 7.19 с (2H, NH2), 7.31
уш.с (1H, NH). Спектр ЯМР 13С, δ, м.д.: 32.7,
д (2Наром, J 6.6 Гц), 12.94 уш.с (1H, NH). Спектр
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
МНОГОКОМПОНЕНТНЫЙ СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ 2-АМИНО-4Н-ПИР
АНОВ
207
ЯМР 13С, δ, м.д.: 32.7, 36.3, 57.3, 119.2, 119.9, 128.7
раствора КОН и 0.85 мл (10 ммоль) аллилброми-
(3С), 129.8 (3С), 131.7, 133.1, 143.5 (2C), 159.5
да 10b, или 0.8 мл (10 ммоль) этилиодида 10с, или
(2С). Масс-спектр (HRMS, ESI), m/z:
373.0527
1.2 мл (10 ммоль) бензилхлорида 10d, после чего
[M + H]+. C17H13ClN4O2S. M + H 373.0448.
перемешивали 2 ч и разбавляли равным объемом
воды. Образовавшийся осадок отфильтровывали и
Этил-2-аллилтио-7-амино-4-оксо-5-(4-хлор-
промывали водой, этанолом и гексаном.
фенил)-4,5-дигидро-3H-пирано[2,3-d]пирими-
дин-6-карбоксилат (12e). Выход 3.2 г (77%), жел-
b. К перемешиваемому раствору
3.9 г
тый порошок, т.пл. 232-234°C (BuOH). ИК спектр,
(10 ммоль) замещенного пиранопиримидина
ν, см-1: 3415, 3330, 3292 (NH, NH2), 1715 (C=О),
12b в 20 мл ДМФА при 20°C прибавляли 5.6 мл
1672 (CONH), 1645 (δNH2). Спектр ЯМР 1Н, δ,
(10 ммоль) 10%-ного водного раствора КОН и со-
м.д.: 1.05 т (3Н, Ме, J 6.7 Гц), 3.68 д (2H, SCH2,
ответствующих 0.85 мл (10 ммоль) аллилброми-
J 6.8 Гц), 3.92 к (2H, ОCH2, J 6.7 Гц), 4.65 с (1H,
да 10b, или 0.8 мл (10 ммоль) этилиодида 10с, пе-
H5пиранопиримидина), 5.10 д (1H, =CH2, Jцис 10.0 Гц),
ремешивали 2 ч и разбавляли равным количеством
5.26 д (1H, =CH2, Jтранс 17.0 Гц), 5.74-5.88 м (1Н,
воды. Образовавшийся осадок отфильтровывали,
СН=), 7.14 к (4Наром, J 8.1 Гц), 7.56 уш.с (2H, NH2),
промывали водой, этанолом и гексаном.
12.68 уш.с (1H, NH). Масс-спектр, m/z (Iотн, %):
Этил-4-аллилокси-2-аллилтио-7-амино-5-
420.0 (100) [M + 1]+. Найдено, %: С 54.28; H 4.26;
фенил-5Н-пирано[2,3-d]пиримидин-6-карбок-
N 9.95. C19H18ClN3O4S. Вычислено, %: С 54.35; H
силат (13a). Выход 3.4 г (80%) (метод а) и 3.5 г
4.32; N 10.01. М 419.9.
(83%) (метод b), желтый порошок, т.пл. 155-157°C
7-Амино-4-оксо-2-(проп-2-ин-1-илтио)-5-фе-
(AcOH). ИК спектр, ν, см-1: 3445, 3352, 3240 (NH2),
нил-4,5-дигидро-3H-пирано[2,3-d]пиримидин-
1712 (C=О), 1644 (δNH2). Спектр ЯМР 1Н, δ, м.д.:
6-карбонитрил (12f). Выход 2.5 г (74%), бесцвет-
1.06 т (3Н, Ме, J 7.0 Гц), 3.84 д (2H, SCH2, J 7.0 Гц),
ный порошок, т.пл. 225-227°C (BuOH), при УФ-
3.94 к (2H, ОCH2, J 7.0 Гц), 4.41 д.д (1H, ОCH2CH=,
облучении флуоресцирует. ИК спектр, ν, см-1:
3J 5.5, 2J 17.0 Гц), 4.59 д.д (1H, ОCH2CH=, 3J 5.5,
3444, 3352, 3330, 3246 (NH, NH2), 2205 (C≡N),
2J 17.0 Гц), 4.66 с (1H, H5), 4.99 д (1H, =CH2, Jтранс
1666 (CONH), 1642 (δNH2). Спектр ЯМР 1Н, δ,
17.0 Гц), 5.13 д (1H, =CH2, Jцис 10.5 Гц), 5.18 д
м.д.: 3.10 с (1H, ≡CH), 3.90 с (2Н, SCH2), 4.37 с
(1H, =CH2, Jцис 10.5 Гц), 5.35 д (1H, =CH2, Jтранс
(1Н, H5), 7.03 уш.с (2H, NH2), 7.14-7.32 м (5Наром),
17.0 Гц), 5.63-5.81 м (1H, CH=), 5.84-6.02 м (1H,
12.95 уш.с (1H, NH). Масс-спектр, m/z (Iотн, %):
CH=), 7.02-7.23 м (5Наром), 7.74 уш.с (2H, NH2).
337.0 (100) [M + 1]+. Найдено, %: С 60.62; H 3.54;
Спектр ЯМР 13С, δ, м.д.: 22.8, 23.2, 23.5, 26.9, 56.1,
N 16.52. C17H12N4O2S. Вычислено, %: С 60.70; H
102.2, 107.4, 115.2 (3С), 117.5, 125.7, 130.8, 132.4
3.60; N 16.66. М 336.4.
(4С), 143.6 (2С), 152.0, 159.5, 162.5. Масс-спектр,
m/z (Iотн, %): 426.0 (100) [M + 1]+. Найдено, %: С
4-Алкилокси-2-алкилтио-7-амино-5-R1-5H-
61.98; H 5.32; N 9.77. C22H23N3O4S. Вычислено, %:
пирано[2,3-d]пиримидин-4(3H)-оны 13a-d (об-
С 62.10; H 5.45; N 9.88. М 425.5.
щая методика). a. К перемешиваемому раствору
соответствующих 1.1 мл (10 ммоль) бензальдеги-
7-Амино-4-бензилокси-2-бензилтио-5-изо-
да 1а, или 0.91 мл (10 ммоль) бутираля 1f, 1.1 мл
пропил-5Н-пирано[2,3-d]пиримидин-6-карбо-
(10 ммоль) цианоуксусного эфира 2с, или 0.66 г
нитрил (13b). Выход 3.4 г (77%), желтый поро-
(10 ммоль) малононитрила 2d в 20 мл ДМФА при
шок, т.пл. 203-205°C (AcOH). ИК спектр, ν, см-1:
20°C прибавляли 1 каплю морфолина, перемеши-
3419, 3342, 3295 (NH2), 2202 (C≡N), 1648 (δNH2).
вали 2 ч и прибавляли 1.44 г (10 ммоль) тиобар-
Спектр ЯМР 1Н, δ, м.д.: 0.70 д (3Н, Ме, J 8.5 Гц),
битуровой кислоты 9 и 0.9 мл (10 ммоль) морфо-
0.97 д (3Н, Ме, J 8.5 Гц), 1.90-2.03 м (1H, CHMe2),
лина. Затем реакционную смесь перемешивали
3.34 с (2H, SCH2), 4.40 д (1Н, H5, J 3.1 Гц), 5.15
1 ч и прибавляли 0.85 мл (10 ммоль) аллилбро-
д (1H, ОCH2, 2J 15.6 Гц), 5.23 д (1H, ОCH2, 2J
мида 10b, или 1.2 мл (10 ммоль) бензилхлори-
15.6 Гц), 7.17 уш.с (2H, NH2), 7.19-7.33 м (8Hаром),
да 10d, перемешивали 1 ч и последовательно
7.37 д (2Hаром, J 8.5 Гц). Спектр ЯМР 13С, δ, м.д.:
прибавляли 5.6 мл (10 ммоль) 10%-ного водного
17.3, 20.6, 33.4, 36.3, 37.4, 47.6, 121.2, 127.2, 128.2,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
208
ДЯЧЕНКО и др.
129.1 (2С), 129.8 (2С), 135.4 (4С), 135.8 (4С), 159.2,
алкилирующих реагентов и морфолина реализу-
161.6, 161.9, 162.0. Масс-спектр, m/z (Iотн, %):
ется в ДМФА в мягких условиях с образованием
443.0 (100) [M - 1]+. Найдено, %: С 67.45; H 5.39;
функционально замещенных конденсированных
N 12.48. C25H24N4O2S. Вычислено, %: С 67.54; H
2-амино-4Н-пиранов, которые удается получать с
5.44; N 12.60. М 444.6.
выходами до 83%.
4-Аллилокси-7-амино-2-бензилтио-5-изо-
ФОНДОВАЯ ПОДДЕРЖКА
пропил-5Н-пирано[2,3-d]пиримидин-6-карбо-
Работа выполнена при финансовой поддерж-
нитрил (13с). Выход 3.0 г (75%), бесцветный ва-
ке Министерства науки и высшего образования
тообразный продукт, т.пл.
180-182°C (BuOH).
Российской Федерации [проект № 075-03-2020-
ИК спектр, ν, см-1: 3415, 3320, 3198 (NH2), 2194
223 (FSSF-2020-0017)].
(C≡N), 1650 (δNH2). Спектр ЯМР 1Н, δ, м.д.: 0.67 д
ИНФОРМАЦИЯ ОБ АВТОРАХ
(3Н, Ме, J 6.5 Гц), 0.95 д (3Н, Ме, J 6.5 Гц), 1.82-
2.02 м (1H, CHMe2), 3.23 д (1H, H5, J 4.5 Гц), 4.42
Дяченко Иван Владимирович, ORCID: https://
с (2Н, SCH2), 4.57 д (2H, ОCH2, J 7.0 Гц), 5.03 д
orcid.org/0000-0001-7255-3446
(1H, =CH2, Jтранс 17.0 Гц), 5.16 д (1H, =CH2, Jцис
Дяченко Владимир Данилович, ORCID: https://
10.5 Гц), 5.76-5.84 м (1H, CH=), 7.15 уш.с (2H,
orcid.org/0000-0002-0993-4091
NH2), 7.28 д (1Hаром, J 7.5 Гц), 7.33 т (2Hаром, J
7.0 Гц), 7.41 д (2Hаром, J 7.0 Гц). Спектр ЯМР 13С,
Хрусталев Виктор Николаевич, ORCID: https://
δ, м.д.: 17.3, 20.6, 33.3, 36.1, 37.3, 46.7, 51.8, 98.4,
orcid.org/0000-0001-8806-2975
118.1, 128.2, 129.1 (2С), 129.8 (2С), 131.1 (2С),
Ненайденко Валентин Георгиевич, ORCID:
135.9, 159.1, 161.0, 161.5, 162.0. Масс-спектр, m/z
(Iотн, %): 395.2 (100) [M + 1]+. Найдено, %: С 63.85;
КОНФЛИКТ ИНТЕРЕСОВ
H 5.54; N 14.09. C21H22N4O2S. Вычислено, %: С
63.94; H 5.62; N 14.20. М 394.5.
Авторы заявляют об отсутствии конфликта ин-
тересов.
Этил-2-аллилтио-7-амино-5-фенил-4-
этокси-5Н-пирано[2,3-d]пиримидин-6-карбок-
СПИСОК ЛИТЕРАТУРЫ
силат (13d). Выход 3.2 г (77%) (метод а) и 3.4 г
1. Mahmoud N.F.H., El-Bordany E.A., Elsaed G.A.
(81%) (метод b), бесцветныe кубические кристал-
J. Chem. 2017, 5373049. doi 10.1155/2017/5373049
лы, т.пл. 170-172°C (AcOH). ИК спектр, ν, см-1:
2. El-Shwiniy W.H., Shehab W.S., Zordok W.A. J. Mol.
3400, 3335, 3288 (NH2), 1717 (C=O), 1636 (δNH2).
Struct. 2020, 1199, 126993
Спектр ЯМР 1Н, δ, м.д.: 1.05 т (3Н, Ме, J 6.5 Гц),
3. Drewe J.A., Xiong C.S., Wang Y. Пат. 6906203 (2005).
1.12 т (3Н, Ме, J 7.0 Гц), 3.83 д (2H, SCH2, J
США. РЖХим. 2006. 06.14-19О.57П.
6.5 Гц), 3.86-4.02 м [4Н, (ОCH2)2], 4.68 с (1H, H5),
4. Шевердов В.П., Андреев А.Ю., Насакин О.Е.,
5.19 д (1H, =CH2, Jцис 10.0 Гц), 5.37 д (1H, =CH2,
Гейн В.Л. Хим.-фарм. ж. 2014, 48, 25-28.
Jтранс 17.0 Гц), 5.82-6.03 м (1H, CH=), 7.11 д
5. Nakhi A., Rahman M.S., Archana S., Kishore R.,
(1Hаром, J 7.0 Гц), 7.14-7.22 м (4Hаром), 7.74 уш.с
Seerapu G.P.K., Kumar K.L., Halofar D., Pal M.
(2H, NH2). Спектр ЯМР 13С, δ, м.д.: 12.9, 14.7, 34.4,
Bioorg. Med. Chem. Lett. 2013, 23, 4195-4205. doi
35.3, 59.3, 77.5, 100.6, 100.8, 119.8, 126.6, 128.2
10.1016/j.bmcl.2013.05.014
(2С), 128.3 (2С), 132.7, 146.3, 157.9, 160.3, 160.7,
6. Kandile N.G., Zaky H.T. J. Enzyme Inhib. Med. Chem.
160.9, 168.3. Масс-спектр, m/z (Iотн, %): 414.2 (100)
2015, 30, 44-51. doi 10.3109/14756366.2013.877896
[M + 1]+. Найдено, %: С 60.89; H 5.55; N 10.02.
7. Dardari Z., LemraniM., Sebban A., Bahloul A., Has-
C21H23N3O4S. Вычислено, %: С 61.00; H 5.61; N
sar M., Kitane S., Berrada M., Boudouma B.
10.16. М 413.5.
Arch. Pharm.
2006,
339,
291-298. doi
10.1002/
ardp.200500266
ЗАКЛЮЧЕНИЕ
8. Ali T.E., Bakhotmah D.A., Assiri M.A. Synth.
Многокомпонентная конденсация альдегидов,
Commun.
2020,
50,
3314-3325. doi
10.1080/
CH-кислоты линейного и циклического строения,
00397911.2020.1800744
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
МНОГОКОМПОНЕНТНЫЙ СИНТЕЗ ФУНКЦИОНАЛИЗИРОВАННЫХ 2-АМИНО-4Н-ПИР
АНОВ
209
9. Saundane A.R., Walmic P., Yarlakatti M., Kutkar V.,
21. Rouf A., Tanyeli C. Eur. J. Med. Chem. 2015, 97, 911-
Verma V.A. J. Heterocycl. Chem. 2014, 51, 303-314.
927. doi 10.1016/j.ejmech.2014.10.058
doi 10.1002/jhet.1582
22. Bender W., Betz U., Kleymann G., Baumeister J.,
10. Kumar B.S., Lakshmi P.V.A., Veena B.S., Sujatha E.
Eckenberg P., Fischer R., Handke-Ergueden G.,
Russ. J. Gen. Chem. 2017, 87, 829-836. doi 10.1134/
Hendrix M., Heninger K., Jensen A., Keldenich J.,
S1070363217040260
Reefschloger J., Schmidt T., Schneider U., Weber O.
11. Dorostkar-Ahmadi N., Davoodnia A., Tavakoli-
Заявка 10210319 (2003). Германия. РЖХим. 2004.
Hoseini N., Behmadi H., Nakhaei-Moghaddam M.
04.22-19О.114П.
Z. Naturforsh. B Chem. Sci. 2019, 74, 175-181. doi
23. Sanner M.A., Helal C.J., Cooper C.B. Пат. 6720427
10.1515/znb-2018-0166
(2004). США. РЖХим. 2005. 05.04-19О.172П.
12. Kaur M., Kaur A., Mankotia S., Singh H., Singh A.,
24. Dhanoa D.S., Ryan D.E., Deckman I., Sapienza A.
Virsingh J., Kupta M.K., Sharma S., Depali K., Be-
di P.M.S. Eur. J. Med. Chem. 2017, 131, 14-28. doi
Пат.
6586453
(2003). США. РЖХим.
2004.
10.1016/j.ejmech.2017.03.002
04.05-19О.136П.
13. Shehab W.S., El-Shwiniy W.H. J. Iranian Chem. Soc.
25. Rawlins D.B., Kimball D.S., Kim K.S., Misra R.N.,
2018, 15, 431-443. doi 10.1007/s13738-017-1244-4
Webster K.R. Пат. 6720347 (2004). США. РЖХим.
14. Erichsen M.N., Huynh T.H., Abrahamsen B., Bast-
2005. 05.06-19О.158П.
lund J.F., Bundgaard C., Monrad O., Bekker-Jensen A.,
26. Титце Л., Браше Г., Герике К. Домино-реакции в ор-
Nielsen C.W., Frydenvang K., Jensen A.A., Bunch L.
ганическом синтезе. М.: Бином. Лаборатория зна-
J. Med. Chem. 2010, 53, 7180-7191. doi 10.1021/
ний. 2010.
jm1009154
27. Ненайденко В.Г. Усп. хим. 2020, 89, 1274-1336.
15. Дяченко И.В., Дяченко В.Д., Дороватовский П.В.,
[Nenajdenko V.G. Russ. Chem. Rev. 2020, 89, 1274-
Хрусталев В.Н., Ненайденко В.Г. ЖОрХ. 2019,
1336.] doi 10.1070/RCR5010
55, 266-278. [Dyachenko I.V., Dyachenko V.D., Do-
rovatovskii P.V., Khrustalev V.N., Nenajdenko V.G.
28. Metwally N.H., Abdelrazek F.M., Sobhy N.A. Afinidad.
Russ. J. Org. Chem. 2019, 55, 215-226.] doi 10.1134/
2005, 62, 616-621.
S1070428019020131
29. Shi D.-A., Yu C.-X., Zhuang Q.-Y., Wang X.-S.
16. Дяченко И.В., Дяченко В.Д., Дороватовский П.В.,
J. Chem. Res.
2006,
4,
225-227. doi
10.3184/
Хрусталев В.Н., Ненайденко В.Г. ЖОрХ. 2020, 56,
030823406776894184
993-1003. [Dyachenko I.V., Dyachenko V.D., Doro-
30. Nagamani M., Jalapathi P., Shankar B., Neelamma M.,
vatovskii P.V., Khrustalev V.N., Nenajdenko V.G. Russ.
Krishna T.M. Russ. J. Gen. Chem. 2019, 89, 998-1002.
J. Org. Chem. 2020, 56, 1123-1131.] doi 10.1134/
doi 10.1134/S1070363219050207
S1070428020070015
31. Sun W., Jiang Y., Yan H., Song X. Austr. J. Chem. 2015,
17. Дяченко В.Д. ЖОХ. 2005, 75, 476-482. [Dyachen-
68, 273-281. doi 10.1071/CH14113
ko V.D. Russ. J. Gen. Chem. 2005, 75, 440-446.] doi
10.1007/s11176-005-0247-5
32. Bruker, SAINT, Bruker AXS Inc., Madison, WI, 2013.
18. Дяченко В.Д. ЖОХ. 2006, 76, 299-308. [Dyachen-
33. SADABS 2016/2. Krause L., Herbst-Irmer R., Sheld-
ko V.D. Russ. J. Gen. Chem. 2006, 76, 282-291.] doi
rick G.M., Stalke D. J. Appl. Crystallogr. 2015, 48,
10.1134/S1070363206020216
3-10. doi 10.1107/S1600576714022985
19. Клокол Г.В., Кривоколыско С.Г., Дяченко В.Д.,
34. Battye T.G.G., Kontogiannis L., Johnson O., Po-
Литвинов В.П. ХГС. 1999, 35, 1363-1366. [Klo-
well H.R., Leslie A.G.W. Acta Crystallogr. Sect. D.
kol G.V., Krivokolisko S.G., Dyachenko V.D., Litvi-
2011, 67, 271-281. doi 10.1107/S0907444910048675
nov V.P. Chem. Heterocycl. Compd. 1999, 35, 1183-
35. Evans P.R. Acta Crystallogr., Sect. D. 2006, 62, 72-82.
1186.] doi 10.1007/BF02323376
doi 10.1107/S0907444905036693
20. Frijia L.M.T., Pompeiro A.J.L., Kopylovich M.N.
Coord. Chem. Rev. 2016, 308, 32-55. doi 10.1016/
36. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
j.ccr.2015.10.003
3-8. doi 10.1107/S2053229614024218
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
210
ДЯЧЕНКО и др.
Multicomponent Synthesis of Functionalized
2-Amino-4H-pyrans Initiated by the Knoevenagel Reaction
I. V. Dyachenkoa, V. D. Dyachenkoa, P. V. Dorovatovskiib,
V. N. Khrustalevc, d, and V. G. Nenajdenkoe, *
a Lugansk State Pedagogical University, ul. Oboronnaya, 2, Lugansk, 91011 Ukraine
b National Research Center “Kurchatov Institute”, ul. Akademika Kurchatova, 1, Moscow, 123182 Russia
c Peoples’ Friendship University of Russia (RUDN University),
ul. Miklukho-Maklaya, 6, Moscow, 117198 Russia
d Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences, Leninsky prosp., 47, Moscow, 119991 Russia
e Lomonosov Moscow State University, Leninskie Gory, 1, Moscow, 119991 Russia
*e-mail: nenajdenko@gmail.com
Received March 23, 2022; revised April 10, 2022; accepted April 12, 2022
The multicomponent condensation of aldehydes, malononitrile derivatives, 1,3-dicarbonyl compounds of the
carbo- and heterocyclic series, and alkyl halides has been studied. The transformation is initiated by the Kno-
evenagel reaction and leads to the formation of functionally substituted condensed 2-amino-4H-pyrans. The
structure of a number of products was studied by X-ray diffraction.
Keywords: multicomponent reaction, Knoevenagel reaction, CH-acid, 2-amino-4H-pyran, X-ray
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023