ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 2, с. 217-227
УДК 547.917 + 547.791.1 + 547.741
СИНТЕЗ И ИНГИБИРУЮЩАЯ АКТИВНОСТЬ
КОНЪЮГАТА АТОРВАСТАТИНА С ЛИГАНДОМ
АСИАЛОГЛИКОПРОТЕИНОВОГО РЕЦЕПТОРА
РАЗВЕТВЛЕННОГО СТРОЕНИЯ С 3 ОСТАТКАМИ
N-АЦЕТИЛ-D-ГАЛАКТОЗАМИНА
© 2023 г. С. Ю. Маклаковаa, *, М. П. Мажугаa, А. В. Лопуховa, К. Р. Гибадуллинаa,
Н. Л. Клячкоa, А. Г. Мажугаa, b, Е. К. Белоглазкинаa
a ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
химический факультет, Россия, 119991 Москва, Ленинские горы, 1, стр. 3
b ФГБОУ ВО «Российский химико-технологический университет им. Д.И. Менделеева»,
Россия, 125047 Москва, Миусская пл., 9
*e-mail: MaklakovaSU@yandex.ru
Поступила в редакцию 30.03.2022 г.
После доработки 10.04.2022 г.
Принята к публикации 13.04.2022 г.
Впервые получен конъюгат аторвастатина и лиганда асиалогликопротеинового рецептора с 3 остатка-
ми N-ацетилгалактозамина. Для синтезированного конъюгата измерена концентрация в насыщенном
водном растворе, которая составила 6.1±0.9 мМ, что почти в 60 раз превосходит данный показатель для
немодифицированного аторвастатина. Продукты гидролиза полученного соединения проявили высокую
ингибирующую способность в отношении целевого фермента редуктазы 3-гидрокси-3-метилглута-
рил-кофермента А.
Ключевые слова: аторвастатин, N-ацетил-D-галактозамин, направленный транспорт лекарственных
препаратов, асиалогликопротеиновый рецептор
DOI: 10.31857/S0514749223020076, EDN: QJQFIG
ВВЕДЕНИЕ
следних десятилетий было показано достоверное
влияние статинов на снижение общей смертности
Сердечно-сосудистые заболевания (ССЗ) зани-
независимо от пола, возраста, исходного уровня
мают ведущую позицию среди причин смертности
холестерина [1]. Невзирая на положительный те-
и утраты трудоспособности населения в развитых
рапевтический эффект препаратов данного класса,
странах мира. Наиболее действенный подход к
нельзя не упомянуть о серьезных, хотя и достаточ-
профилактике и лечению ССЗ в настоящее время -
но редких побочных эффектах (миалгия, головная
борьба с основными факторами риска: гипертони-
боль, боли в животе, бессонница и т.д.) [2, 3].
ей, курением, малоподвижным образом жизни и,
особенно, гиперлипидемией. Основной класс ле-
Точные причины проявления побочных эффек-
карственных препаратов для лечения гиперлипи-
тов остаются неустановленными, но существует
демии сегодня - статины - ингибиторы редуктазы
мнение [4], что они связаны со способностью ста-
3-гидрокси-3-метилглутарил-кофермента А (ГМГ-
тинов неспецифически проникать и накапливать-
КоА-редуктазы), ключевого фермента синтеза эн-
ся в нецелевых типах клеток. Высказано предпо-
догенного холестерина в печени. За несколько по-
ложение о том, что неселективное прохождение
217
218
МАКЛАКОВА и др.
O
O
O
N
N
OH OH O
H
O
N
OH
O
O
NH
N
F
N
OH
N
HO
F
O
O
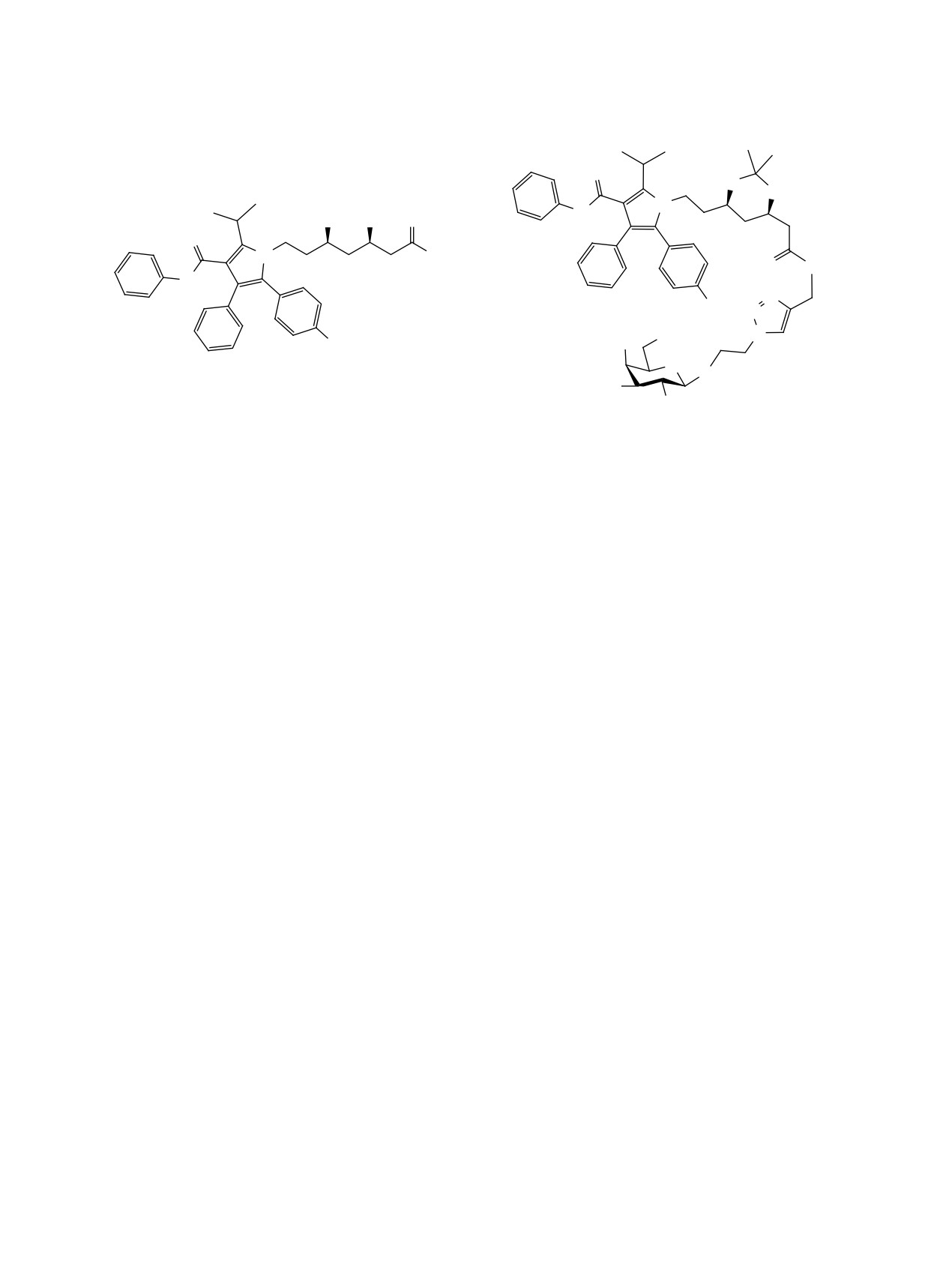
Ⱥɬɨɪɜɚɫɬɚɬɢɧ
HO
NHAc
Рис. 1. Структуры аторвастатина и его конъюгата с N-ацетилгалактозамином
через клеточные мембраны связано с высокой ли-
Таким образом, можно ожидать, что аторвастатин,
пофильностью данного класса препаратов [5], что
модифицированный остатками GalNAc, проявит
согласуется с тем фактом, что более водораствори-
повышенную гепатоселективность благодаря сво-
мые статины (например, розувастатин) приводят к
ей способности связываться с ASGPR.
меньшим негативным последствям для организма
В то же время проведенные нами с помощью
[3, 4]. Таким образом, одной из стратегий сниже-
программы ChemDraw расчеты параметра logP
ния вероятности развития побочных эффектов ста-
(логарифма коэффициента распределения в двух-
тинов может быть увеличение их гидрофильности
фазной системе н-октанол-вода) свидетельствуют
и, как следствие, повышение гепатоселективности.
о том, что синтезированный конъюгат аторваста-
Аторвастатин (рис. 1) выступает наиболее часто
тина с N-ацетилгалактозамином [6] должен быть
назначаемым препаратом из класса статинов. Для
более липофильным, чем исходный аторваста-
аторвастатина характерны все недостатки, отме-
тин, даже невзирая на то, что в его состав входит
ченные выше, а также низкая биодоступность (12%
углеводный фрагмент. Расчетные значения logP
при пероральном введении) и плохая раствори-
составили 4.46 и 4.89 для аторвастатина и конъ-
мость в воде. Описано [6] производное аторваста-
югата, соответственно. Наличие в структуре мо-
тина (рис. 1), соединенное в результате медь(I)-ка-
лекулы аторвастатина гидрофобных ароматиче-
тализируемой реакции азид-алкинового циклопри-
ских и алифатических участков способствует не-
соединения (CuAAC) c N-ацетилгалактозамином
специфическому связыванию с белками плазмы.
(GalNAc). Было показано, что данное пролекарство
Продемонстрировано [8], что в комплексе с аль-
аторвастатина способно высвобождать действую-
бумином аторвастатин оказывается окруженным
щее вещество в активной форме как в растворах,
большим количеством гидрофобных аминокис-
имитирующих физиологические условия, так и в
лотных остатков (Trp-213, Tyr-340, Tyr-451, Ala-
живых клетках. Известно, что соединения, содер-
341, Val-342, Leu-454, Pro-446). Кроме того, было
жащие в своем составе терминальные остатки га-
продемонстрировано неспецифическое связыва-
лактозы или N-ацетилгалактозамина, селективно
ние аторвастатина в фосфолипидном бислое мем-
и эффективно связываются с асиалогликопротеи-
браны клеток, что может приводить к накоплению
новым рецептором (ASGPR) - белком, в больших
препарата в нецелевых тканях и органах [9]. Таким
количествах представленным на поверхности ге-
образом, повышенная липофильность конъюгата
патоцитов и минимально на внепеченочных типах
может негативно повлиять на гепатоселективность
клеток [7]. Биологическая роль ASGPR заключает-
и биодоступность соединения, привести к усилен-
ся в реализации рецептор-опосредованного эндо-
ному связыванию с белками крови. Ранее было по-
цитоза десиалированных гликопротеинов и ряда
казано, что лиганды ASGPR c 2 и более углеводны-
других соединений, циркулирующих в кровотоке.
ми остатками имеют значительно более высокое
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
СИНТЕЗ И ИНГИБИРУЮЩАЯ АКТИВНОСТЬ КОНЪЮГАТА АТОРВАСТАТИНА
219
сродство к рецептору благодаря кооперативному
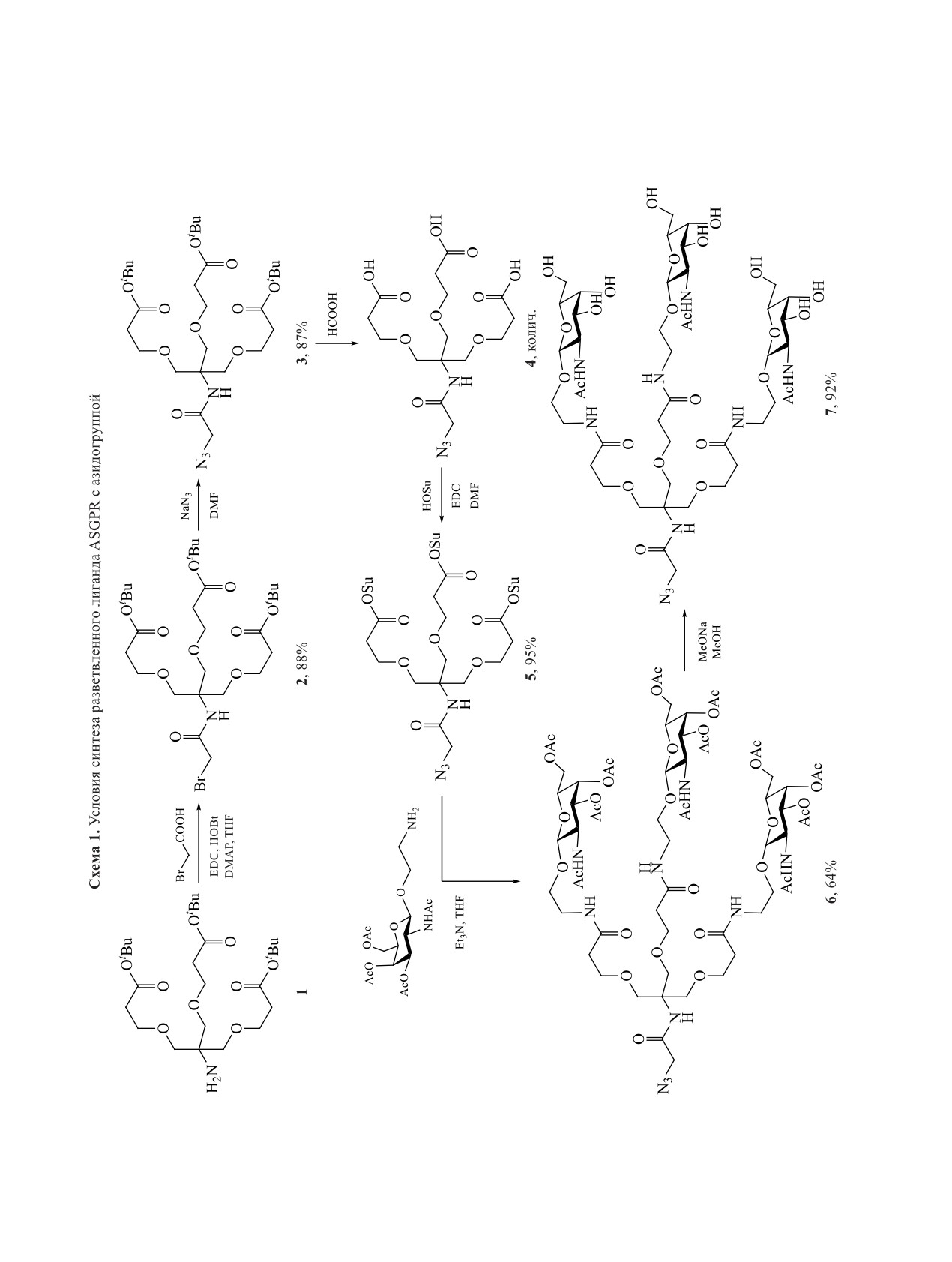
Таким образом, нами был предложен способ
эффекту [10]. В связи с этим целью данного иссле-
синтеза первого конъюгата аторвастатина и лиган-
дования стало совершенствование дизайна конъю-
да асиалогликопротеинового рецептора с 3 остат-
гата аторвастатина и N-ацетилгалактозамина для
ками N-ацетилгалактозамина. Промежуточные со-
получения препарата с высокой растворимостью
единения 2-7 и 9 получены в данной работе впер-
в воде, способного селективно проникать в гепа-
вые.
тоциты и после гидролиза оказывать требуемый
Для определения растворимости конъюгата 10
биологический эффект.
в воде использовали спектрофотометрический ме-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
тод. Для этого для соединения 10, а также для не-
модифицированного аторвастатина (в виде каль-
На поверхности гепатоцитов асиалогликопро-
циевой соли) строили градуировочные графики,
теиновый рецептор в основном представлен в виде
отражающие зависимость оптической плотности
тримера и состоит из 3 близко расположенных
растворов сравнения при 290 нм от их концен-
субъединиц, каждая из которых содержит угле-
трации. Далее готовили насыщенные растворы
вод-распознающий домен, способный связывать
обоих соединений и с помощью градуировочных
фрагмент галактозы или N-ацетилгалактозамина.
графиков определяли концентрации веществ в них
Благодаря этому особо высоким сродством к
в соответствии с законом Бугера-Ламберта-Бера.
ASGPR обладают соединения разветвленного
После проведения необходимых расчетов было
строения с несколькими терминальными остатка-
определено, что растворимость кальциевой соли
ми данных углеводов [10]. Для синтеза целевого
аторвастатина равна 0.11±0.01 мМ (см. таблицу),
конъюгата нами был выбран один из таких развет-
а величина растворимости конъюгата составляла
вленных лигандов, который для последующего со-
единения с аторвастатином модифицировали азид-
6.1±0.9 мМ, что почти в 60 раз больше.
ной группой. Общая последовательность синтеза
Таким образом, объединение в ковалентный
лиганда представлена на схеме 1. Aмин 1 [11] аци-
конъюгат аторвастатина и выбранного тривалент-
лировали бромуксусной кислотой в присутствии
ного лиганда ASGPR позволило значительно уве-
EDC
[N-этил-N'-(3-диметиламинопропил)карбо-
личить растворимость препарата в воде. Стоит
диимида гидрохлорид], после чего проводили ну-
ожидать, что такое повышение гидрофильности
клеофильное замещение брома на азидную группу
положительно скажется на селективности дей-
с последующим сольволизом трет-бутилового
ствия аторвастатина не только благодаря высокому
эфира 3 в муравьиной кислоте. Из соединения 4
сродству конъюгата к асиалогликопротеиновому
под действием активирующих агентов получали
рецептору за счет введенного адресного фрагмен-
NHS-эфир 4, который вводили в реакцию с произ-
та, но и из-за того, что соединение с такой моле-
водным N-ацетилгалактозамина, полученным по
кулярной массой и балансом гидрофильности-ги-
методике [12]. Удаление ацильных групп прово-
дрофобности будет довольно плохо преодолевать
дили сольволизом в основной среде. В результате
мембраны нецелевых клеток.
впервые было выделено в индивидуальном виде и
На заключительных этапах исследования было
охарактеризовано полным набором физико-хими-
проведено измерение ингибирующей активности
ческих методов анализа целевое соединение 7.
полученного конъюгата в отношении ГМГ-КоА
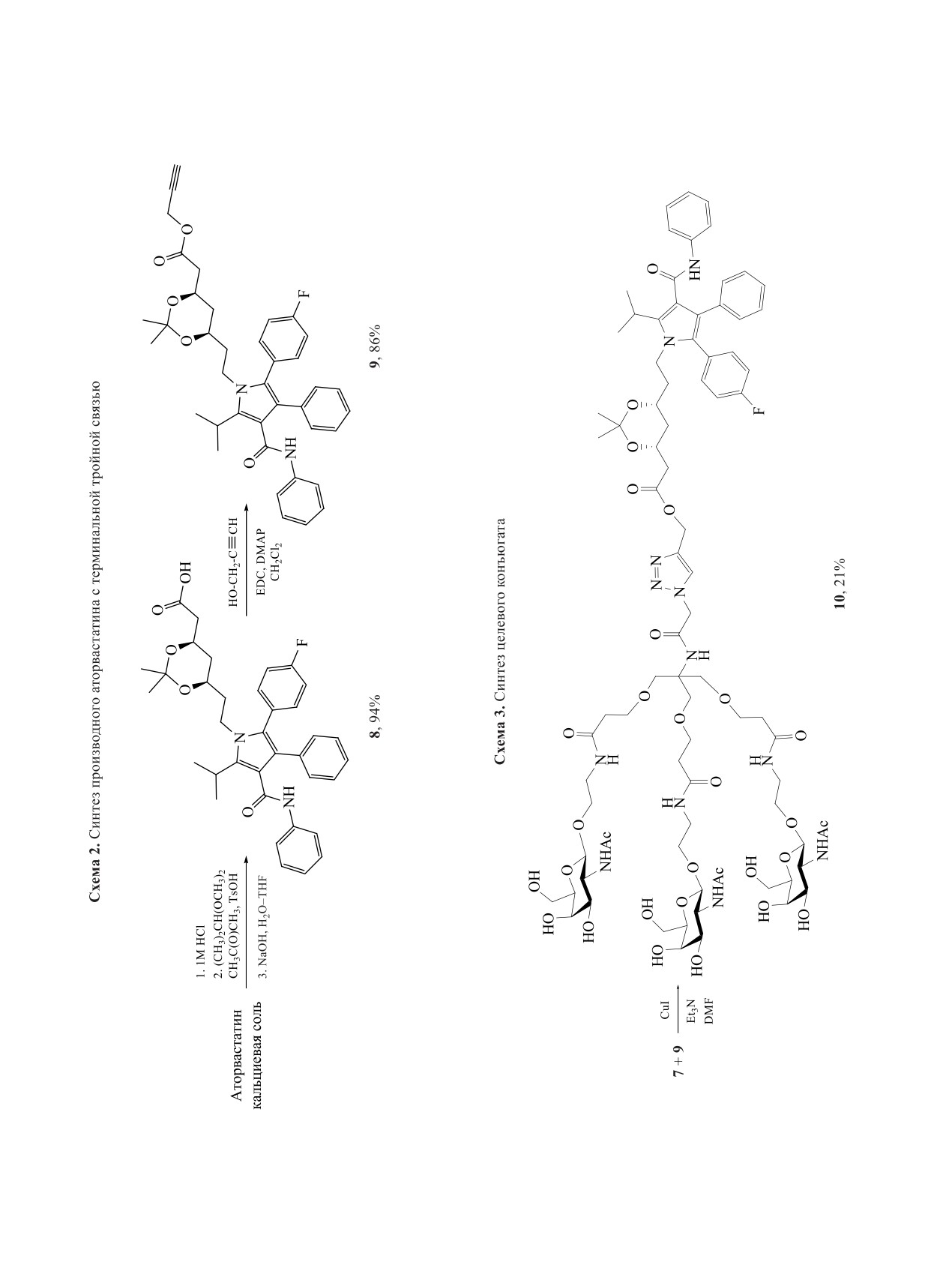
Для соединения с азидом 7 посредством CuAAC
редуктазы с помощью коммерчески доступного
аторвастатин модифицировали пропаргиловым
набора реактивов HMG-CoA Reductase Assay Kit
эфиром и получали производное 9 с терминальной
(Merck). Интересующий нас фермент катализи-
тройной связью (схема 2).
рует этап синтеза холестерина, при котором 3-ги-
На последней стадии синтеза алкин 9 и азид 7
дрокси-3-метилглутарил-кофермент А переходит в
вводили в реакцию циклоприсоединения в присут-
мевалонат. Этот процесс сопровождается окисле-
ствии йодида меди(I) и триэтиламина (схема 3).
нием 2 молекул NADPH в NADP+, благодаря чему
Целевой продукт выделяли с помощью препара-
каталитическую активность фермента можно из-
тивной обращенно-фазовой хроматографии.
мерить по интенсивности поглощения растворов
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
220
МАКЛАКОВА и др.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
СИНТЕЗ И ИНГИБИРУЮЩАЯ АКТИВНОСТЬ КОНЪЮГАТА АТОРВАСТАТИНА
221
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
222
МАКЛАКОВА и др.
Концентрация насыщенных водных растворов синтезированного конъюгата 10 и аторвастатина
Коэффициент
Среднее значение
Концентрация насыщенного раствора,
Соединение
пропорциональности
интенсивности поглощения
мМ
линейной функцииa
тест-растворов
Аторвастатин
0.01174±0.00004
0.062
0.11±0.01
(кальциевая соль)
Конъюгат 10
0.0085±0.0002
0.256b
6.1±0.9
a y = kx, где y - интенсивность поглощения при 290 нм, х - концентрация растворов сравнения, мкМ
b в случае конъюгата 10 тест-раствор дополнительно разбавляли в 10 раз по сравнению с тест-раствором аторвастатина
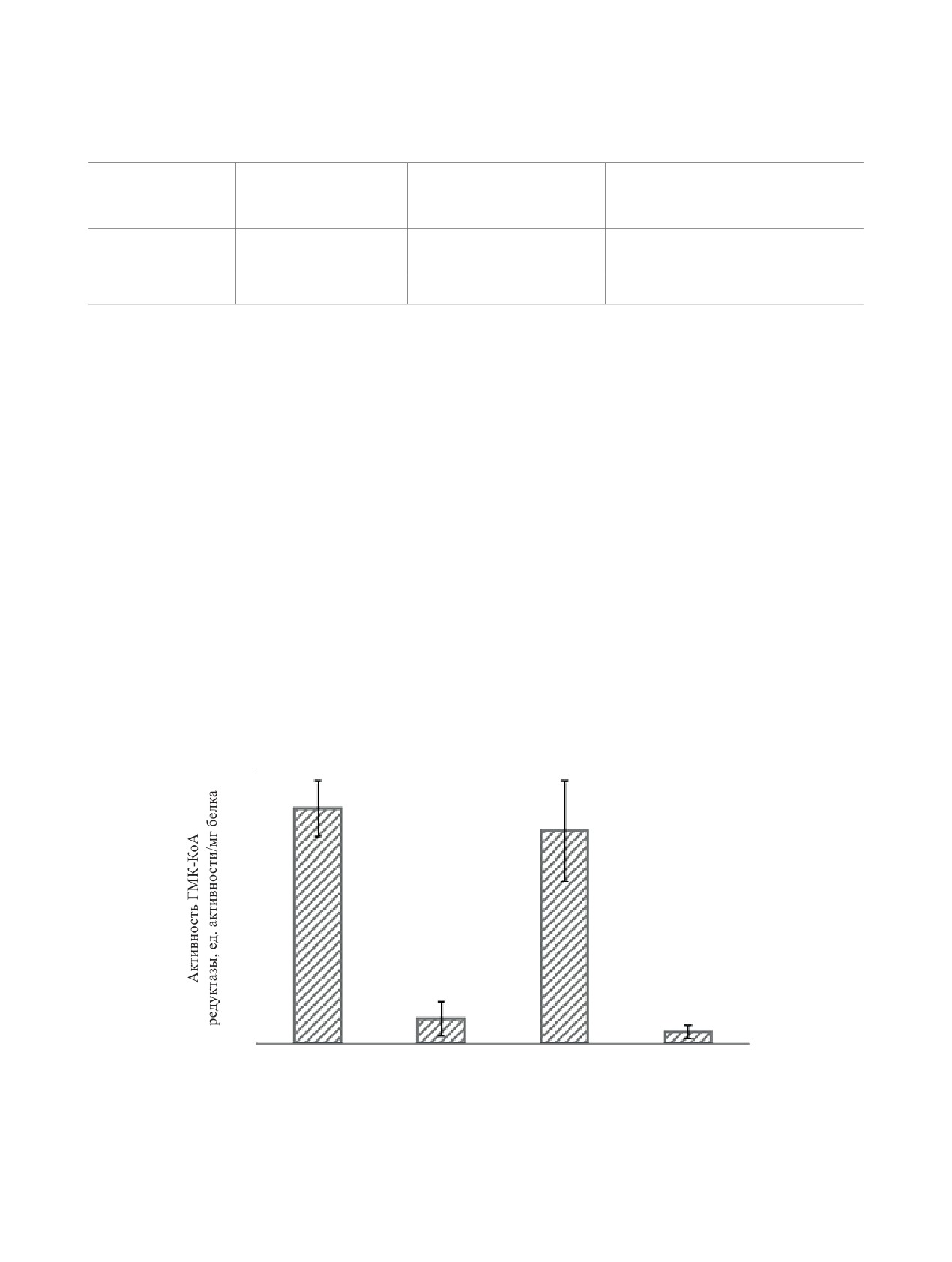
на длине волны 340 нм (характерная длина волны
вать значительного влияния на работу ГМГ-КоА-
поглощения NADP+). Чем значительнее изменение
редуктазы до тех пор, пока не произойдет расще-
во времени интенсивности поглощения растворов,
пление сложноэфирной связи и высвобождение
тем активнее фермент выполняет свою функцию.
исходного аторвастатина. Этот результат и был
В контрольном эксперименте без добавления ин-
получен нами при добавлении к смеси фермента
гибиторов наблюдали превращение 3-гидрокси-
и субстрата синтезированного конъюгата 10: како-
3-метилглутарил-кофермента А в мевалонат и вы-
го-либо статистически значимого влияния на ак-
работку NADP+ (рис. 2). Во втором контрольном
тивность фермента не наблюдали.
эксперименте при добавлении правастатина (ста-
Молекулы с несколькими остатками N-аце-
тин, рекомендованный производителем для ис-
тилгалактозамина демонстрируют высокое срод-
пользования в качестве эталонного ингибитора)
ство к асиалогликопротеиновому рецептору с
окисление NADPH в NADP+ практически не про-
равновесной константой диссоциации лиганд-ре-
исходило, активность ГМГ-КоА-редуктазы значи-
цепторного комплекса порядка единиц нМ. Ранее
тельно снижалась.
была продемонстрирована интернализация соеди-
Как правило [6, 13, 14], сложные эфиры стати-
нений, модифицированных подобными мультива-
нов и другие их производные по карбоксильной
лентными лигандами, экспрессирующими ASGPR
группе теряют ингибирующую способность, по-
клетками культуры HepG2, причем влияние ре-
этому исходный конъюгат 10 не должен оказы-
цептор-опосредованного эндоцитоза было пока-
1
0
ɛɟɡ
ɩɪɚɜɚɫɬɚɬɢɧ
ɤɨɧɴɸɝɚɬ
ɤɨɧɴɸɝɚɬ
ɢɧɝɢɛɢɬɨɪɨɜ
ɩɨɫɥɟ ɨɛɪɚɛɨɬɤɢ
Рис. 2. Активность ГМГ-КоА-редуктазы: без добавления правастатина или конъюгата, при добавлении правастатина
или раствора конъюгата без предварительного выдерживания в буферном растворе с рН 4.5 и после предварительного
гидролиза
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
СИНТЕЗ И ИНГИБИРУЮЩАЯ АКТИВНОСТЬ КОНЪЮГАТА АТОРВАСТАТИНА
223
зано экспериментами с участием конкурирующих
Растворитель удаляли при пониженном давлении.
лигандов рецептора [15]. Известно, что вещества,
Остаток растворяли в хлористом метилене и про-
направленный транспорт которых регулируется
мывали 1 M HCl, насыщенным раствором NaCl,
асиалогликопротеиновым рецептором, попадают в
органическую фракцию сушили над безводным
гепатоциты в результате образования эндосом [7,
Na2SO4. Растворитель удаляли при пониженном
10]. Среда в эндосомах слабокислая (pH 4.5-5.0),
давлении. Продукт очищали колоночной хромато-
в них происходит разрушение комплекса лиганд-
графией (СH2Cl2-СН3OH, 100:1 по объему). Выход
рецептор и первичное расщепление конъюгатов.
550 мг (88%), прозрачное масло. Спектр ЯМР 1Н
При проведении эксперимента в условиях, имити-
(CDCl3), δ, м.д.: 1.46 c (27H), 2.46 т (6Н, J 6.3 Гц),
рующих реальные процессы (после предваритель-
3.66 т (6Н, J 6.3 Гц), 3.71 с (6Н), 3.81 c (2H), 6.87
ной обработки конъюгата буферным раствором с
уш.с (1Н). Спектр ЯМР 13C (CDCl3), δ, м.д: 28.1,
pH 4.5), продукты гидролиза конъюгата 10 про-
29.6, 36.1, 60.1, 67.0, 68.8, 80.5, 165.6, 170.9. Масс-
демонстрировали значительное ингибирование
спектр, m/z: 626.2534 [M + H]+. С27H49BrNO10. M +
ГМГ-КоА-редуктазы. Полученные данные свиде-
H 626.2516.
тельствуют о том, что синтезированный конъю-
N-Трис-{[2-(трет-бутоксикарбонил)этокси]-
гат 10 при гидролизе в условиях, близких к есте-
метил}метиламид
2-азидоуксусной кислоты
ственным, способен высвобождать аторвастатин в
(3). К раствору соединения 2 (350 мг, 0.6 ммоль)
активной форме.
в 4 мл ДМФА прибавляли азид натрия (100 мг,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1.7 ммоль) и перемешивали полученную смесь
при комнатной температуре в течение суток. После
Спектры ЯМР 1Н, 19F и 13С регистрировали на
этого реакционную смесь выливали в воду и экс-
приборе Bruker DPX-300 с рабочими частотами
трагировали продукт этилацетатом. Органический
400 и 100 МГц. Масс-спектры высокого разреше-
слой промывали насыщенным раствором NaCl и
ния регистрировали на квадруполь-времяпролет-
сушили над Na2SO4. Растворитель удаляли при
ном масс-спектрометре TripleTOF 5600+ (AB Sciex,
пониженном давлении. Выход 300 мг (87%), про-
Канада), оснащенном источником ионизации
зрачное масло. Спектр ЯМР 1Н (CDCl3), δ, м.д.:
электрораспылением TurboIon Spray и жидкост-
1.45 c (27H), 2.45 т (6Н, J 6.3 Гц), 3.65 т (6Н, J
ным хроматографом LC-30 «Nexera» (Shimadzu,
6.3 Гц), 3.71 с (6Н), 3.85 c (2H), 6.60 уш.с (1Н).
Япония). Электронные спектры поглощения ре-
Спектр ЯМР 13C (CDCl3), δ, м.д: 28.1, 36.1, 52.6,
гистрировали на приборе HITACHI U-2900.
60.0, 67.0, 68.9, 80.5, 166.7, 170.9. Масс-спектр, m/z
Обращенно-фазовую хроматографию проводили
589.3443 [M + H]+. С27H49N4O10. M + H 589.3439.
на препаративном хроматографе puriFlash 4250
(Interchim, Франция) с применением картриджа PF-
N-Трис-[(2-карбоксиэтокси)метил]метил-
15C18HP-F0025 того же производителя. В работе
амид 2-азидоуксусной кислоты (4). Соединение 3
использовали коммерческие реактивы («Merck»,
(280 мг, 0.48 ммоль) перемешивали в течение 12 ч
«Fluka®Analytical», «abcr», «Carbosynth») без до-
в 5 мл муравьиной кислоты. После этого муравьи-
полнительной очистки. Соединение 1 получали по
ную кислоту удаляли при пониженном давлении.
методике
[11],
1-O-(2'-аминоэтил)-2-ацетамидо-
Выход 200 мг (количественный), бесцветное мас-
2-дезокси-3,4,6-три-О-ацетил-β-D-галактопирано-
ло. Спектр ЯМР 1Н (CD3OD), δ, м.д.: 2.53 т (6Н,
зу - по методике [12].
J 6.1 Гц), 3.67-3.71 м (12Н), 3.84 с (2H). Спектр
ЯМР 13C (CD3OD), δ, м.д: 35.9, 53.2, 61.8, 68.3,
N-Трис-{[2-(трет-бутоксикарбонил)эток-
70.0, 170.1, 175.8. Масс-спектр, m/z: 421.1565 [M +
си]метил}метиламид
2-бромэтановой кис-
H]+. C15H25N4O10. M + H 421.1563.
лоты
(2). К раствору бромуксусной кислоты
(204 мг, 1.5 ммоль) в 4 мл ТГФ прибавляли EDC
Активированный эфир N-трис-{[2-кар-
(206 мг, 1.1 ммоль), HOBt (145 мг, 1.1 ммоль) и
боксиэтокси]метил}метиламид
2-азидоэтано-
DMAP (13 мг, 0.1 ммоль). Затем прибавляли амин 1
вой кислоты (5). Трикарбоновую кислоту 4 (50 мг,
(500 мг, 1.0 ммоль). Полученную смесь перемеши-
0.12 ммоль) растворяли в
4 мл безводного
вали при комнатной температуре в течение суток.
ДМФА, прибавляли EDC (57 мг, 0.30 ммоль) и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
224
МАКЛАКОВА и др.
N-гидроксисукцинимид (50 мг, 0.43 ммоль) и пе-
т (6Н, J 6.0 Гц), 3.33-3.37 м (3Н), 3.40-3.46 м (3Н),
ремешивали при комнатной температуре в течение
3.53 т (3Н, J 6.0 Гц), 3.60 д.д (3H, J 10.3, 3.1 Гц),
24 ч. Реакционную смесь выливали в этилацетат,
3.65-3.72 м (15Н), 3.74-3.80 м (6Н), 3.82-3.87 м
промывали органическую вытяжку NaHCO3, на-
(8Н), 3.93-3.98 м (3Н), 4.40 д (3Н, J 8.4 Гц). Спектр
сыщенным раствором NaCl, сушили над Na2SO4 и
ЯМР 13C (CD3OD), δ, м.д: 23.3, 37.7, 40.9, 53.2, 54.3,
удаляли растворитель при пониженном давлении.
61.9, 62.7, 68.8, 69.3, 69.7, 70.0, 73.4, 76.9, 103.4,
Выход 80 мг (95%), прозрачное масло. Спектр ЯМР
170.0, 174.2, 174.4. Масс-спектр, m/z: 1159.5212
1Н (CDCl3), δ, м.д.: 2.84-2.89 м (18Н), 3.79-3.82 м
[M + H]+. C45H79N10O25. M + H 1159.5206.
(12Н), 3.84 с (2H), 6.45 уш.с (1Н). Спектр ЯМР 13C
2-[(4R,6R)-6-{2-[2-(4-Фторфенил)-5-изопро-
(CDCl3), δ, м.д: 25.6, 32.0, 52.5, 60.4, 65.6, 68.6,
пил-3-фенил-4-(фенилкарбамоил)-1H-пиррол-
166.9, 167.2, 169.1. Масс-спектр, m/z:
712.2057
1-ил]этил}-2,2-диметил-1,3-диоксан-4-ил]ук-
[M + H]+. C27H34N7O16. M + H 712.2040.
сусная кислота (8). Тригидрат кальциевой соли
N-(2-Азидоэтаноил)амино-трис-[(1-(2-ами-
аторвастатина (1.0 г, 0.8 ммоль) перемешивали в
доэтил)-2-ацетамидо-3,4,6-три-О-ацетил-2-де-
течение 15 мин в 40 мл 1 М раствора HCl и экстра-
зокси-β-D-галактозамин)карбоксиэтоксиме-
гировали аторвастатин в виде кислоты дихлорме-
тил]метан (6). К раствору активированного эфи-
таном (3 раза по 40 мл). Объединенные органиче-
ра 5 (73 мг, 0.09 ммоль) в 4 мл ТГФ в атмосфе-
ские вытяжки сушили над Na2SO4. Растворитель
ре аргона прибавляли триэтиламин
(54 мкл,
удаляли при пониженном давлении. Полученный
0.39 ммоль) и 1-O-(2'-аминоэтил)-2-ацетамидо-2-
остаток растворяли в 10 мл ацетона, прибавляли
дезокси-3,4,6-три-О-ацетил-β-D-галактопиранозу
к нему 2,2-диметоксипропан (2.5 мл, 20.0 ммоль)
(132 мг, 0.33 ммоль) и перемешивали в течение
и моногидрат пара-толуолсульфокислоты (0.02 г,
ночи. Растворитель удаляли при пониженном дав-
0.1 ммоль) и перемешивали 24 ч. После этого в
лении. Продукт очищали с помощью колоночной
реакционную смесь прибавляли триэтиламин
хроматографии (CH2Cl2-СН3OH, 30:1 по объему).
(0.075 мл, 0.5 ммоль) и удаляли растворитель при
Выход 92 мг (64%), белые кристаллы. Спектр ЯМР
пониженном давлении. К остатку прибавляли 5 мл
1Н (CD3OD), δ, м.д.: 1.95 с (9H), 1.96 с (9H), 2.03
ТГФ и 1 мл 1 М раствора NaOH, перемешивали в
с (9H), 2.15 с (9H), 2.40-2.51 м (6Н), 3.35-3.45 м
течение ночи. На следующий день к полученной
(6Н), 3.63-3.72 м (15Н), 3.82-3.88 м (5Н), 4.03-
смеси приливали 1.2 мл 1 М раствора HCl и уда-
4.06 м (3Н), 4.09-4.17 м (9Н), 4.59 д (3H, J 8.5 Гц),
ляли ТГФ при пониженном давлении. Для выде-
5.06 д.д (3H, J 11.2, 3.3 Гц), 5.35 д (3H, J 3.3 Гц).
ления продукта в индивидуальном виде проводи-
Спектр ЯМР 13C (CD3OD), δ, м.д: 20.7, 20.8, 20.9,
ли экстракцию в системе диэтиловый эфир-вода.
23.1, 37.5, 40.5, 51.6, 53.2, 61.5, 62.9, 68.3, 68.8,
Органическую фракцию сушили над Na2SO4,
69.5, 70.1, 72.0, 72.3, 103.0, 171.9, 172.2, 172.3,
растворитель удаляли при пониженном давлении.
173.7, 174.1, 174.2. Масс-спектр, m/z: 1537.6163
Выход 0.9 г (94%), белое кристаллическое веще-
[M + H]+. C63H97N10O34. M + H 1537.6179.
ство. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.87-
0.95 м (1Н), 1.18 с (3Н), 1.31 с (3Н), 1.37 д (6H, J
N-(2-Азидоэтаноил)амино-трис-{[1-(2-ами-
7.0 Гц), 1.36-1.42 м (1Н), 1.50-1.65 м (2Н), 2.26-
доэтил)-2-ацетамидо-2-дезокси-β-D-галактоз-
2.28 м (2Н), 3.22 квинтет (1Н, J 7.0 Гц), 3.74-3.82 м
амин]карбоксиэтоксиметил}метан
(7). Соеди-
(2Н), 3.90-3.97 м (1Н), 4.11-4.17 м (1Н), 6.96-7.02
нение 6 (70 мг, 0.04 ммоль) растворяли в 0.2 М
м (2Н), 7.06-7.10 м (4Н), 7.17-7.28 м (6Н), 7.51 д
растворе метилата натрия в метаноле
(2 мл,
(2H, J 8.1 Гц), 9.81 с (1Н), 12.20 уш.с (1Н). Спектр
0.37 ммоль). Перемешивали в течение 3 ч, затем
ЯМР 1H соответствует литературным данным [16].
прибавляли Dowex 50W-X8 H+ до тех пор, пока
не получали значение pH 6.0, отфильтровыва-
Проп-2-ин-1-ил-2-[(4R,6R)-6-{2-[2-(4-фтор-
ли ионобменную смолу, промывали метанолом.
фенил)-5-изопропил-3-фенил-4-(фенилкарба-
Удаляли растворитель при пониженном давлении.
моил)-1H-пиррол-1-ил]этил}-2,2-диметил-1,3-
Выход 48 мг (92%), белый аморфный порошок.
диоксан-4-ил]ацетат (9). К раствору соединения 8
Спектр ЯМР 1Н (CD3OD), δ, м.д.: 2.00 с (9H), 2.46
(600 мг, 1.0 ммоль) в 10 мл дихлорметана при-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
СИНТЕЗ И ИНГИБИРУЮЩАЯ АКТИВНОСТЬ КОНЪЮГАТА АТОРВАСТАТИНА
225
бавляли EDC (383 мг, 2.0 ммоль), DMAP (60 мг,
Спектр ЯМР 13C (ДМСО-d6), δ, м.д: 19.6, 22.2,
0.5 ммоль) и пропаргиловый спирт (190 мкл,
22.4, 23.1, 25.6, 29.7, 35.8, 35.9, 37.8, 40.5, 51.9,
3.2 ммоль). Перемешивали реакционную смесь в
52.0, 60.2, 60.5, 63.1, 65.4, 65.8, 66.8, 67.4, 67.5,
течение суток. Продукт выделяли с помощью ко-
68.1, 71.7, 72.5, 75.4, 98.2, 101.4, 115.4 д (2JCF
лоночной хроматографии (Hex-EtOAc, 1:1 по объ-
21.0 Гц), 117.5, 119.4, 120.6, 125.4, 126.4, 127.3,
ему). Выход 545 мг (86%), белое кристаллическое
127.7, 128.5, 128.8 д (4JCF 3.5 Гц), 129.1, 133.5 д
соединение. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
(3JCF 8.1 Гц), 134.3, 134.8, 135.9, 139.5, 141.4, 161.7
0.91-1.00 м (1Н), 1.16 с (3H), 1.31 c (3H), 1.36 д
д (1JCF 245.7 Гц), 166.1, 169.87, 169.90, 170.3,
(6Н, J 7.0 Гц), 1.36-1.41 м (1Н), 1.51-1.62 м (2Н),
170.4. Масс-спектр, m/z:
898.4168
[M + 2H]2+.
2.36 д.д (1Н, J 15.8, 7.0 Гц), 2.45-2.50 м (1Н), 3.18-
C84H121FN12O30. M + 2H 898.4142.
3.25 м (1Н), 3.55 т (1Н, J 2.5 Гц), 3.73-3.81 м (2Н),
Растворимость в воде. Для построения граду-
3.89-3.96 м (2Н), 4.14-4.20 м (1Н), 4.66 д.д (1Н, J
ировочной прямой готовили растворы конъюга-
15.8, 2.5 Гц), 4.71 д.д (1Н, J 15.8, 2.5 Гц), 6.95-7.02
та 10 и кальциевой соли аторвастатина в концен-
м (2Н), 7.06-7.10 м (4Н), 7.18-7.27 м (6Н), 7.51 д
трации 1 мг/мл, из которых последовательным
(1Н, J 7.7 Гц), 9.82 с (1H). Спектр ЯМР 19F{1H}
разбавлением в метаноле получали растворы
(ДМСО-d6), δ, м.д:
-114.1. Спектр ЯМР
13C
следующих концентраций: 0.1, 0.05, 0.03, 0.02,
(ДМСО-d6), δ, м.д: 19.6, 22.1, 22.4, 25.6, 29.7, 35.1,
0.01 мг/мл. Регистрировали оптическую плот-
37.7, 40.3, 51.6, 65.3, 65.8, 77.6, 78.4, 98.1, 115.4
ность полученных растворов на длине волны 290
д (2JCF 21.4 Гц), 117.4, 119.4, 120.6, 123.0, 125.4,
нм. Рассчитанные коэффициенты пропорциональ-
127.3, 127.7, 128.4, 128.3 д (4JCF 2.9 Гц), 129.1,
ности линейной функции представлены в табли-
133.4 д (3JCF 8.1 Гц), 134.8, 135.9, 139.4, 161.7 д
це. Далее определяли концентрацию веществ в
(1JCF 245.1 Гц), 166.1, 169.6. Масс-спектр, m/z:
их насыщенных растворах. Для этого конъюгат 10
637.3072 [M + H]+. C39H41FN2O5. M + H 637.3074.
или кальциевую соль аторвастатина, взятые в из-
Конъюгат 10. К раствору азида
7
(50 мг,
бытке, перемешивали в течение 15 мин в 1 мл
0.04 ммоль) в 3 мл ДМФА прибавляли соедине-
воды. После этого нерастворившийся остаток от-
ние 9 (24 мг, 0.04 ммоль). Полученную смесь де-
деляли центрифугированием, отбирали 50 мкл
газировали, после чего прибавляли йодид меди(I)
насыщенного водного раствора и прибавляли к
(4 мг,
0.02 ммоль) и триэтиламин
(8 мкл,
950 мкл метанола. В случае конъюгата 10 получен-
0.06 ммоль). Перемешивали реакционную смесь
ный таким образом раствор дополнительно раз-
в течение 48 ч в атмосфере аргона, после чего при-
бавляли в 10 раз метанолом. Для тест-растворов
бавляли дигидрат динатриевой соли ЭДТА (7 мг,
измеряли оптическую плотность и рассчитывали
0.02 ммоль) и продолжали перемешивание еще в
исходные концентрации насыщенных растворов
течение 30 мин. Растворитель удаляли при пони-
веществ по построенным градуировочным пря-
женном давлении. Продукт очищали с помощью
мым.
обращенно-фазовой хроматографии на препара-
тивном хроматографе (подвижная фаза А - вода,
Ингибирующая активность. Активность
B - ацетонитрил, градиент 95:5 → 40:60, А:B по
ГМГ-КоА-редуктазы измеряли с помощью набора
объему). Выход 14 мг (21%), белое кристалличе-
реактивов HMG-CoA Reductase Assay Kit (Merck)
ское вещество. Спектр ЯМР 1Н (СD3OD), δ, м.д.:
в соответствии со стандартным протоколом, пред-
0.93-1.02 м (1Н), 1.23 с (3H), 1.34 c (3H), 1.35-
ложенным производителем. Раствор правастатина
1.39 м (1Н), 1.36 д.д (6Н, J 7.0, 2.1 Гц), 1.59-1.66
с концентрацией 0.1 мМ входил в состав набора
м (2Н), 1.99 c (9H), 2.40-2.48 м (8Н), 3.33-3.37
реактивов, раствор конъюгата 10 с той же концен-
м (3Н), 3.41-3.47 м (3Н), 3.49-3.53 м (4Н), 3.57-
трацией готовили методом 100-кратного разбавле-
3.61 м (3Н), 3.64-3.90 м (29Н), 3.94-3.99 м (3Н),
ния водой 0.01 М раствора конъюгата 10 в ДМСО.
4.02-4.10 м (1Н), 4.22-4.30 м (1Н), 4.39 д (1Н, J
В случае эксперимента с предварительным ги-
8.4 Гц), 5.15-5.27 м (4Н), 7.02-7.14 м (8Н), 7.20-
дролизом 100 мкл 0.01 М раствора конъюгата 10
7.25 м (4Н), 7.30 д (2Н, J 7.7 Гц), 8.08 c (1H).
в ДМСО разбавляли 900 мкл буферного раствора
Спектр ЯМР 19F{1H} (ДМСО-d6), δ, м.д: -114.1.
(0.1 М цитрата натрия + 0.2 М Na2HPO4, pH 4.5)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
226
МАКЛАКОВА и др.
и выдерживали данную смесь в течение 15 мин.
Михайловичу, к.х.н. Горбунову Александру Ни-
Далее отбирали 100 мкл этой смеси и прибавля-
колаевичу, к.х.н. Петрову Ростиславу Алексан-
ли 900 мкл воды, в результате получали 0.1 мМ
дровичу, д.х.н. Ульяновскому Николаю Вале-
раствор конъюгата 10. Эксперимент проводили в
рьевичу за проведение исследований физико-хи-
96-луночном планшете по 3 повтора для каждого
мических свойств полученных в работе соедине-
образца. После добавления реагентов в порядке,
ний и помощь в интерпретации результатов.
рекомендованном производителем, регистрирова-
ФОНДОВАЯ ПОДДЕРЖКА
ли относительную оптическую плотность при 340
нм каждые 20 с до достижения 10 мин. Активность
Исследование выполнено за счет гранта
Российского научного фонда (проект № 20-73-
ГМГ-КоА-редуктазы рассчитывали по уравнению:
00219).
(¨Ⱥ340 ɦɢɧɨɛɪɚɡɟɰ - ¨Ⱥ340 ɦɢɧɮɨɧ)ÂTV
ȿɞ ɦɝ
ИНФОРМАЦИЯ ОБ АВТОРАХ
12.44ÂVÂ ÂLP
Маклакова Светлана Юрьевна, ORCID: https://
где 12.44 - коэффициент экстинкции NADPH при
orcid.org/0000-0001-5290-9353
340 нм; TV - общий объем реакции, мл (в дан-
ном случае 0.2 мл); V - объем используемого в
анализе раствора фермента, мл (в данном случае
orcid.org/0000-0001-6979-1224
0.012 мл); 0.6 - концентрацияфермента, мг белка/мл;
Лопухов Антон Владимирович, ORCID: https://
LP - длина светового пути, см (в данном случае
orcid.org/0000-0002-3517-505X
0.55 см); Ед/мг - активность фермента в единицах
активности на мг белка.
Гибадуллина Карина Ринатовна, ORCID: https://
orcid.org/0000-0002-9432-3366
ЗАКЛЮЧЕНИЕ
Впервые получен конъюгат аторвастатина и
orcid.org/0000-0002-9357-8236
лиганда асиалогликопротеинового рецептора с 3
остатками N-ацетилгалактозамина. Показано, что
Мажуга Александр Георгиевич, ORCID: https://
дополнение структуры аторвастатина выбранным
orcid.org/0000-0002-5184-5551
тривалентным лигандом ASGPR приводит к зна-
Белоглазкина Елена Кимовна, ORCID: https://
чительному увеличению растворимости препарата
orcid.org/0000-0001-6796-8241
в воде. Для синтезированного конъюгата измерен-
ная концентрация насыщенного водного раствора
КОНФЛИКТ ИНТЕРЕСОВ
составила 6.1±0.9 мМ, что почти в 60 раз превосхо-
Авторы заявляют об отсутствии конфликта ин-
дит данный показатель для немодифицированного
тересов.
аторвастатина. Высокая гидрофильность и нали-
СПИСОК ЛИТЕРАТУРЫ
чие адресного фрагмента позволяют с большой ве-
роятностью предполагать, что полученный конъю-
1. Рациональная фармакотерапия сердечно-сосуди-
гат будет выгодно отличаться от исходного статина
стых заболеваний. Ред. Е.И. Чазов, Ю.А. Карпов.
своей селективностью в отношении паренхимных
М.: Литтерра. 2016.
клеток печени, причем мультивалентность лиган-
2. Vardanyan R., Hruby V. Synthesis of Best-seller Drugs.
да значительно увеличивает способность конъюга-
London-San Diego-Cambridge-Oxford: Academic
тов проникать в гепатоциты, как было продемон-
Press. 2016, 286-293.
стрировано ранее. Кроме того, в экспериментах по
3. Bratton L.D., Auerbach B., Choi C., Dillon L.,
ингибированию ГМГ-КоА-редуктазы установле-
Hanselman J.C., Larsen S.D., Lu G., Olsen K., Pfe-
но, что синтезированное соединение 10 способно
fferkorn J.A., Robertson A., Sekerke C., Trivedi B.K.,
высвобождать аторвастатин в активной форме.
Unangst P.C. Bioorg. Med. Chem. 2007, 15, 5576-
5589. doi 10.1016/j.bmc.2007.05.031
БЛАГОДАРНОСТИ
4. Rageh A.H., Atia N.N., Abdel-Rahman H.M. J.
Авторы выражают благодарность Белоглазки-
Pharm. Biomed. Anal. 2017, 142, 7-14. doi 10.1016/
ну Андрею Александровичу, к.х.н. Вацуро Ивану
j.jpba.2017.04.037
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
СИНТЕЗ И ИНГИБИРУЮЩАЯ АКТИВНОСТЬ КОНЪЮГАТА АТОРВАСТАТИНА
227
5. Roth B.D., Bocan T.M.A., Blankley C.J., Chucholows-
12. Manoharan M., Rajeev K., Nair J., Maier M. Европ.
ki A.W., Creger P.L., Creswell M.W., Ferguson E.,
заявка EP 3156077. 2022.
Newton R.S., O’Brien P. J. Med. Chem. 1991, 34, 463-
13. Vickers S., Duncan C.A., Chen I.W., Rosegay A.,
466. doi 10.1021/jm00105a071
Duggan D.E. Drug Metab. Dispos. 1990, 18, 138-145.
6. Zhang Y., Zhang X., Zeng C., Li B., Zhang C., Li W.,
14. Vickers S., Duncan C.A., Vyas K.P., Kari P.H., Ari-
Hou X., Dong Y. Bioorg. Med. Chem. 2019, 27, 2187-
son B., Prakash S.R., Ramjit H.G., Pitzenberger S.M.,
2191. doi 10.1016/j.bmc.2019.04.019
Stokker G., Duggan D.E. Drug Metab. Dispos. 1990,
7. D’Souza A.A., Devarajan P.V. J. Control. Rel. 2015,
18, 476-483.
203, 126-139. doi 10.1016/j.jconrel.2015.02.022
15. Petrov R.A., Mefedova S.R., Yamansarov E.Y., Mak-
8. Wang Q., Huang C., Jiang M., Zhu Y., Wang J., Chen J.,
lakova S.Y., Grishin D.A., Lopatukhina E.V., Bureni-
Shi J. Spectrochim. Acta A: Mol. Biomol. Spectroscopy.
2016, 156, 155-163. doi 10.1016/j.saa.2015.12.003
na O.Y., Lopukhov A.V., Kovalev S.V., Timchen-
ko R.V., Ondar E.E., Ivanenkov Y.A., Evteev S.A.,
9. Galiullina L.F., Scheidt H.A., Huster D., Aganov A.,
Vaneev A.N., Timoshenko R.V., Klyachko N.L.,
Klochkov V. Biochim. Biophys. Acta - Biomembr. 2019,
1861, 584-593. doi 10.1016/j.bbamem.2018.12.013
Erofeev A.S., Gorelkin P.V., Beloglazkina E.K., Ma-
jouga A.G. Mol. Pharmaceutics. 2021, 18, 461-468.
10. Huang X., Leroux J.-C., Castanger B. Bioconjuga-
doi 10.1021/acs.molpharmaceut.0c00980
te Chem.
2017,
28,
283-295. doi
10.1021/
acs.bioconjchem.6b00651
16. Mizoi K., Takahashi M., Haba M., Hosokawa M.
11. Cardona C.M., Gawley R.E. J. Org. Chem. 2002, 67,
Bioorg. Med. Chem. Lett. 2016, 26, 921-923. doi
1411-1413. doi 10.1021/jo0161678
10.1016/j.bmcl.2015.12.069
Synthesis and Inhibitory Activity of Atorvastatin Conjugate
with a Branched Asialoglycoprotein Receptor Ligand
with 3 N-Acetyl-D-galactosamine Residues
S. Yu. Maklakovaa, *, M. P. Mazhugaa, A. V. Lopukhova, K. R. Gibadullinaa, N. L. Klyachkoa,
A. G. Majougaa, b, and E. K. Beloglazkinaa
a Department of Chemistry, Lomonosov Moscow State University, Leninskie Gory, 1/3, Moscow, 119991 Russia
b Dmitry Mendeleev University of Chemical Technology of Russia, Miusskaya pl., 9, Moscow, 125047 Russia
*e-mail: MaklakovaSU@yandex.ru
Received March 30, 2022; revised April 10, 2022; accepted April 13, 2022
The novel atorvastatin conjugate was synthesized in a multi-step procedure using branched N-acetylgalac-
tosamine ligand for asialoglycoprotein receptor targeting. The molar solubility of the obtained conjugate was
6.1±0.9 mM, which is almost 60 times higher than that of unmodified atorvastatin. The hydrolysis products of
the conjugate demonstrated effective inhibition of 3-hydroxy-3-methyl-glutaryl-coenzyme A reductase.
Keywords: atorvastatin, N-acetyl-D-galactosamine, targeted drug delivery, asialoglycoprotein receptor
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023