ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 2, с. 228-236
УДК 547.717; 542.97
ПЕРВЫЙ ПРИМЕР CИНТЕЗА НОВОГО КЛАССА
СПИРОБОРАКАРБОЦИКЛОВ РЕАКЦИЕЙ
ЦИКЛОБОРИРОВАНИЯ МЕТИЛЕНЦИКЛОАЛКАНОВ
С ПОМОЩЬЮ PhBCl2, КАТАЛИЗИРУЕМОЙ Cp2TiCl2
© 2023 г. Л. И. Тулябаева*, Р. Р. Салахутдинов, Т. В. Тюмкина,
А. Р. Тулябаев, У. М. Джемилев
Институт нефтехимии и катализа РАН- обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
Россия, 450075 Уфа, просп. Октября, 141
*e-mail: khusainova_ink@mail.ru
Поступила в редакцию 13.04.2022 г.
После доработки 22.04.2022 г.
Принята к публикации 23.04.2022 г.
Впервые осуществлено циклоборирование метиленциклоалканов с помощью PhBCl2 в присутствии
катализатора Cp2TiCl2 с получением ранее неописанных спироборакарбоциклов с выходами 70-80%.
Структура и свойства спиросочлененных бориранов изучены с помощью ЯМР 11В, 1H, 13C спектроме-
трии и DOSY экспериментов. Показано, что 1-фенилзамещенные бораспираны стабильны в растворе
при комнатной температуре в течение суток.
Ключевые слова: спироборакарбоциклы, циклоборирование, метиленциклоалканы, PhBCl2, катализа-
тор, Cp2TiCl2
DOI: 10.31857/S0514749223020088, EDN: QJSYEG
ВВЕДЕНИЕ
нами осуществлен синтез малоизученных 1,2-ди-
замещенных бориранов 2, 3 - 1-хлор(фтор)- и
Недавно нами разработан эффективный ката-
1-алкил-2-замещенных бориранов [2-4] (схема 2).
литический метод синтеза трехчленных цикличе-
Обнаруженная нами каталитическая система
ских борорганических соединений - 1-фенил-2-за-
Cp2TiCl2/Mg в настоящее время является един-
мещенных бориранов 1, основанный на реакции
ственной системой, позволяющей осуществлять
циклоборирования α-олефинов с PhBCl2 под дей-
ствием катализатора Cp2TiCl2 в присутствии Mg
каталитический синтез трехчленных борацикла-
(акцептор галоген-ионов) [1] (схема 1).
нов [5].
При использовании в качестве борных реаген-
Использование металлокомплексного катали-
тов галогенидов бора или алкилдихлорборанов
затора Cp2TiCl2 позволило расширить арсенал
Схема 1
Cp2TiCl2
ɦɨɥ
Mg, Et2O
B
R
R CH2 + PhBCl2
1
R = Alk, Ar, Bn.
228
ПЕРВЫЙ ПРИМЕР CИНТЕЗА НОВОГО КЛАССА СПИРОБОР
АКАРБОЦИКЛОВ
229
Схема 2
R
BX3
AlkBCl2
R
>7L@
ɦɨɥ
0J
>7L@
ɦɨɥ
0J
B
R CH2
B
40-85%
40-80%
X
Alk
2
3
[Ti] = Cp2TiCl2; R = Alkyl, Aryl; X = F, Cl; Alkyl = ɧ-Pent, ɧ-Hex.
немногочисленных методов, позволяющих в одну
карбоциклов 6 и спиродибораоксакарбоциклов 7
препаративную стадию синтезировать малые ци-
[14-17]. Известные примеры синтеза основаны на
клы с атомом бора [5]. Опираясь на разработанную
реакции [2+2]-циклоприсоединения борандиилбо-
нами реакцию циклоборирования α-олефинов,
риранов 5 к ацетиленам [14] или ацетону [15] при
катализируемую Cp2TiCl2, мы выдвинули идею
низких температурах (схема 4).
о возможности построения спиросочлененных с
Cпиросочлененные борираны 6, 7 нестабильны
циклоалканами бориранов 4 на основе метилиден-
и идентифицированы лишь методом ЯМР при от-
циклоалканов и галогенидов бора под действием
рицательных температурах. Например, 2,3,5,6-те-
Cp2TiCl2 по схеме 3. Важно отметить, что разра-
траметилфенилзамещенный бораспиран 8 в усло-
ботанные для синтеза бориранов методы и подхо-
виях данной реакции при комнатной температуре
ды (метод фотоизомеризации N,C-хелатированных
взаимодействует с избытком ацетилена с образо-
органоборанов [6-9], метод двойного гидробори-
ванием
1,4-дибораспиро[2.5]окта-5,7-диена
9 в
рования ацетиленов с помощью имидазол-2-или-
результате расширения
4-хчленного фрагмента
денборанов
[10-11],
[2+1]-циклоприсоединение
[18] (схема 5). Наличие непрочной связи В1-С3 бо-
непредельных соединений к бориленам, генериру-
емым из стабилизированных карбенами дихлорбо-
распирана 9 способствует его перегруппировке в
ранов [12-13]) не позволяют получать борацикла-
растворе при комнатной температуре в изомерный
ны спиранового строения.
2,7-диборабицикло[4.2.0]окта-4,6-диен 10, иден-
тифицированный методом РСА.
Анализ литературных данных показал, что спи-
роборакарбоциклы являются достаточно редкими
Позднее методом
[2+2]-циклоприсоединения
соединениями. Нами обнаружено лишь несколько
метиленборанов к ацетиленам [16, 17] или 1,1-ди-
публикаций, касающихся синтеза спиродибора-
этоксэтилену [19] получены четырехчленные бо-
Схема 3
Cp2TiCl2, Mg, THF
+ RBX2
B
H2C
R
4
R = Hal, Alk, Ar; X = Hal.
Схема 4
SiMe3
Me
t-Bu
R1
R2
R1
Me
B
Me3Si
SiMe
3
ɉɟɧɬɚɧ -60÷-20°C
B
Me2CO, -60°C
O
1
B
R
t-Bu
B
B
R2
Me3Si
Me3Si
B
Bu-t
SiMe
3
Bu-t
R3
6
5
7
R1 = CMe3 'XU 'XU
ɬɟɬɪɚɦɟɬɢɥɮɟɧɢɥ
52, R3 = Me, CMe3, Ph.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
230
ТУЛЯБАЕВА и др.
Схема 5
SiMe3
SiMe3
Dur
Dur
Dur
1
H
SiMe
3
B
B
SiMe3
SiMe3
B
-30°C
H
SiMe3
B
Dur
Dur
Me3Si
Dur
B
B
3
SiMe3
Me3Si
SiMe
3
SiMe3
8
9
SiMe3
Me3Si
ɉɟɪɟɝɪɭɩɩɢɪɨɜɤɚ
Dur
B
Dur
B
Me3Si
SiMe3
10
рацикланы, спиросочлененные с флуоренильным
первоначально анализировали реакционный рас-
фрагментом.
твор сразу после взаимодействия метиленцикло-
гексана с PhBCl2 в присутствии Cp2TiCl2 и Mg
В рамках наших регулярных исследований [5]
(после цинтрифугирования и отделения твердых
по изучению реакции циклоборирования непре-
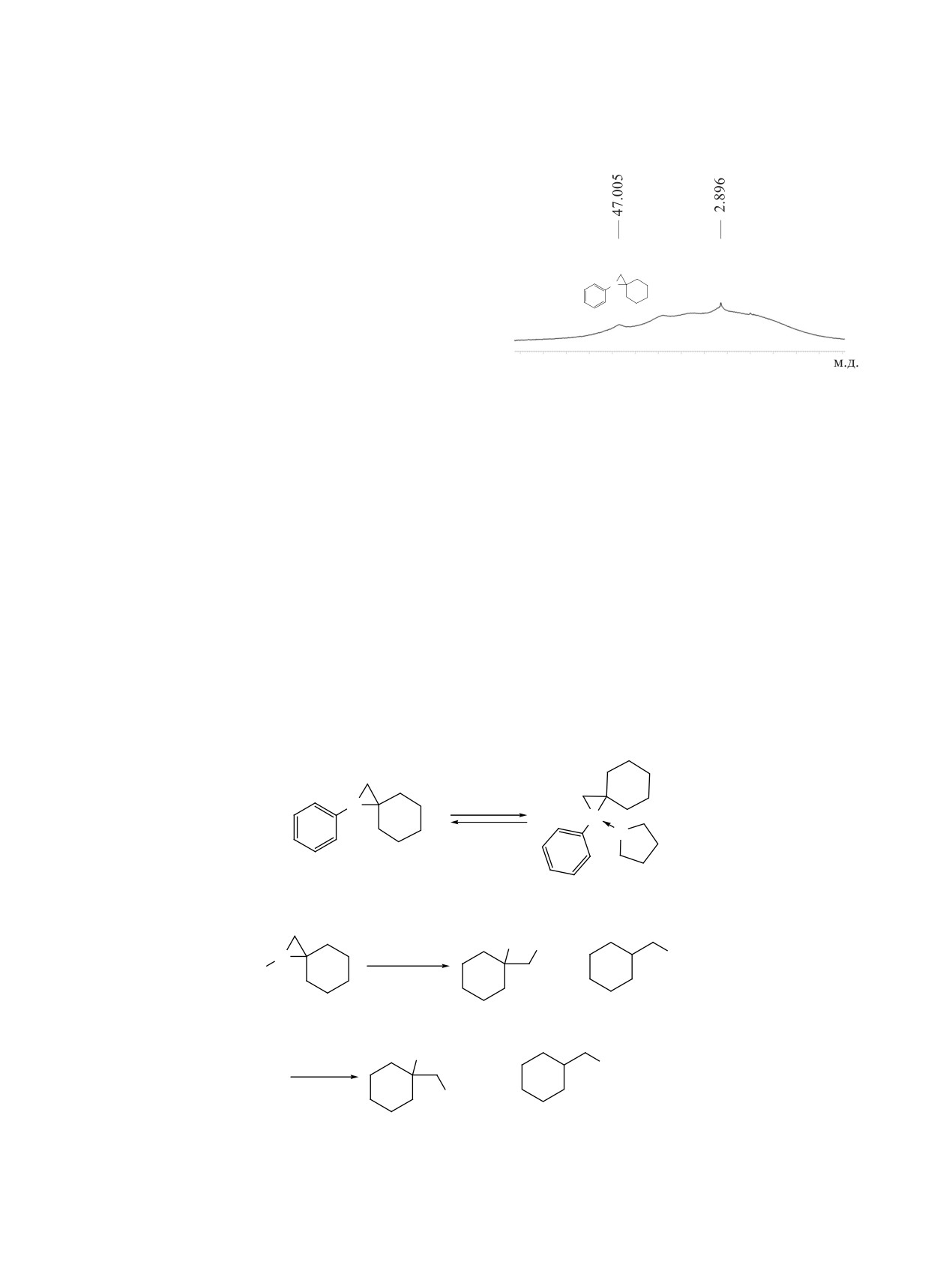
частиц) методом ЯМР 11В спектроскопии (рис. 1).
дельных соединений с использованием каталити-
Сигнал δВ 47.00 м.д. в спектре ЯМР 11В (ТГФ) в
ческой системы Cp2TiCl2/Mg мы расширили наше
области трехкоординированных соединений бора
исследование до напряженных метиленциклоал-
канов. Мы предположили, что использование в
мы отнесли к продукту реакции (бораспирану 11а)
условиях реакции каталитического циклобориро-
(схема 6). Наряду с ним зафиксирован сигнал при
вания в качестве мономеров метиленциклоалка-
δВ 2.89 м.д., соответствующий комплексу соеди-
нов позволит получать спироборираны, в которых
нения 11a с молекулой ТГФ (11a·ТГФ), который
циклоалкан связан с трехчленным борирановым
образуется за счет сольватации атома бора спиро-
фрагментом через спироуглеродный атом.
борирана с молекулой ТГФ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Свободный 1-фенил-1-бораспиран 11a находит-
ся в равновесии с комплексом 11a·ТГФ в растворе
Для разработки эффективного метода синтеза
(схема 7). Ранее нами было установлено, что 1-фе-
новых классов спироборакарбоциклов мы впервые
нил-2-гексилбориран (δВ 30.29 м.д.), полученный
исследовали взаимодействие метиленциклоалка-
циклоборированием окт-1-ена с помощью PhBCl2,
нов (метиленциклогексана, метиленциклооктана
и метиленциклододекана) с PhBCl2 под действием
образует аналогичный комплекс (δВ 2.84 м.д.) в
Cp2TiCl2 в условиях (мономер: PhBCl2-Cp2TiCl2-
растворе ТГФ [1].
Mg = 1-1-1-0.2-1, ТГФ, 20-22°С, 8 ч) (схема 6).
Сигнал исходного PhBCl2 (δВ 55.50 м.д.) полно-
Для получения первой информации о прохож-
стью исчез, а сигнал в области 28 м.д. мы отнесли
дении реакции, количестве продуктов реакции
к продукту разложения гигроскопичного фенил-
и конверсии исходного фенилдихлорборана мы
дихлорборана [20].
Схема 6
Cp2TiCl2
ɦɨɥ
CH2
0J ɌȽɎ
B
+ PhBCl2
(
)n
(
)n
11a-c
n = 1 (a
b
c
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
ПЕРВЫЙ ПРИМЕР CИНТЕЗА НОВОГО КЛАССА СПИРОБОР
АКАРБОЦИКЛОВ
231
Методом ЯМР 11В, 13С и 1Н спектроскопии мы
анализировали 1-фенил-1-бораспиро[2.5]октан 11а
после центрифугирования реакционного рас-
твора, отделения твердых частиц и упаривания
растворителя. Спектр ЯМР 11В соединения 11а
содержит уширенный сигнал при δВ 45.17 м.д.
(W½ 360 Гц, CDCl3). В спектре ЯМР 13С выделен-
11aÂɌȽɎ
B
ного соединения содержится всего три сигнала в
11a
низкочастотной области, характерных для цикло-
гексанового кольца (δС 25.86, 26.71 и 29.70 м.д.)
и сигналы Ph-B фрагмента (δС 127.98, 132.70,
90 80 70 60 50 40 30 20 10
0 -10-20-30-40
135.64 м.д.). Сигналы атомов углерода и водорода
Рис. 1. Спектр ЯМР 11B реакционной массы после вза-
имодействия метиленциклогексана с PhBCl2 в присут-
в спектрах ЯМР 13С и 1Н группы CH2-B-С(CH2)
ствии Cp2TiCl2/Mg (128.33 МГц, ТГФ-d8, 298 K)
(CH2), а также B-CPh непосредственно связан-
ных с квадрупольным атомом бора или удален-
Для доказательства структуры бораспирана
ных от него на 2-3 химические связи, не могут
11а мы использовали методику [1] окисления с
быть зафиксированы в шкале времени ЯМР, что
помощью NaOH/H2O2 с целью получения спир-
обусловлено спин-спиновым взаимодействи-
тов (схема 8). Образование в результате окисле-
ем углерод-бор, величиной этого спин-спино-
ния спироборирана 11а щелочной перекисью во-
вого взаимодействия и скоростью квадруполь-
дорода соответствующего диола 12 и моноола 13
ной релаксации ядер бора 11В при комнатной
дополнительно подтверждало образование новых
температуре [20]. При более низких темпера-
В-С связей. Для идентифицкации спиртов 12 и 13
турах спектры ЯМР 1Н и 13С еще менее инфор-
методом масс-спектрометрии мы превращали их
мативны из-за сильного уширения всех сиг-
в триметилсилильные эфиры 14 и 15 обработкой
налов. В двумерных экспериментах (HSQC,
бис(триметилсилил)ацетамидом (BSA) [21, 22].
HMBC) эти сигналы также не детектируются
Для диэфира 14 обнаружен характерный пик фраг-
(схема 1).
ментарного иона m/z 274, а для эфира 15 - m/z 171,
Схема 7
B
ɌȽɎ
B
O
11a
11aÂɌȽɎ
Схема 8
, OH-
H2O2
OH OH
& ɱ
B
OH
Ph
+
11a
12
13
OSiMe3
BSA
OSiMe3
+
OSiMe3
14
15
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
232
ТУЛЯБАЕВА и др.
11a
80
60
40
20
0
-20
ɦɞ
Рис. 2. ЯМР 11B спектроскопия 1-фенил-1-бораспирана 11a в процессе его деструкции в течение 3 дней (128.33МГц,
ТГФ-d8, 298 K)
образующиеся при отрыве метильной группы от
ринг спироборакарбоцикла 11а методом ЯМР 11В
соответствующих молекул эфиров.
(рис. 2) показал появление новых сигналов при δВ
49.60, 28.27 м.д., которые мы отнесли к продуктам
Полученные спектральные данные ЯМР 1H,
деструкции. Согласно литературным данным сое-
13C, 11B соединения 11а, а также продуктов окис-
динения бора в результате процессов автоокисле-
ления позволили сделать вывод, что при взаимо-
ния [24] за счет следов кислорода инертного газа
действии метиленциклогексана с PhBCl2 в тетра-
или молекулы тетрагидрофурана [25-27] транс-
гидрофуране под действием катализатора Cp2TiCl2
формируются.
образуется
1-фенил-1-бораспиро[2.5]октан
11а.
Образование спироборакарбоциклов
11b, c
Соответствующую картину деструкции соеди-
(схема 6) с использованием в качестве мономе-
нения 11а мы наблюдали во время мониторинга
ров метиленциклооктана и метиленциклододе-
методом ЯМР 13С. Так, в спектре ЯМР 13С появ-
кана подтверждало общий характер реакции.
ляются новые сигналы углеродных атомов [δС
33.3 (уш., CH2B), 35.1 (CHCH2B) м.д.] и [δС 68.53
Эксперименты показали, что бораспирокарбо-
(CH2ОB), 39.40 (CHCH2ОB) м.д.], соответству-
циклы 11а-c термически неустойчивы, поскольку
ющие продуктам деструкции бораспирана 11а,
во время выделения методом вакуумной перегон-
предполагаемые структуры которых изображены
ки при нагревании мы идентифицировали наряду
на схеме 9.
с целевым бораспиранов смесь борорганических
продуктов. Последние, вероятно, образуются в ре-
И, действительно, после обработки реакцион-
зультате раскрытия напряженного бориранового
ной массы, содержащей смесь продуктов деструк-
цикла, а также процесса деборирования, характер-
ции 16 и 17, перекисью водорода в щелочной среде
ных для трехчленных борсодержащих цикличе-
мы получали спирт 13 (схема 9).
ских систем [6, 7, 23].
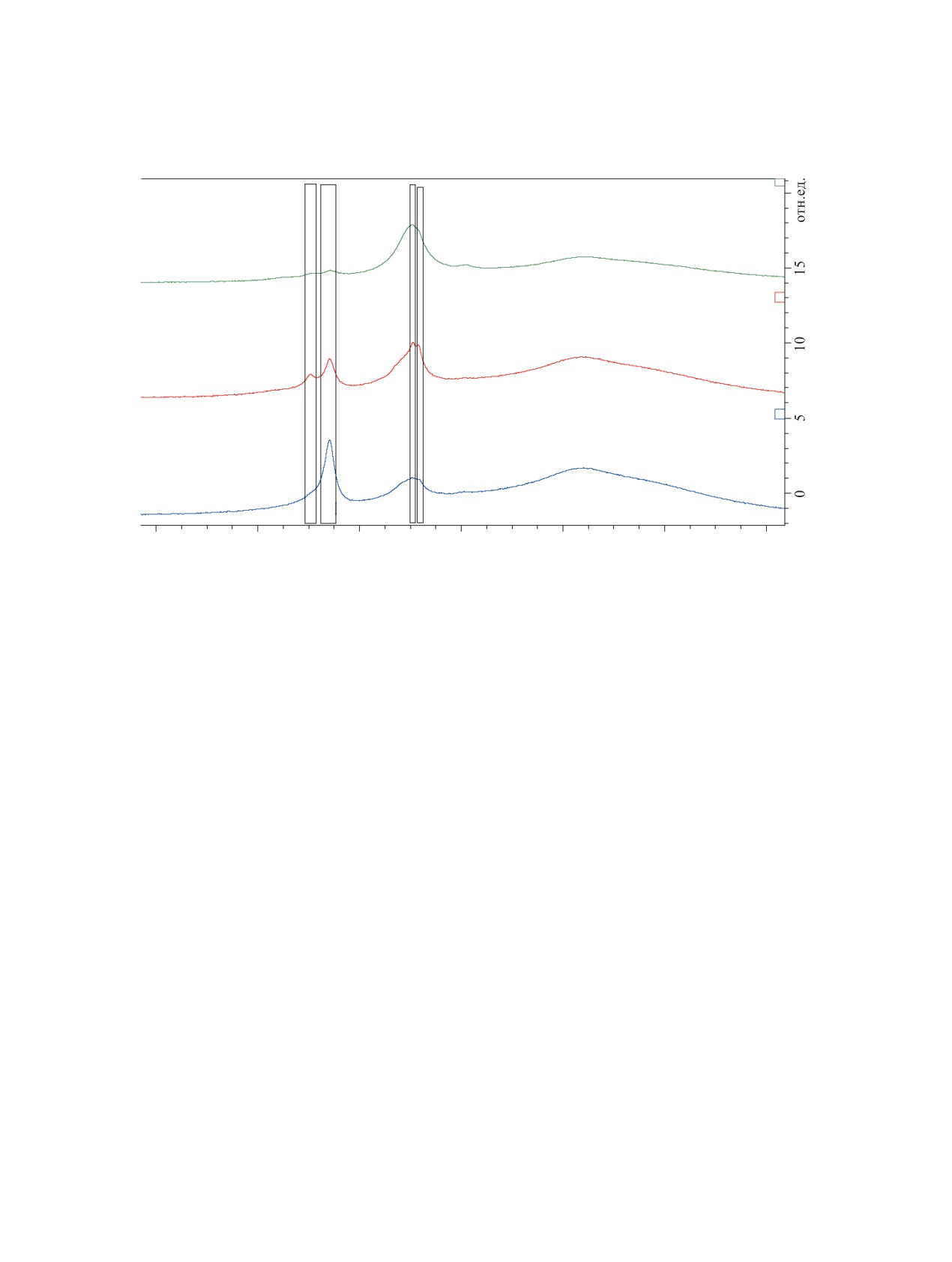
Для дополнительного подтверждения структу-
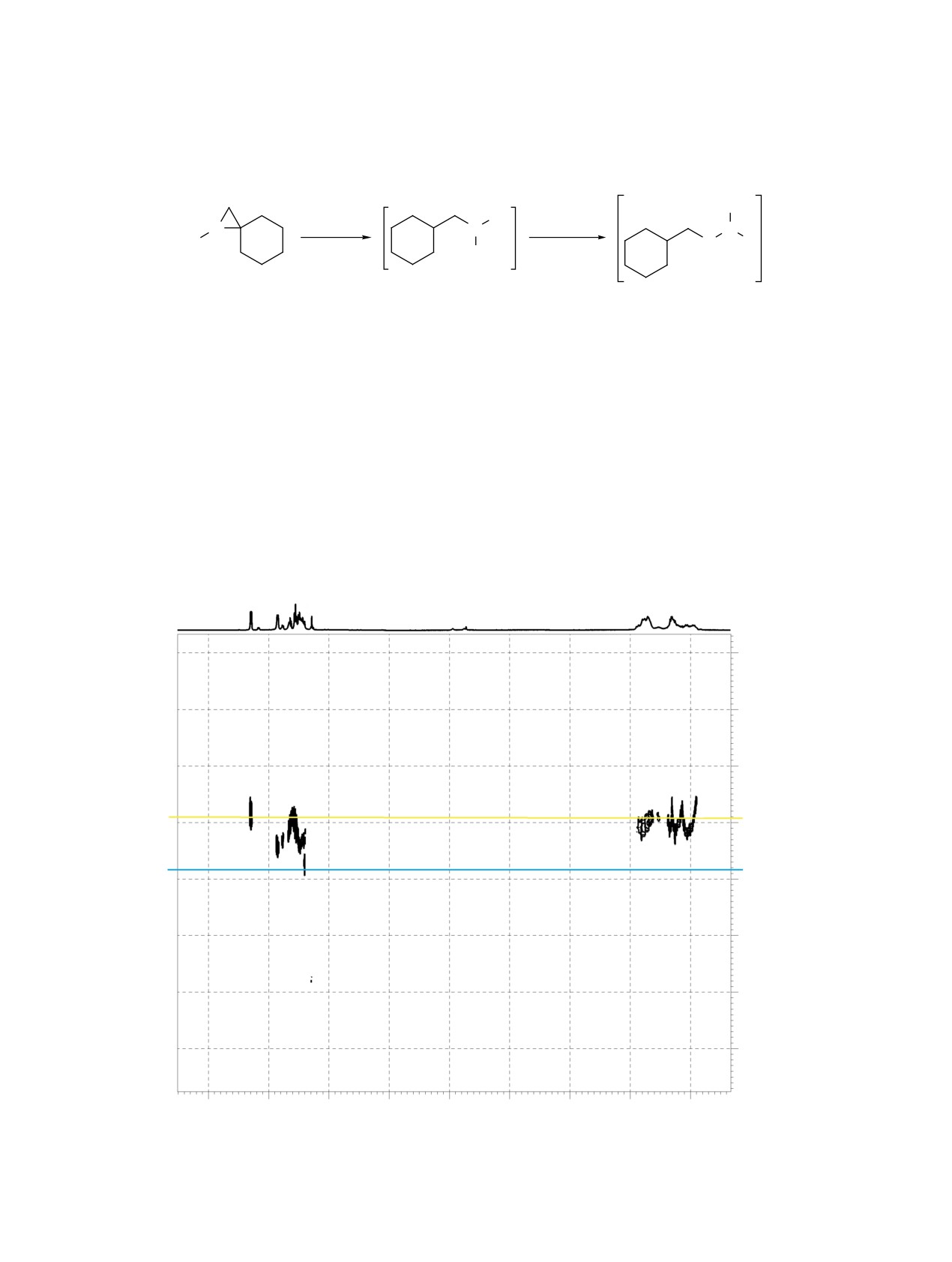
Также нами обнаружено, что при стоянии 11а-с
ры бораспирана мы провели DOSY эксперимент
в течение нескольких дней спектральные харак-
для свежеприготовленного образца 11b (рис. 3).
теристики изменяются. Действительно, монито-
DOSY эксперимент показал, что сигналы прото-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
ПЕРВЫЙ ПРИМЕР CИНТЕЗА НОВОГО КЛАССА СПИРОБОР
АКАРБОЦИКЛОВ
233
Схема 9
ɉɪɢ ɫɬɨɹɧɢɢ ɜ ɪɟɚɤɰɢɨɧɧɨɦ ɪɚɫɬɜɨɪɟ
Ph
Ph
HX
[O]
B
B
B
Ph
O
X
X
11a
16
17
;
2+ &O ɢɥɢ +
нов циклооктильного и ароматического фрагмен-
тами 400.13 (1H), 100.62 (13C), 128.33 (11B) МГц,
тов принадлежат одному соединению.
растворитель - CDCl3. При регистрации спектров
ЯМР 1Н и 13С в качестве внутреннего стандарта
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
использовали Me4Si, для спектров 11B - BF3·Et2O.
Все реакции проводили в атмосфере сухого
Окисление бориранов проводили перекисью во-
аргона. Использовали коммерческие метиленци-
дорода в щелочной среде по методикам [1-3, 21].
клогексан, PhBCl2 и Cp2TiCl2. Тетрагидрофуран
Хроматомасс-спектральный анализ триметилси-
абсолютизировали кипячением над металличе-
лильных эфиров проводили на приборе Shimadzu
ским натрием и использовали свежеперегнанным.
GCMS QP2010 Ultra, капиллярная колонка Supelco
Одномерные (1H, 13C, 11B) и двумерные (COSY,
PTE-5 (60 м×0.25 мм, газ-носитель - гелий, про-
DOSY, HSQC, HMBC) спектры ЯМР записаны на
граммируемая температура от 40 до 280°С со ско-
спектрометре Bruker Avance 400 с рабочими часто-
ростью 8 град/мин, энергия ионизации 70 эВ, тем-
CHCl3
log(m2/s)
-9.2
-9.1
-9.0
-8.9
CHCl3
-8.8
-8.7
-8.6
-8.5
9
8
7
6
5
4
3
2
1
ɦɞ
Рис. 3. DOSY эксперимент для свежеприготовленного образца 11b (СDCl3)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
234
ТУЛЯБАЕВА и др.
пература инжектора 260°С, температура ионного
27.02, 127.22, 132.74, 135.70. Спектр ЯМР 11B, δ,
источника 200°С).
м.д.: 45.05 (W½ 330 Гц). В спектрах ЯМР 1H и 13C
сигналы группы CH2-B-С(CH2)(CH2) не обнару-
Метиленциклооктан (метиленциклододекан)
жены.
были синтезированы по реакции циклооктанона
(циклододеканона) с реагентом Виттига (метилен-
Окисление 1-фенил-1-бораспиро[2.5]октана
трифенилфосфоран CH2PPh3), полученным взаи-
(11a) перекисью водорода в щелочной среде. К
модействием бромида (или йодида) трифенилме-
свежеприготовленному раствору бораспирана 11a,
тилфосфония с BuLi (или t-BuOK) в Et2O по мето-
полученному из 2 ммоль метиленциклогексана, в
дикам [28, 29].Спектральные отнесения получен-
10 мл ТГФ добавляли при 0°C 3 мл 20%-ного во-
ных метиленциклоалканов соответствовали ранее
дного раствора NaOH и затем медленно прикапы-
полученным [30, 31].
вали 1 мл 30%-ного раствора H2O2. Реакционную
смесь перемешивали 5-6 ч. После отделения ор-
Реакции метиленциклоалканов с PhBCl2 в
ганического слоя водный слой экстрагировали ди-
присутствии катализатора Cp2TiCl2 (общая ме-
этиловым эфиром (2×15 мл). Эфирные экстракты
тодика). В стеклянный реактор (20 мл) в атмос-
объединяли с органическим слоем, сушили CaCl2
фере аргона при перемешивании последователь но
и концентрировали в вакууме. Индивидуальные
загружали при 0°С 10 мл ТГФ, 0.04 г (1.6 ммоль)
продукты выделяли методом колоночной хромато-
Mg (порошок),
2 ммоль метиленциклоалкана,
графии на силикагеле (40-100 меш, 30 см×12 мм,
0.1 г (0.4 ммоль) Cp2TiCl2, 0.32 г (2 ммоль) PhBCl2.
элюент - этилацетат-гексан, 2:50). Спектральные
Смесь перемешивали при 0°С 1 ч, затем при ком-
данные и физические характеристики спиртов (12,
натной температуре (~ 20-22°С) 6-8 ч. Избыток
13) соответствовали известным [32, 33].
магния отфильтровывали, растворитель выпарива-
ли и спиробориран анализировали методом ЯМР.
(1-Гидроксициклогексил)метанол
(12). Ге-
Выход бораспирана 11a рассчитан на основе сум-
леобразное твердое вещество. Выход
0.09 г,
марного выхода продуктов окисления 12, 13.
0.7 ммоль (35%). Спектр ЯМР 1H (CDCl3), δ, м.д.:
1.10-1.80 м (10Н, 5СН2), 3.44 с (2Н, CН2-OН).
1-Фенил-1-бораспиро[2.5]октан (11a). Выход
Спектр ЯМР 13С, δ, м.д.: 22.04, 25.81, 35.10, 69.6,
75%. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.14-1.50
71.04.
м (2Н, CН2), 1.60-1.90 м (4Н, 2CН2), 7.64 т (2Н,
2СHаром, J 7.5 Гц), 7.76 т (1Н, СHаром, J 6.2 Гц),
Циклогексилметанол (13). Бесцветное масло.
8.28 д (2Н, 2СHаром, J 6.8 Гц). Спектр ЯМР 13С,
Выход 0.09 г, 0.8 ммоль (40%). Спектр ЯМР 1H
δ, м.д.: 25.86, 26.56, 29.58, 127.98, 132.70, 135.64.
(CDCl3), δ, м.д.: 0.87-1.00 м (2Н), 1.10-1.34 м (3Н),
Спектр 11B, δ, м.д.: 45.16 (W½ 360 Гц). В спектрах
1.43-1.56 м (2Н), 1.65-1.85 м (5Н), 3.45 д (2Н,
ЯМР 1H и 13C сигналы группы CH2-B-С(CH2)
CН2-OН, J 6.4 Гц). Спектр ЯМР 13С, δ, м.д.: 25.84,
(CH2) не обнаружены.
26.59, 29.57, 40.49, 68.74.
1-Фенил-1-бораспиро[2.7]декан (11b). Выход
ЗАКЛЮЧЕНИЕ
70%. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.20-1.85 м
Впервые осуществлено циклоборирование ме-
(10Н, 5CН2), 7.62-7.68 м (3Н, 3СHаром), 8.30 д (2Н,
тиленциклоалканов с помощью PhBCl2, катали-
2СHаром, J 7.4 Гц). Спектр ЯМР 13С, δ, м.д.: 25.58,
зируемое Cp2TiCl2, в тетрагидрофуране с получе-
26.50, 26.95, 27.42, 29.32, 128.39, 132.74, 135.70.
нием ранее неописанных спироборакарбоциклов
Спектр ЯМР 11B, δ, м.д.: 45.81 (W½ 340 Гц). В
с выходом 70-80%. Показано, что полученные
спектрах ЯМР 1H и 13C сигналы группы CH2-B-
спироборакарбоциклы стабильны в растворе в
С(CH2)(CH2) не обнаружены.
течение суток, но далее трансформируются в бор-
1-Фенил-1-бораспиро[2.11]тетрадекан
(11c).
органические «ring-opening» продукты.
Выход 80%. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.21-
БЛАГОДАРНОСТИ
1.90 м (18Н, 9CН2), 7.60-7.70 м (3Н, 3СHаром), 8.26
д (2Н, 2СHаром, J 7.4 Гц). Спектр ЯМР 13С, δ, м.д.:
Структурные исследования проведены в
22.65, 23.55, 24.67, 24.78, 25.84, 26.05, 26.15, 26.71,
Региональном Центре коллективного пользования
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
ПЕРВЫЙ ПРИМЕР CИНТЕЗА НОВОГО КЛАССА СПИРОБОР
АКАРБОЦИКЛОВ
235
«Агидель» УФИЦ РАН, Отделение - Институт не-
7. Baik C., Hudson Z.M., Amarne H., Wang S. J. Am.
фтехимии и катализа УФИЦ РАН.
Chem. Soc. 2009, 131, 14549-14559. doi 10.1021/
ja906430s
ФОНДОВАЯ ПОДДЕРЖКА
8. Rao Y.-L., Amarne H., Wang S. Coord. Chem. Rev.
Работа выполнена по теме государственного за-
2012, 256, 759-770. doi 10.1016/j.ccr.2011.11.009
дания (FMRS-2022-0075).
9. Mellerup S.K., Wang S. Sci. China Mater. 2018, 61,
ИНФОРМАЦИЯ ОБ АВТОРАХ
1249-1256. doi 10.1007/s40843-018-9306-8
10. McFadden T.R., Fang Ch., Geib S.J., Merling E., Liu P.,
Тулябаева Лилия Инверовна, ORCID: https://
Curran D.P. J. Am. Chem. Soc. 2017, 139, 1726-1729.
orcid.org/0000-0002-3159-2868
doi 10.1021/jacs.6b09873
Салахутдинов Рустам Ринатович, ORCID:
11. Dai W., McFadden T.R., Curran D.P., Früchtl H.A.,
Walton J.C. J. Am. Chem. Soc. 2018, 140, 15868-
Тюмкина Татьяна Викторовна, ORCID: https://
15875. doi 10.1021/jacs.8b09288
orcid.org/0000-0001-8127-9135
12. Bissinger P., Braunschweig H., Kraft K., Kupfer T.
Angew. Chem. Int. Ed. 2011, 50, 4704-4707. doi
Тулябаев Артур Радисович, ORCID: https://
10.1002/anie.201007543
orcid.org/0000-0002-6566-4794
13. Braunschweig H., Claes C., Damme A., Deißenber-
Джемилев Усеин Меметович, ORCID: https://
ger A., Dewhurst R.D., Hörl C., Kramer T. Chem.
orcid.org/0000-0002-7992-6337
Comm. 2015, 51, 1627-1630. doi 10.1039/c4cc09036e
КОНФЛИКТ ИНТЕРЕСОВ
14. Wehrmann R., Klusik H., Berndt A. Angew. Chem. Int.
Ed. 1984, 23, 369-370. doi 10.1002/anie.198403691
Авторы заявляют об отсутствии конфликта ин-
тересов.
15. Klusik H., Berndt A. Angew. Chem. Int. Ed. 1983, 22,
877-878. doi 10.1002/anie.198308771
СПИСОК ЛИТЕРАТУРЫ
16. Pues C., Baum G., Massa W., Berndt A., Z. Naturforsch.
1. Khusainova L.I., Khafizova L.O., Tyumkina T.V.,
B. 1988, 43, 275-279. doi 10.1515/znb-1988-0307
Ryazanov K.S., Dzhemilev U.M. J. Organomet.
17. Glaser B., Mayer E.P., Nöth H., Rattay W., Wietel-
Chem.
2017,
832,
12-17. doi
10.1016/
mann U. Z. Naturforsch. B. 1988, 43, 449-456. doi
j.jorganchem.2017.01.009
10.1515/znb-1988-0411
2. Хусаинова Л.И., Хафизова Л.О., Тюмкина Т.В., Дже-
18. Balzereit C., Kybart C., Winkler H.-J., Massa W.,
милев У.М. ЖОрХ. 2015, 51, 1551-1557. [Khusaino-
Berndt A. Angew. Chem. Int. Ed. 1994, 33, 1487-1489.
va L.I., Khafizova L.O., Tyumkina T.V., Dzhemi-
doi 10.1002/anie.199414871
lev U.M. Russ. J. Org. Chem. 2015, 51, 1517-1523.]
doi 10.1134/S1070428015110019
19. Mayer P., Noth H. Chem. Ber. 1993, 126, 1551-1557.
doi 10.1002/cber.19931260708
3. Хусаинова Л.И., Хафизова Л.О., Тюмкина Т.В., Дже-
милев У.М. ЖОХ. 2016, 86, 1046-1049. [Khusaino-
20. Wrackmeyer B. Annu. Rep. NMR Spectrosc. 1988, 20,
va L.I., Khafizova L.O., Tyumkina T.V., Dzhemi-
61-203. doi 10.1016/s0066-4103(08)60170-2
lev U.M. Russ. J. Gen. Chem. 2016, 86, 1038-1041.]
21. Brown H.C., Zaidlewicz M. J. Am. Chem. Soc. 1976,
doi 10.1134/S1070363216060335
98, 4917-4925. doi 10.1021/ja00432a037
4. Khusainova L.I., Khafizova L.O., Tyumkina T.V.,
22. Klebe J.F., Finkbeiner H., White D.M. J. Am. Chem.
Ryazanov K.S., Popodko N.R., Dzhemilev U.M.
Soc. 1966, 88, 3390-3395. doi 10.1021/ja00966a038
J. Organomet. Chem. 2018, 873, 73-77. doi 10.1016/
23. Wilkey J.D., Schuster G.B. J. Am. Chem. Soc. 1991,
j.jorganchem.2018.08.005
113, 2149-2155. doi 10.1021/ja00006a037
5. Джемилев У.М., Хусаинова Л.И., Рязанов К.С., Ха-
24. Midland M.M., Brown H.C. J. Am. Chem. Soc. 1973,
физова Л.О. Изв. АН. Сер. хим. 2021, 70, 1851-1892.
95, 4069-4070. doi 10.1021/ja00793a052
[Dzhemilev U.M., Khusainova L.I., Ryazanov K.S.,
Khafizova L.O. Russ. Chem. Bull. Int. Ed. 2021, 70,
25. Sobota P., Pluzinski T., Jezowska-Trzebiatowska B.,
1851-1892.] doi 10.1007/s11172-021-3292-2
Rummel S. J. Organomet. Chem. 1980, 185, 69-74. doi
10.1016/s0022-328x(00)94401-2
6. Rao Y.-L., Amarne H., Zhao S.-B., McCormick T.M.,
Martić S., Sun Y., Wang R.-Y., Wang S. J. Am. Chem.
26. Eisch J.J., Boleslawski M.P., Tamao K. J. Org. Chem.
Soc. 2008, 130, 12898-12900. doi 10.1021/ja8052046
1989, 54, 1627-1634. doi 10.1021/jo00268a025
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023
236
ТУЛЯБАЕВА и др.
27. Tomboulian P., Amick D., Beare S., Dumke K.,
31. Lebel H., Davi M., Díez-González S., Nolan S.P.
Hart D., Hites R., Metzger A., Nowak R. J. Org.
J. Org. Chem. 2007, 72, 144-149. doi 10.1021/
Chem. 1973, 38, 322-325. doi 10.1021/jo00942a026
jo061781a
28. Fitjer L., Quabeck U. Synth. Commun. 1985, 15, 855-
32. Masuda Y., Ikeshita D., Murakami M. Helv.
864. doi 10.1080/00397918508063883
Chim. Acta.
2021,
104, e2000228. doi
10.1002/
29. Wittig G., Schoellkopf U. Org. Synth., Coll. 1960, 40,
hlca.202000228
66. doi 10.15227/orgsyn.040.0066
33. Kobayashi S., Kawamoto T., Uehara S., Fukuyama T.,
30. Barluenga J., Fernandez-Simon J.L., Concellon J.M.,
Yus M. J. Chem. Soc. Perkin Trans. 1. 1988, 1, 3339-
Ryu I. Org. Lett. 2010, 12, 1548-1551. doi 10.1021/
3343. doi 10.1039/p19880003339
ol1002847
The First Example of Synthesis of a New Class
of Spiroboracarbocycles via Cycloboration
of Methylenecycloalkanes with PhBCl2 Catalyzed by Cp2TiCl2
L. I. Tulyabaeva*, R. R. Salakhutdinov, T. V. Tyumkina,
A. R. Tulyabaev, and U. M. Dzhemilev
Institute of Petrochemistry and Catalysis, Ufa Federal Research Centre, Russian Academy of Sciences,
prosp. Oktyabrya, 141, Ufa, 450074 Russia
*e-mail: khusainova_ink@mail.ru
Received April 13, 2022; revised April 22, 2022; accepted April 23, 2022
Cp2TiCl2-catalyzed cycloboration of methylenecycloalkanes with PhBCl2 in the presence of metallic Mg to
obtain a novel spiroboracarbocycles in good yields (70-80%) is reported for the first time. The structure and
properties of spiro-fused boriranes were studied using 11B, 1H, 13C NMR spectroscopy and DOSY experiments.
1-Phenyl-substituted boraspiranes are stable in solution at room temperature for a day.
Keywords: spiroboracarbocycles, cycloboration, methylenecycloalkanes, PhBCl2, catalyst, Cp2TiCl2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 2 2023