ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 3, с. 338-350
УДК 547.1-304.2, 547.415.1
СИНТЕЗ 1-(АДАМАНТАН-1-ИЛ)ПРОПАН-
1,2-ДИАМИНА И ХИРАЛЬНЫХ ЛИГАНДОВ
НА ЕГО ОСНОВЕ1
© 2023 г. П. А. Манькова*, А. Н. Резников, В. А. Ширяев,
И. М. Ткаченко, Ю. Н. Климочкин
ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*e-mail: orgchem@samgtu.ru
Поступила в редакцию 02.06.2022 г.
После доработки 12.06.2022 г.
Принята к публикации 14.06.2022 г.
Из транс-2-(адамантан-1-ил)-3-метилазиридина получен рацемический 1-(адамантан-1-ил)пропан-
1,2-диамин, и проведена его раскристаллизация l-яблочной кислотой. Для выделенного (1S,2R)-изомера
осуществлена дериватизация бензилом, и с помощью ВЭЖХ определен энантиомерный избыток полу-
ченного (2S,3R)-2-(адамантан-1-ил)-3-метил-5,6-дифенил-2,3-дигидропиразина. Реакцией (1S,2R)-ди-
амина с сероуглеродом синтезирован (4S,5R)-4-(адамантан-1-ил)-5-метилимидазолидин-2-тион, методом
РСА установлена его абсолютная конфигурация. На основе рацемического и хирального (1S,2R)-1-
(адамантан-1-ил)пропан-1,2-диаминов синтезированы лиганды, каталитическая активность комплексов
которых изучена на модельных реакциях эпоксидирования, Михаэля и Анри. Для последней отмечена
энантиодивергенция при использовании лигандов схожего строения.
Ключевые слова: вицинальные диамины, адамантан, раскристаллизация, хиральность, лиганды
DOI: 10.31857/S0514749223030059, EDN: SRKIBH
ВВЕДЕНИЕ
ных диаминов и их способностью образовывать
устойчивые хелатные комплексы между металлом
Соединения, содержащие две аминогруппы
и лигандом. Исходными лигандами для получения
при соседних атомах углерода, интересны с точки
зрения изучения их химических свойств и обла-
большинства катализаторов служат довольно до-
стей применения. Фрагмент 1,2-диамина обнару-
ступные С2-симметричные диамины. Например,
жен во многих важных молекулах, проявляющих
изучена активность катализаторов на основе наи-
антиаритмическое, противосудорожное, противо-
более доступных 1,2-дифенилэтан-1,2-диаминов и
опухолевое действие [1]. Вицинальные диамины
циклогексан-1,2-диаминов с Cu(II), Fe(II), Zn(II),
используются как прекурсоры в синтезе гетеро-
Co(II), Ni(II) [14-18]. Исследование несимметрич-
циклических систем [2-4], а также как реагенты
ных вицинальных диаминов встречается реже
для разделения рацематов [5, 6]. В последнее время
из-за малой доступности и сложности синтеза
использование вицинальных диаминов и их произ-
таких соединений. Особый интерес представляет
водных в качестве хиральных лигандов в металло-
получение вицинальных диаминов, содержащих
комплексном катализе значительно расширилось
адамантильный заместитель, который повыша-
[7-13]. Это связано со стабильностью вициналь-
ет степень липофильности и конформационную
жесткость, однако данное направление изучено
1 Статья посвящается юбилею главного редактора журнала
академика РАН И.П. Белецкой.
относительно слабо [19-21].
338
СИНТЕЗ 1-(АДАМАНТАН-1-ИЛ)ПРОПАН-1,2-ДИАМИНА
339
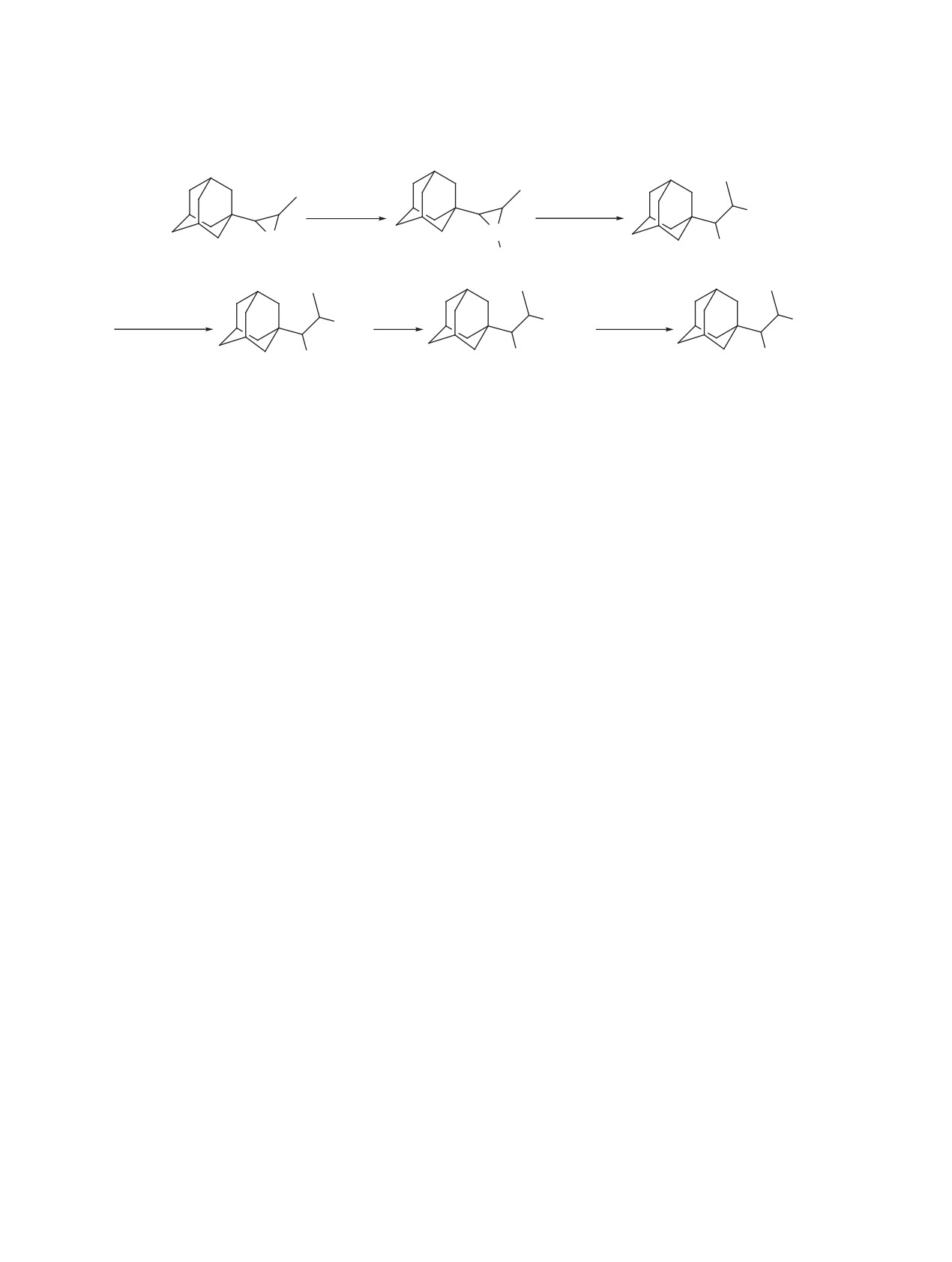
Схема 1. Получение 1-(адамантан-1-ил)пропан-1,2-диамина (6) из транс-2-(адамантан-1-ил)-3-метилазиридина (1)
Boc2O, Et3N
NaN3, NH4Cl
N3
CH2Cl2
N
ДМФА, 80°C
N
rt
NHBoc
H
Boc
1
2
3
Zn, NH4Cl
HCl
NaOH
NH
NH2
NH2
2
EtOH-H2O-ТГФ
MeOH
H2O-CH2Cl2
·2HCl
rt
NHBoc
rt
NH2
NH2
4
5
6
Ранее нами было рассмотрено получение (1S)-
ме азота NHBoc-группы проявляется в области
1-(адамантан-1-ил)этан-1,2-диамина и лигандов
4.49 м.д. в виде дублета, 3J 10.8 Гц. Сигнал прото-
на его основе для асимметрического синтеза [22].
на при атоме углерода, связанном с NHBoc, наблю-
Результаты исследования показали, что для хи-
дается в области 3.48 м.д. в виде дублета дублетов,
ральной индукции необходимо синтезировать и
3J 4.0 и 10.8 Гц; первая вицинальная КССВ свиде-
изучить каталитическую активность новых лиган-
тельствует об эритро-форме азида 3, вторая КССВ
дов, содержащих заместители при обоих связан-
подтверждает расположение NHBoc-заместителя
ных с NH2-группами атомах углерода. В связи с
при атоме углерода, расположенном рядом с ада-
этим целью нашей работы является синтез 1-(ада-
мантильным каркасом. Раскрытие транс-азири-
мантан-1-ил)пропан-1,2-диамина и хиральных ли-
дина 2 протекает со стерически более доступной
гандов на его основе.
стороны с образованием ожидаемого эритро-изо-
мера 3, что соответствует стереохимическим зако-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
номерностям раскрытия транс-2,3-дизамещенных
В качестве исходного соединения для полу-
азиридинов [24, 25].
чения 1-(адамантан-1-ил)пропан-1,2-диамина (6)
Для разделения эритро-изомеров диамина 6
был выбран транс-2-(адамантан-1-ил)-3-метил-
на индивидуальные стереоизомеры применяли
азиридин (1), полученный по литературной ме-
метод раскристаллизации. В качестве расщепля-
тодике [23] (схема 1). На первом этапе проводи-
ющего реагента использовались l-винная, (R)-
ли реакцию азиридина 1 с ди-трет-бутилдикар-
миндальная, l-яблочная кислоты, однако положи-
бонатом (Boc2O) в присутствии триэтиламина.
тельный результат был получен только с помощью
N-Замещенный азиридин 2 раскрывали азидом
последней путем кристаллизации малатной соли
натрия в присутствии хлорида аммония с обра-
диамина 6 в смеси вода-этанол. Выход диамина
зованием азидокарбамата 3. Восстановление ази-
(1S,2R)-6 составил 37% на исходный 6. Для оцен-
догруппы в 3 осуществляли цинком и хлоридом
ки энантиомерного состава полученного (1S,2R)-6
аммония в смеси этанол-вода-ТГФ. Снятие Boc-
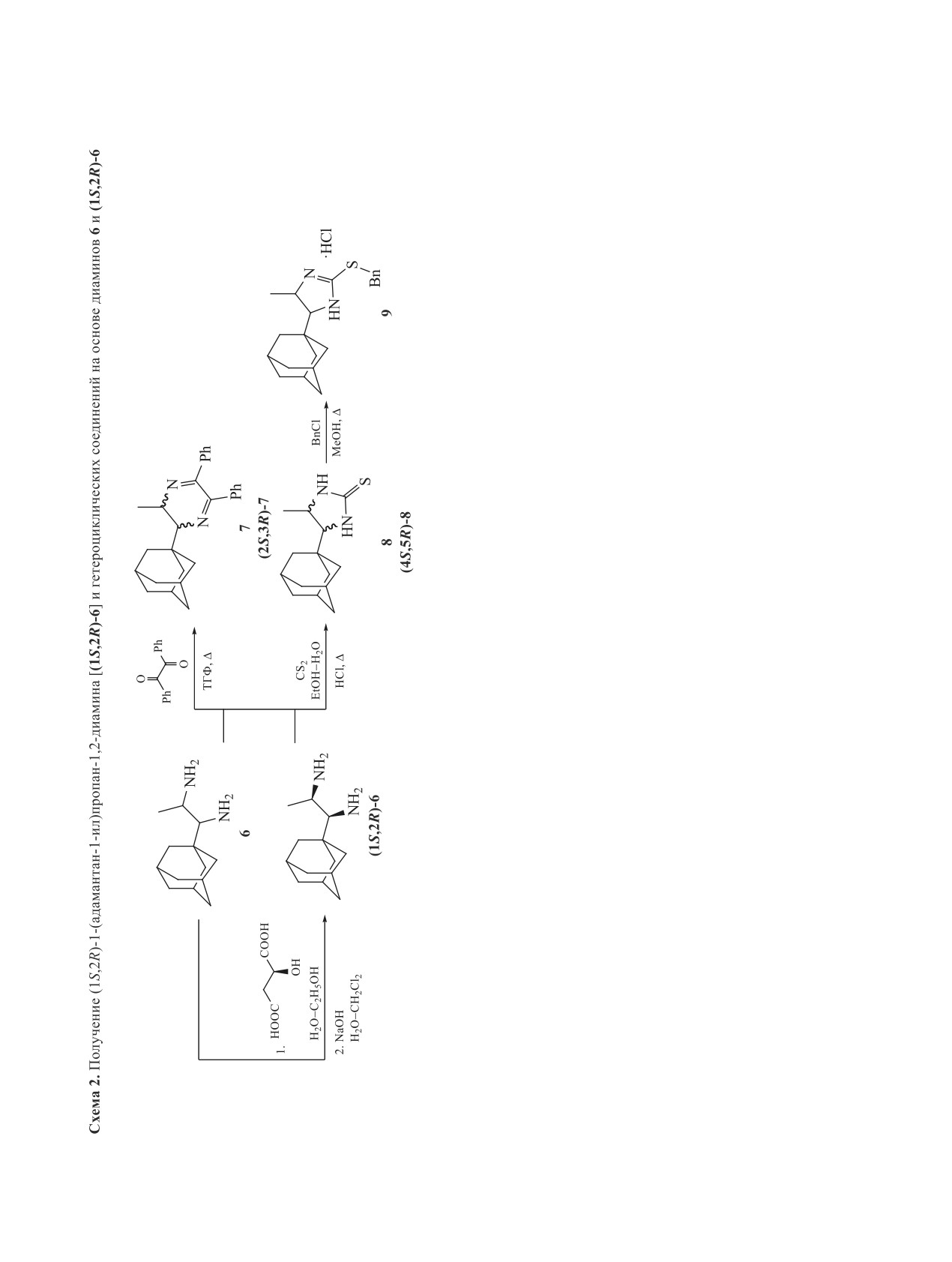
были синтезированы гетероциклические произ-
защиты в аминоуретане 4 проводили 36%-ной со-
водные на основе рацемического 6 и энантимер-
ляной кислотой в метаноле в объемном соотноше-
но обогащенного (1S,2R)-6 (схема 2). В реакции с
нии 3:7 с получением дигидрохлорида 1-(адаман-
сероуглеродом выделяли имидазолидин-2-тион 8,
тан-1-ил)пропан-1,2-диамина
(5). Описанные в
который с бензилхлоридом образовывал изотиу-
дальнейшем реакции проводились с полученным
роневую соль 9. Взаимодействие диамина с бензи-
из него свободным основанием 6.
лом привело к 2,3-дигидропиразину 7. Оптическая
При раскрытии транс-азиридина 2 азидом на-
чистота (1S,2R)-6 определялась с помощью нор-
трия атака нуклеофила происходит региоселек-
мально-фазовой (НФ) ВЭЖХ производного
7.
тивно только со стороны метильной группы. В
Было установлено, что 2,3-дигидропиразин 7 под-
спектре ЯМР 1Н азида 3 сигнал протона при ато-
ходит для анализа на ВЭЖХ в связи с удобным
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
340
МАНЬКОВА и др.
способом его получения и хорошей растворимо-
стью в исследуемой смеси растворителей (гексан-
изопропанол,
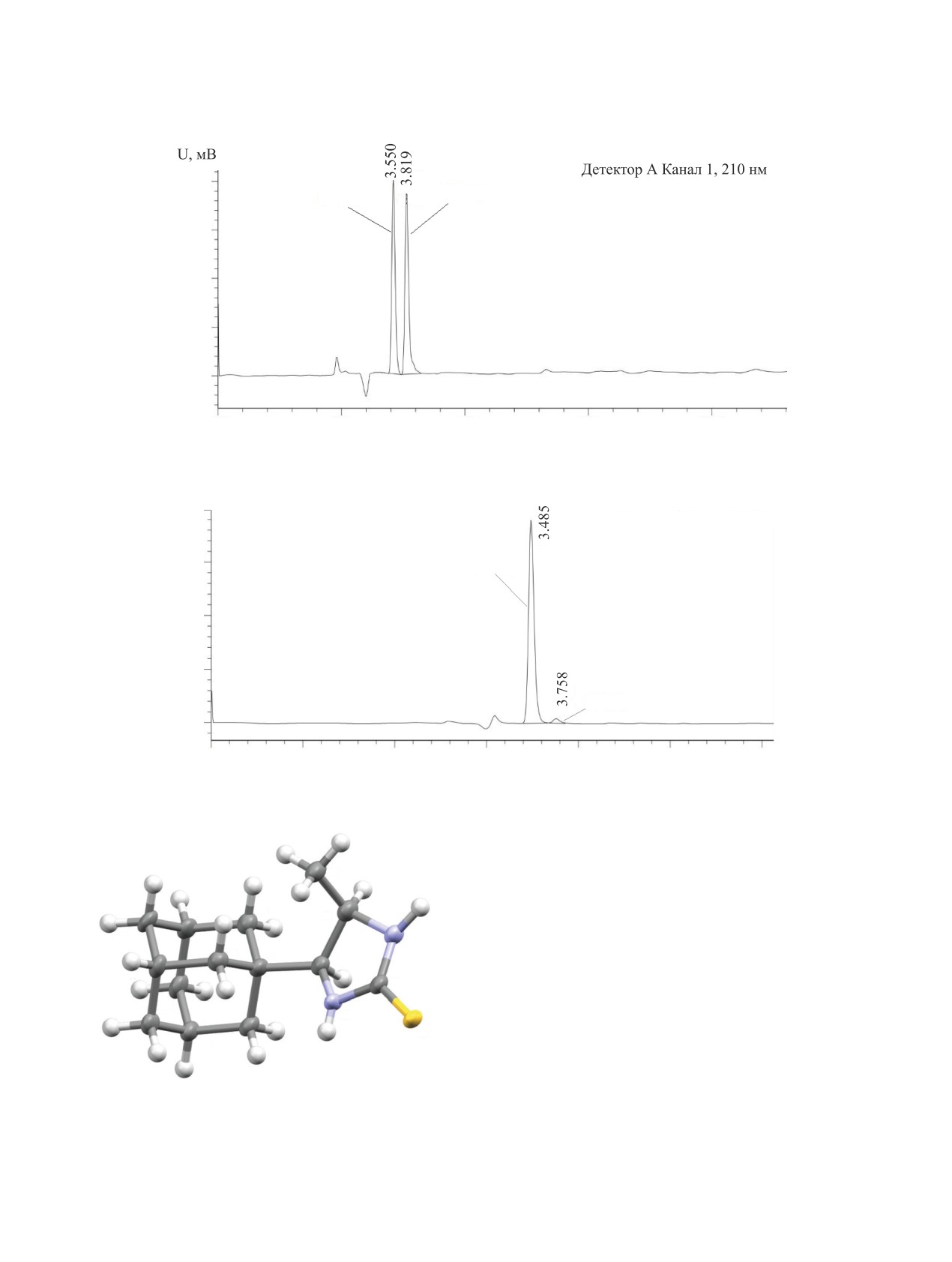
3%) (рис.
1). Методом ВЭЖХ
установлен энантиомерный избыток
(2S,3R)-2-
(адамантан-1-ил)-3-метил-5,6-дифенил-2,3-дигид-
ропиразина
[(2S,3R)-7], равный
94% (рис.
2).
Удалось однозначно установить абсолютную
(1S,2R)-конфигурацию диамина (1S,2R)-6 мето-
дом РСА, анализируя циклическую тиомочевину
(4S,5R)-8 [26] (рис. 3).
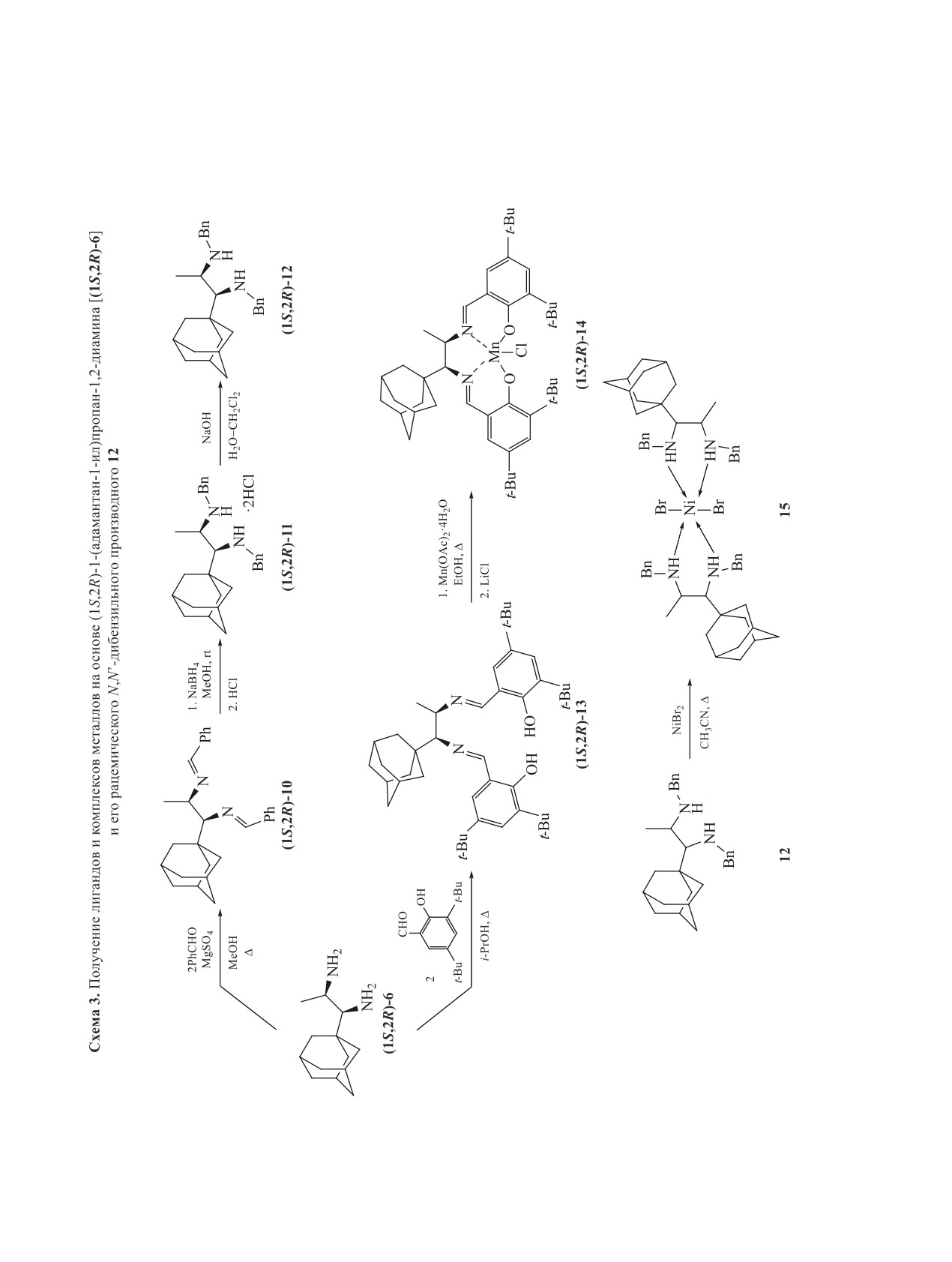
В реакциях асимметрического синтеза ис-
пользуются азотсодержащие лиганды различной
структуры: незамещенные по атому азота вици-
нальные диамины [27, 28], их N,N'-дизамещенные
аналоги, в частности N,N'-дибензильные [29, 30],
а также соединения иминового [31] и саленового
типа [32-34]. В нашей работе синтезирован ряд
лигандов схожего строения и получены комплек-
сы металлов с целью изучения их каталитической
активности (схема 3). В реакции с бензальдегидом
был выделен N,N'-дизамещенный имин [(1S,2R)-
10]. При последующем восстановлении (1S,2R)-
10 боргидридом натрия был получен
1-(ада-
мантан-1-ил)-N,N'-дибензилпропан-1,2-диамин,
выделенный в виде дигидрохлорида (1S,2R)-11.
Взаимодействием
3,5-ди(трет-бутил)салицило-
вого альдегида и диамина (1S,2R)-6 синтезирован
диимин саленового типа (1S,2R)-13.
Производные цис-вицинальных диаминов ра-
нее исследовались в качестве лигандов в асимме-
трических реакциях окисления алкенов, восста-
новления кетиминов, Манниха, альдольной кон-
денсации [35-38]. Полученные нами соединения
(1S,2R)-6, (1S,2R)-10 и (1S,2R)-12 были испыта-
ны в качестве хиральных индукторов в реакции
Анри в присутствии моногидрата ацетата меди(II)
(схема 4). В реакции бензальдегида (16) и нитро-
метана (17) получен 2-нитро-1-фенилэтанол-1 (18)
при использовании 5 мол % соли Cu(II), 5 мол %
лигандов (1S,2R)-6, (1S,2R)-10 или (1S,2R)-12, а
также 5 мол % диизопропилэтиламина. Анализ
продуктов реакции с помощью НФ ВЭЖХ показал,
что незамещенный диаминовый лиганд (1S,2R)-6
способствует энантиомерному обогащению ре-
акционной смеси (S)-изомером соединения
18
(ee 28%), а дииминовый лиганд (1S,2R)-10 при-
водит к преимущественному образованию (R)-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
СИНТЕЗ 1-(АДАМАНТАН-1-ИЛ)ПРОПАН-1,2-ДИАМИНА
341
1000
(2S,3R)-
(2R,3S)-
750
500
250
0
0.0
2.5
5.0
7.5
10.0
τ, мин
Рис. 1. Хроматограмма рацемического 2-(адамантан-1-ил)-3-метил-5,6-дифенил-2,3-дигидропиразина (7)
U, мВ
4000
Детектор А Канал 1, 210 нм
3000
(2S,3R)-
2000
1000
(2R,3S)-
0
0
1
2
3
4
5
6
τ, мин
Рис. 2. Хроматограмма (2S,3R)-2-(адамантан-1-ил)-3-метил-5,6-дифенил-2,3-дигидропиразина [(2S,3R)-7]
изомера нитроспирта 18 (ee 52%). В присутствии
дибензиламинопроизводного (1S,2R)-12 продукт
C16
18 выделен в виде рацемической смеси (см. табли-
цу). Различная конфигурация продуктов 18 в реак-
C13
C12
C5
ции Анри при использовании лигандов (1S,2R)-6
и (1S,2R)-10 свидетельствует о энантиодивергент-
C14
N1
C7
C
6
C4
ном эффекте [39].
C8
C2
Использующийся в реакции Михаэля комплекс
S2
15, полученный взаимодействием безводного бро-
C15
C11
N3
мида никеля (II) с диамином 12 (схема 3), не проде-
C9
C10
монстрировал каталитической активности: в реак-
ции диэтилмалоната с β-нитростиролом в присут-
ствии 2 мол % комплекса 15 не обнаружено про-
Рис.3.Молекулярная структура(4S,5R)-4-(адамантан-1-
дукта присоединения. Окисление стирола переки-
ил)-5-метилимидазолидин-2-тиона [(4S,5R)-8] (CCDC
2164846) [26]
сью водорода в присутствии комплекса (1S,2R)-14
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
342
МАНЬКОВА и др.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
СИНТЕЗ 1-(АДАМАНТАН-1-ИЛ)ПРОПАН-1,2-ДИАМИНА
343
Схема 4. Модельная реакция Анри
5 мол % Cu(OAc)2·H2O
5 мол % L1-L3
NO2
5 мол % (i-Pr)2NEt
PhCHO + CH3NO2
i-PrOH, rt
Ph
OH
16
17
18
NH2
N
Ph
N Ph
H
N
NH
NH
2
Ph
Ph
L1
L2
L3
(2 мол %), выделенного после реакции лиганда
трет-Бутил 2-(адамантан-1-ил)-3-метилази-
(1S,2R)-13 с тетрагидратом ацетата марганца(II) и
ридин-1-карбоксилат (2). К раствору 1 г (5 ммоль)
хлоридом лития (схема 3), в отличие от получен-
транс-2-(адамантан-1-ил)-3-метилазиридина (1) в
ных в [22] результатов, не приводит к ожидаемому
30 мл хлористого метилена прибавляли при пере-
эпоксиду.
мешивании 0.73 мл (0.53 г, 5 ммоль) триэтиламина,
1.2 мл (1.14 г, 5 ммоль) ди-трет-бутилдикарбона-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
та. Раствор перемешивали при комнатной темпе-
ИК спектры регистрировались на ИК спектро-
ратуре 1 ч. Реакционную смесь промывали водой
метре Shimadzu IR Affinity-1. Спектры ЯМР 1H
(2×30 мл), насыщ. раствором соли (2×30 мл), су-
и 13С зарегистрированы на спектрометре JEOL
шили Na2SO4, растворитель отгоняли в вакууме.
NMR-ECX 400 (400 и 100 МГц соответственно).
Остаток очищали колоночной хроматографией
Температуры плавления определены на прибо-
(петролейный эфир-этилацетат, 10:1). Выход 1.32 г
ре OptiMelt MPA100. Элементный анализ вы-
(94%), бесцветная маслянистая жидкость. ИК
полнен на автоматическом CHNS-анализаторе
спектр, ν, см-1: 2900, 2846, 1707, 1452, 1363, 1311,
EuroVector EA-3000. Угол вращения измеряли на
1145, 993. Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.21 д (3H,
приборе Rudolph Research Analytical (Autopol V
СН3, 3J 5.6 Гц), 1.44 c (9H, 3CH3), 1.48-1.50 м (6Н,
Plus Automatic Polarimeter) на длине волны
6СНAd), 1.59-1.69 м (6Н, 6СНAd), 1.77 д (1Н, СН, 3J
589 нм в кювете длиной 10 см при температуре
3.6 Гц), 1.94 с (3Н, 3СНAd), 2.40-2.46 м (1Н, СН).
25°С. Энантиомерный состав определен методом
Спектр ЯМР 13C (CDCl3), δ, м.д.: 16.0 (CH3), 28.1
нормально-фазовой ВЭЖХ на приборе Shimadzu
(3CHAd), 28.2 (3CH3), 32.0 (CAd), 35.0 (CH), 37.0
Prominence с использованием колонки ChiralPAK
(3CH2Ad), 39.4 (3CH2Ad), 53.9 (CH), 80.6 (C-O),
AD-3 в условиях гексан-изопропанол (3%); ско-
161.5 (C=O). Найдено, %: C 74.18; H 10.03; N 4.81.
рость потока 1.2 мл/мин, температура колонки
C18H29NO2. Вычислено, %: C 74.11; H 10.09; N 4.77.
30°С. Рентгеноструктурный анализ выполнен на
дифрактометре Bruker D8 QUEST в ЦКП-САЦ
трет-Бутил [1-(адамантан-1-ил)-2-азидопро-
ФИЦ КазНЦ РАН.
пил]карбамат (3). К раствору 11.75 г (44 ммоль)
Асимметрическое присоединение нитрометана 17 к бензальдегиду 16 в присутствии лигандов L1-L3
Лиганд
Выход 18, %
Конфигурация
ee, %
L1
61
(S)
28
L2
37
(R)
52
L3
45
-
0
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
344
МАНЬКОВА и др.
трет-бутил 2-(адамантан-1-ил)-3-метилазиридин-
Найдено, %: C 70.09; H 10.46; N 9.08. C18H32N2O2.
1-карбоксилата (2) в 180 мл ДМФА прибавля-
Вычислено, %: C 70.15; H 10.41; N 9.11.
ли при перемешивании 11.44 г (0.176 моль) ази-
1-(Адамантан-1-ил)пропан-1,2-диамин ди-
да натрия и 9.42 г (0.176 моль) хлорида аммония.
гидрохлорид (5). К раствору 8.86 г (31.2 ммоль)
Реакционную смесь перемешивали 24 ч при 80°C
трет-бутил [1-(адамантан-1-ил)-2-аминопропил]-
в атмосфере аргона, выливали в 650 мл воды,
карбамата (4) в 70 мл метанола при 10°C добавля-
экстрагировали этилацетатом (5×40 мл), суши-
ли 30 мл 36%-ной соляной кислоты. Реакционную
ли Na2SO4, растворитель отгоняли в вакууме.
смесь перемешивали 12 ч при комнатной тем-
Остаток перекристаллизовывали из петролейного
пературе, упаривали досуха, твердый остаток
эфира. Выход 9.69 (71%), бесцветные кристаллы,
растворяли в минимальном количестве теплого
т.пл. 122-124°C. ИК спектр, ν, см-1: 3377, 2897,
этанола, при комнатной температуре добавляли
2845, 2081, 1685, 1517, 1448, 1321, 1236, 1149.
метил-трет-бутиловый эфир, выпавший осадок
Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.25 д (3H, СН3,
отфильтровывали. Выход 7.16 г (90%), бесцвет-
3J 6.8 Гц), 1.44 c (9H, 3CH3), 1.47-1.67 м (12Н,
ные кристаллы, т.пл. 225-245°C с разл. ИК спектр,
12СНAd), 1.97 с (3Н, 3СНAd), 3.48 д.д (1Н, СН, 3J
ν, см-1: 3435, 2904, 2850, 2684, 1598, 1543, 1510,
4.0, 10.8 Гц), 3.55-3.58 м (1Н, СН), 4.49 д (1Н, NН,
1448, 1159, 1051. Спектр ЯМР 1H (ДМСО-d6), δ,
3J 10.8 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.: 15.9
м.д.: 1.30 д (3H, СН3, 3J 6.8 Гц), 1.45-1.67 м (12Н,
(CH3), 28.3 (3CHAd), 28.5 (3CH3), 36.5 (CAd), 36.8
12СНAd), 1.92 с (3Н, 3СНAd), 3.06 уш.с (1Н, СН),
(3CH2Ad), 39.1 (3CH2Ad), 56.0 (CH), 62.2 (СН), 79.5
3.69 уш.с (1Н, СH), 8.57 с (3Н, NН2·HCl), 8.70 с
(C-O), 156.0 (C=O). Найдено, %: C 64.64; H 9.04; N
(3Н, NН2·HCl). Спектр ЯМР 13C (ДМСО-d6), δ,
16.75. C18H30N4O2. Вычислено, %: C 64.58; H 9.10;
м.д.: 15.1 (CH3), 27.9 (3CHAd), 35.5 (CAd), 36.3
N 16.77.
(3CH2Ad),
38.1
(3CH2Ad), 44.9 (CH), 61.6 (CH).
трет-Бутил
(1-(адамантан-1-ил)-2-амино-
Найдено, %: C 55.51; H 9.32; N 9.96. C13H26Cl2N2.
пропил)карбамат
(4).
К раствору
12.36 г
Вычислено, %: C 55.59; H 9.25; N 9.93.
(40 ммоль) трет-бутил
(1-(адамантан-1-ил)-2-
1-(Адамантан-1-ил)пропан-1,2-диамин (6). К
азидопропил)карбамата (3) в смеси 90 мл этанола,
раствору 1.2 г (4.3 ммоль) 1-(адамантан-1-ил)про-
30 мл воды и 30 мл ТГФ при 10°C прибавляли при
пан-1,2-диамина дигидрохлорида (5) в 40 мл воды
перемешивании 4.9 г (91.6 ммоль) хлорида ам-
и 15 мл хлористого метилена прибавляли при пере-
мония и 3.37 г (51.8 ммоль) цинка. Реакционную
мешивании 0.68 г (17.1 ммоль) гидроксида натрия.
смесь перемешивали 6 ч при комнатной темпера-
Реакционную смесь перемешивали 15 мин, отде-
туре, упаривали этанол и ТГФ, к остатку добав-
ляли органический слой, водный слой экстрагиро-
ляли 40 мл этилацетата и прикапывали насыщ.
вали хлористым метиленом (4×5 мл), суммарные
раствор аммиака до полного растворения осадка.
органические вытяжки сушили Na2SO4, раствори-
Органический слой отделяли, водный слой экс-
тель отгоняли в вакууме. Выход 0.77 г (86%), бес-
трагировали этилацетатом (3×7 мл), суммарные
цветная маслянистая жидкость. ИК спектр, ν, см-1:
органические вытяжки сушили Na2SO4, раствори-
3350, 2897, 2845, 1591, 1446, 1363, 1344, 1099, 813.
тель отгоняли в вакууме. Остаток перекисталлизо-
вывали из смеси хлороформ-петролейный эфир.
(1S,2R)-1-(Адамантан-1-ил)пропан-1,2-ди-
Выход 6.8 г (61%), бесцветные кристаллы, т.пл.
амин [(1S,2R)-6]. Смесь 2.1 г (10 ммоль) 1-(ада-
151-152°C. ИК спектр, ν, см-1: 3192, 2902, 2846,
мантан-1-ил)пропан-1,2-диамина
(6) и
3.09 г
1685, 1548, 1448, 1363, 1246, 1170. Спектр ЯМР 1H
(20 ммоль) l-яблочной кислоты кипятили в 15 мл
(ДМСО-d6), δ, м.д.: 0.90 д (3H, СН3, 3J 6.4 Гц), 1.34
воды 15 мин, охлаждали до комнатной температу-
c (9H, 3CH3), 1.39-1.60 м (12Н, 12СНAd), 1.86 с
ры, добавляли 15 мл этанола, оставляли при 5°C на
(3Н, 3СНAd), 3.06-3.12 м (2Н, 2СН), 3.94 уш.с (2Н,
24 ч. Выпавший осадок отфильтровывали. Выход
NH2), 6.45 д (1Н, NН, 3J 10.4 Гц). Спектр ЯМР 13C
малатной соли 1.81 г, бесцветные кристаллы, [α]D25
(ДМСО-d6), δ, м.д.: 20.2 (CH3), 28.3 (3CHAd), 28.8
-1.9° (с 1.0, H2O). К раствору 1.81 г соли диамина
(3CH3), 36.6 (CAd), 37.0 (3CH2Ad), 39.2 (3CH2Ad),
и l-яблочной кислоты в 50 мл воды и 15 мл хло-
46.2 (CH), 64.8 (CH), 77.9 (C-O), 157.3 (C=O).
ристого метилена прибавляли при перемешивании
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
СИНТЕЗ 1-(АДАМАНТАН-1-ИЛ)ПРОПАН-1,2-ДИАМИНА
345
0.4 г гидроксида натрия. Реакционную смесь пе-
3197, 2902, 2848, 1519, 1448, 1203, 630, 532. Спектр
ремешивали 15 мин, отделяли органический слой,
ЯМР 1H (ДМСО-d6), δ, м.д.: 1.09 д (3Н, СН3, 3J
водный слой экстрагировали хлористым метиле-
6.4 Гц), 1.48-1.73 м (12Н, 12СНAd), 1.87 c (3H,
ном (4×5 мл), суммарные органические вытяжки
3CHAd), 3.20-3.26 м (1Н, СH), 3.72-3.75 м (1Н,
сушили Na2SO4, растворитель отгоняли в вакууме.
СH), 7.86 c (1H, NH), 8.10 c (1H, NH). Спектр ЯМР
Выход 0.78 г (37%), бесцветная маслянистая жид-
13C (ДМСО-d6), δ, м.д.: 17.3 (CH3), 28.1 (3CHAd),
кость, [α]D25 +13.2° (с 1.0, CHCl3).
34.7 (CAd), 36.9 (3CH2Ad), 38.7 (3CH2Ad), 56.2 (CH),
69.6 (CH), 183.5 (C=S). Найдено, %: C 67.15; H
2-(Адамантан-1-ил)-3-метил-5,6-дифенил-
2,3-дигидропиразин
(7).
Раствор
70
мг
8.86; N 11.19; S 12.80. C14H22N2S. Вычислено, %:
(0.34 ммоль)
1-(адамантан-1-ил)пропан-1,2-ди-
C 67.20; H 8.80; N 11.27; S 12.73.
амина (6) и 70 мг (0.33 ммоль) 1,2-дифенил-
(4S,5R)-4-(Адамантан-1-ил)-5-метилимида-
этан-1,2-диона в 5 мл этанола нагревали при ки-
золидин-2-тион [(4S,5R)-8] получен по аналогич-
пении 6 ч. Растворитель отгоняли в вакууме, оста-
ной методике из 0.06 г (1S,2R)-1-(адамантан-1-ил)-
ток перекристаллизовывали из метанола. Выход
пропан-1,2-диамина (1S,2R-6), перекристаллизо-
80 мг
(63%), светло-желтые кристаллы, т.пл.
вывали из н-бутанола, выход 0.06 г (83%), бесцвет-
122-125°C. ИК спектр, ν, см-1: 3066, 3022, 2904,
ные кристаллы, т.пл. > 280°C с разл., [α]D25-9.6° (с
2845, 1550, 1442, 1024, 1002, 765, 686, 584, 569.
0.25, CHCl3). Анализ ВЭЖХ: tr 3.485 мин [(4S,5R)-
Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.99 с (3Н, СН3),
8, 97%], tr 3.758 мин [(4R,5S)-8, 3%].
1.74-2.03 м (12Н, 12СНAd), 2.13 c (3H, 3CHAd),
РСА
(4S,5R)-4-(адамантан-1-ил)-5-метил-
2.83-2.86 м (1Н, СH), 4.40-4.44 м (1Н, СH), 7.21-
7.29 м (6Наром), 7.37-7.39 м (2Наром), 7.41-7.45 м
имидазолидин-2-тиона
[(4S,5R)-8]. Кристаллы
выращены из н-бутанола при комнатной темпе-
(2Наром). Спектр ЯМР 13C (CDCl3), δ, м.д.: 11.4
ратуре. C14H22N2S, M 250.40, кристаллы при-
(CH3), 28.7 (3CHAd), 35.9 (CAd), 37.3 (3CH2Ad), 39.9
(3CH2Ad), 51.3 (CH), 68.0 (CH), 127.9 (2CHаром),
зматические, пространственная группа Р1¯, а
128.0 (2CHаром), 128.1 (4CHаром), 129.2 (CHаром),
6.482(2), b 8.554(3), c 12.684(4)°; α 104.878(12)°,
129.5 (CHаром), 137.9 (Cаром), 138.0 (Cаром), 158.1
β 100.698(13)°, γ 93.746(13)°; V 663.2(4) Å3, dрасч
1.254 мг/см3, Z 2, F(000) 272, l 0.71073 Å, m
(C=N), 158.9 (C=N). Найдено, %: C 84.77; H 7.90;
N 7.33. C27H30N2. Вычислено, %: C 84.83; H 7.87;
0.225 мм-1, всего отражений/независимых отра-
N 7.30.
жений 2830/1756, T 105(2) K, θ 2.481-26.941, R1
0.0733, ωR2 0.1729 для [I > 2σ(I)], R1 0.1317, ωR2
(2S,3R)-2-(Адамантан-1-ил)-3-метил-5,6-ди-
0.2024 для всех данных.
фенил-2,3-дигидропиразин [(2S,3R)-7] получен
по аналогичной методике из 0.05 г (0.24 ммоль)
5-(Адамантан-1-ил)-2-(бензилтио)-4-метил-
(1S,2R)-1-(адамантан-1-ил)пропан-1,2-диамина
4,5-дигидро-1H-имидазол гидрохлорид
(9).
[(1S,2R)-6], выход 0.05 г (56%), светло-желтые
Раствор 65 мг (0.26 ммоль) 4-(адамантан-1-ил)-
кристаллы, т.пл. 145-147°C, [α]D25 +63.4° (с 0.25,
5-метилимидазолидин-2-тиона
(8) и
0.045 мл
CHCl3).
(0.05 г, 0.39 ммоль) бензилхлорида в 5 мл метано-
4-(Адамантан-1-ил)-5-метилимидазолидин-
ла нагревали при кипении 4 ч. Реакционную смесь
2-тион (8). Раствор 0.2 г (0.96 ммоль) 1-(ада-
охлаждали до комнатной температуры, добавля-
мантан-1-ил)пропан-1,2-диамина (6) и 0.064 мл
ли диэтиловый эфир, выпавший осадок отфиль-
(0.08 г, 1 ммоль) сероуглерода в смеси 8 мл этано-
тровывали. Выход 70 мг (71%), бесцветные кри-
ла и 2 мл воды нагревали при кипении 3 ч. К ре-
сталлы, т.пл. 235-237°C. ИК спектр, ν, см-1: 2908,
акционной смеси добавляли 3 капли 36%-ной со-
2848, 2663, 1583, 1456, 1446, 759, 748, 696, 480.
ляной кислоты и кипятили еще 6 ч. Растворитель
Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.23 д (3Н,
отгоняли в вакууме. Остаток очищали колоночной
СН3, 3J 6.4 Гц), 1.46-1.71 м (12Н, 12СНAd), 1.87 c
хроматографией (хлороформ-ацетон, 5:1). Выход
(3H, 3CHAd), 3.60 д (1Н, 3J 9.2 Гц, СH), 4.23-4.30
0.15 г (64%), бесцветные кристаллы, т.пл. > 290°C с
м (1Н, СH), 4.67 с (2Н, СН2), 7.31-7.34 м (3Наром),
разл. Анализ ВЭЖХ: tr 3.550 мин [(4S,5R)-8, 50%],
7.44-7.46 м (2Наром), 10.70 уш.с (2Н, NH·HCl).
tr 3.819 мин [(4R,5S)-8, 50%]. ИК спектр, ν, см-1:
Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 16.6 (CH3),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
346
МАНЬКОВА и др.
27.9 (3CHAd), 35.0 (CH2), 35.3 (CAd), 36.6 (3CH2Ad),
смесь перемешивали при комнатной температуре
38.3 (3CH2Ad), 58.0 (CH), 70.5 (CH), 128.5 (CHаром),
4 ч, растворитель отгоняли в вакууме, к остатку
129.2
(2CHаром),
129.5
(2CHаром), 136.1 (Cаром),
добавляли 15 мл воды, экстрагировали хлоро-
167.8 (C-S). Найдено, %: C 66.91; H 7.75; N 7.43, S
формом (3×4 мл), сушили Na2SO4, растворитель
8.50. C21H29ClN2S. Вычислено, %: C 66.94; H 7.70;
отгоняли в вакууме. Остаток растворяли в мини-
N 7.49, S 8.52.
мальном количестве изопропанола, добавляли
0.2 мл 36%-ной HCl, выпавшие кристаллы отфи-
1-(Адамантан-1-ил)-N,N'-дибензилиденпро-
льтровывали, растворяли в минимальном количе-
пан-1,2-диамин (10). К раствору 0.15 г (0.72 ммоль)
стве этанола, добавляли диэтиловый эфир, выпав-
1-(адамантан-1-ил)пропан-1,2-диамина (6) в 10 мл
ший осадок отфильтровывали. Выход 0.04 г (56%),
метанола добавляли при перемешивании 0.173 г
бесцветные кристаллы, т.пл. 233-238°C с разл. ИК
(1.44 ммоль) сульфата магния и 0.14 мл (0.15 г,
спектр, ν, см-1: 2908, 2848, 2663, 1583, 1446, 759,
1.44 ммоль) бензальдегида, нагревали при ки-
748, 696, 480. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
пении и перемешивании 6 ч в атмосфере арго-
1.55-1.60 м (12Н, СН3+9СНAd), 1.90-1.97 м (6H,
на. Реакционную смесь охлаждали до комнатной
6CHAd), 3.73-3.85 м (2H, СН2), 4.23 c (2H, СН2),
температуры, растворитель отгоняли в вакууме,
4.33-4.35 м (1H, СН), 4.53-4.55 м (1H, СН), 7.39-
к остатку добавляли 20 мл воды, экстрагировали
7.42 м (6Наром), 7.62-7.64 м (2Наром), 7.74-7.76 м
хлороформом (3×5 мл), органические вытяжки
(2Наром), 9.14-9.26 м (2H, NH·HCl), 10.16 уш.с
сушили Na2SO4, растворитель отгоняли в вакуу-
(2H, NH·HCl). Спектр ЯМР 13С (ДМСО-d6), δ,
ме. Остаток перекристаллизовывали из водного
м.д.: 13.3 (СН3), 28.1 (3СНAd), 36.1 (3СН2Ad), 37.5
этанола. Выход 0.15 г (54%), бесцветные кри-
(СAd), 38.5 (3CH2Ad), 48.6 (СН2), 52.2 (СН), 53.6
сталлы, т.пл. 103-105°C. ИК спектр, ν, см-1: 2897,
(СН2), 68.1 (СН), 129.0 (2CHаром), 129.1 (3CHаром),
2846, 1643, 1579, 1448, 756, 694. Спектр ЯМР 1Н
129.4 (CHаром), 130.7 (3CHаром), 131.4 (CHаром),
(CDCl3), δ, м.д.: 1.09 д (3Н, СН3, 3J 6.4 Гц), 1.58-
132.3 (2Cаром). Найдено, %: C 70.27; H 8.30; N 6.07.
1.74 м (12Н, 12СНAd), 1.92 с (3H, 3CHAd), 2.87 д
(1H, 3J 5.2 Гц, СН), 4.00 пентет (1H, СН, 3J 6.4 Гц),
C27H38Cl2N2. Вычислено, %: С 70.25; H 8.27; N
6.14.
7.39-7.42 м (6Наром), 7.71-7.73 м (2Наром), 7.78-
7.80 м (2Наром), 8.18 с (1H, N=CH), 8.32 с (1H,
(1S,2R)-1-(Адамантан-1-ил)-N,N'-дибензил-
N=CH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 21.0
пропан-1,2-диамин дигидрохлорид [(1S,2R)-11]
(СН3), 28.8 (3СНAd), 37.1 (СAd), 37.3 (3СН2Ad), 40.2
получен по аналогичной методике из
0.33 г
(3CH2Ad), 65.5 (СН), 84.7 (СН), 128.1 (2CHаром),
(0.86 ммоль) (1S,2R)-1-(адамантан-1-ил)-N,N'-ди-
128.3 (2CHаром), 128.5 (2CHаром), 128.6 (2CHаром),
бензилиденпропан-1,2-диамина [(1S,2R)-10] с вы-
130.2 (CHаром), 130.4 (CHаром),
136.8
(2Cаром),
ходом 0.22 г (55%), бесцветные кристаллы, т.пл.
158.8 (N=CH), 160.0 (N=CH). Найдено, %: C 84.33;
228-235°C с разл.
H 8.39; N 7.28. C27H32N. Вычислено, %: C 84.29; H
1-(Адамантан-1-ил)-N,N'-дибензилпропан-
8.35; N 7.36.
1,2-диамин (12). К раствору 55 мг (0.12 ммоль)
(1S,2R)-1-(Адамантан-1-ил)-N,N'-дибензили-
1-(адамантан-1-ил)-N,N'-дибензилпропан-1,2-ди-
денпропан-1,2-диамин [(1S,2R)-10] получен по
амина дигидрохлорида (11) в 10 мл воды и 5 мл
аналогичной методике из 0.04 г (0.2 ммоль) (1S,2R)-
хлористого метилена прибавляли при переме-
1-(адамантан-1-ил)пропан-1,2-диамина
[(1S,2R)-
шивании 20 мг (0.5 ммоль) гидроксида натрия.
6] с выходом 0.05 г (74%), бесцветные кристаллы,
Реакционную смесь перемешивали 15 мин, отде-
т.пл. 116-118°C, [α]D25 -32.0° (с 0.1, CHCl3).
ляли органический слой, водный слой экстрагиро-
1-(Адамантан-1-ил)-N,N'-дибензилпропан-
вали хлористым метиленом (4×5 мл), суммарные
1,2-диамин дигидрохлорид (11). К раствору 0.06 г
органические вытяжки сушили Na2SO4, раствори-
(0.16 ммоль) 1-(адамантан-1-ил)-N,N'-дибензили-
тель отгоняли в вакууме. Выход 35 мг (76%), бес-
денпропан-1,2-диамина (10) в 10 мл метанола
цветная маслянистая жидкость. ИК спектр, ν, см-1:
при перемешивании порционно добавляли 0.06 г
3028, 2897, 2846, 1604, 1492, 1450, 1342, 1111,
(1.60 ммоль) боргидрида натрия. Реакционную
1026, 729, 694.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
СИНТЕЗ 1-(АДАМАНТАН-1-ИЛ)ПРОПАН-1,2-ДИАМИНА
347
(1S,2R)-1-(Адамантан-1-ил)-N,N'-дибензил-
бавляли 0.02 г (0.47 ммоль) LiCl, перемешивали
пропан-1,2-диамин [(1S,2R)-12] получен по ана-
и нагревали при кипении еще 2 ч. Реакционную
логичной методике из 50 мг (0.11 ммоль) (1S,2R)-
смесь охлаждали, добавляли 20 мл воды, выпав-
1-(адамантан-1-ил)-N,N'-дибензилпропан-1,2-
ший осадок отфильтровывали. Выход 0.04 г (58%),
диамина дигидрохлорида [(1S,2R)-11] с выходом
коричневые кристаллы, т.пл. > 220°C с разл.,
35 мг (83%), бесцветная маслянистая жидкость,
[α]D25 -1170° (с 0.01, CH2Cl2). ИК спектр, ν, см-1:
[α]D25 -17.4° (с 0.1, CHCl3).
2951, 2904, 2854, 1604, 1531, 1462, 1249, 1172,
837, 540. Найдено, %: C 70.81; H 8.57; N 3.84.
[(1S,2R)-1-(Адамантан-1-ил)пропан-1,2-ди-
C43H62ClMnN2O2. Вычислено, %: C 70.86; H 8.52;
ил]бис(азанилиден)бис(метанилиден)бис-
N 3.89.
(2,4-ди-трет-бутилфенол)
[(1S,2R)-13]. Смесь
0.04 г (0.19 ммоль) (1S,2R)-1-(адамантан-1-ил)-
[1-(Адамантан-1-ил)-N,N'-дибензилпропан-
пропан-1,2-диамина
[(1S,2R)-6] и
0.09
г
1,2-диамин](дибромо)никель
(15). К раствору
(0.38 ммоль)
3,5-ди(трет-бутил)салицилового
25 мг (0.064 ммоль) 1-(адамантан-1-ил)-N,N'-ди-
альдегида в 5 мл изопропанола нагревали при ки-
бензилпропан-1,2-диамина (12) добавляли 5 мл
пении 4 ч. Реакционную смесь охлаждали до ком-
ацетонитрила, 7 мг (0.032 ммоль) безводного бро-
натной температуры, растворитель отгоняли в ва-
мида никеля и кипятили 6 ч. Выпавший при ох-
кууме, остаток перекристаллизовывали из водного
лаждении осадок отфильтровывали. Выход 0.02 г
этанола. Выход 0.09 г (73%), желтые кристаллы,
(35%), светло-розовые кристаллы, т.пл. > 295°C с
т.пл. 125-127°C, [α]D25 +74.0° (с 0.2, CHCl3). ИК
разл. ИК спектр, ν, см-1: 2900, 2846, 1573, 1450,
спектр, ν, см-1: 2951, 2902, 2848, 1625, 1438, 1361,
1026, 748, 694, 634. Найдено, %: C 65.14; H 7.29;
1230, 1217, 1203, 1170, 877, 771. Спектр ЯМР
N 5.63. C54H72BrN4Ni. Вычислено, %: C 65.10; H
1Н (CDCl3), δ, м.д.: 1.17 д (3Н, СН3), 1.22 с (9Н,
7.31; N 5.68.
3СН3), 1.25 с (9Н, 3СН3), 1.34 с (9Н, 3СН3), 1.37 с
Методика модельной реакция Анри. Рас-
(9Н, 3СН3), 1.55-1.65 м (12Н, 12СНAd), 1.93 с (3Н,
твор 9.8 мг (4.92×10-5 моль) Cu(OAc)2·H2O и
3СНAd), 3.92-3.94 м (1Н, СН), 3.98-4.00 м (1Н,
4.92×10-5 моль соответствующего лиганда в 3 мл
СН), 7.19 д (1Наром, 4J 2.0 Гц), 7.30 д (1Наром, 4J
изопропанола выдерживали 15 мин на ультразву-
2.0 Гц), 7.52 д (1Наром, 4J 2.4 Гц), 7.60 д (1Наром,
ковой бане, добавляли 0.26 мл (0.29 г, 4.85 ммоль)
4J 2.0 Гц), 8.34 с (1H, N=CH), 8.59 с (1H, N=CH),
нитрометана (17), 6.3 мг (4.92×10-5 моль) этилди-
13.99 с (1H, OH), 14.25 с (1H, OH). Спектр ЯМР
изопропиламина, 0.1 мл (0.1 г, 0.98 ммоль) бен-
13С (CDCl3), δ, м.д.: 19.9 (CH3), 28.4 (3СНAd), 29.6
зальдегида (16). Реакционную смесь выдерживали
(3CH3), 29.7 (3CH3), 31.6 (3CH3), 31.7 (3CH3), 34.3
18 ч, растворитель отгоняли в вакууме. Остаток
(2С), 35.4 (2C), 35.8 (CAd), 37.0 (3СН2Ad), 39.9
пропускали через слой силикагеля (петролейный
(3CH2Ad), 62.7 (СН), 83.7 (СН),
118.0
(2Cаром),
эфир-этилацетат, 10:1). Лиганд (1S,2R)-6 исполь-
126.6 (2CHаром), 126.9 (2CHаром), 131.5 (2Cаром),
зовали в количестве 10.2 мг, выход (S)-2-нитро-1-
136.1 (2Cаром), 158.0 (Cаром-OH), 158.4 (Cаром-OH),
фенилэтанола (18) 0.1 г (61%), бесцветная мас-
165.9 (N=CH), 167.6 (N=CH). Найдено, %: C 80.57;
лянистая жидкость, [α]D25 -6.7° (с 1, CHCl3), ee
H 10.06; N 4.37. C43H64N2O4. Вычислено, %: C
28%. Анализ ВЭЖХ: tr 30.181 мин [(R)-18, 36%], tr
80.54; H 10.02; N 4.44.
31.558 мин [(S)-18, 64%]. Лиганд (1S,2R)-10 ис-
[(1S,2R)-1-(Адамантан-1-ил)пропан-1,2-ди-
пользовали в количестве 18.9 мг, выход (R)-2-
ил]бис(азанилиден)бис(метанилиден)бис-
нитро-1-фенилэтанола-1 (18) 0.06 г (37%), бес-
(2,4-ди-трет-бутилфенят)(хлор)марганца
цветная маслянистая жидкость, [α]D25 +11.6° (с
[(1S,2R)-14]. К раствору
0.06 г
(0.09 ммоль)
1.0, CHCl3), ee 52%. Анализ ВЭЖХ: tr 30.154 мин
[(1S,2R)-1-(адамантан-1-ил)пропан-1,2-диил]бис-
[(R)-18, 76%], tr 31.528 мин [(S)-18, 24%]. Лиганд
(азанилиден)бис(метанилиден)бис(2,4-ди-трет-
(1S,2R)-12 использовали в количестве 19 мг, выход
бутилфенола) [(1S,2R)-13] в 5 мл этанола добав-
рацемического
2-нитро-1-фенилэтанола-1
(18)
ляли 0.12 г (0.47 ммоль) Mn(OAc)2·4H2O, смесь
0.07 г (45%), бесцветная маслянистая жидкость.
перемешивали и нагревали при кипении 6 ч, до-
Анализ ВЭЖХ: tr 30.206 мин [(R)-18, 50%], tr
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
348
МАНЬКОВА и др.
31.570 мин [(S)-18, 50%]. ИК спектр 2-нитро-1-фе-
дов для асимметрического металлокомплексного
нилэтанола-1 (18), ν, см-1: 3032, 2970, 2908, 1697,
катализа.
1550, 1492, 1454, 1377, 698 [40].
ФОНДОВАЯ ПОДДЕРЖКА
Методика модельной реакция Михаэля. К
Исследование выполнено при финансовой под-
раствору 0.11 г (0.73 ммоль) β-нитростирола и
держке РФФИ в рамках проектов № 20-33-90272
0.11 г (0.1 мл, 0.66 ммоль) диэтилмалоната в 3 мл
и № 20-53-04035. Спектральные исследования вы-
хлороформа добавляли 13.1 мг (1.32×10-5 моль)
полнены при финансовой поддержке Минобрнауки
комплекса 15. Реакционную смесь перемешивали
РФ в рамках проектной части государственного за-
24 ч при комнатной температуре, растворитель от-
дания № 0778-2020-0005.
гоняли в вакууме. Остаток пропускали через слой
ИНФОРМАЦИЯ ОБ АВТОРАХ
силикагеля (хлороформ). Выделены исходные ве-
щества.
Манькова Полина Анатольевна, ORCID: https://
orcid.org/0000-0002-7835-1332
Методика модельной реакция эпоксидиро-
вания. К раствору 0.36 г (0.4 мл, 3.46 ммоль) сти-
Резников Александр Николаевич, ORCID:
рола и 23.5 мг (3.46×10-5 моль) комплекса (1S,2R)-
14 в 10 мл ацетонитрила добавляли 2.8 мл (2.9 г,
48.4 ммоль) уксусной кислоты и 0.9 мл (1.03 г,
orcid.org/0000-0002-6710-0722
9.67 ммоль) 33%-ной перекиси водорода. Через
24 ч к реакционной смеси добавляли насыщ. рас-
Ткаченко Илья Михайлович, ORCID: https://
твор NaHCO3 до pH 7, экстрагировали хлористым
orcid.org/0000-0002-0386-4184
метиленом (5×3 мл), сушили Na2SO4, раствори-
Климочкин Юрий Николаевич, ORCID: https://
тель отгоняли в вакууме. Остаток пропускали че-
orcid.org/0000-0002-7335-4040
рез слой силикагеля (петролейныйэфир-этилаце-
КОНФЛИКТ ИНТЕРЕСОВ
тат, 5:1). Выделено исходное вещество.
Авторы заявляют об отсутствии конфликта ин-
ЗАКЛЮЧЕНИЕ
тересов.
Предложен подход к синтезу эритро- и (1S,2R)-
СПИСОК ЛИТЕРАТУРЫ
1-(адамантан-1-ил)пропан-1,2-диаминов
[6 и
(1S,2R)-6]. Описан новой способ дериватизации
1. Michalson E.T., Szmuszkovicz J. Progress in Drug
вицинальных диаминов реакцией с бензилом для
Research. Ed. E. Jucker. Basel: Birkhäuser. 1989, 33,
анализа на ВЭЖХ. Синтезированные лиганды ди-
135-149. doi 10.1007/978-3-0348-9146-2_6
аминового и саленового типа исследованы в мо-
2. Shiryaev V.A., Radchenko E.V., Palyulin V.A., Zefi-
дельных реакциях Анри, Михаэля и эпоксидирова-
rov N.S., Bormotov N.I., Serova O.A., Shishkina L.N.,
BaimuratovM.R., Bormasheva K.M., Gruzd Yu.A.,
ния. В реакции Анри лиганды (1S,2R)-6 и (1S,2R)-
Ivleva E.A., LeonovaM.V., Lukashenko A.V., Osi-
10 способствуют энантиомерному обогащению
pov D.V., OsyaninV.A., Reznikov A.N., Shadriko-
продукта 18, для лиганда (1S,2R)-12 наблюдалось
va V.A., Sibiryakova A.E., Tkachenko I.M., Klimoch-
образование рацемического 18. В реакции Анри
kin Y.N. Eur. J. Med. Chem. 2018, 158, 214-235. doi
отмечена стереодивергенция при использовании
10.1016/j.ejmech.2018.08.009
лигандов (1S,2R)-6 и (1S,2R)-10. В присутствии
3. Putala M., Kastner-Pustet N., Mannschreck A.
комплексов 15 и (1S,2R)-14 реакции присоеди-
Tetrahedron Asymmetry. 2002, 12, 3333-3342. doi
нения по Михаэлю, а также эпоксидирования
10.1016/S0957-4166(02)00014-9
стирола не наблюдалось. Вероятно, это связано с
4. Wojaczyńska E., Bakowicz J., Dorsz M., Skarżews-
эритро-формой исследуемого диамина. В связи
ki J. J. Org. Chem. 2013, 78, 2808-2811. doi 10.1021/
с этим необходимы исследования трео-формы
jo302820m
1-(адамантан-1-ил)пропан-1,2-диамина, а также
5. Alexakis A., Mangeney P., Lensen N., Tranchier J.P.,
других адамантилсодержащих вицинальных диа-
Gosmini R., Raussou S. Pure Appl. Chem. 1996, 68,
минов с целью поиска более эффективных лиган-
531-534. doi 10.1351/pac199668030531
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
СИНТЕЗ 1-(АДАМАНТАН-1-ИЛ)ПРОПАН-1,2-ДИАМИНА
349
6.
Kawashima M., Hirata R. Bull. Chem. Soc. Jpn. 1993,
kotikhin A.E., Traven’ V.F., Voskresenskii L.G., Zub-
66, 2002-2005. doi 10.1246/bcsj.66.2002
kov F.I., Golubchikov O.A., Semeikin A.S., Bere-
7.
Злотин С.Г., Кочетков С.В. Усп. хим. 2015, 84, 1077-
zin D.B., Stuzhin P.A., Filimonov V.D., Krasnokutska-
1099. [Zlotin S.G., Kochetkov S.V. Russ. Chem. Rev.
ya E.A., Fedorov A.Yu., Nyuchev A.V., Orlov V.Yu.,
2015, 84, 1077-1099.] doi 10.1070/RCR4562
Begunov R.S., Rusakov A.I., Kolobov A.V., Kofa-
nov E.R., Fedotova O.V., Egorova A.Yu., Charu-
8.
Kizirian J.C. Chem. Rev. 2008, 108, 140-205. doi
shin V.N., Chupakhin O.N., Klimochkin Yu.N., Osya-
10.1021/cr040107v
nin V.A., Reznikov A.N., Fisyuk A.S., Sagitullina G.P.,
9.
González-Sabín J., Rebolledo F., Gotor V. Chem. Soc.
Aksenov A.V., Aksenov N.A., Grachev M.K., Maslen-
Rev. 2009, 38, 1916-1925. doi 10.1039/B818679K
nikova V.I., Koroteev M.P., Brel’ A.K., Lisina S.V.,
10.
Shaw S., White J.D. Chem. Rev. 2019, 119, 9381-9426.
Medvedeva S.M., Shikhaliev Kh.S., Suboch G.A.,
doi 10.1021/acs.chemrev.9b00074
Tovbis M.S., Mironovich L.M., Ivanov S.M., Kurba-
11.
Bennani Y.L., Hanessian S. Chem. Rev. 1997, 97,
tov S.V., Kletskii M.E., Burov O.N., Kobrakov K.I.,
3161-3196. doi 10.1021/cr9407577
Kuznetsov D.N. Russ. J. Org. Chem. 2018, 54, 157-
12.
Fache F., Schulz E., Tommasino M.L., Lemaire M.
371.] doi 10.1134/S107042801802001X
Chem. Rev. 2000, 100, 2159-2232. doi 10.1021/
14.
Zhu Y., Zhang W., Mei H., Han J., Soloshonok V.A.,
cr9902897
Pan Y. Chem. Eur. J. 2017, 23, 11221-11225. doi
13.
Коновалов А.И., Антипин И.С., Бурилов В.А., Мад-
10.1002/chem.201702091
жидов Т.И., Курбангалиева А.Р., Немтарев А.В., Со-
15.
Junge K., Wendt B., Zhou S., Beller M. Eur. J.
ловьева С.Е., Стойков И.И., Мамедов В.А., Захаро-
Org. Chem. 2013, 2013, 2061-2065. doi 10.1002/
ва Л.Я., Гаврилова Е.Л., Синяшин О.Г., Балова И.А.,
ejoc.201300039
Васильев А.В., Зенкевич И.Г., Красавин М.Ю.,
16.
Shen C., Chen L., Tang J., Xu M. Chin. J. Chem. 2009,
Кузнецов М.А., Молчанов А.П., Новиков М.С., Ни-
27, 413-418. doi 10.1002/cjoc.200990068
колаев В.А., Родина Л.Л., Хлебников А.Ф., Белец-
17.
Kogami Y., Nakajima T., Ikeno T., Yamada T. Synthesis.
кая И.П., Вацадзе С.З., Громов С.П., Зык Н.В.,
2004, 2004, 1947-1950. doi 10.1055/s-2004-829157
Лебедев А.Т., Леменовский Д.А., Петросян В.С.,
Ненайденко В.Г., Негребецкий В.В., Бауков Ю.И.,
18.
Резников А.Н., Сибирякова А.Э., Климоч-
Шмиголь Т.А., Корлюков А.А., Тихомиров А.С.,
кин Ю.Н. ЖОХ.
2014,
84,
1922-1924.
[Rezni-
Щекотихин А.Е., Травень В.Ф., Воскресенский Л.Г.,
kov A.N., Sibiryakova A.E., Klimochkin Y.N. Russ.
Зубков Ф.И., Голубчиков О.А., Семейкин А.С., Бе-
J. Gen. Chem. 2014, 84, 2280-2282.] doi 10.1134/
резин Д.Б., Стужин П.А., Филимонов В.Д., Крас-
S1070363214110437
нокутская Е.А., Федоров А.Ю., Нючев А.В., Ор-
19.
Papanastasiou I., Tsotinis A., Foscolos G.B.,
лов В.Ю., Бегунов Р.С., Русаков А.И., Колобов А.В.,
Prathalingam S.R., Kelly J.M. J. Heterocycl. Chem.
Кофанов Е.Р., Федотова О.В., Егорова А.Ю., Чару-
2008, 45, 1401-1406. doi 10.1002/jhet.5570450524
шин В.Н., Чупахин О.Н., Климочкин Ю.Н., Ося-
20.
Tataridis D., Fytas G., Kolocouris A., Fytas C.,
нин В.А., Резников А.Н., Фисюк А.С., Сагитулли-
Kolocouris N., Foscolos G.B., Padalko E., Neyts J., De
на Г.П., Аксенов А.В., Аксенов Н.А., Грачев М.К.,
Clercq E. Bioorg. Med. Chem. Lett. 2007, 17, 692-696.
Масленникова В.И., Коротеев М.П., Брель А.К.,
doi 10.1016/j.bmcl.2006.10.092
Лисина С.В., Медведева С.М., Шихалиев Х.С., Су-
21.
Koperniku A., Papanastasiou I., Foscolos G.B., Tsoti-
боч Г.А., Товбис М.С., Миронович Л.М., Ива-
nis A., Taylor M.C., Kelly J.M. MedChemComm. 2013,
нов С.М., Курбатов С.В., Клецкий М.Е., Буров О.Н.,
4, 856-859. doi 10.1039/C3MD00081H
Кобраков К.И., Кузнецов Д.Н. ЖОрХ. 2018, 54,
22.
Манькова П.А., Резников А.Н., Ширяев В.А., Бай-
161-360. [Konovalov A.I., Antipin I.S., Burilov V.A.,
муратов М.Р., Рыбаков В.Б., Климочкин Ю.Н.
Madzhidov T.I., Kurbangalieva A.R., Nemtarev A.V.,
ЖОрХ. 2021, 57, 268-279. [Man’kova P.A., Rezni-
Solovieva S.E., Stoikov I.I., Mamedov V.A., Zakharo-
kov A.N., Shiryaev V.A., Baimuratov M.R., Ryba-
va L.Ya., Gavrilova E.L., Sinyashin O.G., Balova I.A.,
kov V.B., Klimochkin Y.N. Russ. J. Org. Chem. 2021,
Vasilyev A.V., Zenkevich I.G., Krasavin M.Yu.,
Kuznetsov M.A., Molchanov A.P., Novikov M.S.,
57, 226-236.] doi 10.1134/S0514749218110043
Nikolaev V.A., Rodina L.L., Khlebnikov A.F., Belets-
23.
Леонова М.В., Белая Н.В., Баймуратов М.Р., Кли-
kaya I.P., Vatsadze S.Z., Gromov S.P., Zyk N.V., Leb-
мочкин Ю.Н. ЖОрХ. 2018, 54, 1634-1641. [Leono-
edev A.T., Lemenovskii D.A., Petrosyan V.S., Nenaid-
va M.V., Belaya N.V., Baimuratov M.R., Klimoch-
enko V.G., Negrebetskii V.V., Baukov Yu.I., Shmi-
kin Y.N. Russ. J. Org. Chem. 2018, 54, 1643-1651.] doi
gol’ T.A., Korlyukov A.A., Tikhomirov A.S., Shche-
10.1134/S0514749218110043
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
350
МАНЬКОВА и др.
24.
Lee G.E., Shin M.R., Kang H.Y. Bull. Korean Chem.
kon Y.N. Chem. Commun. 1998, 3, 387-388. doi
Soc. 2014, 35, 695-696. doi 10.5012/bkcs.2014.35.3.695
10.1039/A706121H
25.
Liu J., Wang C. ACS Catal. 2019, 10, 556-561. doi
33. Joshi-Pangu A., Cohen R.D., Tudge M.T., Chen Y.
10.1021/acscatal.9b04823
J. Org. Chem. 2016, 81, 3070-3075. doi 10.1021/
26.
Reznikov A.N., Mankova P.A., Klimochkin Y.N.
acs.joc.6b00322
CCDC
2164846: Experimental Crystal Structure
34. Kawatsura M., Hayashi S., Komatsu Y., Hayase S.,
Determination, 2022. doi 10.5517/ccdc.csd.cc2bnprg
Itoh T. Chem. Lett. 2010, 39, 466-467. doi 10.1246/
27.
Li L., Xu L.W., Ju Y.D., Lai G.Q. Synth. Commun.
cl.2010.466
2009, 39, 764-774. doi 10.1080/00397910802431131
35. Wang Q., Neudörfl J.M., Berkessel A. Chem. Eur. J.
28.
Wang W., Wang J., Zhou S., Sun Q., Ge Z., Wang X.,
2015, 21, 247-254. doi 10.1002/chem.201404639
Li R. Chem. Commun. 2013, 49, 1333-1335. doi
36. Berkessel A., Ong M.C., Nachi M., Neudörfl J.M.
10.1039/C2CC35488H
ChemCatChem. 2010, 2, 1215-1218. doi 10.1002/
29.
Сибирякова А.Э., Резников А.Н., Рыбаков В.Б., Кли-
cctc.201000104
мочкин Ю.Н. ЖОрХ. 2017, 53, 268-279. [Sibiryako-
37. Moteki S.A., Han J., Arimitsu S., Akakura M.,
va A.E., Reznikov A.N., Rybakov V.B., Klimoch-
Nakayama K., Maruoka K. Angew. Chem. Int. Ed.
kin Y.N. Russ. J. Org. Chem. 2017, 53, 167-170.] doi
2012, 51, 1187-1190. doi 10.1002/anie.201107239
10.1134/S1070428017020014
38. Matsunaga H., Nakanishi K., Nakajima M.
30.
Резников А.Н., Сибирякова А.Э., Климочкин Ю.Н.
Heterocycles. 2009, 78, 617-622. doi 10.3987/COM-
ЖОрХ.
2014,
50,
1706-1707.
[Reznikov A.N.,
08-11563
Sibiryakova A.E., Klimochkin Y.N. Russ. J. Org.
Chem.
2014,
50,
1695-1696.] doi
10.1134/
39. Beletskaya I.P., Najera C., Yus M. Chem.
S107042801411027X
Rev.
2018,
118,
5080-5200. doi
10.1021/
31.
Li Z., Conser K.R., Jacobsen E.N. J. Am. Chem. Soc.
acs.chemrev.7b00561
1993, 115, 5326-5327. doi 10.1021/ja00065a067
40. MacDonald F.K., Carneiro K.M.M., Pottie I.R.
32.
Tararov V.I, Hibbs D.E., Hursthouse M.B., Ikonni-
Tetrahedron Lett. 2011, 52, 891-893. doi 10.1016/
kov N.S., Malik K.M.A., North M., Orizu C., Belo-
j.tetlet.2010.12.056
Synthesis of 1-(Adamantan-1-yl)propan-1,2-diamine
and Chiral Ligands Based Thereon
P. А. Mankova*, А. N. Reznikov, V. А. Shiryaev, I. M. Tkachenko, and Y. N. Klimochkin
Samara State Technical University, ul. Molodogvardeyskaya, 244, Samara, 443100 Russia
*e-mail: orgchem@samgtu.ru
Received June 2, 2022; revised June 12, 2022; accepted June 14, 2022
Racemic 1-(adamantan-1-yl)propan-1,2-diamine which was resolved with l-malic acid was obtained from
trans-2-(adamantan-1-yl)-3-methylaziridine. The isolated (1S,2R)-isomer was derivatized with benzyl. Enan-
tiomeric excess of (2S,3R)-2-(adamantan-1-yl)-3-methyl-5,6-diphenyl-2,3-dihydropyrazine was determined
by HPLC. (4S,5R)-4-(Adamantan-1-yl)-5-methylimidazolidine-2-thione was synthesized by the reaction of
(1S,2R)-diamine with carbon disulfide; absolute configuration was determined by X-ray diffraction analysis.
Ligands were synthesized on the basis of racemic and chiral (1S,2R)-1-(adamantan-1-yl)propan-1,2-diamines.
The catalytic activity complexes were studied using Michael, Henri and epoxidation model reactions. For the
model reaction of Henri stereodivergence was noted when using ligands of a similar structure.
Keywords: vicinal diamines, adamantane, racemate resolution, chirality, ligands
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023