ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 3, с. 358-365
УДК 547-431
ВЗАИМОДЕЙСТВИЕ 1,3-ДИГАЛОГЕНАДАМАНТАНОВ
С АЗОТНОЙ КИСЛОТОЙ1
© 2023 г. Е. А. Ивлева*, Е. В. Симатова, В. В. Клепиков,
Ю. Э. Хатмуллина, Ю. Н. Климочкин
ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
*e-mail: ivleva.ea@samgtu.ru
Поступила в редакцию 18.08.2022 г.
После доработки 24.08.2022 г.
Принята к публикации 26.08.2022 г.
При взаимодействии 1,3-дибромпроизводных адамантанового ряда с дымящей азотной кислотой по-
лучены смеси продуктов 2-оксаадамантановой структуры. В аналогичных превращениях из 1,3-дии-
одпроизводных адамантанового ряда выделены только соответствующие 1,3-динитроксиадамантаны.
Разработан препаративный метод синтеза 5,7-диметил-3-бромметил-1-гидрокси-2-оксаадамантан-1-ола
из 5,7-диметил-1,3-дибромадамантана. За счет наличия нескольких функциональных групп полученные
соединения могут быть использованы в качестве исходных субстратов в синтезе веществ с широким
спектром биологической активности.
Ключевые слова: 2-оксаадамантан, дымящая азотная кислота, 1,3-дигалогенадамантаны
DOI: 10.31857/S0514749223030072, EDN: SWJWDY
ВВЕДЕНИЕ
31]. Известны превращения 1,3-дибромадаманта-
на, протекающие с изменением геометрии карка-
Соединения каркасной структуры являются
са [32-38]. Синтетический потенциал остальных
предметом непрерывных исследований на протя-
1,3-дигалогенадамантанов изучен меньше [38-44].
жении многих лет, что обусловлено уникально-
стью геометрического строения и практической
В реакциях 1,3-дибром- и 1,3-дихлорадаман-
значимостью их функциональных производных
тана с дымящей азотной кислотой в присутствии
[1-6]. Одними из наиболее синтетически доступ-
уксусного ангидрида происходит нитролиз с об-
ных полифункциональных производных ада-
разованием соответствующих галогеннитратов
мантана являются
1,3-дигалогенпроизводные.
и 1,3-динитроксипроизводных [45, 46]. Ранее мы
1,3-Дибромадамантан используется в качестве
установили, что в 1,3-дихлорадамантаны реагиру-
исходного субстрата при получении биологически
ют с дымящей азотной кислотой с образованием
активных веществ [7-10] и соединений с комплек-
соединений 2-оксаадамантановой структуры [47].
сом ценных свойств: полимерных материалов [11-
С целью расширения субстратного ряда в насто-
16], металлорганических каркасов [17-19]. Его
ящей работе мы представляем исследование пре-
используют в качестве алкилирующего агента в
вращений 1,3-дибром- и 1,3-дииодадамантанов
реакциях с ароматическими субстратами [20, 21],
под действием дымящей азотной кислоты.
в синтезе эфиров алкилбороновых кислот [22-24]
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
и других полифункциональных производных [25-
В качестве исходных соединений использова-
1 Статья посвящается юбилею главного редактора журнала
ли дибромиды 1а-с и дииодпроизводные 5a, b.
академика РАН И.П. Белецкой.
Реакции проводили в избытке дымящей азотной
358
ВЗАИМОДЕЙСТВИЕ 1,3-ДИГАЛОГЕНАДАМАНТАНОВ С АЗОТНОЙ КИСЛОТОЙ
359
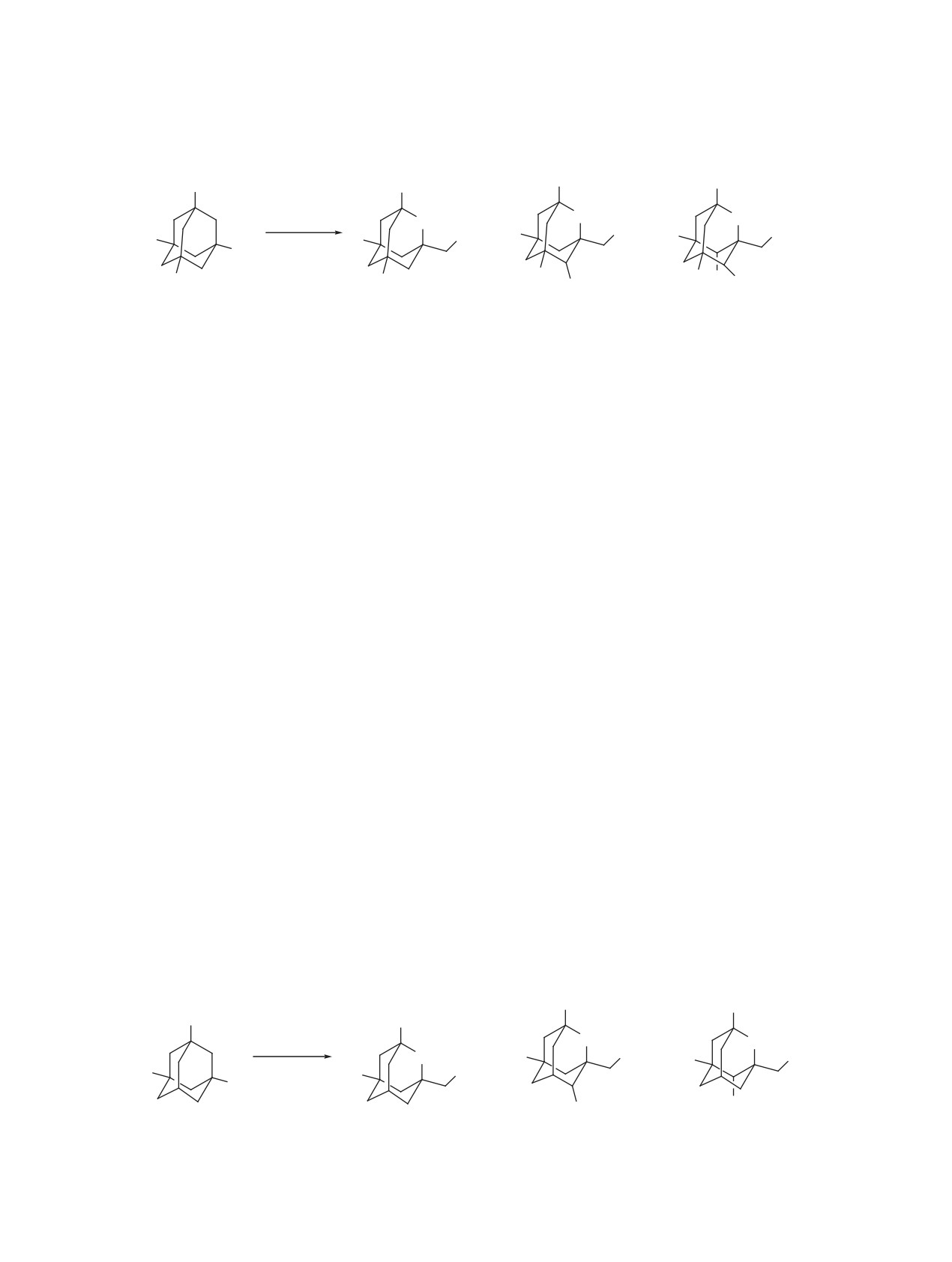
Схема 1
OH
OH
Br
OH
HNO3
O
O
O
Br
+
R
Br
+
R
Br
R
R
20-25°C
Br
R'
R'
Br
R'
R'
Br
Br
1a, b
2a, b
3a, b
4a, b
R = R' = H (a), Me (b).
кислоты при комнатной температуре. Как и в слу-
творителя. Данный способ позволяет получать
чае 1,3-дихлорадамантанов, в результате реакции
5,7-диметил-3-бромметил-1-гидрокси-2-оксаада-
субстратов 1a-с образовывались смеси продук-
мантан-1-ол (2b) с выходом 60%. При разделении
тов 2-оксаадамантановой структуры (схемы 1, 2).
смеси флэш-хроматографией были выделены мо-
Контроль за ходом реакций осуществляли с помо-
нобромид 2b и дибромид 3b c выходами 36 и 11%
щью ГЖХ.
соответственно.
Реакция 1,3-дибромадамантана (1а) с дымящей
В аналогичных условиях проводили реакцию
HNO3 протекает быстро: уже через 2 мин, соглас-
5-метил-1,3-дибромадамантана (1с) с дымящей
но анализу ГЖХ, происходит образование смеси
азотной кислотой (схема 2). Время реакции со-
веществ 2а, 3а и 4а, содержание которых состав-
ставило 30 мин. В отличие от субстратов 1а, b в
ляет 67.6, 21.7 и 10.7% соответственно (схема 1).
данной реакции происходит образование изомер-
Перекристаллизацией из гексана выделили лишь
ных дибромпроизводных
2-оксаадамантановой
смесь монобромида 2а и дибромида 3а 2-окса-
структуры 3с и 3с*. Содержание продуктов 2с, 3с
адамантановой структуры в соотношении
4:1.
и 3с* составило 78.0, 9.8 и 12.2% по данным ГЖХ.
Поэтому полученную смесь продуктов 2а, 3а и
5-Метил-3-бромметил-2-оксаадамантан-1-ол
(2с)
4а разделяли флэш-хроматографией. В индиви-
выделили в индивидуальном виде с выходом 41%
дуальном виде удалось выделить только 3-бром-
перекристаллизацией полученной смеси из гекса-
метил-2-оксаадамантан-1-ол (2а). Дибром- и три-
на.
бромпроизводные 3а и 4а после разделения выде-
В спектрах ЯМР 1Н монобромидов 2-оксаада-
лены в виде смеси в соотношении 9:1.
мантановой структуры 2а-с протоны ОН-группы
Реакцию
5,7-диметил-1,3-дибромадамантана
проявляются в виде синглета в области 2.70-
(1b) проводили аналогично субстрату 1а в тече-
3.10 м.д., протоны бромметильной группы - при
ние 15 мин. Содержание продуктов 2b, 3b и 4b по
3.30-3.45 м.д. в виде синглета. В спектрах ЯМР
данным ГЖХ составило 80.2, 18.9 и 0.9% соответ-
13С соединений 2а-с сигналы четвертичного атома
ственно (схема 1). Выделение продуктов осущест-
углерода, связанного с ОН-группой, проявляются
вляли и перекристаллизацией, и разделением сме-
при 96.0 м.д.
си флэш-хроматографией. Перекристаллизацию
смеси продуктов 2b, 3b и 4b осуществляли из
В спектре ЯМР 1Н дибромида 3b сигнал мети-
гексана с точно подобранным количеством рас-
нового протона, связанного с атомом брома, прояв-
Схема 2
OH
OH
Br
OH
HNO3
O
O
O
+
Me
Br
+
Br
Me
20-25°C
Br
Me
Me
Br
Br
Br
1c
2c
3c
3c*
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
360
ИВЛЕВА и др.
Схема 3
I
ONO2
HNO3
R
R
20-25°C
I
ONO2
R'
R'
5a, b
6a, b
I2 + 10HNO3
2HIO3 + 10NO2 + 4H2O
ляется в виде синглета при 4.14 м.д. Атомы водо-
1Н и 13C зарегистрированы на спектрометре JEOL
рода бромметильной группы проявляются в виде
NMR-ECX400 (Япония) (400, 100 МГц, соответ-
двух дублетов при 3.48 и 3.68 м.д. с КССВ 11.0 Гц.
ственно), внутренний стандарт ТМС. Химические
В спектре ЯМР 13С продукта 3b сигнал третичного
сдвиги сигналов определены в шкале δ м.д. Масс-
атома C, связанного с атомом брома, проявляется
спектры зарегистрированы на спектрометре
при 63.3 м.д., а сигнал четвертичного атома угле-
Finnigan Trace DSQ (США) с энергией ионизирую-
рода, связанного с ОН-группой, при 95.9 м.д.
щих электронов 70 эВ. Изучение количественного
состава смесей проводили на газовом хроматогра-
В аналогичных условиях проводили реакции
фе «Thermo Scientific Focus GC» (США). Кварцевая
1,3-дииодпроизводных 5а, b с дымящей азотной
колонка DB-5: 30 м×0.32 мм. Температура колон-
кислотой, в результате которых были выделены
ки 80°C до 340°C (скорость нагрева 20°C/мин).
только соответствующие
1,3-динитроксипроиз-
Температура испарителя 250°C. Газ-носитель - ге-
водные 6a, b с высокими выходами (схема 3).
лий. Флэш-хроматографию проводили на приборе
Продуктов 2-оксаадамантановой структуры обна-
BUCHI Reveleris X2 (Швейцария), адсорбент - си-
ружено не было.
ликагель (25-40 мкм, 12 г), скорость потока МФ
Предполагаемый механизм образования соеди-
20 мл/мин.
нений 2-оксаадамантановой структуры из 1,3-ди-
Температуры плавления определены капил-
галогенпроизводных адамантана описан в статье
лярным методом на приборе MPM-H2 90-264V/
[47] на примере 5,7-диметил-1,3-дихлорадаманта-
AC (Германия), не корректировались. Элементный
на. Синтез 3-галогенметил-2-оксаадамантан-1-о-
анализ выполнен на элементном анализаторе
лов включает ряд промежуточных превращений:
EuroVector 3000 EA (Италия) с использованием в
нитролиз исходных дигалогенпроизводных с об-
качестве стандарта L-цистина. Чистота соедине-
разованием соответствующих нитроксипроизво-
ний ≥ 96.0%. 1,3-Дибромадамантан (1а), 1,3-ди-
дных, которые затем претерпевают структурные
иодадамнтан (5a) взяты из коллекции реактивов ка-
трансформации каркаса, включающие фрагмен-
федры органической химии СамГТУ. 5,7-Диметил-
тацию Гроба и трансаннулярные циклизации. На
1,3-дибромадамантан (1b) получали из 3,5-диме-
этой же стадии происходит высвобождение моле-
тил-1-бромадамантана по методике [44].
кулярного галогена, участвующего в образовании
соответствующего 3-галогенметил-2-оксаадаман-
Синтез исходных соединений. 5-Метил-1,3-
тан-1-ола. Мы предполагаем, что в ходе реакции
дибромадамантан (1с). К 15 мл (0.29 моль) бро-
субстратов 5а, b с дымящей азотной кислотой про-
ма при охлаждении и перемешивании добавляли
текают аналогичные превращения, однако высво-
0.33 г (0.006 моль) железных опилок. Затем порци-
бодившийся молекулярный йод быстро окисляет-
ями вносили 5 г (0.033 моль) 1-метиладамантана
ся до HIO3, что не приводит к соединениям 2-окса-
в течение 1 ч. Смесь выдерживали при перемеши-
адамантанового ряда (схема 3).
вании при комнатной температуре в течение 2 ч и
выливали на измельченный лед. При перемешива-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
нии добавляли 10%-ный раствор сульфита натрия
ИК спектры регистрировались на спектрометре
до обесцвечивания. Продукт экстрагировали 50 мл
Shimadzu IR Affinity-1 (Япония). Спектры ЯМР
CCl4, экстракт промывали
10%-ным раствором
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
ВЗАИМОДЕЙСТВИЕ 1,3-ДИГАЛОГЕНАДАМАНТАНОВ С АЗОТНОЙ КИСЛОТОЙ
361
гидрокарбоната натрия и сушили над безводным
(4×10 мл). Объединенные органические экстракты
сульфатом натрия. Растворитель упаривали на ва-
последовательно промывали раствором бисульфи-
куумном роторном испарителе. Остаток очищали
та натрия (2×10 мл), 10%-ным водным раствором
перекристаллизацией из метанола. Выход 7.1 г
NaOH (1×10 мл) и водой. После этого экстракты
(69%), бесцветные кристаллы, т.пл. 66-67°C (62°C
сушили над Na2SO4, растворитель упаривали в
[48]). Спектр ЯМР 1Н (СDCl3), δ, м.д.: 0.90 с (3H,
вакууме. По данным ГЖХ содержание продуктов
CH3), 1.44-1.46 м (2H, CHAd), 2.04 с (4H, CHAd),
составило: (2а) - 67.6%; (3а) - 22.7%; (4а) - 10.7%.
2.15-2.30 м (5H, CHAd), 2.72-2.81 м (2H, CHAd).
Полученную смесь разделяли на флэш-хромато-
Спектр ЯМР 13С (СDCl3), δ, м.д.: 29.3 (CH3), 34.9
графе с применением градиентного элюирования
(CH), 38.7 (Cчетв), 40.7 (CH2), 46.3 (CH2),
53.9
в системе хлористый метилен-этанол (7 мин: 0%
(CH2), 58.3 (CH2), 62.0 (Cчетв). Масс-спектр, m/z
этанола; 8 мин: 0→8% этанола), скорость потока
(Iотн, %): 306 (< 1) [M]+, 229 (18), 227 (34), 147 (48),
МФ 20 мл/мин. После разделения были получены
119 (20), 107 (34), 105 (58), 91 (100), 77 (46), 65
следующие соединения.
(36).
3-Бромметил-2-оксаадамантанол-1 (2а). Вы-
5,7-Диметил-1,3-дииодадамантан (5b). Смесь
ход 0.09 г (22%). Бесцветные кристаллы, т.пл.
3 г (0.015 моль) 5,7-диметиладамантан-1,3-дио-
132.0-134.0°С. ИК спектр, ν, см-1: 3373, 2929, 2906,
ла, 25 мл толуола, 0.285 г (0.009 моль) красного
2852. Спектр ЯМР 1Н (СDCl3), δ, м.д.: 1.09-1.54 м
фосфора и 4.65 г (0.018 моль) молекулярного йода
(12Н, CHAd), 2.70 с (1Н, ОН), 3.45 с (2Н, СН2Br).
нагревали при интенсивном перемешивании до
Спектр ЯМР 13С (СDCl3), δ, м.д.: 30.4 (СН), 41.6
80°C и выдерживали при заданной температуре
(СH2), 43.1 (СH2), 46.8 (CH2), 48.7 (СН2Br), 76.3
(Cчетв), 96.1 (Cчетв). Масс-спектр, m/z (Iотн, %): 248
5 ч. Реакцию проводили в атмосфере аргона. Затем
реакционную смесь охлаждали до комнатной тем-
(5) [M + 2]+, 246 (6) [M]+, 168 (12), 167 (100), 166
(46), 125 (14), 121 (25), 107 (49). Найдено, %: С
пературы и промывали 10%-ным раствором суль-
48.72; Н 6.01 С10Н15BrО2. Вычислено, %: С 48.60;
фита натрия. Органический слой отделяли, из во-
Н 6.12.
дного слоя дополнительно экстрагировали хлори-
стым метиленом (5×20 мл). Объединенные орга-
Смесь анти-3-бромметил-4-бром-2-оксаада-
нические фракции сушили над сульфатом натрия.
мантанола-1
(3a), анти,анти-3-бромметил-
Растворитель упаривали на вакуумном роторном
4,10-дибром-2-оксаадамантанола-1 (4a). Соот-
испарителе. Остаток перекристаллизовывали из
ношение продуктов 3a и 4a по данным ГЖХ со-
CCl4. Выход: 3.1 г (48%), бесцветные кристаллы,
ставляет 9:1. Масс-спектр 3a, m/z (Iотн, %): 328 (7)
т.пл. 103.5-105°С (102-103.2°C [49]). ИК спектр,
[M + 4]+, 326 (9) [M + 2]+, 324 (4) [M]+, 245 (56), 247
ν, см-1: 2943, 2895, 2862, 694. Спектр ЯМР 1H
(60), 165 (72), 121 (28), 119 (73), 105 (100). Масс-
(CDCl3), δ, м.д.: 0.84 с (6Н, СН3), 1.34 с (2Н, CHAd),
спектр 4a, m/z (Iотн, %): 408 (4) [M + 6]+, 406 (10)
2.25 с (8Н, CHAd), 3.10 с (2Н, CHAd). Спектр ЯМР
[M + 4]+, 404 (8) [M + 2]+, 402 (4) [M]+, 323 (20), 324
13C (CDCl3), δ, м.д.: 29.0 (СН3), 39.9 (Cчетв), 43.6
(24), 325 (15), 327 (14), 245 (51), 185 (30), 183 (39),
(Cчетв), 48.0 (СН2), 56.1 (СН2), 62.7 (СН2). Масс-
163 (84), 135 (30), 121 (70), 117 (100), 103 (54).
спектр, m/z (Iотн, %): 291 (4), 290 (18), 289 (17), 161
Взаимодействие 1b с дымящей азотной кис-
(28), 119 (48), 107 (54), 105 (62), 91 (100), 77 (57),
лотой. К раствору 0.5 г (1.5 ммоль) 5,7-диме-
55 (50).
тил-1,3-дибромадамантана (1b) в 0.5 мл хлори-
Взаимодействие 1а с дымящей азотной кис-
стого метилена в течение 2 мин при перемешива-
лотой. К раствору 0.5 г (1.7 ммоль) 1,3-диброма-
нии при комнатной температуре добавляли 1.5 мл
дамантана (1а) в 0.5 мл хлористого метилена в те-
(0.036
моль) дымящей азотной кислоты.
чение 5 мин при перемешивании при комнатной
Реакционную смесь выдерживали в течение 15
температуре добавляли 1.65 мл (0.04 моль) дымя-
мин и выливали на измельченный лед. Затем экс-
щей азотной кислоты. Реакционную смесь выдер-
трагировали хлористым метиленом (4×10 мл), экс-
живали в течение 2 мин, выливали на измельчен-
тракт промывали раствором бисульфита натрия
ный лед и экстрагировали хлористым метиленом
(2×10 мл), а затем 10%-ным водным раствором
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
362
ИВЛЕВА и др.
NaOH (1×10 мл). После этого экстракт сушили
NaOH (1×20 мл). После этого экстракт сушили
над Na2SO4, растворитель упаривали в вакуу-
над Na2SO4, растворитель упаривали в вакууме.
ме. По данным ГЖХ содержание продуктов со-
Остаток перекристаллизовывали из 7 мл гексана.
ставило: (2b) - 80.2%; (3b) - 18.9%; (4b) - 0.9%.
Выпавший осадок отфильтровывали, маточный
Полученную смесь разделяли на флэш-хромато-
раствор упаривали и еще раз перекристаллизо-
графе с применением градиентного элюирования
вывали из 8 мл гексана. Выход соединения 2b
в системе хлористый метилен-этанол (5 мин: 0%
1.54 г (60%), бесцветные кристаллы, т.пл. 98.0-
этанола; 4 мин: 0→5% этанола; 3 мин: 4→16% эта-
99.5°С. Спектральные характеристики идентичны
нола), скорость потока МФ 20 мл/мин. После раз-
вышеописанным.
деления были получены следующие соединения.
3-Бромметил-5-метил-2-оксаадамантанол-1
3-Бромметил-5,7-диметил-2-оксаадаманта-
(2c). К раствору 2 г (6.5 ммоль) 5-метил-1,3-дибро-
нол-1 (2b). Выход 0.15 г (36%), т.пл. 97.5-99.5°С.
мадамантана (1с) в 6 мл хлористого метилена в те-
чение 10 мин при перемешивании при комнатной
ИК спектр, ν, см-1: 3427, 2943, 2920, 2862, 2843.
температуре по каплям добавляли 7 мл (0.17 моль)
Спектр ЯМР 1Н (СDCl3), δ, м.д.: 0.96 с (6Н, 2СН3),
азотной кислоты. Реакционную смесь выдержива-
1.18-1.47 м (10Н, CHAd), 2.74 с (1Н, ОН), 3.34 с
ли в течение 30 мин и выливали на измельченный
(2Н, СН2Сl). Спектр ЯМР 13С (СDCl3), δ, м.д.:
лед. Затем экстрагировали хлористым метиленом
29.1 (СН3), 33.4 (Cчетв), 41.1 (СН2), 43.6 (СH2),
(4×20 мл), экстракт промывали раствором бисуль-
47.0 (CH2), 48.3 (СН2Br), 76.4 (Cчетв), 96.0 (Cчетв).
фита натрия (2×20 мл), а затем 10%-ным водным
Масс-спектр, m/z (Iотн, %): 276 (11) [M + 2]+, 274
раствором NaOH (1×20 мл). После этого экстракт
(12) [M]+, 196 (14), 195 (100), 194 (34), 138 (34),
сушили над Na2SO4, растворитель упаривали в ва-
135 (20). Найдено, %: С 52.29; Н 6.83 С12Н19BrО2.
кууме. Остаток перекристаллизовывали из 15 мл
Вычислено, %: С 52.38; Н 6.96.
гексана. Выход 0.7 г (41%), бесцветные кристал-
анти-3-Бромметил-4-бром-5,7-диметил-
лы, т.пл. 81-83.5°C. ИК спектр, ν, см-1: 3423, 2943,
2-оксаадамантанол-1 (3b). Выход 0.07 г (11%),
2910, 2862, 2843. Спектр ЯМР 1Н (СDCl3), δ, м.д.:
т.пл. 94.5-96.6°С. ИК спектр, ν, см-1: 3444, 2943,
0.94 с (3Н, СН3), 1.34-1.53 м (7Н, СНAd), 1.65-1.72
2920, 2864, 2843. Спектр ЯМР 1Н (СDCl3), δ, м.д.:
м (3H, CHAd), 2.32-2.38 м (1H, CHAd), 3.10 уш.
1.00 с (3Н, СН3), 1.06 с (3Н, СН3), 1.25-1.95 м
с (1H, OH), 3.31 c (2H, CH2Br). Спектр ЯМР 13С
(8Н, CHAd), 3.48 д (1Н, СН2Br, 2J 11.0 Гц), 3.68 д
(СDCl3), δ, м.д.: 29.4 (СН), 29.5 (СН3), 33.1 (Cчетв),
(1Н, СН2Br, 2J 11.0 Гц), 4.14 c (1Н, СНBr). Спектр
36.7 (СН2), 40.2 (СН2), 40.9 (СН2), 41.3 (СН2),
ЯМР 13С (СDCl3), δ, м.д.: 28.6 (СН3), 28.7 (СН3),
44.1 (СН2), 47.7 (СН2), 75.4 (Cчетв), 96.1 (Cчетв).
38.2 (СН2), 40.6 (СН2), 42.6 (СН2), 46.8 (СН2), 48.6
Масс-спектр, m/z (Iотн, %): 262 (10) [M + 2]+, 262
(СН2), 63.3 (СНBr), 75.5 (Cчетв), 95.9 (Cчетв). Масс-
(12) [M]+, 181 (100), 163 (16), 135 (14), 121 (32),
спектр, m/z (Iотн, %): 356 (16) [M + 4]+, 354 (33)
93 (14). Найдено, %: С 50.50; Н 6.47. С11Н17BrО2.
[M + 2]+, 352 (18) [M]+, 337 (5), 339 (8), 341 (4),
Вычислено, %: С 50.59; Н 6.56.
273 (100), 275 (82). Найдено, %: С 40.64; Н 5.02
Взаимодействие 1,3-дииодадамантанов 5a, b
С12Н18Br2О2. Вычислено, %: С 40.71; Н 5.12.
с дымящей азотной кислотой. К дымящей азот-
3-Бромметил-5,7-диметил-2-оксаадаманта-
ной кислоте при перемешивании по каплям до-
нол-1 (2b). К раствору 3 г (9.3 ммоль) 5,7-диме-
бавляли субстрат 5a, b при комнатной темпера-
тил-1,3-дибромадамантана (1b) в 3 мл хлористо-
туре. Реакционную смесь выдерживали в течение
го метилена в течение 10 мин при перемешива-
30 мин и выливали на измельченный лед. Продукт
нии при комнатной температуре добавляли 9 мл
экстрагировали хлористым метиленом (3×5 мл).
(0.22 моль) дымящей азотной кислоты. Реак-
Объединенные органические экстракты промы-
ционную смесь выдерживали в течение 15 мин
вали
10%-ным раствором гидрокарбоната на-
и выливали на измельченный лед. Затем экстра-
трия и сушили над безводным сульфатом натрия.
гировали хлористым метиленом (4×20 мл), экс-
Растворитель упаривали на вакуумном роторном
тракт промывали раствором бисульфита натрия
испарителе. Остаток очищали перекристаллизаци-
(2×20 мл), а затем 10%-ным водным раствором
ей.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
ВЗАИМОДЕЙСТВИЕ 1,3-ДИГАЛОГЕНАДАМАНТАНОВ С АЗОТНОЙ КИСЛОТОЙ
363
1,3-Динитроксиадамантан
(6а). Получен
ИНФОРМАЦИЯ ОБ АВТОРАХ
из 0.5 г (1.3 ммоль) 1,3-дииодадамантана (5а) и
Ивлева Елена Александровна, ORCID: https://
1.23 мл (0.0296 моль) дымящей азотной кислоты.
orcid.org/0000-0001-5778-860X
Выход 0.26 г (79%), бесцветные кристаллы, т.пл.
113-115°С (114-115°С [50]).
Климочкин Юрий Николаевич, ORCID: https://
orcid.org/0000-0002-7335-4040
5,7-Диметил-1,3-динитроксиадамантан (6b).
Получен из 0.5 г (1.2 ммоль) 1,3-дииодадаманта-
КОНФЛИКТ ИНТЕРЕСОВ
на (5b) и 1.15 мл (0.0267 моль) дымящей азотной
Авторы заявляют об отсутствии конфликта ин-
кислоты. Выход 0.31 г (92%), бесцветные кристал-
тересов.
лы, т.пл. 43-45°С (43-45°C [51]).
СПИСОК ЛИТЕРАТУРЫ
ЗАКЛЮЧЕНИЕ
1.
Stockdale T. P., Williams C. M. Chem. Soc. Rev. 2015,
Расширен ряд исходных субстратов для получе-
44, 7737-7763. doi 10.1039/c4cs00477a
ния соединений 2-оксаадамантановой структуры и
2.
Ширяев В.А., Климочкин Ю.Н. ХГС. 2020, 56,
показаны ограничения метода. Синтез 3-бромме-
626-635. [Shiryaev V.A., Klimochkin Y.N. Chem.
тил-2-оксаадамантан-1-олов протекает через ста-
Heterocycl. Compd. 2020, 56, 626-635.] doi 10.1007/
дии нитролиза исходных 1,3-дибромпроизводных
s10593-020-02712-6
адамантана с образованием соответствующих
3.
Климочкин Ю.Н., Ширяев В.А., Леонова М.В. Изв.
нитроксипроизводных, которые затем претерпе-
АН. Сер. хим. 2015, 64, 1473-1496. [Klimochkin Y.N.,
вают структурные трансформации каркаса, вклю-
Shiryaev V.A., Leonova M.V. Russ. Chem. Bull. 2015,
чающие фрагментацию Гроба и трансаннулярные
64, 1473-1496.] doi 10.1007/s11172-015-1035-y
циклизации. В случае 1,3-дииодадамантанов за
4.
Nasrallah H., Hierso J.-C. Chem. Mater. 2019, 31,
счет окисления высвободившегося молекулярного
619-642. doi 10.1021/acs.chemmater.8b04508
йода дымящей азотной кислотой протекания даль-
5.
Harrison K.W., Rosenkoetter K.E., Harvey B.G.
нейших структурных трансформаций до 2-окса-
Energy Fuels. 2018, 32, 7786-7791. doi 10.1021/
адамантанового каркаса не происходит.
acs.energyfuels.8b00792
За счет наличия в структурах синтезированных
6.
Kovalenko A., Yumusak C., Heinrichova P., Stritesky S.,
соединений ОН- и бромметильной группы откры-
Fekete L., Vala M., Weiter M., Serdar Sariciftci N.,
вается возможность их использования в качестве
Krajcovica J. J. Mater. Chem. C. 2017, 5, 4716-4723.
doi 10.1039/C6TC05076J
молекулярной платформы для получения новых
функциональных производных 2-оксаадамантано-
7.
Liu Z., Yang S., Jin X., Zhang G., Guo B., Chen H.,
вой структуры.
Yu P., Sun Y., Zhang Z., Wang Y. Med. Chem. Commun.
2017, 8, 135-147. doi 10.1039/c6md00509h
БЛАГОДАРНОСТИ
8.
Sosonyuk S.E., Peshich A., Tutushkina A.V., Khle-
Работа выполнена с использованием научно-
vin D.A., Lozinskaya N.A., Gracheva Y.A., Glazuno-
го оборудования центра коллективного пользова-
va V.A., Osolodkin D.I., Semenova M.N., Seme-
ния СамГТУ «Исследование физико-химических
nov V.V., Palyulin V.A., Proskurnina M.V., Shtila A.A.,
свойств веществ и материалов».
Zefirov N.S. Org. Biomol. Chem. 2019, 17, 2792-2797.
doi 10.1039/c8ob02915f
ФОНДОВАЯ ПОДДЕРЖКА
9.
Mezeiova E., Korabecny J., Sepsova V., Hrabinova M.,
Синтез соединений выполнен при финансо-
Jost P., Muckova L., Kucera T., Dolezal R., Misik J.,
вой поддержке Российского фонда фундамен-
Spilovska K., Pham N. L., Pokrievkova L., Roh J.,
тальных исследований (проект № 20-03-00869).
Jun D., Soukup O., Kaping D., Kuca K. Molecules.
Исследование спектральных характеристик вы-
2017, 22, 1265-1283. doi 10.3390/molecules22081265
полнено при поддержке Министерства науки и
10.
Momose T., Muraoka O. Chem. Pharm. Bull. 1978, 26,
высшего образования Российской Федерации
288-295. doi 10.1248/cpb.26.288
(тема № FSSE-2023-0003) в рамках государствен-
11.
Tsai C.W., Wu K.H., Yang C.C., Wang G.P. React.
ного задания Самарского государственного техни-
Funct. Polym. 2015, 91-92, 11-18. doi 10.1016/
ческого университета.
j.reactfunctpolym.2015.04.002
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
364
ИВЛЕВА и др.
12.
Zhu X., Shao B., Vanden Bout D.A., Plunkett K.N.
28.
Pai Y.-M., Wanek E., Weber W. P. J. Organometal.
Macromolecules. 2016, 49, 3838-3844. doi 10.1021/
Chem.
1984,
270,
271-276. doi
10.1016/0022-
acs.macromol.6b00067
328X(84)80373-3
13.
Galukhin A., Nosov R., Taimova G., Nikolaev I., Isla-
29.
Новаков И.А., Орлинсон Б.С., Савельев Е.Н., По-
mov D., Vyazovkin S. React. Funct. Polym. 2021, 165,
таенкова Е.А., Вострикова О.В., Тараканов Д.П.,
104956. doi 10.1016/j.reactfunctpolym.2021.104956
Наход М.А. ЖОХ. 2017, 87, 1942-1946. [Nova-
kov I.A., Orlinson B.S., Savel’ev E.N., Potaenko-
14.
Galukhin A., Nosov R., Nikolaev I., Kachmarzhi A.,
va E.A., Vostrikova O.V., Tarakanov D.P., Nakhod M.A.
Aleshin R., Islamov D., Vyazovkin S. Thermochim.
Russ. J. Gen. Chem. 2017, 87, 2762-2765.] doi
Acta. 2022, 710, 179177. doi 10.1016/j.tca.2022.179177
10.1134/S1070363217120027
15.
Inomata S., Matsuoka S., Sakai S., Tajima H., Ishizo-
ne T. Macromolecules. 2012, 45, 4184-4195. doi
30.
Хуснутдинов Р.И., Щаднева Н.А., Маякова Ю.Ю.
ЖОрХ. 2018, 54, 1710-1712. [Khusnutdinov R.I.,
10.1021/ma300395s
Shchadneva N.A., Mayakova Y.Y. Russ. J. Org.
16.
Inomata S., Harada Y., Nakamura Y., Uehara Y.,
Chem.
2018,
54,
1728-1730.] doi
10.1134/
Ishizone T. Polymer Chem. 2013, 51, 4111-4124. doi
S1070428018110180
10.1002/pola.26820
31.
Хуснутдинов Р.И., Щаднева Н.А., Мухаметши-
17.
Degtyarenko A.S., Handke M., Krдmer K.W.,
на Л.Ф., Джемилев У.М. ЖОрХ. 2009, 45, 1152-1156.
Liu S.-X., Decurtins S., Rusanov E.B., Thompson L.K.,
[Khusnutdinov R.I., Shchadneva N.A., Mukhametshi-
Krautscheid H., Domasevitch K.V. Dalton Trans.
na L.F., Dzhemilev U. M. Russ. J. Org. Chem. 2009,
2014, 43, 8530-8542. doi 10.1039/c4dt00174e
45, 1137-1142.] doi 10.1134/S1070428009080041
18.
Houlihan J.C.C., Moratti S.C., Hanton L.R. Dalton
32.
Ioannou S., Nicolaides A.V. Tetrahedron Lett. 2009,
Trans.
2020,
49,
12009-12017. doi
10.1039/
50, 6938-6940. doi 10.1016/j.tetlet.2009.08.108
D0DT02437F
33.
Скоморохов М.Ю, Климочкин Ю.Н. ЖОрХ. 2011,
19.
Zhang D., Ronson T.K., Güryel S., Thoburn J.D.,
47,
1775-1779.
[Skomorokhov M.Yu., Klimoch-
Wales D.J., Nitschke J.R. J. Am. Chem. Soc. 2019, 141,
kin Yu.N. Russ. J. Org. Chem. 2011, 47, 1811-1816.]
14534-14538. doi 10.1021/jacs.9b07307
doi 10.1134/S1070428011120062
20.
Wrona-Piotrowicz A., Makal A., Zakrzewski J.
34.
Denmark S.E., Henke B.R. J. Am. Chem. Soc. 1991,
J. Org. Chem. 2020, 85, 11134-11139. doi 10.1021/
113, 2177-2194. doi 10.1021/ja00006a042
acs.joc.0c01060
35.
Скоморохов М.Ю, Климочкин Ю.Н. ЖОрХ. 2001,
21.
Шокова Э.А., Ковалев В.В. ЖОрХ.
2021,
57,
37,
1096-1097.
[Skomorokhov M.Yu., Klimoch-
994-1005. [Shokova E.A., Kovalev V.V. Russ J.
kin Yu.N. Russ. J. Org. Chem. 2001, 37, 1050-1051.]
Org. Chem. 2021, 57, 1089-1097.] doi 10.1134/
doi 10.1023/A:1012403322523
S1070428021070095
36.
Matsuoka S., Ogiwara N., Ishizone T. J. Am. Chem.
22.
Bose S.K., Fucke K., Liu L., Steel P.G., Marder T.B.
Soc. 2006, 128, 8708-8709. doi 10.1021/ja062157i
Angew. Chem. Int. Ed. 2014, 53, 1799-1803. doi
37.
Mueller A.M., Chen P. J. Org. Chem. 1998, 63, 4581-
10.1002/anie.201308855
4586. doi 10.1021/jo971814+
23.
Bose S.K., Brand S., Omoregie H.O., Haehnel M.,
Maier J., Bringmann G., Marder T.B. ACS Catal. 2016,
38.
Inomata S., Harada Y., Nakamura Y., Nakamura T.,
Ishizone T. Synthesis.
2013,
45,
3332-3340. doi
6, 8332-8335. doi 10.1021/acscatal.6b02918
10.1055/s-0033-1338554
24.
Wang B., Peng P., Ma W., Liu Z., Huang C., Cao Y.,
39.
Lukach A.E., Santiago A.N., Rossi R.A. J. Phys. Org.
Hu P., Qi X., Lu Q. J. Am. Chem. Soc. 2021, 143,
Chem. 1994, 7, 610-614. doi 10.1002/poc.610071104
12985-12991. doi 10.1021/jacs.1c06473
40.
Kawamoto T., Fukuyama T., Ryu I. J. Am. Chem. Soc.
25.
Mlinarić-Majerski K., Kragol G. Tetrahedron. 2001,
2012, 134, 875-877. doi 10.1021/ja210585n
57, 449-457. doi 10.1016/S0040-4020(00)01013-9
41.
Adcock W., Clark C.I. J. Org. Chem. 1993, 58, 7341-
26.
Duddeck H., Elgamal M.H.A., Hanna A.G. Phosphorus
7349. doi 10.1021/jo00078a009
Sulfur Relat. Elem. 1986, 28, 307-314.
42.
Argueello J.E., Penenory A.B. J. Org. Chem. 2003, 68,
27.
Тужиков О.И., Малютина И.В., Юрченко Р.И.,
2362-2368. doi 10.1021/jo026518y
Кудрявцев А.А. ЖОХ. 1991, 61, 927-928. [Tuzhi-
kov O.I., Malyutina I.V., Yurchenko R.I., Kudryav-
43.
Ghorai S.K., Jin M., Hatakeyama T., Nakamura M. Org.
tsev A.A. J. Gen. Chem. USSR. 1991, 61, 1021-1022.]
Lett. 2012, 14, 1066-1069. doi 10.1021/ol2031729
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
ВЗАИМОДЕЙСТВИЕ 1,3-ДИГАЛОГЕНАДАМАНТАНОВ С АЗОТНОЙ КИСЛОТОЙ
365
44. Jirgensons A., Kauss V., Mishnev A.F., Kalvinsh I.
Rybakov V.B., Klimochkin Yu.N. Russ. J. Org. Chem.
J. Chem. Soc., Perkin Trans. 1. 1999, 3527-3530. doi
2022, 58, 38-46.] doi 10.1134/S1070428022010043
10.1039/A904394B
48. Molle G., Dubois J.E., Bauer P. Can. J. Chem. 1987,
45. Климочкин Ю.Н., Ивлева Е.А., Моисеев И.К.
65, 2428-2433. doi 10.1139/v87-405
ЖОрХ. 2020, 56, 1353-1362. [Klimochkin Yu.N.,
49. Pincock R.E., Schmidt J., Scott W.B., Torupka E.J. Can.
Ivleva E.A., Moiseev I.K. Russ. J. Org. Chem. 2020,
J. Chem. 1972, 50, 3958-3964. doi 10.1139/v72-627
56, 1532-1539.] doi 10.1134/S1070428020090055
50. Моисеев И.К., Климочкин Ю.Н., Земцова М.Н.,
46. Климочкин Ю.Н., Ивлева Е.А., Скоморохов М.Ю.
Трахтенберг П.Л. ЖОрХ. 1984, 20, 1435-1438.
ЖОрХ. 2020, 56, 1344-1352. [Klimochkin Yu.N., Ivle-
51. Моисеев И.К., Багрий Е.И., Климочкин Ю.Н., Дол-
va E.A., Skomorokhov M.Yu. Russ. J. Org. Chem. 2020,
гополова Т.Н., Трахтенберг П.Л., Земцова М.Н. Изв.
56, 1525-1531.] doi 10.1134/S1070428020090043
АН. СССР. Сер. хим. 1985, 9, 2141-2143. [Moise-
47. Ивлева Е.А., Клепиков В.В., Хатмуллина Ю.Э., Ры-
ev I.K., Bagrii E.I., Klimochkin Yu.N., Dolgopolo-
баков В.Б., Климочкин Ю.Н. ЖОрХ. 2022, 58, 51-
va T.N., Zemtsova M.N., Trakhtenberg P.L. Russ. Chem.
60. [Ivleva E.A., Klepikov V.V., Khatmullina Yu.E.,
Bull. 1985, 9, 1980-1982.] doi 10.1007/BF00953950
Reactions of 1,3-Dihaloadamantanes with Nitric Acid
E. A. Ivlevaa, *, E.V. Simatovaa, V. V. Klepikova, Yu. E. Khatmullinaa, and Yu. N. Klimochkina
Samara State Technical University, ul. Molodogvardeiskaya, 244, Samara, 443100 Russia
*e-mail: ivleva.ea@samgtu.ru
Received August 18, 2022; revised August 24, 2022; accepted August 26, 2022
The reaction of 1,3-dibromoadamantanes with fuming nitric acid gave the mixture of 2-oxaadamantane de-
rivatives. In the same conditions 1,3-diiodoadamantanes gave the corresponding 1,3-dinitroxyadamantanes. A
preparative method for the synthesis of 5,7-dimethyl-3-bromomethyl-1-hydroxy-2-oxaadamantan-1-ol from
5,7-dimethyl-1,3-dibromoadamantane was developed. The obtained compounds can be used in the directed
synthesis of substances with high molecular complexity for studying of biological activity.
Keywords: 2-oxaadamantane, fuming nitric acid, 1.3-dihaloadamantanes
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023