ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 3, с. 366-375
УДК 547-4
ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ 3-БРОММЕТИЛ-
5,7-ДИМЕТИЛ-2-ОКСААДАМАНТАН-1-ОЛА
В СЕРНОЙ КИСЛОТЕ1
© 2023 г. Е. А. Ивлеваa, *, Е. В. Симатоваa, М. С. Заборскаяa, М. С. Казачковаa,
В. Б. Рыбаковb, Ю. Н. Климочкинa
a ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
b ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
Россия, 119991 Москва, Ленинские горы 1/3
*e-mail: ivleva.ea@samgtu.ru
Поступила в редакцию 16.09.2022 г.
После доработки 10.10.2022 г.
Принята к публикации 12.10.2022 г.
Исследованы реакции 3-бромметил-5,7-диметил-2-оксаадамантан-1-ола в среде 96%-ной кислоты как в
присутствии, так и в отсутствии нуклеофилов. В ходе реакций протекает ряд структурных трансформа-
ций 2-оксаадамантанового каркаса, а также открываются пути к труднодоступным 1,2,3-тризамещенным
адамантанам. Изучены особенности строения полученных соединений с помощью 2D ЯМР спектроско-
пии и РСА. Полученные соединения могут быть использованы в направленном синтезе новых каркасных
гетероциклов с целью изучения биологической активности.
Ключевые слова: 2-оксаадамантан, серная кислота, трансаннулярная циклизация, структурная
трансформация, химические свойства, биологическая активность
DOI: 10.31857/S0514749223030084, EDN: SZLDCB
ВВЕДЕНИЕ
этом исследования в области изучения биологиче-
ской активности производных адамантана продол-
Соединения каркасной структуры являются
жают интенсивно развиваться [17-31].
предметом непрерывных исследований на протя-
жении многих лет. Полифункциональные произво-
В то же время биологическая активность и дру-
дные адамантана нашли свое применение в каче-
гие области применения гетероаналогов адаманта-
стве взрывчатых веществ [1], топлив авиакосмиче-
на, в частности, производных 2-оксаадамантана,
ской техники [2, 3], катализаторов [4], в создании
изучены значительно хуже. Вероятно, это связано
металлорганических координационных полиме-
с низкой синтетической доступностью произво-
ров [5-7], пористых материалов [8], хемилюми-
дных 2-оксаадамантана. Имеются сведения, что
нисцентных молекулярных зондов [9-11], молеку-
в ряде случаев производные 2-оксаадамантана
обладают большей активностью по сравнению с
лярных электронных устройств [12]. На сегодняш-
аналогами адамантана. Например, амины с карка-
ний день некоторые из производных адамантана
сом 2-оксаадамантана являются более сильными
введены в медицинскую практику [13-16], многие
ингибиторами рецепторов NMDA, чем амантадин
находятся на стадии клинических испытаний. При
[32, 33]. 2-Оксаадамантил-1-мочевины являются
ингибиторами растворимых ингибиторов эпокси-
1 Статья посвящается юбилею главного редактора журнала
академика РАН И.П. Белецкой.
дгидролазы [34]. Производные 2-оксаадамантана
366
ХИМИЧЕСКИЕ ПРЕВР
АЩЕНИЯ 3-БРОММЕТИЛ-5,7-ДИМЕТИЛ-2-ОКСААДАМАНТАН-1-ОЛА
367
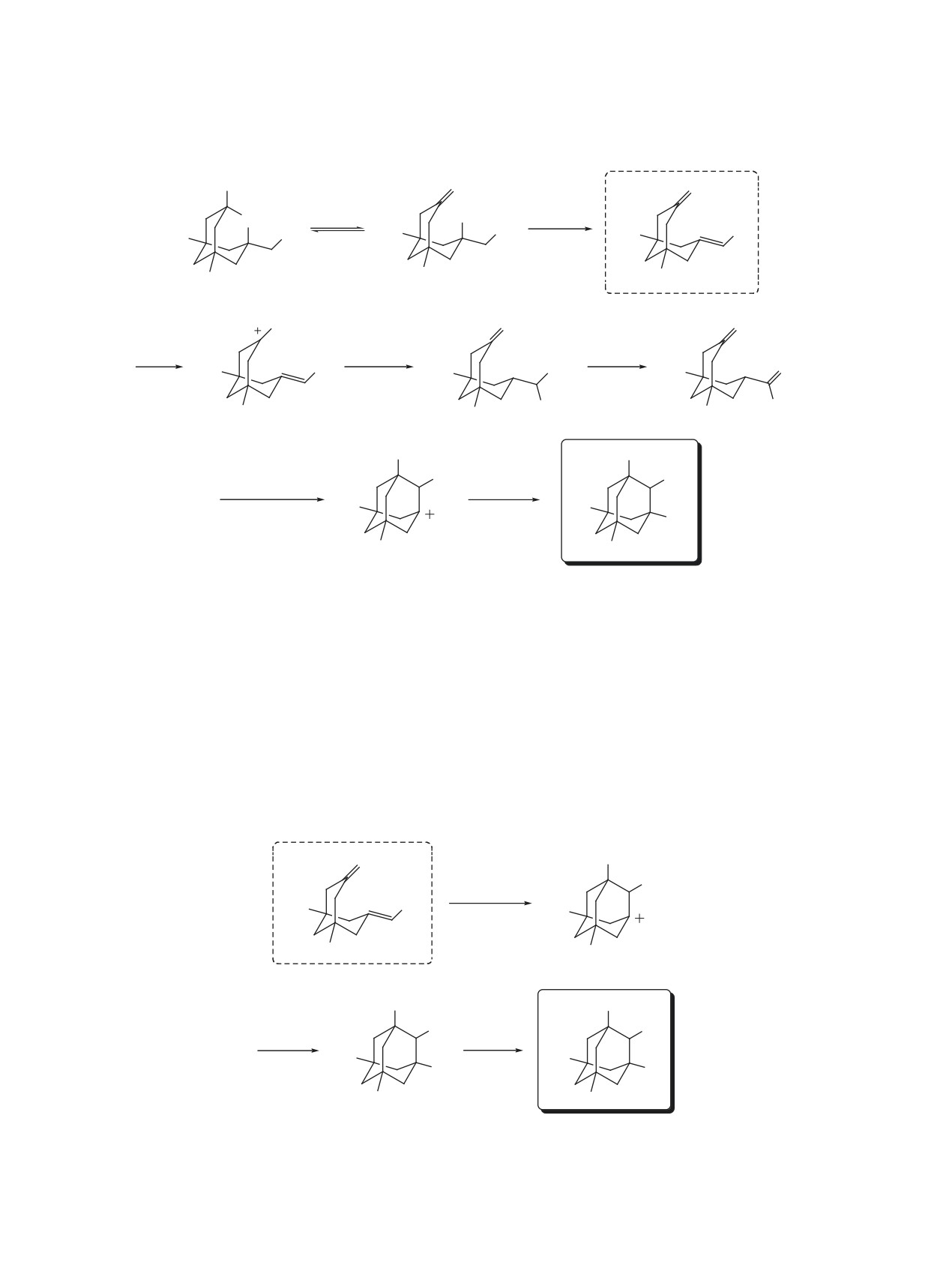
Схема 1
OH
O
O
OH
H+
O
Br
Me
Br
Br
Me
-H2O
Me
Me
Me
Me
1
1*
2
являются субстратами в синтезе гупринов [35],
субстрата 1, находящихся в равновесии в реакци-
ингибиторов ацетилхолинэстеразы [36], конфор-
онной смеси (схема 1).
мационно жестких краун-эфиров [37, 38] и крип-
В спектре ЯМР 13С полученной смеси имеют-
тандов [39]. Отмечено, что некоторые из ионофо-
ся характеристичные сигналы атомов углерода
ров, содержащих 2-оксаадамантановый фрагмент,
двойной связи, проявляющиеся в области 133-
проявляют сравнимую с известными краун-эфира-
135 м.д., и сигнал карбонильной группы при
ми селективность связывания с ионами щелочных
210.6 м.д., а также сигналы атомов углерода исход-
металлов.
ного субстрата. В индивидуальном виде продукт
В предыдущей работе мы подробно описывали
2 выделить не удалось, несмотря на многочислен-
существующие методы и подходы к построению
ные попытки варьирования условий реакции.
системы 2-оксаадамантана [40] и их ограничения и
При уменьшении количества муравьиной кис-
предложили новый оригинальный способ получе-
лоты до 30 экв и выдерживании реакционной
ния его производных. В настоящей работе изучены
смеси в течение 15 ч в результате реакции обра-
превращения
3-бромметил-5,7-диметил-2-окса-
зуется смесь продуктов, состоящая из 5,7-диме-
адамантан-1-ола в кислых средах.
тил-3-бромметил-2-оксаадамантан-1-карбоновой
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
кислоты (3) и 5,7-диметил-1,2,3-трибромадаман-
тана (4) (схема 2). При этом содержание карбоно-
В качестве объекта исследования был выбран
вой кислоты2 составляет 28%, а продукта 4 - 72%
3-бромметил-5,7-диметил-2-оксаадамантан-1-ол
по данным ГЖХ. Из полученной смеси выделить
(1), полученный из 5,7-диметил-1,3-дибромада-
кислоту 3 не удалось.
мантана. Наличие в структуре исходного субстра-
та 1 гидроксигруппы в узловом положении каркаса
При проведении аналогичной реакции 1 с толу-
побуждает осуществить ряд превращений в среде
олом в среде 96%-ной серной кислоты также была
концентрированной серной кислоты с целью по-
получена трудноразделимая смесь веществ, в ко-
лучения широкого круга новых функциональных
торой преобладал продукт 4.
производных аналогично соединениям адаманта-
Мы предположили, что образование 5,7-ди-
на. Основываясь на имеющемся опыте [41-48],
метил-1,2,3-трибромадамантана
(4)
- результат
мы решили начать с реакции Коха-Хаафа с целью
взаимодействия исходного субстрата 1 с 96%-
получения карбоновой кислоты 2-оксаадаманта-
ной серной кислотой. Действительно, через 3 ч
нового ряда. Реакцию проводили при комнатной
в реакционной смеси присутствует только про-
температуре в среде 96%-ной серной кислоты.
дукт 4 согласно данным ГЖХ. Выход 5,7-диме-
При проведении реакции с большим избытком
тил-1,2,3-трибромадамантана (4) составил
31%.
муравьиной кислоты (100 экв) через 20 ч в смеси
Из маточного раствора многократной экстракцией
присутствовали непрореагировавший субстрат 1
бутанолом был выделен
5,7-диметил-1,2,3-ада-
и 1,5-диметил-7-(бромметилиден)бицикло[3.3.1]-
мантантриол (5) в смеси с промежуточно образу-
нонан-3-он (2) в соотношении 1:1 по данным ГХ-
ющимися соединениями (схема 3).
МС. Карбоновой кислоты обнаружено не было.
Образование соединения 2 заключается, вероятно,
2 Предварительная дериватизация раствором диазометана на
в дегидратации 1* - раскрытой формы исходного
стадии пробоподготовки
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
368
ИВЛЕВА и др.
Схема 2
COOH
Br
Br
HCOOH
O
1
Br
+
Me
Me
H2SO4, 15 ч
Br
Me
Me
3
4
Схема 3
Br
OH
Br
OH
H
2SO4
1
+
Me
Me
20-25°C, 3 ч
Br
OH
Me
Me
4
5
Структуру соединения 4 подтверждали с помо-
включающих протонирование 2 с образованием
щью спектров 1Н-13С HMBC и 1Н-13С HETCOR.
карбокатиона А, присоединение молекулы воды
В спектре ЯМР 1H присутствуют синглетные сиг-
и образование геминального спирта B, который
налы неэквивалентных метильных групп (0.91 и
быстро превращается в карбальдегид C с элими-
0.94 м.д.), в виде синглета проявляется сигнал про-
нированием молекулы HBr. Дальнейшее протони-
тонов при С6 (1.28 м.д.). Протоны при С8 и С9 про-
рование приводит к трансаннулярной циклизации
являются в виде двух дублетов с КССВ 12.6 Гц в
в адамантановый каркас (схема 4).
области 1.78 и 2.60 м.д., а протонам при С4 и С10
Одновременно происходит протонирование
соответствует мультиплет при 2.20-2.29 м.д. При
2 и трансаннулярная циклизация в адамантано-
4.66 м.д. проявляется метиновый атом водорода
вый каркас. Образующийся карбокатион D ста-
адамантанового каркаса в виде синглета. В спек-
билизируется бромид-анионом из HBr, которая
тре ЯМР 13С сигнал при 63.8 м.д. соответствует
высвобождается на стадии получения триола 5.
четвертичным атомам углерода С1,3, связанным
Нуклеофильное замещение OH-группы на бром
с бромом. Сигнал атома углерода С2 проявляется
в области слабого поля при 72.9 м.д. В спектре
Br1
1Н-13С HMBC для метинового протона при С2 на-
блюдаются корреляции с атомами углерода С8,9
Br2
(47.6 м.д.) (рис. 1). Для однозначного подтвержде-
C1
ния структуры были выращены монокристаллы
C8
соединения 4 из гексана, и проведен РСА (рис. 2).
C9
C2
Образование триола 5, предположительно, про-
текает через ряд последовательных превращений,
C71
C3
Br3
Br
C7
C10
Br
1
C5
8
2
C6
C4
9
H
Me
10
7
3
Br
C51
6
5
4
Me
Рис. 2. Молекулярная структура соединения 4 в пред-
Рис. 1. Дальние взаимодействия атома водорода при
ставлении неводородных атомов эллипсоидами тепло-
С2 в спектре 1H-13C HMBC соединения 4
вых колебаний с 30%-ной вероятностью [49]
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
ХИМИЧЕСКИЕ ПРЕВР
АЩЕНИЯ 3-БРОММЕТИЛ-5,7-ДИМЕТИЛ-2-ОКСААДАМАНТАН-1-ОЛА
369
Схема 4
OH
O
O
OH
O
Br
Br
Br
Me
Me
Me
-H2O
Me
Me
Me
1
1*
2
OH
O
O
H+
1. H2O
Br
OH
O
Me
Me
Me
2. -H
+
-HBr
Me
Me
Br
Me
H
A
B
C
OH
OH
OH
OH
1. H+
H2O
Me
Me
2. Transannular
-H+
OH
cyclization
Me
Me
приводит к образованию трибромида
4 (схе-
на 4 зафиксировано не было. Анализ реакционной
ма 5).
смеси через 2 ч показал наличие двух соединений:
целевого ацетамида 6 и соединения 2 (87 и 13%
В пользу представленного пути свидетельству-
ют литературные данные о получении 1,2,3-три-
соответственно). Более длительное выдерживание
замещенных адамантанов посредством трансан-
(17 ч) приводит к исчезновению промежуточно-
нулярной циклизации биснепредельных бицик-
го продукта 2: в реакционной смеси содержится
ло[3.3.1]нонанов в кислых средах [50, 51].
только продукт 6 (схема 6). Возможно, образова-
ния трибромида 5 не происходит вследствие сни-
В то же время при введении соединения 1 в ре-
акцию Риттера с ацетонитрилом в 96%-ной H2SO4
жения кислотности реакционной среды после до-
образования 5,7-диметил-1,2,3-трибромадаманта-
бавления ацетонитрила.
Схема 5
OH
O
Br
H+
Br
Me
Me
transannular
cyclization
Me
Me
2
D
OH
Br
Br
Br
Br-
HBr
Me
Me
-H2O
Br
Br
Me
Me
4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
370
ИВЛЕВА и др.
Схема 6
OH
NHAc
MeCN-H2SO4
O
O
Br
Br
Me
Me
20-25°C, 17 ч
Me
Me
1
6
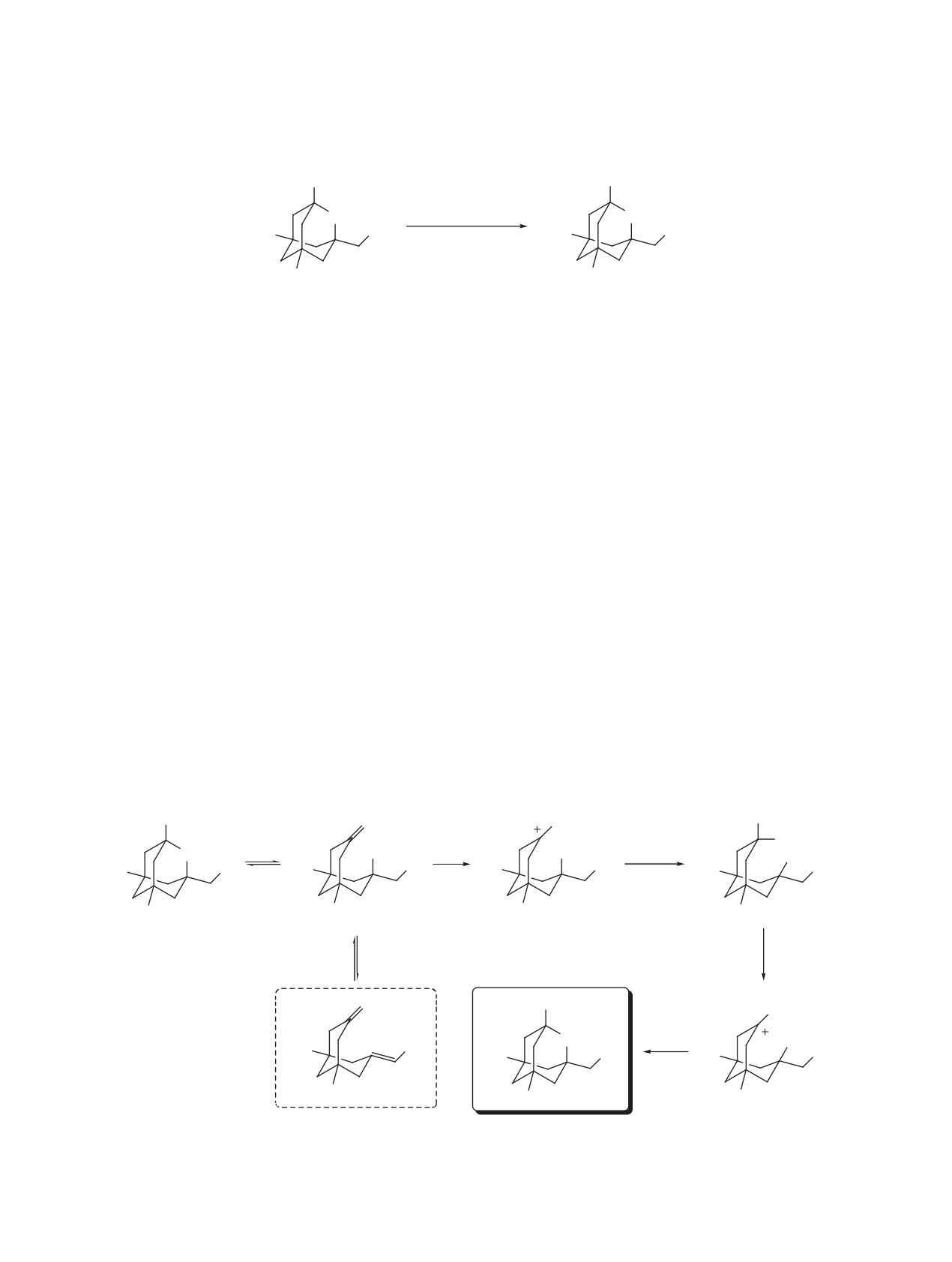
Мы предполагаем, что образование ацетами-
нал протонированной аминогруппы проявляется
да 6 протекает по следующему пути: субстрат 1,
в виде синглета при 8.93 м.д. В спектре ЯМР 13С
находящийся в равновесии со своей раскрытой
сигнал четвертичного атома углерода, связанного
формой 1*, протонируется по атому кислорода
с протонированной аминогруппой, проявляется
карбонильной группы и дает катион E, а дальней-
при 83.5 м.д.
шее взаимодействие с ацетонитрилом по механиз-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
му реакции Риттера, протонирование, дегидрата-
ция и циклизация приводят к целевому продукту
ИК спектры регистрировались на спектро-
(схема 7).
метре Shimadzu IRAffinity-1 (Япония). Спектры
Выход продукта 6 составил 79%. В спектре
ЯМР 1Н и 13C зарегистрированы на спектроме-
ЯМР 1Н сигнал протонов метильной группы аце-
тре JEOLNMR-ECX400 (Япония) (400, 100 МГц,
тамидного фрагмента проявляется при 1.95 м.д.
соответственно), внутренний стандарт ТМС.
в виде синглета, протон NH резонирует при
Химические сдвиги сигналов определены в шкале
5.81 м.д. в виде синглета. В спектре ЯМР 13С
δ м.д. Масс-спектры зарегистрированы на спек-
сигнал четвертичного атома углерода, связанно-
трометре FinniganTrace DSQ (США) с энергией
го с ацетамидным фрагментом, проявляется при
ионизирующих электронов 70 эВ. Изучение ко-
86.8 м.д. Четвертичный атом углерода ацетилами-
личественного состава смесей проводили на га-
ногруппы резонирует при 171.3 м.д.
зовом хроматографе «ThermoScientific Focus GC»
Ацетамид 6 превращали в соответствующий
(США). Кварцевая колонка DB-5: 30 м×0.32 мм.
амин путем кипячения в разбавленной соляной
Температура колонки 80 до 340°С (скорость нагре-
кислоте. Продукт выделен в виде гидрохлорида 7
ва 20°С/мин). Температура испарителя 250°С. Газ-
с выходом 81% (схема 8). В спектре ЯМР 1Н сиг-
носитель - гелий.
Схема 7
OH
NHAc
O
OH
OH
O
OH
H+
OH
MeCN
OH
Br
Br
Br
Me
Br
Me
Me
Me
H2O
Me
Me
Me
Me
1
1*
E
-H2O
H+
H2O
-H2O
O
NHAc
NHAc
O
OH
Br
Me
Br
Br
Me
Me
-H+
Me
Me
Me
2
6
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
ХИМИЧЕСКИЕ ПРЕВР
АЩЕНИЯ 3-БРОММЕТИЛ-5,7-ДИМЕТИЛ-2-ОКСААДАМАНТАН-1-ОЛА
371
Схема 8
2 мл (0.037 моль) 96%-ной серной кислоты, а за-
тем 2.7 мл (0.0716 моль) муравьиной кислоты.
NH3+ Cl-
Реакционную смесь выдерживали в течение 20 ч
HCl-H2O
и выливали на измельченный лед. Затем экстра-
O
6
Br
гировали хлористым метиленом (4×10 мл), экс-
∆, 5 ч
Me
тракт промывали насыщенным раствором соды
Me
(2×10 мл). После этого экстракт сушили над
7
Na2SO4, растворитель упаривали в вакууме. В
Температуры плавления определены капил-
остатке смесь продуктов, состоящая из исходного
лярным методом на приборе MPM-H2 90-264V/
субстрата 1 и 1,5-диметил-7-(бромметилиден)би-
AC (Германия), не корректировались. Элементный
цикло[3.3.1]нонан-3-она (2) в соотношении 1:1.
анализ выполнен на элементном анализаторе
Спектр ЯМР 13С (СDCl3), δ, м.д. (2): 27.9 (CH3),
EuroVector 3000 EA (Италия) с использованием в
31.1 (CH3), 34.7 (Счетв), 36.5 (Счетв), 37.4 (CH2),
качестве стандарта l-цистина. Чистота соедине-
40.8 (CH2), 45.6 (CH2), 52.3 (CH2), 54.8 (CH2), 133.4
ний ≥ 96.0%.
(Счетв), 134.8 (CH), 210.6 (Счетв). Масс-спектр, m/z
(Iотн, %) (2): 257 (˂ 1) [М]+, 256 (˂ 1) [М+ - 1], 203
Синтез 3-бромметил-5,7-диметил-2-оксаада-
(˂ 1), 201 (4), 199 (3), 198 (2), 178 (30), 177 (36), 120
мантанола-1 (1). К раствору 3 г (9.3 ммоль)
(18), 119 (100), 105 (16), 93 (17), 91 (24), 77 (16).
5,7-диметил-1,3-дибромадамантана в 3 мл хлори-
стого метилена в течение 10 мин при перемеши-
Синтез 1,2,3-трибром-5,7-диметиладаманта-
вании при комнатной температуре добавляли 9 мл
на (4). К раствору 0.2 г (0.73 ммоль) 3-бромме-
(0.22
моль) дымящей азотной кислоты.
тил-5,7-диметил-2-оксаадамантанола-1 (1) в 0.2 мл
Реакционную смесь выдерживали в течение
хлористого метилена в течение 10 мин при пере-
15 мин и выливали на измельченный лед. Затем
мешивании при комнатной температуре по каплям
экстрагировали хлористым метиленом (4×20 мл),
добавляли 2 мл (0.038 моль) 96%-ной серной кис-
экстракт промывали раствором бисульфита натрия
лоты. Реакционную смесь выдерживали в течение
(2×20 мл), а затем 10%-ным водным раствором
3 ч и выливали на измельченный лед. Выпавший
NaOH (1×20 мл). После этого экстракт сушили
осадок отфильтровывали и перекристаллизовыва-
над Na2SO4, растворитель упаривали в вакууме.
ли из гексана. Выход 0.09 г (31%), т.пл. 162-164°C.
Остаток перекристаллизовывали из 7 мл гексана.
ИК спектр, ν, см-1: 2945, 2906, 2868, 2839, 704.
Выпавший осадок отфильтровывали, маточный
Спектр ЯМР 1Н (СDCl3), δ, м.д.: 0.91 с (3Н, СН3),
раствор упаривали и еще раз перекристаллизо-
0.94 с (3Н, СН3), 1.28 с (2H6,6'), 1.78 д (2H, H8,8',
вывали из 8 мл гексана. Выход 1.54 г (60%), бес-
2J 12.6 Гц), 2.20-2.29 м (4H4,4',10,10'), 2.60 д (2H,
цветные кристаллы, т.пл. 98.0-99.5°С. ИК спектр,
H9,9', 2J 12.6 Гц), 4.66 с (1Н, H2). Спектр ЯМР 13С
ν, см-1: 3427, 2943, 2920, 2862, 2843. Спектр ЯМР
(СDCl3), δ, м.д.: 27.9 (CH3), 28.6 (СН3), 37.9 (С7),
1Н (СDCl3), δ, м.д.: 0.96 с (6Н, 2СН3), 1.18-1.47 м
38.3 (С5), 47.6 (С8,9H2), 48.6 (C6H2), 54.2 (С4,10Н2),
(10Н, CHAd), 2.74 с (1Н, ОН), 3.34 с (2Н, СН2Сl).
63.9 (С1,3), 72.9 (С2H). Масс-спектр, m/z (Iотн, %):
Спектр ЯМР 13С (СDCl3), δ, м.д.: 29.1 (СН3), 33.4
400 (˂ 1) [М]+, 323 (48), 321 (100), 319 (58), 241
(С), 41.1 (СН2), 43.6 (СH2), 47.0 (CH2), 48.3 (СН2),
(22), 239 (24), 160 (22), 159 (86), 105 (38), 91 (20),
76.4 (Счетв), 96.0 (Счетв). Масс-спектр, m/z (Iотн, %):
77 (18). Найдено, %: С 36.08; Н 4.37. С12Н17Br3.
276 (11) [M + 2]+, 274 (12) [M]+, 196 (14), 195 (100),
Вычислено, %: С 35.94; Н 4.27.
194 (34), 138 (34), 135 (20).
Синтез N-[3-(бромметил-5,7-диметил-2-окса-
3-Бромметил-5,7-диметил-2-оксаадаман-
адамантантил)ацетамида (6). К раствору 0.2 г
танол-1 в реакции Коха-Хаафа. К раствору
(0.73 ммоль) 3-бромметил-5,7-диметил-2-оксаада-
0.2 г (0.73 ммоль) 3-бромметил-5,7-диметил-2-ок-
мантанола-1 (1) в 0.4 мл хлористого метилена в те-
саадамантанола-1 (1) в 0.4 мл хлористого мети-
чение 5 мин при перемешивании при комнатной
лена в течение 5 мин при перемешивании при
температуре по каплям добавляли 2 мл (0.038 моль)
комнатной температуре по каплям добавляли
96%-ной серной кислоты, а затем 4 мл (0.076 моль)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
372
ИВЛЕВА и др.
ацетонитрила. Реакционную смесь выдерживали
Stoe STADI VARI Pilatus-100K (CuKα-излучение).
в течение 17 ч и выливали на измельченный лед.
Структура расшифрована прямым методом и уточ-
Выпавший осадок отфильтровывали и промывали
нена полноматричным МНК в анизотропном при-
небольшим количеством воды. Из маточного рас-
ближении для неводородных атомов. Все расчеты
твора продукт дополнительно экстрагировали хло-
проведены с использованием программного ком-
ристым метиленом (3×5 мл). Растворитель сушили
плекса SHELX [52]. Изображение молекулы по-
над Na2SO4, а затем упаривали в вакууме. Выход
лучено с использованием программы ORTEP [53].
0.092 г (79%), т.пл. 153-155°C. ИК спектр, ν, см-1:
Структурные параметры соединения 2 депониро-
3226, 2939, 2918, 2858, 2839, 1633. Спектр ЯМР
ваны в Кембриджском банке структурных данных
1Н (СDCl3), δ, м.д.: 0.94 с (6Н, СН3), 1.13-1.17 м
(депонент CCDC 1921976 [49]).
(1Н, HAd), 1.24-1.31 м (3H, HAd), 1.41-1.46 м (4H,
ЗАКЛЮЧЕНИЕ
HAd), 1.95 c (3H, CH3), 2.09-2.12 м (2Н, HAd), 3.30 с
(2Н, СН2Br), 5.81 уш.c (1H, NH). Спектр ЯМР 13С
Проведена функционализация
3-бромметил-
(СDCl3), δ, м.д.: 23.9 (CH3), 29.2 (СН3), 32.3 (Счетв),
5,7-диметил-2-оксаадамантан-1-ола в среде 96%-
41.1 (СH2), 43.8 (СH2), 44.5 (CH2), 47.9 (СН2Br),
ной серной кислоты. Реакции протекают через
75.2 (Счетв), 86.8 (Счетв), 171.3 (Счетв). Масс-спектр,
промежуточное образование 1,5-диметил-7-(бром-
m/z (Iотн, %): 317 (40) [М + 1]+, 315 (41) [М - 1]+, 222
метилиден)бицикло[3.3.1]нонан-3-она. В отсут-
(28), 218 (94), 217 (36), 180 (50), 177 (52), 164 (100),
ствии внешних нуклеофилов происходит скелет-
122 (36), 121 (40), 93 (32), 43 (48). Найдено, %: С
ная перегруппировка каркаса 2-оксаадамантана в
53.08; Н 6.93, N 4.32. С14Н22BrNО2. Вычислено, %:
адамантан и открывается путь к синтезу труднодо-
С 53.17; Н 7.01; N 4.43.
ступных 1,2,3-тризамещенных адамантанов.
Синтез гидрохлорида
5,7-диметил-3-бром-
Добавление внешних нуклеофилов приводит
метил-2-оксаадамантан-1-амин)
(7). К
0.2 г
к снижению кислотности реакционной среды и
(0.63ммоль) N-(5,7-диметил-3-бромметил-2-окса-
образованию смеси продуктов с преобладанием в
1-адамантантил)ацетамида (4) добавляли 2 мл
ней 5,7-диметил-1,2,3-трибромадамантана. В слу-
воды и 2 мл концентрированной соляной кисло-
чае использования ацетонитрила получен исклю-
ты. Полученную смесь нагревали при кипении
чительно продукт реакции Риттера. Гидролизом
в течение 5 ч и упаривали в вакууме. К остатку
полученного ацетамида синтезирован амин 2-ок-
добавили 10 мл хлористого метилена, не раство-
саадамантановой структуры. Полученные соеди-
рившийся осадок отфильтровали, маточный рас-
нения могут быть использованы в качестве ис-
твор упарили в вакууме. Продукт перекристалли-
ходных субстратов в синтезе веществ с широким
зовывали из ацетонитрила. Выход составил 0.16 г
спектром биологической активности.
(81%), т.пл. 290-292°C. ИК спектр, ν, см-1: 3360,
БЛАГОДАРНОСТИ
2951, 2909, 2841. Спектр ЯМР 1Н (DMSO-d6),
δ, м.д.: 0.89 с (6Н, СН3), 1.14-1.55 м (10Н, НAd),
Работа выполнена с использованием научно-
3.48 с (2H, CH2), 8.93 c (3H, NH3). Спектр ЯМР
го оборудования центра коллективного пользова-
13С (DMSO-d6), δ, м.д.: 29.1 (CH3), 32.2 (Счетв),
ния СамГТУ «Исследование физико-химических
41.8 (СH2), 42.9 (СH2), 43.5 (СH2), 47.4 (CH2), 75.4
свойств веществ и материалов», а также дифрак-
(Счетв), 83.5 (Счетв). Найдено, %: С 46.53; Н 6.73,
тометра Stoe STADI VARI Pilatus100K, приобре-
N 4.42. С12Н21BrClNО. Вычислено, %: С 46.40; Н
тенного по программе развития МГУ.
6.81; N 4.51.
ФОНДОВАЯ ПОДДЕРЖКА
Рентгеноструктурное исследование соедине-
Синтез соединений выполнен при финан-
ния 4. Кристаллы продукта 4, пригодные для РСА,
совой поддержке Российского научного фонда
выращены из гексана путем медленного испаре-
(проект
№ 20-73-00250). Исследование спек-
ния при комнатной температуре.
тральных характеристик выполнено при поддерж-
Рентгеноструктурное исследование монокри-
ке Министерства науки и высшего образования
сталла соединения 4 проведено на дифрактометре
Российской Федерации (тема № FSSE-2023-0003)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
ХИМИЧЕСКИЕ ПРЕВР
АЩЕНИЯ 3-БРОММЕТИЛ-5,7-ДИМЕТИЛ-2-ОКСААДАМАНТАН-1-ОЛА
373
в рамках государственного задания Самарского го-
13.
Wanka L., Iqbal K., Schreiner P.R. Chem. Rev. 2013,
сударственного технического университета.
113, 3516-3604. doi 10.1021/cr100264t
14.
Stockdale T.P., Williams C.M. Chem. Soc. Rev. 2015,
ИНФОРМАЦИЯ ОБ АВТОРАХ
44, 7737-7763. doi 10.1039/c4cs00477a
Ивлева Елена Александровна, ORCID: https://
15.
Spilovska K., Zemek F., Korabecny J., Nepovimova E.,
orcid.org/0000-0001-5778-860X
Soukup O., Windisch M., Kuca K. Curr. Med. Chem.
2016, 23, 3245-3266. doi 10.2174/092986732366616
Рыбаков Виктор Борисович, ORCID: https://
0525114026
orcid.org/0000-0002-6720-0619
16.
Lamoureux G., Artavia G. Curr. Med. Chem. 2010, 17,
Климочкин Юрий Николаевич, ORCID: https://
2967-2978. doi 10.2174/092986710792065027
orcid.org/0000-0002-7335-4040
17.
Zarubaev V.V., Golod E.L., Anfimov P.M., Shtro A.A.,
Saraev V.V., Gavrilov A.S., Logvinov A.V., Kiselev O.I.
КОНФЛИКТ ИНТЕРЕСОВ
Bioorg. Med. Chem. 2010, 18, 839-848. doi 10.1016/
Авторы заявляют об отсутствии конфликта ин-
j.bmc.2009.11.047
тересов.
18.
Suslov E.V., Mozhaytsev E.S., Korchagina D.V., Bor-
motov N.I., Yarovaya O.I., Volcho K.P., Serova O.A.,
СПИСОК ЛИТЕРАТУРЫ
Agafonov A.P., Maksyutov R.A., Shishkina L.N.,
1.
Klapötke T.M., Krumm B., Widera A. ChemPlusChem.
Salakhutdinov N.F. RSC Med. Chem. 2020, 11, 1185-
2018, 83, 61-69. doi 10.1002/cplu.201700542
1195. doi 10.1039/D0MD00108B
2.
Harrison K.W., Rosenkoetter K.E., Harvey B.G.
19.
Спасов А.А., Хамидова Т.В., Бугаева Л.И., Моро-
Energy Fuels. 2018, 32, 7786-7791. doi 10.1021/
зов И.С. Хим.-фарм. ж. 2000, 34, 3-9. [Spasov A.A.,
acs.energyfuels.8b00792
Khamidova T.V., Bugaeva L.I., Morozov I.S. Pharm.
Chem. J. 2000, 34, 1-7.] doi 10.1007/BF02524549
3.
Xie J., Zhang X., Xie J., Xu J., Pan L., Zou J.-J. Fuel.
2019, 239, 652-658. doi 10.1016/j.fuel.2018.11.064
20.
Papanastasiou I., Tsotinis A., Kolocouris N., Nikas S.P.,
Vamvakides A. Med. Chem. Res. 2014, 23, 1966-1975.
4.
Agnew-Francis K.A., Williams C.M. Adv. Synth. Catal.
doi 10.1007/s00044-013-0798-7
2016, 358, 675-700. doi. 10.1002/adsc.201500949
21.
Kadernani Y.E., Zindo F.T., Kapp E., Malan S.F.,
5.
Pavlov D., Sukhikh T., Filatov E., Potapov A. Molecules.
Joubert J. Med. Chem. Commun. 2014, 5, 1678-1684.
2019, 24, 2717-2728. doi 10.3390/molecules24152717
doi 10.1039/C4MD00244J
6.
Parmar B., Patel P., Murali V., Rachuri Y., Kure-
22.
Protopopova M., Hanrahan C., Nikonenko B., Sama-
shy R.I., Khan N.H., Suresh E. Inorg. Chem. Front.
la R., Chen P., Gearhart J., Einck L., Nacy C.A.J.
2018, 5, 2630-2640. doi 10.1039/C8QI00744F
Antimicrob. Chemother.
2005,
56,
968-974. doi
7.
Zheng Y.-Z., Zheng Z., Tong M.-L., Chen X.-M.
10.1093/jac/dki319
Polyhedron.
2013,
52,
1159-1168. doi
10.1016/
23.
Cheng H., Hoffman J., LeSajiv P., Nair K., Cripps S.,
j.poly.2012.06.051
Matthews J., Smith C., Yang M., Kupchinsky S.,
8.
Nasrallah H., Hierso J.-C. Chem. Mater. 2019, 31, 619-
Dress K., Edwards M., Cole B., Walters E., Loh C.,
642. doi 10.1021/acs.chemmater.8b04508
Ermolieff J., Fanjul A., Bhat G. B., Herrera J., Pauly T.,
9.
Ryan L.S., Nakatsuka A., Lippert A.R. Results Chem.
Hosea N., Paderes G., Rejto P. Bioorg. Med. Chem. Lett.
2021, 3, 100106. doi 10.1016/j.rechem.2021.100106
2010, 20, 2897-2902. doi 10.1016/j.bmcl.2010.03.032
10.
Kagalwala H.N., Reeves R.T., Lippert A.R. Curr.
24.
Dembitsky V.M., Gloriozova T.A., Poroikov V.V. Bio.
Opin. Chem. Biol. 2022, 68, 102134. doi 10.1016/
Biophys. Res. Commun. 2020, 529, 1225-1241. doi
j.cbpa.2022.102134
10.1016/j.bbrc.2020.06.123
11.
Vacher M., Galván I.F., Ding B.-W., Schramm S.,
25.
Шокова Э.А., Ковалев В.В. Хим.-фарм. ж. 2016, 50,
Berraud-Pache R., Naumov P., Ferré N., Liu Y.-J.,
3-15. [Shokova Й. A., Kovalev V. V. Pharm. Chem. J.
Navizet I., Roca-Sanjuán D., Baader W.J., Lindh R.
2016, 50, 63-75.] doi 10.1007/s11094-016-1400-7
Chem. Rev. 2018, 118, 6927-6974. doi 10.1021/
26.
Спасов А.А., Васильев П.М., Бабков Д.А., Прохо-
acs.chemrev.7b00649
рова Т.Ю., Стурова Е.А., Климочкин Ю.Н., Лео-
12.
Gu Y., Zhou X., Li Y., Wu K., Wang F., Huang M.,
нова М.В., Баймуратов М.Р. Биоорг. хим. 2017, 43,
Guo F., Wang Y., Gong S., Ma D., Yang C. Org. Electron.
420-426. [Spasov A.A., Vasil’ev P.M., Babkov D.A.,
2015, 25, 193-199. doi 10.1016/j.orgel.2015.06.036
Prokhorova T.Y., Sturova E.A., Klimochkin Y.N.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
374
ИВЛЕВА и др.
Leonova M.V., Baimuratov M.R. Russ. J. Bioorg. Chem.
39.
Ramljak T.S., Despotovic I., Mlinaric-Majerski K.
2017, 43, 449-455.] doi 10.1134/S1068162017040124
Tetrahedron. 2013, 69, 10610-10620. doi 10.1016/
27.
Liu Z., Yang S., Jin X., Zhang G., Guo B., Chen H.,
j.tet.2013.10.039
Yu P., Sun Y., Zhang Z., Wang Y. Med. Chem. Commun.
40.
Ивлева Е.А., Клепиков В.В., Хатмуллина Ю.Э., Ры-
2017, 8, 135-147. doi 10.1039/c6md00509h
баков В.Б., Климочкин Ю.Н. ЖОрХ. 2022, 58, 51-
28.
Ширяев В.А., Климочкин Ю.Н. ХГС. 2020, 56,
60. [Ivleva E.A., Klepikov V.V., Khatmullina Yu.E.,
626-635. [Shiryaev V.A., Klimochkin Y.N. Chem.
Rybakov V.B., Klimochkin Yu.N. Russ. J. Org. Chem.
Heterocycl. Compd. 2020, 56, 626-635.] doi 10.1007/
2022, 58, 38-46.] doi 10.1134/S1070428022010043
s10593-020-02712-6
41.
Моисеев И.К., Дорошенко Р.И. ЖОрХ. 1983, 19,
29.
Климочкин Ю.Н., Ширяев В.А., Леонова М.В. Изв.
1117-1118.
АН. Сер. хим. 2015, 64, 1473-1496. [Klimochkin Y.N.,
42.
Моисеев И.К., Багрий Е.И., Климочкин Ю.Н., Дол-
Shiryaev V.A., Leonova M.V. Russ. Chem. Bull. 2015,
64, 1473-1496.] doi 10.1007/s11172-015-1035-y
гополова Т.Н., Трахтенберг П.Л., Земцова М.Н. Изв.
АН. СССР. Сер. хим. 1985, 9, 2141-2143. [Moise-
30.
Shiryaev V.A., Skomorohov M.Yu., Leonova M.V.,
Bormotov N.I., Serova O.A., Shishkina L.N.,
ev I.K., Bagrii E.I., Klimochkin Yu.N., Dolgopolo-
Agafonov A.P., Maksyutov R.A., Klimochkin Y.N.
va T.N., Zemtsova M.N., Trakhtenberg P.L. Russ. Chem.
Eur. J. Med. Chem. 2021, 221, 113485. doi 10.1016/
Bull. 1985, 9, 1980-1982.] doi 10.1007/BF00953950
j.ejmech.2021.113485
43.
Ширяев А.К., Моисеев И.К. ЖОрХ. 2001, 37, 781-
31.
Shiryaev V.A., Radchenko E.V., Palyulin V.A., Zefi-
782. [Shiryaev A.K., Moiseev I. K. Russ. J. Org. Chem.
rov N.S., Bormotov N.I., Serova O.A., Shishkina L.N.,
2001, 37, 746-747.] doi 10.1023/A:1012428724127
Baimuratov M.R., Bormasheva K.M., Gruzd Y.A.,
44.
Моисеев И.К., Стулин Н.В., Юдашкин А.В., Кли-
Ivleva E.A., Leonova M.V., Lukashenko A.V., Osi-
мочкин Ю.Н. ЖОХ. 1985, 55, 1655-1656.
pov D.V., Osyanin V.A., Reznikov A.N., Shadriko-
va V.A., Sibiryakova A.E., Tkachenko I.M., Klimoch-
45.
Климочкин Ю.Н., Вологин М.Ф., Коржев И.Р., Ба-
kin Y.N. Eur. J. Med. Chem. 2018, 158, 214-235. doi
грий Е.И. Нефтехимия. 2001, 41, 30-32.
10.1016/j.ejmech.2018.08.009
46.
Ивлева Е.А., Ткаченко И.М., Климочкин Ю.Н.
32.
Duque M.D., Camps P., Profire L., Montaner S.,
ЖОрХ. 2016, 52, 1567-1572. [Ivleva E.A., Tkachen-
Vázquez S., Sureda F.X., Mallol J., López-Querol M.,
ko I.M., Klimochkin Yu.N. Russ. J. Org. Chem. 2016,
Naesens L., De Clercq E., Prathalingam S.R., Kel-
52, 1558-1564.] doi 10.1134/S1070428016110026
ly J.M. Bioorg. Med. Chem. 2009, 17, 3198-3206. doi
47.
Климочкин Ю.Н., Ивлева Е.А., Ширяев В.А. ЖОрХ.
10.1016/j.bmc.2009.02.007
2021, 57, 373-383. [Klimochkin Y.N., Ivleva E.A.,
33.
Leiva R., Gazzarrini S., Esplugas R., Moroni A.,
Shiryaev V.A. Russ. J. Org. Chem. 2021, 57, 355-363.]
Naesens L., Sureda F.X., Vázquez S. Tetrahedron Lett.
doi 10.1134/S1070428021030052
2015, 56, 1272-1275. doi 10.1016/j.tetlet.2015.01.160
48.
Климочкин Ю.Н., Ивлева Е.А. ЖОрХ. 2022, 58, 484-
34.
Codony S., Pujol E., Pizarro J., Feixas F., Valverde E.,
494. [Klimochkin Y.N., Ivleva E.A. Russ. J. Org. Chem.
Loza M.I., Brea J.M., Saez E., Oyarzabal J., Pineda-
2022, 58, 669-678.] doi 10.1134/S1070428022050050
Lucena A., Perez B., Perez C., Rodríguez-Franco M.I.,
Leiva R., Osuna S., Morisseau C., Hammock B.D.,
49.
Ivleva E.A., Petrova E.V., Klimochkin Y.N., Ryba-
Vazquez-Carrera M., Vazquez S. J. Med. Chem. 2020,
kov V.B. CCDC
1921976: Experimental Crystal
63, 9237-9257. doi 10.1021/acs.jmedchem.0c00310
Structure Determination. CSD Commun. 2019. doi
35.
Ronco C., Jean L., Renard P.Y. Tetrahedron Lett. 2010,
10.5517/ccdc.csd.cc22hz7t
66, 7399-7404. doi 10.1016/j.tet.2010.07.021
50.
Юрченко А.Г., Мурзинова З.Н., Степанов Ф.Н.
36.
Ronco C., Foucault R., Gillon E., Bohn P., Nachon F.,
ЖОрХ. 1972, 8, 2332-2339.
Jean L., Renard P.Y. ChemMedChem. 2011, 6, 876-
51.
Юрченко А.Г., Мурзинова З.Н., Исаев С.Д. ЖОрХ.
888. doi 10.1002/cmdc.201000523
1975, 11, 1427-1431.
37.
Mlinarić-Majerski K., Kragol G. Tetrahedron. 2001,
52.
Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
57, 449-457.
3-8. doi 10.1107/S2053229614024218
38.
Marchand A.P., Kumar K.A., McKim A.S.
Tetrahedron.
1997,
53,
3467-3474. doi
10.1016/
53.
Farrugia L.J. J. Appl. Crystallogr. 2012, 45, 849-854.
S0040-4020(97)00075-6
doi 10.1107/S0021889812029111
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
ХИМИЧЕСКИЕ ПРЕВР
АЩЕНИЯ 3-БРОММЕТИЛ-5,7-ДИМЕТИЛ-2-ОКСААДАМАНТАН-1-ОЛА
375
Chemical Transformations of 3-Bromoethyl-5,7-dimethyl-
2-oxaadamantan-1-ol in Sulfuric Acid
E. A. Ivlevaa, *, E. V. Simatovaa, M. S. Zaborskayaa, M. S. Kazachkovaa,
V. B. Rybakovb, and Yu. N. Klimochkina
a Samara State Technical University, ul. Molodogvardeiskaya, 244, Samara, 443100 Russia
b Lomonosov Moscow State University, Leninskie gory 1/3, Moscow, 119991 Russia
*e-mail: ivleva.ea@samgtu.ru
Received September 16, 2022; revised October 10, 2022; accepted October 12, 2022
The reactions of 3-bromomethyl-5,7-dimethyl-2-oxaadamantan-1-ol in a 96% acid medium both in the presence
and in the absence of nucleophiles were studied. During the reactions a number of structural transformations
of the 2-oxaadamantane cage take place. The possibility of obtaining 1,2,3-trisubstituted adamantanes is also
presented. The structural features of new compounds are investigated using 2D NMR spectroscopy and XRD
analysis. The obtained compounds can be used in the directed synthesis of a new cage heterocycles for studying
of biological activity.
Keywords: 2-oxaadamantane, sulfuric acid, transannular cyclization, structural transformation, chemical prop-
erties, biological activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023