ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 3, с. 382-399
УДК 547.814.1 + 547.304.2
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ
1Н-БЕНЗО[f]ХРОМЕНОВ И БЕНЗОФУРАНОВ
С НУКЛЕОФИЛАМИ
© 2023 г. Д. В. Осипова, *, А. А. Артеменкоа, К. С. Корженкоа, Д. А. Ращепкинаа,
О. П. Демидовb, В. А. Осянинa, **
а ФГБОУ ВО «Самарский государственный технический университет»,
Россия, 443100 Самара, ул. Молодогвардейская, 244
b ФГАОУ ВО «Северо-Кавказский федеральный университет», Россия, 355017 Ставрополь, ул. Пушкина, 1
*e-mail: osipovdv25@mail.ru
**e-mail: vosyanin@mail.ru
Поступила в редакцию 31.03.2022 г.
После доработки 18.04.2022 г.
Принята к публикации 20.04.2022 г.
При взаимодействии 2-нитро-1Н-бензо[f]хроменов со спиртами получена серия 3-алкокси-2-ни-
тро-2,3-дигидро-1Н-бензо[f]хроменов в виде смеси цис- и транс-изомеров. Реакция с вторичными
циклическими аминами и 3-амино-5,5-диметилциклогекс-2-ен-1-oном протекает транс-диастереоселек-
тивно с образованием аддуктов Михаэля бензохромановой структуры. Сопряженное присоединение с
участием анилинов приводит к (2-гидрокси-1-нафтил)метилзамещенным β-нитроенаминам. Нуклеофиль-
ная деароматизация 3-нитробензофуранов под действием первичных ароматических аминов включает
аза- и ретро-окса-реакции Михаэля. Данная последовательность превращений иллюстрирует высокую
склонность 3-нитробензофуранов к раскрытию фуранового цикла.
Ключевые слова: 3-нитробензофураны, 2-нитро-1Н-бензо[f]хромены, реакция Михаэля, деароматиза-
ция, 3-амино- и 3-алкокси-2-нитро-2,3-дигидро-1Н-бензо[f]хромены, нитроенамины
DOI: 10.31857/S0514749223030102, EDN: TJBAJD
ВВЕДЕНИЕ
их свойств в дальнейших превращениях [22-25].
Недавно нами был разработан эффективный метод
Нитроолефины широко используются в органи-
получения 2-нитро-1Н-бензо[f]хроменов [26], не
ческом синтезе в качестве структурных блоков при
содержащих заместителя в α-положении к пирано-
построении различных гетероциклических систем
вому атому кислорода, на основе предшественни-
[1-4]. Особый интерес представляют β-нитрови-
ков о-хинонметидов [27].
ниловые эфиры, в частности 2-нитрогликали, со-
держащие в дигидропирановом цикле пуш-пуль-
При введении нитрогруппы в положение
3
ную двойную связь [5-14]. 3-Нитробензофураны и
4Н-хромена или бензофурана происходит измене-
2-нитро-1Н-бензо[f]хромены выступают структур-
ние полярности гетероцикла. Нуклеофильная при-
ными аналогами циклических β-нитровиниловых
рода пиранового/фуранового цикла, обусловлен-
эфиров, однако их химические свойства практи-
ная присутствием фрагмента винилового эфира,
чески не изучены, в отличие от родственных им
меняется на электрофильную за счет сопряжения с
2-нитробензофуранов [15] и 3-нитро-2Н-хроме-
акцепторной группой. В особенности это сказыва-
нов [16-21]. Как правило, исследования посвя-
ется на 2-незамещенных гетероциклах, поскольку
щены синтезу 3-нитро-4Н-хроменов, содержащих
присутствие заместителя (как правило, донорно-
в положении 2 аминогруппу, без исследования
го) в этом положении резко уменьшает восприим-
382
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
383
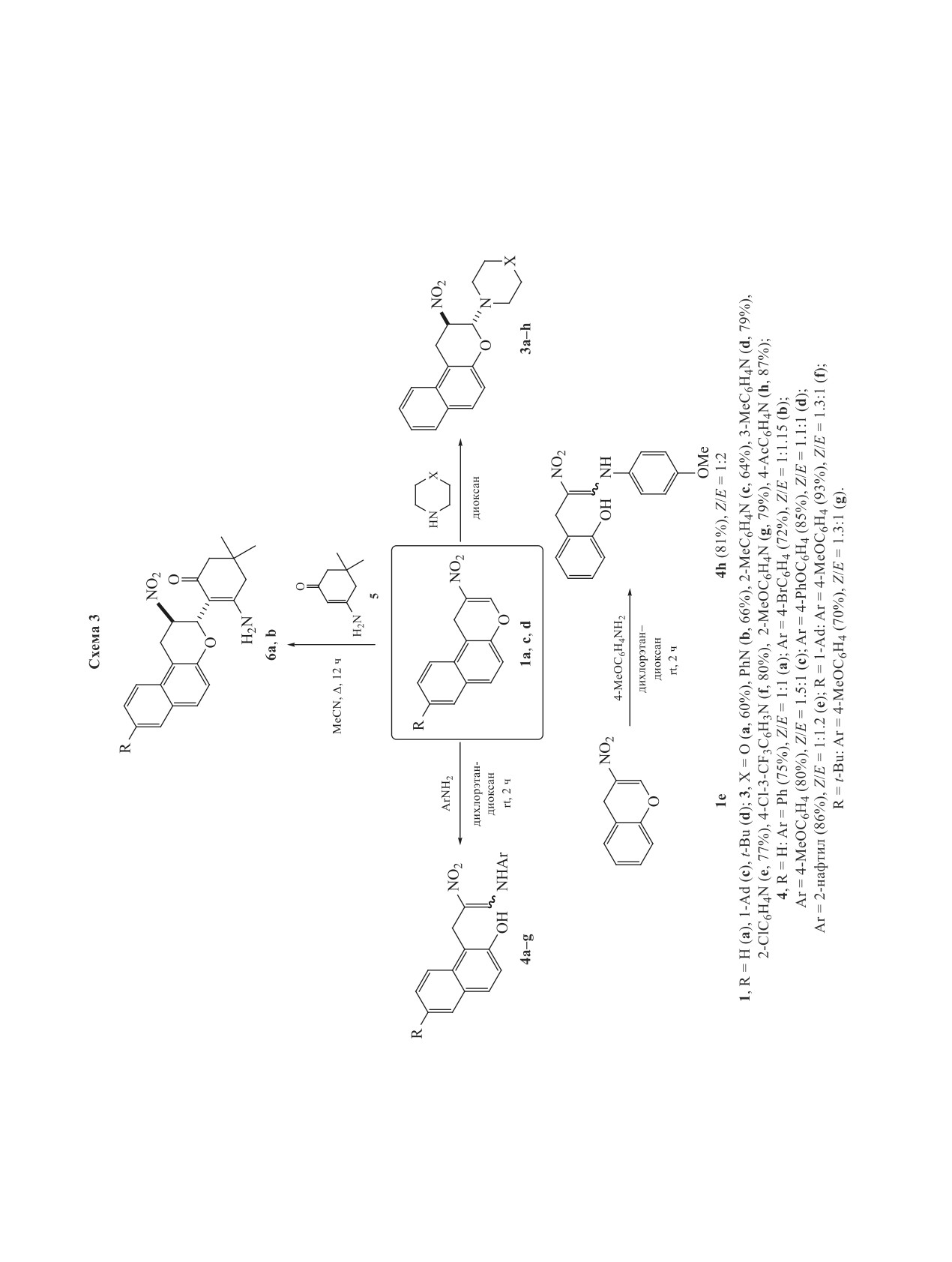
Схема 1
NO2
NO2
NO2
RO
O
O
H
(
)
NO2
(
)
NO2
(
)
NO2
x
NuH
x
x
O
O Nu
OH Nu
x = 0, 1.
чивость к реакциям сопряженного присоединения.
80, 63 и 60% соответственно. В отсутствие основа-
При этом первоначальные аддукты Михаэля могут
ния, а также в присутствии пиридина реакция не
стабилизироваться также за счет раскрытия кисло-
идет. Природа основания при этом существенным
родсодержащего цикла с образованием замещен-
образом не влияет на диастереоселективность
ных фенолов (схема 1). В связи с малой изучен-
присоединения. В случае метанола и этанола со-
ностью свойств высокополяризованных нитроза-
отношение цис- и транс-изомеров составляет 1:1,
мещенных хроменов и бензофуранов, цель работы
а для изопропанола и бутанола, соответственно, -
1.5:1 и 1.4:1. В случае 3-нитрофенилзамещен-
заключалась в исследовании их взаимодействия с
ного бензохромена 1b удалось идентифициро-
различными N, O и С-нуклеофилами.
вать только
(1R*,2S*,3R*)-аддукт Михаэля
2е.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Продукты цис- и транс-2а присоединения метано-
Нами показано, что при взаимодействии 2-ни-
ла к 2-нитро-1Н-бензо[f]хромену 1а были препа-
тро-1Н-бензо[f]хромена (1a) с предельными одно-
ративно разделены флэш-хроматографией. Также
атомными спиртами (метанолом, этанолом, изо-
флэш-хроматографией удалось выделить в чистом
виде цис-изомер этоксипроизводного 2b. В осталь-
пропанолом и бутанолом) в присутствии катали-
ных случаях попытки разделения геометрических
тических количеств DBU (10 мол %) образуются
изомеров оказались безуспешными.
3-алкокси-2-нитро-2,3-дигидро-1H-бензо[f]хроме-
ны 2a-d c выходами 79-90% в виде смеси цис- и
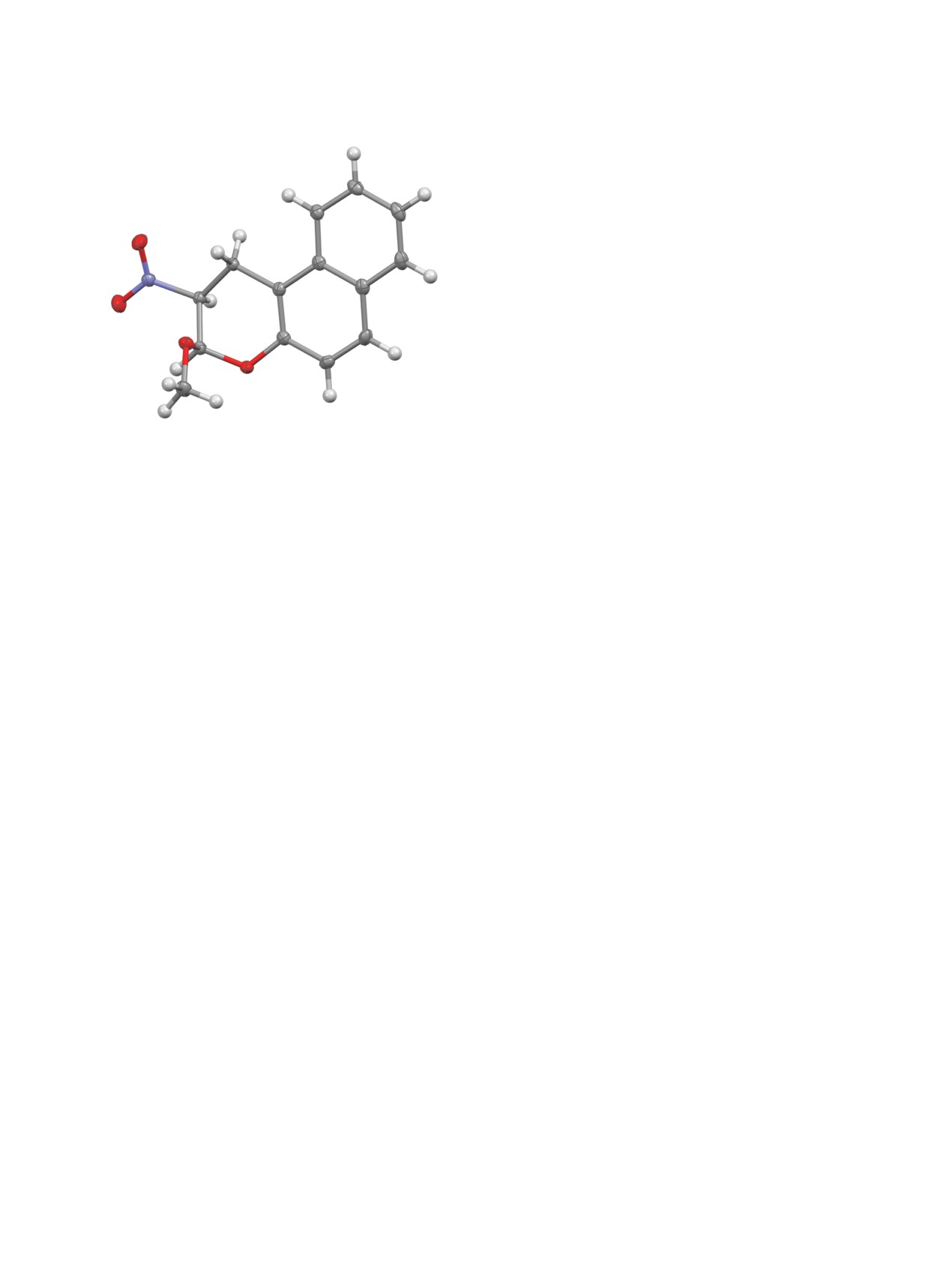
Строение цис-изомера 2а было подтверждено
транс-изомеров (схема 2). На примере 3-меток-
данными рентгеноструктурного анализа (РСА),
си-2-нитро-2,3-дигидро-1H-бензо[f]хромена
(2а)
согласно которым метоксигруппа занимает псев-
установлено, что при замене DBU на DIPEA, те-
доаксиальное положение, а нитрогруппа - псевдо-
траметилгуанидин и Et3N выход снижается с 85 до
экваториальное (рис. 1).
Схема 2
NO2
R1
MeOH
R2OH
NO2
NO2
NO
2
DBU, ∆, 30 мин
DBU, ∆, 30 мин
O
O OR2
O OMe
2e, 52%
1a, b
2a-d
1, R1 = H (a), 3-NO2C6H4 (b);
2, R2 = Me (90%), цис/транс = 1:1 (a); R2 = Et (79%), цис/транс = 1:1 (b);
R2 = i-Pr (80%), цис/транс = 1.5:1 (c); R2 = Bu (84%), цис/транс = 1.4:1 (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
384
ОСИПОВ и др.
молекулярными водородными связями. 3-Амино-
5,5-диметилциклогекс-2-ен-1-oн (5) в реакции с
нитробензохроменами 1а, с выступает уже в роли
С-нуклеофила, что приводит к нитробензохрома-
O
нам 6а, b в виде индивидуальных транс-изомеров
с выходами 60-64% (схема 3). Реакцию проводили
N
при использовании эквимолярных количеств реа-
гентов в кипящем ацетонитриле.
O
В спектрах ЯМР 1Н транс-изомеров 3-алкок-
O
си-2-нитро-2,3-дигидро-1H-бензо[f]хроменов 2a-
d протоны в положениях 1, 2 и 3 проявляются,
O
соответственно, в области 3.50-3.85, 4.96-5.00 и
5.65-5.79 м.д., при этом псевдоаксиальные прото-
Рис. 1. Молекулярная структура цис-изомера соедине-
ны Н1 - в виде дублета дублетов с вицинальной
ния 2а в представлении атомов эллипсоидами тепло-
3J1ax,2
6.1-6.2 Гц и геминальной 2J1eq,1ax 17.2-
вых колебаний с 50%-ной вероятностью
17.4 Гц, псевдоэкваториальные протоны Н1 - так-
же в виде дублета дублетов (2J1eq,1ax 17.2-17.4,
При взаимодействии нитробензохромена
1а
3J1eq,2 3.6-4.4 Гц), протоны H2 - в виде дублета
с эквимолярным количеством морфолина и пи-
дублетов дублетов (3J1ax,2 6.1-6.2, 3J1eq,2 3.6-4.4,
перазинами в диоксане были выделены соответ-
3J2,3 3.4-4.1 Гц) или дублета триплетов из-за бли-
ствующие 3-амино-2-нитробензохроманы 3а-h c
зости 3J1eq,2 и 3J2,3, а протоны Н3 - в виде дублетов
выходами 60-87% (схема 3). Реакция протекает
с 3J2,3 3.4-4.1 Гц. В случае цис-изомеров указан-
диастереоселективно с образованием транс-изо-
ные протоны резонируют при 3.61-3.73 м.д. (H1ax:
меров. В случае первичных ароматических ами-
д.д, 3J1ax,2 11.9-12.2 и 2J1eq,1ax 15.8-16.0 Гц; H1eq:
нов происходит раскрытие дигидропиранового
д.д, 3J1eq,2 6.6-6.9 и 2J1eq,1ax 15.8-16.0 Гц), 4.85-
цикла в первоначально образующихся продуктах
4.87 м.д. (H2: д.д.д, 3J1ax,2 11.9-12.2, 3J1eq,2 6.6-6.9,
аза-реакции Михаэля с образованием нитроенами-
3J2,3 2.8-3.0 Гц) и 5.77-5.95 м.д. (Н3: д, 3J2,3 2.8-
нов 4а-g с выходами 70-93%. Подобное свойство
3.0 Гц). Подобные значения константы спин-спи-
4Н-хроменов ранее нами было показано на приме-
нового взаимодействия (КССВ) свидетельствуют о
ре β-карбонилзамещенных производных [28-30].
том, что в случае цис-изомеров алкокси- и нитро-
В растворе ДМСО нитроенамины 4а-g суще-
группы занимают, соответственно, псевдоаксиаль-
ствуют в виде смеси Е- и Z-изомеров [31-33], при
ное и псевдоэкваториальное положения, а в случае
этом в случае более основных 4-метокси- и 4-фе-
транс-изомеров - псевдоаксиальное положение
ноксианилинов преобладают Z-изомеры, стабили-
(рис. 2) [34-36].
зированные внутримолекулярной водородной свя-
В спектрах ЯМР 13С бензохроманов 2a-d ато-
зью, а в случае менее основных 4-броманилина и
мы углерода С1, С2 и С3 резонируют при 21.1-
2-нафтиламина основными выступают E-изомеры.
23.2, 79.4-80.6 и 93.3-96.6 м.д., причем в случае
Интересно отметить, что в случае нитроенами-
транс-изомеров сигналы указанных атомов прояв-
на 4h, полученного из 3-нитро-4Н-хромена (1е)
ляются в более слабом поле, чем в случае цис-про-
и n-анизидина (схема 3), в растворе ДМСО так-
дуктов. Судя по КССВ для 3-нитрофенилзаме-
же преобладает E-изомер, что можно объяснить
щенного бензохромана 2е (3J1,2 9.2, 3J2,3 3.2 Гц),
меньшими стерическими препятствиями для об-
арильный заместитель и нитрогруппа занимают
разования межмолекулярных водородных связей
псевдоэкваториальные положения, а метоксигруп-
по сравнению с производными нафтола. Легкость
па - псевдоаксиальное (рис. 2).
раскрытия дигидропиранового цикла, по-видимо-
му, определяется термодинамической выгодно-
Согласно РСА для цис-изомера соединения
стью образования кросс-сопряженной системы и
2а, торсионные углы HaxC1C2H2, HeqC1C2H2 и
стабилизацией открытой формы меж- и внутри-
H2C2C3H3 составляют 161°, 43° и 63°, что по урав-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
385
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
386
ОСИПОВ и др.
H
H
2
3
Hax
O2N
OR
Heq
1
O
O
1
Heq
H
H
H
2
ax
3
OR
NO
2
цис-2a-d
OR
H
3
2
Hax
H
O2N
1
O
Heq
O
H
eq
1
H
OR
2
H
3
ax
NO
2
H
транс-2a-d
H
H
2
2
O2N
O2N
Heq
O
O
1
1
H
NR
O2N
H
3
3
2
Hax
OMe
H
2e
3a-h
Рис. 2. Конформации цис- и транс-3-алкокси-2-нитро-2,3-дигидро-1H-бензо[f]хроменов 2a-d, бензохромена 2е и 3-ами-
но-2-нитробензохроманов 3а-h
нению Карплуса соответствует вицинальным кон-
В ИК спектрах нитроенаминов 4а-h в области
стантам, равным примерно 12, 6.6 и 3.5 Гц. Данные
3500-2800 см-1 присутствует широкая полоса по-
значения близки к наблюдаемым значениям КССВ
глощения ОН и NH групп, ассоциированных водо-
в растворе хлороформа (3J1ax,2 12.0, 3J1eq,2 6.7, 3J2,3
родными связями. Пуш-пульный характер двой-
2.8 Гц), в связи с чем конформации в кристалличе-
ной связи нитроенаминового фрагмента приводит
ском виде и растворе аналогичны.
к легкой E,Z-изомеризации в растворе ДМСО [37].
На примере соединения 4с показано, что при уве-
В спектрах ЯМР
1Н
3-амино-2-нитробен-
личении температуры в растворе ДМСО содержа-
зохроманов 3а-h протоны Н1, H2 и Н3 прояв-
ние Z-изомера повышается и при 100°C соотноше-
ляются в области 3.64-3.87, 5.23-5.70 и 4.89-
ние Z/E = 2.1:1, а при понижении температуры до
5.17 м.д. транс-Псевдоэкваториальное располо-
комнатной это соотношение снова составляет 1.5:1.
жение нитрогруппы и циклического вторичного
Характерная черта спектров ЯМР 1Н Z-изомеров -
амина (рис. 2) подтверждается большим значени-
присутствие в области 10.89-11.07 м.д. дублетно-
ем (3J2,3 9.2-9.4 Гц) вицинальной КССВ, соответ-
го сигнала (3J 13.5-14.0 Гц) NH-протона - более
ствующей взаимодействию протонов в положе-
ниях 2 и 3. Характеристично также присутствие
дезэкранированного по сравнению с NH-протоном
в Е-изомерах за счет участия во внутримолекуляр-
сигнала протона Н2 в виде дублета дублетов дуб-
летов (3J1ax,2 10.1-10.8, 3J1eq,2 5.2-6.6, 3J2,3 9.2-
ной водородной связи. В последних NH-протон
9.4 Гц). В спектрах ЯМР 13С атомы углерода С1,
резонирует в области 9.69-9.97 м.д. и проявляет-
С2 и С3 резонируют при 28.3-28.9, 79.5-79.8 и
ся в виде уширенного дублета с 3J 12.8-14.6 Гц
91.1-91.7 м.д. транс-Конфигурация продуктов
за счет вицинального взаимодействия с протоном
6а, b также подтверждается большим значением
группы =CHN. Сигнал ОН-протона проявляется в
вицинальной КССВ (3J2,3 9.8 Гц). При этом обра-
виде синглета при 9.76-9.97 м.д. для Z-изомера и
щает на себя внимание сильная поляризация свя-
в области 10.36-10.50 м.д. для Е-изомера. Кроме
зи C=C енаминокетонного фрагмента: атом угле-
того, более дезэкранированными в случае Е-форм
рода, связанный с аминогруппой, резонирует при
оказываются и протоны групп CH2 (синглетные
165.1 м.д., а соседний атом углерода - при 99.5 м.д.
сигналы при 4.34-4.38 м.д.) и =CHN (дублетные
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
387
Схема 4
OH
NO2
NO2
H
N
R
дихлорэтан
+
H
N
X
2
1.5 ч, rt
X
O
R
7a-c
8a-g
7, R = H (a), AcO (b), TsNH (c); 8, R = H, X = Br (67%), Z/E = 1:2.5 (a); R = H, X = MeO (77%), Z/E = 1:1.7 (b);
R = AcO, X = Br (61%), Z/E = 1:2.15 (c); R = AcO, X = MeO (80%), Z/E = 1:1.4 (d);
R = TsNH, X = H (69%), Z/E = 1:2.4 (e); R = TsNH, X = Br (89%), Z/E = 1:2.7 (f);
R = TsNH, X = MeO (66%), Z/E = 1:1.7 (g).
сигналы при 8.62-8.86 с 3J 11.5-14.0 Гц). Для
как ДМСО, в большей степени стабилизируют
Z-изомеров соответствующие протоны резони-
Е-форму. На примере нитроенамина 8d показано,
руют в области 4.15-4.23 и при ~ 7.2 м.д. либо в
что замена ДМСО, в котором Z/E = 1:1.4, на менее
составе сложных мультиплетов с ароматически-
полярный хлороформ приводит к преобладанию в
ми протонами, либо в виде дублетов с 3J 13.7-
растворе Z-изомера (Z/E = 5.7:1), стабилизирован-
14.0 Гц. Наконец, в спектрах ЯМР 13С нитроена-
ного внутримолекулярной водородной связью.
минов 4а-h сигналы метиленовых атомов углеро-
В спектрах ЯМР 1Н Z- и Е-изомеров 8а-g ги-
да для Z-изомеров смещены в слабое поле пример-
дроксильный протон проявляется в виде синглет-
но на 4 м.д. (25.4-25.6 м.д. против 21.5-21.7 м.д.
ного сигнала в области 9.45-9.67 м.д. (в растворе
для Е-форм).
ДМСО-d6). В случае Z-изомеров протоны групп
Пониженная электронная плотность в положе-
NH и =CHN наблюдаются в виде дублетов с 3J
нии 2 делает 3-нитробензофураны [38] также вос-
13.5-14.0 Гц, соответственно, при 10.94-11.12 и
приимчивыми к нуклеофильной атаке. Описаны
7.60-7.84 м.д. Для Е-изомеров указанные прото-
единичные примеры расщепления 3-нитробензо-
ны резонируют в области 9.15-9.39 (NH) и 8.60-
фуранов под действием первичных алифатических
8.70
(=CHN) м.д. и также проявляются в виде
дублетов с 3J 13.7-14.2 Гц. Подобные значения
аминов [39], енамина на основе морфолина и аце-
тофенона [40] и 2-(1-арилэтилиден)малононитри-
КССВ свидетельствуют о транс-расположении
протонов групп NH и =CHN относительно связи
лов [41].
С-N, которая из-за сопряжения имеет частично
Мы показали, что выдерживание эквимоляр-
двойной характер. Более значительное дезэкрани-
ной смеси 3-нитробензофуранов 7а-с с первич-
рование NH-протонов в случае Z-форм объясняет-
ными ароматическими аминами при комнатной
ся образованием внутримолекулярной водородной
температуре в дихлорэтане приводит к раскрытию
связи с атомом кислорода нитрогруппы. Наоборот,
фуранового цикла и образованию 2-гидроксифе-
протон =CHN находится в более слабом поле для
нилзамещенных β-нитроенаминов 8а-g с выхо-
E-изомера из-за пространственного сближения с
дами 61-89% (схема 4). Полученные продукты в
нитрогруппой.
растворе ДМСО существуют также в виде смеси
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Z- и E-изомеров с преобладанием последних, при-
чем соотношение E/Z возрастает при наличии в
ИК спектры записаны на Фурье-спектрометре
n-положении к аминогруппе электроноакцептор-
Shimadzu IRAffinity-1 (Япония), оснащенном
ного атома брома и уменьшается в случае n-ме-
приставкой Specac Diamond ATR GS10800-B
токсипроизводных. При этом природа заместителя
(Великобритания). Спектры ЯМР 1Н и 13C (400
в бензольном кольце 3-нитробензофуранов 7а-с
и 100 МГц соответственно), а также DEPT-135
явным образом не сказывается на выходе продук-
зарегистрированы на спектрометре JEOL JNM-
тов. По-видимому, сильные межмолекулярные во-
ECX400 (Япония) в CDCl3 или ДМСО-d6, внутрен-
дородные связи в таком полярном растворителе,
ний стандарт - сигнал остаточного растворителя
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
388
ОСИПОВ и др.
(СDCl3: 7.26 м.д. для ядер 1Н и 77.2 м.д. для ядер
для РСА, размером 0.305×0.294×0.226 мм, выра-
13С; ДМСО-d6: 2.50 м.д. для ядер 1Н и 39.5 м.д.
щены медленным испарением MeOH при комнат-
для ядер 13С). Элементный анализ выполнен на ав-
ной температуре. Сингония кристалла (C14H13NO4
томатическом СНNS-анализаторе Euro Vector EA-
M
259.25)
моноклинная, пространственная
3000 (Италия). Температуру плавления определя-
группа P21/с, a 10.7700(1) Å, b 14.0365(2) Å, c
ли капиллярным методом на приборе SRS OptiMelt
8.05130(10) Å, β 99.1780(10), V 1201.56(3) Å3, Z
MPA100 (США). Флэш-хроматографию проводи-
4, dвыч 1.433 г/см3, μ 0.884 мм-1. Сбор отражений,
ли на приборе BUCHI Reveleris X2 (Швейцария),
определение и уточнение параметров элементар-
адсорбент - силикагель (25-40 мкм), скорость по-
ной ячейки проведены с использованием специа-
тока МФ 20 мл/мин. Исходные нитрохромены 1a-e
лизированного программного пакета CrysAlisPro
[26, 42] и 3-нитробензофураны 7b, c [41] получены
1.171.38.41 (Rigaku Oxford Diffraction, 2015) [43].
по описанным в литературе методикам.
Структуры расшифрованы с помощью программы
ShelXT (Sheldrick, 2015) [44], уточнение ShelXL
3-Aлкокси-2-нитро-2,3-дигидро-1Н-бензо[f]-
(Sheldrick,
2015)
[45], молекулярная графика и
хромены 2а-е (общая методика). К суспензии
подготовка материала для публикации выполне-
1 ммоль бензохромена 1a, b (227 мг 1a, 348 мг
ны с использованием программного пакета Olex2
1b) в 5 мл метанола, этанола, изопропанола или
ver. 1.2.10 [46]. Результаты РСА зарегистрированы
н-бутанола прибавляли 0.015 мл (10 мол %) DBU
в Кембриджском центре кристаллографических
и смесь нагревали при кипении в течение 30 мин.
данных под номером CCDC 2084716 и могут быть
Избыток спирта отгоняли при пониженном давле-
нии, остаток очищали флэш-хроматографией на
request/cif.
силикагеле, элюент CHCl3. Изомеры цис- и транс-
2а, цис-2b, а также бензохроман 2е были выделены
транс-3-Метокси-2-нитро-2,3-дигидро-1H-
в индивидуальном виде, остальные продукты по-
бензо[f]хромен (транс-2a). Выход 115 мг (44%),
лучены в виде смеси цис- и транс-изомеров.
светло-желтые кристаллы, т.пл. 99-101°C (EtOH).
цис-3-Метокси-2-нитро-2,3-дигидро-1H-бен-
ИК спектр, ν, см-1: 2985, 2939, 1624, 1600. 1543,
зо[f]хромен (цис-2a). Выход 106 мг (41%), свет-
1512, 1462, 1388, 1330, 1222, 1192, 1145, 1095, 1060,
1014, 972, 914, 813, 798, 752, 675, 636. Спектр ЯМР
ло-желтые кристаллы, т.пл. 137-139°C (EtOH). ИК
спектр, ν, см-1: 2989, 2970, 2939, 1624, 1600, 1546,
1H (CDCl3), δ, м.д.: 3.50 д.д (1Н, H1, J 17.4, 6.2 Гц),
1512, 1357, 1288, 1219, 1195, 1122, 1060, 1014, 987,
3.57 c (3Н, CH3O), 3.85 д.д (1Н, H1, J 17.4, 3.6 Гц),
898, 810, 767, 740, 682. Спектр ЯМР 1H (CDCl3),
5.00 д.д.д (1Н, H2, J 6.2, 3.6, 3.4 Гц), 5.65 д (1Н,
δ, м.д.: 3.49 c (3Н, CH3O), 3.61 д.д (1Н, H1, J 16.0,
H3, J 3.4 Гц), 7.11 д (1Н, Н5, J 8.9 Гц), 7.39-7.44
6.7 Гц), 3.73 д.д (1Н, H1, J 16.0, 12.0 Гц), 4.85
м (1Наром), 7.53-7.57 м (1Наром), 7.70 д (1Наром, J
д.д.д (1Н, H2, J 12.0, 6.7, 2.8 Гц), 5.77 д (1Н, H3, J
8.7 Гц), 7.79-7.82 м (2Наром). Спектр ЯМР 13C
2.8 Гц), 7.13 д (1Н, Н5, J 8.9 Гц), 7.40-7.45 м
(CDCl3), δ, м.д.: 22.6 (СН2), 56.5 (СН3O), 79.8
(1Наром), 7.54-7.58 м (1Наром), 7.72 д (1Наром, J
(СН2), 96.6 (СН3), 110.7, 118.6 (СН), 121.7 (СН),
8.9 Гц), 7.80 д (1Наром, J 8.0 Гц), 7.89 д (1Наром,
124.4 (СН), 127.0 (СН), 128.8 (CH), 129.0 (СН),
J 8.5 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.: 21.1
129.8, 132.0, 147.6 (C4a). Найдено, %: C 64.78; H
(СН2), 56.4 (СH3O), 79.4 (СН2), 95.6 (СН3), 110.7,
5.01; N 5.33. C14H13NO4. Вычислено, %: C 64.86;
118.3 (СН), 121.9 (СН), 124.4 (СH), 127.2 (СН),
H 5.05; N 5.40.
128.7 (СН), 129.1 (СН), 129.8, 132.2, 147.2 (С4a).
Смесь цис- и транс-изомеров
2-нитро-3-
Найдено, %: C 64.80; H 4.99; N 5.31. C14H13NO4.
этокси-2,3-дигидро-1H-бензо[f]хромена
(1:1)
Вычислено, %: C 64.86; H 5.05; N 5.40.
(2b). Выход 215 мг (79%), желтое масло. ИК
РСА цис-изомера соединения 2а проведен на
спектр, ν, см-1: 2976, 2927, 1625, 1600, 1548, 1467,
дифрактометре Agilent SuperNova с использова-
1400, 1220, 1176, 1120, 1060, 999, 960, 860, 810,
нием микрофокусного источника рентгеновско-
769, 746. Чистый цис-изомер выделен флэш-хро-
го излучения с анодом из меди и координатным
матографией в виде светло-желтых кристаллов с
CCD детектором Atlas S2. Кристаллы, пригодные
т.пл. 122-124°C (с разл.) (MeOH). Спектр ЯМР 1H
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
389
(CDCl3), δ, м.д. (цис-изомер): 1.11 т (3Н, CH3, J
72.1 (CHMe2), 79.6 (CH2), 93.3 (CH3), 110.7, 118.4
7.1 Гц), 3.61 д.д (1Н, H1, J 15.8, 6.6 Гц), 3.67-3.78 м
(CH), 121.9 (CH), 124.3 (CH), 127.1 (CH), 128.7
(2H, H1, CH2O), 3.84 д.к (1H, CH2O, J 9.9, 7.1 Гц),
(CH), 129.0 (CH), 129.7, 132.3, 147.6 (С4a). Спектр
4.85 д.д.д (1H, H2, J 12.0, 6.6, 3.0 Гц), 5.88 д (1Н,
ЯМР 13C (CDCl3), δ, м.д. (транс-изомер): 21.8
Н3, J 3.0 Гц), 7.11 д (1Н, Н5, J 8.9 Гц), 7.40-7.44
(CH3), 23.2 (CH2), 23.3 (CH3), 72.3 (CHMe2), 80.6
м (1Наром), 7.54-7.58 м (1Наром), 7.71 д (1Наром, J
(CH2), 94.5 (CH3), 110.6, 118.7 (CH), 121.8 (CH),
8.9 Гц), 7.81 д (1Наром, J 8.0 Гц), 7.90 д (1Наром, J
124.2 (CH), 127.0 (CH), 128.8 (CH), 128.9 (CH),
8.5 Гц). Спектр ЯМР 1H (CDCl3), δ, м.д. (транс-
130.0, 132.1, 148.2 (С4a). Найдено, %: C 66.93; H
изомер): 1.20 т (3Н, CH3, J 7.1 Гц), 3.54 д.д (1Н,
5.90; N 4.78. C16H17NO4. Вычислено, %: C 66.89;
H1, J 17.4, 6.2 Гц), 3.74-3.88 м (2H, H1, CH2O), 3.95
H 5.96; N 4.88.
д.к (1H, CH2O, J 9.6, 7.1 Гц), 4.99 д.т (1H, H2, J 6.2,
Смесь цис- и транс-изомеров
3-бутокси-
3.9 Гц), 5.74 д (1Н, Н3, J 3.9 Гц), 7.08 д (1Н, Н5, J
2-нитро-2,3-дигидро-1H-бензо[f]хромена
(2d)
8.9 Гц), 7.39-7.43 м (1Наром), 7.53-7.57 м (1Наром),
(1.4:1). Выход 253 мг (84%), желтое масло. ИК
7.69 д (1Наром, J 8.9 Гц), 7.80 д (1Наром, J 8.0 Гц),
спектр, ν, см-1: 2958, 2933, 1625, 1600, 1550, 1516,
7.90 д (1Наром, J 8.5 Гц). Спектр ЯМР 13C (CDCl3),
1467, 1400, 1384, 1220, 1174, 1099, 1060, 1014,
δ, м.д. (цис-изомер): 14.8 (CH3), 21.1 (СН2), 65.0
964, 896, 862, 810, 771, 744, 682. Спектр ЯМР 1H
(CH2O), 79.5 (СН2), 94.4 (СН3), 110.7, 118.4 (СН),
(CDCl3), δ, м.д. (цис-изомер): 0.78 т (3H, CH3, J
121.9 (СН), 124.3 (СH), 127.1 (СН), 128.7 (СН),
7.3 Гц), 1.13-1.22 м (2H, CH2), 1.42-1.49 м (2Н,
129.0 (СН),
129.7,
132.2,
147.5 (С4a). Спектр
СН2), 3.60-3.92 м (4Н, Н1, СН2О), 4.87 д.д.д (1Н,
ЯМР 13C (CDCl3), δ, м.д. (транс-изомер): 15.0
H2, J 11.9, 6.9, 3.0 Гц), 5.86 д (1H, H3, J 2.8 Гц), 7.07
(CH3), 22.9 (СН2), 65.2 (CH2O), 80.2 (СН2), 95.6
д (1Н, Н5, J 8.9 Гц), 7.40-7.44 м (1Наром), 7.54-7.58
(СН3), 110.7, 118.7 (СН), 121.7 (СН), 124.3 (СH),
м (1Наром), 7.71 д (1Наром, J 8.9 Гц), 7.81 д (1Наром,
127.0 (СН), 128.8 (СН), 128.9 (СН), 129.7, 132.1,
J 8.0 Гц), 7.90 д (1Наром, J 8.5 Гц). Спектр ЯМР 1H
147.9 (С4a). Найдено, %: C 65.85; H 5.49; N 5.06.
(CDCl3), δ, м.д. (транс-изомер): 0.84 т (3H, CH3,
C15H15NO4. Вычислено, %: C 65.92; H 5.53; N 5.13.
), 1.49-1.57 м (2Н,
J 7.3 Гц), 1.22-1.33 м (2H, CH2
Смесь цис- и транс-изомеров 3-изопропокси-
СН2), 3.54 д.д (1Н, H1, J 17.4, 6.2 Гц), 3.62-3.84
2-нитро-2,3-дигидро-1H-бензо[f]хромена
(2c)
м (3Н, Н1, СН2О), 4.99 д.т (1Н, Н2, J 6.2, 3.9 Гц),
(1.5:1). Выход 230 мг (80%), желтое масло. ИК
5.71 д (1Н, H3, J 3.9 Гц), 7.08 д (1Н, Н5, J 8.9 Гц),
спектр, ν, см-1: 2978, 2922, 1625, 1600, 1546, 1516,
7.39-7.43 м (1Наром), 7.52-7.56 м (1Наром), 7.68 д
1467, 1450, 1384, 1330, 1220, 1176, 1124, 1093, 1051,
(1Наром, J 8.9 Гц), 7.79-7.82 м (2Наром, J 8.0 Гц).
1012, 999, 968, 864, 819, 798, 744, 671, 638. Спектр
Спектр ЯМР 13C (CDCl3), δ, м.д. (цис-изомер):
ЯМР 1H (CDCl3), δ, м.д. (цис-изомер): 1.05 д (3H,
13.7 (CH3), 19.0 (CH2), 21.2 (CH2), 31.2 (CH2), 69.2
CH3, J 6.2 Гц), 1.13 (3H, CH3, J 6.2 Гц), 3.62 д.д (1Н,
(CH2O), 79.5 (CH2), 94.6 (CH3), 110.7, 118.4 (CH),
H1, J 15.8, 6.9 Гц), 3.74 д.д (1Н, H1, J 15.8, 12.2 Гц),
121.9 (CH), 124.3 (CH), 127.1 (CH), 128.7 (CH),
4.08 септет (1Н, CHMe2, J 6.2 Гц), 4.85 д.д.д (1Н,
129.0 (CH), 129.7, 132.2, 147.5 (С4a). Спектр ЯМР
H2, J 12.2, 6.9, 3.0 Гц), 5.95 д (1H, H3, J 3.0 Гц), 7.09
13C (CDCl3), δ, м.д. (транс-изомер): 13.7 (CH3),
д (1Н, Н5, J 8.9 Гц), 7.41-7.45 м (1Наром), 7.54-7.58
19.0 (CH2), 23.0 (CH2), 31.4 (CH2), 69.4 (CH2O),
м (1Наром), 7.71 д (1Наром, J 8.9 Гц), 7.81 д (1Наром,
80.2 (CH2), 95.8 (CH3), 110.6, 118.7 (CH), 121.7
J 8.0 Гц), 7.91 д (1Наром, J 8.5 Гц). Спектр ЯМР 1H
(CH), 124.3 (CH), 127.0 (CH), 128.8 (CH), 128.9
(CDCl3), δ, м.д. (транс-изомер): 1.15 д (3H, CH3, J
(CH), 129.7, 132.0, 148.0 (С4a). Найдено, %: C
6.2 Гц), 1.23 (3H, CH3, J 6.2 Гц), 3.55 д.д (1Н, H1, J
67.85; H 6.32; N 4.58. C17H19NO4. Вычислено, %:
17.2, 6.1 Гц), 3.84 д.д (1Н, H1, J 17.2, 4.4 Гц), 4.17
C 67.76; H 6.36; N 4.65.
септет (1Н, CHMe2, J 6.2 Гц), 4.96 д.д.д (1Н, Н2,
J 6.1, 4.4, 4.1 Гц), 5.79 д (1Н, H3, J 4.1 Гц), 7.06 д
(1R*,2S*,3R*)-3-Метокси-2-нитро-1-(3-нит-
(1Н, Н5, J 8.9 Гц), 7.39-7.43 м (1Наром), 7.52-7.56
рофенил)-2,3-дигидро-1H-бензо[f]хромен
(2e).
м (1Наром), 7.68 д (1Наром, J 8.9 Гц), 7.79-7.82 м
Выход 198 мг (52%), бесцветные кристаллы, т.пл.
(2Наром, J 8.0 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.
199-201°C (EtOH). ИК спектр, ν, см-1: 2937, 1622,
(цис-изомер): 21.1 (CH2), 21.6 (CH3), 23.1 (CH3),
1598, 1556, 1527, 1465, 1402, 1344, 1315, 1220,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
390
ОСИПОВ и др.
1143, 1101, 1039, 1018, 977, 823, 746, 734, 690, 677,
м.д.: 28.7 (CH2), 47.9 (2CH2N), 67.0 (2CH2O), 79.6
634. Спектр ЯМР 1H (CDCl3), δ, м.д.: 3.43 c (3Н,
(CH2), 91.6 (CH3), 109.6, 118.2 (CH), 121.7 (CH),
CH3O), 5.02 д.д (1Н, Н2, J 9.2, 3.2 Гц), 5.63 д (1Н,
124.3 (CH), 127.3 (CH), 128.8 (CH), 129.2 (CH),
Н1, J 9.2 Гц), 5.67 д (1Н, Н3, J 3.2 Гц), 7.20-7.32 м
129.4, 132.1, 151.2 (C4a). Найдено, %: C 64.89; H
(3Наром), 7.33 д (1Наром, J 8.5 Гц), 7.45 т (1Наром,
5.75; N 8.83. C17H18N2O4. Вычислено, %: C 64.96;
J 8.0 Гц), 7.62 д (1Наром, J 7.8), 7.78 д (1Наром, J
H 5.77; N 8.91.
8.5 Гц), 7.81 д (1Наром, J 8.9 Гц), 8.02 т (1Наром, J
транс-1-(2-Нитро-2,3-дигидро-1H-бензо[f]-
1.8 Гц), 8.07 д.д.д (1Наром, J 8.3, 2.3, 1.2 Гц). Спектр
хромен-3-ил)-4-фенилпиперазин
(3b). Выход
ЯМР 13C (CDCl3), δ, м.д.: 39.3 (CH1), 56.5 (CH3O),
355 мг (66%), бесцветные кристаллы, т.пл. 171-
88.8 (CH2), 95.8 (CH3), 113.9, 118.7 (CH), 122.9
173°C (EtOH). ИК спектр, ν, см-1: 1622, 1599,
(CH), 123.3 (CH), 123.9 (CH), 124.3 (CH), 126.9
1553, 1503, 1468, 1452, 1416, 1314, 1275, 1233,
(CH), 129.0 (CH), 130.3 (CH), 130.8 (CH), 130.9
1217, 1188, 1157, 1142, 1076, 1065, 1020, 988, 959,
(CH), 131.0, 134.8, 145.1, 148.1, 148.9. Найдено, %:
922, 818, 781, 756, 745, 723, 689. Спектр ЯМР 1H
C 63.11; H 4.22; N 7.28. C20H16N2O6. Вычислено,
(CDCl3), δ, м.д.: 2.99-3.04 м (2H, CH2N), 3.17-3.34
%: C 63.16; H 4.24; N 7.37.
м (6H, CH2N), 3.74-3.87 м (2H, CH2), 4.99 д (1H,
H3, J 9.4 Гц), 5.27 д.д.д (1Н, Н2, J 10.8, 9.4, 6.4 Гц),
3-Аминозамещенные
2-нитро-2,3-дигидро-
6.88 т (1Наром, J 7.3 Гц), 6.94 д (2Наром, J 8.0 Гц),
1Н-бензо[f]хромены
3а-h (общая методика).
7.07 д (1Наром, J 8.9 Гц), 7.23-7.29 м (2Наром), 7.39-
В 5 мл диоксана растворяли при нагревании
7.43 м (1Наром), 7.52-7.56 м (1Наром), 7.68-7.72 м
227 мг (1 ммоль) бензохромена 1а и при переме-
(2Наром), 7.80 д (1Наром, J 8.0 Гц). Спектр ЯМР
шивании прибавляли 1 ммоль морфолина (87 мг)
13C (CDCl3), δ, м.д.: 28.8 (СН2), 47.6 (2СН2N),
или N-замещенного пиперазина {162 мг 1-фенил-
49.6 (2СН2N), 79.8 (СН2), 91.5 (СН3), 109.6, 116.6
пиперазина, 176 мг 1-(о-толил)пиперазина, 176 мг
(2СНPh), 118.3 (СН), 120.1 (СН), 121.8 (СН), 124.3
1-(м-толил)пиперазина, 197 мг 1-(2-хлорфенил)-
(СН), 127.3 (СН), 128.8 (СН), 129.20 (СН), 129.24
пиперазина, 265 мг 1-[3-(трифторметил)-4-хлор-
(2СНPh), 129.4, 132.1, 151.2, 151.4. Найдено, %: C
фенил]пиперазина, 192 мг 1-(2-метоксифенил)-
70.85; H 5.92; N 10.70. C23H23N3O3. Вычислено, %:
пиперазина, 205 мг 1-[4-(пиперазин-1-ил)фенил]-
C 70.93; H 5.95; N 10.79.
этан-1-она}. Смесь выдерживали при комнатной
транс-1-(2-Нитро-2,3-дигидро-1H-бензо[f]-
температуре до полного исчезновения исходно-
хромен-3-ил)-4-(o-толил)пиперазин (3c). Выход
го бензохромена (контроль методом ТСХ, элюент
260 мг (64%), светло-желтые кристаллы, т.пл. 181-
CH2Cl2). Выпавший осадок отфильтровывали и
183°C (PhH). ИК спектр, ν, см-1: 3055, 2960, 2814,
перекристаллизовывали из подходящего раство-
1624, 1597, 1554, 1490, 1465, 1456, 1355, 1267,
рителя. В случае, если осадок не выпадал, рас-
1197, 1136, 1076, 1026, 975, 927, 864, 813, 777, 763,
творитель отгоняли при пониженном давлении и
748, 723, 696, 611. Спектр ЯМР 1H (CDCl3), δ, м.д.:
остаток очищали перекристаллизацией.
N), 3.28-
2.34 c (3H, CH3), 2.91-3.01 м (6H, CH2
транс-4-(2-Нитро-2,3-дигидро-1H-бензо[f]-
3.33 м (2H, CH2N), 3.77 д.д (1H, H1, J 15.8, 6.6 Гц),
хромен-3-ил)морфолин (3a). Выход 188 мг (60%),
3.83 д.д (1Н, Н1, J 15.8, 10.8 Гц), 4.99 д (1Н, H3, J
бесцветные кристаллы, т.пл. 165-167°C (MeOH).
9.4 Гц), 5.28 д.д.д (1Н, H2, J 10.8, 9.4, 6.6 Гц), 6.99
ИК спектр, ν, см-1: 2968, 2860, 1624, 1598, 1550,
т (1Наром, J 7.3 Гц), 7.02 д (1Hаром, J 7.6 Гц), 7.12 д
1512, 1469, 1367, 1269, 1230, 1188, 1159, 1114,
(1Наром, J 8.9 Гц), 7.15-7.20 м (2Наром), 7.39-7.43
1070, 1024, 979, 941, 891, 864, 815, 769, 748, 723,
м (1Наром), 7.52-7.56 м (1Наром), 7.70 д (1Наром, J
696, 665, 609. Спектр ЯМР 1H (CDCl3), δ, м.д.:
8.9 Гц), 7.71 д (1Наром, J 8.3 Гц), 7.80 д (1Наром, J
2.81-2.87 м (2Н, CH2N), 3.11-3.18 м (2H, CH2N),
8.0 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.: 18.0 (СН3),
3.67-3.85 м (6H, 2CH2O, H1), 4.89 д (1H, H3, J
28.9 (СН2), 48.1 уш.с (2СН2N), 51.9 (2СН2N), 79.8
9.4 Гц), 5.23 д.д.д (1H, H2, J 10.1, 9.4, 6.6 Гц), 7.08 д
(СН2), 91.7 (СН3), 109.6, 118.3 (CH), 119.3 (СН),
(1H, H5, J 8.9 Гц), 7.41 т (1Hаром, J 7.4 Гц), 7.53 д.д.д
121.8 (СН), 123.4 (СН), 124.2 (СН), 126.7 (СН),
(1Hаром, J 8.3, 6.9, 0.9 Гц), 7.68-7.71 м (2Наром),
127.2 (СН), 128.8 (СН), 129.2 (СН), 129.4, 131.1
7.80 д (1H, J 8.0 Гц). Спектр ЯМР 13C (CDCl3), δ,
(СН), 132.2, 132.8, 151.39, 151.48. Найдено, %: C
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
391
71.50; H 6.24; N 10.34. C24H25N3O3. Вычислено, %:
транс-1-[3-(Трифторметил)-4-хлорфенил]-4-
C 71.44; H 6.25; N 10.41.
(2-нитро-2,3-дигидро-1H-бензо[f]хромен-3-ил)-
пиперазин (3f). Выход 393 мг (80%), бесцветные
транс-1-(2-Нитро-2,3-дигидро-1H-бензо[f]-
кристаллы, т.пл. 203-205°C (ДМФА-MeOH, 1:3).
хромен-3-ил)-4-(м-толил)пиперазин (3d). Выход
ИК спектр, ν, см-1: 1624, 1599, 1555, 1489, 1300,
320 мг (79%), бесцветные кристаллы, т.пл. 180-
1260, 1236, 1194, 1173, 1144, 1119, 1076, 1065, 1022,
182°C (EtOH). ИК спектр, ν, см-1: 1624, 1599, 1584,
980, 961, 943, 860, 814, 779, 772, 750. Спектр ЯМР
1557, 1495, 1468, 1416, 1314, 1277, 1252, 1233,
1H (ДМСО-d6), δ, м.д.: 2.86-2.93 м (2Н, CH2N),
1188, 1175, 1144, 988, 957, 941, 820, 770, 746, 687.
3.15-3.29 м (6H, CH2N), 3.64 д.д (1Н, Н1, J 16.0,
Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 2.22 c (3H,
10.3 Гц), 3.85 д.д (1Н, Н1, J 16.0, 6.0 Гц), 5.17 д (1Н,
CH3), 2.83-2.95 м (2H, CH2N), 3.03-3.20 м (2H,
Н3, J 9.2 Гц), 5.70 д.д.д (1Н, Н2, J 10.3, 9.2, 6.0 Гц),
CH2N), 3.64 д.д (1H, H1, J 15.8, 10.6 Гц), 3.85 д.д
7.09 д (1Наром, J 8.9 Гц), 7.21 д.д (1Наром, J 8.9,
(1Н, Н1, J 15.8, 5.2 Гц), 5.14 д (1Н, H3, J 9.2 Гц), 5.67
2.9 Гц), 7.26 д (1Наром, J 2.9 Гц), 7.37-7.41 м
д.д.д (1Н, H2, J 10.6, 9.2, 5.2 Гц), 6.58 д (1Наром, J
(1Наром), 7.47 д (1Наром, J 8.9 Гц), 7.50-7.54 м
7.1 Гц), 6.72 д (1Hаром, J 8.2 Гц), 6.75 с (1Наром),
(1Наром), 7.75 д (1Наром, J 8.9 Гц), 7.82-7.86 м
7.04-7.10 м (2Наром), 7.37-7.41 м (2Наром), 7.50-
(2Наром). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 28.3
7.54 м (2Наром), 7.75 д (1Наром, J 8.9 Гц), 7.82-7.86 м
(CH2), 47.2 (2CH2N), 48.3 (2CH2N), 79.5 (CH2), 91.1
(2Наром). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 22.0
(CH3), 111.1, 114.3 к (CH, 3JCF 5.7 Гц), 118.6 (CH),
(СН3), 28.3 (СН2), 47.5 (2СН2N), 49.2 (2СН2N), 79.5
119.4, 120.5 (CH), 122.8 (CH), 123.6 к (СF3, 1JCF
(СН2), 91.2 (СН3), 111.1, 113.4 (CH), 117.0 (CH),
271.3 Гц), 124.5 (CH), 127.4 к (CCF3, 2JCF 29.6 Гц),
118.7 (CH), 120.4 (CH), 122.7 (CH), 124.5 (CH),
127.5 (CH), 128.9 (CH), 129.1 (CH), 129.3, 132.4,
127.5 (CH), 128.9 (CH), 129.1 (CH), 129.3 (CH, C),
132.5 (CH), 150.2, 151.1. Найдено, %: C 58.55; H
132.4, 138.5, 151.1, 151.5. Найдено, %: C 71.37; H
4.27; N 8.46. C24H21ClF3N3O3. Вычислено, %: C
6.24; N 10.33. C24H25N3O3. Вычислено, %: C 71.44;
58.60; H 4.30; N 8.54.
H 6.25; N 10.41.
транс-1-(2-Метоксифенил)-4-(2-нитро-2,3-
транс-1-(2-Хлорфенил)-4-(2-нитро-2,3-ди-
дигидро-1H-бензо[f]хромен-3-ил)пиперазин
гидро-1H-бензо[f]хромен-3-ил)пиперазин
(3e).
(3g). Выход 330 мг (79%), бесцветные кристаллы,
Выход 325 мг (77%), светло-желтые кристаллы,
т.пл. 183-185°C (EtOH). ИК спектр, ν, см-1: 1624,
т.пл. 185-187°C (EtOH). ИК спектр, ν, см-1: 2827,
1597, 1555, 1504, 1462, 1454, 1381, 1358, 1315,
1624, 1585, 1556, 1475, 1456, 1440, 1379, 1315,
1267, 1236, 1198, 1140, 1117, 1076, 1055, 1024, 976,
1232, 1193, 1074, 1062, 1039, 1024, 931, 806, 746,
949, 928, 812, 779, 743. Спектр ЯМР 1H (ДМСО-d6),
723, 688, 659. Спектр ЯМР 1H (CDCl3), δ, м.д.:
δ, м.д.: 2.80-2.98 м (6H, СН2N), 3.15-3.22 м (2H,
2.99-3.13 м (6H, CH2N), 3.32-3.36 м (2H, CH2N),
CH2N), 3.64 д.д (1Н, Н1, J 16.0, 10.8 Гц), 3.76 c (3H,
3.77 д.д (1H, H1, J 15.8, 6.6 Гц), 3.83 д.д (1Н, Н1,
CH3O), 3.85 д.д (1Н, Н1, J 16.0, 5.7 Гц), 5.12 д (1Н,
J 15.8, 10.6 Гц), 4.99 д (1Н, Н3, J 9.4 Гц), 5.27
Н3, J 9.2 Гц), 5.66 д.д.д (1Н, H2, J 10.8, 9.2, 5.7 Гц),
д.д.д (1Н, H2, J 10.6, 9.4, 6.6 Гц), 6.98 т.д (1Наром,
6.82-6.96 м (4Наром), 7.12 д (1Наром, J 8.9 Гц), 7.37-
J 7.8, 1.4 Гц), 7.05 д.д (1Наром, J 8.2, 1.4 Гц), 7.11
7.41 м (1Hаром), 7.50-7.54 м (1Hаром), 7.76 д (1Наром,
д (1Hаром, J 8.9 Гц), 7.22 д.д (1Наром, J 7.6, 1.4 Гц),
J 8.9 Гц), 7.82-7.87 м (2Наром). Спектр ЯМР 13C
7.37 д.д (1Наром, J 7.8, 1.4 Гц), 7.39-7.43 м (1Наром),
(ДМСО-d6), δ, м.д.: 28.4 (CH2), 47.7 уш.с (2CH2N),
7.51-7.56 м (1Наром), 7.69-7.72 м (2Наром), 7.80 д
50.8 (2CH2N), 55.9 (CH3O), 79.5 (CH2), 91.3 (CH3),
(1Наром, J 8.0 Гц). Спектр ЯМР 13C (CDCl3), δ, м.д.:
111.0, 112.4 (CH), 118.7 (2CH), 121.4 (CH), 122.7
28.8 (CH2), 47.8 уш.с (2CH2N), 51.4 (2CH2N), 79.8
(CH), 123.1 (CH), 124.4 (CH), 127.5 (CH), 128.9
(CH2), 91.6 (CH3), 109.6, 118.4 (CH), 120.6 (CH),
(CH), 129.1 (CH), 129.3, 132.4, 141.6, 151.2, 152.6.
121.7 (CH), 123.9 (CH), 124.2 (CH), 127.2 (CH),
Найдено, %: C 68.66; H 5.97; N 9.95. C24H25N3O4.
127.7 (CH), 128.8 (CH), 128.9, 129.2 (CH), 129.4,
Вычислено, %: C 68.72; H 6.01; N 10.02.
130.7 (CH), 132.1, 149.3, 151.3. Найдено, %: C
65.15; H 5.19; N 9.84. C23H22ClN3O3. Вычислено,
транс-1-{4-[4-(2-Нитро-2,3-дигидро-1H-бен-
%: C 65.17; H 5.23; N 9.91.
зо[f]хромен-3-ил)пиперазин-1-ил]фенил}этан-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
392
ОСИПОВ и др.
1-он (3h). Выход 375 мг (87%), бесцветные кри-
уш.с (2Н, NH2), 7.36-7.40 м (1Hаром), 7.50-7.54
сталлы, т.пл. 201-203°C (EtOH). ИК спектр, ν, см-1:
м (1Наром), 7.72 д (1Наром, J 8.9 Гц), 7.81-7.86 м
2833, 1658, 1622, 1595, 1548, 1512, 1465, 1444,
(2Наром). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.:
1419, 1388, 1359, 1319, 1280, 1238, 1219, 1209,
28.1 (2CH3), 29.1 (CH2хромен), 31.5 (CMe2), 43.6
1190, 1145, 1109, 1076, 1064, 1051, 1022, 975, 950,
(CH2), 50.8 (CH2), 71.9 (CH3хромен), 79.8 (CH3хромен),
923, 887, 862, 815, 802, 777, 769. Спектр ЯМР 1H
99.5 (C=CN), 111.4, 119.0 (CH), 122.6 (CH), 124.3
(ДМСО-d6), δ, м.д.: 2.43 c (3H, CH3), 2.85-2.92 м
(CH), 127.5 (CH), 128.6 (CH), 128.9 (CH), 129.2,
(2H, CH2N), 3.14-3.22 м (2H, CH2N), 3.26-3.40 м
132.7, 152.6 (C4хaромен), 165.1 (С=СN), 192.8 (C=O).
(4H, CH2N), 3.64 д.д (1Н, Н1, J 15.8, 10.5 Гц), 3.85
Найдено, %: C 68.77; H 5.99; N 7.57. C21H22N2O4.
д.д (1Н, Н1, J 15.8, 6.0 Гц), 5.17 д (1Н, Н3, J 9.2 Гц),
Вычислено, %: C 68.84; H 6.05; N 7.65.
5.69 д.д.д (1Н, Н2, J 10.5, 9.2, 6.0 Гц), 6.97 д (2Hаром,
2-{транс-8-(Адамантан-1-ил)-2-нитро-2,3-
J 8.7 Гц), 7.07 д (1Hаром, J 8.9 Гц), 7.36-7.40 м
дигидро-1H-бензо[f]хромен-3-ил}-3-амино-5,5-
(1Hаром), 7.50-7.54 м (1Наром), 7.72 д (1Hаром, J
диметилциклогекс-2-ен-1-он (6b). Выход 320 мг
8.9 Гц), 7.76 д (2Hаром, J 8.7 Гц), 7.82-7.85 м
(64%), бесцветные кристаллы, т.пл. 237-239°C (с
(2Наром). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 26.7
разл.) (MeOH-CH2Cl2, 2:1). ИК спектр, ν, см-1:
(CH3), 28.3 (CH2), 47.2 (2CH2N), 47.5 (2CH2N),
3439, 3316, 3186, 2895, 2847, 1653, 1601, 1558,
79.5 (CH2), 91.2 (CH3), 111.0, 113.9 (2CH), 118.6
1474, 1433, 1408, 1389, 1371, 1344, 1317, 1290,
(CH), 122.7 (CH), 124.5 (CH), 127.4, 127.5 (CH),
1229, 1150, 1076, 1026, 995, 964, 885, 818, 799, 775.
128.9 (CH), 129.1 (CH), 129.3, 130.6 (2CH), 132.4,
Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 0.90 с (3H,
151.1, 154.3, 196.2 (C=O). Найдено, %: C 69.62; H
CH3), 0.91 c (3H, CH3), 1.74 уш.с (6H, CH2Ad), 1.93
5.80; N 9.63. C25H25N3O4. Вычислено, %: C 69.59;
уш.с (6H, CH2Ad), 2.00 д (2H, CH2, J 2.1 Гц), 2.06
H 5.84; N 9.74.
уш.с (3Н, CHAd), 2.27 д (2H, CH2, J 3.7 Гц), 3.52 д.д
3-Аминоциклогекс-2-ен-1-оны 6a, b (общая
(1H, H1хромен, J 15.8, 11.0 Гц), 3.81 д.д (1Н, Н1хромен,
методика). К суспензии 1 ммоль бензохромена 1а,
J 15.8, 5.7 Гц), 5.40 д (1Н, H3хромен, J 9.8 Гц), 6.04
с (227 мг 1а, 361 мг 1с) в 10 мл MeCN прибавля-
д.д.д (1Н, H2, J 11.0, 9.8, 5.7 Гц), 7.01 д (1Наром, J
ли 140 мг (1 ммоль) 3-амино-5,5-диметилцикло-
8.9 Гц), 7.09 уш.с (2Н, NH2), 7.60 д.д (1Наром, J 8.9,
гекс-2-ен-1-oна (5), смесь нагревали при кипении
2.1 Гц), 7.68 д (1Наром, J 8.9 Гц), 7.70 д (1Наром,
в течение 12 ч и затем выдерживали при -10°C в
J 2.1 Гц), 7.76 д (1Hаром, J 8.9 Гц). Спектр ЯМР
течение 1 ч. Выпавший осадок отфильтровывали,
13C (ДМСО-d6), δ, м.д.: 28.12 (CH3), 28.15 (CH3),
промывали ледяным MeOH и сушили на воздухе
28.9 (3CHAd), 29.1 (CH2хромен), 31.5 (CMe2), 36.2
при комнатной температуре. Для очистки продукт
(CAd), 36.8 (3CH2Ad), 43.1 (3CH2Ad), 43.6 (CH2),
растворяли в минимальном количестве CH2Cl2
50.8 (CH2), 71.9 (CH3хромен), 79.8 (CH3хромен), 99.5
и осаждали двукратным по объему количеством
(C=CN), 111.0, 118.6 (CH), 122.4 (CH), 123.8 (CH),
MeOH.
125.4 (CH), 128.7 (CH), 129.3, 130.9, 146.7 (C8хромен),
152.1 (C4хaромен),
165.1 (С=СN),
192.8 (C=O).
3-Амино-5,5-диметил-2-(транс-2-нитро-2,3-
Найдено, %: C 74.41; H 7.22; N 5.51. C31H36N2O4.
дигидро-1H-бензо[f]хромен-3-ил)циклогекс-2-
Вычислено, %: C 74.37; H 7.25; N 5.60.
ен-1-он (6а). Выход 220 мг (60%), бесцветные
кристаллы, т.пл. 209-210°C (MeOH-СH2Cl2). ИК
Нитроенамины 4а-h (общая методика). К
спектр, ν, см-1: 3464, 3321, 1651, 1593, 1556, 1512,
раствору 1 ммоль нитрохромена 1a, c-e (227 мг 1а,
1465, 1425, 1388, 1342, 1327, 1303, 1257, 1226,
361 мг 1с, 283 мг 1d, 177 мг 1е) в 4 мл дихлорэтана
1172, 1143, 1072, 1022, 993, 862, 812, 779, 769,
прибавляли при перемешивании раствор 1 ммоль
754. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 0.90 с
первичного ароматического амина (93 мг анилина,
(3H, CH3), 0.91 c (3H, CH3), 2.00 уш.с (2H, CH2),
172 мг 4-броманилина, 123 мг 4-метоксианилина,
2.27 д (2H, CH2, J 3.4 Гц), 3.54 д.д (1H, H1хромен, J
185 мг 4-феноксианилина, 143 мг 2-аминонафта-
15.8, 11.0 Гц), 3.84 д.д (1Н, Н1хромен, J 15.8, 5.7 Гц),
лина) в 4 мл диоксана. Смесь выдерживали при
5.43 д (1Н, H3хромен, J 9.8 Гц), 6.05 д.д.д (1Н, H2,
комнатной температуре в течение 2 ч, выпавший
J 11.0, 9.8, 5.7 Гц), 7.06 д (1Наром, J 8.9 Гц), 7.09
осадок отфильтровывали и перекристаллизовы-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
393
вали из смеси ДМФА-EtOH или MeOH (в случае
128.9 (CH), 129.1 (CH), 132.86 (CH), 132.95 (CH),
продукта 4h).
133.6, 134.0, 139.2 (CH), 139.5 (CH), 139.8, 140.3,
152.8, 153.8. Найдено, %: C 57.10; H 3.84; N 6.95.
1-[2-Нитро-3-(фениламино)аллил]нафта-
C19H15BrN2O3. Вычислено, %: C 57.16; H 3.79; N
лин-2-ол (4a). Выход 240 мг (75%), ярко-желтые
7.02.
кристаллы, т.пл. 190-192°C (ДМФА-EtOH, 1:3).
ИК спектр, ν, см-1: 3400-3100, 1641, 1589, 1516,
1-{3-[(4-Метоксифенил)амино]-2-нитроал-
1501, 1476, 1450, 1427, 1373, 1339, 1323, 1312,
лил}нафталин-2-ол (4c). Выход 280 мг (80%),
1267, 1215, 1196, 1157, 945, 858, 808, 752, 741, 718,
ярко-желтые кристаллы, т.пл. 185-187°C (ДМФА-
684. Спектр ЯМР 1H (ДМСО-d6), δ, м.д. (смесь
EtOH, 1:3). ИК спектр, ν, см-1: 3400-3000, 1636,
E- и Z-изомеров, Z/E = 1:1): 4.19 c (2Н, CH2, Z),
1589, 1510, 1431, 1387, 1375, 1346, 1300, 1236,
4.38 c (2Н, CH2, E), 7.04-7.46 м (16Hаром, =CHN,
1217, 1167, 1151, 1136, 1057, 1034, 995, 970, 878,
Z), 7.65-7.79 м (4Наром), 7.95 д (1Наром, J 8.2 Гц),
866, 822, 810, 791, 750. Спектр ЯМР 1H (ДМСО-d6),
8.11 д (1Наром, J 8.5 Гц), 8.70 д (1Н, =СHN, E, J
δ, м.д. (Z/E = 1.5:1) (Z-изомер): 3.66 c (3H, CH3O),
12.1 Гц), 9.74 уш.д (1Н, NH, E, J 13.3 Гц), 9.94 c
4.16 c (2H, CH2), 6.83 д (2Hаром, J 8.9 Гц), 7.00 д
(1H, OH, Z), 10.46 уш.с (1Н, OH, E), 10.91 д (1Н,
(2Hаром, J 8.9 Гц), 7.15 д (1Н, =CHN, J 13.7 Гц), 7.18
NH, Z, J 13.5 Гц). Спектр ЯМР 13C (ДМСО-d6), δ,
д (1Наром, J 8.9 Гц), 7.24-7.28 м (1Наром), 7.41-7.45
м.д. (смесь E- и Z-изомеров): 21.6 (CH2, E), 25.4
м (1Наром), 7.70 д (1Наром, J 8.9 Гц), 7.77 д (1Наром,
(CH2, Z), 115.3, 115.9, 117.0 (CH), 118.1 (CH),
J 8.9 Гц), 7.93 д (1Наром, J 8.5 Гц), 9.91 с (1Н,
118.6 (CH), 122.1, 123.1 (CH), 123.5 (CH), 124.0
ОН), 10.99 д (1Н, NH, J 13.7 Гц). Спектр ЯМР 1H
(CH), 124.3 (CH), 125.3 (CH), 126.8 (CH), 127.1
(ДМСО-d6), δ, м.д. (E-изомер): 3.71 c (3H, CH3O),
(CH), 127.8, 128.7, 128.87 (CH), 128.90 (CH), 129.0,
4.35 c (2H, CH2), 6.94 д (2Hаром, J 8.9 Гц), 7.16 д
129.2 (CH), 130.2 (CH), 130.3 (CH), 133.7, 134.0,
(1Наром, J 8.9 Гц), 7.23-7.26 м (3Наром), 7.39-7.43 м
139.7 (CH), 139.9 (CH), 140.3, 140.7, 152.7, 153.8.
(1Наром), 7.66 д (1Наром, J 8.7 Гц), 7.74 д (1Наром, J
Найдено, %: C 71.29; H 5.01; N 8.67. C19H16N2O3.
8.0 Гц), 8.12 д (1Наром, J 8.5 Гц), 8.63 д (1Н, =CHN,
Вычислено, %: C 71.24; H 5.03; N 8.74.
J 14.0 Гц), 9.73 уш.д (1Н, NH, J 14.0 Гц), 10.47
уш.с (1Н, OH). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.
1-{3-[(4-Бромфенил)амино]-2-нитроаллил}-
(смесь E- и Z-изомеров): 21.5 (CH2, E), 25.4 (CH2,
нафталин-2-ол (4b). Выход 287 мг (72%), ярко-
Z), 55.9 (CH3O), 115.36 (CH), 115.44, 115.5 (CH),
желтые кристаллы, т.пл.
199-201°C (ДМФА-
116.1, 118.1 (CH), 118.6 (CH), 119.8 (CH), 121.2,
EtOH, 1:3). ИК спектр, ν, см-1: 3263, 3059, 1639,
123.1 (CH), 123.5 (CH), 124.1 (CH), 126.7 (CH),
1583, 1517, 1489, 1429, 1340, 1232, 1161, 1138,
127.0 (CH), 128.7, 128.81 (CH), 128.85 (CH), 128.90
1070, 979, 954, 854, 808, 736, 709, 613. Спектр ЯМР
(CH), 129.03, 129.1 (CH), 133.5, 133.7, 134.0, 140.7
1H (ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров,
(CH), 140.8 (CH), 152.3 (C-O), 153.8 (C-O), 156.6
Z/E = 1:1.15): 4.17 c (2Н, CH2, Z), 4.35 c (2Н,
(C-O), 157.3 (C-O). Найдено, %: C 68.47; H 5.15; N
CH2, E), 7.06 д (2Наром, J 8.9 Гц), 7.14 д (1Наром, J
7.92. C20H18N2O4. Вычислено, %: C 68.56; H 5.18;
8.7 Гц), 7.17 д (1Наром, J 8.9 Гц), 7.23-7.31 м (5Наром,
N 8.00.
=CHN, Z), 7.40-7.47 м (4Наром), 7.52 д (2Наром, J
8.9 Гц), 7.65 д (1Наром, J 8.9 Гц), 7.70 д (1Наром,
1-{2-Нитро-3-[(4-феноксифенил)амино]ал-
J 8.7 Гц), 7.73-7.78 м (2Наром), 7.97 д (1Hаром, J
лил}нафталин-2-ол (4d). Выход 350 мг (85%),
8.5 Гц), 8.12 д (1Наром, J 8.5 Гц), 8.65 д (1Н, =СHN,
ярко-желтые кристаллы, т.пл. 173-175°C (ДМФА-
E, J 12.8 Гц), 9.80 уш.д (1Н, NH, E, J 12.8 Гц), 9.91
EtOH, 1:3). ИК спектр, ν, см-1: 3500-3100, 1645,
c (1H, OH, Z), 10.36 уш.с (1Н, OH, E), 10.89 д (1Н,
1587, 1506, 1489, 1466, 1437, 1429, 1389, 1375,
NH, Z, J 13.5 Гц). Спектр ЯМР 13C (ДМСО-d6), δ,
1337, 1315, 1308, 1244, 1233, 1202, 1192, 1161,
м.д. (смесь E- и Z-изомеров): 21.7 (CH2, E), 25.6
1111, 1072, 1061, 947, 854, 833, 808, 741, 719, 710,
(CH2, Z), 115.3, 115.7, 117.1, 118.1 (CH), 118.6 (CH),
687. Спектр ЯМР 1H (ДМСО-d6), δ, м.д. (смесь E-
119.1 (CH), 120.2 (CH), 122.7, 123.0 (CH), 123.6
и Z-изомеров, Z/E = 1.1:1): 4.17 c (2Н, CH2, Z), 4.36
(CH), 124.0 (CH), 126.7 (CH), 127.0 (CH), 128.5,
c (2Н, CH2, E), 6.91-7.45 м (11Наром для E-изомера
128.7, 128.80 (CH), 128.85 (CH), 128.88 (CH),
и 10Hаром, =CHN для Z-изомера), 7.66 д (1Наром, J
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
394
ОСИПОВ и др.
8.9 Гц), 7.69 д (1Наром, J 8.9 Гц), 7.73-7.78 м
1165, 1144, 1113, 1063, 1034, 984, 968, 880, 824,
(2Наром), 7.95 д (1Наром, Z, J 8.7 Гц), 8.12 д (1Наром,
808, 787, 762, 700. Спектр ЯМР 1H (ДМСО-d6),
E, J 8.5 Гц), 8.66 д (1Н, =СHN, E, J 13.8 Гц),
δ, м.д. (смесь E- и Z-изомеров, Z/E = 1.3:1): 1.71 c
9.80 уш.д (1Н, NH, E, J 13.8 Гц), 9.92 c (1H, OH,
(6H, CH2Ad, E и 6H, CH2Ad, Z), 1.89 c (6H, CH2Ad,
Z), 10.42 уш.с (1Н, OH, E), 10.91 д (1Н, NH, Z, J
E и 6H, CH2Ad, Z), 2.03 c (3H, CHAd, E и 3H, CH,
13.7 Гц). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.
Z), 3.65 c (3H, CH3O, Z), 3.71 c (3H, CH3O, E), 4.15
(смесь E- и Z-изомеров): 21.6 (CH2, E), 25.4 (CH2,
c (2H, CH2, Z), 4.34 c (2H, CH2, E), 6.82 д (2Наром,
Z), 115.4, 115.9, 118.1 (CH), 118.6 (CH), 118.77
Z, J 8.9 Гц), 6.93 (2Наром, E, J 8.9 Гц), 6.99 (2Наром,
(CH), 118.84 (CH), 120.0 (CH), 120.5 (CH), 120.9
Z, J 8.9 Гц), 7.11-7.15 м (1Наром, Z и 1Наром, Е),
(CH), 121.8, 123.1 (CH), 123.5 (CH), 123.8 (CH),
7.16 д (1Н, =CHN, Z, J 14.0 Гц), 7.23 д (2Hаром, E,
123.9 (CH), 124.0 (CH), 126.7 (CH), 127.0 (CH),
J 8.9 Гц), 7.49-7.63 м (3Наром, Е и 2Наром, Z), 7.66
127.5, 128.7, 128.80 (CH), 128.85 (CH),
128.90
д (1Наром, Z, J 8.9 Гц), 7.86 д (1Наром, Z, J 8.9 Гц),
(CH), 129.0, 129.1 (CH), 130.6 (CH), 133.7, 134.0,
8.04 (1Наром, E, J 8.9 Гц), 8.62 д (1H, =CHN, E, J
136.1, 136.7, 140.1 (CH), 140.3 (CH), 152.7, 153.1,
13.5 Гц), 9.69 уш.д (1Н, NH, E, J 14.6 Гц), 9.76 c (1H,
153.8, 154.1, 157.3, 157.7. Найдено, %: C 72.86; H
OH, Z), 10.38 уш.с (1Н, OH, E), 10.99 д (1Н, NH,
4.84; N 6.70. C25H20N2O4. Вычислено, %: C 72.80;
Z, J 14.0 Гц). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.
H 4.89; N 6.79.
(смесь E- и Z-изомеров): 21.5 (CH2, E), 25.4 (CH2,
Z), 28.9 (3СHAd, Z и 3СНAd, E), 36.0 (СAd, Z и CAd,
1-[3-(Нафталин-2-иламино)-2-нитроаллил]-
E), 36.8 (3СH2Ad, Z и 3СН2Ad, E), 43.1 (3СH2Ad, Z и
нафталин-2-ол (4e). Выход 319 мг (86%), ярко-
3СН2Ad, E), 55.9 (CH3O, Z и СH3O, E), 115.2, 115.3
желтые кристаллы, т.пл.
218-220°C (ДМФА-
(2CH, Z), 115.5 (2CH, E), 115.7, 117.8 (CH), 118.4
EtOH, 1:3). ИК спектр, ν, см-1: 3302, 3037, 1649,
(CH), 118.6 (2CH, E), 119.8 (2CH, Z), 121.3, 123.3
1598, 1581, 1521, 1469, 1446, 1421, 1338, 1313,
(CH), 123.6 (CH), 123.7 (CH), 123.9 (CH), 124.9
1251, 1236, 1211, 1174, 1089, 1053, 981, 966, 954,
887, 854, 802, 746. Спектр ЯМР 1H (ДМСО-d6), δ,
(CH), 125.1 (CH), 126.9, 128.7, 128.9 (CH), 129.1,
129.2 (CH), 131.9, 132.2, 133.6, 134.0, 140.6 (CH),
м.д. (смесь E- и Z-изомеров, Z/E = 1:1.2): 4.23 c (2Н,
140.8 (CH), 145.4, 145.5, 151.9, 153.2, 156.6, 157.3.
CH2, Z), 4.42 c (2Н, CH2, E), 7.17-7.94 м (13Наром
Найдено, %: C 74.44; H 6.65; N 5.67. C30H32N2O4.
для E-изомера и 12Hаром, =CHN для Z-изомера),
8.02 д (1Наром, Z, J 8.7 Гц), 8.15 д (1Наром, E, J
Вычислено, %: C 74.36; H 6.66; N 5.78.
8.7 Гц), 8.86 д (1Н, =CHN, E, J 11.5 Гц), 9.97 уш.c
6-(трет-Бутил)-1-{3-[(4-метоксифенил)ами-
(2Н, NH, E, OH, Z), 10.50 уш.с (1Н, OH, E), 11.07 д
но]-2-нитроаллил}нафталин-2-ол
(4g). Выход
(1Н, NH, Z, J 13.5 Гц). Спектр ЯМР 13C (ДМСО-d6),
285 мг (70%), оранжевые кристаллы, т.пл. 189-
δ, м.д. (смесь E- и Z-изомеров): 21.7 (CH2, E), 25.6
191°C (с разл.) (ДМФА-EtOH, 1:3). ИК спектр,
(CH2, Z), 112.2 (CH), 114.2 (CH), 115.4, 115.9, 118.2
ν, см-1: 3300-2800, 1643, 1612, 1514, 1439, 1385,
(CH), 118.3 (CH), 118.62 (CH), 118.65 (CH), 122.5,
1346, 1298, 1260, 1244, 1204, 1171, 1157, 1146,
123.1 (CH), 123.7 (CH), 124.0 (CH), 125.3 (CH),
1057, 1034, 984, 966, 926, 887, 876, 820, 806, 789,
125.9 (CH), 126.8 (CH), 127.0 (CH), 127.5 (CH),
760. Спектр ЯМР 1H (ДМСО-d6), δ, м.д. (смесь E-
127.61 (CH), 127.67 (CH), 128.2 (CH), 128.3, 128.7,
и Z-изомеров, Z/E = 1.3:1): 3.66 c (3H, CH3O, Z),
128.87 (CH), 128.90 (CH), 129.0, 129.1 (CH), 130.1
3.71 c (3H, CH3O, E), 4.15 c (2H, CH2, Z), 4.34 c (2H,
(CH), 130.2 (CH), 130.5, 130.9, 133.77, 133.83, 134.0,
CH2, E), 6.83 д (2Наром, Z, J 8.9 Гц), 6.93 д (2Наром,
134.3, 138.1, 139.7 (CH), 140.0 (CH), 152.8, 153.9.
E, J 8.9 Гц), 7.00 д (2Наром, Z, J 8.9 Гц), 7.11-7.15
Найдено, %: C 74.57; H 4.85; N 7.47. C23H18N2O3.
м (1Наром, Z и 1Наром, Е), 7.17 д (1Н, =CHN, Z, J
Вычислено, %: C 74.58; H 4.90; N 7.56.
13.7 Гц), 7.23 д (2Наром, E, J 8.9 Гц), 7.51-7.67 м
6-(Адамантан-1-ил)-1-{3-[(4-метоксифенил)-
(3Наром, Е и 3Наром, Z), 7.87 д (1Наром, Z, J 8.9 Гц),
амино]-2-нитроаллил}нафталин-2-ол (4f). Вы-
8.04 (1Наром, E, J 8.9 Гц), 8.62 д (1H, =CHN, E, J
ход 450 мг (93%), желтые кристаллы, т.пл. 212-
14.0 Гц), 9.69 уш.д (1Н, NH, E, J 14.2 Гц), 9.77 c
214°C (с разл.) (ДМФА-EtOH, 1:3). ИК спектр,
(1H, OH, Z), 10.40 уш.с (1Н, OH, E), 10.99 д (1Н,
ν, см-1: 3300-3000, 2897, 2843, 1641, 1609, 1512,
NH, Z, J 13.7 Гц). Спектр ЯМР 13C (ДМСО-d6), δ,
1466, 1389, 1341, 1310, 1296, 1250, 1240, 1219,
м.д. (смесь E- и Z-изомеров): 21.5 (CH2, E), 25.4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
395
(CH2, Z), 31.6 (CH3), 34.7 (CMe3), 55.9 (CH3O),
лы, т.пл. 131-132°C (MeOH). ИК спектр, ν, см-1:
115.25, 115.32 (CH), 115.5 (CH), 115.7, 117.9 (CH),
3500-3000, 1639, 1609, 1585, 1489, 1450, 1418,
118.46 (CH), 118.55 (CH), 119.8 (CH), 121.3, 123.4
1362, 1325, 1217, 1134, 1096, 1074, 1024, 1007, 988,
(CH), 123.66 (CH), 123.71 (CH), 123.9 (CH), 125.6
955, 837, 814, 752. Спектр ЯМР 1H (ДМСО-d6),
(CH), 125.8 (CH), 126.8, 128.6, 128.8 (CH), 128.9,
δ, м.д. (смесь E- и Z-изомеров, Z/E = 1:2.5): 6.77-
129.1 (CH), 131.8, 132.1, 133.6, 134.0, 140.6 (CH),
6.90 м (2Наром, Z и 2Наром, E), 7.09-7.25 м (2Наром,
140.9 (CH), 145.1, 145.2, 151.9, 153.2, 156.6, 157.3.
Z и 2Наром, E), 7.27 д (2Наром, E, J 8.9 Гц), 7.45
Найдено, %: C 70.85; H 6.44; N 6.80. C24H26N2O4.
д (2Наром, E, J 8.9 Гц), 7.49 c (4Hаром, Z), 7.83 д
Вычислено, %: C 70.92; H 6.45; N 6.89.
(1H, =CHN, Z, J 13.5 Гц), 8.70 д (1Н, =CHN, E, J
13.7 Гц), 9.26 д (1Н, NH, E, J 13.7 Гц), 9.55 c (1H,
2-{3-[(4-Метоксифенил)амино]-2-нитроал-
OH, E), 9.56 c (1H, OH, Z), 10.94 д (1H, NH, Z, J
лил}фенол (4h). Выход 243 мг (81%), оранжевые
13.5 Гц). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.
кристаллы, т.пл. 163-165°C (MeOH). ИК спектр,
(смесь E- и Z-изомеров): 115.7, 115.9 (CH), 116.5
ν, см-1: 3400-2800, 1639, 1607, 1593, 1512, 1456,
(CH), 116.8, 116.9, 119.2 (CH), 119.7 (CH), 120.6
1421, 1389, 1331, 1296, 1229, 1153, 1111, 1092,
(CH), 122.6, 127.1, 130.4 (CH), 131.1 (CH), 132.6
1032, 970, 908, 874, 862, 825, 750. Спектр ЯМР 1H
(CH), 132.9 (CH), 133.1 (CH), 139.7, 139.9 (CH),
(ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров, Z/E =
140.1 (CH), 140.7, 156.7, 156.8. Найдено, %: C
1:2): 3.68 с (1H, CH2, Z и 1Н, СН2, E), 3.71 c (3H,
50.21; H 3.27; N 8.28. C14H11BrN2O3. Вычислено,
CH3O, E), 3.72 c (3H, CH3O, Z), 3.89 c (1H, CH2, Z и
%: C 50.17; H 3.31; N 8.36.
1Н, СН2, E), 6.65-7.03 м (6Наром, Z и 6Наром, E), 7.25
д (2Наром, Е, J 8.9 Гц), 7.36 д (2Наром, Z, J 8.9 Гц),
2-{2-[(4-Метоксифенил)амино]-1-нитрови-
7.91 д (1H, =CHN, Z, J 13.8 Гц), 8.73 д (1H, =CHN,
нил}фенол (8b). Выход 220 мг (77%), оранжевые
E, J 13.5 Гц), 9.44 c (1H, OH, Z), 9.61 с (1Н, OH, E),
кристаллы, т.пл. 138-139°C (MeOH). ИК спектр, ν,
9.72 уш.д (1Н, NH, E, J 13.5 Гц), 11.04 д (1Н, NH,
см-1: 3400-2800, 1638, 1607, 1591, 1516, 1450, 1360,
Z, J 13.8 Гц). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.
1317, 1300, 1256, 1219, 1177, 1124, 1103, 1028, 959,
(смесь E- и Z-изомеров): 25.7 (CH2, E), 30.7 (CH2,
876, 822, 810, 750. Спектр ЯМР 1H (ДМСО-d6),
Z), 55.9 (CH3O), 115.2 (CH), 115.3 (CH), 115.4 (CH),
δ, м.д. (смесь E- и Z-изомеров, Z/E = 1:1.7): 3.69
118.9 (CH), 119.2 (CH), 119.4 (CH), 120.0 (CH),
c (3H, CH3O, E), 3.71 c (3H, CH3O, Z), 6.77-7.26
120.8, 124.5, 125.3, 125.4, 127.6 (CH), 127.8 (CH),
м (6Hаром, Z и 8Наром, E), 7.44 д (2Наром, Z, J
128.5 (CH), 130.0 (CH), 133.5, 134.3, 141.2 (CH),
8.9 Гц), 7.78 д (1H, =CHN, Z, J 13.7 Гц), 8.68 д (1Н,
141.9 (CH), 155.5, 155.7, 156.5, 157.3. Найдено, %:
=СHN, E, J 14.2 Гц), 9.20 д (1Н, NH, E, J 14.2 Гц),
C 64.07; H 5.31; N 9.25. C16H16N2O4. Вычислено,
9.49 c (1H, OH, E), 9.53 c (1H, OH, Z), 11.11 д (1H,
%: C 63.99; H 5.37; N 9.33.
NH, Z, J 13.7 Гц). Спектр ЯМР 13C (ДМСО-d6),
2-(2-Ариламино-1-нитровинил)фенолы 8а-g
δ, м.д. (смесь E- и Z-изомеров): 55.83 (CH3O, E),
(общая методика). К раствору 1 ммоль 3-нитро-
55.90 (CH3O, Z), 115.2 (CH), 115.9 (CH), 116.5
бензофурана 7а-с (163 мг 7а, 221 мг 7b, 332 мг 7с)
(CH), 117.2, 119.2 (CH), 119.4 (CH), 119.7 (CH),
в 5 мл дихлорэтана прибавляли при перемешива-
120.1 (CH), 120.9, 121.1, 125.3, 130.2 (CH), 130.9
нии 1 ммоль первичного ароматического амина
(CH), 132.9 (CH), 133.2 (CH), 133.3, 134.6, 141.5
(93 мг анилина, 172 мг 4-броманилина, 123 мг
(CH), 141.6 (CH), 156.5, 156.6, 157.2. Найдено, %:
4-метоксианилина). Смесь выдерживали при ком-
C 62.88; H 4.87; N 9.70. C15H14N2O4. Вычислено,
натной температуре в течение 1.5 ч, выпавший
%: C 62.93; H 4.93; N 9.79.
осадок отфильтровывали и перекристаллизовыва-
(3-{2-[(4-Бромфенил)амино]-1-нитровинил}-
ли из MeOH. В случае ацетоксипроизводных 8с,
4-гидроксифенил)ацетат
(8c). Выход
240 мг
d растворитель отгоняли при пониженном давле-
(61%), желтые кристаллы, т.пл.
155-157°C
нии и остаток очищали перекристаллизацией из
(MeOH). ИК спектр, ν, см-1: 3500-3100, 1746,
MeOH.
1721, 1649, 1618, 1591, 1508, 1493, 1429, 1373,
2-{2-[(4-Бромфенил)амино]-1-нитровинил}-
1350, 1335, 1223, 1188, 1159, 1072, 922, 831, 816,
фенол (8a). Выход 225 мг (67%), желтые кристал-
787, 766, 754. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
396
ОСИПОВ и др.
(смесь E- и Z-изомеров, Z/E = 1:2.15): 2.187 c (3H,
187-188°C (MeOH). ИК спектр, ν, см-1: 3418, 3294,
CH3, E), 2.191 с (3Н, СН3, Z), 6.82 д (1Hаром, Z, J
1643, 1593, 1497, 1369, 1296, 1269, 1234, 1146,
8.7 Гц), 6.89 д (1Hаром, E, J 8.7 Гц), 6.89 д (1Наром,
1018, 961, 910, 868, 818, 748, 675, 660, 629. Спектр
E, J 3.0 Гц), 6.95 д.д (1Наром, Z, J 8.7, 3.0 Гц), 7.00
ЯМР 1H (ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров,
д (1Наром, Z, J 3.0 Гц), 7.02 д.д (1Наром, E, J 8.7,
Z/E = 1:2.4): 2.21 c (3H, CH3, E), 2.26 c (3H, CH3,
3.0 Гц), 7.28 д (2Наром, E, J 8.9 Гц), 7.46 д (2Наром,
Z), 6.69-7.56 м (12Наром, Z, 12Hаром, E), 7.69 д
E, J 8.9 Гц), 7.50 с (4Наром, Z), 7.84 д (1H, =CHN, Z,
(1H, =CHN, Z, J 13.7 Гц), 8.67 д (1H, =CHN, E, J
J 13.7 Гц), 8.70 д (1Н, =СHN, E, J 13.7 Гц), 9.39 д
13.7 Гц), 9.20 д (1Н, NH, E, J 13.7 Гц), 9.50 с (1Н,
(1Н, NH, E, J 13.7 Гц), 9.66 c (1H, OH, E), 9.67 c (1H,
ОН, E), 9.54 c (1H, OH, Z), 9.69 c (1H, NHTs, E, 1H
OH, Z), 10.97 д (1H, NH, Z, J 13.7 Гц). Спектр ЯМР
NHTs, Z), 10.98 д (1Н, NH, Z, J 13.7 Гц). Спектр ЯМР
13C (ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров):
13C (ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров):
21.31 (CH3, Z), 21.36 (CH3, E), 115.9, 116.1 (CH),
21.40 (CH3, E), 21.45 (CH3, Z), 116.3 (CH), 117.0
116.8 (CH), 117.1, 118.6, 119.8 (CH), 120.8 (CH),
(CH), 117.2, 117.8 (CH), 118.6 (CH), 120.8, 121.2,
121.0, 121.7, 123.5 (CH), 124.3 (CH), 125.5 (CH),
124.2 (CH), 124.8 (CH), 125.3 (CH), 125.4 (CH),
125.7 (CH), 126.1, 132.62 (CH), 132.66 (CH), 139.6,
125.7, 126.9 (CH), 127.1 (CH), 127.4 (CH), 129.0,
140.3 (CH), 140.56 (CH), 140.62, 142.7, 143.1, 154.3
129.4, 129.96 (CH), 130.01 (CH), 137.3, 137.4, 140.0,
(C-OH), 169.90 (C=O), 169.98 (C=O). Найдено, %:
140.7 (CH), 140.9 (CH), 141.1, 143.3, 143.4, 154.1,
C 48.94; H 3.28; N 7.06. C16H13BrN2O5. Вычислено,
154.2. Найдено, %: C 59.29; H 4.45; N 9.80; S 7.43.
%: C 48.88; H 3.33; N 7.12.
C21H19N3O5S. Вычислено, %: C 59.28; H 4.50; N
9.88; S 7.54.
(4-Гидрокси-3-{2-[(4-метоксифенил)ами-
но]-1-нитровинил}фенил)ацетат
(8d). Выход
N-(3-{2-[(4-Бромфенил)aмино]-1-нитрови-
275 мг (80%), ярко-желтые кристаллы, т.пл. 144-
нил}-4-гидроксифенил)-4-метилбензолсуль-
146°C (MeOH). ИК спектр, ν, см-1: 3500-3200,
фонамид (8f). Выход 450 мг (89%), ярко-желтые
1748, 1639, 1595, 1516, 1466, 1425, 1383, 1346,
кристаллы, т.пл. 181-183°C (MeOH). ИК спектр,
1315, 1254, 1231, 1211, 1163, 1128, 1101, 1020,
ν, см-1: 3296, 1643, 1593, 1498, 1431, 1369, 1296,
984, 928, 922, 897, 874, 864, 827, 810, 789, 766.
1269, 1232, 1145, 1105, 1089, 962, 912, 866, 852,
Спектр ЯМР 1H (ДМСО-d6), δ, м.д. (смесь E- и
831, 819, 800, 771, 756, 746, 707, 677. Спектр ЯМР
Z-изомеров, Z/E = 1:1.4): 2.19 c (3H, CH3, E и 3H,
1H (ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров, Z/E
CH3, Z), 3.70 c (3H, CH3O, E), 3.71 c (3H, CH3O, Z),
= 1:2.7): 2.23 c (3H, CH3, E), 2.26 c (3H, CH3, Z),
6.81-7.02 м (5Hаром, Z и 5Наром, E), 7.24 д (2Наром,
6.67-6.70 м (1Hаром, Z, 1Hаром, E), 6.76 д (1Hаром,
Е, J 8.9 Гц), 7.45 д (2Наром, Z, J 8.9 Гц), 7.82 д
E, J 8.9 Гц), 6.81 д (1Наром, Z, J 2.3 Гц), 6.86 д.д
(1H, =CHN, Z, J 14.0 Гц), 8.67 д (1Н, =СHN, E, J
(1Наром, Z, J 8.9, 2.3 Гц), 6.97 д.д (1Наром, E, J 8.9,
14.2 Гц), 9.33 д (1Н, NH, E, J 14.2 Гц), 9.59 c (1H,
2.3 Гц), 7.21-7.30 (4Hаром, Z, 4Hаром, E), 7.43-7.56
OH, E), 9.62 c (1H, OH, Z), 11.12 д (1H, NH, Z, J
м (4Hаром, Z, 4Hаром, E), 7.67 д (1Н, =CHN, Z, J
14.0 Гц). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.
13.5 Гц), 8.63 д (1Н, =CHN, E, J 13.7 Гц), 9.23 д
(смесь E- и Z-изомеров): 21.31 (CH3, Z), 21.36
(1Н, NH, E, J 13.7 Гц), 9.53 с (1Н, OH, E), 9.55
(CH3, E), 55.84 (CH3O, E), 55.89 (CH3O, Z), 116.2
c (1H, OH, Z), 9.70 c (1H NHTs, E, 1H NHTs, Z),
(CH), 116.8 (CH), 117.5, 119.6 (CH), 120.2, 120.3
10.94 д (1Н, NH, Z, J 13.5 Гц). Спектр ЯМР 13C
(CH), 121.2, 123.3, 124.0 (CH), 124.3, 125.5 (CH),
(ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров): 21.4
125.7 (CH), 133.3, 134.5, 141.7 (CH), 142.0 (CH),
(CH3), 115.9, 116.3 (CH), 117.0 (CH), 117.1, 119.8
142.7, 143.1, 154.24, 154.26, 156.6, 157.3,
169.9
(CH), 120.7 (CH), 121.7, 124.7 (CH), 125.5 (CH),
(C=O, E), 170.0 (C=O, Z). Найдено, %: C 59.36; H
126.4, 126.8 (CH), 127.1 (CH), 127.3 (CH), 129.0,
4.64; N 8.05. C17H16N2O6. Вычислено, %: C 59.30;
129.4, 129.96 (CH), 130.03 (CH), 132.7 (CH), 137.4,
H 4.68; N 8.14.
139.6, 140.2 (CH), 140.4 (CH), 140.6, 143.3, 143.4,
N-{4-Гидрокси-3-[1-нитро-2-(фениламинo)-
154.2. Найдено, %: C 49.95; H 3.57; N 8.41; S 6.27.
винил]фенил}-4-метилбензолсульфонамид (8e).
C21H18BrN3O5S. Вычислено, %: C 50.01; H 3.60; N
Выход 294 мг (69%), желтые кристаллы, т.пл.
8.33; S 6.36.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
397
N-(4-Гидрокси-3-{2-[(4-метоксифенил)ами-
кания реакции, отсутствием катализатора, просто-
но]-1-нитровинил]фенил)-4-метилбензолсуль-
той обработки без использования колоночной хро-
фонамид (8g). Выход 300 мг (66%), ярко-желтые
матографии, 100% атомной экономией, поскольку
кристаллы, т.пл. 179-180°C (MeOH). ИК спектр,
все атомы реагирующих веществ входят в состав
ν, см-1: 3431, 3327, 1643, 1516, 1497, 1477, 1429,
продукта.
1368, 1315, 1296, 1256, 1236, 1144, 1115, 1090, 1032,
БЛАГОДАРНОСТИ
1020, 972, 829, 816, 802, 772, 750. Спектр ЯМР 1H
(ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров, Z/E =
Исследование выполнено с использованием на-
учного оборудования центра коллективного поль-
1:1.7): 2.23 c (3H, CH3, E), 2.26 c (3H, CH3, Z), 3.70
c (3H, CH3O, E), 3.72 c (3H, CH3O, Z), 6.68-6.70 м
зования СамГТУ «Исследование физико-химиче-
(1Наром, Z, 1Hаром, E), 6.76 д (1Наром, E, J 8.7 Гц),
ских свойств веществ и материалов».
6.79 д (1Наром, Z, J 2.8 Гц), 6.84-6.98 м (3Наром,
ФОНДОВАЯ ПОДДЕРЖКА
E, 4Hаром, Z), 7.21-7.24 м (3Hаром, E, 1Hаром, Z),
Работа выполнена при финансовой поддерж-
7.28 д (2Наром, Z, J 8.0 Гц), 7.40 д (1Наром, E, J
ке Российского научного фонда (грант № 19-73-
8.9 Гц), 7.53-7.58 м (2Наром, Z, 2Hаром E), 7.60 д
10109).
(1H, =CHN, Z, J 14.0 Гц), 8.60 д (1H, =CHN, E, J
14.0 Гц), 9.15 д (1Н, NH, E, J 14.0 Гц), 9.45 с (1Н,
ИНФОРМАЦИЯ ОБ АВТОРАХ
ОН, E), 9.50 c (1H, OH, Z), 9.68 c (1H NHTs, E, 1H,
Осипов Дмитрий Владимирович, ORCID:
NHTs, Z), 11.07 д (1Н, NH, Z, J 14.0 Гц). Спектр ЯМР
13C (ДМСО-d6), δ, м.д. (смесь E- и Z-изомеров):
21.4 (CH3), 55.86 (CH3O, E), 55.91 (CH3O, Z), 115.2
Артеменко Алина Александровна, ORCID:
(CH), 116.3 (CH), 116.9 (CH), 117.3, 119.5 (CH),
120.2 (CH), 121.0, 124.6 (CH), 125.2 (CH), 126.9
Корженко Кирилл Сергеевич, ORCID: https://
(CH), 127.1 (CH), 127.3 (CH), 128.9, 129.4, 129.96
orcid.org/0000-0002-2482-0674
(CH), 130.02 (CH), 133.3, 134.5, 137.3, 137.4, 141.67
Ращепкина Дарья Андреевна, ORCID: https://
(CH), 141.75 (CH), 143.3, 143.4, 154.0, 154.1, 156.6,
orcid.org/0000-0001-6150-4745
157.3. Найдено, %: C 57.96; H 4.69; N 9.17; S 6.92.
C22H21N3O6S. Вычислено, %: C 58.01; H 4.65; N
9.23; S 7.04.
orcid.org/0000-0002-3586-0487
ЗАКЛЮЧЕНИЕ
Осянин Виталий Александрович, ORCID:
Сопряженное присоединение вторичных али-
фатических аминов и спиртов к β-нитрозамещен-
КОНФЛИКТ ИНТЕРЕСОВ
ным 1Н-бензо[f]хроменам протекает с сохранени-
Авторы заявляют об отсутствии конфликта ин-
ем дигидропиранового цикла, тогда как реакция
тересов.
с анилинами сопровождается его раскрытием.
Взаимодействие 3-нитробензофуранов с первич-
СПИСОК ЛИТЕРАТУРЫ
ными ароматическими аминами приводит к де-
1. Halimehjani A.Z., Namboothiri I.N.N., Hoosh-
ароматизации фуранового цикла и образованию
mand S.E. RSC Adv. 2014, 4, 48022-48084. doi
2-(2-ариламино-1-нитровинил)фенолов. На осно-
10.1039/c4ra08828j
вании спектров ЯМР 1Н предложены надежные
2. Halimehjani A.Z., Namboothiri I.N.N., Hoosh-
критерии для идентификации Е- и Z-форм полу-
mand S.E. RSC Adv. 2014, 4, 51794-51829. doi
ченных β-нитроенаминов, а также цис- и транс-и-
10.1039/c4ra08830a
зомеров синтезированных 3-алкокси- и 3-амино-
3. Das T., Mohapatra S., Mishra N.P., Nayak S., Raigu-
бензохроманов. Предложенный метод получения
ru B.P. ChemistrySelect. 2021, 6, 3745-3781. doi
2-гидроксифенил- и (2-гидрокси-1-нафтил)метил-
10.1002/slct.202100679
замещенных β-нитроенаминов характеризуется
4. Barrett A.G.M. Chem. Soc. Rev. 1991, 20, 95-127. doi
хорошими выходами, мягкими условиями проте-
10.1039/CS9912000095
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
398
ОСИПОВ и др.
5.
Zhang Q., Sun J., Zhang F., Yu B. Eur. J. Org. Chem.
taev V.Yu., Kutyashev I.B., Barkov A.Yu., Sosnovs-
2010, 3579-3582. doi 10.1002/ejoc.201000397
kikh V.Ya. Russ. Chem. Rev. 2019, 88, 27-58.] doi
6.
Xue W., Sun J., Yu B. J. Org. Chem. 2009, 74, 5079-
10.1070/RCR4840
5082. doi 10.1021/jo900609s
21.
Vroemans R., Dehaen W. Targets Heterocycl. Syst.
7.
Winterfeld G.A., Das J., Schmidt R.R. Eur. J.
2018, 22, 318-355. doi 10.17374/targets.2019.22.318
Org. Chem.
2000,
3047-3050. doi
10.1002/
22.
Gampa M., Padmaja P., Aravind S., Reddy P.N. Chem.
1099-0690(200009)2000:17%3C3047::AID-
Heterocycl. Compd. 2021, 57, 1176-1180. doi 10.1007/
EJOC3047%3E3.0.CO;2-6
s10593-021-03040-z
8.
Tan F., Xiao C., Cheng H.-G., Wu W., Ding K.-R.,
23.
Лукашенко А.В., Осипов Д.В., Осянин В.А., Кли-
Xiao W.-J. Chem. Asian J. 2012, 7, 493-497. doi
мочкин Ю.Н. ХГС. 2020, 56, 521-528. [Lukashen-
10.1002/asia.201100820
ko A.V., Osipov D.V., Osyanin V.А., Klimochkin Yu.N.
9.
Xiang S., Ma J., Gorityala B.K., Liu X.-W.
Chem. Heterocycl. Compd. 2020, 56, 521-528.] doi
Carbohydr. Res. 2011, 346, 2957-2959. doi 10.1016/
10.1007/s10593-020-02694-5
j.carres.2011.01.032
24.
Krishnammagari S.K., Lim K.T., Cho B.G., Jeong Y.T.
10.
Pachamuthu K., Gupta A., Das J., Schmidt R.R.,
Phosphorus, Sulfur, Silicon, Relat. Elem. 2018, 193,
Vankar Y.D. Eur. J. Org. Chem. 2002, 1479-1483. doi
574-581. doi 10.1080/10426507.2018.1469489
10.1002/1099-0690(200205)2002:9%3C1479::AID-
25.
Thirumalai K.J., Paramasivan P. Tetrahedron Lett.
EJOC1479%3E3.0.CO;2-P
2014, 55, 2010-2014. doi 10.1016/j.tetlet.2014.02.019
11.
Menicagli R., Samaritani S. Tetrahedron. 1996, 52,
26.
Осянин В.А., Лукашенко А.В., Осипов Д.В., Кли-
1425-1432. doi 10.1016/0040-4020(95)00968-X
мочкин Ю.Н. ХГС. 2014, 1663-1668. [Osyanin V.A.,
12.
Khodair A.I., Winterfeld G.A., Schmidt R.R. Eur. J. Org.
Lukashenko A.V., Osipov D.V., Klimochkin Yu.N.
Chem. 2003, 1847-1852. doi 10.1002/ejoc.200200712
Chem. Heterocycl. Compd. 2015, 50, 1528-1533.] doi
10.1007/s10593-014-1620-2
13.
Dharuman S., Gupta P., Kancharla P.K., Vankar Y.D.
J. Org. Chem. 2013, 78, 8442-8450. doi 10.1021/
27.
Осянин В.А., Лукашенко А.В., Осипов Д.В. Усп.
jo401165y
хим. 2021, 90, 324-373. [Osyanin V.A., Lukashen-
ko A.V., Osipov D.V. Russ. Chem. Rev. 2021, 90, 324-
14.
Barroca N., Schmidt R.R. Org. Lett. 2004, 6, 1551-
373.] doi 10.1070/RCR4971
1554. doi 10.1021/ol049729t
15.
Nair S.R., Baire B. Asian J. Org. Chem. 2021, 10, 932-
28.
Осипов Д.В., Мельникова И.В., Корженко К.С.,
948. doi 10.1002/ajoc.202100025
Осянин В.А., Климочкин Ю.Н. ХГС. 2020, 56, 990-
996. [Osipov D.V., Melnikova I.V., Korzhenko K.S.,
16.
Alsharif M.A., Khan D., Mukhtar S., Alahmdi M.I.,
Osyanin V.A., Klimochkin Yu.N. Chem. Heterocycl.
Ahmed N. Eur. J. Org. Chem. 2018, 3454-3463. doi
Compd. 2020, 56, 990-996.] doi 10.1007/s10593-020-
10.1002/ejoc.201800431
02765-7
17.
Барков А.Ю., Коротаев В.Ю., Котович И.В., Зим-
29.
Osyanin V.A., Osipov D.V., Melnikova I.V., Korzhen-
ницкий Н.С., Кутяшев И.Б., Сосновских В.Я. ХГС.
ko K.S., Semenova I.A., Klimochkin Yu.N. Synthesis.
2016, 52, 814-822. [Barkov A.Yu., Korotaev V.Yu.,
2020, 52, 3604-3621. doi 10.1055/s-0040-1707209
Kotovich I.V., Zimnitskiy N.S., Kutyashev I.B.,
Sosnovskikh V.Ya. Chem. Heterocycl. Compd. 2016,
30.
Осянин В.А., Корженко К.С., Ращепкина Д.А.,
52, 814-822.] doi 10.1007/s10593-016-1971-y
Осипов Д.В., Климочкин Ю.Н. ЖОрХ. 2021, 57,
949-960. [Osyanin V.A., Korzhenko K.S., Rashchepki-
18.
Коротаев В.Ю., Сосновских В.Я., Кутяшев И.Б.,
na D.A., Osipov D.V., Klimochkin Yu.N. Russ. J.
Кодесс М.И. Изв. Ан. Сер. хим. 2006, 55, 309-321.
Org. Chem. 2021, 57, 1053-1062.] doi 10.1134/
[Korotaev V.Yu., Sosnovskikh V.Ya., Kutyashev I.B.,
S1070428021070046
Kodess M.I. Russ. Chem. Bull., Int. Ed. 2006, 55, 317-
330.] doi 10.1007/s11172-006-0255-6
31.
Rajappa S. Tetrahedron. 1999, 55, 7065-7114. doi
10.1016/S0040-4020(99)00384-1
19.
Коротаев В.Ю., Сосновских В.Я., Барков А.Ю.
Усп. хим. 2013, 82, 1081-1116. [Korotaev V.Yu.,
32.
Rajappa S. Tetrahedron. 1981, 37, 1453-1480. doi
Sosnovskikh V.Ya., Barkov A.Yu. Russ. Chem.
10.1016/S0040-4020(01)92085-X
Rev.
2013,
82,
1081-1116.] doi
10.1070/
33.
Маслова М.М., Марченко Н.Б., Глушков Р.Г. Хим.
RC2013v082n12ABEH004370
фарм. ж. 1993, 27, 41-51. [Maslova M.M., Marchen-
20.
Коротаев В.Ю., Кутяшев И.Б., Барков А.Ю., Со-
ko N.B., Glushkov R.G. Pharm. Chem. J. 1993, 27,
сновских В.Я. Усп. хим. 2019, 88, 27-58. [Koro-
263-276.] doi 10.1007/BF00810978
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023
РЕАКЦИИ β-НИТРОЗАМЕЩЕННЫХ 1Н-БЕНЗО[f]ХРОМЕНОВ
399
34. Morigaki A., Tsukade K., Arimitsu S., Konno T.,
Granik V.G. Pharm. Chem. J. 1991, 25, 260-263.] doi
Kubota T. Tetrahedron. 2013, 69, 1521-1525. doi
10.1007/BF00772110
10.1016/j.tet.2012.12.012
40. Andreini M., Chapellas F., Diab S., Pasturaud K., Piett-
35. Clark-Lewis J.W. Aust. J. Chem. 1968, 21, 2059-2075.
re S.R., Legros J., Chataigner I. Org. Biomol. Chem.
doi 10.1071/CH9682059
2016, 14, 2833-2839. doi 10.1039/C5OB02595H
36. Лукашенко А.В., Осипов Д.В., Осянин В.А., Кли-
41. Осипов Д.В., Ращепкина Д.А., Артеменко А.А.,
мочкин Ю.Н. ХГС. 2020, 56, 529-536. [Lukashen-
Демидов О.П., Осянин В.А. ХГС. 2021, 57, 996-
ko A.V., Osipov D.V., Osyanin V.A., Klimochkin Yu.N.
1001. [Osipov D.V., Rashchepkina D.A., Аrtemen-
ko A.А., Demidov O.P., Osyanin V.A. Chem.
Chem. Heterocycl. Compd. 2020, 56, 529-536.] doi
Heterocycl. Compd. 2021, 57, 996-1001.] doi 10.1007/
10.1007/s10593-020-02695-4
s10593-021-03013-2
37. Chiara J.L., Gómez-Sánchez A., Bellanato J. J. Chem.
42. René L. Synthesis. 1989, 69-70. doi 10.1055/s-1989-
Soc. Perkin Trans. 2. 1992, 787-798. doi 10.1039/
27157
P29920000787
43. CrysAlisPro, version
1.171.38.41; Rigaku Oxford
38. Осянин В.А., Осипов Д.В., Ращепкина Д.А., Кли-
Diffraction. 2015.
мочкин Ю.Н. ХГС. 2021, 57, 615-623 [Osyanin V.A.,
Osipov D.V., Rashchepkina D.A., Klimochkin Yu.N.
44. Sheldrick G.M. Acta Crystallogr., Sect. A. 2015, 71,
Chem. Heterocycl. Compd. 2021, 57, 615-623.] doi
3-8. doi 10.1107/S2053273314026370
10.1007/s10593-021-02957-9
45. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
39. Любчанская В.М., Алексеева Л.М., Николаева И.С.,
3-8. doi 10.1107/S2053229614024218
Ильина М.Г., Фомина А.Н., Граник В.Г. Хим. фарм.
46. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
ж. 1991, 25, 35-37. [Lyubchanskaya V.M., Aleksee-
ward J.A.K., Puschmann H. J. Appl. Crystallogr. 2009,
va L.M., Nikolaeva I.S., Il’ina M.G., Fomina A.N.,
42, 339-341. doi 10.1107/S0021889808042726
Reactions of β-Nitro-substituted 1H-Benzo[f]chromenes
and Benzofurans with Nucleophiles
D. V. Osipova, *, A. A. Artyomenkoa, K. S. Korzhenkoa, D. A. Raschepkinaa,
O. P. Demidovb, and V. A. Osyanina, **
a Samara State Technical University, ul. Molodogvardeyskaya, 244, Samara, 443100 Russia
b North Caucasus Federal University, ul. Pushkina, 1, Stavropol, 355017 Russia
*e-mail: osipovdv25@mail.ru
**e-mail: vosyanin@mail.ru
Received March 31, 2022; revised April 18, 2022; accepted April 20, 2022
A series of 3-alkoxy-2-nitro-2,3-dihydro-1H-benzo[f]chromenes as a mixture of cis- and trans-isomers was
obtained in the reaction of 2-nitro-1H-benzo[f]chromenes with alcohols. The reaction with secondary cyclic
amines and 3-amino-5,5-dimethylcyclohex-2-en-1-one proceeds trans-diastereoselectively to form Michael
adducts of benzochromane structure. Conjugated addition involving anilines leads to (2-hydroxy-1-naphthyl)
methyl-substituted β-nitroenamines. The nucleophilic dearomatization of 3-nitrobenzofurans under the action of
primary aromatic amines was shown to involve sequential aza- and retro-oxa-Michael reactions. This reaction
illustrates the high propensity of 3-nitrobenzofurans to open the furan cycle.
Keywords: 3-nitrobenzofurans, 2-nitro-1H-benzo[f]chromenes, Michael reaction, dearomatization, 3-amino-
and 3-alkoxy-2-nitro-2,3-dihydro-1H-benzo[f]chromenes, nitroenamines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 3 2023