ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 4, с. 507-515
УДК 547.446.1:547.781.1:547.785.5
ГЕТЕРОЦИКЛЫ НА ОСНОВЕ
БИС(ТРИФТОРМЕТИЛ)ИМИДАЗОЛИДИН-2-ОНОВ,
2-АМИНОЭТАНОЛА И 2-АМИНОФЕНОЛА
© 2023 г. Л. В. Салоутинаa, *, М. И. Кодессa, b, И. Н. Ганебныхa, П. А. Слепухинa, b,
В. И. Салоутинa, b, О. Н. Чупахинa, b
a ФГБУН «Институт органического синтеза им. И.Я. Постовского Уральского отделения РАН»,
Россия, 620108 Екатеринбург, ул. С. Ковалевской, 22/20
b ФГАОУ ВО «Уральский федеральный университет им. первого Президента России Б.Н. Ельцина»,
Россия, 620002 Екатеринбург, ул. Мира, 19
*e-mail: saloutinalv@yandex.ru
Поступила в редакцию 02.06.2022 г.
После доработки 16.02.2023 г.
Принята к публикации 18.02.2023 г.
Осуществлен синтез новых трифторметил-содержащих имидазо-1,4-оксазинов реакцией конденсации
4,5-дигидрокси-4,5-бис(трифторметил)имидазолидин-2-она с 2-аминоэтанолом (2-АЭ) и 2-аминофенолом
(2-АФ). Обнаружен необычный маршрут реакции 1-метил(фенил)-4,5-дигидрокси-4,5-бис(трифторметил)-
имидазолидин-2-онов с 2-АЭ, приводящий к гидроксиэтиламино-замещенным N-метил(фенил)гидан-
тоинам. Реакция указанных N-замещенных имидазолидинов с 2-АФ в аналогичных условиях привела к
образованию продуктов перегруппировки, 5,5-бис(трифторметил)гидантоинов. Молекулярная структура
5-[(2-гидроксиэтил)амино]-3-метил-5-(трифторметил)имидазолидин-2,4-диона изучена методом РСА.
Ключевые слова: перфторбиацетил, имидазолидины, аминоспирты, имидазо-1,4-оксазины, гидантоины, РСА
DOI: 10.31857/S0514749223040092, EDN: ASLNQI
ВВЕДЕНИЕ
Ранее нами был разработан способ получения
4,5-дигидрокси-4,5-бис(трифторметил)имидазо-
4,5-Дигидроксиимидазолидин-2-оны являют-
лидин-2-она 2а и его N-замещенных аналогов на
ся удобными синтонами для получения аннели-
основе перфторбиацетила (ПФБА) 1, мочевины,
рованных гетероциклических соединений путем
N,N'-диалкилмочевин
[10] и N-алкил(арил)мо-
реакции конденсации с мочевинами и их аналога-
чевин [11, 12]. Реакцией ПФБА с тиомочевиной
ми [тиомочевиной, сульфамидами, гуанидинами,
(ТМ) был синтезирован тио-аналог соединения 2а,
(тио)семикарбазидами, KSCN] [1]. N-Гетероциклы
4,5-дигидрокси-4,5-бис(трифторметил)имидазо-
на основе имидазолидин-2-онов, такие как гли-
лидин-2-тион [13]. Показано, что реакция ими-
кольурилы, тиогликольурилы и имидазотриазины,
дазолидин-2-она 2а с мочевиной в диметила-
представляют интерес в качестве биологически
цетамиде (ДМА) приводит к бициклическому
активных соединений [1, 2-4], кроме того, они мо-
продукту конденсации, бис(трифторметил)гли-
гут быть использованы в качестве молекулярных
кольурилу
[10]. N-Алкил(арил)-4,5-дигидрокси-
капсул [5], стабилизаторов полимеров [6, 7], жид-
4,5-бис(трифторметил)имидазолидин-2-оны при
ких кристаллов [8] и флуоресцентных веществ [9].
взаимодействии с мочевиной в аналогичных ус-
Фторсодержащие имидазолидин-2-оны яв-
ловиях дают продукты конденсации другого типа,
ляются менее изученными соединениями, и
1-алкил(арил)-бис(трифторметил)имидазооксазо-
данные об их синтезе и свойствах ограничены.
лы, при этом реакция сопровождается образова-
507
508
САЛОУТИНА и др.
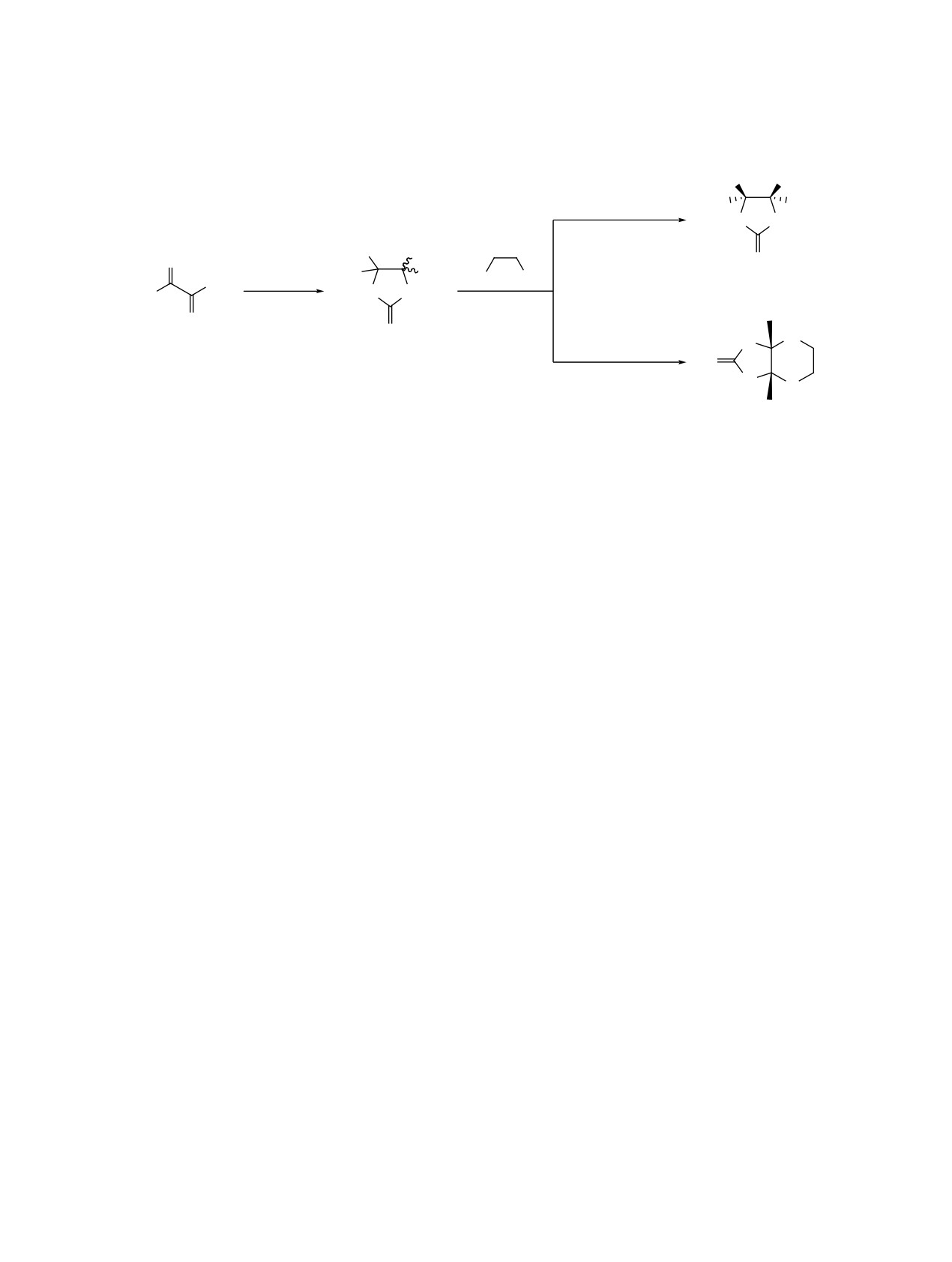
Схема 1
F3C
OH
ɩɭɬɶ ɚ
HO
CF3
HN NH
MeOH, H+
F3C
CF3
ɢɥɢ ɞɢɨɤɫɚɧ
O
O
ɤɢɩɹɱɟɧɢɟ
NH2CONH2
HO
OH
HO
NH2
ɬɪɚɧɫ-2a
CF3
F3C
HN NH
F3C
O
H
O
H
N
ɩɭɬɶ b
N
1
ɰɢɫ,ɬɪɚɧɫ-2a
O
80:20
ȾɆȺ, 150 160°C
N
2H2O
O
H
F3C
3
нием N-алкил(арил)-5,5-бис(трифторметил)гидан-
конденсации при действии динуклеофилов в кис-
тоинов [11]. Аналогичная реакция симметричных
лой спиртовой среде [1], фторсодержащие имида-
N,N'-диалкилимидазолидин-2-онов с мочевиной
золидины 2a-c (в виде цис-, транс-изомеров) не
приводит к образованию 5-гидрокси-5-трифтор-
дают продуктов конденсации с 2-АЭ и 2-АФ в ана-
метилгидантоинов [10]. Взаимодействие 4,5-ди-
логичных условиях: транс-изомеры 2a-c остаются
гидрокси-4,5-бис(трифторметил)имидазолидин-
неизменными, а цис-изомеры 2a-c изомеризуются
2-тиона с мочевиной в ДМА при повышенной тем-
в соответствующие транс-изомеры. Кипячение
пературе дает, в основном, тиогликольурил, а его
смесей цис-, транс-изомеров имидазолидинов 2a-
реакция с ТМ или NH4SCN приводит к тиоксоими-
c с 2-АЭ и 2-АФ в диоксане также приводит к изо-
дазотиазолону [13]. Наряду с перечисленными ре-
меризации цис-изомеров в транс-изомеры указан-
акциями, 4,5-дигидрокси-4,5-бис(трифторметил)-
ных соединений (схемы 1-4, путь а).
имидазолидин-2-тион участвует и во взаимодей-
Взаимодействие имидазолидина
2a с
2-АЭ
ствиях другого типа. Так, в работе [14] показано,
удалось осуществить лишь в среде биполярно-
что при действии бикарбоната аминогуанидина
го апротонного растворителя, диметилацета-
на данный имидазолидин-2-тион в среде ДМА об-
мида (ДМА) при 150-160°C, при этом был пол-
разуется
5,6-бис(трифторметил)-1,2,4-триазино-
учен 3a,7a-бис(трифторметил)гексагидроимидазо-
3-амин с выходом 47%, вероятно, как результат
[4,5-b][1,4]оксазин-2(1H)-он 3 (схема 1, путь b).
нуклеофильного замещения тиоуреидного фраг-
мента исходного тиоимидазолидина на фрагмент
Взаимодействие имидазолидина
2а с
2-АФ
динуклеофила.
дает более низкий выход продукта конденсации,
фенилимидазооксазина 4 (схема 2, путь b), из-за
Настоящая работа посвящена изучению взаи-
протекания побочных процессов. При исследо-
модействия имидазилидин-2-она 2a [10] (схемы 1,
вании полученного сырца методами ЯМР 1H и
2),
1-метил-4,5-дигидрокси-4,5-бис(трифторме-
19F спектроскопии наряду с имидазооксазином 4
тил)имидазилидин-2-она 2b [11] (схемы 3, 4) и
были обнаружены бензоксазин 5 [15] и гликольу-
1-фенил-4,5-дигидрокси-4,5-бис(трифторметил)-
рил 6 [10] в соотношении 4:5:6 ~ 46:14:10, а так-
имидазилидин-2-она 2c [12] (схемы 3, 4) с 2-АЭ и
же неидентифицированные продукты (~
30%).
2-АФ с целью получения фторсодержащих N,O-
Предполагаемый механизм образования соедине-
гетероциклических соединений, перспективных
ний 4-6 представлен на схеме 2.
для поиска биологически активных веществ.
Образование соединения 5 в реакции может
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
быть объяснено нуклеофильным SN2 замещением
В отличие от углеводородных 4,5-дигидроксии-
уреидного фрагмента в соединении 2a на фраг-
мидазолидин-2-онов, которые образуют продукты
мент 2-АФ, что приводит к образованию интер-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
ГЕТЕРОЦИКЛЫ НА ОСНОВЕ БИС(ТРИФТОРМЕТИЛ)ИМИДАЗОЛИДИН-2-ОНОВ
509
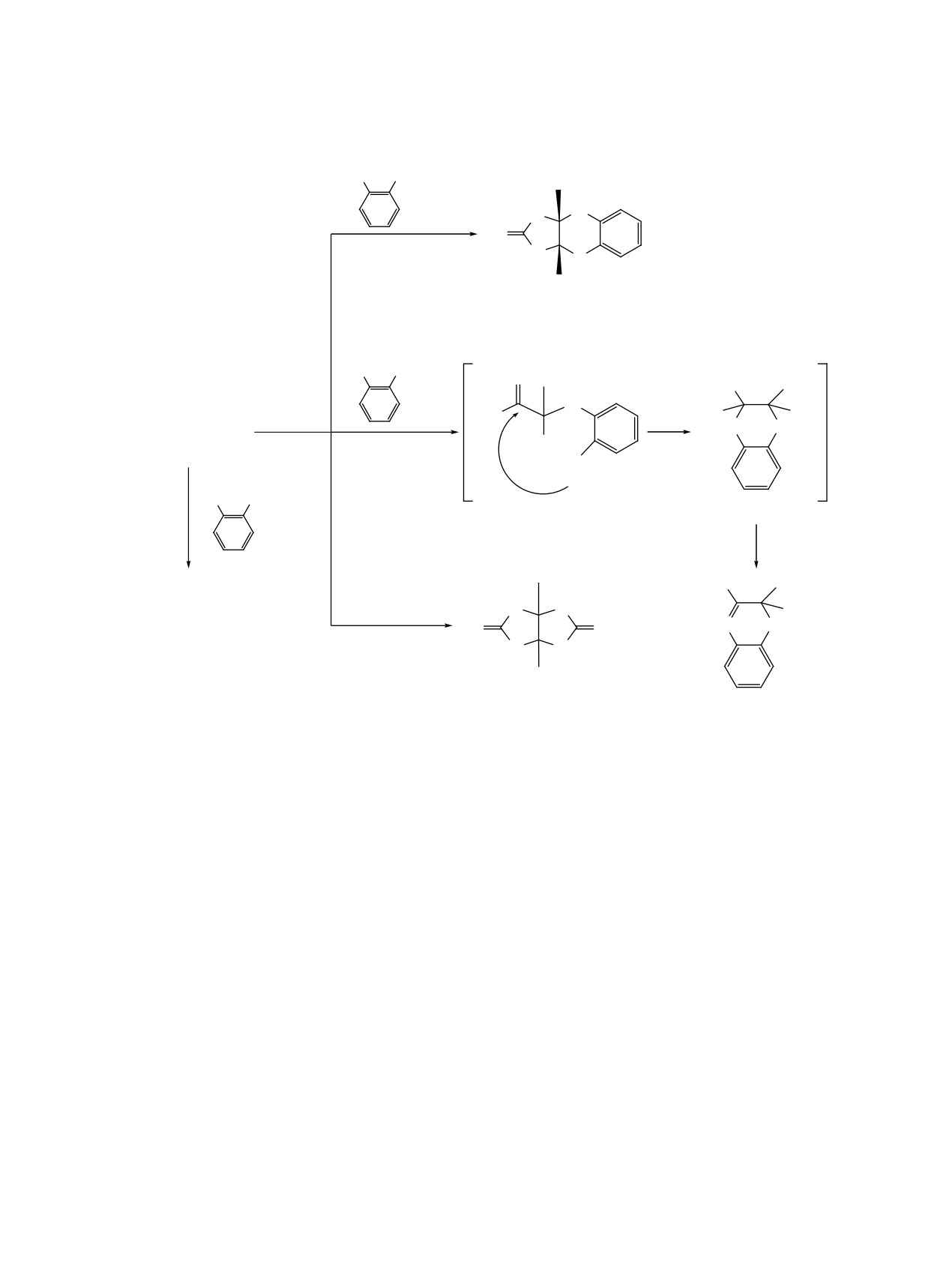
Схема 2
H
2
N
OH
F3C
H
H
N
ɩɭɬɶ b
N
O
2H2O
N
O
H
CF3
4
H
2
N
OH
O
OH
F3C
CF3
H
DMA,
N
ɩɭɬɶ c
F3C
HO
OH
ɰɢɫ,ɬɪɚɧɫ-2a
160 165°C
HN O
80:20
CF3
2
NH2CONH
HO
ɩɭɬɶ ɚ
0H2+ ++
ɢɥɢ
H
OH
2N
ɞɢɨɤɫɚɧ
A
ɤɢɩɹɱɟɧɢɟ
-H2O
CF3
ɬɪɚɧɫ-2a
F3C
CF3
ɩɭɬɶ d
H
H
NH2CONH2
N
N
OH
O
O
N O
2H2O
N
N
H
H
CF
3
6
5
медиата А; последний в результате дегидратации
цис-расположении групп CF3 [11]. Наличие ана-
дает бензоксазин 5 [15] (схема 2, путь c).
логичных сигналов в спектрах ЯМР 19F фенили-
мидазооксазина 4 [δF -76.81 м.д. (к, 5JFF 12.6 Гц),
Присутствие мочевины в реакционной смеси
-76.28 м.д. (к, 5JFF 12.6 Гц)] позволяют предполо-
наряду с 2-АФ, которая также вступает в реакцию
жить, что группы CF3 в этом соединении также
с исходным имидазолидином 2a, приводит к обра-
имеют цис-расположение.
зованию гликольурила 6 [10] (схема 2, путь d).
Мы обнаружили, что взаимодействие N-ме-
Состав и структура соединений 3, 4, выделен-
тил(фенил)имидазолидинов 2b, c с 2-АЭ в анало-
ных в чистом виде с помощью колоночной хромато-
гичных условиях приводит к неожиданным про-
графии, были подтверждены ИК-спектроскопией,
дуктам - гидроксиэтиламинозамещенным гидан-
ЯМР 1H, 13C и 19F спектроскопией и масс-спектро-
метрией высокого разрешения.
тоинам 7b, c. Предполагаемый механизм реакции
представлен на схеме 3.
Сигналы CF3-групп в спектре ЯМР 19F соеди-
нения 3 проявляются при δF -77.02 и -75.53 м.д.
Как видно из схемы 3 (путь e), первичная атака
в виде квартетов с константой спин-спиново-
свободной электронной пары атома азота группы
го взаимодействия 5JFF 12.9 Гц. Относительно
NH2 2-АЭ направлена на атом углерода C4 соеди-
большая величина константы дальнего спин-спи-
нений 2b, c, в результате которой происходит кон-
нового взаимодействия атомов фтора 5JFF в зна-
денсация с отщеплением молекулы H2O и образо-
чительной степени обусловлено вкладом взаимо-
ванием интермедиата B. Последующее элимини-
действия через пространство и свидетельствует о
рование CF3H приводит к соединениям 7b, c.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
510
САЛОУТИНА и др.
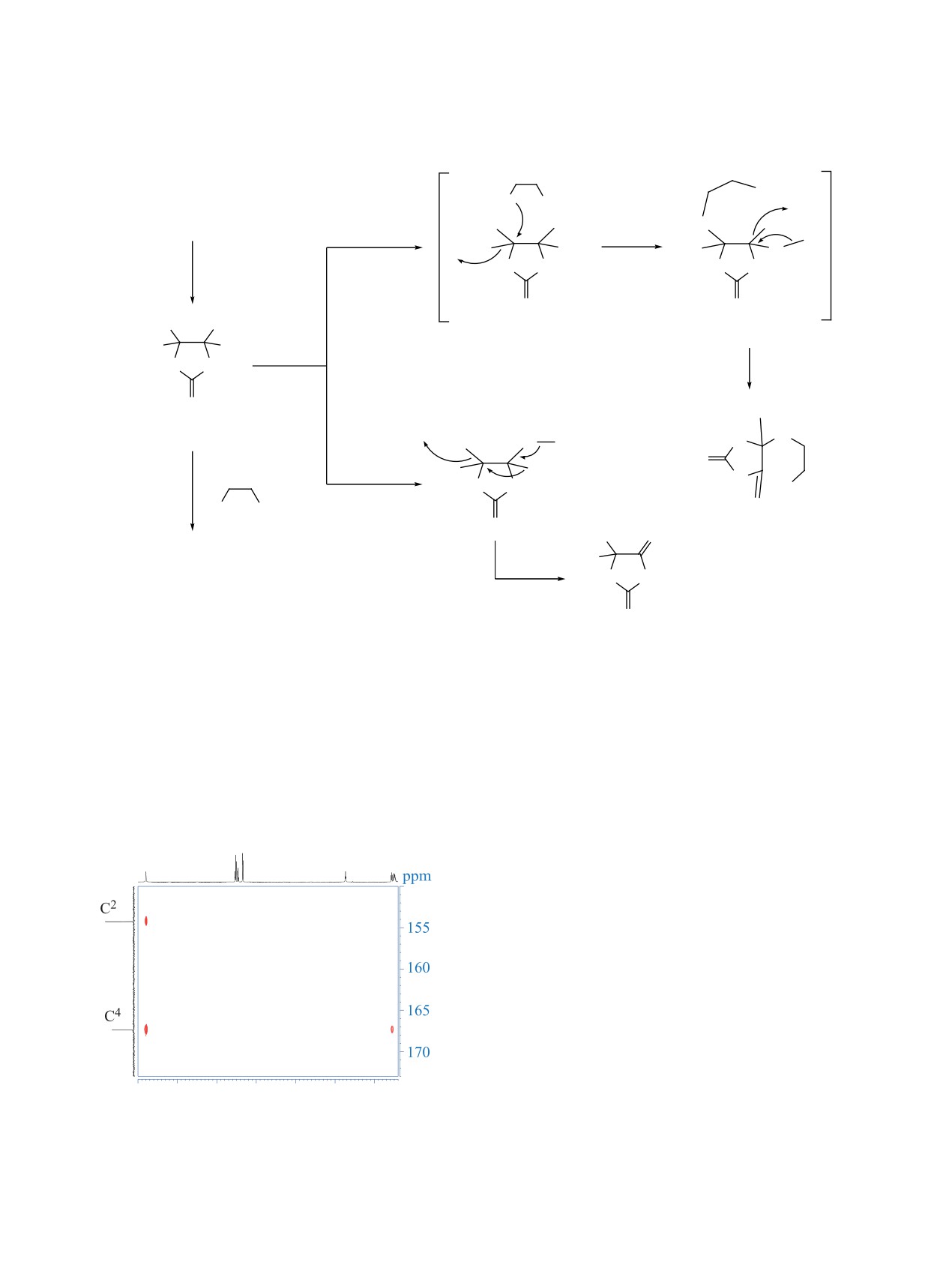
Схема 3
OH
H2N OH
F3C
CF3
HN
CF3
1
ɩɭɬɶ e
H
HO
OH
F3C
O
R = Me, Ph
H2O
RNH2CONH2
HN NR
HN NR
O
O
F3C
CF3
B
ȾɆȺ,
HO
OH
150 160°C
HN NR
CF3H
O
F3C
H
ɰɢɫ,ɬɪɚɧɫ-2b, c
H
N
HO
O
H
N
O
MeOH, H+
ɩɭɬɶ f
ɩɭɬɶ ɚ
F3C
CF3
ɢɥɢ
N
HN NR
R
HO
ɞɢɨɤɫɚɧ
R = Ph
ɤɢɩɹɱɟɧɢɟ
H2N
OH
O
O
F3C
O
7b, c
ɬɪɚɧɫ-2b, c
F3C
HN NPh
H
2O
O
8c
R = Me [2b (ɰɢɫ:ɬɪɚɧɫ = 56:44) , 7b], Ph [2c (ɰɢɫ:ɬɪɚɧɫ = 6:94), 7c, 8c].
В отличие от имидазолидина 2b (R = Me), ко-
на 2с, сопровождающейся миграцией группы CF3
торый селективно образует соединение 7b, имида-
от атома C5 к атому C4 исходного гетероцикла и
золидин 2c (R = Ph) при нагревании с 2-АЭ дает
элиминированием молекулы H2O (схема 3, путь f).
Отметим, что аналогичная перегруппировка N-за-
гидантоин 8c наряду с гидроксиэтиламиногидан-
мещенного имидазолидина 2b в гидантоин 8b при
тоином 7c (7c:8c ~ 45:55). Очевидно, образование
кипячении в ДМА, а также при кипячении в ДМА
гидантоина 8с происходит в результате внутри-
в присутствии мочевины была описана нами ранее
молекулярной перегруппировки имидазолиди-
[11].
1
NH
OH NH
Состав и структура соединений 7b, c, выде-
ленных в чистом виде с помощью колоночной
хроматографии, были подтверждены методами
ИК-спектроскопии, ЯМР 1H, 13C, 19F спектроско-
пии и масс-спектрометрии высокого разрешения.
Отнесение сигналов 1H и 13C соединения 7c было
легко достигнуто с помощью 2D экспериментов
1H-13C HSQC и HMBC. Например, триплет OH
при 4.73 м.д. (J 5.4 Гц) и дублет дублетов NH при
3.56 м.д. (J 7.4 и 6.0 Гц) можно различить по их
кросс-пикам в спектре HMBC (рис. 1).
10
9
8
7
6
5
4
ppm
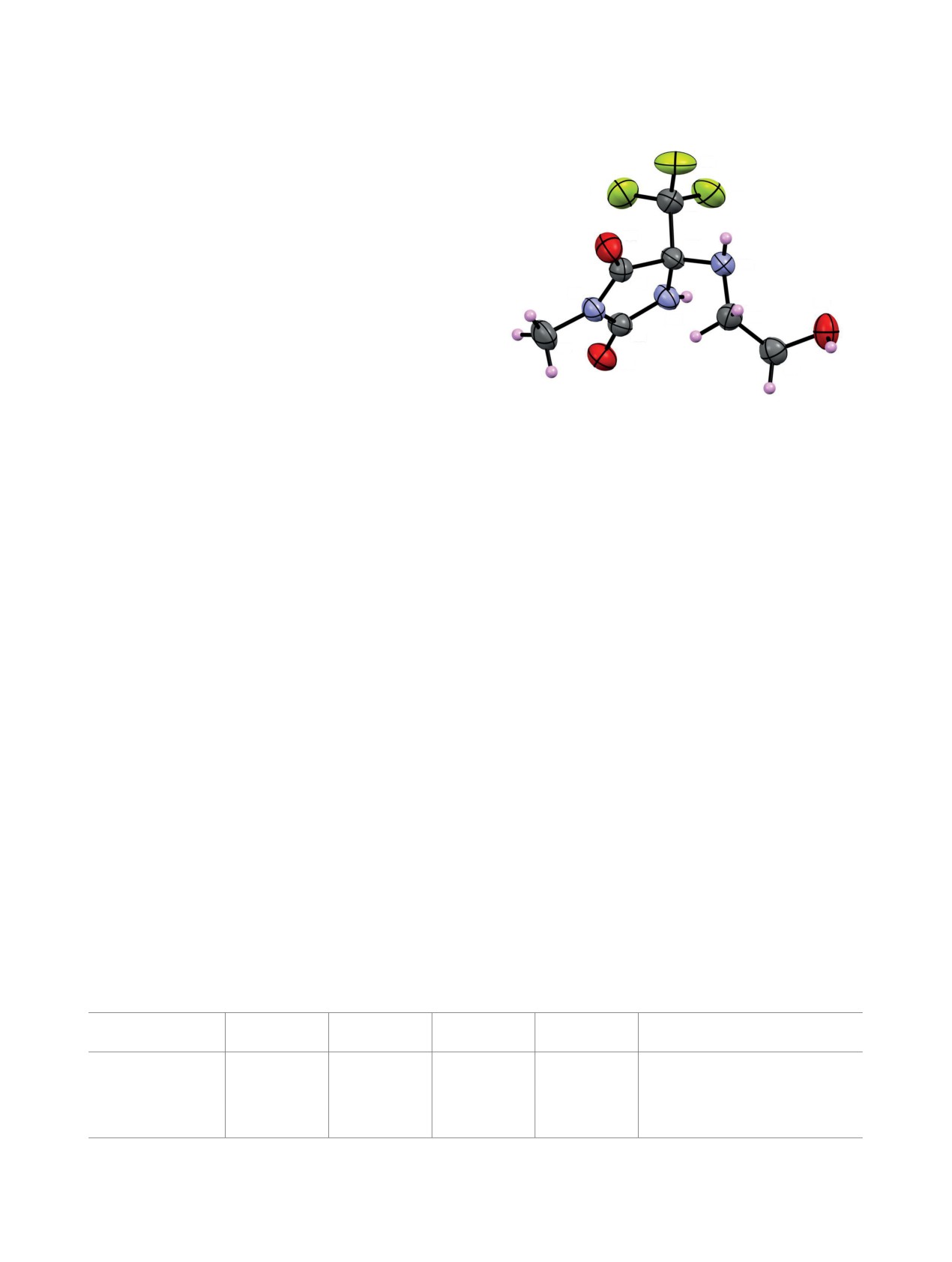
Кроме того, структура гидантоина 7b была из-
Рис. 1. Фрагмент 2D 1H-13C HMBC спектра (500 МГц,
ДМСО-d6) соединения 7c
учена с помощью рентгеноструктурного анализа
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
ГЕТЕРОЦИКЛЫ НА ОСНОВЕ БИС(ТРИФТОРМЕТИЛ)ИМИДАЗОЛИДИН-2-ОНОВ
511
(рис. 2). Согласно данным РСА, соединение 7b
F3
кристаллизовалось в центросимметричной про-
F1
странственной группе в виде рацемической смеси.
F2
Общая геометрия молекулы (расстояния и углы
C3
O2
связи) близка к ожидаемой. Расстояния между свя-
C4
зями C-N1 сильно асимметричны [N1-C5 1.358 Å и
N3
N1-C2 1.489(3) Å], что указывает на слабое сопря-
N1
C5
жение между O2C5N1 и O1C2N2 амидными фраг-
O3
ментами. Гетероциклическая часть является пло-
C6
N2
ской, атомы фтора группы CF3 хорошо локализо-
C1
C2
ваны. N3-атом имеет треугольно-пирамидальную
O1
C7
конфигурацию и расположен в гош-конформации
по отношению к O3-атому аминоэтанольной ча-
Рис. 2. Молекулярная структура гидантоина 7b в те-
сти. В кристаллах молекулы образуют систему ме-
пловых эллипсоидах уровня вероятности 50%.
жмолекулярных водородных связей (см. таблицу),
которая предотвращает разупорядочение амино-
четании с системой ВЭЖХ Agilent 1260. Растворы
этанольной группы.
образцов в смеси метанол-вода (9:1) вводили либо
непосредственно в масс-спектрометр с помощью
Обработка имидазолидинов 2b, c 2-АФ (ДМА,
шприцевого насоса (расход 180 мкл/час), либо
150-160°C) привела к продуктам перегруппиров-
после хроматографического разделения (колон-
ки, гидантоинам 8b [11] и 8c [12, 16] (схема 4,
ка Agilent RRHD SB-88; 1.8 мкм, 2.1×50 мм, 95%
путь f).
метанола или 95% ацетонитрила при расходе
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
0.3 мЛ/мин; 40°C). Колоночную хроматографию
проводили на силикагеле
60
(0.063-0.02 мм)
Точки плавления измерены в открытых капил-
(Merck).
лярах на приборе Stuart SMP30. ИК спектры заре-
гистрированы на приборе Perkin Elmer Spectrum
РСА эксперименты проводились на дифрак-
Two в диапазоне 400-4000 см-1 с помощью при-
тометре Xcalibur
3 по стандартной методике
ставки диффузного отражения (DRA). Значения
[МоKα-излучение, графитовый монохроматор,
νmax указаны в см-1. Спектры ЯМР 1H, 13C и 19F
ω-сканирование с шагом 1° при T 295(2) K]. Была
записаны на спектрометрах Bruker DRX-400
применена эмпирическая коррекция поглощения.
(400, 100 и 376 МГц соответственно) и Bruker
Используя Olex2 [20], структура была решена с по-
Avance 500 (500, 126 и 470 МГц соответственно)
мощью пакета программ ShelXS прямым методом
в Me2SO-d6 относительно внутренних стандартов
и уточнена с помощью пакета уточнения ShelXL
TMS (1H и 13C) и C6F6 (19F). Химические сдвиги
[21] с использованием полноматричного метода
19F приведены в шкале δ относительно внешнего
наименьших квадратов. Все неводородные атомы
CCl3F. Масс-спектры высокого разрешения заре-
были уточнены в анизотропном приближении,
гистрированы с помощью квадрупольно-время-
H-атомы связей C-H уточнены в модели «наездни-
пролетного масс-спектрометра сверхвысокого раз-
ка», H-атомы OH- и NH-групп были уточнены не-
решения «Bruker maXis impact» с ионизационным
зависимо в изотропном приближении. Результаты
зондом электрораспыления, установленным в со-
РСА в виде cif-файла были зарегистрированы в
Водородные связи с H∙∙∙A < r(A) + 2.000 Å и <DHA > 110°
D-H
d(D-H)
d(H∙∙∙A)
Угол DHA
d(D…A)
A
N2-H2
0.77(4)
2.02(4)
172(3)
2.780(3)
O3 [-x+1, -y+1, -z]
O3-H3
0.83(3)
2.04(3)
168(3)
2.863(3)
O1 [x, y+1, z]
N3-H3A
0.83(4)
2.34(4)
168(3)
3.160(3)
O2 [-x+1, -y+1, -z+1]
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
512
САЛОУТИНА и др.
Схема 4
H
2N
OH
H
2
N
OH
F3C
O
F3C
ɩɭɬɶ ɚ
ɩɭɬɶ f
ɬɪɚɧɫ-2b, c
2b, c
HN NR
MeOH, H+
ȾɆȺ,
ɢɥɢ ɞɢɨɤɫɚɧ
150 160°C
ɤɢɩɹɱɟɧɢɟ
O
H2O
8b, 54%
8c, 63%
R = Me [2b (ɰɢɫ:ɬɪɚɧɫ = 56:44), 8b]; Ph [2c (ɰɢɫ:ɬɪɚɧɫ = 6:94), 8c].
Кембриджской структурной базе данных под но-
CF3, 5JFF 12.9 Гц), -75.53 к (3F, CF3, 5JFF 12.9 Гц).
мером CCDC 2159184 (7b). Эти данные находятся
Масс-спектры (ВЭЖХ-МС, ESI), m/z: 278.0371.
в свободном доступе и могут быть получены по
C7H6F6N3O2. [M - H]- 278.0370.
3a,9a-Бис(трифторметил)-3,3a,9,9a-тетра-
лидин-2-оны 2a-c синтезированы с использова-
гидроимидазо[4,5-b][1,4]бензоксазин-2(1H)-он
нием известных методик [22, 10, 11, 13], соответ-
(4). Реакцию 0.2 г (0.79 ммоль) соединения 2а
ственно, другие реагенты коммерчески доступны.
(цис:транс ~ 80:20) и 0.086 г (0.79 ммоль) 2-АФ
Растворители, использованные в работе, очищены
в 2.5 мл ДМА проводили аналогично предыдуще-
и осушены с использованием стандартных проце-
му эксперименту в течение 30 мин при 160-165°C.
дур. Соотношения продуктов реакции определяли
После обработки реакционной массы получили
путем сравнения интегральных интенсивностей
маслянистый осадок, который подвергли разде-
соответствующих сигналов в спектрах ЯМР 1H и
лению и очистке с помощью колоночной хро-
19F.
матографии (силикагель, элюент CHCl3-ацетон,
3a,7a-Бис(трифторметил)гексагидроимида-
10:1). Выход 0.056 г (22%), желтый порошок: т.пл.
зо[4,5-b][1,4]оксазин-2(1Н)-он (3). Смесь 0.2 г
192-193°C. ИК спектр, ν, см-1: 3211 ш, 3092 ш
(0.79 ммоль) имидазолидина
2а (цис:транс
~
(NH), 1734 (C=O), 1505, 1421 (C=C). Спектр ЯМР
80:20) и 0.06 г (0.98 ммоль) 2-АЭ в 2.5 мл ДМА
1Н (500 МГц), δ, м.д.: 6.78 д.д.д (1H, H6, J 7.9, 7.6,
1.4 Гц), 6.90 д.д (1H, H5, J 7.9, 1.2 Гц), 6.93 д.д.д
перемешивали в течение 15 мин при 150-160°C,
(1H, H7, J 7.8, 7.6, 1.2 Гц), 7.02 д.д (1H, H8, J 7.8,
затем реакционную смесь охлаждали до ком-
1.4 Гц), 7.35 с (1H, NH), 8.69 с (1H, NH), 9.02 с
натной температуры и выливали в воду (70 мл).
(1H, NH). Спектр ЯМР 13C (126 МГц), δ, м.д.: 74.4
Полученный раствор обрабатывали Et2O, экстракт
к (C9a, 2JCF 32.3 Гц), 88.9 к (C3a, 2JCF 34.5 Гц),
сушили MgSO4, затем эфир удаляли испарением.
116.1 и 116.3 (C8, C5), 120.1 (C6), 121.2 к (CF3, 1JCF
Полученное бесцветное масло выдерживали в
281.1 Гц), 123.5 (C7), 122.7 к (CF3, 1JCF 285.9 Гц),
течение нескольких дней до затвердевания, твер-
129.7 (C8a), 139.6 (C4a), 154.1 (C2). Спектр ЯМР
дый продукт очищали методом колоночной хро-
19F (470 МГц), δ, м.д.: -76.81 к (3F, CF3, 5JFF
матографии (силикагель, элюент CHCl3-ацетон,
12.6 Гц), -76.28 к (3F, CF3, 5JFF 12.6 Гц). Масс-
10:1). Выход 0.075 г (34%), белый порошок: т.пл.
спектры (ВЭЖХ-МС, ESI), m/z:
326.0370.
211-212°C. ИК спектр, ν, см-1: 3197 ш, 3107 ш
C11H6F6N3O2-. [M - H]- 326.0370.
(NH), 1731 (C=O). Спектр ЯМР 1Н (500 МГц), δ,
м.д.: 2.81-2.94 м (2H, NCH2), 3.61 т (1H, NH7, 3JHH
Взаимодействие имидазолидинов
2b, c
5.2 Гц), 3.78 т (2H, OCH2, 3JHH 5.4 Гц), 8.15 с (1H,
с
2-АЭ. Аналогично предыдущему опыту
NH), 8.35 с (1H, NH). Спектр ЯМР 13C (126 МГц),
0.7 ммоль имидазолидинов 2b (цис:транс ~ 56:44)
δ, м.д.: 36.3 (C6), 60.1 (C5),
73.9 к (C7a, 2JCF
и 2c (цис:транс ~ 6:94) обрабатывали 0.05 г
31.0 Гц), 84.6 к (C3a, 2JCF 32.5 Гц), 122.1 к (CF3, 1JCF
(0.82 ммоль) 2-АЭ в 2 мл ДМА в течение 30 мин
286.6 Гц), 123.2 к (CF3, 1JCF 286.0 Гц), 158.5 (C2).
при 150-160°C. После очистки полученных твер-
Спектр ЯМР 19F (470 МГц), δ, м.д.: -77.02 к (3F,
дых веществ методом колоночной хроматографии
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
ГЕТЕРОЦИКЛЫ НА ОСНОВЕ БИС(ТРИФТОРМЕТИЛ)ИМИДАЗОЛИДИН-2-ОНОВ
513
(силикагель, элюент CHCl3-ацетон, 10:1) полу-
(470 MГц), δ, м.д.: -78.12 с (CF3). Масс-спектры
чено 0.074 г гидантоина 7b (выход 42%) в случае
(ВЭЖХ-МС, ESI), m/z: 302.0756. C12H11F3N3O3-.
имидазолидина 2b, а также 0.044 г гидантоина
[M - H]- 302.0758.
7c (выход 21%), и 0.053 г гидантоина 8c (выход
Взаимодействие имидазолидинов 2b, c 2-АФ.
24.4%) - в случае имидазолидина 2c (силикагель,
Аналогично предыдущему опыту, 0.79 ммоль ими-
элюент CHCl3-ацетон, 1:1).
дазолидинов 2b (цис:транс ~ 56:44), 2c (цис:транс
5-[(2-Гидроксиэтил)амино]-3-метил-5-(три-
~ 6:94) обрабатывали 0.086 г (0.79 ммоль) 2-АФ в
фторметил)имидазолидин-2,4-дион (7b), белые
2 мл ДМА. После очистки полученных твердых
кристаллы: т.пл. 78-79°C. ИК спектр, ν, см-1: 3421
веществ методом колоночной хроматографии
ш, 3339, 3067 ш (NH, OH), 1704 уш (C=О). Спектр
(силикагель, элюент CHCl3-ацетон, 10:1) получе-
ЯМР 1Н (400 МГц), δ, м.д.: 2.40-2.47 м (1H, NCHB),
но 0.105 г гидантоина 8b (выход 53%.) в случае
2.51-2.57 м (1H, NCHA), 2.91 с (3H, NCH3), 3.33 т
имидазолидина 2b и 0.15 г гидантоина 8c (выход
(1H, NH перекрывается H2O, J ≈ 6.0 Гц), 3.39-3.48
61%) - в случае имидазолидина 2c.
м (2H, OCH2), 4.68 т (1H, OH, 3JHH 5.4 Гц), 9.42
3-Метил-5,5-бис(трифторметил)имидазо-
с (1H, NH1). Спектр ЯМР 13C (126 МГц), δ, м.д.:
лидин-2,4-дион
(8b), светло-желтый порошок,
24.4 (NCH3), 43.9 (NCH2), 60.0 (OCH2), 76.1 к (С5,
т.пл. 160-162°C (разл.). ИК спектр, ν, см-1: 3343
2JCF 30.2 Гц), 122.3 к (CF3, 1JCF 285.3 Гц), 155.5
ш, 3214, 3168 ш (NH), 1771, 1725 ш, 1655 (C=O),
(C2), 168.1 (C4). Спектр ЯМР 19F (376 МГц), δ, м.д.:
1566 (NH). Спектр ЯМР 1Н (500 МГц), δ, м.д.: 2.99
-78.20 с (CF3). Масс-спектры (ВЭЖХ-МС, ESI),
с (3H, CH3), 10.81 уш.с (1H, NH). Спектр ЯМР 13C
m/z: 240.0599. C7H9F3N3O3-. [M - H]- 240.0601.
(126 МГц), δ, м.д.: 25.58 (CH3), 65.94 септет (С5,
Кристаллы соединения 7b получены медленной
2JCF 31.0 Гц), 120.18 к (2СF3, 1JCF 286.8 Гц), 155.38
кристаллизацией из смеси: H2O-ДМА (1:1) при
(C2), 160.72 (C4). Спектр ЯМР 19F (470.5 МГц), δ,
20°C. Кристаллографические данные для соедине-
м.д.: -72.60 с (CF3). Масс-спектры (ВЭЖХ-МС,
ния 7b: C7H10F3N3O3 (M 241.18 г/моль): триклин-
ESI), m/z: 249.0105. C6H3F6N2O2. [M - H]- 249.0104.
ный, пространственная группа P-1, a 7.6098(11) Å,
3-Фенил-5,5-бис(трифторметил)имидазоли-
b 7.9642(13) Å, c 9.9342(12) Å, α 85,964(12)°, β
дин-2,4-дион (8c). белые кристаллы, т.пл. 110-
69.429(12)°, γ 65.132(15)°, V 509.29(14) Å3, Z 2,
112°C. ИК спектр, ν, см-1: 3211 ш, 3146 ш (NH),
μ(MoKα) 0.156 мм-1, dcalc 1.573 г/см3, измерено
1745,
1676 (C=O),
1596,
1501 (C=C). Спектр
4659 отражений (7.482° ≤ 2Θ ≤ 61.388°), 2740 неза-
ЯМР 1Н (400 МГц), δ, м.д.: 7.38-7.42 м (2Hаром),
висимых отражений (Rint 0.0473), которые исполь-
7.50-7.59 м (3Hаром), 11.26 уш.с (1H, NH). Спектр
зовались во всех расчетах. Итоговый R1 0.1036,
ЯМР 13C (126 МГц), δ, м.д.: 65.94 септет (C5, 2JCF
wR2 0.1986 (по всем отражениям), R1 0.0614, wR2
31.1 Гц), 120.18 к (2CF3, 1JCF 286.5 Гц), 126.67 (Co),
0.1505 [I ≥ 2σ(I)], GooF 1.023, Δρē 0.36/-0.28 εÅ-3.
129.51 (Cм), 129.54 (Cп), 129.86 (Cи), 154.04 (C2),
5-[(2-Гидроксиэтил)амино]-3-фенил-5-
159.89 (C4). Спектр ЯМР 19F (376.5 МГц), δ, м.д.:
(трифторметил)имидазолидин-2,4-дион (7c), бе-
-72.47 c (2 CF3). Масс-спектры (ВЭЖХ-МС, ESI),
лый порошок, т.пл. 114-115°C. ИК спектр, ν, см-1:
m/z: 311.0261. C11H5F6N2O2. [M - H]- 311.0261.
3419 ш, 3126 ш (NH, OH), 1720 уш (C=O), 1597,
ЗАКЛЮЧЕНИЕ
1504, 1468 (C=C). Спектр ЯМР 1Н (500 МГц), δ,
м.д.: 2.58-2.64 м (1H, NCHB), 2.67-2.73 м (1H,
Осуществлен синтез новых фторсодержащих
NCHA), 3.44-3.54 м (2H, OCH2), 3.56 д.д (1H, NH,
бис(трифторметил)имидазо-1,4-оксазинов реакци-
J 7.4, 6.0 Гц), 4.73 т (1H, OH, 3JHH 5.4 Гц), 7.34 д.д
ей конденсации 4,5-дигидрокси-4,5-бис(трифтор-
(2H, Hо, J 8.4, 1.3 Гц), 7.46 т.т (1H, Hп, J 7.3, 1.3 Гц),
метил)имидазолидин-2-она с 2-АЭ и 2-АФ. При
7.52 д.д (2H, Hм, J 8.4, 7.3 Гц), 9.79 с (1H, NH1).
взаимодействии монозамещенных
1-метил(фе-
Спектр ЯМР 13C (126 МГц), δ, м.д.: 44.1 (NCH2),
нил)-4,5-дигидрокси-4,5-бис(трифторметил)ими-
60.2 (OCH2), 76.1 к (C5, 2JCF 30.3 Гц), 122.4 к (СF3,
дазолидин-2-онов с 2-АЭ в ДМА получены неожи-
1JCF 286.2 Гц), 126.7 (2Co), 128.7 (Cп), 129.2 (2Cм),
данные продукты, гидроксиэтиламино-замещен-
130.9 (Cи), 154.3 (C2), 167.4 (C4). Спектр ЯМР 19F
ные гидантоиы. Реакция 1-метил(фенил)-4,5-ди-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
514
САЛОУТИНА и др.
гидрокси-4,5-бис(трифторметил)имидазолидин-2-
nov V.V., Anikina L.V., Vikharev Yu.B., Bushmari-
онов с 2-АФ привела к образованию продуктов
nov I.S., Nelyubina Yu.V. Russ. J. Bioorg. Chem. 2012,
38, 550-557.] doi 10.1134/S106816201205007X
перегруппировки,
5,5-бис(трифторметил)гидан-
тоинов. Синтезированные гетероциклические со-
4. Anikina L.V., Vikharev Yu.B., Baranov V.V., Maly-
shev O.R., Kravchenko A.N. Mendeleev Commun.
единения представляют интерес для поиска новых
2018, 28, 317-319. doi 10.1016/j.mencom.2018.05.030
биологически активных веществ [17-19].
5. Ajami D., Rebek J.Jr. J. Am. Chem. Soc. 2006, 128,
БЛАГОДАРНОСТИ
5314-5315. doi 10.1021/ja060095q
6. Helwig R., Aumueller A., Neumann P., Trauth H. Пат.
Аналитические исследования проводились с
3530666 (1987). ФРГ. C.A. 1987, 107, 41059x.
использованием оборудования Центра коллектив-
7. Krause A., Aumueller A., Korola E., Trauth. H. Пат.
ного пользования «Спектроскопия и анализ орга-
4303522 (1994). ФРГ. C.A. 1994, 121, 205400n.
нических соединений» Института органического
8. KölbelM.,MengerF.M.Adv.Mater.2001,13,1115-1119.
синтеза Уральского отделения РАН.
doi
10.1002/1521-4095(200107)13:14<1115:AID-
ФОНДОВАЯ ПОДДЕРЖКА
ADMA1115>3.0.CO;2-Y
9. She N., Gao M., Cao L., Yin G., Wu A. Synlett. 2007,
Работа выполнена при финансовой поддержке
18, 2533-2536. doi 10.1055/s-2007-986671
Министерства образования и науки России в рам-
10. Салоутина Л.В., Запевалов А.Я., Слепухин П.А.,
ках проекта AAAA-A19-119011790132-7.
Кодесс М.И., Салоутин В.И., Чупахин О.Н. ХГС.
ИНФОРМАЦИЯ ОБ АВТОРАХ
2014, 50, 1040-1049 [Saloutina L.V., Zapevalov A.Ya.,
Slepukhin P.A., Kodess M.I., Saloutin V.I., Chupa-
Салоутина Людмила Высильевна, ORCID:
khin O.N. Chem. Heterocycl. Compd. 2014, 50, 958-
966.] doi 10.1007/s10593-014-1550-z
Кодесс Михаил Исаакович, ORCID: https://
11. Салоутина Л.В., Запевалов А.Я., Слепухин П.А.,
Кодесс М.И., Салоутин В.И., Чупахин О.Н. Изв.
orcid.org/0000-0003-4649-3659
АН. Сер. хим. 2016, 65, 473-478. [Saloutina L.V.,
Ганебных Илья Николаевич, ORCID: https://
Zapevalov A.Ya., Slepukhin P.A., Kodess M.I.,
orcid.org/0000-0002-8487-8448
Saloutin V.I., Chupakhin O.N. Russ. Chem. Bull. 2016,
65, 473-478.] doi 10.1007/s11172-016-1324-0
Слепухин Павел Александрович, ORCID:
12. Saloutina L.V., Zapevalov A.Ya., Kodess M.I., Sle-
pukhin P.A., Ganebnykh I.N., Saloutin V.I., Chupa-
Салоутин Виктор Иванович, ORCID: https://
khin O.N. AIP Conf. Proc. 2022. 2390, 020070. doi
orcid.org/0000-0003-1976-7861
10.1063/5.0069427
13. Saloutina L.V., Zapevalov A.Ya., Kodess M.I.,
Чупахин Олег Николаевич, ORCID: https://
Ganebnykh I.N., Saloutin V.I., Chupakhin O.N. J.
orcid.org/0000-0002-1672-2476
Fluorine Chem. 2018, 212, 144-152. doi 10.1016/
j.jfluchem.2018.05.015
КОНФЛИКТ ИНТЕРЕСОВ
14. Saloutina L.V., Zapevalov A.Ya., Kodess M.I.,
Авторы заявляют об отсутствии конфликта ин-
Slepukhin P.A., Ganebnykh I.N., Saloutin V.I.,
тересов.
Chupakhin O.N. J. Fluor. Chem. 2019, 227, 109362.
doi 10.1016/j.jfluchem.2019.109362
СПИСОК ЛИТЕРАТУРЫ
15. Saloutina L.V., Zapevalov A.Ya., Saloutin V.I., Ko-
1. Кравченко А.Н., Баранов В.В., Газиева Г.А. Усп.
dess M.I., Kirichenko V.E., Pervova M.G., Chupa-
хим. 2018, 87, 89-108. [Kravchenko A.N., Baranov
khin O.N. J. Fluorine Chem. 2005, 126, 976-983. doi
V.V., Gazieva G.A. Russ. Chem. Rev. 2018, 87, 89-
10.1016/j.jfluchem.2005.05.001
108.] doi 10.1070/RCR4763
16. Saloutina L.V., Zapevalov A.Ya., Kodess M.I.,
2. Машковский М.Д. Лекарственные средства. М:
Slepukhin P.A., Ganebnykh I.N., Saloutin V.I.,
Новая волна. 2010, 44, 89, 447.
Chupakhin O.N. AIP Conf. Proc. 2022, 2390, 020069.
3. Кравченко А.Н., Баранов В.В., Аникина Л.В., Виха-
doi 10.1063/5.0069424
рев Ю.Б., Бушмаринов И.С., Нелюбина Ю.В. Био-
17. Thompson A.M., Bonnet M., Lee H.H., Franzblau S.G.,
орг. хим. 2012, 38, 621-628. [Kravchenko A.N., Bara-
Wan B., Wong G.S., Cooper C.B., Denny W.A. ACS
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
ГЕТЕРОЦИКЛЫ НА ОСНОВЕ БИС(ТРИФТОРМЕТИЛ)ИМИДАЗОЛИДИН-2-ОНОВ
515
Med. Chem. Lett. 2017, 8, 1275-1280. doi 10.1021/
20. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
acsmedchemlett.7b00356
ward J.A.K., Puschmann H. J. Appl. Crystallogr., 2009,
18. Sindhu T.J., Arikkatt Sonia D., Vincent G., Chand-
42, 339-341. doi 10.1107/S0021889808042726
ran M., Bhat A.R., Krishnakumar K. Int. J. Pharm. Sci.
21. Sheldrick G.M. Acta Crystallogr., Sect. A. 2008, 64,
Res. 2013, 4, 134-143.
112-122. doi 10.1107/S0108767307043930
19. Wehner V., Stils H.-U., Osipov V.N., Golubev A.S.,
Sieler J., Burger K. Tetrehedron. 2004, 60, 4295-4302.
22. Krespan C.G., Smart B.E., Howard E.G. J. Am. Chem.
doi 10.1016.tet.2004.03.025
Soc. 1977, 99, 1214-1217. doi 10.1021/ja00446a037
Heterocycles on the Base of Bis(Trifluoromethyl)imidazoli-
din-2-ones, 2-Aminoethanol and 2-aminophenol
L. V. Saloutinaa, *, M. I. Kodessa, b, I. N. Ganebnykha, P. A. Slepukhina, b,
V. I. Saloutina, b, and O. N. Chupakhina, b
a Postovsky Institute of Organic Synthesis of Ural Branch of Russian Academy of Sciences,
ul. S. Kovalevskoi, 22/20, Ekaterinburg, 620108 Russia
b Ural Federal University named after the first President of Russia B.N. Yeltsin,
ul. Mira, 19, Ekaterinburg, 620002 Russia
*e-mail: saloutinalv@yandex.ru
Received June 2, 2022; revised February 16, 2023; accepted February 18, 2023
Novel trifluoromethyl-containing imidazo-1,4-oxazines have been synthesized through the condensation reaction
of 4,5-dihydroxy-4,5-bis(trifluoromethyl)imidazolidin-2-one with 2-aminoethanol (2-AE) and 2-aminophenol
(2-APh). Unusual route of the reaction of 1-methyl(phenyl)- 4,5-dihydroxy-4,5-bis(trifluoromethyl)imidazoli-
din-2-ones with 2-AE has been found, leading to hydroxyethylamino-substituted hydantoins. The interaction
of the N-substituted imidazolidines with 2-APh under similar conditions led to formation of rearrangement
products, 5,5-bis(trifluoromethyl)hydantoins. The molecular structure of 5-[(2-hydroxyethyl)amino]-3-meth-
yl-5-(trifluoromethyl)imidazolidin-2,4-dione has been studied by X-ray diffraction experiment.
Keywords: perfluorobiacetyl, imidazolidines, aminoalcohols, imidazo-1,4-oxazines, hydantoins, X-ray dif-
fraction
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023