ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 4, с. 525-534
УДК 547.895
ГЕТЕРОЦИКЛИЗАЦИЯ N-(2-ЦИКЛОАЛК-1-ЕН-1-ИЛ-
6-МЕТИЛФЕНИЛ)-N-(2-ГИДРОКСИЭТИЛ)-
4-МЕТИЛБЕНЗОЛСУЛЬФОНАМИДОВ
В БЕНЗОКСАЗОЦИНЫ
© 2023 г. Р. Р. Гатауллин*
Уфимский Институт химии - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
Россия, 450054 Уфа, просп. Октября, 71
*e-mail: gataullin@anrb.ru
Поступила в редакцию 16.06.2022 г.
После доработки 24.06.2022 г.
Принята к публикации 26.06.2022 г.
Приведены результаты исследования по синтезу бензоксазоцинов, конденсированных с циклоалкенами.
Взаимодействием соответствующих N-тозил-2-(1-циклоалкен-1-ил)анилинов с 2-бромэтиловым эфиром
уксусной кислоты синтезированы продукты замещения брома на ариламидную группу. Щелочным
гидролизом полученные эфиры превращены в N-(2-циклоалк-1-ен-1-ил-6-метилфенил)-N-(2-гидрокси-
этил)-4-(метилбензол)сульфонамиды. При взаимодействии этих амидов с молекулярным бромом обра-
зуются N-тозилаты бензо[e]циклоалка[g][1,4]оксазоцинов с преимущественной aR*,R*-стереохимией,
которые в растворе медленно превращаются в aS*,R*-атропоизомеры достигая соотношения 2.7:1 в
случае циклогексенильного, и 1.4:1 в случае циклопентенильного гомологов.
Ключевые слова: бензоксазоцин, атропоизомерия, 2-бромэтанол, толуолсульфонамид
DOI: 10.31857/S0514749223040110, EDN: ASZTUO
ВВЕДЕНИЕ
[19, 20], алкилфениловые эфиры [21], антранило-
вую кислоту [22], 2-аминобензиловый спирт [23].
Бензоксазогетероциклы проявляют различные
Лактонизация N-(орто-алкенилфенил)глицинов,
виды биологической активности [1-3], исполь-
N-ацилалкениланилинов или
2-аминохалконов
зуются в качестве добавок к полимерам [4] и по-
[24-27] также приводит к бензоксазоцинам. При-
лучены их комплексы с металлами [5]. Интерес
меняя эти реакции можно синтезировать бензокса-
представляют также арилконденсированные ок-
зоцины с различным расположением атомов азота
сазоцины [6-10], некоторые из которых способны
и кислорода в гетероциклическом фрагменте.
ингибировать биохимические процессы в клет-
ках [11, 12], являются антитромботическими [13],
Как известно [28], в семи- или восьмичленных
анальгетическими агентами или модуляторами
арилконденсированных гетероциклах наличие
процессов нервной системы [14, 15]. Из природно-
элементов стереогенности способствует появле-
го источника - верхней части растения Peristrophe
нию атропоизомерии [29]. Она проявляется в виде
lanceolaria изолирован алкалоид со структурой
равновесной смеси двух аксиальных диастерео-
бензоксазоцин-5-она [16]. Бензоксазоцины обыч-
меров [30-38] или же наблюдается необратимое
но получают, используя в качестве исходных со-
превращение кинетического продукта реакции в
единений фталевую кислоту [17], 2-аминофенолы
термодинамически стабильный пространствен-
[18] и метатезис их N,O-бис-аллил прекурсоров
ный изомер [39].
525
526
ГАТАУЛЛИН
H
H
CDCl3
4a O
O
sp2
sp2
6
8
O
O
N
N
CH3
CH
3
Ts
Ts
aR*,R ɷɧɚɧɬɢɨɦɟɪ
aS*,R ɷɧɚɧɬɢɨɦɟɪ
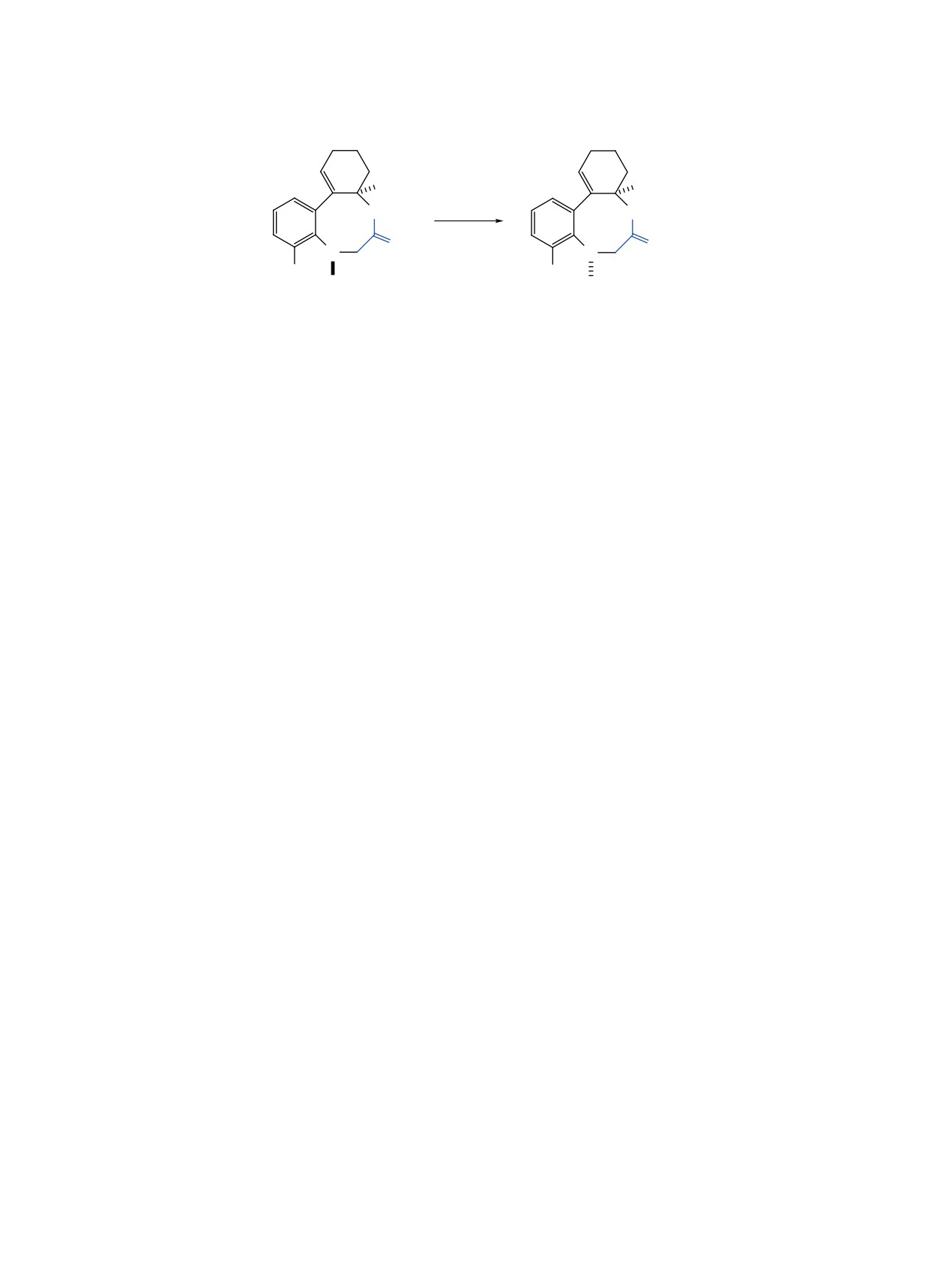
Рис. 1. Необратимая изомеризация aR*,R*-изомера в aS*,R*-изомер [39]
В N-арилсульфонил-бензо[e]циклогекса[g]-
лекулярной этерификации с образованием смеси
[1,4]оксазоцин-6-онах, полученных ранее
[39]
бензоксазоцинов P*-4a, b и M*-4a, b, которым, по
взаимодействием N-(2-циклогекс-1-ен-1-ил-6-ме-
аналогии с ранее полученными нами данными [39]
тилфенил)-N-арилсульфонилглицинов с молеку-
приписаны предполагаемые aR*,R*- и aS*,R*-сте-
лярным бромом, при растворении их в CDCl3 мы
реохимия заместителей (схема 1).
наблюдали последующую необратимую медлен-
Оба гомолога бензоксазоцинов P*-4a, b при
ную аксиальную изомеризацию кинетического
нахождении в CDCl3 или в другом растворителе
продукта циклизации, имеющего aR*,R*-стерео-
медленно превращаются в аксиальные изомеры с
химию, в термодинамически более стабильный
aS*-стереохимией по оси Ar-N с сохранением R*-
aS*,R*-атропоизомер (рис. 1).
конфигурации при хиральном атоме С3a в случае
В этом же исследовании как единственный
циколпентенильного 4a, и С4a в случае циклогек-
аксиальный изомер был получен также цикло-
сенильного 4b производных. Ранее, на основании
пента[g]-конденсированный
(aS*,R*)-гомолог,
данных NOESY ЯМР 1H экспериментов [39], опи-
который дальнейшим конформационным изме-
раясь также на рентгеноструктурные исследова-
нениям не подвергался. Очевидно, что в случае
ния [24], стабильному 6-оксогомологу [39] бензок-
[39] лактонизация в восьмичленный бензоксазо-
сазоцинов 4a нами была приписана aS*,R*-стере-
гетероцикл происходит за счёт образования новой
охимия. По аналогии с этим, описываемый здесь
HC4
a3-O-C6p2-связи. С целью выявления роли ги-
значительно преобладающий вначале aR*,R*-кон-
бридизации углеродного атома С6 в эфирном звене
формер P*-4a медленно превращается в aS*,R*-
оксазоцинового цикла на существование атропо-
аналог M*-4a.
изомерии и соотношение аксиальных изомеров, в
Химические сдвиги некоторых ароматических,
представленной статье нами исследована реакция
протонов оксазоцинового и карбоциклического
получения аналогичных бензоксазоцинов, в кото-
фрагментов этих изомеров сильно различаются,
рых в простом HC4
a3-O-C6p3H2 эфирном фраг-
что облегчает при таком медленном аксиальном
менте конфигурация валентных электронов обоих
превращении установление соотношения атропо-
углеродных атомов имеет sp3-гибридизацию.
изомеров M*-4a и P*-4a по изменению интегра-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
лов пиков этих протонов. Измерением интегралов
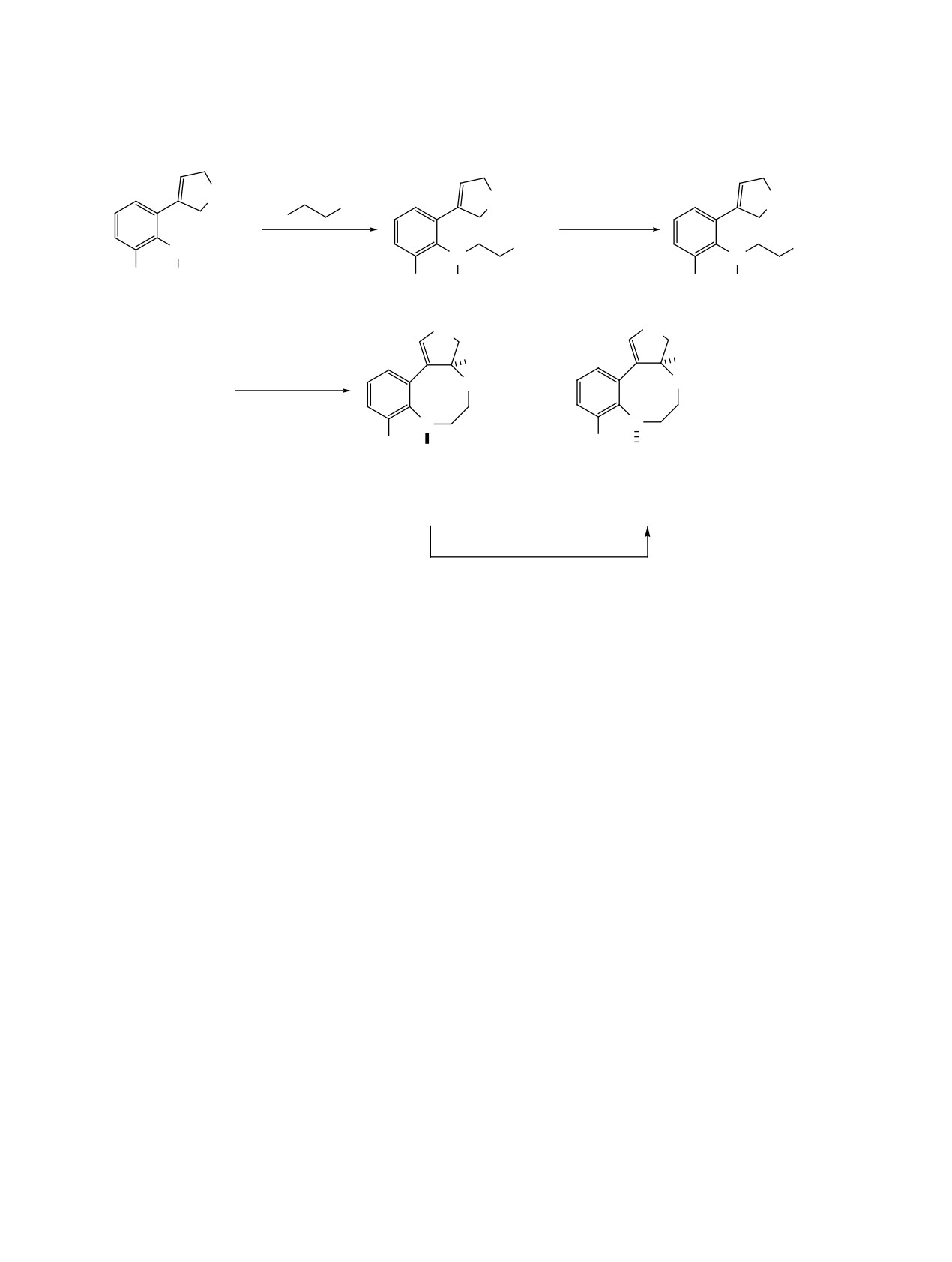
Для проведения этих исследований взаимодей-
сигналов протонов в спектре ЯМР 1H полученной
ствием N-тозил-2-(1-циклопентен-1-ил)- 1a [40] и
сырой реакционной смеси установлено, что изо-
N-тозил-2-(1-циклогексен-1-ил)-6-метиланилинов
меры P*-4a и M*-4a образовались в соотношении
1b [39] с 2-хлорэтилацетатом в присутствии ги-
3:1. Построением кинетической кривой изменения
дроксида калия и бромида триэтилбензиламмония
концентрации веществ в смеси в растворе CDCl3
(TEBAB) в тетрагидрофуране синтезировали эфи-
установлено, что в её начальном участке происхо-
ры 2a, b. Гидролизом эфиров 2a, b в присутствии
дит быстрое расходование изомера P*-4a. По мере
LiOH в водном тетрагидрофуране (1:3) получали
уменьшения концентрации этого изомера в смеси
спирты 3a, b. При взаимодействии с молекуляр-
наблюдается замедление скорости изомеризации.
ным бромом спирты 3a, b подвергаются внутримо-
Мы предполагаем, что содержание изомера P*-4a
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
ГЕТЕРОЦИКЛИЗАЦИЯ
527
Схема 1
2'''
2'''
(CH2)
3''
n
1'''
(CH2)
3''
1'''
(CH2)
OAc
2''
n
2''
n
Br
LiOH
KOH, TEBAB
1''
THF H2O, 3:1
6''
1''
1
OAc
2'
OH
NH
THF, 20°C
2
1'
N
20°C, 3 ɱ
N
24 ɱ
CH3
Ts
CH3
Ts
CH
3
Ts
1a, b
2a, b
3a, b
(CH2)
(CH2)
n
n
H
H
Br2
R*
R*
O
O
+
aR*
aS*
CH2Cl2, NaHCO3
& ɱ
N
N
CH3
CH3
Ts
Ts
P*-4a, b
M*-4a, b
aR*,R ɷɧɚɧɬɢɨɦɟɪ
aS*,R ɷɧɚɧɬɢɨɦɟɪ
CDCl3 ɢɥɢ ɞɪɭɝɨɣ ɪɚɫɬɜɨɪɢɬɟɥɶ
ɞɨ ɫɨɨɬɧɨɲɟɧɢɹ
ɤɨɝɞɚ n = 1
ɤɨɝɞɚ n = 2
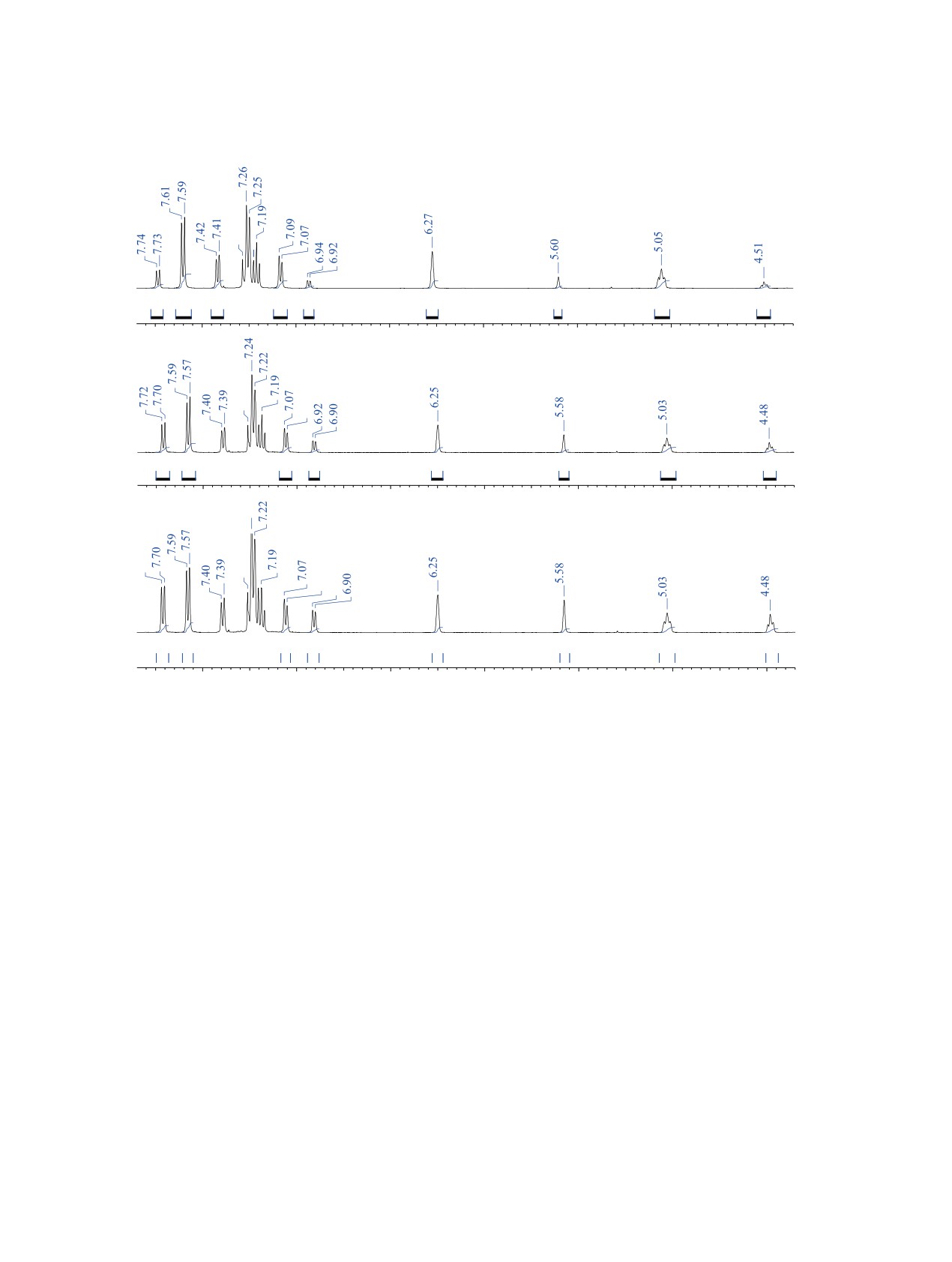
в смеси было намного выше, а за 6 ч реакции в
нее [39] полученных данных. Как в случае менее
хлористом метилене быстро уменьшилось из-за
стабильных aR*,R*-6-оксогомологов [39] (рис. 1),
изомеризации в минорный аналог M*-4a. Также
так и в спектрах этих бензоксазоцинов 4b, у смеси
было обнаружено, что, возможно, преобладающий
aR*,R*-энантиомеров протоны H1 и H4a резониру-
изомер P*-4a хуже растворяется в этаноле, чем
ют в более сильном поле, чем аналогичные сигна-
минорный аналог M*-4a. Это видно из рис. 2, a,
лы aS*,R*-энантиомеров, изображенного на рис. 1,
который снят после кристаллизации реакционной
и M*-4b (схема 1). На рис. 3, a приведен фрагмент
смеси из EtOH, где, с учётом даже кратковремен-
спектра смеси изомеров P*-4b и M*-4b после кри-
ного повышения температуры почти до 80°C, спо-
сталлизации из горячего этанола. Нагревание спо-
собствующей увеличению скорости изомеризации
собствует повышению скорости изомеризации,
P*-4a в M*-4a, соотношение изомеров составляет
и, поэтому, вероятно, при растворении в горячем
спирте значительная часть аксиального изомера
4:1, а не исходные 3:1. После семидневного выдер-
P*-4b успевает превратиться в конформер M*-4b,
живания раствора этой смеси кристаллов в CDCl3
что приводит к изменению соотношения гетеро-
при комнатной температуре их соотношение ста-
циклов в выпавших кристаллах до 12:1. После 6
новится 2:1 (рис. 2, b). По истечении 20 дней соот-
дней нахождения этой смеси кристаллов в дейте-
ношение изомеров становится 1.4:1 и после этого
рохлороформе соотношение интегралов соответ-
практически не меняется. На рис. 2, с приведён
ствующих пиков меняется на 5:1 (рис. 3, b). После
этот же фрагмент спектра, снятый через 32 дня.
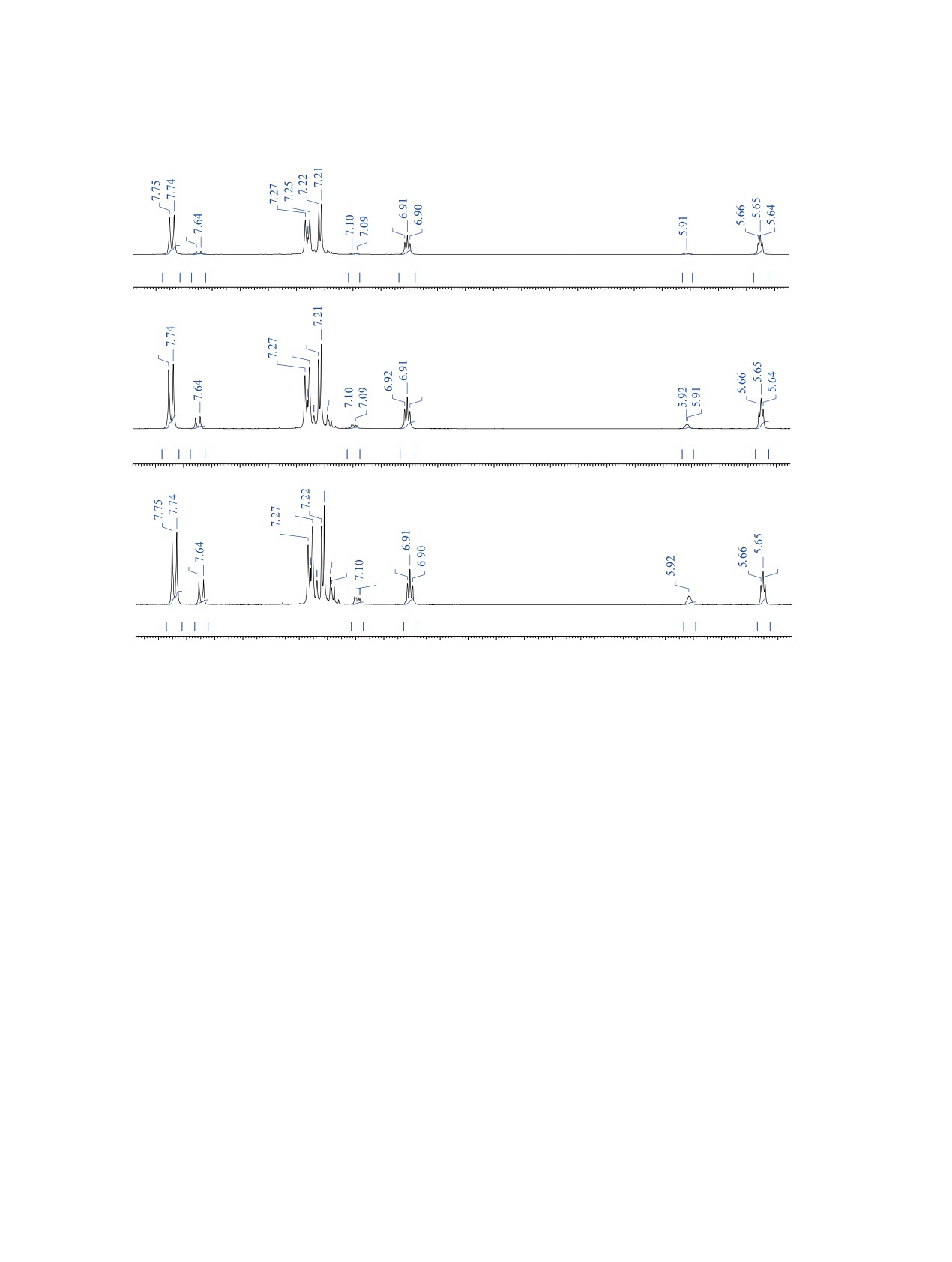
20 дней их соотношение становится ≈ 2.7:1 и
Измерением интегралов протонов в спектре
после этого в данных условиях не меняется. На
ЯМР 1H неочищенной реакционной смеси, полу-
рис. 3, c приведён фрагмент спектра ЯМР 1H этой
ченной при взаимодействии спирта 3b с бромом,
смеси, находившейся в CDCl3 в течение 30 дней.
установлено значительное преобладание изоме-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ра P*-4b (P*-4b:M*-4b ≈ 21:1). Отнесение про-
дуктов реакции к соответствующим аксиальным
Реагенты и растворители были использованы
изомерам осуществлено также на основании ра-
без дополнительной очистки. Препаративное хро-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
528
ГАТАУЛЛИН
(a)
21
77
42
40
10
40
10
42
11
7.5
7.0
6.5
6.0
5.5
5.0
4.5
ɦɞ
(b)
19
36
19
10
19
10
20
11
7.5
7.0
6.5
6.0
5.5
5.0
4.5
ɦɞ
(c)
20
27
14
10
14
10
14
10
7.5
7.0
6.5
6.0
5.5
5.0
4.5
ɦɞ
Рис. 2. Спектр раствора смеси P*-4a и M*-4a в CDCl3: (а) после кристаллизации полученной реакционной смеси из эта-
нола (соотношение изомеров ≈ 4:1); (b) раствор этой же смеси в CDCl3 через 7 дней (соотношение изомеров ≈ 2:1); (с)
раствор этой же смеси в CDCl3 через 32 дня (соотношение изомеров ≈1.4:1)
матографическое разделение продуктов реакции
(CDCl3) 77.2 м.д. Масс-спектры получены на при-
проводили на силикагеле марки Kieselgel 60 (0.04-
боре LCMS-2010EV (Shimadzu), колонка Luna 5μС
0.063 мм) (Macherey-Nagel GmBH & Co, KG) с
(18) 150×4.6 мм, сорбент октадецилсилан, подвиж-
последующим анализом методом ТСХ на пласти-
ная фаза MeCN-H2O, 95:5 или MeOH-H2O, 95:5.
нах Sorbfil (ЗАО «Сорбполимер», г. Краснодар,
Элементный анализ выполнен на приборе CHNS
Россия), проявлением парами йода. Температуры
Elemental Analyzer EURO EA-3000 (HEKAtech
плавления определены на столике Boetius (VEB
GmBH). Содержание галогена определяли колбо-
вым методом Шёнигера с последующим потенци-
Wägetechnik Rapido) и не исправлены. ИК спек-
тры записаны на спектрофотометре с преобразо-
ометрическим титрованием.
вателем Фурье IR Prestige-21 (Shimadzu). Спектры
2-{(2-Циклопент-1-ен-1-ил-6-метилфенил)-
ЯМР 1H и 13C записаны в CDCl3 на приборе Bruker
[(4-метилфенил)сульфонил]амино}этилацетат
Avance III (Bruker) при 500.13 и 125.13 МГц соот-
(2a). К раствору 0.98 г (3 ммоль) тозилата 1a [40] в
ветственно. Для корректного отнесения сигналов
10 мл тетрагидрофурана добавили 0.34 г (6 ммоль)
в спектрах ЯМР использовались методы гомо- и
тонкоизмельченного KOH и 0.81 г (3 ммоль) броми-
гетероядерной корреляции COSY, HMBC, HSQC и
да триэтилбензиламмония. Суспензию перемеши-
NOESY. Химический сдвиг в м.д. указан относи-
вали 5 мин и добавили 1.00 г (6 ммоль) 2-бромэти-
тельно сигналов растворителя, откалиброванных
лового эфира уксусной кислоты. Перемешивание
для CDCl3 следующим образом: δH (CHCl3) 7.26, δC
продолжили 72 ч. В течение этого времени наблю-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
ГЕТЕРОЦИКЛИЗАЦИЯ
529
(a)
5
0
0
0
5
ɦɞ
(b)
00
50
0
5
ɦɞ
(c)
5
0
7
0
7
ɦɞ
Рис. 3. Спектр раствора смеси P*-4b и M*-4b в CDCl3: (а) после кристаллизации полученной реакционной смеси из этано-
ла (соотношение изомеров ≈ 12:1); (b) раствор этой же смеси в CDCl3 через 6 дней (соотношение изомеров ≈ 5:1); (c) через
30 дней (соотношение изомеров ≈2.7:1)
дается постепенное выделение белого осадка. К
J 8.2 Гц), 7.70 д (2Н, Н2',6', J 8.2 Гц). Спектр ЯМР
реакционной смеси добавили 50 мл хлористого
13C, δ, м.д.: 19.62, 20.55, 21.53 (3СH3), 23.59, 33.65,
метилена и 15 мл воды, перемешивали 1 мин, пе-
37.61 (C3''', C4''', C5'''), 49.49 (С2), 61.74 (С1), 127.85,
реносили в делительную воронку. Органический
129.25 (C2',6', C3',5'), 128.00, 128.25, 130.01, 131.17
слой отделяли, промывали водой (10 мл), сушили
(C3'', C4'', C5'', C2'''), 135.31, 138.66, 139.31, 140.61,
MgSO4. После удаления растворителя и хромато-
141.02, 142.74 (C1', C4', C1'', C2'', C6'', C1'''), 169.84
графирования остатка на силикагеле для удале-
(C=O). Масс-спектр, m/z (Iотн, %): 414.1 (100) [M +
ния смолистых веществ (элюент C6H6), получили
H]+. С23H27NO4S.
1.03 г (81%) эфира 2a в виде вязкой прозрач-
2-{(2-Циклогекс-1-ен-1-ил-6-метилфенил)-
ной бесцветной массы. Rf 0.2 (С6H6). ИК спектр
[(4-метилфенил)сульфонил]амино}этилацетат
(KBr), ν, см-1: 1735, 1597, 1442, 1344, 1234, 1161,
(2b). Получали аналогично вышеописанному из
1107, 1089, 1049, 977, 908, 815, 785, 715, 680, 659,
1.02 г (3 ммоль) тозилата 1b [39]. Экстрагировали
582, 570, 543. Спектр ЯМР 1H, δ, м.д.: 1.83-1.94
60 мл диэтилового эфира, органический слой от-
м, 2.36-2.41 м, 2.46-2.54 м, 2.65-2.71 м (6H,
C3'''H2C4'''H2C5'''H2), 1.87 с (3H, CH3), 2.05 с (3H,
делили, водный слой экстрагировали 10 мл эфи-
CH3), 2.45 с (3H, CH3), 3.67 д.т (1H, H2A, J 5.8,
ра. Объединённые эфирные фракции промыва-
14.6 Гц), 3.85 д.т (1H, H2B, J 6.4, 14.6 Гц), 4.02 д.т
ли водой (15 мл), сушили MgSO4. Растворитель
(1H, H1A, J 6.4, 11.3 Гц), 4.10 д.т (1H, H1B, J 5.8,
упаривали в вакууме, остаток хроматографирова-
11.3 Гц), 5.77 c (1H, H2'''), 7.07 д (2Н, Н3'', Н5'', J
ли на колонке с силикагелем (30 г, элюент С6H6).
7.0 Гц), 7.15 т (1H, H4'', J 7.0 Гц), 7.27 д (2Н, Н3',5',
Выделили 1.01 г (79%) соединения 2b в виде про-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
530
ГАТАУЛЛИН
зрачной стекловидной массы. Rf 0.2 (С6H6). ИК
вязкой бесцветной прозрачной стекловидной мас-
спектр, ν, см-1 (KBr): 1747, 1734, 1598, 1494, 1456,
сы. Rf 0.1 (C6H6). При медленном улетучивании
1436, 1388, 1367, 1338, 1305, 1286, 1238, 1211, 1155,
хлористого метилена из раствора соединения 3b
1138, 1107, 1089, 1051, 968, 910, 815, 788, 761, 742,
образовались кристаллы на стенках колбы. Т.пл.
709, 696, 659, 601, 586, 574, 545. Спектр ЯМР 1H,
137-139°С. Спектр ЯМР 1H, δ, м.д.: 1.54-1.65
δ, м.д.: 1.58-1.70 м, 1.92-2.09 м, 2.36-2.40 м (8H,
м, 1.89-1.93 м, 2.04-2.08 м, 2.34-2.40 м (8H,
C3'''H2C4'''H2C5'''H2C6'''H2), 1.82 с (3H, CH3), 2.14 с
C3'''H2C4'''H2C5'''H2C6'''H2), 2.12 с (3H, CH3), 2.46 с
(3H, CH3), 2.45 с (3H, CH3), 3.59-3.65 м, 3.85-3.94
(3H, CH3), 3.56-3.64 м (4H, H1'A, H1'B, H2'A, H2'B),
м, 4.04-4.09 м (4H, H1A, H1B, H2A, H2B), 5.57-5.59
5.60 c (1H, H2'''), 6.97 д (1Н, ArН, J 7.3 Гц), 7.07 д
м (1H, H2'''), 6.96 д (1Н, ArН, J 7.3 Гц), 7.08 д (1Н,
(1H, ArH, J 7.3 Гц), 7.14 т (1H, ArH, J 7.3 Гц), 7.29
ArН, J 7.3 Гц), 7.14 т (1H, H4'', J 7.3 Гц), 7.29 д (2Н,
д (2Н, Н3',5', J 8.2 Гц), 7.76 д (2Н, Н2',6', J 8.2 Гц).
Н3',5', J 8.2 Гц), 7.75 д (2Н, Н2',6', J 8.2 Гц). Спектр
Спектр ЯМР 13C, δ, м.д.: 19.95, 21.56 (2СH3), 21.77,
ЯМР 13C, δ, м.д.: 19.98, 20.47, 21.51 (3СH3), 21.83,
23.08, 25.23, 30.90 (C3''', C4''', C5''', C4'''), 53.98 (С1'),
23.12, 25.21, 30.63 (C3''', C4''', C5''', C6'''), 49.23 (С2),
60.22 (С2'), 127.92, 127.95, 128.15, 129.91 (C3'', C4'',
61.60 (С1), 127.87, 129.23 (C2',6', C3',5'), 128.00,
C5'', C2'''), 128.21, 129.31 (C2,6, C3,5), 136.13, 136.30,
128.01, 128.19, 129.62 (C3'', C4'', C5'', C2'''), 135.65,
137.83, 138.81, 142.95, 146.22 (C1, C4, C1'', C2'', C6'',
135.97, 138.52, 139.38, 142.69, 145.87 (C1', C4', C1'',
C1'''). Масс-спектр, m/z (Iотн, %): 386.1 (100) [M +
C2'', C6'', C1'''), 169.80 (C=O). Масс-спектр, m/z (Iотн,
H]+. С22H27NO3S
%): 428.3 (100) [M + H]+, 273.2 (40). С24H29NO4S.
8-Метил-7-[(4-метилфенил)сульфонил]-
N-(2-Циклопент-1-ен-1-ил-6-метилфенил)-
2,3,3a,5,6,7-гексагидробензо[e]циклопента[g]-
N-(2-гидроксиэтил)-4-метилбензолсульфон-
[1,4]оксазоцин в виде смеси aR*,R*- и aS*,R*-ди-
амид (3a). К раствору 0.83 г (2 ммоль) эфира 2a
астереомеров P*-4a и M*-4a в соотношении 4:1.
в 30 мл ТГФ добавляли раствор 0.42 г (10 ммоль)
К раствору 0.37 г (1 ммоль) спирта 3a в 5 мл хло-
LiOH∙H2O в 10 мл воды и реакционную смесь
ристого метилена прибавили 0.82 г (10 ммоль) ги-
интенсивно перемешивали 3 ч на магнитной ме-
дрокарбоната натрия и при перемешивании на маг-
шалке. Добавляли 10 мл воды, 70 мл хлористого
нитной мешалке в течение 1 мин прибавляли 0.16 г
метилена, перемешивали, органический слой от-
(1 ммоль) Br2 в 1 мл CCl4. Каждая прибавленная ка-
деляли, промывали водой (10 мл), сушили MgSO4.
пля мгновенно обесцвечивается. Перемешивание
Растворитель упаривали в вакууме, продукт очи-
продолжили ещё 6 ч. После этого к реакционной
щали хроматографированием остатка на силикаге-
смеси при перемешивании добавляли воду (10 мл),
ле (3 г, элюент C6H6). Выход 0.62 г (83%). Вязкая
продукт экстрагировали хлористым метиленом
бесцветная прозрачная масса. Rf 0.1 (C6H6). Спектр
(40 мл). Органический слой промывали водой
ЯМР 1H, δ, м.д.: 1.84-1.90 м, 2.36-2.40 м, 2.46-2.53
(10 мл), сушили MgSO4. После удаления раствори-
м, 2.63-2.69 м (6H, C3'''H2C4'''H2C5'''H2), 2.01 с (3H,
теля в вакууме получили 0.37 г (100%) сырой, по
CH3), 2.45 с (3H, CH3), 3.50-3.72 м (4H, H1'A, H1'B,
спектральным данным практически чистой сме-
H2'A, H2'B), 5.86 c (1H, H2'''), 7.07 т (2Н, Н3'', Н5'', J
си продуктов P*-4a и M*-4a в соотношении 3:1 в
7.0 Гц), 7.14 т (1H, H4'', J 7.0 Гц), 7.27 д (2Н, Н3',5', J
виде пены. Кристаллизация этой пены из горячего
8.2 Гц), 7.71 д (2Н, Н2',6', J 8.2 Гц). Спектр ЯМР 13C,
этанола (2 мл) дает смесь продуктов P*-4a и M*-4a
δ, м.д.: 19.55, 21.56 (2СH3), 23.47, 33.69, 37.90 (C3''',
с выходом 0.28 г (76%) в соотношении 4:1 в виде
C4''', C5'''),
54.19 (С1'), 60.31 (С2'), 127.91, 128.07,
бесцветных кристаллов с т.пл. 135-138°С (EtOH).
130.23, 131.46 (C3'', C4'', C5'', C2'''), 128.07, 129.33
Спектр ЯМР 1H (CDCl3), δH и δH' (0.8H:0.2H'),
(C2,6, C3,5), 135.96, 138.16, 138.92, 140.89, 141.18,
м.д.: 1.22-1.35 м, 1.61-1.70 м, 2.01-2.09 м, 2.11-
143.05 (C1, C4, C1'', C2'', C6'', C1'''). Масс-спектр, m/z
2.21 м, 2.32-2.36 м (4H, H2A, H'2A, H2B, H'2B, H3A,
(Iотн, %): 372.1 (100) [M + H]+. С21H25NO3S.
H'3A, H3B, H'3B), 1.79 с (2.4H, CH3), 2.42 с (0.6H,
N-(2-Циклогекс-1-ен-1-ил-6-метилфенил)-N-
'),
'), 2.45 с (2.4H, CH3), 3.23-
(2-гидроксиэтил)-4-метилбензолсульфонамид
3.29 м (1.2H, H6A, H'6A, H'6B), 3.81-3.87 м (1H,
(3b). Получали аналогично спирту 3a из 0.86 г
H6B, H'5A), 4.03 д.т (0.8H, H5A, J 3.0, 12.3 Гц),
(3 ммоль) эфира 2b. Выход 0.62 г (80%). В виде
4.24-4.23 м (1H, H5B, H'5B), 4.49-4.52 м (0.2H,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
ГЕТЕРОЦИКЛИЗАЦИЯ
531
H'3a), 5.04-5.07 м (0.8H, H3a), 5.60 с (0.2H, H'1),
9-Метил-8-[(4-метилфенил)сульфонил]-
6.27 с (0.8H, H1), 6.93 д (0.2H, ArH', J 7.0 Гц), 7.08
2,4,4a,6,7,8-гексагидро-3H-дибензо[e,g][1,4]ок-
д (0.8H, ArH, J 7.3 Гц), 7.19-7.26 м (2H, ArH, ArH'),
сазоцин (M*-4b). Смесь изомеров M*-4b и P*-4b
7.42 д (0.8H, ArH, J 7.6 Гц), 7.60 д (1.6H, ArH, J
(50 мг) в CDCl3, в котором преобладает aR*,R*-сте-
8.2 Гц), 7.74 д (0.4H, ArH', J 8.0 Гц). Спектр ЯМР
реоизомер P*-4b, выдерживали при комнатной
13C (CDCl3), δC и δC' (0.8C:0.2 C'), м.д.: 17.78, 21.52
температуре 45 сут или нагревали при температу-
(2CH3), 18.72, 21.49 (2C'H3), 28.58, 34.08 (C2, C3),
ре 60°С 30 ч. Затем в этом же растворителе сни-
30.26, 30.29 (C'2, C'3), 52.04 (C′6), 54.53 (C6), 63.13
мали спектры ЯМР. Растворитель упаривали в
(C'5), 70.27 (C5), 88.63 (C3a), 89.58 (C'3a), 127.34,
вакууме. Аморфная масса в виде белой пены. Rf
129.54 (C2',6', C3',5'), 127.86, 127.99 (C'2',6', C'3',5'),
0.2 (C6H6). Спектр ЯМР выписан из смеси сте-
127.82, 128.58, 130.37, 130.58 (C1, C9, C10, C11),
реоизомеров M*-4b:P*-4b в соотношении ≈ 2.6:1
128.41, 128.81, 131.04, 134.94 (C'1, C'9, C'10, C'11),
вычитанием сигналов изомера P*-4b. Спектр ЯМР
134.81, 138.97, 140.14, 141.23, 142.61, 143.51 (C'7a,
1H, δ, м.д.: 1.74-1.78 м, 1.90-1.95 м, 2.10-2.15 м,
C'8, C'11a, C'11b, C'1', C'4'), 135.83, 137.44, 138.26,
(6H, CH2CH2CH2), 1.97 с (3H, CH3), 2.43 с (3H,
138.29, 143.34, 146.16 (C7a, C8, C11a, C11b, C1', C4').
CH3), 3.24 д.т (1H, H7A, J 8.5, 14.6 Гц), 3.79-3.81
Масс-спектр, m/z (Iотн, %): 370.1 (100) [M + H]+,
м (2H, H6A, H7B), 4.22 д.т (1H, H6B, J 1.5, 14.6 Гц),
214.4 (45). С21H23NO3S.
4.26-4.30 м (1H, H4a), 5.89 к (1H, H1, J 2.2 Гц),
7.10 д.д (1H, ArH, J 2.0, 7.4 Гц), 7.25 д (2H, ArH, J
9-Метил-8-[(4-метилфенил)сульфонил]-
8.2 Гц), 7.65 д (2H, ArH, J 8.2 Гц). Спектр ЯМР 13C,
2,4,4a,6,7,8-гексагидро-3H-дибензо[e,g][1,4]ок-
δ, м.д.: 18.28, 25.54, 30.90 (С2, С3, С4), 20.99, 21.52
сазоцин (P*-4b). Получали аналогично смеси изо-
меров P*-4a и M*-4a из 0.39 г (1 ммоль) спирта 3b
(2CH3), 53.09 (C7), 70.57 (C6), 81.27 (С4a), 127.42,
129.44 (С2',6', С3',5'), 128.12, 128.41, 128.63, 130.22,
в виде белой пены. Выход 0.38 г (100%) практиче-
ски чистой сырой смеси изомеров P*-4b и M*-4b
(С1, С10, С11, С12), 137.05, 137.93, 138.71, 141.97,
в соотношении 21:1. Полученную пенообразную
142.12, 143.26 (C8a, C9, С12a, С12b, С1', С4'). Масс-
массу растворяли в 1 мл горячего этанола, выпав-
спектр, m/z (Iотн, %): 384.1 (75) [M + H]+, 228.1
шие после охлаждения кристаллы отфильтровы-
(100) [M - H3CC6H4SO2]+. С22H25NO3S.
вали. Выход 0.33 г (85%). После кристаллизации
ЗАКЛЮЧЕНИЕ
соотношение изомеров P*-4b и M*-4b изменилось
При взаимодействии N-(2-циклоалк-1-ен-1-ил-
на 12:1. Бесцветные кристаллы с т.пл. 158-160°C
6-метилфенил)-N-(2-гидроксиэтил)-4-метилбен-
(EtOH). ИК спектр (KBr, вазелиновое масло),
золсульфонамидов с молекулярным бромом как и
ν, см-1: 1597, 1336, 1219, 1155, 1101, 1083, 1066,
1051, 970, 958, 896, 873, 815, 783, 748, 713, 665,
в случае ранее описанных [39] N-арилсульфонил-
N-[6-(1-циклоалкен-1-ил)-2-метилфенил]глици-
651, 594, 563, 542, 501. Спектр ЯМР 1H, δ, м.д.:
1.23-1.29 м, 1.41-1.47 м, 1.58-1.66 м, 1.76-1.84 м,
нов, образуются N-тозилаты гексагидробензо[e]-
1.89-1.94 м (6H, CH2CH2CH2), 2.33 c (3H, CH3),
циклоалка[g][1,4]оксазоцинов. Первоначально, как
2.41 c (3H, CH3), 3.18-3.22 м (2H, H6A, H7A),
и в ранее описанном
[39] случае образуется
3.68 т (1H, H4a, J 4.0 Гц), 3.90 д.т (1H, H7B, J 4.0,
aR*,R*-конформер в качестве преобладающего
13.8 Гц), 4.03 д.д.д (1H, H6B, J 4.0, 10.0, 14.0 Гц),
продукта реакции, который частично медлен-
5.65 т (1H, H1, J 3.5 Гц), 6.91 т (1H, ArH, J 4.5 Гц),
но трансформируется в аксиальный изомер с
7.21 д (2H, ArH, J 4.5 Гц), 7.26 д (2H, ArH, J 7.9 Гц),
aS*,R*-стереохимией. Отмечается влияние на со-
7.74 д (2H, ArH, J 7.9 Гц). Спектр ЯМР 13C, δ, м.д.:
отношение aR*,R*- и aS*,R*-аксиальных изомеров
18.02, 25.77, 30.16 (С2, С3, С4), 18.97 (CH3), 21.48
вида гибридизации валентных орбиталей углерод-
(CH3), 51.66 (C7), 66.64 (C6), 77.96 (С4a), 127.68,
ного атома C5 в случае конденсированного с ци-
129.16 (С2',6', С3',5'), 128.20, 128.99, 130.59 (С10, С11,
клопентеном и C6 в случае конденсированного с
С12), 131.70 (C1), 135.16, 137.85, 138.87, 139.52,
циклогексеном оксазоцинового цикла молекулы.
142.71, 146.09 (C8a, C9, С12a, С12b, С1', С4'). Масс-
Равновесные соотношения синтезированных в
спектр, m/z (Iотн, %): 384.1 (100) [M + H]+, 228.1
настоящей статье бензоксазоцинов, где эти атомы
(95) [M - H3CC6H4SO2]+. С22H25NO3S.
sp3-гибридизованы, и описанных ранее [39] гекса-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
532
ГАТАУЛЛИН
гидробензоксазоцинонов с sp2-гибридизованными
ACS Med. Chem. Lett. 2014, 5, 550-555. doi 10.1021/
атомами C5 (или C6) углеродными атомами отлича-
ml400528y
ются. В случае, синтезированных в данной статье,
2. Colarusso S., Conte I., Di Filippo M., Ercolani C.,
конденсированных с циклопентеном бензоксазо-
Mackay A.C., Palumbi M.C., Rico Ferreira M.R.,
Stansfield I., Zaramella S., Narjes F., Habermann J.
цинов в реакционной смеси обнаруживаются как
Synlett. 2011, 1527-1532. doi 10.1055/s-0030-1260790
aR*,R*-, так и aS*,R*-аксиальный изомер, тогда
как в случае [39] бензоксазоцин-5-онового ана-
3. Mitra S., Banerjee T.S., Hota S.K., Bhattacharya D.,
Das S., Chattopadhyay P. Eur. J. Med. Chem. 2011, 46,
лога был представлен единственный aS*,R*-кон-
1713-1720. doi 10.1016/j.ejmech.2011.02.024
формер. В ранее [39] синтезированных конден-
4. Liu J., Agag T., Ishida H. Polymer. 2010, 51, 5688-
сированных с циклогексеном бензоксазоцин-6-о-
5694. doi 10.1016/j.polymer.2010.08.059
нах, где углеродный атом С6 sp2-гибридизован,
5. Попов Л.Д., Зайченко Н.Л., Венидиктова О.В., Ва-
наблюдается необратимая полная изомеризация
лова Т.М., Барачевский В.А., Шиенок А.И., Коль-
aR*,R*-конформера в aS*,R*-аналог независимо
цова Л.С., Левченков С.И., Коган В.А. ЖОХ. 2014.
от природы алкил- или арилсульфонильной груп-
84, 843-847. [Popov L.D., Zaichenko N.L., Venidikto-
пы при атоме азота. Электронная конфигурация
va O.V., Valova T.M., Barachevskii V.A., Shienok A.I.,
при атоме С6 в синтезированных в данной статье
Kol’tsova L.S., Levchenkov S.I., Kogan V.A. Russ.
аналогичных бензоксазоцинах имеет sp3-гибриди-
J. Gen. Chem.
2014.
84, 934-938.] doi 10.1134/
зацию. Эти гетероциклы в растворе существуют в
S1070363214050259
виде равновесной смеси изомеров (соотношение
6. Moghaddam F.M., Taheri S., Mirjafary Z., Saeidian H.,
aR*,R*- и aS*,R*-конформеров ≈ 2.7:1).
Kiamehr M., Tafazzoli M. Helv. Chim. Acta. 2011, 94,
142-147. doi 10.1002/hlca.201000144
БЛАГОДАРНОСТИ
7. Шинкевич Е.Ю., Новиков М.С., Хлебников А.Ф.,
Спектральные анализы выполнены на оборудо-
Костиков Р.Р., Kopf J., Magull J. ЖОрХ. 2007,
вании ЦКП «Химия» Уфимского института химии
43, 1071-1084. [Shinkevich E.Yu., Novikov, M.S.,
РАН.
Khlebnikov A.F., Kostikov R.R., Kopf J., Magull J.
Russ. J. Org. Chem. 2007, 43, 1065-1079.] doi 10.1134/
ФОНДОВАЯ ПОДДЕРЖКА
S1070428007070214
Работа выполнена в рамках программы «Новые
8. Girgis A.S., Hosni H.M. J. Chem. Res. 2006, 274-276.
подходы и усовершенствование известных стра-
doi 10.3184/030823406776894274
тегий направленного синтеза поли-, би- и моно-
9. Bremner J.B., Browne E.J., Gunawardana I.W.K.
циклических N,N-, N,O-, S,O-содержащих гетеро-
Austral. J. Chem. 1984, 37, 129-141. doi 10.1071/
циклов с выявлением их биологической, антикор-
CH9840129
розионной активностей и разработкой технологии
10. Berg S.S., Toft M.P. Synth. Commun. 1976, 6, 175-183.
практической реализации полученных соедине-
doi 10.1080/00397917608072628
ний с соответствующими свойствами», государ-
11. Dockendorff C., Faloon P.W., Pu J., Yu M., Johns-
ственное задание (номер госрегистрации темы в
ton S., Bennion M., Penman M., Nieland T.J.F., Da-
ЕГИСУ 122031400274-4).
ndapani S., Perez J.R., Munoz B., Palmer M.A.,
Schreiber S.L., Krieger M. Bioorg. Med. Chem. Lett.
ИНФОРМАЦИЯ ОБ АВТОРАХ
2015, 25, 2100-2105. doi 10.1016/j.bmcl.2015.03.073
Гатауллин Раил Рафкатович, ORCID: https://
12. Miki T., Kori M., Fujishima A., Mabuchi H., Toza-
orcid.org/0000-0003-3269-2729
wa R., Nakamura M., Sugiyama Y., Yukimasa H.
Bioorg. Med. Chem. 2002, 10, 385-400. doi 10.1016/
КОНФЛИКТ ИНТЕРЕСОВ
S0968-0896(01)00289-9
Авторы заявляют об отсутствии конфликта ин-
13. Mishra J.K., Samanta K., Jain M., Dikshit M., Pan-
da G. Bioorg Med. Chem. Lett. 2010, 20, 244-247. doi
тересов.
10.1016/j.bmcl.2009.10.126
СПИСОК ЛИТЕРАТУРЫ
14. Sanga M., Banach J., Ledvina A., Modi N.B.,
1. Hanessian S., Jennequin T., Boyer N., Babonneau V.,
Mittur A. Xenobiotica. 2016, 46, 1001-1016. doi
Soma U., la Cour C.M., Millan M.J., De Nanteuil G.
10.3109/00498254.2015.1136989
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
ГЕТЕРОЦИКЛИЗАЦИЯ
533
15. Schaefer G.I., Perez J.R., Duvall J.R., Shamji A.F.,
J. Gen. Chem. 2020, 90, 1255-1284.] doi 10.1134/
Schreiber S.L. J. Am. Chem. Soc. 2013, 135, 9675-
S1070363220070130
9680. doi 10.1021/ja400034k
29. Siegel J.S. Synlett. 2018, 29, 2122-2125. doi 10.1055/
16. Prapalert W., Santiarworn D., Liawruangrath S.,
s-0037-1610998
Liawruangrath B., Pyne S. G. Nat. Prod. Commun. 2014,
30. Tanaka R., Makino K., Tabata H., Oshitari T., Natsuga-
9, 1433-1435. doi 10.1177/1934578X1400901008
ri H., Takahashi H. Synthesis. 2021, 53, 4682-4688. doi
17. Jangili P., Das B. Synlett. 2016, 27, 924-928. doi
10.1055/s-0040-1720865
10.1055/s-0035-1561203
31. Tabata H., Tsuji Y., Yoneda T., Tasaka T., Oshitari T.,
18. Baimuratov M. R., Leonova M.V., Klimochkin Y.N.
Takahashi H., Natsugari H. Synlett. 2018, 29, 2141-
Chem. Heterocycl. Compd. 2021, 57, 298-304. doi
2146. doi 10.1055/s-0037-1609868
10.1007/s10593-021-02907-5
32. Tabata H., Yoneda T., Oshitari T., Takahashi H.,
19. Taher A., Aderibigbe B.A., Morgans G.L., Made-
Natsugari H. J. Org. Chem. 2013, 78, 6264-6270. doi
ley L.G., Khanye S.D., der Westhuizen L., Fernan-
10.1021/jo401020y
des M.A., Smith V.J., Michael J.P., Green I.R., van
Otterlo W.A.L. Tetrahedron. 2013, 69, 2038-2047. doi
33. Burke E.W.D., Morris G.A., Vincent M.A., Hillie-
10.1016/j.tet.2012.12.043
ra I.H., Clayden J. Org. Biomol. Chem. 2012, 10, 716-
20. van Otterlo W.A.L., Morgans G.L., Khanye S.D.,
719. doi 10.1039/C1OB06490H
Aderibigbe B.A.A., Michael J.P., Billing D.G.
34. Tabata H., Wada N., Takada Y., Oshitari T., Takaha-
Tetrahedron Lett. 2004, 45, 9171-9175. doi 10.1016/
shi H., Natsugari H. J. Org. Chem. 2011, 76, 5123-
j.tetlet.2004.10.108
5131. doi 10.1021/jo2008725
21. Lakshmi Ch.S., Rehaman H., Rao A.B. Monatsh.
35. Ishichi Y., Ikeura Y., Natsugari H. Tetrahedron. 2004,
Chem. 2009, 140, 611-613. doi 10.1007/s00706-008-
60, 4481-4490. doi 10.1016/j.tet.2004.01.097
0101-7
36. Albert J.S., Ohnmacht C., Bernstein P.R., Rumsey W.L.,
22. Ibrahim N.M., Yosef H.A.A., Yakout E.-S.M.A., Mah-
Aharony D., Masek B.B., Dembofsky B.T., Koe-
ranM.R.H. Phosphorus, Sulfur Silicon Relat. Elem. 2009,
ther G.M., Potts W., Evenden J.L. Tetrahedron. 2004,
184, 1124-1138. doi 10.1080/10426500902855133
60, 4337-4347. doi 10.1016/j.tet.2004.03.054
23. Rujirawanich J., Gallagher T. Org. Lett. 2009, 11,
37. Natsugari H., Ikeura Y., Kamo I., Ishimaru T., Ishi-
5494-5496. doi 10.1021/ol9023453
chi Y., Fujishima A., Tanaka T., Kasahara F., Kawa-
24. Gataullin R.R., Mescheryakova E.S., Sultanov R.M.,
da M., Doi T. J. Med. Chem. 1999, 42, 3982-3993. doi
Fatykhov A.A., Khalilov L.M. Synthesis. 2019, 51,
10.1021/jm990220r
3485-3490. doi 10.1055/s-0039-1689971
38. Tabata H., Akiba K., Lee S., Takahashi H.,
25. Гатауллин Р.Р. ЖОХ. 2021, 91, 1213-1224. [Gataul-
Natsugari H. Org. Lett. 2008, 10, 4871-4874. doi
lin R.R. Russ. J. Gen. Chem. 2021, 91, 1484-1493.] doi
10.1134/S1070363221080090
10.1021/ol801968b
26. Agejas J., Delgado F., Vaquero J.J., Garcıa-Navıo J.L.,
39. Gataullin, R.R. Tetrahedron. 2021, 96, 132388. doi
Lamas C. Tetrahedron Lett. 2002, 43, 8025-8027. doi
10.1016/j.tet.2021.132388
10.1016/S0040-4039(02)01974-3
40. Кириллова И.А., Залимова М.А., Мулюкова Р.В.,
27. Gao Y.-Q., Hou Y., Zhu L., Chen J., Li R., Zhang S.-Y.,
Вахитова Ю.В., Хуснитдинов Р.Н., Гатауллин Р.Р.
He Y.-P., Xie W. Chem. Commun. 2020, 56, 6739-6742.
ЖОХ. 2018, 88, 390-396. [Kirillova I.А., Zalimo-
doi 10.1039/D0CC02416C
va М.M., Mulyukova R.V., Vakhitova Yu.V., Khus-
28. Гатауллина А.Р., Гатауллин Р.Р. ЖОХ. 2020, 90,
nitdinov R.N., Gataullin R.R. Rus. J. Gen. Chem. 2018,
1070-1101. [Gataullina A.R., Gataullin R.R. Russ.
88, 418-424.] doi 10.1134/S1070363218030076
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023
534
ГАТАУЛЛИН
Heterocyclisation of N-(2-Cycloalk-1-en-1-yl-6-methylphenyl)-
N-(2-hydroxyethyl)-4-methylbenzenesulfonamides
to Benzoxazocines
R. R. Gataullin*
Ufa Institute of Chemistry of Russian Academy of Sciences, prosp. Oktyabrya, 71, Ufa, 450054 Russia
*e-mail: gataullin@anrb.ru
Received June 16, 2022; revised June 24, 2022; accepted June 26, 2022
The article cover the results of a study on the synthesis of benzoxazocines condensed with cycloalkenes. By
reacting the corresponding N-tosyl-2-(1-cycloalken-1-yl)anilines with 2-bromoethyl ester of acetic acid, the
products of substitution of bromine for the arylamide group were synthesized. The resulting esters were convert-
ed by alkaline hydrolysis into N-(2-cycloalk-1-en-1-yl-6-methylphenyl)-N-(2-hydroxyethyl)-4-(methylbenzene)-
sulfonamides. The interaction of these amides with molecular bromine gives benzo[e]cycloalka[g][1,4]oxazocine
N-tosylates with predominant aR*,R*-stereochemistry, which in solution slowly turn into aS*,R*-atropisomers
reaching a ratio of 2.7:1 in the case of cyclohexenyl and 1.4:1 in the case of cyclopentenyl homologues.
Keywords: benzoxazocine, atropisomerism, 2-bromoethanol, toluenesulfonamide
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 4 2023