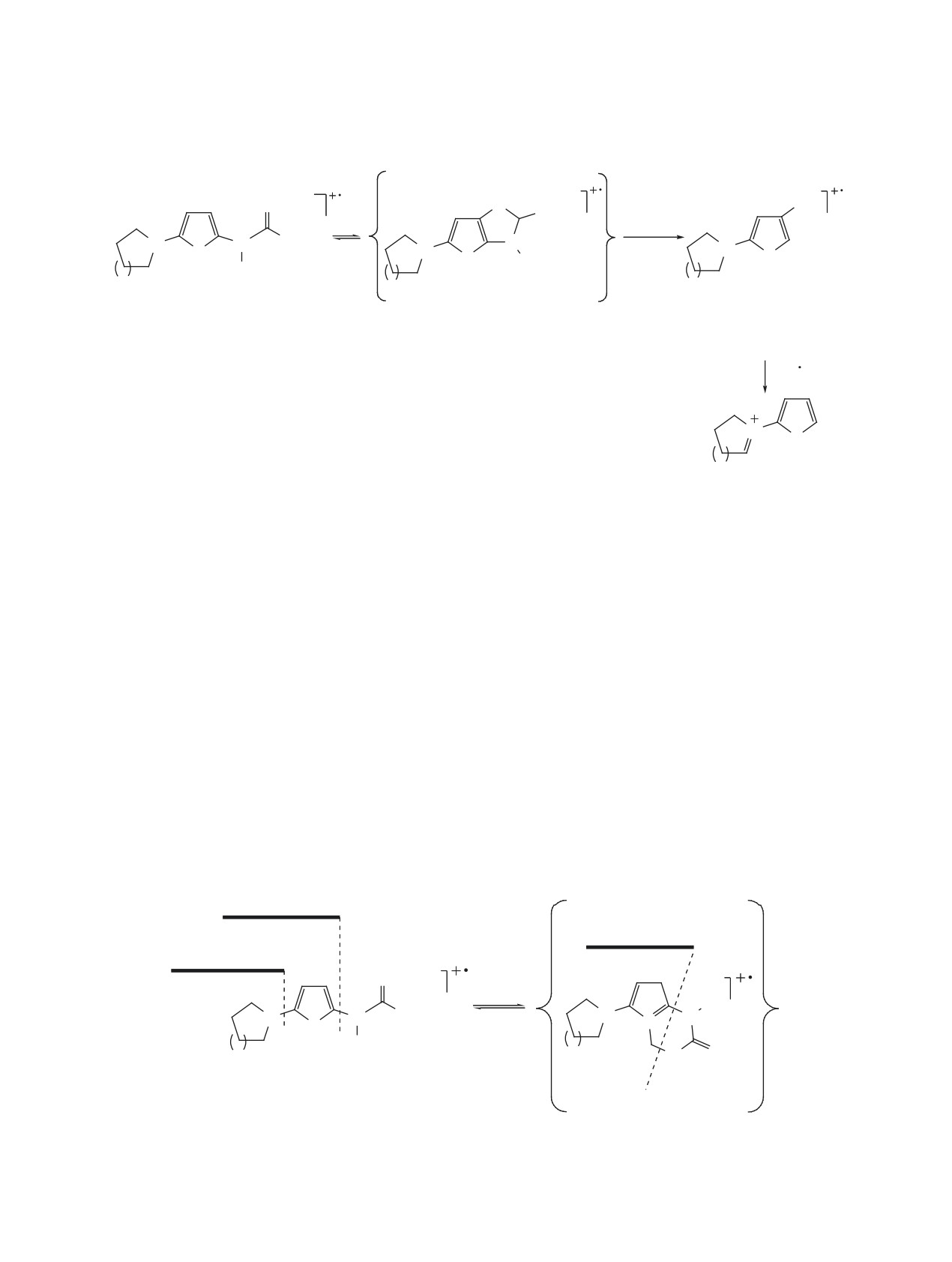ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 5, с. 596-602
УДК 547.73 + 543.51
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXV.1
ИССЛЕДОВАНИЕ N-(5-АМИНО-2-ТИЕНИЛ)-
ТИОМОЧЕВИН МЕТОДОМ ЭЛЕКТРОННОЙ
ИОНИЗАЦИИ
© 2023 г. Л. В. Клыба*, Е. Р. Санжеева, Н. А. Недоля, О. А. Тарасова
ФГБУН «Иркутский институт химии им. А.Е. Фаворского СО РАН», Россия, 664033 Иркутск, ул. Фаворского, 1
*e-mail: klyba@irioch.irk.ru
Поступила в редакцию 11.05.2022 г.
После доработки 22.05.2022 г.
Принята к публикации 24.05.2022 г.
Впервые изучены масс-спектры ранее неизвестных N-(5-амино-2-тиенил)тиомочевин, получаемых в 1
препаративную стадию из пропаргиламинов и изотиоцианатов, и выявлены основные закономерности
их фрагментации в условиях электронной ионизации (70 эВ). Все исследуемые тиенилтиомочевины
образуют молекулярный ион (Iотн 7-61%), общим направлением фрагментации которого (за исключе-
нием N-[5-(диэтиламино)-2-тиенил]-N,N'-дифенилтиомочевины) является разрыв связи R1N-C(=S) с
образованием иона [M - R2NHCS]+, пик которого имеет высокую интенсивность (Iотн 35-85%). Доми-
нирующее направление фрагментации молекулярного иона N-[5-(диэтиламино)-2-тиенил]-N,N'-дифе-
нилтиомочевины связано с деградацией тиофенового цикла по связям C2-S и C4-C5. Для N-(5-пирроли-
дин-1-ил-2-тиенил)- и N-(5-пиперидин-1-ил-2-тиенил)тиомочевин характерно протекание интенсивных
специфических процессов перегруппировки, проявляющихся в появлении неожиданных каналов пер-
вичной фрагментации молекулярного иона, основным из которых является элиминирование молекулы
N,N'-диметилкарбодиимида.
Ключевые слова: N-(5-амино-2-тиенил)тиомочевины, электронная ионизация, масс-спектры, молеку-
лярные ионы, фрагментация
DOI: 10.31857/S0514749223050051, EDN: DQNLPF
ВВЕДЕНИЕ
туры и свойств - важная задача. Разработанная
нами и успешно развиваемая оригинальная мето-
Арил- и гетарилтиомочевины, включая тиенил-
дология однореакторной сборки тиофенового ядра
тиомочевины, играют важную роль как перспек-
из алленовых или ацетиленовых карбанионов и
тивные объекты для биологических исследований
изотиоцианатов обеспечивает простой выход к но-
[2-7], органические катализаторы [8, 9] и струк-
вым семействам функционализированных тиофе-
турные блоки для гетероциклического синтеза
нов, в том числе с тиомочевинными и изотиомоче-
[10-13] и материаловедения [14-16]. Однако ряд
винными заместителями [20, 21].
доступных тиенилтиомочевин, основным методом
получения которых является присоединение тие-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ниламинов к изотиоцианатам [17, 18] или аминов
Ранее [1] мы описали синтез и распад молеку-
к тиенилизотиоцианатам [19], относительно неве-
лярных ионов N-(3-метокси-2-тиенил)-, N-[3-(1-
лик. Поэтому разработка оригинальных и удобных
этоксиэтокси)-2-тиенил]- и N-[3-(1Н-пиррол-1-
подходов к их синтезу, а также изучение их струк-
ил)-2-тиенил]изотиомочевин в условиях электрон-
1 Сообщение XXIV см. [1].
ной ионизации.
596
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXV
597
Схема 1
S
1. BuLi, ТГФ-гексан
R2N
2
R2N
N
NHR
2. R1N=C=S
S
3. t-BuOK-ДМСО
R1
4. R2N=C=S
1a-f
5. H2O
R2N = Et2N, R1 = Ph: R2 = Me (a), Et (b), i-Pr (c), Ph (d);
R1 = R2 = Me: R2N = пирролидин-1-ил (e), пиперидин-1-ил (f).
В настоящей работе в продолжение наших
далее отщепляет молекулу нитрила (R1CN) и пре-
исследований масс-спектров гетероциклов мы
вращается в 2H-тиет-2-иминий (ион B, схема 2).
впервые изучили распад ранее неизвестных N-(5-
Для N-(5-пирролидин-1-ил-2-тиенил)- (1e) и
амино-2-тиенил)тиомочевин
1a-f в условиях
N-(5-пиперидин-1-ил-2-тиенил)- (1f) тиомочевин,
электронной ионизации (70 эВ). Соединения 1a-f
кроме образования иона А (схема 2), характерны
синтезированы в 1 препаративную стадию из мо-
дополнительные каналы первичной фрагмента-
нолитиированных третичных пропаргиламинов
ции молекулярного иона (схемы 3 и 4), один из
(N,N-диэтилпроп-2-ин-1-амина, 1-проп-2-ин-1-ил-
которых (ведущий к иону С) является основным
пирролидина и 1-проп-2-ин-1-илпиперидина) и
(схема 3). Образование катион-радикала 5-пирро-
изотиоцианатов (метил-, этил-, изопропил- и фе-
лидин-1-ил- и
5-пиперидин-1-илтиофен-3-тиола
нилизотиоцианатов) по разработанной нами мето-
(ион С), пик которого имеет максимальную ин-
дике (схема 1) [21].
тенсивность (Iотн 100%), связано с выбросом мо-
лекулы N,N'-диметилкарбодиимида, скорее всего,
При ионизации электронами тиенилтиомо-
из перегруппированного иона M1+• (образование
чевины 1a-f образуют молекулярный ион (Iотн
которого, возможно, обусловлено внутримоле-
7-61%), фрагментация которого значительно
кулярной циклизацией по атому серы тионового
многообразнее, чем у описанных в предыдущем
фрагмента) (схема 3).
сообщении тиенилизотиомочевин (N-(3-алкокси-
Тогда как отщепление молекулы N-метил-
2-тиенил)- и N-[3-(1Н-пиррол-1-ил)-2-тиенил]-
имидотиокарбаматы) [1]. Общим направлением
ентиомочевины, вероятно, реализуется из пере-
группированного иона M2+• (образующегося в ре-
распада исследуемых тиенилтиомочевин [за ис-
зультате циклизации по атому серы гетероцикла) и
ключением N-[5-(диэтиламино)-2-тиенил]-N,N'-
приводит к иону D (схема 4).
дифенилтиомочевины (1d)] является разрыв связи
R1N-C(=S) с образованием радикала R2NHCS и
Интересно отметить, что при распаде молеку-
5-иминотиофен-2(5H)-иминия (ион А), который
лярного иона тиенилтиомочевин 1е и 1f фиксиру-
Схема 2
S
2
R2N
R2N
N
NHR
S
R2N
NR1
-(R2NHCS)
S
-R1CN
S
R1
1, M+˙
A
B
a, m/z 319 (7)
m/z 245 (35)
m/z 142 (12)
b, m/z 333 (8)
m/z 245 (40)
m/z 142 (9)
c, m/z 347 (8)
m/z 245 (43)
m/z 142 (8)
e, m/z 255 (33)
m/z 181 (80)
m/z 140 (23)
f, m/z 269 (31)
m/z 195 (85)
m/z 154 (24)
R2N = Et2N, R1 = Ph: R2 = Me (a), Et (b), i-Pr (c),
R1 = R2 = Me: R2N = пирролидин-1-ил (e), пиперидин-1-ил (f).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
598
КЛЫБА и др.
Схема 3
S
S
SH
NHMe
N
N NHMe
N
N
-C3H6N2
N
S
S
S
Me
Me
n
n
n
M+˙
M1+˙
C
1e, n = 1, 255 (33)
m/z 185 (100)
1f, n = 2, 269 (31)
m/z 199 (100)
-SH
N
S
n
m/z 152 (25)
m/z 166 (26)
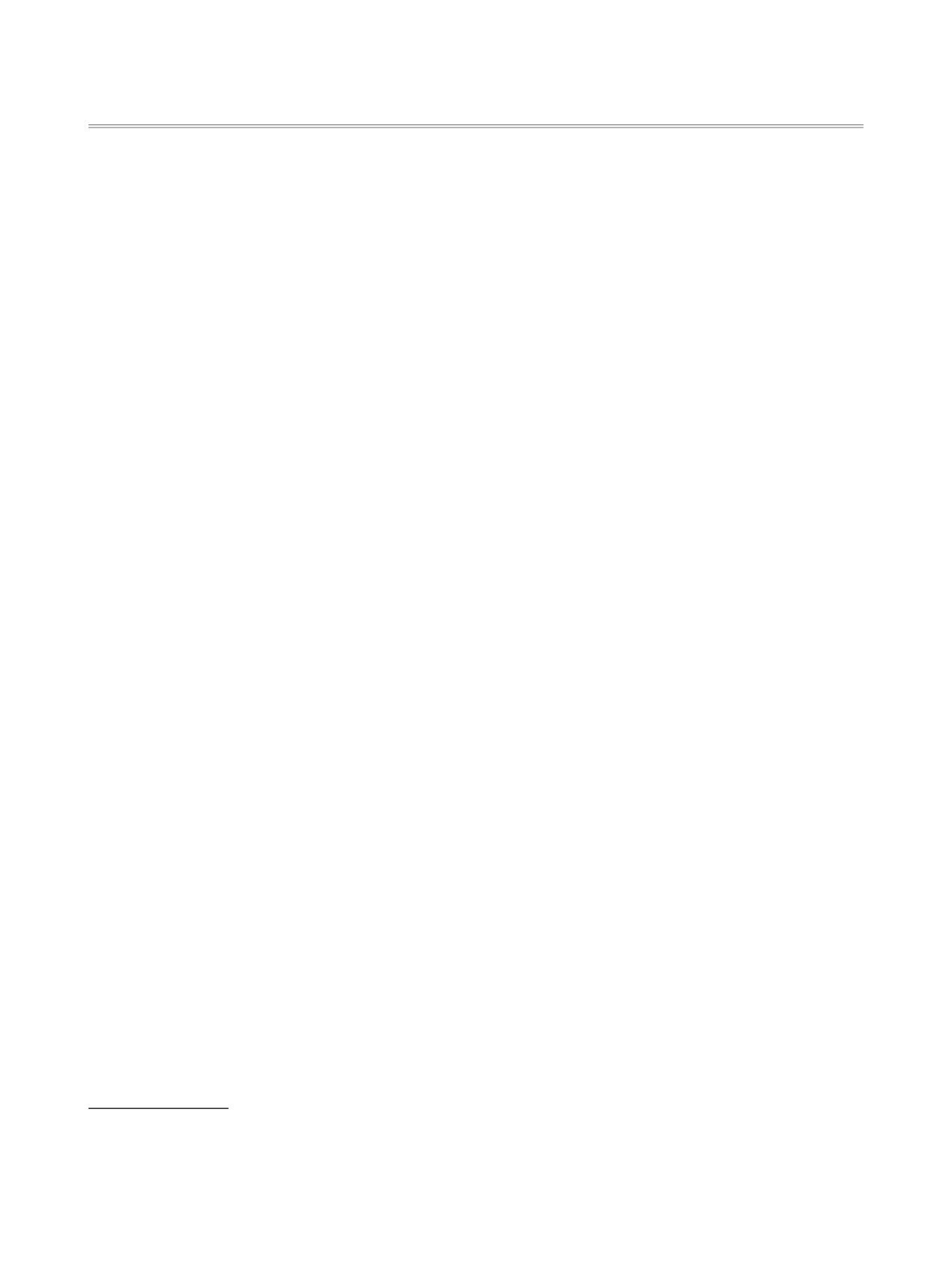
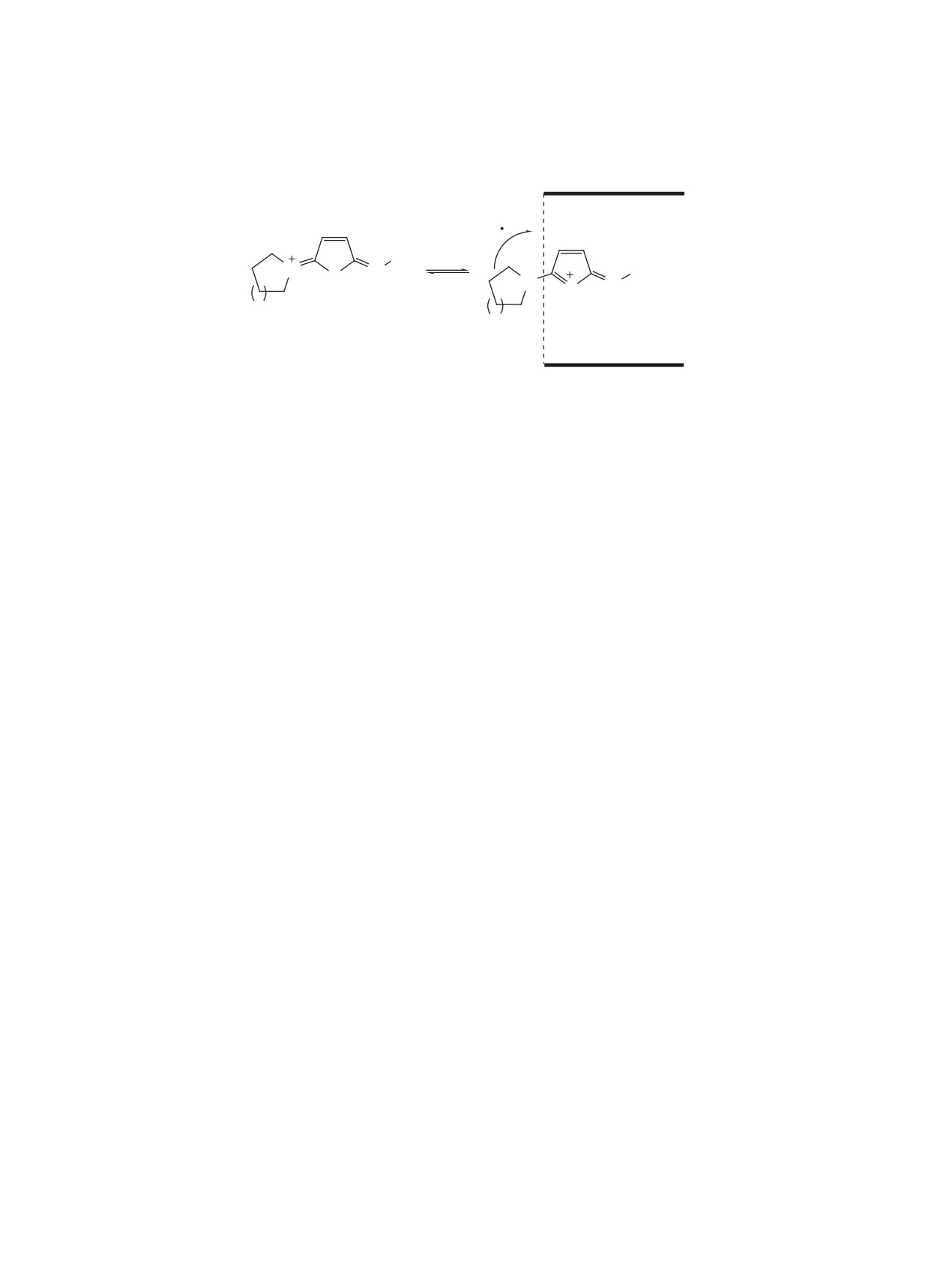
ется нетипичный разрыв связи Сгет-Nзам с обеих
Дальнейшая фрагментация ионов G и H приво-
сторон гетероцикла. При этом в одном случае за-
дит к ионам J [m/z 88 (Iотн 68%)] и K [m/z 162 (Iотн
ряд локализуется на аминном заместителе в поло-
42%)], привносящим основной вклад в полный
жении 5 (ион F, m/z 70 и 84), в другом - на гетеро-
ионный ток (схема 5). Кроме этого, образуются ха-
цикле (ион E, m/z 152 и 166) (схема 4).
рактерные фенилсодержащие ионы с m/z 104 (Iотн
29%), m/z 103 (Iотн 19%) и m/z 77 (Iотн 100%).
В отличие от тиенилтиомочевин 1а-с, e, f, фраг-
ментация молекулярного иона N-[5-(диэтиламино)-
Из вышерассмотренных результатов очевидно,
2-тиенил]-N,N'-дифенилтиомочевины
(1d), пик
что на направление первичной фрагментации мо-
которого имеет наивысшую интенсивность (Iотн
лекулярного иона тиенилтиомочевин 1а-f суще-
61%) в ряду исследованных тиенилтиомочевин,
ственное или принципиальное влияние оказывают
протекает по 2 конкурирующим направлениям,
как аминный заместитель в положении 5, так и
связанным с деградацией тиофенового цикла по
заместители R1 и R2 в тиомочевинном фрагменте.
связям C2-S и C4-C5 [ион G, m/z 116 (Iотн 99%) и
ион H, m/z 265 (Iотн 81%)] и отрывом молекулы ди-
Как уже отмечалось выше, общим направле-
этиламина [ион I, m/z 308 (Iотн 45%)] (схема 5).
нием распада молекулярного иона тиенилтио-
Схема 4
E: m/z 152 (25)
m/z 166 (26)
D: m/z 167 (45)
m/z 181 (80)
F: m/z 70 (43)
m/z 84 (24)
S
Me
N
N NHMe
N
N
S
S
n
Me
n
N
S
H
M+˙
1e, n = 1, 255 (33)
M2+˙
1f, n = 2, 269 (31)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXV
599
Схема 5
H: m/z 265 (81)
K: m/z 162 (42)
-PhCN
-S
S
m/z 130 (28)
I: m/z 308 (45)
NHPh
-Et2NH
Et2N
N
S
Ph
1d, M+˙, 381 (61)
J: m/z 88 (68)
G: m/z 116 (99)
-C
2H4
мочевин 1а-с, e, f является образование иона А,
Для N-(5-пирролидин-1-ил-2-тиенил)- и N-(5-
дальнейшая фрагментация которого определяется
пиперидин-1-ил-2-тиенил)тиомочевин 1e и 1f пик
природой заместителя в положении 5 тиофеново-
иона А имеет наибольшую интенсивность (Iотн
го цикла. Так, для N-[5-(диэтиламино)-2-тиенил]-
80 и 85% соответственно). Для этих соединений,
тиомочевин 1а-с, кроме традиционного последо-
кроме представленного на схеме 2 направления
вательного элиминирования молекулы этилена из
фрагментации иона А (элиминирование молекулы
диэтиламинного заместителя (ион L, m/z 217) и
R1CN), характерен отрыв аминного заместителя
от, скорее всего, изомерного иона А''', причём как
радикала HCS (ион M, m/z 172, предположительно
простой (ион O, m/z 111), так и с переносом прото-
имеющий структуру N-[2-(этилимино)циклопро-
на (ион P, m/z 112, схема 7).
пилиден]анилина), наблюдается выброс радикала
EtNHCH2, приводящий к образованию устойчивой
Таким образом, анализ масс-спектров элек-
трициклической структуры - 2,3-дигидротиопи-
тронной ионизации N-(5-амино-2-тиенил)тиомо-
рано[2,3-b]индола (ион N) с m/z 187 (Iотн 100%)
чевин показал, что направление фрагментации как
(схема 6). Появление такого катион-радикала мож-
молекулярного иона, так и образованных из него
но объяснить, предположив изомеризацию иона А
осколочных ионов, зависит от строения и природы
в ион А' и/или А''.
заместителей в тиофеновом цикле, что приводит к
Схема 6
H
NPh
NPh
Et2N
NPh
EtHN
S
EtN
S
S
1a-c, A
A'
A''
-C2H4
-(EtHNCH2)
S
N
EtHN
NPh
S
L: m/z 217
N: m/z 187
(27, 41, 58)
(100, 100, 100)
-(HCS)
EtN
NPh
M: m/z 172
(15, 11, 7)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
600
КЛЫБА и др.
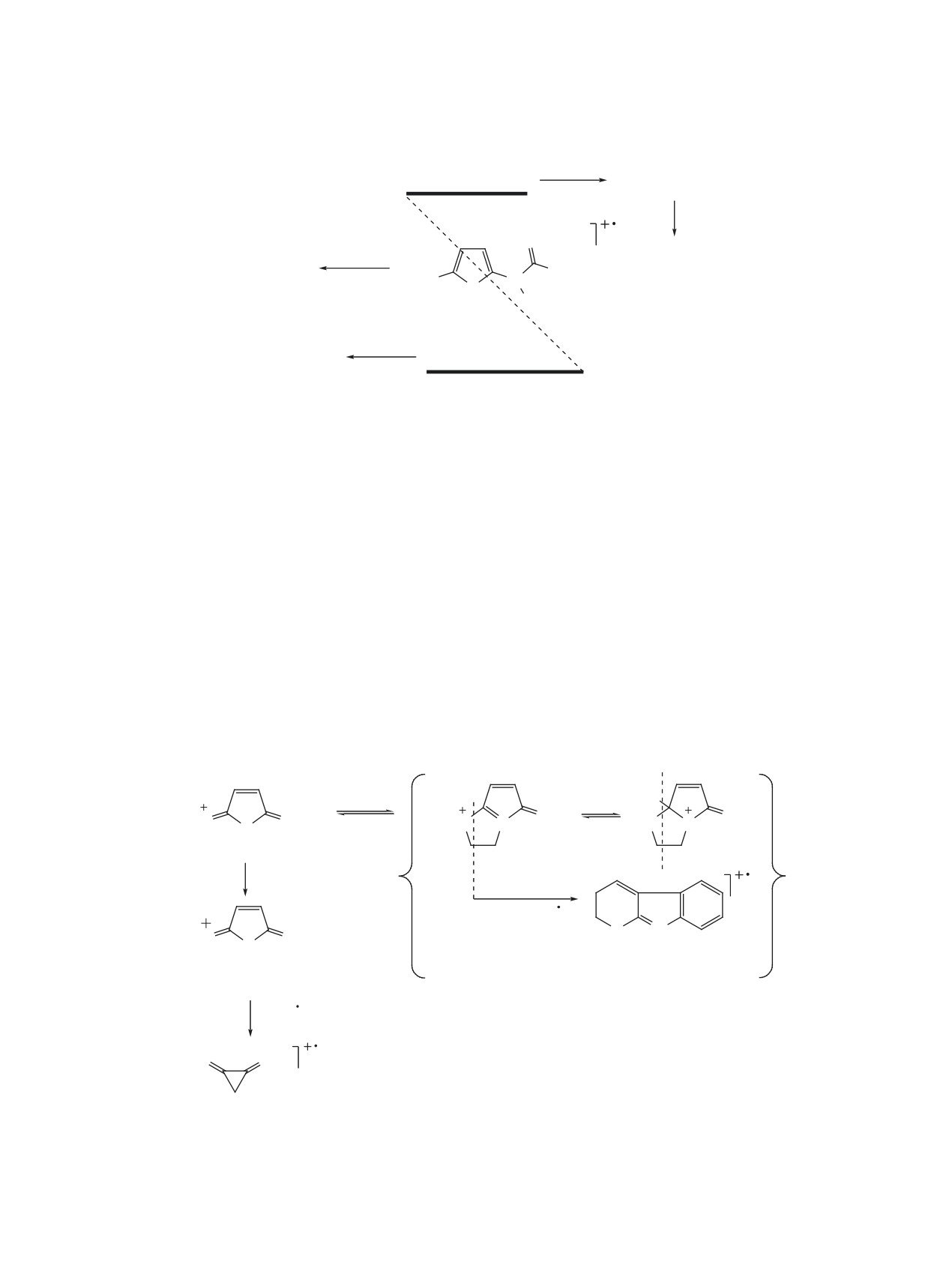
Схема 7
P: m/z 112 (13, 10)
~ H
Me
N
N
Me
S
N
N
S
n
n
1e, f: A
A'"
O: m/z 111 (7, 10)
n = 1 (e), 2 (f).
появлению дополнительных каналов распада M+•
минирование молекулы N-метилентиомочевины
(как в случае соединений 1е и 1f), либо к полной
(из перегруппированного иона M2+•) и разрыв свя-
смене маршрута (как в случае соединения 1d).
зи Сгет-Nзам с обеих сторон гетероцикла, то есть
связей Стиофен-NR2 и Стиофен-NR1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Первичный распад молекулярного иона N-[5-
Соединения 1 (с чистотой > 98%) синтезирова-
(диэтиламино)-2-тиенил]-N,N'-дифенилтиомоче-
ны по разработанной нами методике [21]. Масс-
вины протекает по 2 конкурирующим направле-
спектры положительных ионов электронной ио-
ниям, обусловленным деградацией тиофенового
низации (70 эВ) исследуемых соединений зареги-
цикла по связям C2-S и C4-C5 и отщеплением мо-
стрированы на приборе Shimadzu GCMS-QP5050A
лекулы диэтиламина.
(Япония) с системой прямого ввода образца DI-50
(масс-анализатор квадрупольный, диапазон детек-
БЛАГОДАРНОСТИ
тируемых масс 34-650 Дa). Температуру ионного
Работа выполнена с использованием оборудо-
источника и ввода образца подбирали так, чтобы
вания Байкальского аналитического центра кол-
обеспечить получение качественного масс-спек-
лективного пользования СО РАН.
тра, исключив при этом термическую деструкцию
ИНФОРМАЦИЯ ОБ АВТОРАХ
вещества.
Клыба Людмила Васильевна, ORCID: https://
ЗАКЛЮЧЕНИЕ
orcid.org/0000-0002-5521-3201
При ионизации электронами исследуемые
Санжеева Елена Ринчиновна, ORCID: https://
N-(5-амино-2-тиенил)тиомочевины образуют мо-
orcid.org/0000-0002-9776-2794
лекулярный ион (Iотн 7-61%), общим направ-
лением фрагментации которого (за исключе-
нием N-[5-(диэтиламино)-2-тиенил]-N,N'-дифе-
orcid.org/0000-0003-2614-7265
нилтиомочевины) является разрыв связи R1N-
Тарасова Ольга Анатольевна, ORCID: https://
C(=S) с элиминированием радикала R2NHCS.
orcid.org/0000-0003-4895-3217
Для N-(5-пирролидин-1-ил-2-тиенил)- и N-(5-
КОНФЛИКТ ИНТЕРЕСОВ
пиперидин-1-ил-2-тиенил)тиомочевин характерно
Авторы заявляют об отсутствии конфликта ин-
протекание интенсивных процессов перегруппи-
тересов.
ровки, проявляющихся в появлении новых неожи-
данных каналов первичной фрагментации моле-
СПИСОК ЛИТЕРАТУРЫ
кулярного иона, среди которых элиминирование
1. Клыба Л.В., Санжеева Е.Р., Недоля Н.А., Тарасо-
молекулы N,N'-диметилкарбодиимида (из пере-
ва О.А. ЖОрХ. 2023, 59, 62-72. [Klyba L.V., San-
группированного иона M1+•) с образованием устой-
zheeva E.R., Nedolya N.A., Tarasova O.A. Russ.
чивого катион-радикала
5-пирролидин-1-ил- и
J. Org. Chem.
2023,
59,
38-46.] doi
10.1134/
5-пиперидин-1-илтиофен-3-тиола (Iотн 100%), эли-
S1070428023010037
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XXV
601
2.
Katritzky A.R., Witek R.M., Rodriguez-Garcia V.,
1036-1040. [Zborovskii Yu., Orysyk V., Staninets V.,
Mohapatra P.P., Rogers J.W., Cusido J., Abdel-Fat-
Rusanov E., Chernega A. Russ. J. Org. Chem. 2007, 43,
tah A.A.A., Steel P.J. J. Org. Chem. 2005, 70, 7866-
1030-1034.] doi 10.1134/S1070428007070159
7881. doi 10.1021/jo050670t
13.
Liu M., Zeng M.-T., Xu W., Chang C.-Z., Liu X.,
3.
Steppeler F., Iwan D., Wojaczyńska E., Wojaczyńs-
Zhu H., Li Y.-S., Dong Z.B. J. Chem. Res. 2017, 41,
ki J. Molecules.
2020,
25,
401. doi
10.3390/
165-167. doi 10.3184/174751917X14878812592733
molecules25020401
14.
Raposo M.M.M., García-Acosta B., Ábalos T., Cale-
ro P., Martínez-Máñez R., Ros-Lis J.V., Soto J. J. Org.
4.
Al-Omran F., El-Khair A.A. J. Heterocycl. Chem. 2004,
41, 909-914. doi 10.1002/jhet.5570410610
Chem. 2010, 75, 2922-2933. doi 10.1021/jo100082k
15.
Malashikhin S.A., Baldridge K.K., Finney N.S. Org.
5.
D’Cruz O.J., Samuel P., Uckun F.M. Biol.
Lett. 2010, 12, 940-943. doi 10.1021/ol902902m
Reproduct.
2004,
71,
2037-2047. doi
10.1095/
biolreprod.104.032870
16.
Odago M.O., Colabello D.M., Lees A.J. Tetrahedron.
2010, 66, 7465-7471. doi 10.1016/j.tet.2010.07.006
6.
Kang I.-J., Wang L.-W., Lee C.-C., Lee Y.C., Chao Y.-S.,
Hsu T.-A., Chern J.-H. Bioorg. Med. Chem. Lett. 2009,
17.
Cannito A., Perrissin M., Luu Duc C., Huguet F.,
19, 1950-1955. doi 10.1016/j.bmcl.2009.02.048
Gaultier C., Narcisse G. Eur. J. Med. Chem. 1990, 25,
635-639. doi 10.1016/0223-5234(90)90128-P
7.
Shakeel, A., Altaf, A.A., Qureshi, A.M., Badshah, A. J.
Drug Des. Med. Chem. 2016, 2, 10-20. doi 10.11648/
18.
El-Kashef H., Farghaly A.-R., Al-Hazmi A., Terme T.,
Vanelle P. Molecules.
2010,
15,
2651-2666. doi
j.jddmc.20160201.12
10.3390/molecules15042651
8.
Kataja A.O., Koskinen A.M.P. Arkivoc. 2010, ii, 205-
19.
McCarthy W.C., Foss L.E. J. Org. Chem. 1977, 42,
223. doi 10.3998/ark.5550190.0011.216
1508-1510. doi 10.1021/jo00429a004
9.
Cai X.-H., Xie B. Arkivoc. 2013, i, 264-293. doi
20.
Недоля Н.А., Тарасова О.А., Клыба Л.В., Дмитрие-
10.3998/ark.5550190.p007.839
ва Г.В., Трофимов Б.А. Тезисы III Международной
10.
Grehn L. J. Heterocycl. Chem. 1978, 15, 81-87. doi
конференции
«Химия гетероциклических соеди-
10.1002/jhet.5570150118
нений», посвященной 95-летию со дня рождения
11.
Boehm R., Mueller R., Lohmann D., Laban G. Пат.
профессора Алексея Николаевича Коста. Москва,
240892 A1 19861119 (1986). Германия. С.А. 1987,
18-21 октября, 2010, 146.
107, 77829n.
21.
Tarasova O.A., Nedolya N.A., Vvedensky V.Yu.,
12.
Зборовский Ю.Л., Орысык В.В., Станинец В.И.,
Brandsma L., Trofimov B.A. Tetrahedron Lett. 1997,
Русанов Э.Б., Чернега А.Н. ЖОрХ.
2007,
43.
38, 7241-7242. doi 10.1016/s0040-4039(97)01680-8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
602
КЛЫБА и др.
Mass-spectra of New Heterocycles: XXV.
Electron Impact Study of N-[5-Amino-2-thienyl]thioureas
L. V. Klyba*, E. R. Sanzheeva, N. A. Nedolya, and O. A. Tarasova
Favorsky Irkutsk Institute of Chemistry, Siberian Branch, Russian Academy of Sciences,
ul. Favorskogo, 1, Irkutsk, 664033 Russia
*e-mail: klyba@irioch.irk.ru
Received May 11, 2022; revised May 22, 2022; accepted May 24, 2022
The mass spectra of previously unknown N-(5-amino-2-thienyl)thioureas obtained in one preparative step
from propargylamines and isothiocyanates were studied for the first time, and the main patterns of their frag-
mentation under electron ionization conditions (70 eV) were revealed. All thienylthioureas studied form a
molecular ion (Irel 7-61%), whose general direction of fragmentation {with the exception of N-[5-(diethylami-
no)-2-thienyl]-N,N'-diphenylthiourea} is the breaking of the R1N-C(=S) bond with the formation of the [M -
R2NHCS]+ ion, the peak of which has a high intensity (Irel 35-85%). The dominant direction of fragmentation
of the molecular ion N-[5-(diethylamino)-2-thienyl]-N,N'-diphenylthiourea is associated with the degradation
of the thiophene cycle by C2-S and C4-C5 bonds. For N-(5-pyrrolidine-1-yl-2-thienyl)- and N-(5-piperidine-1-
yl-2-thienyl)thioureas are characterized by the course of intensive specific rearrangement processes, manifested
in the appearance of unexpected channels of primary fragmentation of the molecular ion, the main of which is
the elimination of the molecule N,N'-dimethylcarbodiimide.
Keywords: N-(5-amino-2-thienyl)thioureas, electron ionization, mass spectra, molecular ions, fragmentation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023