ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 5, с. 655-664
УДК 547.022
ПРОБЛЕМЫ СИНТЕЗА МЕРКАПТОПРОИЗВОДНЫХ
ИЗ СООТВЕТСТВУЮЩИХ ГИДРОКСИПРОИЗВОДНЫХ
ПОЛИФЕНИЛЕНОВ
© 2023 г. А. В. Финькоa, b, *, А. С. Саакяна, В. С. Безбородовc,
С. Г. Михалёнокc, P. В. Тальрозеb
a ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
химический факультет, Россия, 119991 Москва, Ленинские горы, 1, стр. 3
b ФГБУН «Институт нефтехимического синтеза им. А.В. Топчиева РАН»,
Россия, 199991 Москва, Ленинский просп., 29
c Белорусский государственный технологический университет, Беларусь, 220006 Минск, ул. Свердлова, 13а
*e-mail: finko.alexander@gmail.com
Поступила в редакцию 23.09.2022 г.
После доработки 30.10.2022 г.
Принята к публикации 31.10.2022 г.
Для исследования возможности создания новых анизотропных нанокомпозитов на основе органических
молекул, содержащих меркаптогруппы для специфического взаимодействия с наночастицами, изучена
возможность превращения гидроксипроизводных полифениленов в соответствующие тиолы.
Ключевые слова: наночастицы, анизотропные среды, жидкие кристаллы, спирты, тиолы
DOI: 10.31857/S0514749223050130, EDN: DRQWPH
ВВЕДЕНИЕ
ния, обладающих уникальными специфическими
свойствами, способствуют расширению исследо-
В последние десятилетия наблюдается устой-
вательской деятельности по разработке новых и
чивый рост исследований анизотропных нано-
улучшению параметров существующих нанома-
композиционных материалов, обусловленный
териалов, особенно полученных на основе много-
разнообразием и широким спектром их использо-
функциональных структурированных анизотроп-
вания
- от волноводов, фотоэлектрических
ных, термотропных и лиотропных ЖК матриц [1].
устройств, устройств отображения информации,
устройств с контролем спонтанного излучения и
Однако в настоящее время, к сожалению, в
лазерной генерации до биологических систем и
большинстве работ основное внимание уделяется
новых поколений лекарственных препаратов [1-
некоторым уникальным оптическим или другим
10].
эффектам, вызываемым одним конкретным типом
наночастиц, а не целенаправленному изучению
Огромное разнообразие наночастиц (НЧ) (ме-
закономерностей изменения эффектов в зависи-
таллических, полупроводниковых, ферромаг-
мости от характера среды, типа, размера и формы
нитных, сегнетоэлектрических), различающихся
частиц, структуры реагента, покрывающего нано-
свойствами, размером, формой; анизотропных
частицы.
матриц на основе хиральных и нехиральных низ-
комолекулярных, полимерных жидких кристаллов
Следует отметить, что использование ани-
(ЖК), анизотропных солей, полифункциональных
зотропных материалов, обладающих определен-
соединений и биополимеров; высокая потребность
ной структурой и характеризующихся наличием
в наноматериалах различного целевого назначе-
функциональных групп, например, таких как ги-
655
656
ФИНЬКО и др.
дроксильная, карбоксильная, тиольная, акрилат-
синтеза их меркаптопроизводных, поскольку мер-
ная, винилкетонная, является одним из наиболее
каптогруппы должны способствовать специфи-
эффективных способов контролируемого разме-
ческому взаимодействию с наночастицами и тем
щения наночастиц в среде. Локализация кван-
самым созданию новых анизотропных нанокомпо-
товых точек (КТ) в таких системах обусловлена
зитов.
ориентационной упорядоченностью анизотроп-
Как следует из литературных данных [1, 9,
ных молекул, а также межмолекулярными взаимо-
13-14], меркаптопроизводные характеризуются
действиями, включая дисперсионные и Ван-дер-
высокой эффективностью взаимодействия с на-
Ваальсовы, образованием ковалентных, ионных
ночастицами золота, серебра, CdTe, другими КТ
связей между поверхностями квантовых точек и
и могут способствовать равномерному распреде-
функциональными группами соединений [1].
лению легированных НЧ в нематических ЖК ма-
В результате проведенных исследований [11,
трицах. Целью настоящей работы является синтез
12] нам удалось продемонстрировать способность
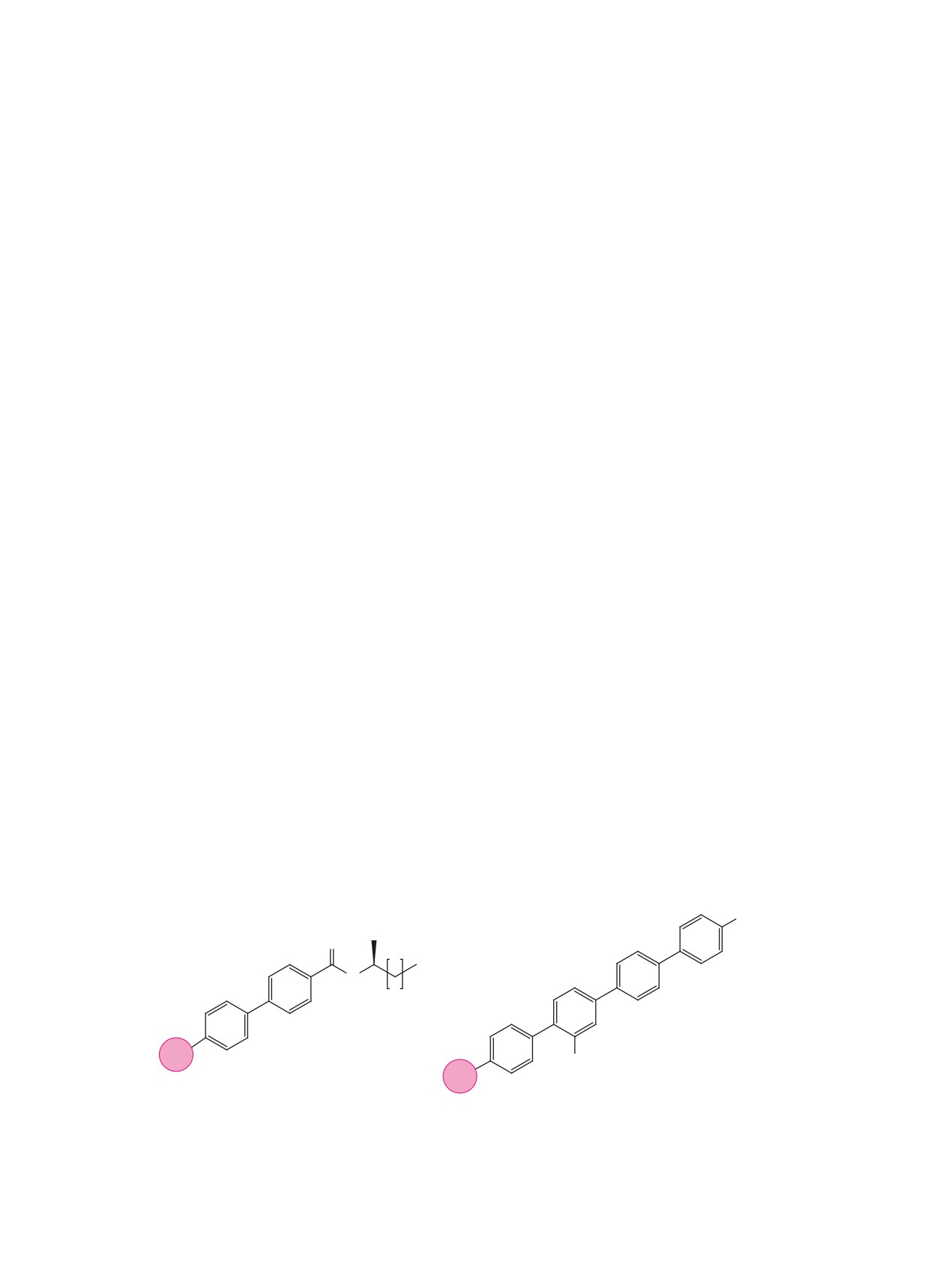
гидроксипроизводных полифениленов, формулы
анизотропных матриц, содержащих функциональ-
которых приведены на рис. 1, и изучение возмож-
ные группы, взаимодействовать с наночастицами
ности их превращения в соответствующие тиолы.
и контролировать их равномерное распределение
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
и места локализации в объеме материала. Так,
например, было показано, что использование по-
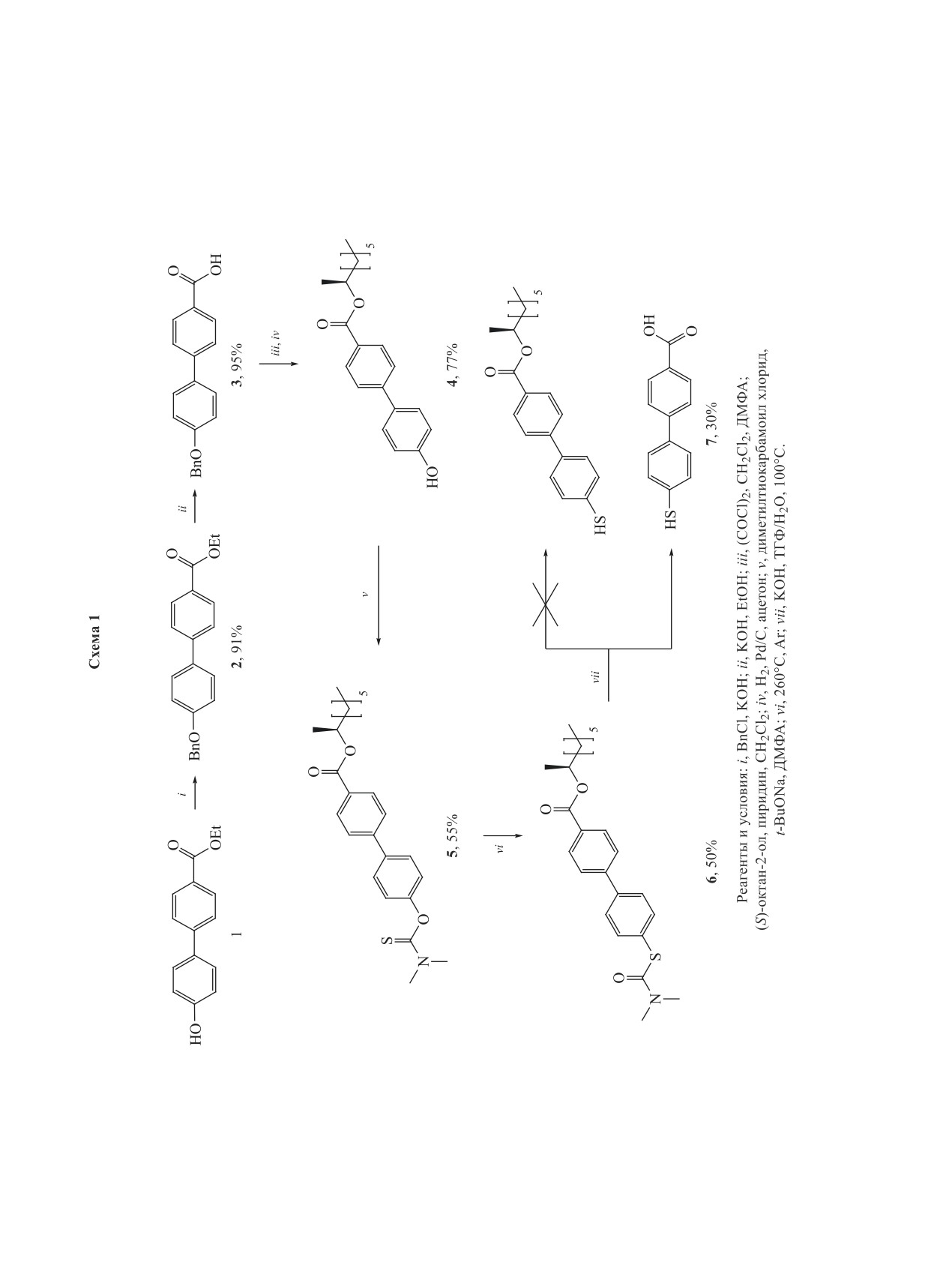
Взаимодействием соединения 1 с бензилхлори-
лифениленов сходного строения как в качестве
дом в щелочной среде был получен его «защищен-
лигандов КТ, так и одновременно ЖК матриц по-
ный» аналог 2 с целью предотвращения нежела-
зволяет внедрить КТ в жидкий кристалл без раз-
тельных превращений фенольной группы в даль-
рушения ЖК фазы и с сохранением термодинами-
нейших реакциях (схема 1). Далее провели гидро-
ческих характеристик фазовых переходов. Кроме
лиз сложноэфирной группы, выделив кислоту 3,
этого, было установлено, что, меняя тип ЖК ма-
из которой синтезировали целевой фенол 4 после-
трицы, природу и количество функциональных
довательными классическими процедурами [15]:
групп, можно понять и выяснить, как структура
на первом этапе получили хлорангидрид, провели
анизотропной среды, природа функциональных
реакцию образования сложноэфирной группы с
групп в молекулах, взаимодействующих с поверх-
(S)-октан-2-олом, и затем реакцией гидрогенолиза
ностью квантовых точек, влияют на свойства на-
сделали доступной фенольную группу для даль-
нокомпозитов на основе КТ и, в частности, селе-
нейших трансформаций.
нида кадмия.
Последовательным прибавлением трет-бу-
В продолжение этих исследований [11, 12],
токсида натрия и диметилтиокарбaмоилхлорида
учитывая их несомненную актуальность и прак-
к раствору фенола 4 в ДМФА было получено со-
тическую значимость, представляло интерес ис-
единение 5. Далее осуществили перегруппировку
пользовать подобные полифенилены (рис. 1) для
Ньюмана-Кварта [16, 17], нагревая тиокарбaмо-
C8H17
O
O
5
HX
Cl
HX
X = O или S.
Рис. 1. Гидрокси- и меркаптопроизводные полифениленов
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
ПРОБЛЕМЫ СИНТЕЗА МЕРКАПТОПРОИЗВОДНЫХ
657
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
658
ФИНЬКО и др.
ильное производное 5 при 260°C в течение 60 ч.
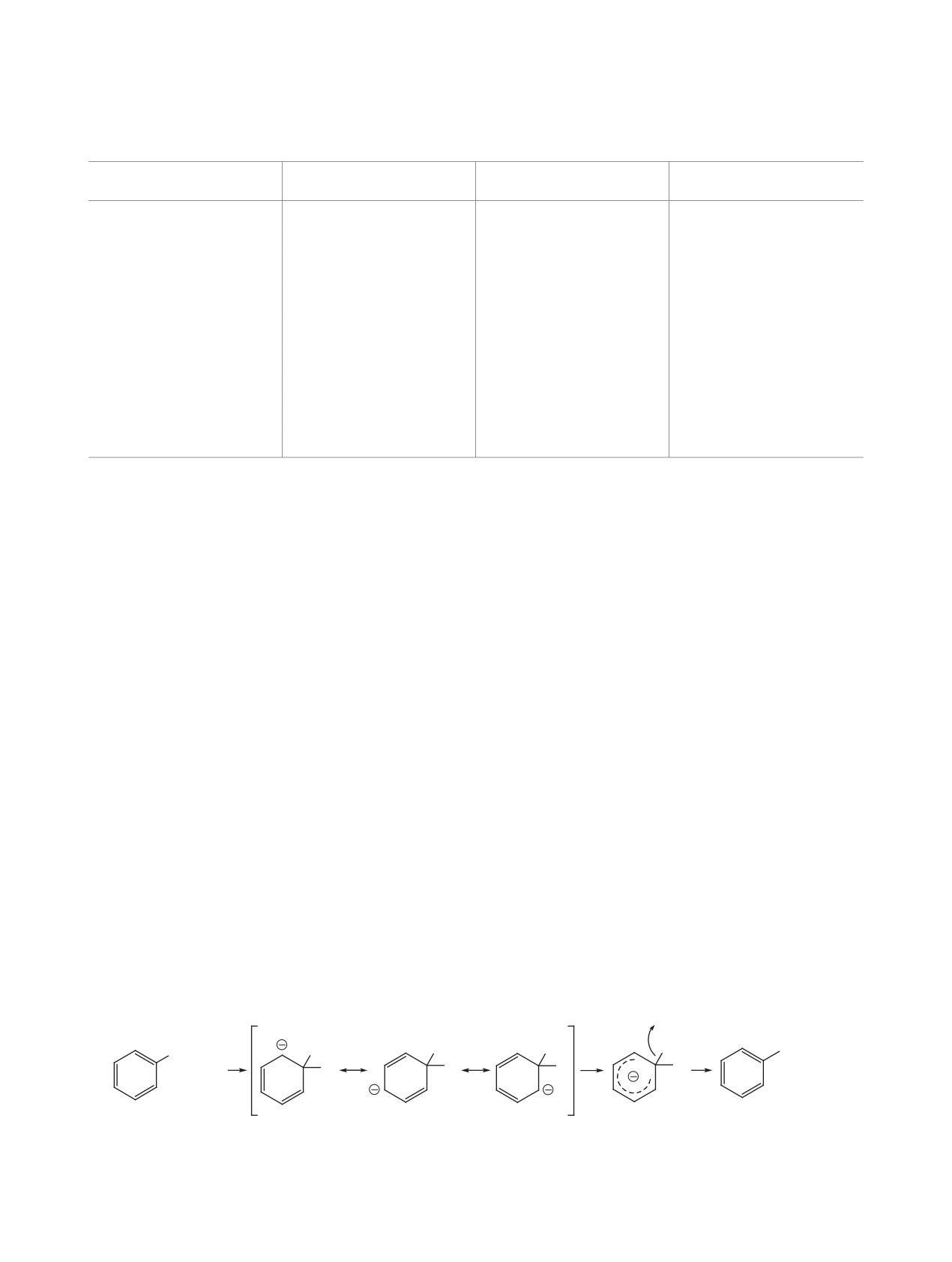
хлора в ароматической системе. Дело в том, что в
Кипячением щелочного водно-органического рас-
условиях реакции постановки диметилтиокарбa-
твора продукта перегруппировки 6 синтезировали
моильной группы также может происходить ну-
меркаптокарбоновую кислоту 7. На данной стадии
клеофильное замещение в ароматическом кольце
произошел незапланированный гидролиз сложно-
по атому хлора (рис. 2).
эфирной группы, однако проведение реакции при
В таком случае в молекуле находятся два ре-
60°С не приводило к конверсии исходного веще-
акционных центра, что делает реакцию неселек-
ства. Использование других оснований (t-BuONa,
тивной, и фенол участвует в двух параллельных,
NaH в ТГФ) для снятия защитной группы с атома
препятствующих друг другу процессах. В реакции
серы при комнатной температуре и при темпера-
нуклеофильного замещения образуется так назы-
туре кипения ТГФ (66°С) не привело к появле-
ваемый комплекс Мейзенгеймера, который огра-
нию каких-либо новых веществ в реакции. Спектр
ничивает атаку по фенольной группе, что суще-
ЯМР 1H совпал с литературными данными [18].
ственно затрудняет конверсию фенола целиком в
Таким образом, условия реакции снятия защитной
необходимый продукт 12.
группы c 6 приводит к гидролизу сложноэфирной
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
группы.
Все исходные реагенты были получены из ком-
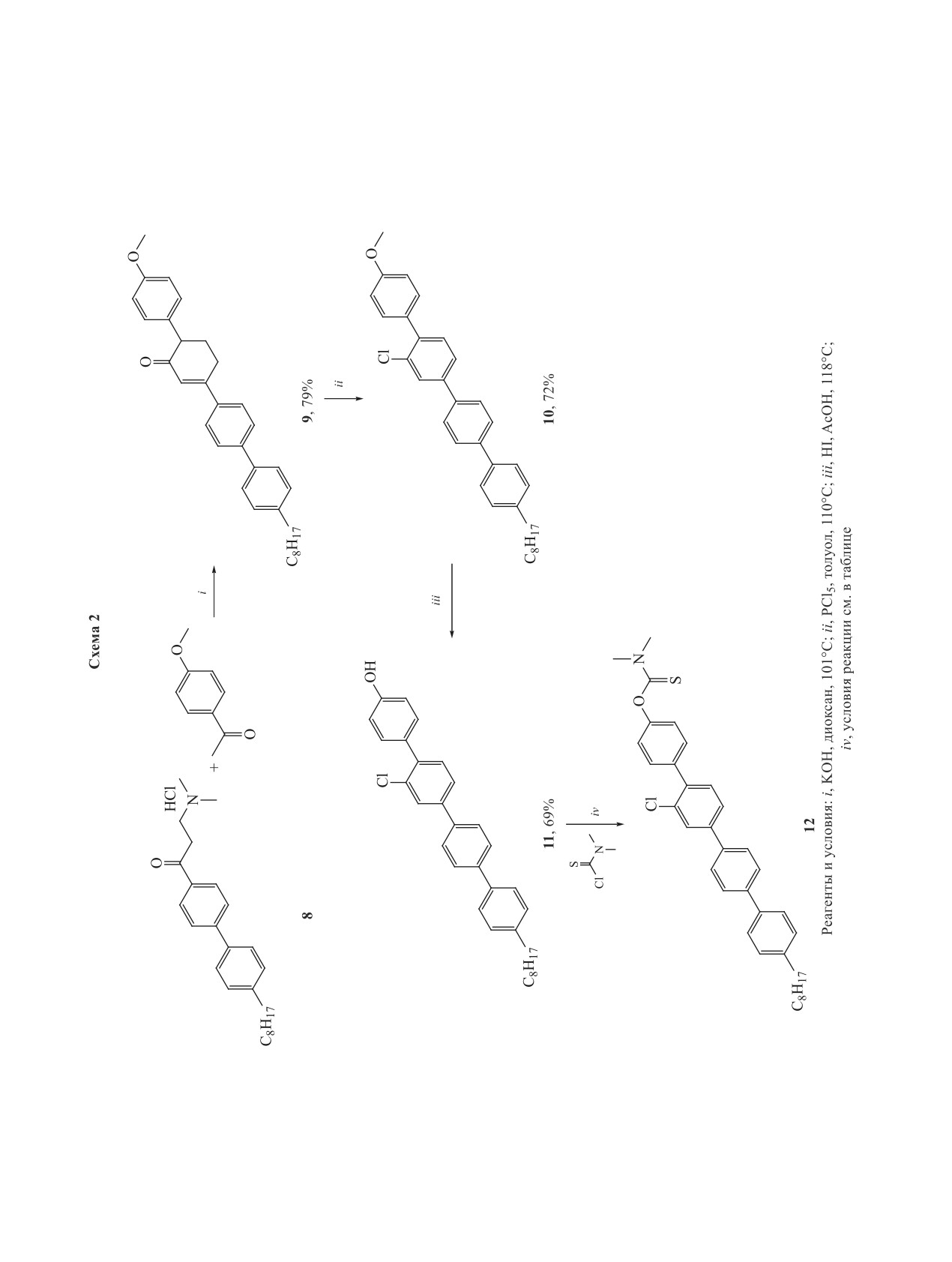
Реакцией конденсации в щелочных усло-
мерческих источников и использованы без допол-
виях было получено соединение 9 (схема
2).
нительной очистки. Контроль хода реакций про-
Последующие ароматизация под действием пен-
водили с помощью тонкослойной хроматографии
тахлорида фосфора и деалкилирование в кипящей
на пластинках Merck Silicagel 60 F254 и Macherey-
уксусной кислоте в присутствии йодистоводород-
Nagel Pre-coated TLC sheets ALUGRAM Xtra SIL
ной кислоты приводят к фенолу 11.
G/UV254 с закрепленным слоем силикагеля с флуо-
Синтез тиокарбaмоильного соединения 12 осу-
ресцентным индикатором. Спектры ЯМР 1Н запи-
ществляли несколькими вариантами. К раствору
сывали на приборах Bruker Avance III HD и Bruker
фенола 11 (см. таблицу, схема 2) добавляли 1.5-эк-
Avance-500 с рабочей частотой 400 и 500 МГц. В
вивалентный избыток основания, перемешивали
качестве растворителя использовали CDCl3
15 мин, и далее добавляли диметилтиокарбaмоил
(δH 7.26, δС 77.0 м.д.) и DMSO-d6 (δH 2.50, δС
хлорид (1.5 экв). Мольные соотношения основа-
39.52 м.д.). Инфракрасные спектры записывали
ния и диметилкарбaмоил хлорида были проварьи-
на приборе Thermo Nicolet iS5 FTIR с 32 сканами
рованы в сторону избытка или недостатка одного
и разрешением 4 см-1 c применением нарушен-
из реагентов, также осуществляли единовремен-
ного полного внутреннего отражения (НПВО).
ную загрузку реагентов, но к полной конверсии
Эксперименты по масс-спектрометрии высокого
исходного фенола данные действия не привели.
разрешения осуществляли с помощью квадру-
поль-времяпролетного масс-спектрометра вы-
Были проведены попытки выделения продук-
сокого разрешения TripleTOF 5600+ (AB Sciex,
та по следующей процедуре: реакционную смесь
Канада), оснащенного источником ионизации
выливали в воду, доводили pH до 7 добавлением
электрораспылением TurboIon Spray и жидкост-
NH4Cl, экстрагировали этилацетатом, упаривали,
ным хроматографом LC-30 «Nexera» (Shimadzu,
очищали методом колоночной хроматографии,
Япония). Вводили по 0.2 мкл образца в поток
элюент CHCl3-MeOH (10:1). Однако в процес-
0.3 мл/мин метанола без хроматографического
се колоночной хроматографии появлялись новые
разделения напрямую в источник ионов.
вещества по ТСХ, что говорит о разложении ком-
Ионизация в режиме электрораспыления в по-
понентов реакционной смеси. Выход целевого со-
ложительном и отрицательном режимах. Режим
единения 12 после колоночной хроматографии со-
сканирования (TOFMS). ВЭЖХ-МС анализ об-
ставил не более 10%.
разцов проводился с использованием жидкост-
Отсутствие полной конверсии мы связываем
ного хроматографа LC-20 Promlinence (Shimadzu,
с наличием в структуре исходного фенола атома
Япония) и квадрупольного хроматомасс-спектро-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
ПРОБЛЕМЫ СИНТЕЗА МЕРКАПТОПРОИЗВОДНЫХ
659
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
660
ФИНЬКО и др.
Подбор условий реакции в синтезе 12
Основание
Температура, °C
Растворитель
Поведение по ТСХa
25
ДМФА
-
DABCO
90
ДМФА
н.к.
25
ДМФА
-
NaH
90
ДМФА
н.к.
90
ДМФА
н.к.
KOH
80
Этилацетат-вода
н.к.
90
ТГФ-вода
н.к.
25
ДМФА
н.к.
t-BuONa
90
ДМФА
н.к.
a «н.к.» - неполная конверсия, «-» -отсутствие продукта
метра LCMS-2020 (Shimadzu, Япония), оснащен-
добавили оксалил хлорид (1.29 мл, 15 ммоль) и
ного источником ионизации электрораспылением
3 капли ДМФА. Смесь кипятили до окончания
ESI. Скорость подачи подвижной фазы 1.0 мл/мин,
выделения газов. Избыток оксалил хлорида и
температура колонки 40°C. Ионизацию аналитов
дихлорметан упарили при пониженном давлении.
проводили в условиях электрораспыления (ESI),
Остаток растворили в дихлорметане (50 мл), доба-
параметры источника: температура нагрева линии
вили пиридин (2.09 мл, 26 ммоль) и (S)-октан-2-
десольватации 250°C, температура нагрева узла
ол (2.06 мл, 13 ммоль). Смесь кипятили в течение
ионизации пробы 400°C, распыляющий и осуша-
24 ч. Окончание реакции контролировали с помо-
ющий газы - 1.5 л/мин, газ-завесы - 15 л/мин, на-
щью ТСХ в системе хлороформ-метанол (10:1).
пряжение на капилляре 4500 В (в отрицательном
Далее реакционную смесь вылили в воду и подкис-
режиме -4500 В). Масс-спектры записывали в
лили 6M соляной кислотой при перемешивании
диапазоне m/z 170-2000, скорость сканирования
до pH 5. Смесь экстрагировали дихлорметаном
1875 мкс. Температуры плавления были опреде-
(3×50 мл), объединенные органические фракции
лены с использованием автоматической системы
сушили над сульфатом натрия и упарили при по-
OptiMelt MPA100 с программируемой темпера-
ниженном давлении. Полученное желтоватое мас-
турной развёрткой от 0.1°C мин-1 до 20°C мин-1 и
ло растворили в ацетоне (50 мл), добавили 10%
пределом измерения 400°C с разрешением 0.1°C.
палладий на угле (0.7 г) и пропускали поток водо-
рода при 40°C. Окончание реакции контролирова-
Этил
4'-(бензилокси)-[1,1'-бифенил]-4-кар-
ли с помощью ТСХ в системе этилацетат-петро-
боксилат (2) и 4'-(бензилокси)-[1,1'-бифенил]-
лейный эфир (1:2). Далее очистили реакционную
4-карбоновая кислота (3) синтезированы соглас-
смесь от катализатора через слой силикагеля под
но литературной методике [15].
пониженным давлением. Фильтрат сконцентриро-
Синтез (R)-1-метилгептил-4'-гидрокси-[1,1'-
вали, остаток перекристаллизовали из смеси ТГФ-
бифенил]-4-карбоксилата (4). К раствору кис-
петролейный эфир (1:10). Выход 3.26 г (77%), т.пл.
лоты (3) (4 г, 13 ммоль) в дихлорметане (50 мл)
85-86°C. ИК спектр (алмаз), ν, см-1: 642, 699, 721,
X
X
X
X
X
Y
Y
Y
Y
+
Y-
Y
+
X-
Рис. 2. Предполагаемый механизм «присоединение - отщепление» по атому хлора.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
ПРОБЛЕМЫ СИНТЕЗА МЕРКАПТОПРОИЗВОДНЫХ
661
775, 817, 921, 834, 995, 1016, 1046, 1060, 1113,
130.1 (2C), 137.9, 144.6, 154.1, 166.2, 187.7. Масс-
1126, 1198, 1227, 1276, 1294, 1355, 1374, 1406,
спектр (FTMS + pESI), m/z: 414.2088 [M + H]+.
1454, 1469, 1497, 1533, 1564, 1588, 1601, 1683,
C24H31NO3S. M 414.2097.
2849, 2874, 2917, 2958, 3349. Спектр ЯМР 1Н
Синтез (S)-1-метилгептил-4'-[(диметилкар-
(400 МГц, CDCl3), δ, м.д.: 0.88 т (3H, СН3, J
бамоил)тио]-[1,1'-бифенил]-4-карбоксилата
6.8 Гц), 1.25-1.45 м (11H, 4CH2 + CH3), 1.58-1.67 м
(6). В колбу Эрленмейера загружали производное
(1H, СН2), 1.72-1.81 м (1H, CH2), 5.14-5.22 м (1H,
диметилтиокарбамоила (5) (374 мг, 0.91 ммоль) в
СН), 5.45 с (1H, ОН), 6.95 д (2Hаром, J 8.6 Гц), 7.52
атмосфере аргона и нагревали до 260°С в течение
д (2Hаром, J 8.6 Гц), 7.61 д (2Hаром, J 8.4 Гц), 8.08
60 ч. Окончание реакции контролировали с помо-
д (2Hаром, J 8.4 Гц). Спектр ЯМР 13С (101 MГц,
щью ТСХ в системе петролейный эфир-этилацетат
CDCl3), δ, м.д.: 20.3, 22.7, 22.8, 25.6, 29.3, 31.9,
(5:1). Желтое масло очищали флэш-хроматографи-
36.2, 72.0, 116.0 (2C), 126.6 (2C), 128.7 (2C), 129.1,
ей на силикагеле, элюент петролейный эфир-эти-
130.2 (2C), 132.8, 145.2, 156.1, 166.5. Масс-спектр
лацетат (6:1). Выход 190 мг (50%), т.пл. 56-57°C.
(FTMS + pESI), m/z: 327.1955 [M + H]+. C21H26O3.
ИК спектр (алмаз), ν, см-1: 560, 654, 685, 699, 721,
M 327.1955.
768, 826, 909, 1005, 1090, 1107, 1204, 1275, 1368,
Синтез (S)-1-метилгептил-4'-[(диметилкар-
1460, 1484, 1608, 1656, 1711, 2858, 2927. Спектр
бамотиоил)окси]-[1,1'-бифенил]-4-карбоксила-
ЯМР 1Н (400 МГц, CDCl3), δ, м.д.: 0.86-0.89 м (3H,
та (5). В колбу Эрленмейера загружали фенол
CH3), 1.26-1.43 м (11H, 4CH2 + CH3), 1.58-1.66 м
(600 мг,
1.84 ммоль), трет-бутоксид натрия
(1H, CH2), 1.71-1.80 м (1H, CH2), 3.05-3.12 м (6H,
(265 мг, 2.76 ммоль) и ДМФА (6 мл, C 0.31 М).
2CH3), 5.17-5.23 м (1H, CH), 7.57-7.76 м (6Hаром),
Смесь перемешивали при комнатной температу-
8.11 д (2Hаром, J 8.0 Гц). Спектр ЯМР 13С (101 MГц,
ре в течение 1 ч. Затем к желтому раствору до-
CDCl3), δ, м.д.: 14.2, 20.3, 22.7, 25.6, 29.3, 29.8,
бавляли диметилтиокарбамоилхлорид
(340 мг,
31.9, 36.2, 37.1, 72.0, 127.2 (2C), 127.9 (2C), 128.9,
2.76 ммоль). Окончание реакции контролирова-
130.17, 130.21 (2C), 136.3 (2C), 141.1, 144.7, 166.2,
ли с помощью ТСХ в системе хлороформ-мета-
166.9. Масс-спектр (FTMS + pESI), m/z: 414.2069
нол (50:1). Через 4 ч раствор разбавляли водой
[M + H]+. C24H31NO3S. M 414.2097.
(200 мл). Смесь экстрагировали этилацетатом
Синтез
4'-меркапто-[1,1'-бифенил]-4-кар-
(3×30 мл), объединенные органические слои про-
боновой кислоты (7). К исходному веществу (6)
мывали насыщенным раствором хлорида натрия
(60 мг, 0.145 ммоль) добавили 1 мл метанола. KOH
(20 мл), сушили над Na2SO4 и удаляли раство-
(16 мг, 0.319 ммоль) растворили в 1 мл H2O и при-
ритель на роторном испарителе. Желтое масло
лили к метанольному раствору. Добавили ТГФ
очищали флэш-хроматографией на силикагеле,
(0.5 мл) для растворения выпавшего осад-
элюент
- петролейный эфир-этилацетат
(8:1).
ка. Нагревали смесь при 100°С в течение 2 ч.
Бесцветное масло перекристаллизовывали из сме-
Окончание реакции контролировали с помощью
си ТГФ-петролейный эфир (1:10) с получением
ТСХ в системе петролейный эфир-этилацетат
продукта в виде белого твердого вещества. Выход
(1:1). Реакционную смесь вылили в воду и под-
420 мг (55%), т.пл. 57-58°C. ИК спектр (алмаз),
кислили 6М раствором HCl до pH 3, далее экстра-
ν, см-1: 702, 732, 776, 839, 1006, 1051, 1102, 1126,
гировали этилацетатом (2×20 мл), объединенные
1141, 1183, 1218, 1283, 1391, 1466, 1491, 1519,
органические слои сушили над Na2SO4 и удаляли
1607, 1710, 2858, 2928, 2955. Спектр ЯМР 1Н (400
растворитель на роторном испарителе. Очищали
МГц, CDCl3), δ, м.д.: 0.87 т (3H, CH3, J 6.8 Гц),
методом колоночной хроматографии (элюент -
1.29-1.43 м (11H, 4CH2 + CH3), 1.58-1.67 м (1H,
этилацетат). Выход 10 мг (30%). Спектр ЯМР 1Н
CH2), 1.71-1.80 м (1H, CH2), 3.38 с (3H, CH3), 3.48
(400 МГц, DMSO-d6), δ, м.д.: 7.40 д (2Hаром, J
с (3H, CH3), 5.17-5.29 м (1H, CH), 7.17 д (2Hаром,
8.4 Гц), 7.62 д (2Hаром, J 8.4 Гц), 7.76 д (2Hаром, J
J 8.6 Гц), 7.63-7.66 м (4Hаром), 8.10 д (2Hаром,
8.4 Гц), 7.99 д (2Hаром, J 8.4 Гц).
J 8.6 Гц). Спектр ЯМР 13С (101 MГц, CDCl3), δ,
м.д.: 14.2, 20.2, 22.7, 25.5, 29.3, 31.9, 36.2, 38.9,
3-(Диметиламино)-1-(4'-октил-[1,1'-бифе-
43.4, 71.9, 123.4 (2C), 127.1 (2C), 128.2 (2C), 129.8,
нил]-4-ил)пропан-1-он гидрохлорид
(8). Син-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
662
ФИНЬКО и др.
тезирован согласно литературной методике [19].
7.0 Гц), 1.23-1.42 м (10Н, 5CН2), 1.66 квинтет (2H,
Спектр ЯМР 1Н (500 МГц, CDCl3), δ, м.д.: 0.89 т
CН2CH2C6H4, J 7.7 Гц), 2.65 т (2H, CH2C6H4, J
(3H, CH3CH2, J 7.0 Гц), 1.43-1.21 м (10Н, 5CН2),
7.8 Гц), 3.86 с (3H, OCH3), 6.98 д (2H, H3, H5, J
1.63 квинтет (2Н, CН2CН2Ar, J 7.7 Гц), 2.62 т (2H,
8.7 Гц), 7.27 д (2H, H3''', H5''', J 8.0 Гц), 7.40 д (1H,
CН2Ar, J 7.7 Гц), 2.87 д [6Н, (CH3)2HN+, J 2.9 Гц],
H6', J 8.0 Гц), 7.44 д (2Hаром, J 8.7 Гц), 7.55 д.д (1H,
3.54-3.65 м (2Н, CH2N), 3.72 т (2Н, CH2CO, J
H5', J 8.0, 1.9 Гц), 7.56 д (2Hаром, J 8.0 Гц), 7.67
7.4 Гц), 7.26 д (2Наром, J 8.1 Гц), 7.55 д (2Наром, J
с (4Hаром), 7.74 д (1H, H3', J 1.9 Гц). Спектр ЯМР
8.1 Гц), 7.66 д (2Н, Н3, Н5, J 8.5 Гц), 8.05 д (2Н, Н2,
13С (126 MГц, CDCl3), δ, м.д.: 14.1, 22.7, 29.3, 29.4,
Н6, J 8.5 Гц), 12.45 с (1H, NH).
29.5, 31.5, 31.9, 35.6, 55.3, 113.5 (2C), 125.3, 126.9
(2C), 127.3 (2C), 127.4 (2C), 128.3, 128.9 (2C), 130.6
Синтез
6-(4-метоксифенил)-3-(4-октилдифе-
(2C), 131.4, 131.7, 133.0, 137.7, 137.9, 138.8, 140.7,
нил-4')циклогекс-2-енона
(9). Смесь
8
(4 г,
140.9, 142.4, 159.2.
0.1
моль),
4-метоксифенилацетона
(1.64
г,
0.11 моль) и (1.4 г, 0.25 моль) КОН кипятили в
Синтез
4'''-октил-2'-хлор-[1,1':4',1'':4'',1'''-
150 мл диоксана в колбе с обратным холодильни-
кватерфенил]-4-ола (11). Кватерфенил 10 (7.25 г,
ком в течение 2.5-3 ч. Реакционную смесь охлаж-
0.015 моль) помещали в 100 мл AcOH и 10 мл 59%
дали, подкисляли 5%-ным раствором серной кис-
иодистоводородной кислоты. Смесь кипятили с
лоты до pH 5-6. Выпавший осадок отфильтровы-
обратным холодильником в течение 25 ч, охлажда-
вали, промывали водой до нейтральной среды, су-
ли до комнатной температуры и выливали в воду.
шили на воздухе, перекристаллизовали из EtOAc.
Продукт экстрагировали DCM (3×50 мл), промы-
Выход 3.7 г (79%), т.пл. 127-128°C. Спектр ЯМР
вали раствором Na2S2O3, водой до нейтральной
среды и сушили над безводным Na2SO4. После
1Н (500 МГц, CDCl3), δ, м.д.: 0.88 т (3Н, CН3CH2, J
7.0 Гц), 1.43-1.22 м (10Н, 5CН2), 1.65 квинтет (2H,
удаления растворителя продукт кристаллизовали
из смеси толуол-гептан. Выход 4.9 г (69%), т.пл.
CН2CH2Ar, J 7.7 Гц), 2.47-2.36 м (2Н, CН2), 2.64 т
155-156°C. ИК спектр (алмаз), ν, см-1: 717, 812,
(2H, CH2Ar, J 7.7 Гц), 2.94-2.87 м (2Н, CН2), 3.65
886, 1002, 1075, 1177, 1250, 1290, 1379, 1441, 1477,
д.д (1Н, Н6, J 10.6, 5.1 Гц), 3.79 с (3H, OМе), 6.64
1520, 1595, 1610, 1681, 2852, 2924, 3028, 2957,
т (1H, H2, J 1.3 Гц), 6.88 д (2Hаром, J 8.8 Гц), 7.12
3361. Спектр ЯМР 1Н (400 МГц, CDCl3), δ, м.д.:
д (2Hаром, J 8.7 Гц), 7.28 д (2Hаром, J 8.0 Гц), 7.54
0.89 т (3Н, CH3CH2, J 6.8 Гц), 1.26-1.34 м (10H,
д (2Hаром, J 8.0 Гц), 7.64 с (4Hаром). Спектр ЯМР
5CН2), 1.62-1.68 м (2H, CH2), 2.66 т (2H, CH2, J
13С (126 MГц, CDCl3), δ, м.д.: 14.1, 22.7, 28.5, 29.2,
7.6 Гц), 6.93 д (2Hаром, J 8.6 Гц), 7.28 д (2Hаром, J
29.4, 29.5, 30.8, 31.4, 31.9, 35.6, 52.1, 55.3, 114.2
8.1 Гц), 7.39-7.42 м (3Hаром), 7.56-7.58 м (3Hаром),
(2C), 125.2, 126.8 (2C), 127.2 (2C), 128.1 (2C), 128.2
7.68 с (4Hаром), 7.74 д (1Hаром, J 1.8 Гц). Спектр
(2C), 129.0 (2C), 131.6, 136.8, 137.3, 142.8, 142.9,
ЯМР 13С (101 MГц, CDCl3), δ, м.д.: 14.3, 22.8, 29.4,
158.5, 159.2, 199.8.
29.5, 29.6, 31.6, 32.0, 35.8, 115.2 (2C), 125.5, 127.0
Синтез
4-метокси-4'''-октил-2'-хлор-[1,1':-
(2C), 127.4 (2C), 127.6 (2C), 128.4, 129.1 (2C), 131.0
4',1'':4'',1''']кватерфенила
(10). Пентахлорид
(2C), 131.7, 131.8, 133.1, 137.9, 138.1, 138.9, 140.8,
фосфора (8.33 г, 0.04 моль) добавляли к раствору 9
141.1, 142.6, 155.5. Жидкостная хроматография с
(14 г, 0.03 моль) в 150 мл толуола. Смесь кипятили
тандемной масс-спектрометрией (ESI/MS), m/z:
с обратным холодильником при перемешивании
467.25 [M - H]-. C32H32ClO-. M 467.22.
около 5 ч, охлаждали до комнатной температуры,
ЗАКЛЮЧЕНИЕ
добавляли 200 мл воды и перемешивали еще 1 ч.
Органический слой отделяли, промывали разбав-
Полученные полифенилены, несмотря на их
ленным раствором NaOH, водой до нейтральной
способность к образованию ЖК фаз, оказались
среды, сушили над безводным Na2SO4 и фильтро-
неэффективны для синтеза тиолов. Анализ полу-
вали через слой силикагеля. Растворитель удаляли.
ченных результатов приводит к выводу о том, что
Полученный продукт кристаллизовали из EtOAc.
для реализации процесса в молекуле гидроксилсо-
Выход 10.5 г (72%), т.пл. 135-138°C. Спектр ЯМР
держащего полифенилена необходимо отсутствие
1Н (500 МГц, CDCl3), δ, м.д.: 0.89 т (3Н, CН3CH2, J
атомов галогенов в ароматической системе, а так-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
ПРОБЛЕМЫ СИНТЕЗА МЕРКАПТОПРОИЗВОДНЫХ
663
же отсутствие функциональных групп, способных
Talroze R.V. Polymer. 2015, 77, 113-121. doi 10.1016/
к разложению при температуре до 260°С и подвер-
j.polymer.2015.09.029
гающихся щелочному гидролизу. На каждой ста-
5.
Rodarte A.L., Cisneros F., Hein J., Ghosh S., Hirst L.S.
дии синтеза необходима оптимизация условий в
Photonics.
2015,
2,
855-864. doi
10.3390/
целях увеличения воспроизводимости методики и
photonics2030855
увеличения выходов целевых соединений.
6.
Cresta V., Romano G., Kolpak A., Zalar B., Domenici V.
Polymers. 2018, 10, 773. doi 10.3390/polym10070773
БЛАГОДАРНОСТИ
7.
Bugakov M., Boiko N., Samokhvalov P., Zhu X.,
Авторы выражают благодарность ком-
Mouller M., Shibaev V. J. Mater. Sci. C. 2019, 7, 4326-
пании Thermo Fisher Scientifiс, лично проф.
4331. doi 10.1039/C9TC00610A
А. Макарову за возможность поведения измере-
8.
Soule E.R., Milette J., Reven L., Rey A.D. Soft Matter.
ний на масс-спектрометре Orbitrap Elite и Центрам
2012, 8, 2860-2866. doi 10.1039/C2SM07091J
коллективного пользования Химического факуль-
9.
Milette J., Cowling S.J., Toader V., Lavigne C.,
тета МГУ и ИНХС РАН.
Saez I.M., Lennox R.B., Goodby J.W., Reven L. Soft
ФОНДОВАЯ ПОДДЕРЖКА
Matter. 2012, 8, 173-179. doi 10.1039/c1sm06604h
Работа выполнена при поддержке проекта РНФ
10.
Mirzaei J., Urbanski M., Yu K., Kitzerow H.-S.,
№ 20-13-00341.
Hegmann T. J. Mater. Chem. 2011, 21, 12710-12716.
doi 10.1039/C1JM11832C
ИНФОРМАЦИЯ ОБ АВТОРАХ
11.
Bezborodov V.S., Finko A.V., Mikhalyonok S.G.,
Финько Александр Валериевич, ORCID: https://
Derikov Y.I., Shandryuk G.A., Kuz’menok N.M.,
orcid.org/0000-0002-1334-9485
Arol A.S., Karpov O.N., Talroze R.V. Liq. Cryst. 2021,
48, 1544-1554. doi 10.1080/02678292.2021.1884912
Саакян Аревик Самвеловна, ORCID: https://
orcid.org/0000-0003-4687-5251
12.
Merekalov A.S., Shandryuk G.A., Bezborodov V.S.,
Otmakhova O.A., Mikhalyonok S.G., Kuz’menok N.M.,
Безбородов Владимир Степанович, ORCID:
Arol A.S., Osipov M.F., Talroze R.V. J. Mol. Liq. 2019,
276, 588-594. doi 10.1016/j.molliq.2018.12.036
Михалёнок Сергей Георгиевич, ORCID: https://
13.
Priscilla P., Malik P., Supreet, Kumar A., Castagna R.,
orcid.org/0000-0002-7433-9889
Singh G. Crit. Rev. Solid State Mater. Sci. 2022, 48,
57-92. doi 10.1080/10408436.2022.2027226
Тальрозе Раиса Викторовна, ORCID: https://
orcid.org/0000-0002-9151-5493
14.
Milette J., Toader V., Soulé E.R., Lennox R.B.,
Rey A.D., Reven L. Langmuir. 2013, 29, 1258-1263.
КОНФЛИКТ ИНТЕРЕСОВ
doi 10.1021/la304189n
Авторы заявляют об отсутствии конфликта ин-
15.
Żurowska M., Filipowicz M., Czerwiński M.,
тересов.
Szala M. Liq. Cryst.
2019,
46,
299-308. doi
10.1080/02678292.2018.1499147
СПИСОК ЛИТЕРАТУРЫ
16.
Newman M.S., Karnes H.A. J. Org. Chem. 1966, 31,
1. Shivakumar U., Mirzaei J., Feng X., Sharma A.,
3980-3984. doi 10.1021/jo01350a023
Moreira P., Hegmann T. Liq. Cryst. 2011, 38, 1495-
1514. doi 10.1080/02678292.2011.605477
17.
Kwart H., Evans E.R. J. Org. Chem. 1966, 31, 410-
413. doi 10.1021/jo01340a015
2. Mundoor H., Park S., Senyuk B., Wensink H.,
Smalyukh I. Science. 2018, 360, 768-771. doi 10.1126/
18.
Faucher A-M., White P.W., Brochu C., Grand-Maît-
science.aap9359
re C., Rancourt J., Fazal G. J. Med. Chem. 2004, 47,
3. Shen Y., Dierking I. Appl. Sci. 2019, 9, 2512. doi
18-21. doi 10.1021/jm034206x
10.3390/app9122512
19.
Sasnouski G., Lapanik V., Bezborodov V., Dabrows-
4. Ezhov A.A., Derikov Y.I., Chernikova E.V., Abram-
ki R., Dziaduszek J. Phase Transit. 2014, 87, 783-789.
chuk S.S., Shandryuk G.A., Merekalov A.S., Panov V.I.,
doi 10.1080/01411594.2014.893341
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023
664
ФИНЬКО и др.
Problems of Synthesis of Mercapto Derivatives
from Corresponding Hydroxy Derivatives of Polyphenylenes
A. V. Finkoa, b, *, A. S. Saakiana, V. S. Bezborodovc, S. G. Mikhalyonokc, and R. V. Talrozeb
a Moscow State University, Faculty of Chemistry, Leninskie gory, 1/3, Moscow, 119991 Russia
b A.V. Topchiev Institute of Petrochemical Synthesis, Russian Academy of Sciences,
Leninsky prosp., 29, Moscow, 199991 Russia
c Belarusian State Technological University, ul. Sverdlova, 13a, Minsk, 220006 Belarus
*e-mail: finko.alexander@gmail.com
Received September 23, 2022; revised October 30, 2022; accepted October 31, 2022
In order to study the possibility of creating new anisotropic nanocomposites based on organic molecules
containing mercapto groups for specific interaction with nanoparticles, the possibility of converting hydroxy
derivatives of polyphenylenes into the corresponding thiols was studied.
Keywords: nanoparticles, anisotropic media, liquid crystals, alcohols, thiols
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 5 2023