ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 6, с. 807-814
УДК 547.517:542.971.2:546.82
СИНТЕЗ НОВЫХ ФЛУОРЕНСОДЕРЖАЩИХ
9-АЗАБИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ
[6π+2π]-ЦИКЛОПРИСОЕДИНЕНИЕМ АЛКИНОВ
К N-КАРБОФЛУОРЕНИЛМЕТОКСИАЗЕПИНУ
© 2023 г. Г. Н. Кадиковаa, *, В. А. Дьяконовb
a Институт нефтехимии и катализа РАН - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
Россия, 450075 Уфа, просп. Октября, 141
b ФГБУН Институт органической химии им. Н.Д. Зелинского РАН, Россия, 119991 Москва, Ленинский просп., 47
*e-mail: Kad.Gulnara@gmail.com
Поступила в редакцию 28.06.2022 г.
После доработки 10.07.2022 г.
Принята к публикации 12.07.2022 г.
Впервые осуществлено каталитическое [6π+2π]-циклоприсоединение терминальных алкинов к
N-карбофлуоренилметоксиазепину под действием новой трехкомпонентной каталитической системы
Co(acac)2(dppe)/Zn/ZnI2 c получением ранее неописанных и перспективных 9-азабицикло[4.2.1]нона-
2,4,7-триенов (с выходами 79-92%), содержащих флуореновый заместитель.
Ключевые слова: циклоприсоединение, N-карбофлуоренилметоксиазепин, алкины, 9-азабицикло[4.2.1]-
нона-2,4,7-триены, ацетилацетонат кобальта(II)
DOI: 10.31857/S0514749223060101, EDN: FBLLFB
ВВЕДЕНИЕ
Одним из доступных и эффективных методов
синтеза 9-азабицикло[4.2.1]нонанов являются ре-
Синтез мостиковых гетероциклов гомотропа-
акции циклоприсоединения N-замещенных азепи-
нового ряда (9-азабицикло[4.2.1]нонаны) на протя-
нов с участием комплексов переходных металлов
жении нескольких десятилетий остается актуаль-
(схема 1) [25]. В мировой литературе известны
ным и интенсивно развивающимся направлением
главным образом работы по фотоиндуцирован-
в области органической химии [1-6]. Наиболее
ной циклосодимеризации трикарбонил(η6-N-кар-
известные соединения с 9-азабицикло[4.2.1]нона-
боалкоксиазепин)хрома(0)
[26-31] и трикарбо-
новым остовом формируют группу важных при-
нил(η6-N-цианоазепин)хрома(0) [32] с алкенами,
родных и синтетических алкалоидов, например,
1,3-диенами и алкинами. Каталитические вариан-
анатоксин-a [5, 7-10], пиннамин [10-12], бис-го-
ты данных превращений изучены в гораздо мень-
моэпибатидин [13, 14], UB-165 [15-21] (см. рису-
шей степени и представлены двумя примерами
нок), обладающих уникальным фармакологиче-
ским профилем [22].
по Cr(0)-катализируемому циклоприсоединению
этилакрилата к N-карбометоксиазепину
[29] и
Указанные гомотропановые алкалоиды активно
N-карбоэтоксиазепину [33] (схема 1).
исследуются учеными как модели для разработки
инновационных лекарственных препаратов против
Ранее [34-38] нами впервые показано, что ко-
болезней Паркинсона, Альцгеймера, шизофрении
бальт(I)-катализируемое [6π+2π] циклоприсоеди-
и депрессии, вызванных дисбалансом нейромеди-
нение алкинов,
1,3-диинов и
1,2-диенов к
аторов [4, 16-24].
N-карбоэтокси-, фенокси- и холестероксиазепи-
807
808
КАДИКОВА, ДЬЯКОНОВ
H
H
H
N
N
N
COMe
COEt
COMe
Ⱥɧɚɬɨɤɫɢɧ ɚ
Ƚɨɦɨɚɧɚɬɨɤɫɢɧ
Ƚɢɞɪɨɤɫɬɚɧɚɬɨɤɫɢɧ ɚ
H
H
H
N Cl
O Et
Cl
N
N
N
N
O
Ȼɢɫ ɝɨɦɨɷɩɢɛɚɬɢɞɢɧ
ɉɢɧɧɚɦɢɧ
8%
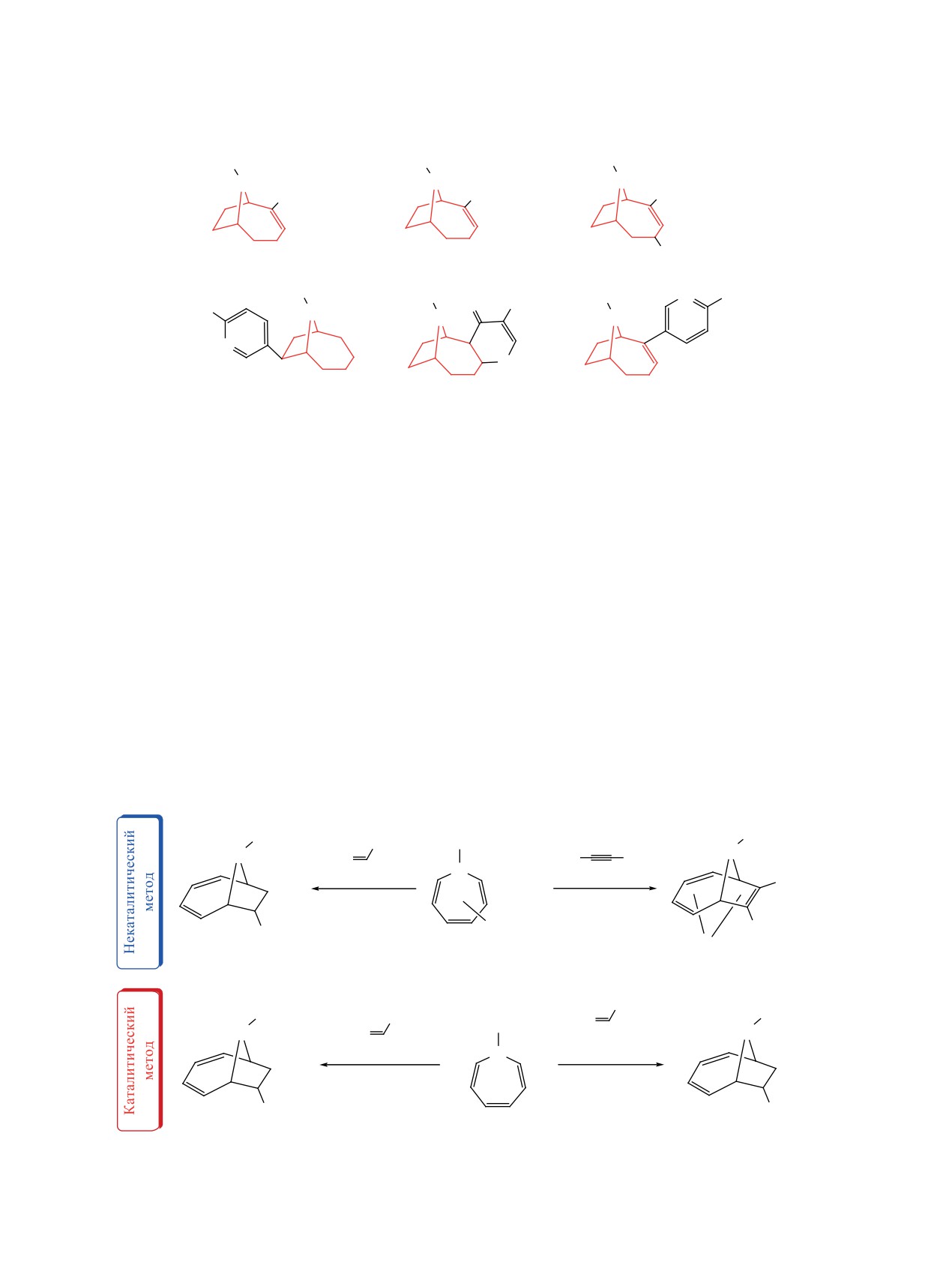
Азациклические соединения, содержащие 9-азабицикло[4.2.1]нонановый остов
нам приводит к образованию практически важных
активных гетерофункциональных соединений с
9-азабицикло[4.2.1]нонади(три)енов (схема
2).
9-азабицикло[4.2.1]нонановым остовом, содержа-
Одновременно была обнаружена высокая проти-
щим флуореновый заместитель, с использовани-
воопухолевая активность in vitro ряда получен-
ем реакции каталитической циклосодимеризации
ных азабициклов в отношении различных линий
N-карбофлуоренилметоксиазепина с алкинами
опухолевых клеток [34-36]. Таким образом, мы
(схема 2).
показали, что 9-азабицикло[4.2.1]нонади(три)ены
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
представляют интерес в качестве потенциальных
Первоначально осуществили синтез исходно-
противоопухолевых агентов в лечении онкологи-
го мономера для реакции циклосодимеризации,
ческих заболеваний.
N-карбофлуоренилметоксиазепина. Важно от-
С другой стороны, в работах авторов [39-43]
метить, что данный N-замещенный азепин был
сообщается, что выраженным противоопухоле-
получен нами впервые на основе реакции термо-
вым действием обладают производные флуоре-
лиза азидоформиатов в бензоле. Так, в результате
на. Поэтому в настоящей работе мы поставили
термолиза 9-флуоренилметилазидоформиата 1 в
перед собой задачу синтеза новых биологически
бензоле (125°С, 2 ч, автоклав) образуется целе-
Схема 1
R
CO2Me
CO2Et
R
N
N
H2C
R'
R'
hv
N
hv
R'
[26]
R = CO2Et [31]
R = CN [32]
Cr(CO)3
R'
CO2Et
Cr(CO)3
CO2Et
CO2Me
CO2Et
CO2Et
H2C
CO2R
N
H2C
N
Resin-based
NpCr(CO)3
[Cr] catalyst
N
Np = naphthalene
[33]
[29]
CO2Et
CO2Et
R = Me, Et.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 6 2023
СИНТЕЗ НОВЫХ ФЛУОРЕНСОДЕРЖАЩИХ 9-АЗАБИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ
809
Схема 2
ɇɚɲɢ ɩɪɟɞɵɞɭɳɢɟ ɪɚɛɨɬɵ
R2
CO2R1
H2C
·
CO2R1
N
R3
CO2R1
R2
R3
N
Co(acac)2(dppe)/Zn/ZnI2
Co(acac)2(dppe)/Zn/ZnI2
N
R2
[35, 38]
[34, 36, 37]
R2
R3
R3
R = Et, Ph
cholesteryl.
ɗɬɚ ɪɚɛɨɬɚ
O
HC
R
C
Co(acac)2(dppe)/Zn/ZnI2
O O
N O
C
N
R
ɉɟɪɜɵɣ ɩɪɢɦɟɪ ɫɢɧɬɟɡɚ N ɤɚɪ
ɉɟɪɜɵɣ ɩɪɢɦɟɪ ɤɚɬɚɥɢɬɢɱɟɫɤɨɝɨ
ɛɨɮɥɭɨɪɟɧɢɥɦɟɬɨɤɫɢɚɡɟɩɢɧɚ
ɰɢɤɥɨɩɪɢɫɨɟɞɢɧɟɧɢɹ ɚɥɤɢɧɨɜ ɤ N-
ɤɚɪɛɨɮɥɭɨɪɟɧɢɥɦɟɬɨɤɫɢɚɡɟɩɢɧɭ
вой N-карбофлуоренилметоксиазепин 2 с выходом
нием замещенных 9-азабицикло[4.2.1]нона-2,4,7-
78% (схема 3).
триенов 4a-e с выходами 79-92%. Аддукты фор-
мируются в виде двух N-(CO)OFm-ротамеров [34-
Получив исходный мономер, мы изучи-
38] в соотношении 1:1, возникающих в результате
ли реакции циклоприсоединения алкинов к
ограниченного вращения заместителя вокруг CN-
N-карбофлуоренилметоксиазепину. Установлено,
связи (схема 4).
что N-карбофлуоренилметоксиазепин 2 вступает
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
в реакцию [6π+2π] циклоприсоединения с тер-
минальными алкинами 3a-e под действием ка-
Хроматографический анализ проводили на
талитической системы Co(acac)2(dppe)/Zn/ZnI2
приборе Shimadzu GC-9A, колонка 2000×2 мм,
[44-49] в разработанных условиях [10 мол %
неподвижная фаза
- силикон SE-30
(5%) на
Co(acac)2(dppe), 30 мол % Zn, 20 мол % ZnI2,
Сhromaton N-AW-HMDS (0.125-0.160 мм), газ-но-
1,2-дихлорэтан (C2H4Cl2), 20 ч, 60°С] с образова-
ситель - гелий (30 мл/мин), при программирова-
Схема 3
125°C, 2 ɱ
O O
+
C
O O
78%
C
N
N3
1
2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 6 2023
810
КАДИКОВА, ДЬЯКОНОВ
Схема 4
O
Co(acac)2(dppe)/Zn/ZnI2
C
O
C2H4Cl2, 60°C, 20 ɱ
N
2
+ HC
R
79-92%
3a-e
R
4a-e
4, R = Bu (a
ɋ+2)3CN (b, 85%), (CH2)4OH (c, 88%), ɩ-FPh (d, 79%), 2-phthalimidoethyl (e, 81%).
нии температуры от 50 до 300°С со скоростью 8°С/
(2С), 127.14 (2С), 127.85 (2С), 129.70, 130.52 (2С),
мин. Спектры ЯМР 1Н и 13С записаны в CDCl3 на
131.14, 141.34 (2C), 143.70 (2C), 153.29. Масс-
спектрометре «Bruker Avance-500» (125 MГц для
спектр (HRMS, ESI-TOF), m/z: 338.1057 [M + Na]+.
13C и 500 MГц для 1H), химические сдвиги даны
C21H17NO2Na. [M + Na]+ 338.1157.
относительно SiMe4. Масс-спектры высокого раз-
Циклоприсоединение алкинов к N-карбо-
решения (HRMS) измеряли на приборе («MaXis
флуоренилметоксиазепину (общая методика).
Impact», Bruker) с использованием времяпро-
В сосуд Шленка в атмосфере сухого аргона по-
летного масс-анализатора (TOF) с ионизацией
следовательно загружали 1,2-дихлорэтан (1.5 мл),
электрораспылением (ESI). Реакции каталитиче-
Co(acac)2(dppe) (0.066 г, 0.1 ммоль) и порошок
ского циклоприсоединения проводили в токе су-
металлического цинка (0.020 г, 0.3 ммоль). Смесь
хого аргона. Бензол сушили над металлическим
перемешивалась при комнатной температуре
натрием. 1,2-Дихлорэтан перегоняли над P2O5.
2 мин. Затем к смеси последовательно добави-
Использовали коммерчески доступные реагенты
ли N-карбофлуоренилметоксиазепин
(0.315 г,
Acros и Aldrich. 9-Флуоренилметилазидоформиат
1.0 ммоль), алкин (1.5 ммоль) в 1,2-дихлорэтане
и Co(acac)2(dppe) синтезированы по методикам,
(1.5 мл) и сухой ZnI2 (0.064 г, 0.2 ммоль). После
описанным в литературе [50, 51].
нагревания при 60°C в течение 20 ч реакцион-
Синтез N-карбофлуоренилметоксиазепина.
ную смесь фильтровали через короткий слой ок-
Раствор 1.33 г (5 ммоль) 9-флуоренилметилази-
сида алюминия, легкие растворители удаляли
доформиата в 106 мл сухого бензола нагревали
под вакуумом. Остаток хроматографировали на
при перемешивании в автоклаве в течение 2 ч при
колонке, заполненной силикагелем (петролейный
125°С в условиях автогенного давления. Затем
эфир → петролейный эфир-этилацетат, 15:1 →
охлажденную реакционную смесь концентриро-
10:1 → 5:1).
вали с помощью ротационного испарителя RV 10
(9H-Флуорен-9-ил)метил 7-бутил-9-азабици-
digital V. Остаток хроматографировали на колонке,
кло[4.2.1]нона-2,4,7-триен-9-карбоксилат
(4a).
заполненной силикагелем (петролейный эфир →
Выход 0.365 г (92%). Вязкое вещество бледно-
петролейный эфир-этилацетат, 30:1 → 20:1 →
желтого цвета, существует в виде двух ротамеров
15:1).
N-(CO)OFm. Спектр ЯМР 1Н, δ, м.д.: 0.90-1.01
N-Карбофлуоренилметоксиазепин (2). Выход
м (6H, 2СН3), 1.30-1.42 м (4H, 2СН2), 1.44-1.54
1.23 г (78%). Кристаллическое вещество желтова-
м (4H, 2СН2), 2.14-2.27 м (4H, 2СН2), 4.22-4.29
того цвета, т.пл. 89-90°С. Спектр ЯМР 1Н, δ, м.д.:
м (2H, 2СН), 4.33-4.40 м (2H, СН2), 4.46-4.52 м
4.32 т (1H, СН, J 7.4 Гц), 4.49 д (2H, СН2, J 7.4 Гц),
(2H, СН2), 4.76 д (1H, СН, J 3.7 Гц), 4.86 д (1H,
5.66 д (2H, 2СН, J 9.0 Гц), 5.96 дд (2H, 2СН, J 22.0,
СН, J 4.0 Гц), 4.91 д (1H, СН, J 5.1 Гц), 5.03 д (1H,
7.2 Гц), 6.18 т (2H, 2СН, J 3.0 Гц), 7.35 т (2H, 2СН, J
СН, J 5.2 Гц), 5.21-5.27 м (2H, 2СН), 5.85-6.02
7.5 Гц), 7.45 т (2H, 2СН, J 7.5 Гц), 7.63 д (2H, 2СН,
м (4H, 4СН), 6.17-6.25 м (2H, 2СН), 6.32-6.41 м
J 7.5 Гц), 7.81 д (2H, 2СН, J 7.6 Гц). Спектр ЯМР
(2H, 2СН), 7.33-7.39 м (4H, 4СН), 7.41-7.47 м (4H,
13С, δ, м.д.: 47.04, 68.09, 120.07 (3С), 120.22, 125.20
4СН), 7.65 д.д (4H, 4СН, J 13.9, 4.5 Гц), 7.80 д.д
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 6 2023
СИНТЕЗ НОВЫХ ФЛУОРЕНСОДЕРЖАЩИХ 9-АЗАБИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ
811
(4H, 4СН, J 7.5, 4.1 Гц). Спектр ЯМР 13С, δ, м.д.:
(4H, 4СН, J 7.2, 2.8 Гц). Спектр ЯМР 13С, δ, м.д.:
13.91, 13.95, 22.38, 22.39, 26.35, 26.42, 30.32 (2C),
24.35, 24.39, 26.37, 26.46, 32.23 (2C), 47.34, 47.38,
47.40, 47.43, 60.35, 60.42, 62.37 (2C), 66.90, 66.96,
60.32, 60.39, 62.30 (2С), 62.48 (2С), 66.92, 66.97,
115.32, 115.72, 119.93 (4С), 123.70 (2C), 124.75,
115.53, 115.95, 119.92 (4С), 123.71 (2C), 124.83 (2C),
124.78, 125.12, 125.16, 125.20 (2C), 127.01 (4С),
125.07, 125.11, 125.15 (2С), 127.00 (4С), 127.63
127.63 (4С), 137.42, 137.79, 137.98, 138.12 (2С),
(4С), 136.90, 137.27, 137.81, 137.94, 138.01, 138.18,
138.28, 141.39 (4C), 144.17 (4C), 153.33 (2C). Масс-
141.36 (4C), 144.10 (3C), 144.14, 153.33 (2C). Масс-
спектр (HRMS, ESI-TOF), m/z: 420.1934 [M + Na]+.
спектр (HRMS, ESI-TOF), m/z: 436.1883 [M + Na]+.
C27H27NO2Na. [M + Na]+ 420.1939.
C27H27NO3Na. [M + Na]+ 436.1889.
(9H-Флуорен-9-ил)метил 7-(3-цианопропил)-
(9H-Флуорен-9-ил)метил
7-(4-фторфенил)-
9-азабицикло[4.2.1]нона-2,4,7-триен-9-карбок-
9-азабицикло[4.2.1]нона-2,4,7-триен-9-карбок-
силат (4b). Выход 0.347 г (85%). Бледно-желтое
силат (4d). Выход 0.344 г (79%). Бледно-желтое
кристаллическое вещество, т.пл. 125-126°С, суще-
кристаллическое вещество, т.пл. 104-105°С, суще-
ствует в виде двух ротамеров N-(CO)OFm. Спектр
ствует в виде двух ротамеров N-(CO)OFm. Спектр
ЯМР 1Н, δ, м.д.: 1.78-1.87 м (4H, 2СН2), 2.28-2.41
ЯМР 1Н, δ, м.д.: 4.26 д.т (2H, 2СН, J 19.5, 6.6 Гц),
м (8H, 4СН2), 4.22 к (2H, 2СН, J 6.8 Гц), 4.32-4.38
4.37-4.43 м (2H, 2СН), 4.48-4.55 м (2H, 2СН), 4.91
м (2H, СН2), 4.43-4.53 м (2H, СН2), 4.72 д.д (1H,
д.д (1H, СН, J 5.2, 2.6 Гц), 5.03 д.д (1H, СН, J 5.3,
СН, J 5.1, 2.2 Гц), 4.80 д (1H, СН, J 5.2 Гц), 4.84 д.д
2.5 Гц), 5.42 д (1H, СН, J 5.2 Гц), 5.58 д (1H, СН, J
(1H, СН, J 5.1, 2.1 Гц), 4.96 д (1H, СН, J 5.2 Гц),
5.2 Гц), 5.83 д.д (2H, 2СН, J 10.0, 2.5 Гц), 5.86-6.00
5.29 с (2H, 2СН), 5.83-5.95 м (3H, 3СН), 5.99 д.д
м (4H, 4СН), 6.17-6.25 м (2H, 2СН), 6.35-6.42 м
(1H, СН, J 11.0, 7.6 Гц), 6.07-6.13 м (1H, СН), 6.17
(2H, 2СН), 7.05 к (4H, 4СН, J 8.6 Гц), 7.31-7.47
д.д (1H, СН, J 11.0, 5.2 Гц), 6.28-6.37 м (2H, 2СН),
м (12H, 12СН), 7.59-7.67 м (4H, 4СН), 7.80 д.д
7.31-7.37 м (4H, 4СН), 7.43 д.д (4H, 4СН, J 12.8,
(4H, 4СН, J 7.5, 3.6 Гц). Спектр ЯМР 13С, δ, м.д.:
7.1 Гц), 7.57-7.63 м (4H, 4СН), 7.79 д.д (4H, 4СН, J
47.34, 47.38, 60.79, 60.87, 60.99, 61.05, 66.98, 67.12,
7.3, 4.8 Гц). Спектр ЯМР 13С, δ, м.д.: 16.34, 16.37,
115.24, 115.43, 115.61 (2С), 115.78 (2С), 119.93
24.06 (2С), 25.49, 25.54, 47.32, 47.38, 60.25, 60.33,
(4С),
124.31
(2C), 125.03,
125.14
(5С),
127.03
62.04, 62.11, 66.90 (2С), 116.87, 117.48, 119.23 (2С),
(4С), 127.66 (4С), 128.45 (2С), 128.52 (2С), 133.93,
119.93 (4С), 123.84 (2C), 125.01 (2С), 125.10 (2С),
134.37, 136.80, 137.00, 138.22, 138.39, 141.40 (4C),
125.24, 125.27, 127.01 (4С), 127.65 (4С), 134.05,
144.05 (4C), 153.32 (2C), 162.31 (2С, J 247.0 Гц).
134.45, 137.32, 137.44, 137.97, 138.12, 141.38 (4C),
Масс-спектр (HRMS, ESI-TOF), m/z: 458.1524 [M +
144.04
(4C),
153.22
(2C). Масс-спектр (HRMS,
Na]+. C29H22FNO2Na. [M + Na]+ 458.1532.
ESI-TOF), m/z: 431.1750 [M + Na]+. C27H24N2O2Na.
(9H-Флуорен-9-ил)метил 7-[2-(1,3-диоксоизо-
[M + Na]+ 431.1735.
индолин-2-ил)этил]-9-азабицикло[4.2.1]нона-
(9H-Флуорен-9-ил)метил
7-(4-гидроксибу-
2,4,7-триен-9-карбоксилат (4e). Выход 0.416 г
тил)-9-азабицикло[4.2.1]нона-2,4,7-триен-9-
(81%). Вязкое вещество бледно-желтого цве-
карбоксилат (4c). Выход 0.363 г (88%). Вязкое ве-
та, существует в виде двух ротамеров N-(CO)
щество бледно-желтого цвета, существует в виде
OFm. Спектр ЯМР 1Н, δ, м.д.: 2.56-2.71 м (4H,
двух ротамеров N-(CO)OFm. Спектр ЯМР 1Н, δ,
2СН2), 3.75-3.94 м (4H, 2СН2), 4.17-4.25 м (2H,
м.д.: 1.57 c (8H, 4СН2), 2.21 д (4H, 2СН2, J 5.7 Гц),
2СН), 4.29-4.37 м (2H, СН2), 4.39-4.45 м (2H,
3.61-3.69 м (4H, 2СН2), 4.19-4.26 м (2H, 2СН), 4.33
СН2), 4.71 д (1H, СН, J 3.8 Гц), 4.81 д (1H, СН, J
д.д (1H, СН, J 10.4, 6.7 Гц), 4.46 т.д (1H, СН, J 10.4,
4.5 Гц), 4.97 д (1H, СН, J 5.2 Гц), 5.03 д (1H, СН,
7.0 Гц), 4.72 д (1H, СН, J 3.4 Гц), 4.83 д (1H, СН, J
J 5.2 Гц), 5.36 с (2H, 2СН), 5.69-5.86 м (4H, 4СН),
3.3 Гц), 4.87 д (1H, СН, J 5.0 Гц), 4.98 д (1H, СН,
6.09-6.20 м (2H, 2СН), 6.26-6.33 м (2H, 2СН),
J 5.1 Гц), 5.23 д (2H, 2СН, J 5.6 Гц), 5.81-5.99 м
7.27-7.37 м (4H, 4СН), 7.38-7.44 м (4H, 4СН),
(4H, 4СН), 6.13-6.21 м (4H, 4СН), 6.28-6.37 м (4H,
7.55-7.65 м (4H, 4СН), 7.69-7.80 м (8H, 8СН), 7.84
4СН), 7.30-7.36 м (4H, 4СН), 7.42 т (4H, 4СН, J
т.д (4H, 4СН, J 5.7, 3.0 Гц). Спектр ЯМР 13С, δ,
7.2 Гц), 7.61 д.д (4H, 4СН, J 11.9, 7.4 Гц), 7.78 д.д
м.д.: 25.30, 25.37, 36.35, 36.42, 47.31, 47.35, 60.37,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 6 2023
812
КАДИКОВА, ДЬЯКОНОВ
60.45, 62.07, 62.25, 66.85, 67.05, 117.15, 117.33,
3. Ferguson J.R., Lumbard K.W., Scheinmann F.,
119.90 (4С), 123.23 (2C), 123.24 (2С), 123.77 (2С),
Stachulski A.V., Stjernlöf P., Sundell S. Tetrahedron
Lett.
1995,
36,
8867-8870. doi
10.1016/0040-
125.05, 125.12, 125.20 (2С), 125.24, 125.29, 126.97
4039(95)01842-6
(2С), 127.03 (2С), 127.61 (4С), 132.02 (4С), 132.14,
132.49, 133.99 (2С), 134.02 (2С), 137.37, 137.48,
4. Gohlke H., Gundisch D., Schwarz S., Seitz G., Tilot-
ta M.C., Wegge T. J. Med. Chem. 2002, 45, 1064-1072.
137.73, 137.94, 141.34 (4С), 144.06 (2C), 144.14
doi 10.1021/jm010936y
(2C), 153.17, 153.28,
168.12
(2С),
168.15
(2С).
Масс-спектр (HRMS, ESI-TOF), m/z:
537.1781
5. Brenneman J.B., Martin S.F. Org. Lett. 2004, 6, 1329-
1331. doi 10.1021/ol049631e
[M + Na]+. C33H26N2O4Na. [M + Na]+ 537.1790.
6. Hemming K., Gorman P.A.O., Page M.I. Tetra-
ЗАКЛЮЧЕНИЕ
hedron Lett.
2006,
47,
425-428. doi
10.1016/
Впервые осуществлен синтез N-карбофлуоре-
j.tetlet.2005.11.081
нилметоксиазепина и изучены его реакции [6π+2π] -
7. Mansell H.L. Tetrahedron. 1996, 52, 6025-6061. doi
циклоприсоединения с терминальными алкинами
10.1016/0040-4020(95)01076-9
под действием трехкомпонентной каталитической
8. Devlin J.P., Edwards O.E., Gorham P.R., Hunter N.R.,
системы Co(acac)2(dppe)/Zn/ZnI2 c получением
Pike R.K., Stavric B. Can. J. Chem. 1977, 55, 1367-
флуоренил-замещенных 9-азабицикло[4.2.1]нона-
1371. doi 10.1139/v77-189
2,4,7-триенов с высокими выходами (79-92%).
9. Parsons P.J., Camp N.P., Edwards N., Sumoreeah L.R.
Синтезированные мостиковые азабициклические
Tetrahedron. 2000, 56, 309-315. doi 10.1016/S0040-
соединения могут быть использованы в качестве
4020(99)00909-6
ключевых прекурсоров в направленном поиске и
10. Hjelmgaard T., Søtofte I., Tanner D. J. Org. Chem.
разработке новых лекарственных соединений и
2005, 70, 5688-5697. doi 10.1021/jo0506682
других практически значимых соединений.
11. Takada N., Iwatsuki M., Suenaga K., Uemura D.
Tetrahedron Lett. 2000, 41, 6425-6428. doi 10.1016/
БЛАГОДАРНОСТИ
S0040-4039(00)00931-X
Структурные исследования проведены в
12. Kigoshi H., Hayashi N., Uemura D. Tetrahedron
Региональном Центре коллективного пользования
Lett.
2001,
42,
7469-7471. doi
10.1016/S0040-
«Агидель» УФИЦ РАН, Отделение - Институт не-
4039(01)01583-0
фтехимии и катализа УФИЦ РАН.
13. Malpass J.R., Hemmings D.A., Wallis A.L. Tetrahed-
ФОНДОВАЯ ПОДДЕРЖКА
ron Lett. 1996, 37, 3911-3914. doi 10.1016/0040-
4039(96)00687-9
Работа выполнена по теме государственного за-
14. Malpass J.R., Hemmings D.A., Wallis A.L., Flet-
дания (FMRS-2022-0075).
cher S.R., Patel S. J. Chem. Soc., Perkin Trans. 1.
ИНФОРМАЦИЯ ОБ АВТОРАХ
2001, 1044-1050. doi 10.1039/B010178H
Кадикова Гульнара Назифовна, ORCID: https://
15. Kanne D.B., Ashworth D.J., Cheng M.T., Mutter L.C.,
Abood L.G. J. Am. Chem. Soc. 1986, 108, 7864-7865.
orcid.org/0000-0003-1020-7606
doi 10.1021/ja00284a078
Дьяконов Владимир Анатольевич, ORCID:
16. Sharples C.G.V., Karig G., Simpson G.L., Spencer J.A.,
Wright E., Millar N.S., Wonnacott S., Gallagher T.
КОНФЛИКТ ИНТЕРЕСОВ
J. Med. Chem. 2002, 45, 3235-3245. doi 10.1021/
jm020814l
Авторы заявляют об отсутствии конфликта ин-
17. Wright E., Gallagher T., Sharples C.G.V., Wonna-
тересов.
cott S. Bioorg. Med. Chem. Lett. 1997, 7, 2867-2870.
СПИСОК ЛИТЕРАТУРЫ
doi 10.1016/S0960-894X(97)10090-7
1. Anastassiou A.G., Cellura R.P. J. Org. Chem. 1972, 37,
18. Sutherland A., Gallagher T., Sharples C.G.V., Won-
3126-3129. doi 10.1021/jo00985a019
nacott S. J. Org. Chem. 2003, 68, 2475-2478. doi
10.1021/jo026698b
2. Barluenga J., Pérez-Prieto J., Bayón A.M., Asensio G.
Tetrahedron. 1984, 40, 1199-1204. doi 10.1016/S0040-
19. Sharples C.G.V., Kaiser S., Soliakov L., Marks M.J.,
4020(01)99327-5
Collins A.C., Washburn M., Wright E., Spencer J.A.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 6 2023
СИНТЕЗ НОВЫХ ФЛУОРЕНСОДЕРЖАЩИХ 9-АЗАБИЦИКЛО[4.2.1]НОНА-2,4,7-ТРИЕНОВ
813
Gallagher T., Whiteaker P., Wonnacott S. J.
35. Kadikova G.N., D’yakonov V.A., Nasretdinov R.N.,
Neurosci.
2000,
20,
2783-2791. doi
10.1523/
Dzhemileva L.U., Dzhemilev U.M. Tetrahedron. 2020,
JNEUROSCI.20-08-02783.2000
76, 130996. doi 10.1016/j.tet.2020.130996
20. Gundisch D., Kampchen T., Schwarz S., Seitz G.,
36. Kadikova G.N., D’yakonov V.A., Nasretdinov R.N.,
Siegl J., Wegge T. Bioorg. Med. Chem. 2002, 10, 1-9.
Dzhemileva L.U., Dzhemilev U.M. Mendeleev
doi 10.1016/S0968-0896(01)00258-9
Commun.
2020,
30,
318-319. doi
10.1016/
21. Karig G., Large J.M., Sharples C.G.V., Sutherland A.,
j.mencom.2020.05.019
Gallagher T., Wonnacott S. Bioorg. Med. Chem.
37. Kadikova G.N., D’yakonov V.A., Dzhemilev U.M.
Lett.
2003,
13,
2825-2828. doi
10.1016/S0960-
Molecules.
2021,
26,
2932.
doi
10.3390/
894X(03)00594-8
molecules26102932
22. Wonnacott S., Gallagher T. Mar. Drugs. 2006, 4, 228-
38. Kadikova G.N., D’yakonov V.A., Dzhemilev U.M.
254. doi 10.3390/md403228
ACS Omega. 2021, 6, 21755-21763. doi 10.1021/
23. Gohlke H., Schwarz S., Gündisch D., Tilotta M.C.,
acsomega.1c03321
Weber A., Wegge T., Seitz G. J. Med. Chem. 2003, 46,
39. Shima H., Kuniyasu T., Sugie S., Tanaka T., Mori H.,
2031-2048. doi 10.1021/jm020859m
Takahashi M., Muto Y. Jpn. J. Cancer Res. Gann. 1986,
24. Sardina F.J., Howard M.H., Koskinen A.M.P., Rapo-
77, 351-355. doi 10.20772/cancersci1985.77.4_351
port H. J. Org. Chem. 1989, 54, 4654-4660. doi
40. Mukherjee A., Dutta S., Chashoo G., Bhagat M., Saxe-
10.1021/jo00280a037
na A.K., Sanyal U. Oncol. Res. 2009, 17, 387-396. doi
25. Дьяконов В.А., Кадикова Г.Н., Джемилев У.М. Усп.
10.3727/096504009788912516
хим. 2018, 87, 797-820. [D’yakonov V.A., Kadiko-
41. Pan H.L., Fletcher T.L. J. Med. Chem. 1967, 10, 957-
va G.N., Dzhemilev U.M. Russ. Chem. Rev. 2018, 87,
959. doi 10.1021/jm00317a050
797-820.] doi 10.1070/rcr4793
42. Pan H.L., Fletcher T.L. J. Med. Chem. 1964, 7, 31-38.
26. Rigby J.H., Ateeq H.S., Krueger A.C. Tetrahedron
doi 10.1021/jm00331a008
Lett.
1992,
33,
5873-5876. doi
10.1016/S0040-
43. Dimmock J.R., Smith P.J., Tsui S.K. J. Pharm. Sci.
4039(00)61076-6
1979, 68, 866-871. doi 10.1002/jps.2600680721
27. Rigby J.H. Acc. Chem. Res. 1993, 26, 579-585. doi
44. Dyakonov V.A., Kadikova G.N., Nasretdinov R.N.,
10.1021/ar00035a003
Dzhemilev U.M. Tetrahedron Lett. 2017, 58, 1839-
28. Rigby J.H., Ateeq H.S., Charles N.R., Cuisiat S.V.,
1841. doi 10.1016/j.tetlet.2017.03.084
Ferguson M.D., Henshilwood J.A., Krueger A.C.,
45. Dyakonov V.A., Kadikova G.N., Dzhemileva L.U.,
Ogbu C.O., Short K.M., Heeg M.J. J. Am. Chem. Soc.
Gazizullina G.F., Ramazanov I.R., Dzhemilev U.M.
1993, 115, 1382-1396. doi 10.1021/ja00057a023
J. Org. Chem. 2017, 82, 471-480. doi 10.1021/
29. Rigby J.H., Ateeq H.S., Choler N.R., Henshil-
acs.joc.6b02540
wood J.A., Short K.M., Sugathapala P.M. Tetrahed-
ron.
1993,
49,
5495-5506. doi
10.1016/S0040-
46. D’yakonov V.A., Kadikova G.N., Nasretdinov R.N.,
Dzhemileva L.U., Dzhemilev U.M. J. Org. Chem.
4020(01)87265-3
2019, 84, 9058-9066. doi 10.1021/acs.joc.9b00996
30. Rigby J.H., Pigge F.C. J. Org. Chem. 1995, 60, 7392-
7393. doi 10.1021/jo00128a007
47. Kadikova G.N., Dzhemileva L.U., D’yakonov V.A.,
Dzhemilev U.M. ACS Omega. 2020, 5, 31440-31449.
31. Chaffee K., Huo P., Sheridan J.B., Barbieri A., Ais-
doi 10.1021/acsomega.0c05072
tars A., Lalancette R.A., Ostrander R.L., Rheingold A.L.
J. Am. Chem. Soc. 1995, 117, 1900-1907. doi 10.1021/
48. Achard M., Tenaglia A., Buono G. Org. Lett. 2005, 7,
ja00112a005
2353-2356. doi 10.1021/ol050618j
32. Morkan I.A. J. Organomet. Chem. 2002, 651, 132-136.
49. Achard M., Mosrin M., Tenaglia A., Buono G. J. Org.
doi 10.1016/S0022-328X(02)01369-4
Chem. 2006, 71, 2907-2910. doi 10.1021/jo052630v
33. Rigby J.H., Kondratenko M.A., Fiedler C. Org. Lett.
50. Carpino L.A., Han G.Y. J. Am. Chem. Soc. 1970, 92,
2000, 2, 3917-3919. doi 10.1021/ol0002931
5748-5749. doi 10.1021/ja00722a043
34. D’yakonov V.A., Kadikova G.N., Nasretdinov R.N.,
51. Cotton F.A., Faut O.D., Goodgame M.L., Holm R.H.
Dzhemileva L.U., Dzhemilev U.M. Eur. J. Org. Chem.
J. Am. Chem. Soc. 1961, 83, 1780-1785. doi 10.1021/
2020, 5, 623-626. doi 10.1002/ejoc.201901837
ja01469a002
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 6 2023
814
КАДИКОВА, ДЬЯКОНОВ
Synthesis of New Fluorene-containing
9-Azabicyclo[4.2.1]nona-2,4,7-trienes [6π+2π]-Cycloaddition
of Alkynes to N-Carbofluorenylmethoxyazepine
G. N. Kadikovaa, * and V. A. D’yakonovb
a Institute of Petrochemistry and Catalysis, Ufa Federal Research Center, Russian Academy of Sciences,
prosp. Oktyabrya, 141, Ufa, 450075 Russia
b N.D. Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences,
Leninsky Prospekt, 47, Moscow, 119991 Russia
*e-mail: Kad.Gulnara@gmail.com
Received June 28, 2022; revised July 10, 2022; accepted July 12, 2022
Catalytic [6π+2π]-cycloaddition of terminal alkynes to N-carbofluorenylmethoxyazepine under the action of a
three-component catalytic system Co(acac)2(dppe)/Zn/ZnI2 was performed for the first time to obtain previously
undescribed and promising 9-azabicyclo[4.2.1]nona-2,4,7-trienes (in 79-92% yields) containing a fluorene
substituent.
Keywords: cycloaddition, N-carbofluorenylmethoxyazepine, alkynes, 9-azabicyclo[4.2.1]nona-2,4,7-trienes,
cobalt(II) acetylacetonate
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 6 2023