ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 7, с. 910-919
УДК 547.239
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ
МОЧЕВИН, СОДЕРЖАЩИХ АДАМАНТИЛЬНЫЙ
И ПИРИДИНОВЫЙ (ХИНОЛИНОВЫЙ) ФРАГМЕНТЫ
© 2023 г. С. О. Байковаa, С. В. Байковa, А. А. Петровa, *,
В. В. Бурмистровb, В. П. Боярскийa, **
a ФГБОУ ВО «Санкт-Петербургский государственный университет»,
Россия, 199034 Санкт-Петербург, Университетская наб., 7-9
b ФГБОУ ВО «Волгоградский государственный технический университет» ВолгГТУ,
Россия, 400005 Волгоград, просп. Ленина, 28
*e-mail: aap1947@yandex.ru
**e-mail: v.boiarskii@spbu.ru
Поступила в редакцию 21.06.2022 г.
После доработки 11.07.2022 г.
Принята к публикации 12.07.2022 г.
Реакцией 1,1-диметил-3-(гетарил)мочевин с гидрохлоридами аминов синтезирована серия 1,3-дизаме-
щенных мочевин, содержащих пиридиновую (хинолиновую) и липофильную адамантановую структуры
(13 соединений, выходы 53-94%). Синтезированные соединения отличаются между собой по положению
замещения адамантанового фрагмента, строению алкильного линкера между адамантановым фрагментом
и амидной группой, типом гетероциклического заместителя. Они потенциально являются мишень-ори-
ентированными ингибиторами растворимой эпоксидгидролазы человека (sEH).
Ключевые слова: N-гетарилмочевина, адамантан, скрытые изоцианаты, растворимая эпоксидгидролаза
DOI: 10.31857/S0514749223070054, EDN: HSRVKC
ВВЕДЕНИЕ
паратам, а также в отношении возбудителя сибир-
ской язвы Bacillus anthracis [3]. Отдельно стоит от-
В литературе описан широкий спектр биоло-
метить большое количество исследований по син-
гической активности соединений, содержащих
тезу 1,3-дизамещенных мочевин - ингибиторов
в своей структуре уреидные фрагменты. Напри-
растворимой эпоксидгидролазы человека (sEH,
мер, гликлазид (N-{гексагидроциклопентал[c]пир-
E.C. 3.3.2.10) - фермента арахидонового каскада
рол-2(1H)-илкарбамоил}-4-метилбензенсульфон-
[4-6], участвующего в метаболизме эпоксижирных
амид) - гипогликемическое средство, является
кислот до вицинальных диолов. Ингибирование
потенциальным противовирусным препаратом в
sEH высокоэффективными соединениями класса
отношении РНК-вирусов, таких как SARS-CoV-2
1,3-дизамещенных мочевин позволяет воздейство-
[1, 2]. Такие соединения, как 1-(3-хлор-4-метил-
вать на гипертонические [7], воспалительные [8]
фенил)-3-(4-фенилбутан-2-ил)мочевина, содержа-
и болевые состояния [9]. Введение в структуру
щие в своей структуре галогенсодержащие произ-
1,3-дизамещенных мочевин высоколипофильных
водные бензола, проявляют активность в отноше-
полициклических фрагментов (адамантильно-
нии Staphylococcus aureus, Klebsiella pneumoniae
го [10, 11], борнильного [12] и других) позволяет
(палочка Фридлендера) - бактерии, относящейся
получать соединения, проявляющие активность в
к классу клебсиелл, штаммы которых бывают пол-
концентрациях ниже 1 нмоль/л. Такой «липофиль-
ностью резистентными к антибактериальным пре-
ный якорь» облегчает транспортировку препарата
910
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН
911
через клеточные мембраны, позволяет эффективно
недостатки существующих ингибиторов, является
преодолевать гематоэнцефалический барьер и уве-
важнейшей актуальной задачей, решение которой
личивает сродство к гидрофобным областям бел-
позволит создать лекарственные средства много-
ковых комплексов [13]. В то же время подобные
функционального терапевтического и профилак-
заместители делают итоговую молекулу малорас-
тического действия в отношения ряда социально
творимой в высокополярных средах (в частности,
значимых заболеваний.
в воде и в водных физиологических средах), что
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
уменьшает её биодоступность и соответственно
В настоящей работе изучено взаимодействие
снижает потенциальный терапевтический эффект.
1,1-диметил-3-(гетарил)мочевин 2a, b с замещен-
Одним из путей устранения данного недостат-
ными адамантиламинами и (адамантан-1-ил)ал-
ка, по нашему предположению, может быть вве-
киламинами 1a-g. При нагревании аминов 1a-g c
дение в молекулу 1,3-дизамещённой мочевины в
мочевинами 2а, b в присутствии каталитических
дополнение к адамантильному фрагменту поляр-
количеств ДМФА при 90°С в течение несколь-
ного гетероциклического заместителя, что позво-
ких часов осуществлен синтез серии 1-адаманта-
лит увеличить гидрофильность молекул. С этой
нил-3-гетарилмочевин 3a-m (схема 1) с выходами
целью мы использовали ранее разработанную
53-95%. Амины 1a-g были предварительно полу-
нами концепцию синтеза различных производных
чены из солянокислых солей аминов адамантана.
2-аминопиридина, основанную на удобном мето-
Предполагаемый механизм реакции, описанный
де получения 1,1-диалкил-3-(пиридин-2-ил)моче-
нами ранее [18], заключается в образовании из
вин и способности выступать в качестве скрытых
1,1-диметил-3-(гетарил)мочевин 2a, b в качестве
изоцианатов [14-19]. Также с целью оптимиза-
интермедиатов гетарилизоцианатов, которые да-
ции структур ингибиторов sEH, относящихся к
лее взаимодействуют с адамантиламинами 1a-g.
указанному хемотипу, нами была проведена це-
ленаправленная модификация липофильной ча-
Структуры полученных соединений подтверж-
дены методами спектроскопии ЯМР 1H и 13C,
сти молекулы при введении в структуру мочевин
различных алифатических заместителей, а также
масс-спектрометрии высокого разрешения (ESI-
заместителей в Ad-группу. В результате были по-
MS), а также методом рентгеноструктурного ана-
лиза. В спектрах ЯМР 1H соединений 3a-m на-
лучены мочевины с различным положением ме-
ста замещения адамантильного фрагмента - 3a,
блюдаются сильнопольные сигналы адамантиль-
ных и алифатических протонов, сигналы гетероа-
3b, 3h, 3i [Ad1(2)], (адамантан-1-ил)алкил(фенил)-
роматических протонов и низкопольные сигналы
замещенные мочевины 3c, 3e, 3f, 3g, 3j, 3l, 3m, а
2 протонов мочевинных групп NH, связанных с
также мочевины с 3,5-диметилзамещенным ада-
адамантильным фрагментом (непосредственно
мантильным фрагментом 3d, 3k. Введение до-
или через метиленовую группу) и с гетероарома-
полнительных алкильных групп в липофильную
тическим кольцом (соответственно в области δH
часть структуры мочевин может оказать заметное
8.00-8.63 и 8.98-9.85 м.д. для мочевин 3a-g и δH
влияние на связывание уреидной группы в актив-
8.12-9.10 и 10.16-10.74 м.д. для мочевин 3h-m).
ном домене sEH и повлиять на их ингибирую-
В алкилмочевинах химический сдвиг протона NH
щую активность. Ранее показано, что отдаление
смещен в область сильного поля по сравнению с
адамантильного фрагмента от уреидной группы
протоном в арилмочевинах. В спектре ЯМР 1H мо-
на метиленовый мостик приводит к повышению
чевин, содержащих адамантильную и фенильную
ингибирующей активности в отношении sEH в 2-
группы, протон NH, связанный непосредственно
4 раза, а также положительно влияет на водорас-
с адамантильным радикалом, имеет значительно
творимость [5, 11]. Сочетание в одной молекуле
меньший химический сдвиг (5.88 м.д.), а сигнал
гидрофильного фрагмента и каркасного фрагмента
8.24 м.д. соответствует NH протону, связанному с
с регулируемой липофильностью может позволить
ароматическим кольцом [20].
оптимизировать фармакотерапию. Создание ново-
го поколения ингибиторов sEH, которые обладали
Значения δH зависят не только от структуры
бы комплексом требуемых свойств и исключали
молекулы, но и от используемого растворителя.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023
912
БАЙКОВА и др.
Схема 1
t-BuONa
RNH2×HCl
RNH2
CH2Cl2, 20°C, 1 ɱ
1a-g
O
O
1a-g
Me
R
N N
N
ȾɆɎȺ, 90°C, 4 ɱ
N
N
N
H
H
H
Me
2a
3a-g
3a-g, R = Ad-1-yl (a), Ad-2-yl (b), CH2Ad-1-yl (c), 3,5-(CH3)2-Ad-1-yl (d),
CH(Et)CH2Ad-1-yl (e), 4-(Ad-1-yl)C6H4 (f), CH(Me)Ad-1-yl (g).
O
O
1a-g
Me
R
N N
N
ȾɆɎȺ, 90°C, 4 ɱ
N
N
N
H
H
H
Me
2b
3h-m
3h-m, R = Ad-1-yl (h), Ad-2-yl (i), CH2Ad-1-yl (j), 3,5-(CH3)2-Ad-1-yl (k),
CH(Et)CH2Ad-1-yl (l), CH(Me)Ad-1-yl (m).
В ДМСО-d6 сигналы протонов NH претерпевают
Исследованы физические свойства полученных
сильнопольный сдвиг в сравнении с CDCl3 (для
соединений 3a-m (табл. 1). Для всех мочевин на-
соединения 3a δH 8.09 и 8.94 м.д. [21], а также 8.38
блюдается тенденция к снижению температуры
и 9.06 м.д., соответственно, для соединения 3j δH
плавления на 25-82°С при введении между ада-
9.65 и 9.73 м.д., а также 8.98 и 10.28 м.д. соответ-
мантильным фрагментом и группой NH алкиль-
ственно), что может быть связано со значительной
ных групп различной степени длины и развет-
ассоциацией мочевин, вызванной образованием
вления, а также при введении в адамантильную
межмолекулярных водородных связей в CDCl3
группу метильных групп в узловые положения 3
[22]. В спектрах ЯМР 1H мочевин 3j, 3i, 3l, 3m на-
и 5. В то же время наблюдается увеличение темпе-
блюдается спин-спиновое взаимодействие между
ратуры плавления при введении между амидным
NH протоном и протонами алкильного мостика
и адамантильным фрагментами 1,4-фениленовой
между амидной и адамантильной группами. Эти
группы и при замене пиридинового фрагмента
изменения вида сигналов слабопольных протонов
на хинолиновый. Температура плавления моче-
NH могут быть связаны с заторможенным враще-
вины 3a ниже на 35°С температуры плавления
нием вокруг связи C-N.
1-(адамантан-1-ил)-3-(фенил-2-ил)мочевины [20].
В спектре ЯМР 13C сигнал атома углерода груп-
Коэффициенты липофильности мочевин, содер-
жащих пиридиновый фрагмент, ниже, чем коэф-
пы C=O проявляется в области 153-157 м.д., при-
чем наибольшие значения установлены у соедине-
фициенты липофильности аналогичных соедине-
ний 3c и j, в которых группа NH связана с адаман-
ний, содержащих фенильный фрагмент (табл. 1).
тильным фрагментом через метиленовую группу,
Коэффициенты липофильности соединений 3a-m
а наименьшие значения (153.19 м.д.) - у соедине-
увеличиваются при введении в структуру мочевин
ния 3j, в котором группа NH связана с адамантиль-
алкильных и фениленового мостиков между груп-
ным фрагментом через фенильную группу.
пой NH и адамантильным фрагментом, а также
при замене пиридинового фрагмента на хинолино-
Синтезированные нами соединения отлича-
вый. Коэффициент липофильности logP в системе
ются между собой по ряду структурных пара-
октанол-вода был рассчитан при помощи онлайн
метров: положению замещения адамантанового
сервиса Molinspiration [23].
фрагмента, строению алкильного заместителя
между адамантановым фрагментом и амидной
Для 2 производных пиридина 3a и 3c и 2 про-
группой, типом гетероциклического заместителя.
изводных хинолина 3k и 3m были получены мо-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН
913
Таблица 1. Коэффициенты липофильности и температура плавления синтезированных соединений 3a-m
Соединение
logP
Т.пл., °С
3a
3.47
204-205
3b
3.32
211-212
3c
3.48
179-180
3d
3.59
132-133
3e
4.74
122-123
3f
5.15
238-240
3g
3.81
207-208
3h
4.72
245-247
3i
4.56
251-252
3j
4.73
224-225
3k
4.84
210-211
3l
5.87
188-189
3m
5.06
231-232
1-Адамантан-1-ил-3-фенилмочевина
4.37
1-Адамантан-2-ил-3-фенилмочевина
4.22
1-[(Адамантан-1-ил)метил]-3-фенилмочевина
4.38
нокристаллы, структуры которых исследовали
Напряжение ионного источника на входе ±4500 В
методом рентгеноструктурного анализа. Во всех
и на выходе из капилляра ±70-150 В. Образцы для
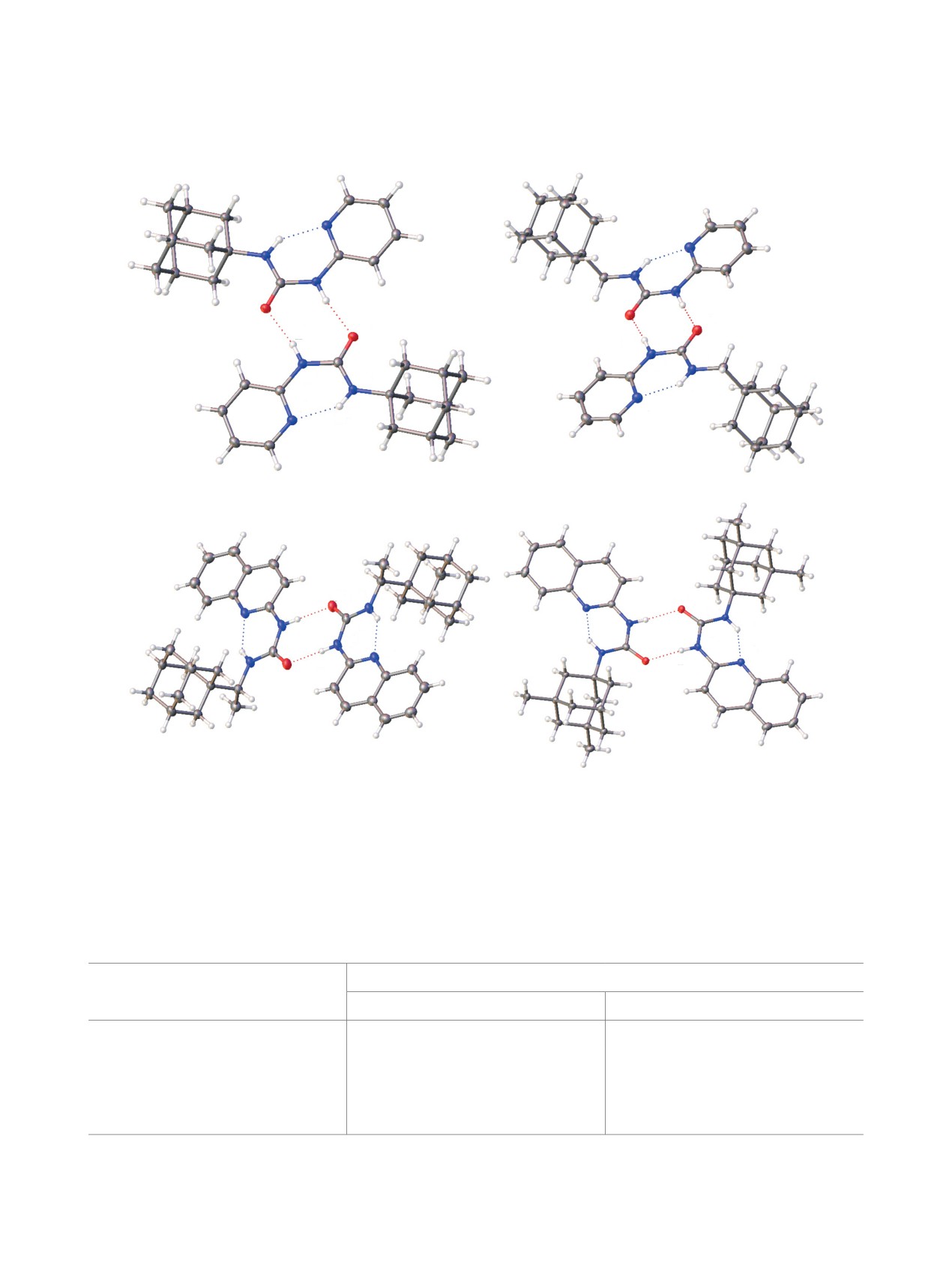
4 случаях молекулы мочевины упакованы в кри-
анализа растворяли в MeОН. Температуры плав-
сталле в виде димеров, связанных межмолеку-
ления определены на приборе Electrothermal IA
лярными N2H2···O=C водородными связями (см.
9300. Рентгеноструктурный анализ выполнен на
рисунок). Кроме того, в каждой структуре наблю-
дифрактометре Rikagu XtaLAB Synergy с исполь-
даются внутримолекулярные водородные связи с
зованием рентгеновского излучения CuKα (λ =
участием атома азота гетероциклического фраг-
0.154184 нм). Решение структур проводили с по-
мента (N3H3···N1). Геометрические параметры
мощью программы SHELXT (Intrinsic Phasing)
обсуждаемых водородных связей представлены в
[24] и уточняли методом наименьших квадратов
табл. 2.
SHELXL [25], интегрированными в пакет OLEX2
[26]. Кристаллографические данные представле-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ны в табл. 3. Итоговые кристаллографические дан-
Спектры ЯМР 1H и 13С регистрировали на
ные в формате CIF депонированы в Кембриджском
спектрометре Bruker Avance III, рабочая часто-
центре структурных данных и доступны по адре-
та 400.13 (1Н), 100.61 (13C) МГц, при комнатной
температуре. Химические сдвиги измеряли от-
носительно остаточных сигналов протона и ато-
В работе использовали без дополнительной
ма углерода растворителя: δH 7.27 м.д. (CHCl3),
очистки трет-бутоксид натрия и коммерческие ги-
δH 2.50 м.д. (ДМСО-d6), δС 77.0 м.д. (CDCl3).
дрохлориды аминов фирм Merck и Acros Organics,
Масс-спектры регистрировали на приборе Bruker
хлористый метилен и диметилформамид фирмы
micrOTOF с ионизацией электрораспылением
Вектон. 1,1-Диметил-3-(гетарил)мочевины 2a, b
(ESI), сканирование m/z в диапазоне 50-3000 Да.
получены по методикам [14, 16]. Для хромато-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023
914
БАЙКОВА и др.
(a)
(b)
O1
O1
H2
H2
3
N
2
N
N2
N3
H3
N1
N1
H3
(c)
(d)
O1
N3
O1
N3
3
H
H3
N2
N2
N1
N1
H2
H2
Кристаллическая упаковка мочевин 3a (a), 3c (b), 3k (c) и 3m (d) в виде димеров, связанных водо-
родными связями
графии использовали силикагель Macherey-Nagel
ющего амина в 2 мл CH2Cl2 прибавляли 0.30 ммоль
60 M (0.04-0.063 мм).
трет-бутоксида натрия. Реакционную смесь пере-
1-R-3-(Гетарил)мочевины 3a-m (общая ме-
мешивали в течение 1 ч при комнатной темпера-
тодика). К 0.30 ммоль гидрохлорида соответству-
туре, затем фильтровали, фильтрат прибавляли к
Таблица 2. Длина водородных связей в кристаллах мочевин 3a, c, k, m
Длина связи, Å
Соединение
H2···O1
H3···N1
3a
2.0232(8)
1.9534(10)
3c
1.9656(7)
1.9932(8)
3k
1.9472(9)
2.0327(10)
3m
1.9350(9)
1.9711(11)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН
915
0.25 ммоль соответствующей 1,1-диметил-3-(гет-
δ, м.д.: 0.90 с (6H), 1.16-1.27 м (2H), 1.48-1.31 м
арил)мочевины 2a, b. К реакционной смеси при-
(4H), 1.71-1.85 м (4H), 2.02-1.96 м (2H), 2.19 квин-
бавляли 100 мкл ДМФА, выдерживали 4 ч при
тет (1H, J 3.2 Гц), 6.88-6.82 м (1H), 6.90 д (1H, J
90°С (при получении мочевины 3f - 20 ч). По
8.3 Гц), 7.60-7.53 м (1H), 8.17 д.д (1H, J 5.2, 1.2 Гц),
окончании реакции отгоняли растворитель под ва-
8.40 с (1H), 8.98 с (1H). Спектр ЯМР 13С, δ, м.д.:
куумом. Остаток очищали с помощью колоночной
30.23, 30.26, 32.44, 40.64, 42.87, 48.16, 50.84, 52.68,
хроматографии на силикагеле, используя в каче-
112.02, 116.35, 138.01, 146.00, 153.97, 154.84. Масс-
стве элюента смесь этилацетат-гексан (EtOAc/гек-
спектр (ESI), m/z: 300.2071 [M + H]+. C18H25N3O.
сан, градиент от 50% к чистому EtOAc).
[M + H]+ 300.2070.
1-(Адамантан-1-ил)-3-(пиридин-2-ил)моче-
1-[(Адамантан-1-ил)бутан-2-ил]-3-(пиридин-
вина (3a). Синтезирована из 50 мг (0.30 ммоль)
2-ил)мочевина
(3e). Синтезирована из
41 мг
соединения 1a. Выход 68 мг (83%), белый поро-
(0.25 ммоль) соединения 1a. Выход 76 мг (93%),
шок, т.пл. 204-205°С (205-206°С [21]). Спектр
белый порошок, т.пл. 122-123°С. Спектр ЯМР
ЯМР 1Н, δ, м.д.: 1.69-1.79 м (6H), 2.10-2.19 м
1Н, δ, м.д.: 0.96 т (3H, J 7.4 Гц), 1.29-1.37 м (2H),
(9H), 6.81-6.92 м (2H), 7.53-7.62 м (1H), 8.16 д.д
1.54-1.73 м (14H), 1.88-1.96 м (3H), 3.98-4.11 м
(1H, J 5.1, 1.0 Гц), 8.38 м (1H), 9.06 м (1H). Спектр
(1H), 6.79-6.88 м (1H), 6.88-6.98 м (1H), 7.50-7.62
ЯМР 13С, δ, м.д.: 29.61, 36.59, 42.17, 51.04, 112.02,
м (1H), 8.17 д.д (1H, J 5.2, 1.8 Гц), 8.97-9.32 м (2H).
116.27, 138.01, 145.95, 154.06, 154.87. Масс-спектр
Спектр ЯМР 13С, δ, м.д.: 10.03, 28.73, 30.84, 32.48,
(ESI), m/z: 272.1771 [M + H]+. C16H21N3O. [M + H]+
37.07, 42.80, 46.55, 50.01, 112.05, 116.29, 137.92,
272.1757.
145.99, 153.95, 155.53. Масс-спектр (ESI), m/z:
328.2400 [M + H]+. C20H29N3O. [M + H]+ 328.2383.
1-(Адамантан-2-ил)-3-(пиридин-2-ил)моче-
вина (3b). Синтезирована из 41 мг (0.25 ммоль) со-
1-[(4-Адамантан-1-ил)фенил]-3-(пиридин-2-
единения 1a. Выход 48 мг (71%), белый порошок,
ил)мочевина
(3f). Синтезирована из
41 мг
т.пл. 211-212°С. Спектр ЯМР 1Н, δ, м.д.: 1.66-1.74
(0.25 ммоль) соединения 1a. Выход 59 мг (68%),
м (2H), 1.80 с (2H), 1.91 с (6H), 1.98-2.09 м (4H),
белый порошок, т.пл. 238-240°С (разл.). Спектр
4.13 д (1H, J 7.8 Гц), 6.81-6.92 м (2H), 7.56-7.64 м
ЯМР 1Н, δ, м.д.: 1.70-1.88 м (6H), 1.89-2.03 м
(1H), 8.22 д.д (1H, J 5.2, 1.9 Гц), 8.27 с (1H), 9.85 с
(6H), 2.09-2.20 м (3H), 6.85 д (1H, J 8.3 Гц), 6.96
(1H). Спектр ЯМР 13С, δ, м.д.: 27.28, 27.54, 32.24,
д.д (1H, J 7.3, 5.1 Гц), 7.32-7.41 м (2H), 7.51-7.60 м
32.55, 37.23, 37.77, 53.99, 112.11, 116.43, 138.14,
(2H), 7.63-7.71 м (1H), 8.00 с (1H), 8.28 д.д (1H, J
146.11, 153.94, 155.46. Масс-спектр (ESI), m/z:
5.1, 1.9 Гц), 11.64 с (1H). Спектр ЯМР 13С, δ, м.д.:
272.1740 [M + H]+. C16H21N3O. [M + H]+ 272.1757.
29.00, 35.84, 36.83, 43.28, 111.90, 117.16, 120.29,
1-[(Адамантан-1-ил)метил]-3-(пиридин-2-
125.34, 135.78, 138.62, 146.12, 146.77, 152.90,
ил)мочевина
(3c). Синтезирована из
41 мг
153.19. Масс-спектр (ESI), m/z: 348.2061 [M + H]+.
(0.25 ммоль) соединения 1a. Выход 47 мг (66%),
C22H25N3O. [M + H]+ 328.2383.
белый порошок, т.пл. 179-180°С. Спектр ЯМР 1Н,
1-[1-(Адамантан-1-ил)этил]-3-(пиридин-2-
δ, м.д.: 1.57-1.63 м (6H), 1.64-1.79 м (6H), 1.96-
ил)мочевина
(3g). Синтезирована из
41 мг
2.06 м (3H), 3.12 д (2H, J 5.9 Гц), 6.79-6.91 м (2H),
(0.25 ммоль) соединения 1a. Выход 69 мг (93%),
7.56-7.64 м (1H), 8.20 д (1H, J 4.8 Гц), 8.33 с (1H),
белый порошок, т.пл. 207-208°С (разл.). Спектр
9.43 с (1H). Спектр ЯМР 13С, δ, м.д.: 28.37, 33.82,
ЯМР 1Н, δ, м.д.: 1.16 д (3H, J 6.8 Гц), 1.59-1.77
37.07, 40.38, 51.79, 112.16, 116.42, 138.10, 146.00,
м (12H), 2.06-1.97 м (3H), 3.66-3.76 м (1H), 6.93-
153.90, 156.80. Масс-спектр (ESI), m/z: 286.1906
6.83 м (2H), 7.55-7.64 м (1H), 8.20 д.д (1H, J 5.1,
[M + H]+. C17H23N3O. [M + H]+ 286.1914.
1.8 Гц), 8.63 с (1H), 9.38 с (1H). Спектр ЯМР 13С, δ,
1-(3,5-Диметиладамантан-1-ил)-3-(пиридин-
м.д.: 14.95, 28.48, 36.02, 37.20, 38.63, 54.32, 111.92,
2-ил)мочевина (3d). Синтезирована из 41 мг
116.40, 138.13, 146.08, 153.85, 155.88. Масс-спектр
(0.25 ммоль) соединения 1a. Выход 40 мг (53%),
(ESI), m/z: 300.2071 [M + H]+. C18H25N3O. [M + H]+
белый порошок, т.пл. 132-133°С. Спектр ЯМР 1Н,
300.2070.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023
916
БАЙКОВА и др.
Таблица 3. Основные кристаллографические данные, параметры рентгеноструктурных экспериментов и уточнения
для соединений 3a, c, k, m
Соединение
Параметр
3a (CJL-495)
3с (CJL-499)
3k (CJL-527)
3m (CJL-530)
M
271.36
285.38
349.46
349.46
Температура, K
100(2)
100(2)
100(2)
100(2)
Размер кристалла, мм
0.24×0.10×0.08
0.30×0.26×0.10
0.12×0.08×0.02
0.16×0.08×0.04
Сингония
моноклинная
моноклинная
моноклинная
моноклинная
Группа симметрии
P2/n
I2/a
P21/n
P21/c
a, Å
11.5122(2)
9.66810(10)
13.0659(2)
11.6726(2)
b, Å
6.67830(10)
9.19300(10)
7.93270(10)
17.5538(2)
c, Å
18.7959(3)
34.2428(3)
18.1863(3)
9.11350(10)
α, град
90
90
90
90
β, град
100.701(2)
96.9730(10)
98.9660(10)
92.4640(10)
γ, град
90
90
90
90
V, Å3
1419.93(4)
3020.95(5)
1861.94(5)
1865.62(4)
Z
4
8
4
4
ρвыч, г/см3
1.269
1.255
1.247
1.244
μ, мм-1
0.641
0.627
0.605
0.604
F(000)
584.0
1232.0
752.0
752.0
CuKα
CuKα
CuKα
CuKα
Излучение
(λ 1.54184)
(λ 1.54184)
(λ 1.54184)
(λ 1.54184)
от 8.374
от 5.2
от 7.786
от 7.58
Область сканирования по 2Θ, град
до 159.116
до 159.922
до 159.958
до 159.428
–14 ≤ h ≤ 14
-10 ≤ h ≤ 12
-16 ≤ h ≤ 16
-14 ≤ h ≤ 14
Интервалы индексов
-8 ≤ k ≤ 6
-11 ≤ k ≤ 11
-9 ≤ k ≤ 9
-22 ≤ k ≤ 17
–23 ≤ l ≤ 23
-43 ≤ l ≤ 43
-23 ≤ l ≤ 21
-11 ≤ l ≤ 11
Число измеренных отражений
10592
11942
13751
13599
Число независимых отражений
2976
3172
3879
3894
Rint (Rsigma)
0.0433
(0.0444)
0.0175
(0.0140)
0.0365
(0.0365)
0.0341
(0.0370)
GOOF
1.054
1.034
1.059
1.065
R1 [(I > 2σ(I)]
0.0428
0.0345
0.0403
0.0440
wR2 (по всем I)
0.1058
0.0911
0.1008
0.1184
R1 0.0511
R1 0.0353
R1 0.0477
R1 0.0493
R (все данные)
wR2 0.1100
wR2 0.0920
wR2 0.1047
wR2 0.1232
Δρмакс/Δρмин, eÅ-3
0.29/-0.24
0.18/-0.26
0.23/-0.26
0.29/-0.23
CCDC
2178508
2178509
2178510
2178511
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН
917
1-(Адамантан-1-ил)-3-(хинолин-2-ил)моче-
белый порошок, т.пл. 210-211°С. Спектр ЯМР 1Н,
вина (3h). Синтезирована из 54 мг (0.25 ммоль) со-
δ, м.д.: 0.95 с (6H), 1.19-1.32 м (2H), 1.35-1.53 м
единения 1b. Выход 55 мг (68%), белый порошок,
(4H), 1.83-1.95 м (4H), 2.04-2.11 м (2H), 2.25 п
т.пл. 245-247°С. Спектр ЯМР 1Н, δ, м.д.: 1.70-1.89
(1H, J 3.2 Гц), 6.88 д (1H, J 8.8 Гц), 7.37-7.44 м
м (6H), 2.15-2.22 м (3H), 2.21-2.31 м (6H), 6.93 д
(1H), 7.62-7.68 м (1H), 7.68-7.76 м (2H), 8.00 д (1H,
(1H, J 8.8 Гц), 7.40 т (1H, J 7.5 Гц), 7.61-7.68 м (1H),
J 8.8 Гц), 8.12 с (1H), 10.17 с (1H). Спектр ЯМР
7.67-7.79 м (2H), 8.01 д (1H, J 8.8 Гц), 8.53 с (1H),
13С, δ, м.д.: 30.29, 30.33, 32.47, 40.64, 42.93, 48.08,
10.23 с (1H). Спектр ЯМР 13С, δ, м.д.: 29.64, 36.62,
50.87, 52.97, 113.75, 124.22, 124.36, 126.53, 127.54,
42.12, 51.35, 113.53, 124.27, 124.34, 126.56, 127.54,
129.87, 138.03, 145.42, 152.69, 154.90. Масс-спектр
129.94, 138.19, 145.42, 152.53, 154.45. Масс-спектр
(ESI), m/z: 350.2235 [M + H]+. C22H27N3O. [M + H]+
(ESI), m/z: 322.1917 [M + H]+. C20H23N3O. [M + H]+
350.2227.
322.1914.
1-[(Адамантан-1-ил)бутан-2-ил]-3-(хинолин-
1-(Адамантан-2-ил)-3-(хинолин-2-ил)моче-
2-ил)мочевина
(3l). Синтезирована из
18 мг
вина (3i). Синтезирована из 54 мг (0.25 ммоль)
(0.084 ммоль) соединения 1b. Выход 28 мг (89%),
соединения 1b. Выход 77 мг (95%), белый поро-
белый порошок, т.пл. 188-189°С. Спектр ЯМР 1Н,
шок, т.пл. 251-252°С. Спектр ЯМР 1Н, δ, м.д.:
δ, м.д.: 1.03 т (3H, J 7.4 Гц), 1.39-1.52 м (2H), 1.62-
1.77-1.88 м (4H), 1.9-2.01 м (5H), 2.02-2.08 м (1H),
1.73 м (14H), 1.90-2.00 м (3H), 4.08-4.19 м (1H),
2.09-2.16 м (2H), 2.24 д (2H, J 13.1 Гц), 4.22-4.29
7.00 д (1H, J 8.8 Гц), 7.41 т (1H, J 7.5 Гц), 7.63-7.69
м (1H), 6.97 д (1H, J 8.8 Гц), 7.42 т (1H, J 7.5 Гц),
м (1H), 7.72 д (1H, J 8.0 Гц), 7.77 д (1H, J 8.4 Гц),
7.63-7.70 м (1H), 7.70-7.80 м (2H), 8.04 д (1H, J
8.00 д (1H, J 8.8 Гц), 9.10 с (1H), 10.16 д (1H, J
8.8 Гц), 8.73 с (1H), 10.74 д (1H, J 8.4 Гц). Спектр
8.4 Гц). Спектр ЯМР 13С, δ, м.д.: 9.92, 28.73, 30.76,
ЯМР 13С, δ, м.д.: 27.33, 27.61, 32.51, 32.67, 37.23,
32.54, 37.07, 42.91, 46.70, 50.06, 113.98, 124.16,
37.82, 54.19, 113.83, 124.30, 124.47, 126.47, 127.63,
124.46, 126.57, 127.56, 129.86, 137.96, 145.55,
130.04, 138.26, 145.49, 152.67, 155.44. Масс-спектр
152.79, 155.77. Масс-спектр (ESI), m/z: 378.2528
(ESI), m/z: 322.1917 [M + H]+. C20H23N3O. [M + H]+
[M + H]+. C24H31N3O. [M + H]+ 378.2540.
322.1914.
1-[(Адамантан-1-ил)этил]-3-(хинолин-2-ил)-
1-[(Адамантан-1-ил)метил]-3-(хинолин-2-
мочевина
(3m). Синтезирована из
30 мг
ил)мочевина
(3j). Синтезирована из
54 мг
(0.14 ммоль) соединения 1b. Выход 46 мг (94%),
(0.25 ммоль) соединения 1b. Выход 79 мг (95%),
белый порошок, т.пл. 231-232°С. Спектр ЯМР 1Н,
белый порошок, т.пл. 224-225°С. Спектр ЯМР 1Н
δ, м.д.: 1.26 д (3H, J 6.8 Гц), 1.76 п (12H, J 11.3 Гц),
(CDCl3), δ, м.д.: 1.68-1.82 м (12H), 2.04-2.12 м
2.03-2.12 м (3H), 3.80 д.к (1H, J 9.1, 6.8 Гц), 7.00 д
(3H), 3.23 д (2H, J 5.7 Гц), 7.00 д (1H, J 8.8 Гц),
(1H, J 8.8 Гц), 7.41 т (1H, J 7.5 Гц), 7.63-7.69 м (1H),
7.39-7.45 м (1H), 7.63-7.70 м (1H), 7.73 д (1H, J
7.72 д.д (1H, J 8.1, 1.4 Гц), 7.78 д (1H, J 8.3 Гц), 8.03
8.1 Гц), 7.78 д (1H, J 8.4 Гц), 8.03 д (1H, J 8.8 Гц),
д (1H, J 8.9 Гц), 8.99 с (1H), 10.27 д (1H, J 9.0 Гц).
8.98 с (1H), 10.28 т (1H, J 5.9 Гц). Спектр ЯМР 1Н
Спектр ЯМР 13С, δ, м.д.: 15.02, 28.51, 36.03, 37.23,
(ДМСО-d6), δ, м.д.: 1.56-1.67 м (9H), 1.67-1.75 м
38.77, 54.73, 113.81, 124.24, 124.45, 126.44, 127.62,
(3H), 1.96-2.02 м (3H), 3.01 д (2H, J 5.7 Гц), 7.25
130.00, 138.19, 145.53, 152.70, 156.07. Масс-спектр
д (1H, J 8.9 Гц), 7.42 д.д.д (1H, J 8.1, 5.9, 2.2 Гц),
(ESI), m/z: 350.2235 [M + H]+. C22H27N3O. [M + H]+
7.63-7.73 м (2H), 7.84 д (J 7.9 Гц), 8.21 д (1H, J
350.2227.
8.9 Гц), 9.65 уш.с (1H), 9.73 с (1H). Спектр ЯМР
13С, δ, м.д.: 28.42, 33.75, 37.12, 40.55, 52.10, 113.96,
ЗАКЛЮЧЕНИЕ
124.24, 124.49, 126.47, 127.62, 129.97, 138.16,
Реакцией
1,1-диметил-3-(гетарил)мочевин с
145.49, 152.75, 156.94. Масс-спектр (ESI), m/z:
гидрохлоридами аминов синтезирована серия
336.2074 [M + H]+. C21H25N3O. [M + H]+ 336.2070.
1,3-дизамещенных мочевин, содержащих пири-
1-(3,5-Диметиладамантан-1-ил)-3-(хинолин-
диновую (хинолиновую) и липофильную ада-
2-ил)мочевина (3k). Синтезирована из 54 мг
мантановую структуры (13 соединений, выходы
(0.25 ммоль) соединения 1b. Выход 65 мг (74%),
53-94%). Установлено влияние структурных фак-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023
918
БАЙКОВА и др.
торов синтезированных 1,3-замещенных мочевин
Chem. Lett.
2013,
23,
3732-3737. doi
10.1016/
на температуру плавления и коэффициенты липо-
j.bmcl.2013.05.011
фильности (logP).
6. Hiesinger K., Wagner K.M., Hammock B.D.,
Proschak E., Hwang S.H. Prostaglandins Other
БЛАГОДАРНОСТИ
Lipid Mediat.
2019,
140,
31-39. doi
10.1016/
Работа выполнена с использованием обору-
j.prostaglandins.2018.12.003
дования ресурсных центров СПбГУ «Магнитно-
7. Imig J.D., Zhao X., Zaharis C.Z., Olearczyk J.J.,
резонансные методы исследования» и «Методы
Pollock D.M., Newman J.W., Kim I.-H., Watanabe T.,
анализа состава вещества».
Hammock B.D. Hypertension. 2005, 46, 975-981. doi
10.1161/01.HYP.0000176237.74820.75
ФОНДОВАЯ ПОДДЕРЖКА
8. Das Mahapatra A., Choubey R., Datta B. Molecules.
Работа выполнена при финансовой поддерж-
2020, 25, 5488. doi 10.3390/molecules25235488
ке Российского научного фонда (грант № 19-13-
9. Wagner K.M., McReynolds C.B., Schmidt W.K.,
00008).
Hammock B.D. Pharmacol. Ther. 2017, 180, 62-76.
ИНФОРМАЦИЯ ОБ АВТОРАХ
doi 10.1016/j.pharmthera.2017.06.006
10. Burmistrov V., Morisseau C., Harris T.R., Butov G.,
Байкова Светлана Олеговна, ORCID: https://
Hammock B.D. Bioorg. Chem. 2018, 76, 510-527. doi
orcid.org/0000-0002-7943-7525
10.1016/j.bioorg.2017.12.024
Байков Сергей Валентинович, ORCID: https://
11. Morisseau C., Hammock B.D. Annu. Rev. Pharmacol.
orcid.org/0000-0002-8912-5816
Toxicol.
2013,
53,
37-58. doi
10.1146/annurev-
pharmtox-011112-140244
Петров Александр Анатольевич, ORCID:
12. Burmistrov V., Morisseau C., Karlov D., Pitushkin D.,
Vernigora A., Rasskazova E., Butov G. M., Ham-
Бурмистров Владимир Владимирович, ORCID:
mock B.D. Bioorg. Med. Chem. Lett. 2020, 30, 127430.
doi 10.1016/j.bmcl.2020.127430
Боярский Вадим Павлович, ORCID: https://
13. Wanka L., Iqbal K., Schreiner P.R. Chem. Rev. 2013,
orcid.org/0000-0002-6038-0872
113, 3516-36142. doi 10.1021/cr100264t
14. Rassadin V.A., Zimin D.P., Raskil’dina G.Z., Iva-
КОНФЛИКТ ИНТЕРЕСОВ
nov A.Y, Boyarskiy V.P, Zlotskii S.S., Kukush-
Авторы заявляют об отсутствие конфликта ин-
kin V.Y. Green Chem. 2016, 18, 6630-6636. doi
тересов.
10.1039/C6GC02556K
СПИСОК ЛИТЕРАТУРЫ
15. Geyl K., Baykov S., Tarasenko M., Zelenkov L.E,
Matveevskaya V., Boyarskiy V.P. Tetrahedron Lett.
1. Korkmaz H. SDÜ Tıp Fakültesi Derg. 2021, 28, 171-
2019, 60, 151108. doi 10.1016/j.tetlet.2019.151108
175. doi 10.17343/sdutfd.904540
16. Kasatkina S.O., Geyl K.K., Baykov S.V., Boyars-
2. Schopman J.E., Simon A.C.R., Hoefnagel S.J.M,
kaya I.A., Boyarskiy V.P. Org. Biomol. Chem. 2021,
Hoekstra J.B.L., Scholten R.J.P.M., Holleman F.
19, 6059-6065. doi 10.1039/D1OB00783A
Diabetes Metab. Res. Rev. 2014, 30, 11-22. doi
10.1002/dmrr.2470
17. Baykov S., Mikherdov A., Novikov A., Geyl K.,
Tarasenko M., Gureev M., Boyarskiy V. Molecules.
3. Brown J.R., North E.J., Hurdle J.G., Morisseau C.,
2021, 26, 5672. doi 10.3390/molecules26185672
Scarborough J.S., Sun D., Korduláková J., Scher-
man M.S., Jones V., Grzegorzewicz A., Crew R.M.,
18. Kasatkina S.O., Geyl K.K., Baykov S.V., Novi-
Jackson M., McNeil M.R., Lee R.E. Bioorg. Med. Chem.
kov M.S., Boyarskiy V.P. Adv. Synth. Catal. 2022, 364,
2011, 19, 5585-5595. doi 10.1016/j.bmc.2011.07.034
1295-1304. doi 10.1002/adsc.202101490
4. Dorrance A.M., Rupp N., Pollock D.M., New-
19. Baykova S.O., Geyl K.K., Baykov S.V., Boyars-
man J.W., Hammock B.D., Imig J.D. J. Cardiovasc.
kiy V.P. Int. J. Mol. Sci. 2023, 24, 7633. doi 10.3390/
Pharmacol.
2005,
46,
842-848. doi
10.1097/
ijms24087633
01.fjc.0000189600.74157.6d
20. Zhu X., Xu M., Sun J., Guo D., Zhang Y., Zhou S.,
5. Hwang S.H., Wecksler A.T., Zhang G., Morisseau C.,
Wang S. Eur. J. Org. Chem. 2021, 5213-5218. doi
Nguyen L.V., Fu S.H., Hammock B.D. Bioorg. Med.
10.1002/ejoc.202100932
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН
919
21. North E.J., Scherman M.S., Bruhn D.F., Scarbo-
24. Sheldrick G.M. Acta Crystallogr., Sect. A. 2015, 71,
rough J.S., Maddox M.M., Jones V., Grzegorzewicz A.,
3-8. doi 10.1107/S2053273314026370
Yang L., Hess T., Morisseau C., Jackson M.,
McNeil M.R., Lee R.E. Bioorg. Med. Chem. 2013, 21,
25. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
2587-2599. doi 10.1016/j.bmc.2013.02.028
3-8. doi 10.1107/S2053229614024218
22. Abraham R.J., Griffiths L, Perez M. Magn. Reson.
26. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Chem. 2014, 52, 395-408. doi 10.1002/mrc.4079
ward J.A.K., Puschmann H. J. Appl. Crystallogr. 2009,
23. Molinspiration Chemoinformatic Software, URL:
42, 339-341. doi 10.1107/S0021889808042726
Synthesis and Properties of 1,3-Disubstituted Ureas Bearing
Adamantyl and Pyridin(quinolin)yl Moieties
S. O. Baykovaa, S. V. Baykova, A. A. Petrova, *, V. V. Bumistrovb, and V. P. Boyarskiya, **
a St Petersburg State University, Institute of Chemistry, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
b Volgograd State Technical University, prosp. Lenina, 28, Volgograd, 400005 Russia
*e-mail: aap1947@yandex.ru
**e-mail: v.boiarskii@spbu.ru
Received June 21, 2022; revised July 11, 2022; accepted July 12, 2022
A series of 1,3-disubstituted ureas containing pyridine (quinoline) and lipophilic adamantane moieties was syn-
thesized by the reaction of 1,1-dimethyl-3-(hetaryl)ureas with amine hydrochlorides (13 compounds, 53-94%
yields). The synthesized compounds differ from each other in the substitution position of the adamantane
fragment, the structure of the alkyl linker between the adamantane fragment and the amide group, and the type
of heterocyclic substituent. They are potentially targeted inhibitors of human soluble epoxide hydrolase (sEH).
Keywords: adamantane, N-hetarylureas, masked isocyanates, soluble epoxide hydrolase
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 7 2023