ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 8, с. 1012-1024
УДК 547.022
ДИНАМИЧЕСКАЯ СТРУКТУРА МОЛЕКУЛ
В РАСТВОРЕ ПО ДАННЫМ СПЕКТРОСКОПИИ ЯМР
И КВАНТОВО-ХИМИЧЕСКИХ РАСЧЕТОВ: IV1.
БЕНЗАМИД
© 2023 г. В. В. Станишевскийa, А. К. Шестаковаb, В. А. Чертковa, *
a ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
химический факультет, Россия, 119991 Москва, Ленинские горы, 1, стр. 3
b ФГУП «ГНЦ РФ ГНИИХТЭОС», Россия, 105118 Москва, ш. Энтузиастов, 38
*e-mail: vchertkov@hotmail.com
Поступила в редакцию 28.04.2023 г.
После доработки 10.05.2023 г.
Принята к публикации 11.05.2023 г.
Для изучения структуры и динамики азотсодержащих соединений важную информацию дают параметры
ЯМР с непосредственным участием азота, однако получить ее можно лишь с использованием 15N-обо-
гащенных соединений. В синтезе этих соединений в качестве первичного источника изотопной метки
могут использоваться 15N-аммониевые соли и обогащенные бензамиды. В настоящей работе исследована
динамическая структура бензамида, которая определяется двумя независимыми факторами: затормо-
женным внутренним вращением как NH2-группы вокруг связи C(O)-N, так и карбамидной группы в
целом относительно бензольного кольца. Знание параметров этих процессов важно для содержательной
интерпретации и предсказания биологической активности ароматических амидов в живых системах,
прочности, конформации супрамолекулярных комплексов амидов с ионами лантанидов и актинидов. Для
того, чтобы избежать перекрывания в спектрах ЯМР 1Н протонов карбамидной группы и ароматического
кольца синтезирован дважды обогащенный [2H5, 15N]бензамид. Анализ температурной зависимости
спектров ЯМР 1Н этого соединения позволил получить точные параметры вращения группы NH2 вокруг
связи C(O)-N. Полученные экспериментальные данные хорошо соответствуют результатам проведенных
расчетов с использованием методов квантовой молекулярной динамики.
Ключевые слова: бензамид, ЯМР 15N, динамическая структура, 15N-обогащенные соединения, амидная
группа, динамические спектры ЯМР
DOI: 10.31857/S0514749223080025, EDN: JOWIUQ
ВВЕДЕНИЕ
вращения в бензамиде. Знание механизма и пара-
метров этого процесса в бензамиде важно для со-
Амидные группы являются важнейшим струк-
держательной интерпретации и прогнозирования
турообразующим фактором органических сое-
биологической активности ароматических амидов
динений. Они содержатся во многих биологиче-
в живых системах [4], прочности и конформации
ски-активных молекулах, таких, например, как
супрамолекулярных комплексов с переходными
мочевина, глутамин, аспарагин, амид никотиновой
металлами на их основе [5, 6]. Также требуют про-
кислоты, амиды жирных и ароматических кислот,
верки и уточнения имеющиеся в настоящее время
в олиго- и полипептидах [2, 3]. Настоящая рабо-
литературные данные (см., например, [7]).
та посвящена изучению динамики внутреннего
Спектроскопия ЯМР широко используется для
1 Сообщение III см. [1].
описания структуры и свойств азотсодержащих
1012
ДИНАМИЧЕСКАЯ СТРУКТУР
А ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В РАСТВОРЕ... : IV.
1013
соединений в растворе, и важную информацию
ких концентрациях [14-16]. В этих случаях одно-
дают параметры ЯМР, в которых непосредственно
временно протекают оба указанные выше внутри-
задействован атом азота. Природный азот суще-
молекулярных процесса плюс образование диме-
ствует почти исключительно в виде квадрупольно-
ров и т.д. Причем, как правило, само-ассоциация
го изотопа 14N (~ 99.63%) со спином 1, сигнал ко-
протекает со значительно более высокими скоро-
торого в спектрах ЯМР имеет, как правило, очень
стями, чем заторможенное внутреннее вращение.
короткое время релаксации. Это приводит к уши-
Количественное описание такого комплексного
рению непосредственно связанных с ним ядер,
динамического явления требует разработки специ-
неизбежной потере точности и появлению систе-
ального подхода.
матических ошибок соответствующих параметров
Проведенные нами тестовые эксперименты по-
спектров ЯМР. Особенно остро задача разделения
казали, что для раствора в ДМСО в широком диа-
эффектов, вызванных квадрупольным азотом и
пазоне концентраций (5.7-57 ммоль/л) химические
уширением линий за счет химического обмена,
сдвиги амидных протонов практически не зависят
стоит при измерении параметров динамических
от концентрации бензамида (градиент химических
процессов.
сдвигов каждого амидного протона не превышает
Изотоп 15N имеет спин ½, спектры ЯМР соеди-
1.2×10-2 млрд/град). Это свидетельствует о том,
нений с этим изотопом не содержат отмеченных
что этот сильно сольватирующий растворитель
выше недостатков, однако его низкое природное
подавляет процесс само-ассоциации бензамида.
содержание во многих случаях не позволяет полу-
Этот вывод подтверждается данными эксперимен-
чить требуемой информации из-за недостаточной
та DOSY [17, 18], который показал, что в растворе
чувствительности метода. Задача существенно
ДМСО бензамид преимущественно мономерен и
упрощается, если использовать препараты обога-
не образует прочных комплексов с растворителем.
щенные 15N [8, 9]. Однако, замена квадрупольного
Полученные нами результаты дают основание
азота на ядро 15N сама по себе не решает всех про-
проводить обработку динамического процесса в
блем, возникающих при описании динамической
бензамиде 1 в рамках модели внутримолекулярно-
структуры. Например, для ароматических амидов
го заторможенного внутреннего вращения вокруг
в растворах одновременно могут протекать два
связи С-N амидного фрагмента. В настоящей ра-
процесса: заторможенное внутреннее вращение
боте мы изучили динамику этого процесса в рас-
аминогруппы вокруг связи Ci-N и само-ассоциа-
творе ДМСО-d6 как экспериментально методами
ция с образованием димеров [7]. Серия проведен-
ных нами предварительных экспериментов пока-
динамической спектроскопии ЯМР [10], так и тео-
ретически в рамках подхода квантовой молекуляр-
зала, что во всех изученных нами растворителях
наблюдается динамика в шкале времени метода
ной динамики [19].
ЯМР. Сигналы ЯМР амидных протонов бензамида
Перекрывание уширенных из-за обмена сигна-
обнаруживают температурную зависимость, ха-
лов амидной группы с интенсивными ароматиче-
рактерную для вырожденного двухпозиционного
скими протонами вызывает непреодолимые труд-
обмена в терминах динамической спектроскопии
ности в количественной интерпретации этих ди-
ЯМР [10]. При пониженной температуре наблюда-
намических процессов. Чтобы обойти эти ослож-
ются узкие линии для сигналов обоих обмениваю-
нения, в данной работе мы использовали дважды
щихся амидных протонов.
обогащенный изотопомер бензамида 1, меченый
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
одновременно изотопом 15N по амидной группе и
дейтерием по бензольному кольцу.
Для растворов амидов в большинстве случаев
характерно эффективное взаимодействие с раство-
Этот объект удобен тем, что в спектре ЯМР
рителем [11-13]. Отмечались случаи, когда поло-
1Н не проявляются интенсивные сигналы арома-
жение сигналов ЯМР амидных протонов зависит
тических протонов, что позволяет исключить не-
и от концентрации амида, что свидетельствует о
желательные систематические ошибки, которые
проявлении эффектов само-ассоциации при высо-
неизбежны при обработке динамических экспе-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
1014
СТАНИШЕВСКИЙ и др.
ме 15N составляет 91.4%, что хорошо согласуется
D O
с изотопной чистотой использованного в работе
15
D
i
H
сульфата аммония.
N
cis
o
H
Для амидных протонов характерной особенно-
D
p
m
D
trans
стью является их неэквивалентность из-за частич-
D
но двойной связи между амидным атомом угле-
1
рода и азотом. В необогащенном бензамиде эти
Рис. 1. Структура и нумерация атомов в соединении 1
сигналы дополнительно уширены за счёт влияния
квадрупольного ядра 14N. Введение изотопной
риментов ЯМР недейтерированного соединения.
метки 15N позволило избавиться от эффектов ква-
Помимо этого, соединение 1 позволяет изучить
друпольного уширения амидных протонов и про-
аддитивность изотопных эффектов для параме-
вести их отнесение методами спектроскопии ЯМР
тров спектров ЯМР. Эти результаты могут быть
высокого разрешения, что, в частности, позволяет
использованы в дальнейшем для точной интерпре-
корректно сравнить экспериментальные данные с
тации новых экспериментальных данных в более
результатами квантовохимических расчетов [21].
сложных изотопомерах, содержащих много меток.
Подбор оптимальных условий при регистрации
Синтез соединения 1 был осуществлён, исходя
спектров ЯМР 1Н, позволил добиться необходи-
из [2H5]бензойной кислоты (2) в соответствии со
мого разрешения в протонном спектре и в явном
схемой 1. В качестве источника изотопной мет-
виде определить КССВ через две связи между
ки использовали 15N-обогащённую аммониевую
протонами группы NH2 бензамида: 2JHH -1.23 Гц
соль.
(рис. 2).
На первой стадии взаимодействием кислоты 2
Соединение 1 содержит атомы дейтерия в аро-
с хлористым тионилом получен хлорангидрид 3 с
матическом кольце, которые могут служить допол-
выходом 69%. Ключевым этапом синтеза соедине-
нительным источником информации о характере
ния 1 является взаимодействие хлорангидрида 3 с
электронных эффектов молекулы. Имеющиеся
[15N]аммиаком в двухфазной системе вода/бензол.
экспериментальные данные [22] и теоретические
Условия проведения реакции и методика выделе-
оценки [23] показали, что времена релаксации дей-
ния целевого продукта отрабатывалась ранее на
терия критически зависят от однородности плот-
необогащенных соединениях [20]. Выход бенз-
ности распределения заряда в зоне ядра дейтерия.
амида 1 составил 91%.
При этом наличие существенной неоднородности
Рассчитанная масса молекулярного иона [M +
сопровождается увеличением скорости релакса-
H]+ целевого продукта 128.0886, эксперименталь-
ции квадрупольных ядер дейтерия. В настоящей
ная масса 128.0887, что однозначно подтвержда-
работе мы измерили времена релаксации сигналов
ет изотопный состав целевого продукта (рис. 1).
дейтерия бензольного кольца соединения 1 (раз-
Помимо основного молекулярного иона, важ-
бавленный раствор в ДМСО-d6, 303 K) методом
ную информацию несет сигнал с М/е 127.0912,
инверсия-восстановление [24].
Наблюдаемая разница в массах указывает на моле-
кулярный ион [M + H]+ [2H5]бензамида, в котором
Сигналы дейтерия Do и Dm имеют близкие вре-
отсутствие изотопной метки наблюдается на атоме
мена релаксации:
азота, а не на одном из пяти атомов дейтерия. Из
T1(Do) = 0.0787(4) c,
расчетов интегральной интенсивности молекуляр-
ных ионов степень изотопного обогащения на ато-
T1(Dm) = 0.0767(4) c.
Схема 1
SOCl2
15NH3
C6D5COOH
C6D5COCl
C6D5CO15NH2
∆, 2 ч, 69%
H2O-бензол
2
3
0-20°C, 1.5 ч, 91%
1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
ДИНАМИЧЕСКАЯ СТРУКТУР
А ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В РАСТВОРЕ... : IV.
1015
В то же время для дейтерия в пара-положении
1JNH
время релаксации оказалось почти в два раза ко-
роче:
T1(Dp) = 0.0453(6) с.
Это может свидетельствовать о том, что наве-
2JHH
2JHH
денный карбамидной группой градиент электри-
ческого поля в области пара-протона бензами-
да значительно больше, чем в позиции орто- и
мета-протонов [22, 23].
Из литературных данных следует, что для ядер
1Н и 13С замена водорода на дейтерий сопрово-
ждается эффектом дополнительного экранирова-
ния, или сильнопольным сдвигом сигналов [24-
8.10
8.00
7.90
м.д.
27]. Вызванные заменой водорода на дейтерий
Рис.
2. Фрагмент спектра ЯМР 1Н соединения 1
смещения химических сдвигов 13C могут быть ис-
(ДМСО-d6, 293 K, «Bruker AV-600»). Показана область
пользованы для установления пространственной и
протона Htrans
электронной структуры соединений. Этот эффект
в ряде ранних работ объясняли тем, что водород
на дейтерий, так и 14N/15N амидной группы. При
несколько более электроотрицателен, чем дейте-
наличии нескольких разных изотопных меток в
рий [24]. Однако, по нашему мнению, механизм
молекуле, каждая из них вносит свой вклад в сум-
изотопных сдвигов не связан напрямую с распре-
марный изотопный химический сдвиг. Имеющиеся
делением электронной плотности и требует более
литературные данные показывают, что с увеличе-
детального изучения.
нием числа связей между атомом углерода и поло-
жением изотопной метки изотопный химический
Изотопные сдвиги, вызываемые заменой ядра
сдвиг от замены водорода на дейтерий, как прави-
14N на 15N на текущий момент менее исследованы
ло, монотонно уменьшается. И для карбамидного
[28]. В связи с этим можно лишь отметить первич-
углерода в соединении 1 суммарный изотопный
ные изотопные эффекты в 15N-обогащенных 2,4-
эффект замены всех протонов бензольного кольца
или 2,5-дизамещенных тиазолах [29]:
на дейтерий оказывается сравнимым по величине
1ΔδC2(14N/15N) = 22 млрд.д.
с локальным эффектом замены 14N на 15N.
1ΔδC4(14N/15N) = 34 млрд.д.
Для оценки значений изотопных химических
Для более детального изучения изотопных эф-
сдвигов 13С мы использовали в качестве вну-
фектов в произвольно замещенных тяжелыми изо-
треннего эталона [30] необогащенный бензамид,
топами водорода и азота производных бензамида
что позволяет избежать влияния температурных
были синтезированы [15N]бензамид (4) из бензой-
и концентрационных эффектов при привязке к
ной кислоты и 15NH2 и [2H5]бензамид (5) из [2H5]-
эталонному сигналу постороннего вещества (см.
бензойной кислоты и NH2 (схема 1).
таблицу).
Как видно из таблицы, изотопный химический
При анализе спектров ЯМР 13С соединений 1,
сдвиг атомов углерода в соединении 1 с высокой
4 и 5 оказалось, что все сигналы атомов углерода
точностью соответствует сумме эффектов, вызван-
в изотопомерах с тяжелыми изотопами смещены в
ных дейтерием и азотом. Таким образом, вклад
более сильное поле по сравнению с незамещенным
атома азота в общий изотопный химический сдвиг
бензамидом. Это значит, что все наблюдаемые изо-
для амидного углерода (первичный изотопный
топные эффекты положительны. При этом наибо-
эффект) положителен и равен 14.67 млрд.д. Как и
лее сложная картина наблюдается для Сі бензоль-
ожидалось, вторичный изотопный эффект также
ного кольца и карбамидного углерода, поскольку
на химические сдвиги этих атомов влияют замена
положителен, но гораздо менее значителен:
как всех пяти атомов водорода бензольного кольца
2δΔСi(14N/15N) = 0.88 млрд.д.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
1016
СТАНИШЕВСКИЙ и др.
Значения изотопных химических сдвигов 13С (млрд.д.) соединений 1, 4 и 5 относительно соответствующих сигналов
необогащенного бензамида (ДМСО-d6, 303 K)
Соединения
CC(O)
Ci
Co
Cm
Cp
[2H5, 15N]бензамид (1)
35.35
179.15
398.6
506.5
506.0
[15N]бензамид (4)
14.67
0.88
≤ 0.5
≤ 0.5
≤ 0.5
[2H5]бензамид (5)
20.70
178.1
397.6
507.0
504.2
Замена изотопа азота 14N на 15N амидной груп-
как по относительной интенсивности, так и по ве-
пы практически не вносит вклад в изотопный хи-
личине химического сдвига. Однако значительная
мический сдвиг сигналов Со, Cm и Сp.
разница в величине изотопного химического сдви-
га в соединении 1, может служить надежной опор-
В литературе для ряда монозамещенных аро-
ной точкой при отнесении этих сигналов в спектре
матических соединений хорошо известна величи-
ЯМР 13С.
на прямого изотопного эффекта дейтерия на атом
углерода:
Для углерода Ci из-за отсутствия первичного
изотопного эффекта дейтерия суммарный изотоп-
1δΔC(H/D) = 280-310 млрд.д.
ный химический сдвиг составляет значительно
В отличие от ядра 15N, дейтерий оказывает
меньшую величину:
значительное влияние на положение химического
ΔδCi(H/D) = 165.4 млрд.д.
сдвига атомов углерода через две и три связи:
Важной особенностью дейтерия является про-
2ΔδC(H/D) = 75-110 млрд.д.
явление так называемого отрицательного изотоп-
3δΔC(H/D) ≤ 20-25 млрд.д.
ного эффекта при большой степени удаленности
от атома углерода: nΔδC(H/D) ≤ 0 млрд.д., n ≥ 4.
Таким образом, различное расположение пяти
Отмечается, например, небольшой по модулю
атомов дейтерия по отношению к атомам угле-
суммарный отрицательный изотопный эффект на
рода бензольного кольца молекулы 1 достаточно
карбоксильном атоме углерода в кислоте 2 [24].
сложным образам влияет на суммарные значения
Согласно полученным нами данным, в амиде 1 на-
изотопных химических сдвигов. Так для атомов
блюдается суммарный положительный изотопный
углерода Cm и Cp, изотопный химический сдвиг
эффект от пяти атомов дейтерия на карбамидном
представляет собой сумму изотопного эффекта че-
атоме углерода:
рез одну связь 1δΔC(H/D) и двух эффектов через
две связи 2δΔC(H/D), так как каждый из этих ато-
ΔδСС(О)(H/D) = 20.7 млрд.д.
мов углерода имеет два атома дейтерия, удаленные
Изотопное обогащение 15N позволяет за разум-
на две связи. В результате смещение для этих ато-
ное время регистрировать высокоинформативные
мов происходит на величину от 506 до 507 млрд.д.
двумерные спектры ЯМР 15N HSQC бензамида в
Атом углерода Co характеризуется наличием толь-
режиме спиновой развязки от азота. Для соедине-
ко одного дейтерия через две связи, и суммарный
ния 1 наблюдается узкий одиночный сигнал при
изотопный эффект определяется двумя главными
-284.15 м.д. (ДМСО-d6, 303 K) относительно ни-
членами, что дает более низкое значение изотоп-
трометана в качестве внутреннего эталона. Новую
ного химического сдвига:
информацию о природе химической связи в группе
ΔδСо(H/D) = 398.6 млрд.д.
NH2 бензамида мы получили из изотопных хими-
ческих сдвигов ядер 15N, которые вызывает замена
С помощью изотопных сдвигов можно сделать
атомов водорода на дейтерий бензольного кольца.
надежное отнесение, например, сигналов ато-
мов углерода Cm и Co в соединении 1, что явля-
Для оценки этих тонких эффектов для ЯМР 15N
ется весьма непростой задачей с использованием
мы с высокой точностью измерили химические
«обычных» методов. Эти сигналы весьма близки
сдвиги 15N бензамида 1 относительно не содер-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
ДИНАМИЧЕСКАЯ СТРУКТУР
А ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В РАСТВОРЕ... : IV.
1017
жащего дейтерия бензамида 4 с использованием
15N, м.д.
двумерной спектроскопии ЯМР на узкой полосе
96.80
частот.
∆H(D)
[2H5,15N]BA
96.82
На рис. 3 приведена область корреляции цис-
амидного протона Hcis с азотом в двумерном экс-
96.84
∆N(D)
перименте ЯМР 15N HSQC для 15N-обогащенных
соединений 1 и 4 (смесь 1:1, моль/моль). Этот
96.86
эксперимент проведен в режиме, выявляющем
96.88
кросс-пики для 15N соответствующий константе
[15N]BA
ССВ 15N-H азота с цис-амидным протоном через
1H, м.д.
7.300
7.290
7.280
одну связь. Количественный анализ положения
Рис. 3. Фрагмент двумерного спектра ЯМР 15N HSQC
приведенных на этом рисунке частично перекры-
смеси (1:1, моль/моль) амидов 1 ([2H5,15N]BA) и 4
вающихся сигналов показал, что замещение всех
([15N]BA). (ДМСО-d6, 303 K, Bruker AV-600)
пяти атомов водорода на дейтерий бензольного
кольца вызывает достаточно сильное смещение в
составляет 99.6%, а для Hp 99.2%, каждый из них
сильное поле сигнала 15N:
занимает компактный диапазон частот и легко опо-
Δδ15N(2H/1H) = -29.4 млрд.д.
знаётся в спектре ЯМР 1Н как по его положению,
так и по мультиплетности (рис. 4). Существенно
Соответствующий изотопный эффект для про-
для настоящего исследования то, что наличие этих
тонов имеет то же направление, но значитель-
остаточных сигналов протонов бензольного коль-
но меньше по модулю и составляет примерно
ца не мешает последующей обработке динамиче-
-5.4 млрд. д. Следует отметить то, что разрешён-
ских спектров ЯМР амидных протонов.
ность сигналов в двумерном спектре ЯМР выше,
чем в проекциях на каждую из осей и то, что дан-
Одна из основных задач настоящей работы
ный эффект наблюдался только для цис-протона
состояла в количественной характеристике моле-
амидной группы. Это очевидно свидетельствует
кулярной динамики бензамида как на основании
о том, что взаимное расположение места изотопи-
экспериментальных данных для раствора в диме-
ческого замещения и ядра-детектора может напря-
тилсульфоксиде, так и на основании результатов
мую влиять на величину изотопного химического
моделирования методами квантовой молекуляр-
сдвига.
ной динамики.
В спектре ЯМР 1Н соединения 1 наблюдаются
При вращении вокруг амидной связи пропада-
интенсивные сигналы протонов амидной группы.
ет энергетически выгодное перекрывание неподе-
Общее обогащение бензольного кольца дейтерием
ленной электронной пары азота с карбонильным
по данным масс-спектрометрии составляет 99.2%.
атомом углерода, что приводит к возникновению
Сигналы остаточных протонов ароматического
барьера вращения. На примере формамида иссле-
кольца проявляются в виде уширенных триплетов
довано влияние растворителя на барьер обмена
для остаточных орто-протонов (8.10 м.д., соотно-
протонов амидной группы. Оценки величины это-
шение интенсивностей компонент 1:1:1) и квинте-
го барьера имеют близкие значения для раство-
тов для остаточных мета- и пара-протонов (7.46
ров формамида в серии полярных растворителей.
и 7.53 м.д., соотношение интенсивностей компо-
Значения свободной энергии активации в воде,
нент 1:2:3:2:1). Мультиплетность сигналов оста-
ДМСО и в чистой жидкости составляют 18.2 (0.1),
точных протонов определяется, главным образом,
17.8 (0.1) и 18.0 (0.1) ккал/моль, соответственно
КССВ 3JHD с соседними атомами дейтерия (от 0.95
[32]. Следует, однако, отметить, что приведенные
до 1.11 Гц), а быстрая квадрупольная релаксация
данные оценены по температуре коллапса сигна-
дейтерия вызывает дополнительное уширение
лов, которая для процесса каждом новом раствори-
и даже частичное слияние линий, подробнее см.
теле своя. Строго говоря, эти данные справедливы
[31]. Степень обогащения для протонов Нoo и Hm
лишь для сравнения в очень ограниченном темпе-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
1018
СТАНИШЕВСКИЙ и др.
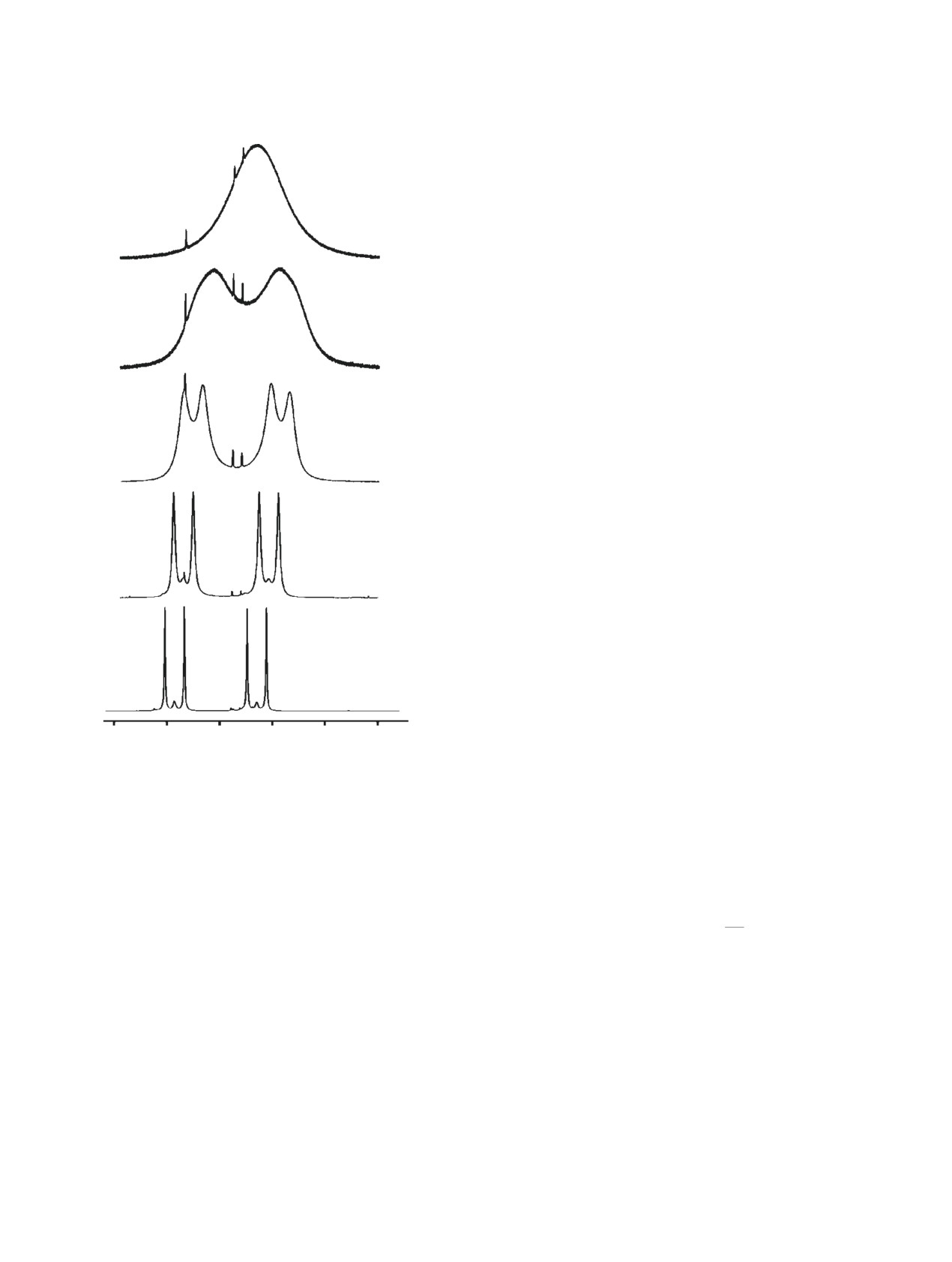
Наличие ядра 15N позволяет получить сигналы
с хорошим разрешением ввиду отсутствия квадру-
T = 372 K
польного уширения от ядра 14N. Так при темпера-
туре 293 K амидные протоны соединения 1 прояв-
ляются в виде хорошо разрешенных дублет дубле-
тов с КССВ. Это позволяет надежно определить
значения химического сдвига амидных протонов.
T = 355 K
С увеличением температуры происходит ушире-
ние сигналов амидных протонов, а при температу-
ре 372 K происходит их слияние (коллапс) в один
широкий пик (рис. 4).
Для каждого из амидных протонов Нtrans и Нcis
наблюдается линейная температурная зависи-
T = 338 K
мость химического сдвига, которая описывается
соотношениями (1) и (2), соответственно:
δ(Hcis) = -0.0039T + 9.1436 ± 0.01061
(1),
δ(Нtrans) = -0.0055T + 8.9786 ± 0.01127
(2),
T = 322 K
где δ(H) - химические сдвиги в м.д. и Т - абсолют-
ная температура.
Как видно из приведенных уравнений, оба из-
ученных химических сдвига протонов смещаются
в сильное поле при увеличении температуры, при-
T = 305 K
чем химический сдвиг протона Нtrans примерно в
1.4 раза более чувствителен к температурным из-
менениям, чем сдвиг Нcis. Анализ подобных зави-
симостей позволяет предсказать значения химиче-
8.4
8.0
7.6
8.2
6.8
6.4
м.д.
ского сдвига при абсолютном нуле температуры,
Рис. 4. Характерные точки температурной зависимо-
поскольку эти значения могут быть использованы
сти сигналов амидных протонов в спектрах ЯМР 1Н
для сравнения с расчетными значениями.
соединения 1
Вращение группы NH2 в бензамиде является
примером симметричного двухпозиционного об-
ратурном диапазоне. Тем не менее, этим методом
мена [10, 16]. Энергия активации Гиббса при тем-
получена оценка параметров динамики вращения
пературе коалесценции может быть рассчитана с
амидных групп в серии соединений [14, 33].
помощью соотношения (3) [32]:
Для определения барьера вращения изучаемо-
T
c
∆G≠ = RTc(22.96 + ln
)
(3),
го бензамида, нами использовался метод динами-
δν
ческой спектроскопии ЯМР [10]. Как отмечалось
где R - универсальная газовая постоянная, пара-
ранее, при вращении вокруг амидной связи про-
метры Тс - температура коалесценции (в нашем
исходит обмен неэквивалентных амидных прото-
случае 367 K) и δv - разница частот обмениваю-
нов, в свою очередь, динамические спектры ЯМР
щихся сигналов ЯМР (371 Гц). Для соединения 1
чувствительны к скорости этого обмена и обеспе-
мы получили этим методом значение ΔG≠, равное
чивают хорошо зарекомендовавший себя способ
16.8(0.8) кДж/моль, или 16.7(0.2) ккал/моль. Это
извлечения кинетических параметров с помощью
значение несколько выше, чем для формамида
экспериментов ЯМР с вариацией температуры
[32]. Такое отличие может быть обусловлено тем,
[10, 34].
что в данной модели не учитывается влияние рас-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
ДИНАМИЧЕСКАЯ СТРУКТУР
А ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В РАСТВОРЕ... : IV.
1019
Схема 2
тропия активации ΔS‡ равна 1.49 ккал/моль∙K, что
соответствует изменению энтропии при переходе
O
O
k1
из начального состояния системы в активирован-
C
H
A
C
HB
Ph
N
Ph
N
ный комплекс. Значение энергии активации Ea со-
k-1
ставляет 16.6 ккал/моль. Энтальпия активации ΔH‡
HB
HA
равна 15.93 ккал/моль. Полученные термодинами-
щеплений линий в соединении 1 за счет больших
ческие величины могут быть использованы в ка-
КССВ с ядром 15N.
честве опорных значений при сравнении барьеров
вращения в схожих системах, а также при расчете
Ранее такой метод широко применялся при опи-
методами квантовой молекулярной динамики.
сании заторможенного внутреннего вращения в се-
рии родственных амидов [14, 33] и может служить
Теоретическое описание динамической струк-
полезной информацией на ранних стадиях иссле-
туры бензамида основано на предположении, что
дования, поскольку во многих случаях достаточно
она определяется двумя основными структурны-
получить качественную характеристику скорости
ми факторами: вращением группы NH2 вокруг
реакции без использования ресурсоемких экспе-
связи C(O)-N (угол ψ) и вращением карбамидной
риментов динамического ЯМР. Количественную
группы в целом относительно бензольного кольца
меру скорости динамического процесса обеспечи-
(угол φ), (рис. 5). Здесь и в дальнейшем, нулевое
вает анализ полной формы линии вовлеченных в
значение для угла φ (С6С1C7O) соответствует пло-
обмен сигналов ЯМР в достаточно широком диа-
ской ориентации карбонила с цис ориентацией Н6
пазоне варьируемой температуры [10].
и атома кислорода, а для угла ψ (С1С7NH8trans) -
Хорошо известно, что в используемом нами
плоской конфигурации карбамидной группы.
методе обработки динамических спектров ЯМР
Это предположение основано на том, что в ос-
по полной форме линии неопределенность зада-
новном состоянии как атом азота, так и атом угле-
ния фактора ширины линии может вносить зна-
рода карбонильной группы должны находиться в
чительную систематическую ошибку для оценки
состоянии гибридизации sp2. Этому способствует
скорости обмена в низкотемпературной области.
сопряжение карбонильной группы как с π-систе-
Такая проблема может возникнуть из-за того, что
мой бензольного кольца, так и с неподеленной
определенное при медленных скоростях обмена
парой азота. Проведенные нами квантовомеха-
значение Т2 может сильно меняться на большом
нический расчет основного состояния бензами-
диапазоне температуры, например, из-за неучтен-
да в приближении MP2 с базисными функциями
ных процессов сольватации или из-за того, что
aug-cc-pVTZ [35, 36], в целом, подтвердил это
оценка времени релаксации Т2 может содержать
предположение. Однако, эта конфигурация мо-
случайные ошибки из-за ограниченности выбор-
лекулы оказалась не точкой минимума энергии, а
ки. Необходимо отметить, что вблизи от точки ко-
седловой точкой.
алесценции нельзя точно определить положение
сигналов, поэтому при использовании этого под-
На следующем этапе мы провели серию рас-
четов (в том же приближение MP2 с базисными
хода следует предварительно изучить зависимость
химических сдвигов обеих обменивающихся форм
8cis
H
на достаточно широком диапазоне температуры.
Ψ
8
N
7
O
Цифровую обработку температурной зависи-
H
C
8trans
φ
мости формы линии амидных протонов соедине-
H
H
ния 1 проводили с помощью программного ком-
1
2
6
плекса DNMRD5 отдельно для каждого значения
3
5
H
H
температуры. На завершающем этапе температур-
4
ную зависимость константы скорости реакции ана-
H
лизировали с использованием уравнения Эйринга
Рис. 5. Направления главных осей заторможенного
теории переходного состояния. Стандартная эн-
внутреннего вращения в бензамиде (углы ψ и φ)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
1020
СТАНИШЕВСКИЙ и др.
данным. Уже на самых начальных стадиях процес-
E, ккал/моль
са наблюдается нарушение плоскостности коор-
3.5
динационной сферы аминогруппы, которое моно-
3.0
тонно усиливается по мере удаления от исходной
точки и достигает максимальной степени, когда
2.5
достигается конфигурация характерная для sp3-ги-
2.0
бридизации азота. Неподеленная электронная пара
1.5
занимает при этом направление в сторону одной
из вершин тетраэдра. При этом наблюдаются два
1.0
максимума потенциала, в которых неподеленная
0.5
пара азота находится в плоскости сопряженного
0.0
с бензольным кольцом карбонила, но направлена
0
30
60
90
120
150
180
либо в сторону бензольного кольца (конфигурация
φ, град
син), либо в сторону атома кислорода (конфигура-
Рис. 6. Сечение поверхности потенциальной энергии бен-
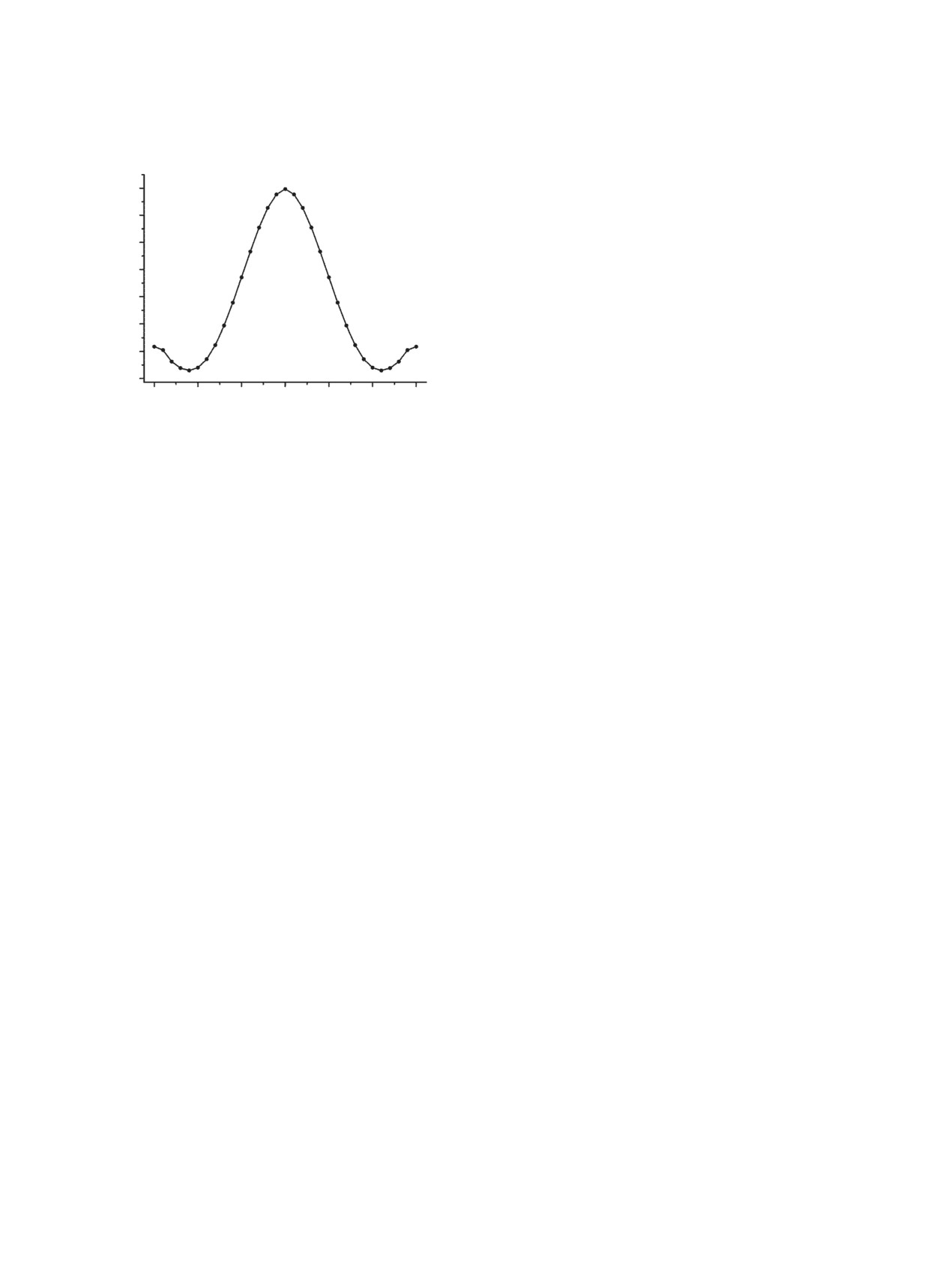
ция анти). Очевидно, что сближение неподелен-
замида как функция двугранного угла φ при фиксирова-
ной пары электронов с несущим избыточный от-
нии плоской геометрии карбамидной группы
рицательный заряд атомом кислорода в конфигу-
функциями aug-cc-pVTZ) с полной оптимизацией
рации анти вызывает дестабилизацию энергии по
энергии молекулы со сканированием двугранного
сравнению с конфигурацией син. Значения потен-
угла φ с шагом 6° при фиксировании плоской ге-
циальной энергии в этих точках сечения потенци-
ометрии аминогруппы. Сечение поверхности по-
ала равны 18.3 и 14.2 ккал/моль, соответственно.
тенциальной энергии бензамида как функция дву-
Следует отметить, что графическое изображение
гранного угла φ приведено на рис. 6. Минимальное
сечений поверхности потенциальной энергии как
значение энергии бензамида достигается для зна-
функции двугранного угла ψ оказывается излишне
чения двугранного угла φ равного 24°. Анализ ге-
сложным из-за того, что в ходе процесса изменяет-
ометрии этой структуры показал, что отклонение
ся конфигурация аминогруппы. Значительно луч-
от плоской формы вызваны стерическим оттал-
ше в данном случае в качестве аргумента исполь-
киванием орто-протонов бензольного кольца и
зовать значение координаты реакционного пути,
атома водорода H8trans аминогруппы. Аналогичный
значения которой определяются совокупностью
эффект наблюдался ранее для стирола [37] и бенз-
перемещений всех атомов динамической системы,
альдегида [38].
подробнее см. [39]. Сечение поверхности потен-
циальной энергии заторможенного внутреннего
Как и следовало ожидать, это сечение по-
вращения группы NH2 вокруг связи C(O)-N бенза-
тенциала достигает максимального значения
мида как функция координаты реакционного пути
3.5 ккал/моль в конфигурации, для которой пло-
представлено на рис. 7.
скость карбамидной группы отрогональна пло-
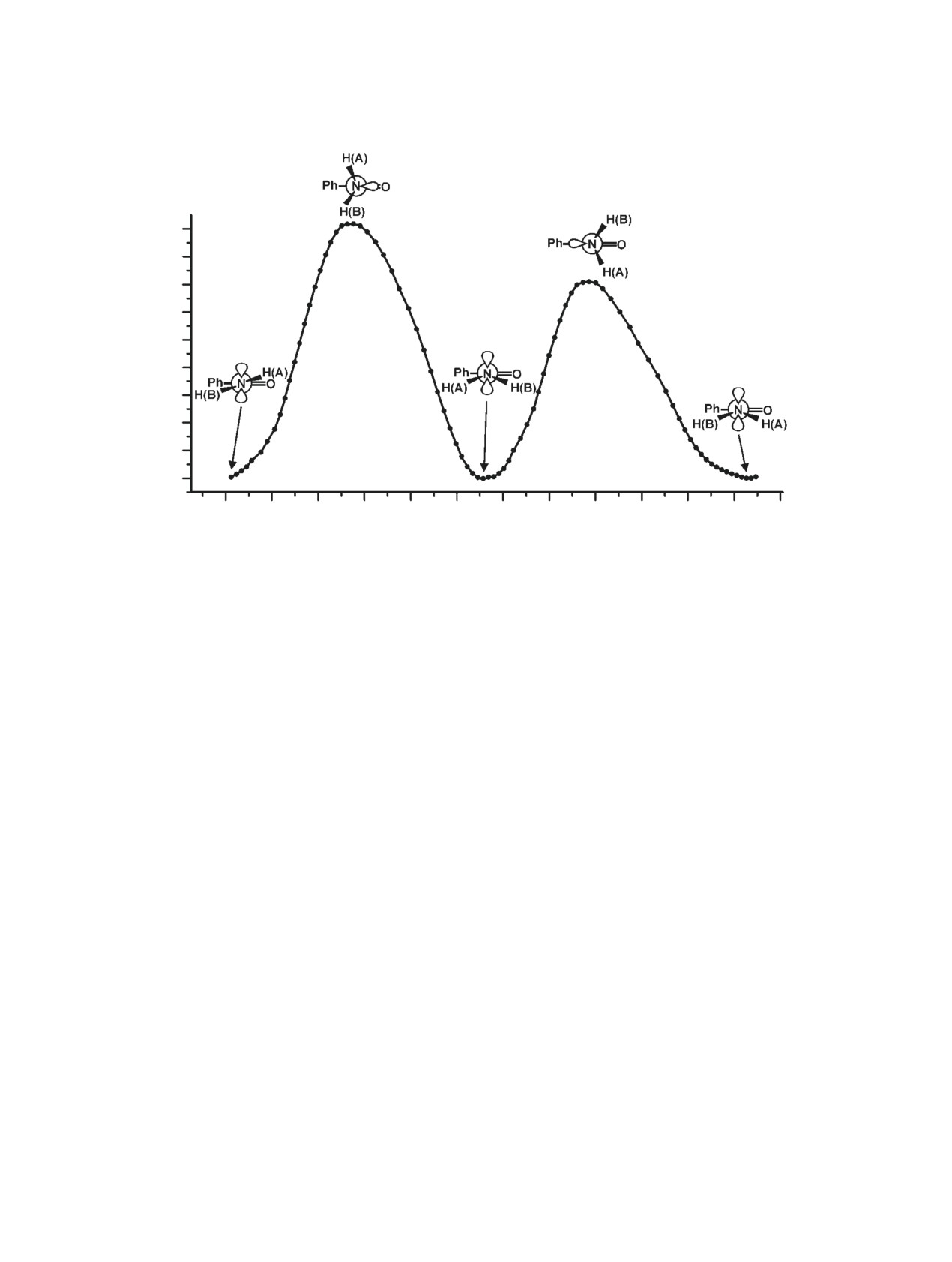
Как следует из приведенных данных, этот про-
скости бензольного кольца (угол φ равен 90°).
цесс тоже является циклическим. Минимальное
Действительно, в этой конфигурации совершенно
значение энергии соответствует плоской конфи-
отсутствует сопряжение электронных систем кар-
гурации карбамидного фрагмента, но плоскость
бамидной группы и бензольного кольца.
карбамидного фрагмента повернута относитель-
Значительно более сложную картину пред-
но плоскости бензольного кольца на угол φ = 24°.
ставляет процесс заторможенного вращения ами-
При прохождении молекулярной системы через
ногруппы вокруг связи С7-N8. Для этого мы вос-
каждый из двух барьеров происходит химический
пользовались аналогичной процедурой, как и в
обмен протонов, помеченных символами A и B.
предыдущем случае, но сканировали угол ψ тоже
Преодоление барьера, соответствующего конфигу-
с шагом 6°. При этом был зафиксировано значение
рации син для значения координаты реакционного
двугранного угла φ так, чтобы оба сечения сопря-
пути равном 15.7 Б(а.е.м)½ требует значительно
гались в точке φ = 24°. Результат оказался неожи-
меньшей энергии активации, чем для барьера, со-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
ДИНАМИЧЕСКАЯ СТРУКТУР
А ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В РАСТВОРЕ... : IV.
1021
E, ккал/моль
18
16
14
12
10
8
6
4
2
0
0
2
4
6
8
10
12
14
16
18
20
22
24
Координата реакции, Б∙(а.е.м.)1/2
Рис. 7. Сечение поверхности потенциальной энергии заторможенного внутреннего вращения группы NH2 вокруг связи
C(O)-N бензамида как функция координаты реакции с фиксацией двугранного угла φ (см. текст)
ответствующего конфигурации анти. Поэтому ре-
ного обогащения продуктов по азоту находится в
акция обмена протонов амидной группы должна
диапазоне 91.5-92.0%.
пойти именно по этому маршруту. Таким образом,
Спектры ЯМР 1Н, 13C, 15N и двумерные спек-
рассчитанное значение энергии активации состав-
тры HSQC 13C и 15N регистрировали в ДМСО-d6
ляет 14.2 ккал/моль, что несколько ниже экспери-
на спектрометре ЯМР «Bruker AV-600» с рабочи-
ментального значения. По нашему мнению, это раз-
ми частотами для ядер 1Н, 13C, 15N 600, 150.92 и
личие может быть обусловлено эффектами среды.
60.67 МГц, соответственно, при различных темпе-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ратурах с параметрами, приведенными в [40-43].
В эксперименте 15N-HSQC для определения отно-
В работе использовали реагенты и дейтериро-
сительных изотопных сдвигов использовали узкие
ванные растворители фирм: «Aldrich», «Deutero
полосы частот и параметр D6 = 0.03 Гц, см. [44])
GmbH» и «Merck». Бензол, хлористый метилен,
этанол, гексан подвергали предварительной очист-
Оценку времени релаксации дейтерия проводи-
ке перед введением в реакции или для отчистки
ли при температуре 303 K с использованием ме-
продуктов; хлористый тионил, гидроксид натрия,
тода инверсия-восстановление [26]. Регистрация
бензойная кислота-d5 (Aldrich, изотопная чисто-
экспериментов ЯМР 2Н проводилась, с равномер-
та 99%), хлороформ-d (Merck, изотопная чисто-
но распределенной в логарифмической шкале ва-
та 99.8%), ДМСО-d6 (Aldrich, изотопная чистота
рьируемой задержкой D2 в диапазоне от 0.01 до
99.8%) использовались без дополнительной очист-
0.5 с.
ки.
Динамические
1Н эксперименты проводили
В качестве источника изотопной метки 15N ис-
на образце обогащенного бензамида в растворе
пользовали (15NH4)2SO4 фирмы «ИЗОТОП» с за-
ДМСО-d6 с концентрацией 57 ммоль/л в диапазо-
явленной изотопной чистотой по азоту 15N 96%.
не температур 305-372 K с шагом в 5-7 K. Перед
Точные измерения интенсивностей сигналов в
измерением спектров ЯМР термостатирование
спектрах ЯМР и данными масс-спектральных из-
образца проводили не менее 45 мин. Температура
мерений продуктов, показали, что степень изотоп-
откалибрована согласно калибровочным кривым,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
1022
СТАНИШЕВСКИЙ и др.
полученным по сигналу 100% этиленгликоля со-
денных расчетов с использованием методов кван-
гласно [45]. Обработку массива спектров ЯМР
товой молекулярной динамики.
1Н проводили с помощью программы DNMRD5
БЛАГОДАРНОСТИ
[6, 46].
АКШ благодарит фонд AvH за поддержку, ВАЧ
Масс-спектр высокого разрешения для синте-
благодарит Химический факультет МГУ (проект
зированного [2H5, 15N]BA был зарегистрирован на
ХИМОМЕТ-2020).
спектрометре Sciex TripleTOF 5600+.
ИНФОРМАЦИЯ ОБ АВТОРАХ
[2H5]Бензоилхлорид
(3).
Раствор
3.92 г
(30.8 ммоль) кислоты 2 в 5.2 мл (71.6 ммоль)
Станишевский Владислав Витальевич, ORCID:
тионилхлорида кипятили с обратным холодиль-
ником в течение 2.0 ч. Затем в реакционную смесь
Шестакова Алла Константиновна, ORCID:
добавляли небольшое количество бензола 0.5 мл
и отгоняли избыток тионилхлорида в вакууме при
Чертков Вячеслав Алексеевич, ORCID: https://
нагревании. Очистку проводили перегонкой в ва-
orcid.org/0000-0001-8699-5894
кууме 91-92°C (20 торр). Выход 3.10 г (69%), бес-
цветная жидкость с резким запахом. Спектр ЯМР
КОНФЛИКТ ИНТЕРЕСОВ
13С, δ, м.д.: 128.45 т (2C, Сm, 1JCD 24.9 Гц), 131.01
Авторы заявляют об отсутствии конфликта ин-
т (2C, Сo, 1JСD 25.1 Гц), 133.17 (Сi), 134.79 т (Сp,
тересов.
1JСD 24.6 Гц), 168.35 (СCO).
СПИСОК ЛИТЕРАТУРЫ
[2H5, 15N]Бензамид (1). Синтез проводили со-
1. Ганина Т.А. Чертков В.А. ЖОрХ. 2019, 55, 411-419.
гласно методики, подробно описанной в работе
[Ganina T.A., Chertkov V.A. Russ. J. Org. Chem. 2019,
[20] исходя из 1.41 г (10.51 ммоль) (15NH4)2SO4 и
55, 354-361.] doi 10.1134/S107042801903014X
3.31 г (22.76 ммоль) свежеперегнанного хлоранги-
2. Leskowitz G.M., Ghaderi N., Olsen R.A., Pederson K.,
дрида 3. Выход 1.21 г (91%), белые кристаллы с
Hatcher M.E., Mueller L.J. J. Phys. Chem. A. 2005,
т.пл. 128-130°С (EtOH). Спектр ЯМР 1Н, δ, м.д.:
109, 1152-1158. doi 10.1021/jp0460689
7.32 д.д (1H, Hcis, 1JHN 87.7, 2JHH -1.2 Гц), 7.94 д.д
3. Koz’minykh V.O. Pharm. Chem. J. 2006, 40, 8-17. doi
(1H, Htrans, 1JHN 88.5, 2JHH -1.2 Гц). Спектр ЯМР
10.1007/s11094-006-0048-0
13С, δ, м.д.: 127.09 т (2С, Сo, 1JCD 24.5 Гц), 127.73 т
4. Wong M.W., Wiberg K.B. J. Phys. Chem. 1992, 96,
(2С, Сm, 1JCD 24.6 Гц), 130.73 т (Сp, 1JCD 24.1 Гц),
668. doi 10.1021/jp304300n
134.16 д (Сi, 2JCN 8.1 Гц), 169.94 д (СCO, 1JCN
5. Ustynyuk Yu.A., Zhokhova N.I., Gloriozov I.P., Mat-
15.9 Гц). Спектр ЯМР
15N, δ, м.д.:
-284.15
veev P.I., Evsiunina M.V., Lemport P.S., Pozdeev A.S.,
уш.с (NH2). Найдено, m/z: 128.0887 [M + H]+.
Petrov V.G., Yatsenko A.V., Tafeenko V.A., Nenajden-
ko V.G., Int. J. Mol. Sci. 2022, 23, 15538. doi 10.3390/
C72H5Н215NO. Вычислено, m/z: 128.0886.
ijms232415538
ЗАКЛЮЧЕНИЕ
6. Palyulin V.A., Emets S.V., Chertkov V.A., Kasper C.,
Schneider H-Y. Eur. J. Org. Chem. 1999, 3479-3482.
Синтезирован дважды обогащенный [2H5, 15N]
7. Stewart W.E., Siddall T.H. III. Chem. Rev. 1970, 70,
бензамид и исследована его динамическая структу-
517-551. doi 10.1021/cr60267a001
ра бензамида, которая определяется двумя незави-
8. Coursindel T., Farran D., Martinez J., Dewynter G.
симыми факторами: заторможенным внутренним
Tetrahedron Lett. 2008, 49, 906-909. doi 10.1016/
вращением как NH2-группы вокруг связи C(O)-N,
j.tetlet.2007.11.159
так и карбамидной группы в целом относительно
9. Shestakova T.S., Shenkarev Z.O., Deev S.L., Chu-
бензольного кольца. Анализ температурной зави-
pakhin O.N., Khalymbadzha I.A., Rusinov V.L.,
симости спектров ЯМР 1Н этого соединения позво-
Arseniev A.S. J. Org. Chem. 2013, 78, 6975-6982. doi
лил получить точные параметры вращения группы
10.1021/jo4008207
NH2 вокруг связи C(O)-N. Экспериментальные
10. Sandström J. Dynamic NMR Spectroscopy. New York:
данные хорошо соответствуют результатам прове-
Academic Press. 1982.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
ДИНАМИЧЕСКАЯ СТРУКТУР
А ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В РАСТВОРЕ... : IV.
1023
11.
Bagchi B., Jana B. Chem. Soc. Rev. 2010, 39, 1936-
30.
Hansen P.E. Ann. Rep. NMR Spectrosc. 1983, 15, 105-
1954. doi 10.1039/b902048a
234.
12.
Lopez J.C., Alonso J.L., Pena I., Vaquero V. Phys.
31.
Leshcheva I.F., Torocheshnikov V.N., Sergeyev N.M.,
Chem. Chem. Phys. 2010, 12, 14128-14134. doi
Chertkov V.A., Khlopkov V.N. J. Magn. Reson. 1991,
10.1039/c0cp00665c
94, 9-19. doi 10.1016/0022-2364(91)90290-a
13.
Kubica D., Molchanov S., Gryff-Keller A. J. Phys.
32.
Taha A., True N. J. Phys. Chem. A. 2000, 104, 2985-
Chem. A.
2017,
121,
1842-1849. doi
10.1021/
2993. doi 10.1021/jp993915c
acs.jpca.7b00144
33.
Gamov G.A., Aleksandriiskii V.V., Sharnin V.A.
14.
Perrin C.L., Nielson J.B. Annu. Rev. Phys. Chem. 1997,
J. Mol. Liq.
2017,
231,
238-241. doi
10.1016/
48, 511. doi 10.1146/annurev.physchem.48.1.511
j.molliq.2017.01.078
15.
Kamorin D.M., Rumyantsev M., Kazantsev O.A.,
34.
Olsen R.A., Liu L., Ghaderi N., Johns A., Hatcher M.E.,
Sivokhin A.P., Kamorina S.I. J. Appl. Polym. SCI.
Mueller L.J. J. Am. Chem. Soc. 2003, 125, 10125. doi
2017, 134, 44412. doi 10.1002/app.44412
10.1021/ja028751j
16.
Aitken R.A., Smith M.H., Wilson H.S. J. Mol.
35.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuse-
Struct.
2016,
1113,
171-173. doi
10.1016/
ria G.E., Robb M.A., Cheeseman J.R., Scalmani G.,
j.molstruc.2016.02.030
Barone V., Mennucci B., Petersson G.A., Nakatsu-
17.
Loening M.N., Keeler J., Morris G.A. J. Magn. Reson.
ji H., Caricato M., Li X., Hratchian H.P., Izmaylov A.F.,
2001, 153, 103-112. doi 10.1006/jmre.2001.2423
Bloino J., Zheng G., Sonnenberg J.L., Hada M., Eha-
ra M., Toyota K., Fukuda R., Hasegawa J., Ishida M.,
18.
Evans R., A. Hernandez-Cid A., Poggetto G.D., Ves-
Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T.,
ty A., Haiber S., Morris G.A., Nilsson M. RSC Adv.
Montgomery J.A., Jr., Peralta J.E., Ogliaro F., Bear-
2017, 7, 449-452. doi 10.1039/c6ra26144b
park M., Heyd J.J., Brothers E., Kudin K.N., Starove-
19.
Shimanski S., Bernatowicz P. Clasical and Quantum
rov V.N., Kobayashi R., Normand J., Raghavachari K.,
Molecular Dynamics in NMR Spectra. Cham: Springer.
Rendell A., Burant J.C., Iyengar S.S., Tomasi J., Cos-
2018. doi 10.1007/978-3-319-90781-9
si M., Rega N., Millam J.M., Klene M., Knox J.E.,
20.
Stanishevskiy V.V., Shestakova A.K., Chertkov V.A.
Cross J.B., Bakken V., Adamo C., Jaramillo J., Gom-
Appl. Magn. Reson. 2022, 53, 1693-1713. doi 10.1007/
perts R., Stratmann R.E., Yazyev O., Austin A.J.,
s00723-022-01503-w
Cammi R., Pomelli C., Ochterski J.W., Martin R.L.,
21.
Abraham R.J., Griffiths L., Perez M. Magn. Reson.
Morokuma K., Zakrzewski V.G., Voth G.A., Salva-
Chem. 2013, 51, 143-155.
dor P., Dannenberg J.J., Dapprich S., Daniels A.D.,
22.
Leshcheva I.F., Torocheshnikov V.N., Sergeyev N.M.,
Farkas O., Foresman J.B., Ortiz J.V., Cioslowski J.,
Chertkov V.A., Khlopkov V.N. J. Magn. Reson. 1991,
Fox D.J. Gaussian 09W, Revision A.02, Gaussian, Inc.,
94, 1-8. doi 10.1016/0022-2364(91)90289-6
Wallingford. 2009
23.
Levitt M.H. Spin Dynamics. New York: Wiley. 2005.
36.
Foresman J.B., Frisch A. Exploring Chemistry with
Electronic Structure Methods. Pittsburgh: Gaussian
24.
Berger S. NMR Basic Principles and Progress. 1990,
Inc. 1996.
22, 1-29.
25.
Hansen P.E. Prog. Nucl. Magn. Reson. Spectrosc. 2020,
37.
Ganina T.A., Cheshkov D.A., Chertkov V.A. Russ.
120, 109-117. doi 10.1016/j.pnmrs.2020.08.001
J. Org. Chem.
2017,
53,
12-23, doi
10.1134/
S1070428017010043
26.
Dziembowska T., Hansen P.E., Rozwadowskia Z. Prog.
Nucl. Magn. Reson. Spectrosc. 2004, 45, 1-29. doi
38.
Godunov I.A., Bataev V.A., Abramenkov A.V.,
10.1016/j.pnmrs.2004.04.001
Pupyshev V.I. J. Phys. Chem. A. 2014, 118, 10159. doi
10.1021/jp509602s
27.
Roznyatovsky V.A., Sergeyev N.M., Chertkov V.A.
Magn. Reson. Chem. 1991, 29, 304-307 doi 10.1002/
39.
Ganina T.A., Chertkov V.A. Russ. J. Org. Chem. 2016,
mrc.1260290404
52, 489-498. doi 10.1134/S1070428016040023
28.
Pietrzak M., Benedict C., Gehring H., Daltrozzo E.,
40.
Chertkov V.A., Shestakova A.K., Davydov D.V. Chem.
Limbach H.H. J. Mol. Struct. 2007, 844-845, 222-231.
Heterocycl. Compd. 2011, 47, 45-54. doi 10.1007/
doi 10.1016/j.molstruc.2007.04.023
s10593-011-0718-z
29.
Guzzo T., Aramini A., Lillini S., Nepravishta R.,
41.
Uvarov V.A., Chertkov V.A., Sergeyev N.M. J. Chem.
Paci M., Topai A. Tetrahedron Lett. 2015, 56, 4455-
Soc. Perkin. Trans. 2. 1994, 2, 2375-2378. doi 10.1039/
4458. doi 10.1016/j.tetlet.2015.05.084
P29940002375
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
1024
СТАНИШЕВСКИЙ и др.
42. Morgan W.D., Birdsall B., Nieto P.M., Gargaro A.R.,
45. Claridge T.D.W. High-resolution NMR Techniques in
Feeney J. Biochemistry. 1999, 38, 2127-2134. doi
Organic Chemistry. Tetrahedron Organic Chemistry
10.1021/bi982359u
Series. Oxford: Elsevier. 2009, 27.
43. Williamson R.T., Buevich A.V., Martin G.E.
Tetrahedron Lett. 2014, 55, 3365-3366. doi 10.1016/
46. Reutov O.A., Barinov I.V., Chertkov V.A., Soko-
j.tetlet.2014.04.060
lov V.I. J. Organomet. Chem. 1985, 297, C25-C29.
44. Berger S., Braun S. 200 and more NMR Experiments.
Oxford, Weinheim: Wiley. 2014.
doi 10.1016/0022-328X(85)80443-5
Dynamic Structure of Organic Compounds in Solution
According to NMR Data and Quantum Mechanical
Calculations: IV. Benzamide
V. V. Stanishevskiya, A. K. Schestakovab, and V. A. Chertkova, *
a Department of Chemistry, Lomonosov Moscow State University, Leninskie gory, 1/3, Moscow, 119991 Russia
b State Scientific Research Institute of Chemistry and Technology of Organoelement Compounds,
Moscow, sh. Entuziastov, 38 105118 Russia
*e-mail: vchertkov@hotmail.com
Received April 28, 2023; revised May 10, 2023; accepted May 11, 2023
To study the structure and dynamics of nitrogen-containing compounds, NMR parameters with directly involved
nitrogen can provide valuable structure information. However, this information can only be obtained using
15N-enriched compounds due to low natural abundance of 15N and extremely short relaxation of 14N nuclei. For
synthesis of these compounds from 15N-ammonium salts, 15N-enriched benzamides often used as intermediates.
In the present work, we study the dynamic structure of benzamide caused by two independent factors: hindered
internal rotation of the NH2 group around the C(O)-N bond and the amide group as a whole relative to the
benzene ring. This deeper knowledge of mechanism and parameters of these processes in amides is important
for meaningful interpretation and prediction of the biological activity of aromatic amides in living systems, the
strength and conformation of its supramolecular complexes with lanthanide and actinide ions. Double enriched
[2H5, 15N]benzamide was synthesized to avoid unwanted superposition of intense aromatic multiplet on the
amide signals in the 1H NMR spectra. In the 1H spectrum of this compound observed only intense signals of
amide protons, which allowed accurate quantitative characterization of the parameters of the dynamic processes
under study. The experimental data obtained is in good agreement with our results of simulation by quantum
molecular dynamics techniques.
Keywords: benzamide, 15N NMR, dynamic structure, 15N enriched synthesis, amide group, dynamic NMR
spectra
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023