ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2023, том 59, № 8, с. 1096-1099
КРАТКИЕ СООБЩЕНИЯ
УДК 547.514.71 + 547.514.472.1
ПРОДУКТ ДВОЙНОГО АЦИЛИРОВАНИЯ
В ПРОМОТИРУЕМОЙ SnCl4 РЕАКЦИИ
4,5-ДИХЛОРЦИКЛОПЕНТ-4-ЕН-1,3-ДИОНА
С 1,3,5-ТРИМЕТОКСИБЕНЗОЛОМ
© 2023 г. В. А. Егоров, Л. С. Хасанова, Ф. А. Гималова*, М. С. Мифтахов
Уфимский Институт химии - обособленное структурное подразделение
ФГБНУ «Уфимского федерального исследовательского центра РАН»,
*e-mail: fangim@anrb.ru
Поступила в редакцию 05.07.2022 г.
После доработки 16.07.2022 г.
Принята к публикации 17.07.2022 г.
Взаимодействием 4,5-дихлорциклопент-4-ен-1,3-диона с 1,3,5-триметоксибензолом в условиях реакции
Фриделя-Крафтса, наряду с ожидаемым 5-(2,4,6-триметоксифенил)-4-хлорциклопент-4-ен-1,3-дионом,
получен дизамещенный продукт - 3,4-бис(2,4,6-триметоксифенил)-2-хлорциклопент-2-ен-1-он.
Ключевые слова: хлорциклопентеноны, 1,3,5-триметоксибензол, реакция Фриделя-Крафтса,
5-арил-4-хлорциклопентен-1,3-дион, замещение
DOI: 10.31857/S0514749223080128, EDN: JQXXSN
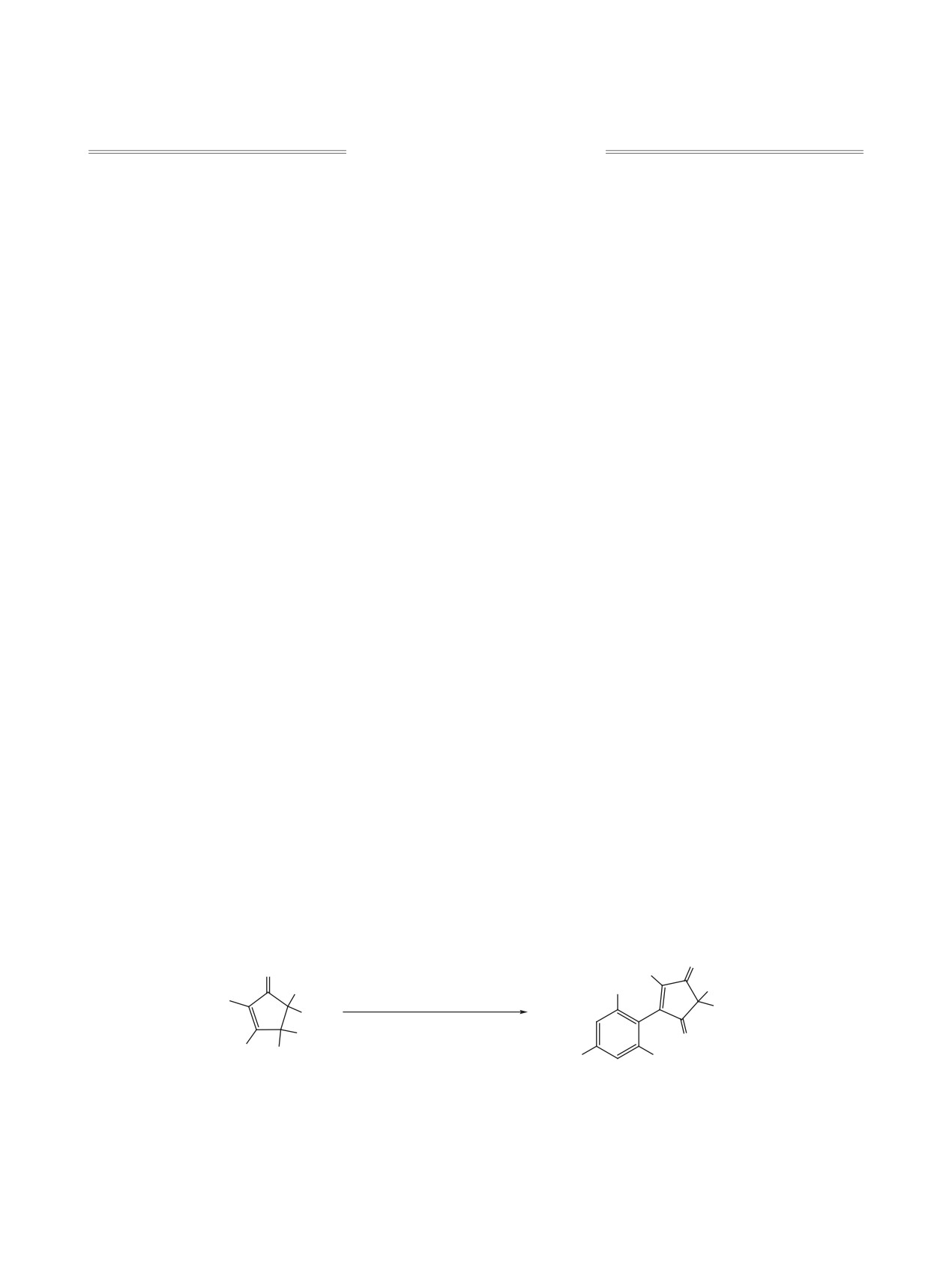
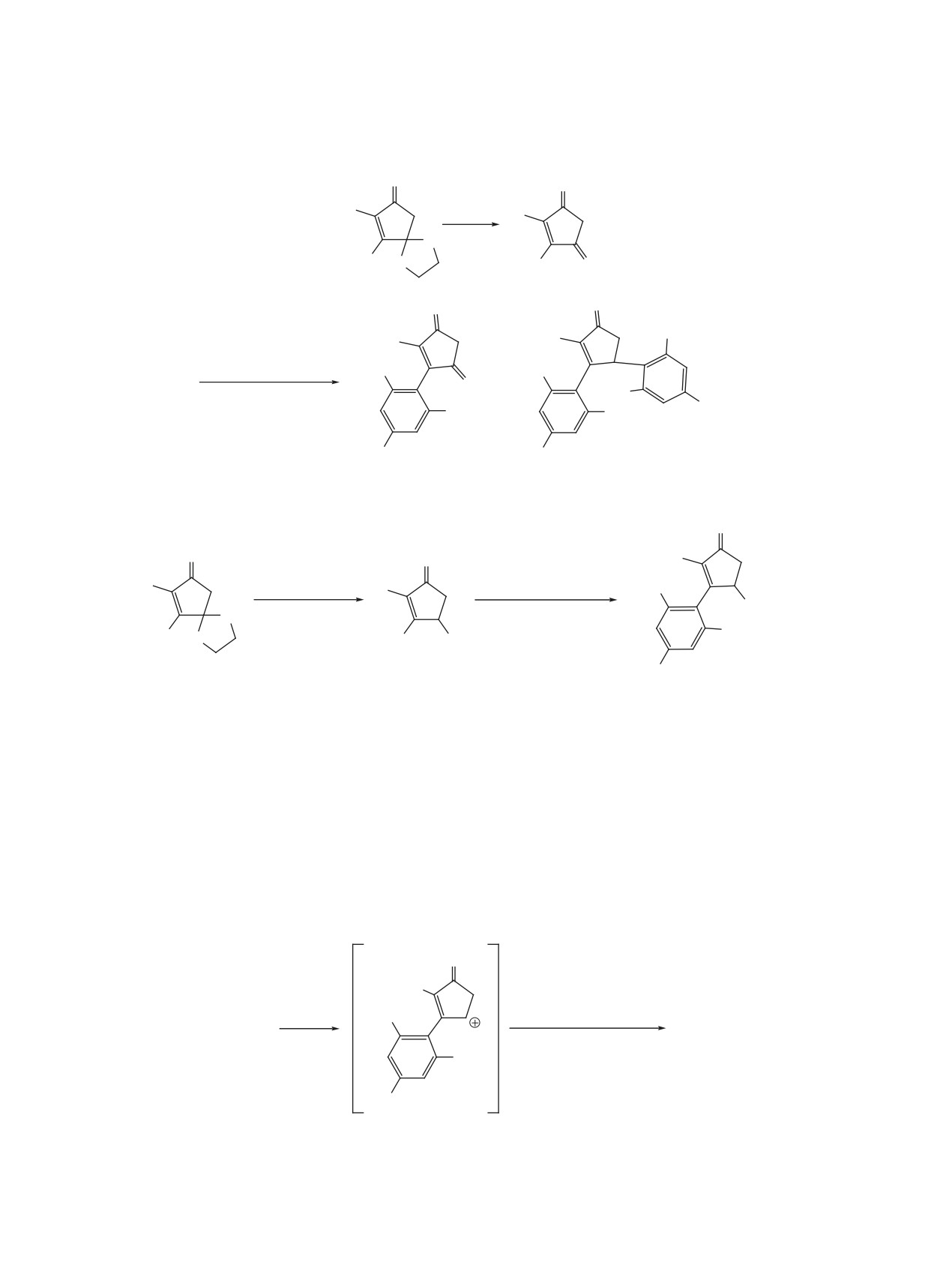
Ранее реакцией ацилирования 1,3,5-триметок-
Образование соединения 5 можно объяснить
сибензола ди- и трихлорциклопентенонами 1a и b
восстановлением одной из кетогрупп промежуточ-
по Фриделю-Крафтсу мы получили замещенные
ного продукта 4 в ходе реакции и последующего
при С3 циклопентендионы 2а, b (cхема 1) [1-3].
замещения ОН-группы второй молекулой триме-
При этом в реакции соединения 1b с 2-кратным
токсибензола по Фриделю-Крафтсу. Для доказа-
избытком триметоксибензола при длительном
тельства этого пути в реакции с триметоксибензо-
кипячении, кроме описанного ранее соединения 4
лом был испытан ранее полученный гидроксике-
[2], был выделен продукт двойного замещения 5
тон 6 [4, 5], который при длительном кипячении
(схема 2).
привел к смеси соединений 7 и 5 (схема 3). По-
Схема 1
O
O
Cl
R
OCH3
R
Cl
1,3,5-Триметоксибензол
X
X
, ДХЭ, кипячение
SnCl4
1
OR
O
Cl
R1O
H3CO
OCH3
1a, b
2a, b
1, R = CH2CH=CH2, X = Cl, R1 = CH2 (a), R = H, X = H, R1-R1 = (CH2)2 (b);
2, R = CH2CH=CH2, X = Cl (a), R = H, X = H (b).
1096
1098
ЕГОРОВ и др.
и 0.251 г (39%) ранее описанного соединения 4
(Iотн, %): 299 (300, 301) (100) [M + H]+. Найдено, %:
[2].
С 56.58; H 5.29; Cl 11.49. С14H15ClO5. Вычислено,
%: С 56.29; H 5.06; Cl 11.87.
3,4-Бис(2,4,6-триметоксифенил)-2-хлорцик-
лопент-2-ен-1-он (5). Желтые кристаллы, т.пл.
ИК спектры получены на спектрофотометре
223-225°C. ИК спектр, ν, см-1: 2925, 2854, 1701,
«IR Prestige-21 Shimadzu» (Япония) для образцов
1607, 1594, 1496, 1462, 1457, 1377, 1341, 1230,
в тонком слое. Спектры ЯМР 1Н и 13С записаны
1207, 1188, 1156, 1145, 1126, 1059, 1033, 951, 822,
на спектрометре «Bruker Avance-500» (Германия)
808, 791. Спектр ЯМР 1Н, δ, м.д.: 2.81 д.д (1Н, СН2,
с рабочими частотами 500.13 и 125.77 МГц соот-
J 2.9, 18.0 Гц), 2.95 д.д (1Н, СН2, J 7.2, 18.1 Гц), 3.70
ветственно, внутренний стандарт - ТМС. Масс-
с (3Н, ОСН3), 3.75 с (3Н, ОСН3), 3.77 с (3Н, ОСН3),
спектры получены на масс-спектрометре LCMS-
3.82 с (6Н, ОСН3), 3.85 с (3Н, ОСН3), 4.87 д.д (1Н,
2010EV (Shimadzu, Япония) (шприцевой ввод, рас-
С4-Н, J 2.9, 7.2 Гц), 6.11 с (1Наром), 6.12 с (1Наром),
твор образца в хлороформе/ацетонитриле при рас-
6.18 с (1Наром), 6.19 с (1Наром). Спектр ЯМР 13С,
ходе 0.1 мл/мин, элюент - ацетонитрил-вода, 95:5,
δ, м.д.: 39.48 (СН2), 41.69 (С4), 55.14 (ОСН3),
режим регистрации положительных ионов при по-
55.32 (ОСН3), 55.38 (ОСН3), 55.83 (ОСН3), 55.91
тенциале игольчатого ионизирующего электрода
(ОСН3), 56.17 (ОСН3), 90.58, 90.88, 91.00 и 91.08
4.5 кВ; температура капилляра интерфейса 250°С,
(С3аром, С5аром), 104.15 и 107.37 (C1аром), 135.18 (С2),
напряжение на капилляре интерфейса 5В). Данные
158.93, 159.25, 160.05, 160.69, 161.85 (С2аром, С6аром,
элементного анализа синтезированных соедине-
C4аром), 170.29 (С3), 203.80 (С=O). Масс-спектр
ний получены на CHNS-анализаторе EuroEA-3000
(EI), m/z (Iотн, %): 449 (450, 451) (100) [M + H]+ .
(Италия). Ход реакции контролировали методом
Найдено, %: С 61.88; H 5.39; Cl 8.19. С23H25ClO7.
ТСХ на пластинках «Сорбфил» (Россия) с обнару-
Вычислено, %: С 61.54; H 5.61; Cl 7.90.
жением веществ щелочным раствором перманга-
ната калия. Продукты синтеза выделяли методом
Взаимодействие соединения 6 с 1,3,5-три-
колоночной хроматографии на силикагеле (30-
метоксибензолом. Проводили в условиях, опи-
60 г адсорбента на 1 г вещества).
санных выше для соединения 3, вводя в реакцию
0.1 г (0.59 ммоль) кетоспирта 6 и 0.2 г (1.2 ммоль)
ЗАКЛЮЧЕНИЕ
1,3,5-триметоксибензола в присутствии 0.14 мл
Изучено взаимодействие
4,5-дихлорцикло-
(1.2 ммоль) SnCl4. После аналогичной преды-
пент-4-ен-1,3-диона и 2,3-дихлор-4-гидроксицик-
дущему опыту обработки реакционной массы и
лопент-2-ен-1-она с двукратным избытком 1,3,5-
разделения продуктов реакции на колонке с SiO2
триметоксибензола, при этом в отличие от ранее
(элюент - петролейный эфир-EtOAc, 10:1) полу-
описанной реакции замещения атома хлора у ато-
чили 61 мг (23%) соединения 5 и 53 мг (30%) со-
ма С5 [1, 2] наблюдается образование продуктов
единения 7.
двойного замещения.
4-Гидрокси-3-(2,4,6-триметоксифенил)-2-
БЛАГОДАРНОСТИ
хлорциклопент-2-ен-1-он (7). Бесцветные кри-
сталлы, т.пл. 181-182°C. ИК спектр, ν, см-1: 3389,
Анализы выполнены на оборудовании ЦКП
2926, 2853, 1703, 1607, 1584, 1495, 1454, 1435,
«Химия» УфИХ УФИЦ РАН.
1418, 1377, 1344, 1335, 1281, 1285, 1225, 1204,
ФОНДОВАЯ ПОДДЕРЖКА
1155, 1132, 1121, 1072, 1042, 968, 961, 806. Спектр
Работа выполнена по теме № 122031400261-4
ЯМР 1Н, δ, м.д.: 2.48 д.д (1Н, СН2, J 2.1, 18.3 Гц),
госзадания УфИХ УФИЦ РАН.
2.62 уш.с (1Н, ОН), 2.94-2.99 м (1Н, СН2), 3.79 с
(3Н, ОСН3), 3.84 с (6Н, ОСН3), 5.31 д.д (1Н, С4-Н,
ИНФОРМАЦИЯ ОБ АВТОРАХ
J 2.0, 6.3 Гц), 6.18 с (2Наром). Спектр ЯМР 13С,
Егоров Виктор Анатольевич, ORCID: https://
δ, м.д.: 43.33 (СН2), 55.50 (ОСН3), 55.90 (ОСН3),
orcid.org/0000-0001-9710-265X
69.88 (С4), 90.99 (С3аром, С5аром), 101.78 (C1аром),
135.33 (С2), 163.06, 163.26 (C2аром, C4аром, C6аром),
Хасанова Лидия Семеновна, ORCID: https://
163.89 (С3), 197.81 (С=O). Масс спектр (EI), m/z
orcid.org/0000-0002-7183-4200
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023
ПРОДУКТ ДВОЙНОГО АЦИЛИРОВАНИЯ В ПРОМОТИРУЕМОЙ SnCl
4
РЕАКЦИИ
1099
Гималова Фануза Арслановна, ORCID: https://
khov M.S. Mendeleev Commun. 2022, 32, 183-185.
orcid.org/0000-0002-5176-1227
doi 10.1016/j.mencom.2022.03.010
3. Егоров В.А., Хасанова Л.С., Гималова Ф.А., Мифта-
Мифтахов Мансур Сагарьярович, ORCID:
хов М.С. ЖОрХ. 2019, 55, 1877-1882. [Egorov V.A.,
Khasanova L.S., Gimalova F.A., Miftakhov M.S. Russ.
J. Org. Chem. 2019, 55, 1869-1873.] doi 10.1134/
КОНФЛИКТ ИНТЕРЕСОВ
S1070428019120091
Авторы заявляют об отсутствии конфликта ин-
4. Ахметвалеев Р.Р., Шавалеева Г.А., Байбулато-
тересов.
ва Г.М., Мифтахов М.С. ЖОрХ. 2001, 37, 1407-1408.
[Akhmetvaleev R.R., Shavaleeva G.A., Baibulato-
СПИСОК ЛИТЕРАТУРЫ
va G.M., Miftakhov M.S. Russ. J. Org. Chem. 2001,
1. Egorov V.A., Gimalova F.A., Zileeva Z.R., Zainulli-
37, 1342-1343.] doi 10.1023/A:1013156326836
na L.F., Vakhitova Yu.V., Miftakhov M.S. Mendeleev
5. Ахметвалеев Р.Р., Акбутина Ф.А., Иванова Н.А.,
Commun.
2019,
29,
174-175. doi
10.1016/
Мифтахов М.С. Изв. АН. Сер. хим. 2001, 50, 1417-
j.mencom.2019.03.019
1435.
[Akhmetvaleev R.R., Akbutina F.A., Ivano-
2. Egorov V.A., Khasanova L.S., Gimalova F.A., Lo-
va N.A., Miftakhov M.S. Russ. Chem. Bull., Int. Ed.
bov A.N., Ishmetova D.V., Vakhitov V.A., Mifta-
2001, 50, 1489-1509.] doi 10.1023/A:1013038427455
Double Acylation Product in the SnСl4-Promoted Reaction
of 4,5-Dichlorocyclopent-4-en-1,3-dione
with 1,3,5-Trimethoxybenzene
V. A. Egorov, L. S. Khasanova, F. A. Gimalova*, and M. S. Miftakhov
Ufa Institute of Chemistry, Ufa Federal Research Center of the Russian Academy of Sciences
prosp. Oktyabrya, 71, Ufa, 450054 Russia
*e-mail: fangim@anrb.ru
Received July 5, 2022; revised July 16, 2022; accepted July 17, 2022
The interaction of 4,5-dichlorocyclopent-4-en-1,3-dione with 1,3,5-trimethoxybenzene under Friedel-Crafts
reaction conditions along with the expected 5-(2,4,6-trimethoxyphenyl)-4-chlorocyclopent-4-ene-1,3-dione
obtained disubstituted product - 3,4-bis-(2,4,6-trimethoxyphenyl)-2-chlorocyclopent-2-en-1-one.
Keywords: chlorocyclopentenones, 1,3,5-trimethoxybenzene, Friedel-Crafts reaction, 5-aryl-4-chlorocyclo-
pentene-1,3-dione, substitution
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 59 № 8 2023