ПАРАЗИТОЛОГИЯ, 53, 2, 2019
УДК 616-094
ПЕРСПЕКТИВА ПРИМЕНЕНИЯ ПРОТЕОМНОГО АНАЛИЗА
НА ОСНОВЕ MALDI-TOF MS ДЛЯ ДИФФЕРЕНЦИАЦИИ
НЕМАТОД НА ПРИМЕРЕ ИЗУЧЕНИЯ БЕЛКОВЫХ
ПРОФИЛЕЙ АСКАРИД И ДИРОФИЛЯРИЙ
© 2019 г. С. А. Нагорный1*, А. В. Алешукина1, И. С. Алешукина1,
Л. А. Ермакова1, Н. Ю. Пшеничная1, 2
1 ФБУН Ростовский НИИ микробиологии и паразитологии Роспотребнадзора,
пер. Газетный 119, Ростов-на-Дону, 344000 Россия
2 ФБУН Центральный НИИ эпидемиологии Роспотребнадзора, ул. Новогиреевская 3а,
Москва, 111123 Россия
* е-mail: ya.parazitov-net@yandex.ru
Поступила в редакцию 18.10.2018 г.
После доработки 18.11.2018 г.
Принята к публикации 18.11.2018 г.
Приведены результаты изучения белковых профилей нематод, актуальных для юга России
(дирофилярий и аскарид), с помощью протеомного анализа на основе MALDI-TOF MS. Анализ
белковых экстрактов дирофилярий и аскарид показал спектры с пиками высокой интенсивности
в диапазоне 2-20 kDa, качество спектров и интенсивности спектральных пиков согласовывалось
у всех образцов одного вида. Профили спектров дирофилярий D. repens и D. immitis различа-
лись по восьми мажорным пикам. Профили спектров, полученные из белков аскарид A. suum и
А. lumbricoides, минимально различались по 5 из 8 мажорных пиков, что создает возможность
для дифференциации этих видов по белковому профилю. Таким образом, метод протеомного
анализа на основе MALDI-TOF MS может служить эффективным таксономическим инструмен-
том при паразитологических исследованиях.
Ключевые слова: белковый профиль, MALDI-TOFF MS, нематоды, дирофилярии, аскаридаты.
DOI: 10.1134/S0031184719020054
Определение возбудителя на основе анализа его белкового спектра (протеомные ис-
следования) является относительно новым направлением лабораторной диагностики
инфекционных болезней. В частности, масс-спектрометрический анализ показал свою
эффективность в качестве достоверного метода диагностики ряда бактериальных ин-
фекций, прочно заняв свою нишу с начала нового тысячелетия при идентификации
возбудителей инфекционных заболеваний в педиатрической практике (Крыжановская
и др., 2014).
Первые исследования потенциала MALDI-TOF MS (Matrix Assisted Laser Desorption/
Ionization-Time Off Flight Mass Spectrometry) для изучения белкового профиля нема-
тод с неустановленным геномом были предприняты в 2007 г. специалистами Брази-
лии (León et al, 2007). В дальнейшем этот метод был применен с целью дифференциа-
ции белков протосколексов многокамерного эхинококка (Wang et al, 2009). Корейские
специалисты также изучали изменения белкового профиля клеток холангиокарци-
136
номы, обработанных экскреторно-секреторными антигенами Clonorchis sinensis
(Pak et al, 2009).
Кроме того, проводились исследования по дифференциации белковых профилей
мужских и женских особей возбудителя японского шистосомоза (Yuan et al, 2009).
Данный метод показал свою эффективность в качестве способа быстрой диагностики
нематод, паразитирующих на сельскохозяйственных культурах (Ahmad et al, 2012).
В Российской Федерации на сегодняшний день методы протеомного анализа в па-
разитологических исследованиях не применялись. Принимая во внимание опыт зару-
бежных ученых, мы использовали метод MALDI-TOF MS для изучения белковых про-
филей нематод, актуальных для юга России: дирофилярий (Dirofilaria repens (Railliet
et Henry, 1911) и Dirofilaria immitis (Leidy, 1856) и аскрид (Ascaris lumbricoides (Linnaues,
1758) и Ascaris suum (Goeze, 1782).
Целью настоящей работы явилось изучение потенциала методов протеомного анали-
за на основе MALDI-TOF MS для таксономической дифференциации нематод.
МАТЕРИАЛ И МЕТОДИКА
Материалом для исследования послужили головные концы десяти неполовозрелых
самок дирофилярий (пять особей каждого вида). Особи D. repens были выделены опе-
ративным путем у больных людей из подкожной клетчатки, D. immitis из сердца у со-
бак. Из десяти молодых, неполовозрелых аскарид, взятых в исследование, пять особей
A. lumbricoides отошли естественным путем у пациентов, пять образцов A. suum были
выделены из кишечника свиней на бойнях.
Подготовку проб осуществляли по оригинальной авторской методике. Для проведе-
ния исследования методом MALDI-TOF MS гельминтов отмывали в изотоническом
растворе хлорида натрия, затем отделяли головной конец тела (20 мм), поскольку
в районе глотки расположены стихоцитные клетки, или, в случае с D. repens, если дли-
на гельминта не превышала 60 мм, то брали паразита целиком. Аскаридат помещали
на 24 ч в 0.9 % раствор NaCl с добавлением 100 ед./мл феноксиметилпенициллина
(пенициллин V) и 100 мкг/мл стрептомицина. Биологический материал замораживали
и пятикратно гомогенизировали механически в замороженном состоянии с последую-
щей обработкой ультразвуком при 70 кГц 5 раз по 30 с в 3 циклах на спиртовой бане
(-30 qC). Для лизиса клеток добавляли лизис буфер из набора MALDI SepsityperKit 50
(Bruker) и встряхивали на вортексе 10 с. Для улучшения качества спектра проводили
экстракцию в 20 μl 70 % муравьиной кислоты. Затем в пробирку добавляли анало-
гичное количество (20 μl) 50 % ацетонитрила. Гомогенизаты центрифугировали при
13000 оборотах в минуту в течение 2 мин. 1 μl супернатанта образца наносили на
стальную пластину (Bruker) в двух последовательностях. Мишень сушили в течение
нескольких минут (5-15) при комнатной температуре. Далее на каждый образец нано-
сили 1 μl матрицы CHCA (α-Cyano-4-hydroxycinnamicacid), после чего пробы просу-
шивали и помещали в масс-спектрометр для анализа.
Профили масс-белка гомогенизатов получали с использованием Microflex
LT MALDI-TOF MS (Bruker Daltonics) с программным обеспечением FlexControl
(Bruker Daltonics). Визуализацию проводили с помощью программного обеспечения
Flex analysis 3.3 (Bruker Daltonics).
РЕЗУЛЬТАТЫ
Масс-спектрометрический анализ белковых экстрактов дирофилярий показал спек-
тры с пиками высокой интенсивности в диапазоне 2-20 кДа. Качество спектров и ин-
тенсивности спектральных пиков согласовывалось у всех образцов одного вида. При
137
использовании Flex analysis отмечено, что профили спектров, полученные из белков
дирофилярий различных видов, в данном случае D. repens и D. immitis, различались
по восьми мажорным пикам, что позволяет дифференцировать по белковому профилю
один вид от другого (рис.1, 2).
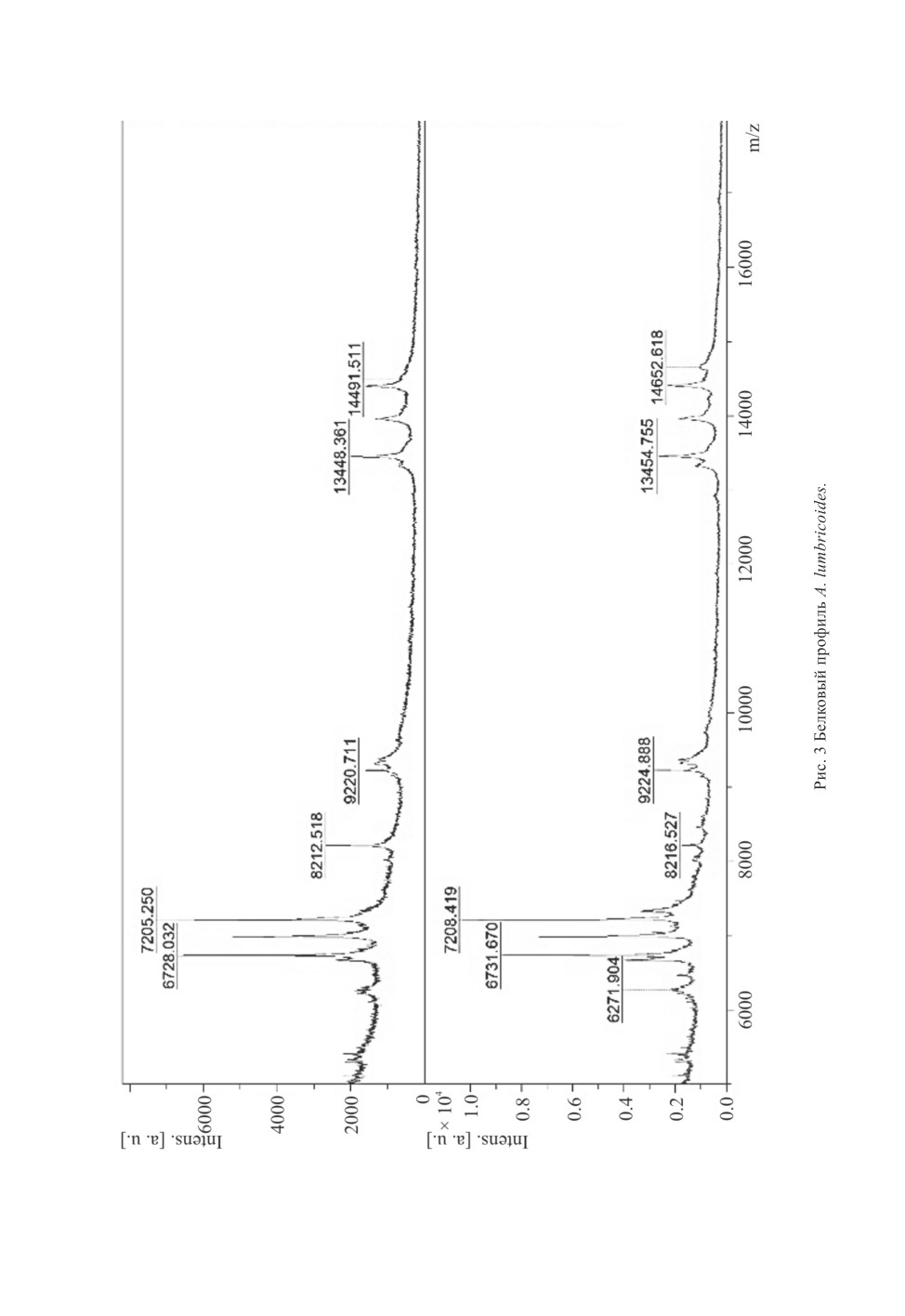
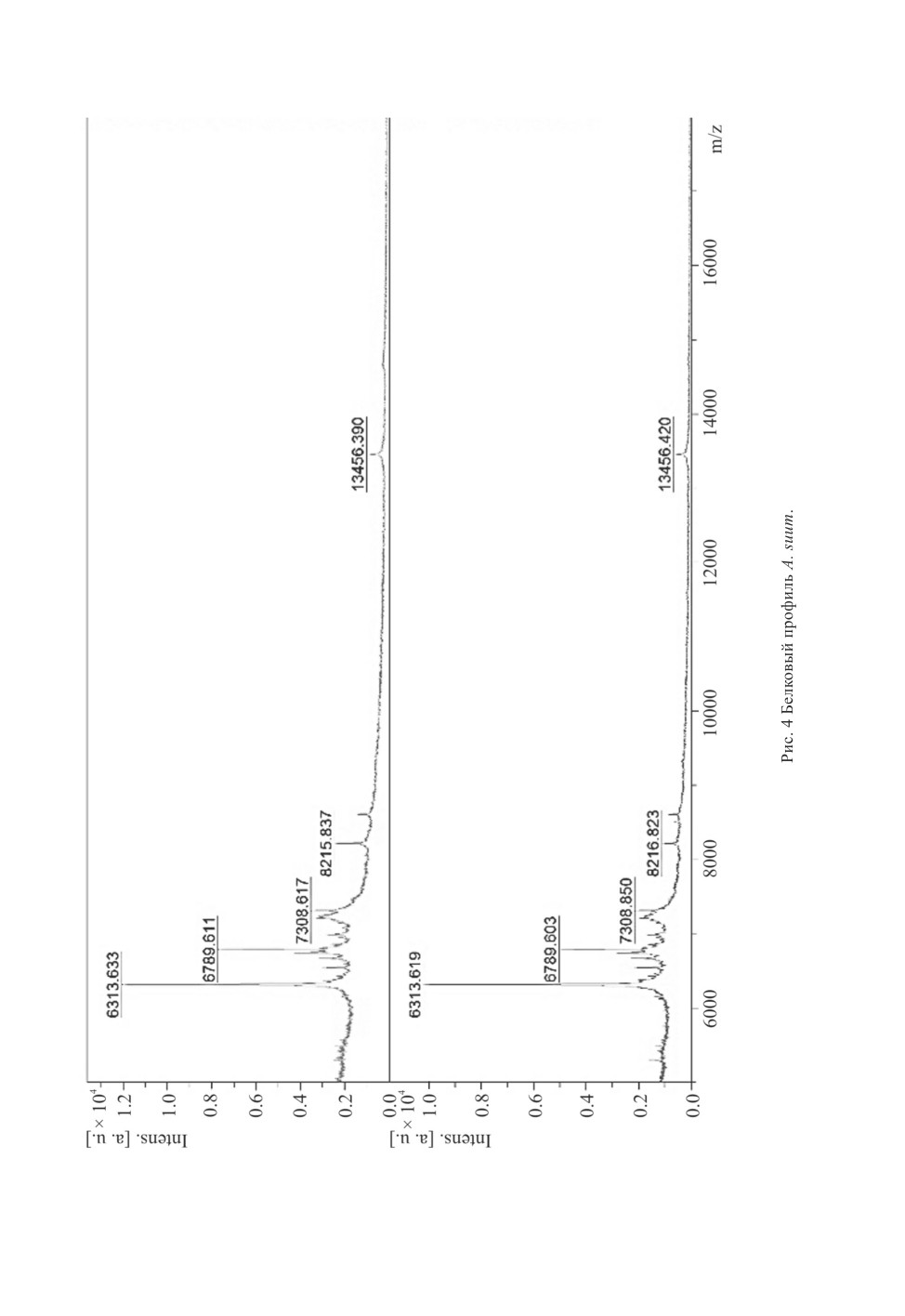
Масс-спектрометрический анализ белковых экстрактов аскарид показывал спектры
с пиками высокой интенсивности в диапазоне 2-20 кДа. Распределение паттернов и
интенсивности спектральных (масс-пролетных) пиков со схожей массой было единоо-
бразным у всех образцов одного вида аскарид, что доказывалось идентичными профи-
лями при наложении масс-спектрометрических пиков друг на друга. Тем не менее, при
использовании Flexanalysis отмечено, что профили спектров, полученные из белков
аскарид A. suum и А. lumbricoides, минимально различаются по 5 из 8 мажорных пиков
(рис. 3, 4), что делает возможным дифференцировать по белковому профилю один вид
от другого.
ОБСУЖДЕНИЕ
Одной из относительно новых проблем территорий умеренного климата является
единственный трансмиссивный гельминтоз, встречающийся у жителей данных реги-
онов - дирофиляриоз. Следует отметить, что частота инвазии человека двумя основ-
ными патогенами данного вида (D. repens и D. immitis) значительно варьирует в раз-
личных континентах и странах (Криворотова 2015), очевидно за счет преобладания
того или иного вида филярий у окончательных хозяев - животных семейства псовых,
и энтомологической структуры векторов трансмиссии, обусловленной природно-кли-
матическими условиями (Криворотова, 2016). Длительное наблюдение за динамикой
видового состава дирофилярий у наиболее эпидемиологически значимого источника
инвазии для человека - домашних собак - свидетельствует об изменчивости структу-
ры видов дирофилярий (Nagorny et al.,2018), паразитирующих у данных животных.
В последние десять лет отмечается значительное увеличение доли D. immitis на юге
России. Если в 2000 г. доля инвазии D. repens у окончательных хозяев составляла
76.5 %, D. immitis 23.5 %, а инвазии 2 паразитами не регистрировались, то в 2010 г.
соотношение инвазии D. repens к D. immitis и к микст составило 1 : 1 : 1 (33.3 %).
К 2017 г. экстенсивность инвазии домашних собак D. repens составила всего
14.5 %.Однако на сегодняшний день в данном регионе регистрируются в основном
случаи инвазии человека D. repens (Ermakova et al., 2017). Не исключено, что в данном
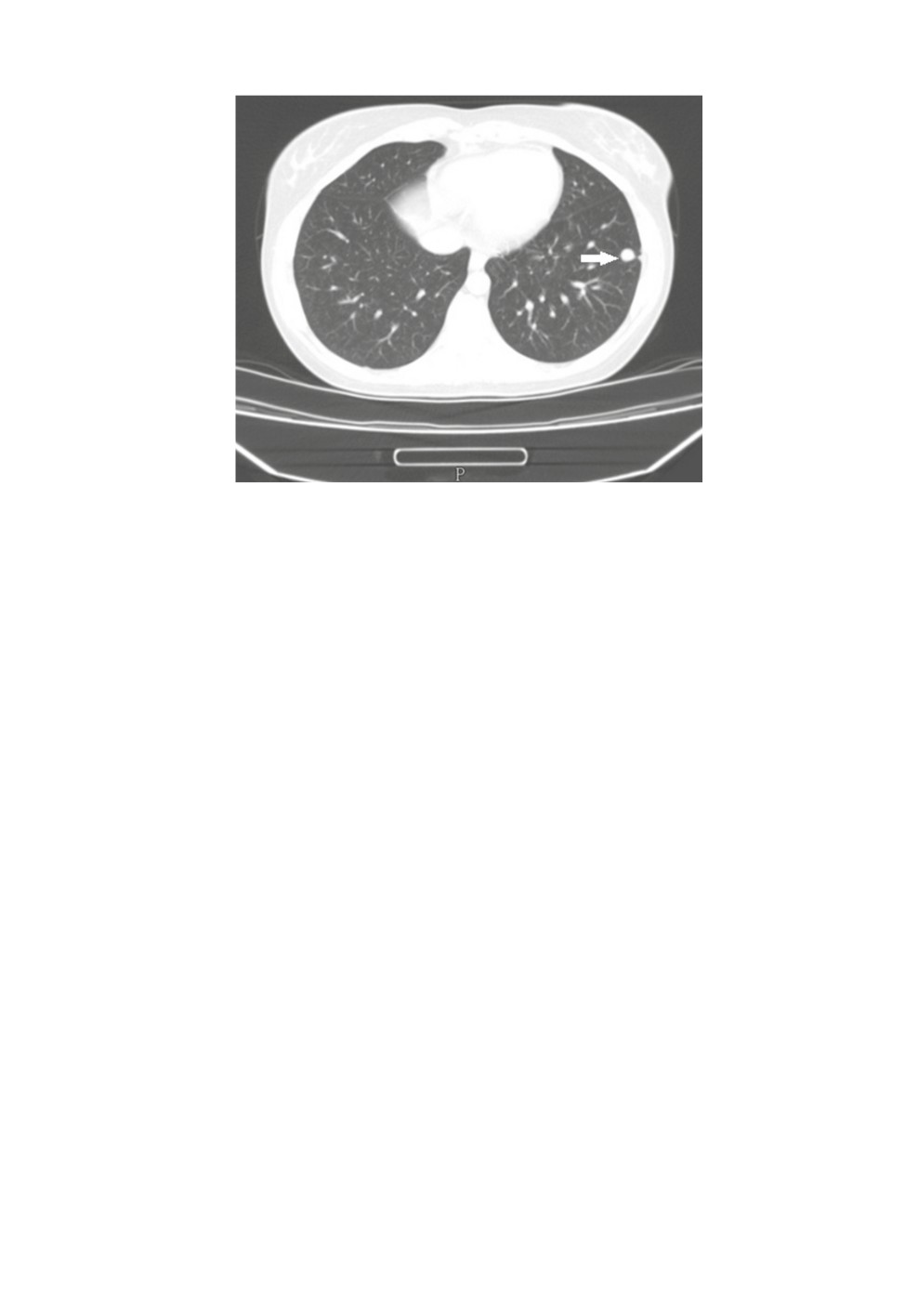
случае имеет место гиподиагностика инвазии D. immitis у жителей юга России. На-
пример, в 2017 г. мы наблюдали случай, предположительно легочного дирофиляриоза,
у жительницы Ростовской области (рис. 5). В июле 2018 г. в Воронежской области была
прооперирована местная жительница по поводу новообразования в правом лёгком,
в гистологических препаратах были обнаружены поперечные срезы D. immitis.
«Золотым стандартом» диагностики дирофиляриоза человека является морфоло-
гическая идентификация гельминтов, удаленных при хирургическом вмешательстве.
Однако в случае повреждения нематоды при хирургическом вмешательстве диагности-
ческая значимость данного метода значительно снижается. Использование масс-спек-
трометрического метода при анализе фрагментов паразита позволит с высокой точ-
ностью определить его видовую принадлежность. По данным зарубежных ученых,
данный метод показал высокую диагностическую значимость при диагностике таких
протозоозов как лейшманиозы и трихомониаз (Cassagne, 2013; Calderaro, 2016).
В структуре заболеваемости населения геогельминтозами доля инвазии нематодами
семейства Ascarididae составляет более 50 %. Однако кишечный аскаридоз человека
вызывают только A. lumbricoides и A. suum (Nejsum et al., 2005; Arizono et al., 2010).
В зарубежной литературе обсуждаются генетические особенности и происхождение
138
Рис. 5. Компьютерная томограмма легких (июль 2017).
этих двух, наиболее широко распространенных и патогенных для человека видов аска-
рид. По мнению ряда зарубежных ученых (Leles et al., 2012; Chang-Chun et al., 2014;
Betson et al., 2016), эти виды обладают тесным генетическим сродством. C учетом ре-
зультатов молекулярно-генетического исследования полиморфизма рибосомальной
ДНК данных гельминтов (Peng, 2003) авторы предполагают, что A. lumbricoides являет-
ся потомком A. suum. В отличие от дирофилярий, в белковых профилях A. lumbricoides
и A. suum отмечаются минимальные различия, что согласуется с данными зарубежных
ученых о близком родстве указанных гельминтов и косвенно подтверждает потенци-
альную патогенность A. suum для человека.(Nejsum et al., 2005; Arizono et al., 2010).
ЗАКЛЮЧЕНИЕ
Масс-спектрометрическое биотипирование относится к прямым методам диагно-
стики инфекционных болезней, и, в отличие от традиционной бактериологии, являет-
ся более экономичным по временным и трудовым затратам. Полученные результаты
показывают возможности метода масс-спектрометрии для видовой дифференциации
нематод, который может применяться в качестве эффективного таксономического ин-
струмента при паразитологических исследованиях.
MALDI-TOF MS позволит определять видовую принадлежность не только целых
гельминтов, но и их фрагментов (в отличие от других методов), что в значительной
степени оптимизирует диагностику паразитарной инвазии, в частности дирофиля-
риоза, при минимальных материальных, временных и трудовых затратах. Создание
библиотеки масс-спектрометрических профилей нематод на базе MALDI Sepsityper
Kit 50 позволит использовать метод наравне с «золотым стандартом».
СПИСОК ЛИТЕРАТУРЫ
Криворотова Е.Ю. 2015. Биологические аспекты дирофиляриоза в ряде субъектов Российской Федерации.
Автореф. дис
канд. биол. наук. М., 24 с.
Криворотова Е.Ю., Нагорный C.А. 2016. Ксеномониторинг дирофиляриоза на юге и северо-западе Россий-
ской Федерации. Паразитология 5 (50): 357-364.
Крыжановская О.А., Лазарева А.В., Пономаренко О.А., Катосова Л.К., Тепаев Р.Ф., Карасева О.В., Чебо-
тарь И.В. 2014. Масс-спектрометрическая идентификация возбудителей инфекций кровотока: опыт
в педиатрической практике. Российский педиатрический журнал 5: 4-9.
143
Arizono N., Yoshimura Y., Tohzaka N. et al. 2010. Ascariasis in Japan: is pig-derived Ascaris infecting humans?
Japan Journal of Infectious Diseases 63 (6): 447-448.
Ahmad F., Gopal J., Wu H.F. 2012. Rapid and highly sensitive detection of single nematode via direct MALDI Mass
Spectrometry. Talanta 93: 182-5. doi: 10.1016/j.talanta.2012.02.009.
Betson M., Stothard J.R. 2016. Ascaris lumbricoides or Ascaris suum: What’s in a Name? Japan Journal of Infectious
Diseases 213 (8): 1355-1356. doi: 10.1093/infdis/jiw037.
Calderaro A., Piergianni M., Montecchini S., Buttrini M. et al. 2016. MALDI-TOF mass spectrometry as a potential
tool for Trichomonas vaginalis identification. BMC Infectious Diseases 16: 261. doi: 10.1186/s12879-016-
1594-z.
Cassagne C., Pratlong F., Jeddi F., et al. 2013. Identification of Leishmania at the species level with matrix-assisted
laser desorption ionization time-of-flight mass spectrometry. Clinical Microbiology and Infection. European
Society of Clinical Microbiology and Infectious Diseases, CMI 20, 551-557. doi: 10.1111/1469-0691.12387.
Chang-Chun Shao, Min-Jun Xu, Alasaad S., et al. 2014. Comparative analysis of microRNA profiles between adult
Ascaris lumbricoides and Ascaris suum. BMC Veterinary Research 10: 99. doi: 10.1186/1746-6148-10-99.
León I.R., Neves-Ferreira A.G., Valente R.H., Mota E.M., Lenzi H.L., Perales J. 2007. Improved protein
identification efficiency by mass spectrometry using N-terminal chemical derivatization of peptides from
Angiostrongylus costaricensis, a nematode with unknown genome. Journal of Mass Spectrometry 42 (6):
781-92. doi: 10.1002/jms.1214.
Ermakova L., Nagorny S., Pshenichnaya N., Ambalov Y., Boltachiev K. 2017. Clinical and laboratory features of
human dirofilariasis in Russia. ID Cases 19 (9): 112-115. doi: 10.1016/j.idcr.2017.07.006.
Leles D., Gardner S.L., Karl R., et al. 2012. Are Ascaris lumbricoides and Ascaris suum a single species? Parasites
and Vectors 20 (5): 42. doi: 10.1186/1756-3305-5-42.
Nagorny S., Ermakova L., Pshenichnaya N., Krivorotova E., Zhuravlev A. 2018. Epidemiological features of human
Dirofilariasis in the south of Russia. International Journal of Infectious Diseases 73 (S): 313-313. doi: https://
doi.org/10.1016/j.ijid.2018.04.412.
Nejsum P.E., Parker D., Frydenberg J., Roepstorff A. et al. 2005. Ascariasis is a zoonosis in Denmark. Journal of
Clinical Microbiology 43 (3): 1142-1148. doi: 10.1128/JCM.43.3.1142-1148.2005.
Pak J.H., Moon J.H., Hwang S.J., Cho S.H., Seo S.B., Kim T.S. 2009. Proteomic analysis of differentially expressed
proteins in human cholangiocarcinoma cells treated with Clonorchis sinensis excretory-secretory products.
Journal of Cell Biochemistry 108 (6): 1376-1388. doi: 10.1002/jcb.22368.
Peng W., Yuan K., Zhou X., Hu M. et al. 2003. Molecular epidemiological investigation of Ascaris genotypes in
China based on single-strand conformation polymorphism analysis of ribosomal DNA. Electrophoresis 24
(14): 2308-2315. doi: 10.1002/jcb.22368.
Wang Y., Cheng Z., Lu X., Tang C. 2009. Echinococcus.multilocularis: Proteomic analysis of the protoscoleces by
two-dimensional electrophoresis and mass spectrometry. Experimental Parasitology 123 (2): 162-167. doi:
10.1016/j.exppara.2009.06.014.
Yuan S.S., Xing X.M., Liu J.J., Huang Q.Y., Yang S.Q., Peng F. 2009. Screening and identification of differentially
expressed proteins between adult female and male worms of Schistosoma japonicum. Zhonghua Yu Fang Yi
XueZaZhi 43 (8): 695-699.
PROSPECT OF THE USE OF PROTEOMIC ANALYSIS ON THE BASE
OF MALDI-TOF MS FOR DIFFERENTIATION OF NEMATODES
WITH AN EXAMPLE OF PROTEIN PROFILES OF ASCARIDES
AND DIROFILLARIANS
S. A. Nagornyi, A. V. Aleshukina, I. S. Aleshukina, L. A. Ermakova, N. Yu. Pshenichnaya
Key words: protein profile, MALDI-TOFF MS, nematodes, dirofillarians, ascarides.
SUMMARY
This paper presents the results of investigation of the protein profiles of nematodes that are relevant
for the south of Russia (dirofilaria and ascaris) using the proteomic method MALDI-TOF MS. Analysis
of protein extracts of dirofilarians and ascrides showed spectra with high-intensity peaks in the range
of 2-20 kDa, the quality of the spectra and the intensity of the spectral peaks were consistent in all
samples of the same species. The profiles of the spectra of Dirofilaria. repens and D. immitis differed in
eight major peaks. The spectra profiles obtained from A. suum and A. lumbricoides proteins differed in
5 out of 8 major peaks. MALDI-TOFF MS makes it possible to differentiate one species of nematode
from another according to the protein profile. So the method of mass spectrometry can be an effective
taxonomic tool in parasitological studies.
144