ПАРАЗИТОЛОГИЯ, 2021, том 55, № 1, с. 12-31.
УДК 571.27: 595.143
роль Антимикробных пептидов
в Иммунитете паразитических пиявок
(aNNELIDA, hIRUDINEA)
© 2021 г. И. А. Кайгородова*
Лимнологический институт СО РАН,
ул. Улан-Баторская, 3, Иркутск, 664033 Россия
* e-mail: irina@lin.irk.ru
Поступила в редакцию 20.08.2020 г.
После доработки 21.10.2020 г.
Принята к печати 25.10.2020 г.
В обзоре кратко изложено современное состояние знаний об иммунитете пиявок с особым
акцентом на роль антимикробных пептидов (АМП), подчеркивается широкое разнообразие
первичных структур АМП, которые, по-видимому, коррелируют с разнообразием жизненных
стратегий и экологией эктопаразитов. Антимикробные белки и пептиды представляют собой
разнообразный класс природных молекул, которые вырабатываются всеми живыми организмами
в ответ на атаку патогена и которые являются важнейшим компонентом иммунной системы.
АМП могут обладать широким спектром антибиотической активности против чужеродных и
потенциально патогенных бактерий, грибков и вирусов. Не последнюю роль АМП играют при
отборе колонизирующих бактериальных симбионтов, что помогает многоклеточным организ-
мам справляться с определенными экологическими проблемами. Особенно важны АМП для
беспозвоночных ввиду отсутствия у них системы адаптивного иммунитета. Хотя многие АМП
обладают сходными физико-химическими свойствами (общий размер от 10 до 100 аминокислот,
суммарный положительный заряд или высокое содержание цистеинов), их иммуномодулирующая
активность специфична для каждого такого пептида.
Ключевые слова: паразитирующие пиявки, иммунитет, антимикробные пептиды
DOI: 10.31857/S0031184721010026
Пиявки (Hirudinea) относятся к классу кольчатых червей (Clitellata, Annelida), для
половозрелых особей которых характерен поясок, особый орган, вырабатывающий
репродуктивный кокон. В настоящее время известно более 720 видов пиявок, которые
распространены в пресных, морских и наземных экосистемах по всему миру, и более
двух третей этого биоразнообразия составляют паразитические виды (Sket, Trontelj,
2008; Kaygorodova et al., 2020). Пиявки возникли порядка 540 млн лет назад во время
кембрийского взрыва, в период бурного биологического развития (Pfeiffer et al., 2005;
Kaygorodova, Sherbakov, 2006; McDougall et al., 2008). Считается, что ближайшим
предком паразитических пиявок являются олигохеты. Первые пиявкоподобные черви
(Acanthobdellida) мозаично сочетают в своем строении примитивные признаки олигохет
12
семейства Lumbriculidae с признаками, присущими современным пиявкам (Ливанов,
1905; Kaygorodova, 2012; Kaygorodova et al., 2012). Филогенетические исследования
показывают, что общим предком истинных пиявок (Euhirudinea), вероятно, была кро-
вососущая пиявка с хоботком (Arhynchobdellida), а не специфический эктокомменсал,
как предполагали ранее (Trontelj et al., 1999). В ходе эволюции у хищных аринхоб-
деллидных предков пиявок могла произойти редукция хоботка, что позволило им
проглатывать более крупную добычу. Вторичная приспособленность к кровососанию
у бесхоботных пиявок отряда Hirudiniformes могла возникнуть благодаря преадаптации
к эктопаразитарному питанию кровью. Кроме того, транскриптомный анализ выявил
высокую гомологию генетических последовательностей челюстной (бесхоботной)
пиявки Hirudo medicinalis и млекопитающих (Macagno et al., 2010), что может свиде-
тельствовать о коэволюции в системе «хозяин-паразит» посредством молекулярной
мимикрии паразита (Salzet et al., 2000).
В ходе эволюции пиявки выработали разные стратегии иммунной защиты, однако,
как и другие беспозвоночные, они не обладают системой приобретенного иммуни-
тета с системой диверсификации антител. Защищаясь от микробов, живущих в воде
или почве и попадающих в организм с пищей или при травме, пиявки используют
систему врожденного иммунитета в качестве основной защиты от потенциальных
патогенов (Dhainaut, Scaps, 2001). Особая роль в их иммунном ответе принадлежит
антимикробным пептидам (АМП), эволюционно консервативной группе защитных
полипептидов (Ageitos et al., 2017).
Первым зарегистрированным АМП был лизоцим, открытый Александром Флемин-
гом в 1922 г. Интерес к лизоциму угас после открытия пенициллина и начала «золотого
века антибиотиков». Однако уже в 1960-х появление и рост микробных патогенов,
устойчивых к антибиотикам, пробудил новую волну интереса к AMП. С тех пор АМП
были выявлены практически во всех живых организмах, от архей до млекопитаю-
щих. В настоящее время в базе данных по антимикробным пептидам хранится более
Благодаря древнему происхождению и широкому распространению в природе, АМП
остаются ключевым компонентом иммунной системы. Известно, что АМП обладают
широким спектром действия против патогенных бактерий, грибков и вирусов, обла-
дающих оболочкой, а также губительны для паразитов и раковых клеток (de Eguileor
et al., 2003). Кроме того, АМП принимают участие в регуляции качества и количества
мутуалистических и комменсальных симбионтов, тем самым способствуя симбиостазу
путем контроля, формирования состава и при необходимости ограничения активности
симбиотической микрофлоры в определенных анатомических компартментах (кишеч-
ник, бактериомы, кожа) (Tasiemski et al., 2015). Как известно, симбионты представляют
собой быстрый источник инноваций, что позволяет животным приспосабливаться
к изменяющейся среде обитания (Macke et al., 2017), следовательно, АМП могут косвен-
но участвовать в способности пиявок справляться с изменениями окружающей среды.
Использование пиявки в качестве модельного организма в иммунологических ис-
следованиях имеет свои преимущества. Являясь водным эктопаразитом, пиявка своим
покровным эпителием вынужденно контактирует не только с множеством микроорга-
низмов окружающей ее среды, но и с внешними покровами хозяина, имеющими свой
состав эктосимбионтов и защитных молекул. В период питания, что случается редко,
пиявки максимально используют предоставленную возможность, потребляя вдвое
больше собственного веса (Sawyer, 1986). При этом пища переваривается чрезвычай-
13
но медленно, и кровь хозяина сохраняется в кишечнике паразита длительное время
(до нескольких месяцев у медицинских пиявок). Должно быть, в пищеварительной
системе пиявок имеется защитный механизм, адаптированный к патогенам хозяина и
предотвращающий гнилостные процессы. Не менее важным свойством пиявок явля-
ется их способность к регенерации центральной нервной системы и восстановлению
ее функций после травмы (Burrell et al., 2003). Анатомические особенности пиявки
облегчают использование нервного тяжа пиявки in vitro. Нервный тяж довольно лег-
ко поддерживать в культуре в течение нескольких недель в отсутствие компонентов
периферической иммунной системы и клеток крови, что позволяет сфокусировать
исследования на собственном иммунном ответе, развиваемом нервной системой пи-
явки (Schikorski et al., 2008). Более того, как показали клинические исследования,
использование пиявок в лечебных целях не вызывает иммунных реакций со стороны
пациента (Singh, 2010).
В обзоре рассматриваются особенности иммунной системы пиявок с акцентом на
роль в ней антимикробных пептидов (АМП), подчеркивается разнообразие первич-
ных структур AMП, фокусируется внимание на их функциональных особенностях и
механизмах действия, а также на перспективах практического применения АМП не
только в медицине, но и в других отраслях человеческой деятельности.
Иммунная система пиявок
Пиявки, как и другие беспозвоночные животные, обладают системой врожденного
иммунитета, в их иммунном ответе отсутствует адаптивный (приобретенный) ком-
понент, появившийся на более поздних этапах эволюции у позвоночных (Hoffmann
et al., 1999). Врожденный иммунитет играет важную роль в качестве первого барьера
от микробов. Эффекторы врожденного ответа включают рецепторы распознавания
образов, фагоцитарные клетки, протеолитические каскады и полипептиды с анти-
микробными свойствами. Несмотря на общность врожденной защиты, исследования
генома показали, что даже представители одного и того же отряда беспозвоночных
используют разные подходы к внутренней защите (Loker et al., 2004). Особенность
пиявок состоит в том, что они имеют тесные ассоциации как с симбионтами, которые
могут играть важную роль во внутренней защите, так и вынужденные контакты с хо-
зяевами, на которых они паразитируют. Примером может служить медицинская пиявка
Hirudo verbana, пищеварительный тракт которой необычен в двух аспектах: содержит
простое микробное сообщество и хранит большое количество крови позвоночных
в течение нескольких месяцев (Silver, Graf, 2011).
В ходе длительной эволюции пиявки выработали несколько стратегий иммунной
защиты от микробов, с которыми они контактируют в воде или почве, а также защитные
механизмы от патогенов, что попадают в организм с пищей или после травмы (Salzet
et al., 2006). При этом пиявки относятся к группе примитивных вторичнополостных
или целомических животных и анатомически характеризуются наличием двух компар-
тментов, содержащих свободные клетки. Во-первых, это система крови с гемоцитами:
этот компартмент, по-видимому, активно не связан с иммунитетом; и, во-вторых, целом,
в котором содержится несколько популяций целомоцитов, играющих определенную
роль в иммунной защите. Пиявки обладают специально развитым клеточным имму-
нитетом, направленным против патогенных микроорганизмов, включая фагоцитоз,
инкапсуляцию и спонтанную цитотоксичность целомоцитов в отношении аллоген-
ных или ксеногенных клеток. Дополнительно они выработали важный гуморальный
14
иммунитет, который основан на антимикробных, гемолитических и свертывающих
свойствах жидкости их организма.
Клеточный иммунный ответ
Все аннелиды, включая пиявок, имеют эффекторные клетки (целомоциты), которые
обладают спонтанной аллогенной и ксеногенной цитотоксичностью (Suzuki, Cooper,
1995). При контакте целомоцитов с клеткой-мишенью неотвратимо происходит лизис
последней (Cossarizza et al., 1995) по аналогии с цитотоксической активностью есте-
ственных клеток-киллеров (ЕК) у позвоночных. Как и в системе ЕК, специфичность
мишени чрезвычайно широка, поскольку ксеногенные, аллогенные и даже сингенные
эритроциты погибают при соответствующих условиях. Специфичность этих цитотокси-
ческих эффекторов может быть направлена на гликопротеины клеточной поверхности
на поверхности клеток-мишеней, поскольку несколько определенных моно- и дисаха-
ридов могут блокировать уничтожение. При совместном культивировании целомоцитов
с ЕК-чувствительными клеточными линиями мелкие целомоциты (МЦ) становятся
возбужденными, распространяя многочисленные псевдоподии, которые связываются
с клетками-мишенями и убивают их, тогда как крупные целомоциты (КЦ) агрегируют
вокруг лизированных мишеней и инкапсулируют их до образования гранулем (Quaglino
et al., 1996). МЦ активны во время распознавания, быстро связываются с мишенями,
а КЦ являются фагоцитирующими. Одна группа клеток МЦ производит распознавание,
связывание и уничтожение, тогда как функцию очистки оставшегося мусора выполняет
другая группа клеток типа КЦ. Эти результаты показывают, что фагоцитоз и цитоток-
сичность опосредованы двумя разными типами клеток; лейкоциты кольчатых червей
полифункциональны и не являются исключительно фагоцитирующими (Cooper et al.,
2001), что свидетельствует о ранней дивергенции фагоцитоза и лизиса.
При исследовании миграционного поведения клеток, участвующих в воспалитель-
ных реакциях, у пиявок Glossiphonia complanata выявлено два разных типа клеток:
ЕК-подобные клетки и клетки CD8+ (de Eguileor et al., 2000). Как и у других кольча-
тых червей, лейкоциты пиявки фагоцитируют и инкапсулируют инородный материал
избирательно в зависимости от размера (de Eguileor et al., 2003). Инкапсуляция ста-
новится визуально заметна, когда паразит полностью покрыт и изолирован толстой
меланотической капсулой. При травмировании пиявок в ране наблюдается массовая
пролиферация лимфоцитоподобных клеток, происходящих из одного кластера (лей-
копоэз), как и у позвоночных животных.
Гуморальный иммунный ответ
Защитные механизмы беспозвоночных, помимо клеточного иммунитета, состоят
из лизиса и агглютинации, усиленных воздействием компонентов из целомической
жидкости, таких как антигенсвязывающий белок, цитокины и антимикробные вещества
(Prochazkova et al., 2020). В конце ХХ в. было экспериментально доказано наличие
комплементоподобной активности у аннелид (Cooper et al., 1995), а вскоре был вы-
делен и целомный цитолитический фактор (ЦЦФ), который имеет функциональную
аналогию с фактором некроза опухоли (ФНО) позвоночных (Beschin et al., 1999).
В отличие от ФНО, цитолитическая активность ЦЦФ опосредуется лизисом и не свя-
зана с протеолизом.
Помимо ЦЦФ, в целоме кольчатых червей присутствуют порообразующие белки,
такие как эизенипор, лизенин и фетидин. Эти молекулы связываются и нарушают
15
липидный бислой только в тех случаях, когда присутствуют сфинголипиды (Milochau
et al., 1997). Посредством канального комплекса компоненты иммунной системы ан-
нелид разрушают чужеродные компоненты. Кроме того, перфорин-подобные белки
(Kauschke et al., 1997) создают дыры в мембранах клеток-мишеней, способствуя проник-
новению литических молекул, таких как лизенины, лизины, фетидины и гемолизины.
Цитокины представляют собой небольшие молекулы белка (5-20 кДа), которые
играют решающую роль в борьбе с инфекциями и другими иммунными реакциями
(Dinarello, 2000), участвуя в аутокринной, паракринной и эндокринной передаче сиг-
налов в качестве иммуномодулирующих агентов.
Что касается митогенных факторов, в целомической жидкости аннелид был
идентифицирован компонент с массой 60 кДа, обладающий митогенной активностью
в отношении спленоцитов мыши и названный ЦМФ (целомный митогенный фактор)
(Hanusova et al., 1999). В этой же работе было показано, что целомическая жидкость
аннелид, обогащенная ЦМФ, проявляет фосфолипазную активность, и PLA2-подобный
фермент участвует в иммунных реакциях, таких как антибактериальные механизмы.
Антигенсвязывающие белки у аннелид состоит из двух дисульфидсвязанных по-
липептидных цепей (31 и 33 кДа), обе участвуют в образовании антигенсвязывающего
сайта (Tučkova et al., 1991).
Ингибиторы протеаз. У птичьей пиявки T. tessulatum был найден генный тандем
цистатин B (Tt-cysb) и катепсин L (Tt-catl) (Lefebvre et al., 2004). Tt-cysb принадлежит
к семейству ингибиторов цистеиновой протеазы. Его последовательность демонстри-
рует 54 % идентичность с цистатином B человека. Tt-cysb экспрессируется только
в одной популяции циркулирующих целомических клеток. Бактериальное заражение
приводит к усилению транскрипта Tt-cysb исключительно в этих клетках.
Антимикробные белки. Наиболее изученным антимикробным белком у аннелид
является лизоцим (Perin, Jolles, 1972). Этот фермент расщепляет связи β-1-4 между
N-ацетилглюкозамином и N-ацетилмураминовой кислотой грамположительных бакте-
риальных клеточных стенок. Помимо лизоцимной активности, целомическая жидкость
E. fetida andrei проявляет антибактериальную, гемолитическую и гемагглютинирующую
активность. Эти действия в основном опосредованы двумя белками, называемыми
фетидинами (Lassegues et al., 1997).
У пиявок обнаружена собственная лизоцимоподобная активность для дестабилазы,
несколько изоформ которой составляют семейство белков, характеризующееся актив-
ностью лизоцима (Baskova et al., 2001). Кроме того, в жировых клетках пиявок был
обнаружен белок, обладающий бактериостатической активностью, принадлежащий
к семейству гемэритринов (Salzet et al., 2006).
Антимикробные пептиды (АМП) в отличие от белков имеют меньшую длину по-
липептидной цепи (менее 100 аминокислотных остатков) и единую для всех цистеин-
стабилизированных АМП структурную сигнатуру в виде γ-мотива (Yeaman, Yount,
2007). Для всех AMП характерны такие физико-химические свойства, как амфипатич-
ность и катионный характер, обеспечивающие их биологические функции, а именно:
естественную антибактериальная активность, хемотаксис иммунных клеток, иммуно-
модуляцию, нейтрализацию эндотоксинов, участие в регенерации нервной системы
(Salzet et al., 2006). АМП пиявок были выделены из четырех гематофаговых видов:
трех медицинских пиявок Hirudo medicinalis, H. verbena и H. nipponica, питающихся
кровью преимущественно теплокровных животных, и пиявка Theromyzon tessulatum,
паразитирующая на водоплавающих птицах. Первым аннелидным AMП был люм-
16
брицин, полученный из Lumbricus rubellus (Cho et al., 1998). Позже сходный АМП
был выявлен у пиявок (Schikorski et al., 2008). В настоящее время имеются сведения
о шести АМП, обнаруженных у пиявок: теромацин, теромизин, пептид B (Tasiemski
et al., 2004), нейромацин, люмбрицин (Schikorski et al., 2008) и гирудомацин (Ding
et al., 2019).
Роль АМП в иммунном ответе
Как было показано выше, АМП являются частью врожденного иммунного ответа
и играют важную роль в первой линии защиты от микроорганизмов, локализуясь,
в основном, в эпителиальных тканях внешних покровов и кишечника. Пептиды могут
быть индуцибельными или конститутивными, они неспецифичны и реагируют до того,
как приобретенный иммунный ответ был инициирован, они не генерируют иммунную
память, они не являются каталитическими, но обеспечивают экономию клеток, будучи
мелкими эффекторными молекулами (Wiesner, Vilcinskas, 2010).
В дополнение к их прямой антимикробной активности, некоторые АМП обладают
различными иммуномодулирующими функциями (Afacan et al., 2012).
Вот некоторые из наиболее важных из них:
1) Хемотаксическая активность: АМП действуют прямо как хемоаттрактант, спо-
собный привлекать иммунные клетки к месту инфекции. Косвенным образом АМП
индуцируют экспрессию широкого спектра хемокинов (Mookherjee, Hancock, 2007).
2) Антиэндотоксиновая активность: АМП обладают способностью подавлять выра-
ботку индуцируемых эндотоксином провоспалительных медиаторов, таких как фактор
некроза опухоли альфа (TNF-α), путем блокирования или модуляции сигнальных путей
толл-подобного рецептора (Bowdish, Hancock, 2005).
3) Дифференцировка иммунных клеток: АМП, по-видимому, напрямую индуци-
руют процессы дифференцировки и активации клеток, соединяя воедино элементы
врожденного и приобретенного иммунитета (Davidson et al., 2004).
4) Заживление ран и ангиогенез: заживление ран включает повторный рост эпители-
альных слоев и образование новых кровеносных сосудов (ангиогенез). АМП действуют
непосредственно на эпителиальные и эндотелиальные клетки, вызывая реэпителизацию
и ангиогенез. АМП также косвенно индуцируют заживление ран благодаря своим
хемотаксическим эффектам (Wu et al., 2010).
Благодаря этим иммуномодулирующим и антибактериальным свойствам, АМП
являются отличными кандидатами для лечения инфекций, так как они могут контро-
лировать воспаление в месте заражения.
Разнообразие антимикробных пептидов.
Структура и свойства АМП пиявок
Открытие первых АМП в начале 1980-х годов было многообещающим для раз-
работки новых антибиотиков (Hultmark et al., 1983) и решения проблем, связанных
с множественной лекарственной устойчивостью патогенных бактерий (Afacan et al.,
2012). С тех пор выяснилось, что в живой природе АМП встречаются повсеместно,
от примитивных организмов до млекопитающих. Как оказалось, многие АМП фило-
генетически близки, что предположительно указывает на их эволюционную консер-
вативность (Pasupuleti et al., 2012). Большинство известных АМП имеют низкую мо-
лекулярную массу (2-50 кДа). Основные характеристики АМП основаны на том, что
17
они представляют собой (1) молекулы суммарного положительного заряда (обычно
от +2 до +9) из-за большого количества положительно заряженных аминокислот, таких
как лизин и аргинин, (2) амфипатические молекулы, стабильные как в водных, так и
гидрофобных растворах (Zasloff, 2002).
У АМП выявлено 4 типа вторичных структур: (1) α-спираль, (2) β-складчатый
лист (3) смесь β-листов и α-спиралей и (4) линейная или случайная структура (Zhang
et al., 2014). Однако большинство АМП, находясь в растворе в свободной форме не
проявляют особой структуры и принимают окончательную конформацию при взаи-
модействии с мембраной.
АМП синтезируются в основном в поверхностных тканях, таких как эпителий кожи
или кишечника, легкие или эритроциты. Эти пептиды синтезируются в 100 раз быстрее,
чем иммуноглобулин, и при низких метаболических затратах, а также могут в каче-
стве резерва накапливаться в клетках и высвобождаться, когда клетки стимулируются
при контакте с патогенами (Nissen-Meyer, Nes, 1997). Таким образом, АМП являются
быстрым неспецифическим способом борьбы с широким спектром микроорганизмов.
По данным международной базы антимикробных пептидов (APD) за последние
30 лет из разных источников было выделено более 3250 антимикробных пептидов
(данные на 02 октября 2020 г.).
Одноклеточные производят АМП в качестве стратегии регуляции численности
собственной популяции, а также для борьбы с другими микроорганизмами, конку-
рирующими с ними за пространство и пищевые ресурсы среды. В настоящее время
известно 391 АМП, из них основную массу составляют бактериоцины (бактериальные
АМП), из архей выделено 5 АМП, из протист - 8 и 20 АМП получены из грибков
порообразование, нуклеазную и пептидогликаназную активность, интерференцию
с энергетическими процессами и ингибированием синтеза белка и репликации ДНК.
Грамотрицательными бактериями продуцируются колицины (25-80 кДа) и микроци-
ны (<10 кДа). К бактериоцинам, продуцируемым грамположительными бактериями,
относятся линейные и глобулярные лантибиотики (<5 кДа), пептиды без лантионина
(<10 кДа) и высокомолекулярные пептиды (> 30 кДа).
Растения вырабатывают небольшие богатые цистеином АМП (360 АМП по данным
APD), которые выявлены во всех органах, но большее их количество накапливается
в наружном слое (Nawrot et al., 2014). Большинство растительных AMП имеют мо-
лекулярную массу от 2 до 10 кДа. К ним относятся тионины, денфесины, циклоти-
ды, ноттиноподобные АМП, а также β-барилины, активные только против грибков.
Тионины, дефенсины и циклотиды, как было показано, обладает противоопухолевой
активностью.
Животные являются наиболее важными и перспективными продуцентами АМП
(2396 против 360 из растений или 358 из бактерий).
У насекомых конститутивные АМП накапливаются в клетках крови и слюнных же-
лезах, и в присутствии микробов секретируются в гемолимфу. Индуцированные АМП
синтезируются после микробной инфекции (Bulet, Stöcklin, 2005). В настоящее время
известно большое количество разнообразных по структуре и действию АМП, проду-
цируемых насекомыми (например: цекропины направлены против грамотрицательных
бактерий, грибков, вирусов, а также обладают инсектицидным и противоопухолевым
действием; дефенсины активны против грамположительных бактерий; дрозомицин
обладает мощной противогрибковой активностью; танатин проявляет антимикробную
18
активность в отношении устойчивых к множеству лекарственных средств клинических
изолятов E. aerogenes и K. pneumoniae; апидаецин действует против грамотрицательных
бактерий; мечниковеин - против грамположительных бактерий, грибов и насекомых;
инсектицидная активность выявлена у аттацина и саркотоксина) и огромное разноо-
бразие других АМП.
У водных беспозвоночных обнаружено большое разнообразие пептидов, обладаю-
щих в основном антибактериальной и противогрибковой активностью (Ponnappan
et al., 2015). Пептиды, полученные из морских организмов, способны выдерживать
высокие концентрации соли, поэтому они могут иметь высокую вероятность успеха
при физиологических концентрациях соли. К ним относятся АМП морских губок
(дискодермины, галицилиндрамиды, теонелламиды, циклолитизиды и фориоспонгины),
медуз, кораллов и других книдарий (аурелины, гидрализины, стиолизины), моллюсков,
включая головоногих (митилус, митилин и мицицины), ракообразных (пенаэдины, кал-
линектины, астацидины, тахиплезин и тахистатины), морских звезд (стронгиолоцины)
и кольчатых червей (гедистин, перинерин, ареницин, мацины).
На сегодняшний день в международных базах зарегистрировано порядка 20 АМП,
биохимически выделенных из 8 видов пресноводных аннелид, включая 4 пиявок.
Первым аннелидным АМП был богатый пролином люмбрицин-1, выделенный из
дождевого червя Lumbricus rubellus (Cho et al., 1998), а затем его аналог был найден
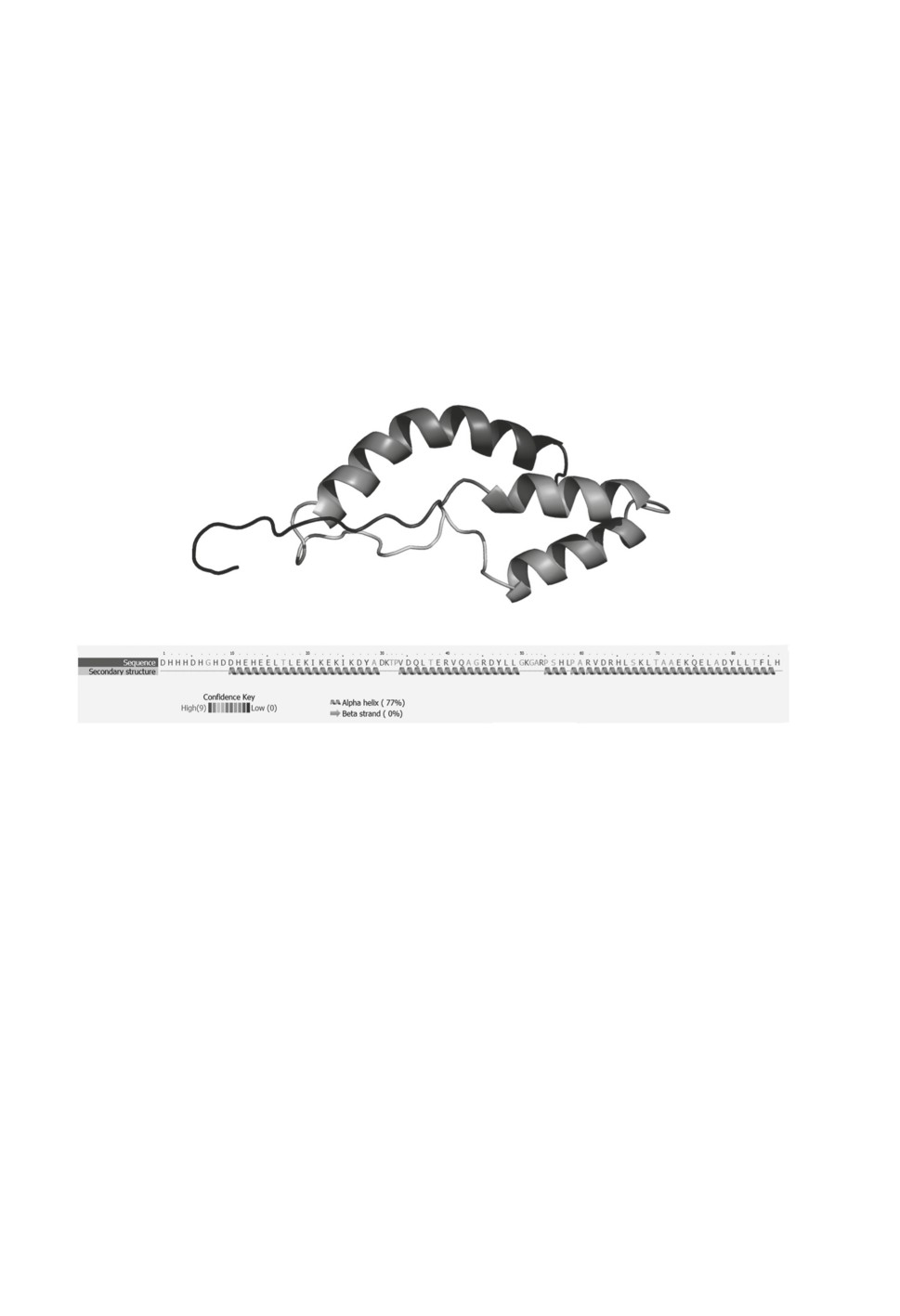
у пиявок (Schikorski et al., 2008). Трехмерная структура люмбрицина представлена на
рис. 1. Механизм действия люмбрицин-подобных АМП до сих пор не описаны. Их
антимикробная активность относительно не велика. Это позволяет предположить, что
защита от патогенов не является основной биологической функцией люмбрицина.
Рисунок 1. Трехмерная модель люмбрицина медицинской пиявки Hirudo medicinalis,
полученная с помощью Phyre2 (Kelley et al., 2015) на основе аминокислотной
последовательности, транслированной из кДНК EU156756.
Figure 1. Three-dimensional model of lumbricin from the medicinal leech Hirudo medicinalis
obtained with Phyre2 (Kelley et al., 2015). The reconstruction was based on the amino acid
sequence translated from cDNA EU156756.
19
Следующим открытием были два разных пептида из птичьей пиявки T. tessulatum:
теромизин (анионный АМП) и теромацин (катионный АМП) (Tasiemski et al., 2004).
Теромизин является линейным полипептидом, состоящим из 86 аминокислот-
ных остатков. В третичной структуре этого пептида присутствуют три α-спирали
(рис. 2). Это первый анионный антимикробный пептид, описанный у беспозвоноч-
ных. Теромизин проявляет активность, направленную против грамположительных
бактерий (Tasiemski et al., 2004). Синтез полипептида наблюдается исключительно
в диффузной ткани, состоящей из крупных жировых клеток, равномерно распределенных
в теле пиявки и контактирующих с целомическими полостями. Уровень транскрипции
теромизина у пиявки регулируется иммунным стимулом и повышается после приема
пищи или бактериального заражения. Кроме того, теромизин был иммунодетектирован
в целомической жидкости и кишечном эпителии (Tasiemski et al., 2004).
Рисунок 2. Трехмерная модель теромизина птичьей пиявки Theromyzon tessulatum,
реконструированная c помощью Phyre2 (Kelley et al., 2015) на основе аминокислотной
последовательности (MedGen UID: 265817).
Figure 2. Three-dimensional model of theromyzin from the bird leech Theromyzon tessulatum,
reconstructed with Phyre2 (Kelley et al., 2015) basing on the amino acid sequence (MedGen UID:
265817).
Теромацин принадлежит к семейству мацинов, впервые идентифицированных
у птичьих пиявок (Tasiemski et al., 2004). Мацины представляют собой семейство
катионных АМП, богатых цистеином. Они имеют общий мотив CSαβ, также харак-
терный для дефенсинов беспозвоночных и токсино-подобных пептидов, найденных
у скорпионов (Jung et al., 2012). Представители этого семейства пептидов были описаны
у пиявок Theromyzon tessulatum (Tasiemski et al., 2004) и Hirudo medicinalis (Schikorski
et al., 2008). Обе пиявки являются эктопаразитическими гематофагами позвоночных.
В отличие от дефенсинов, мацины обладают нейротрофической и пролиферативной
активностью в дополнение к их бактерицидному эффекту (Schikorski et al., 2008; Jung
et al., 2012). АМП мацинового ряда представляют собой довольно длинные и слож-
ные молекулы, в состав которых входят не менее 60 остатков. Третичная структура
мацинов организована в узловатую складку в соответствии с расположением цистеи-
20
новых связей, а молекулярные поверхности пептидов разделены на два гидрофобных
полушария благодаря полосообразному распределению положительных зарядов (Jung
et al., 2012). Консервативными структурными особенностями пептидов мацинового
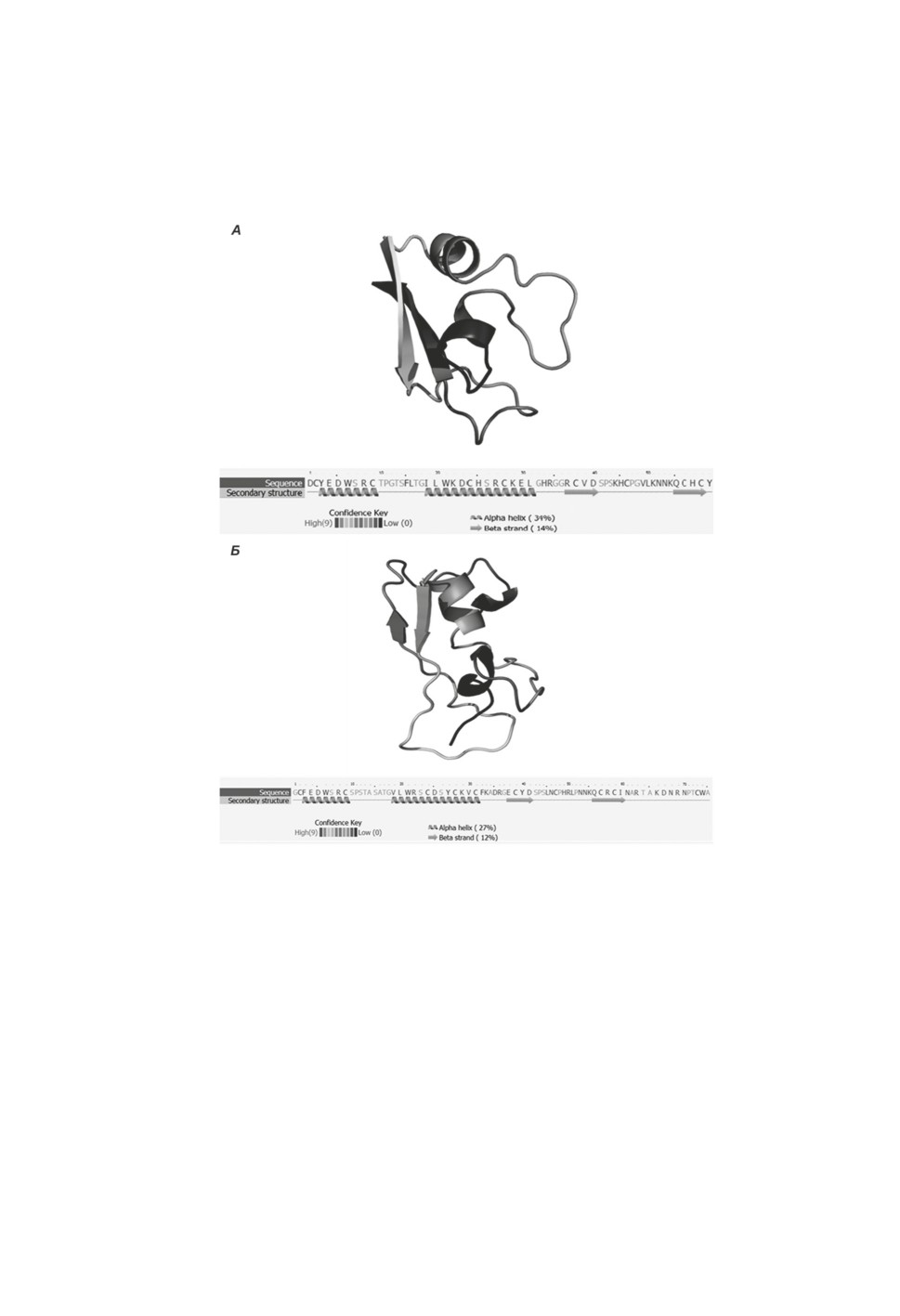
семейства являются дополнительная α-спираль в N-концевом положении (рис. 3 и 4)
и две длинные гибкие петли (показаны в виде стрелок).
Рисунок 3. Трехмерные модели двух теромацинов, реконструированные c помощью Phyre2
(Kelley et al., 2015). А - теромацин птичьей пиявки Theromyzon tessulatum (аминокислотная
последовательность AP01556). Б - теромацин медицинской пиявки Hirudo medicinalis
(аминокислотный транслят кДНК EU16497).
Figure 3. Three-dimensional models of two theromacins reconstructed with Phyre2 (Kelley et al.,
2015). A - theromacin of the bird leech Theromyzon tessulatum (amino acid sequence AP01556).
B - theromacin of the medicinal leech Hirudo medicinalis (amino acid translate of cDNA
EU16497).
Теромацины обеих пиявок состоят из 75 а. о. (Tasiemski et al., 2004; Schikorski
et al., 2008). На рис. 3 показаны открытые циклические структуры теромацинов из
птичьей и медицинской пиявок (рис. 3А и 3Б соответственно), которые имеют сходные
элементы в третичных структурах, несмотря на 8%-ную разницу в аминокислотных
последовательностях. В отличие от других цистеин-богатых АМП беспозвоночных,
21
теромацины пиявок имеют другой набор дисульфидных мостиков из-за большего
количества остатков цистеина (Bulet, Stöcklin, 2005). Теромацины проявляют анти-
микробную активность в отношении грамположительных бактерий (B. megaterium
и M. luteus) (Jung et al., 2012) и низкую антибактериальную активность против гра-
мотрицательных протеобактерий (E. coli) (Tasiemski et al., 2004). Их антимикробная
активность снижается с увеличением концентрации солей (Jung et al., 2012), что может
свидетельствовать о наличии теромацинов исключительно у пресноводных пиявок.
Нейромацин (рис. 4), выделенный из медицинской пиявки, состоит из 59 а. о. и на
сегодняшний день является самым коротким АМП мацинового ряда. Этот пептид имеет
общую схему строения с другими АМП мацинового ряда. Нейромацин вырабатывается
нейронами и обладает высокой активностью в отношении грамположительных бактерий
(Schikorski et al., 2008). В отличие от теромацина в первичной структуре нейромацина
содержится четыре остатка гистидина, что повышает его антимикробную активность
в слабощелочной среде. В дополнение к антибактериальным свойствам нейромацин
действует как промотор регенеративного процесса центральной нервной системы (ЦНС)
пиявки. Общеизвестно, что ЦНС кольчатых червей, включая пиявок, в отличие от ЦНС
других животных, обладает способностью довольно быстро регенерировать нейриты
и синаптические связи, которые после травмы восстанавливают нормальную функ-
цию. Согласно экспериментальным данным, регенеративный процесс у медицинской
пиявки усиливается бактериальной инфекцией, а индукция регенерации нормальной
функции ЦНС в значительной степени зависит от одновременного нейроиммунного
ответа (Schikorski et al., 2008).
Рисунок 4. Трехмерная модель нейромацина пиявки Hirudo medicinalis, реконструированная
c помощью Phyre2 (Kelley et al., 2015) на основе аминокислотной последовательности
AP02025.
Figure 4. Three-dimensional model of neuromacin from the leech Hirudo medicinalis reconstructed
with Phyre2 (Kelley et al., 2015) basing on the amino acid sequence AP02025.
22
Таким образом, теромацин из T. tessulatum (Tasiemski et al., 2004), нейромацин и
теромацин из H. medicinalis (Schikorski et al., 2008) выполняют несколько функций,
включая защиту от патогенов внешней среды, обеспечение кишечного симбиостаза и
иммунную защиту, а также участвуют в регенерации поврежденной нервной системы.
Недавно в слюнной железе азиатской гематофаговой пиявки Hirudo nipponica
был обнаружен новый АМП гирудомацин, последовательность которого состоит из
61 аминокислотных остатков (Ding et al., 2019). Гирудомацин содержит 8 остатков
цистеина, образующих 4 дисульфидных мостика, и структурно демонстрирует наи-
большее сходство с членами семейства мацинов. Водородные связи стабилизируют
конформацию гирудомацина с образованием вторичных структур, таких как α-спираль
и β-лист (рис. 5). Зрелый полипептид проявляет антимикробное действие широкого
спектра против грамположительных и грамотрицательных бактерий. Синтез гиру-
домацина у Hirudo nipponica активируется на стадии питания в присутствии крови
позвоночного хозяина.
Рисунок 5. Трехмерная модель гирудомацина пиявки Hirudo nipponiсa, предсказанная
c помощью Phyre2 (Kelley et al., 2015) на основе аминокислотной последовательности,
транслированной из кДНК MH686152.
Figure 5. Three-dimensional model of hirodomacin from the leech Hirudo nipponiсa predicted
with Phyre2 (Kelley et al., 2015) basing on the amino acid translate from cDNA MH686152.
Другим семейством АМП, богатых цистеином и обнаруженных у аннелид, является
BRICHOS, первым участником которого был ареницин, выделенный из целомической
жидкости морской полихеты Arenicola marina (Ovchinnikova et al., 2004). В настоящее
время домен BRICHOS описан для предшественников таких АМП, как альвинеллацин
и капителлацин (Tasiemski et al., 2014), а также никомицин (Panteleev et al., 2018).
Вторичная структура большинства пептидов этого семейства характеризуется нали-
чием β-шпильки, стабилизированной одним или двумя дисульфидными мостиками
23
(Tasiemski et al., 2014), однако имеются сведения о нахождении домена BRICHOS
в составе предшественников α-спиральных АМП, в структуре которых отсутствуют
β-шпильки (Panteleev et al., 2018).
Белки-предшественники этих АМП участвуют в основном в хемотаксисе клеток.
Имеются свидетельства того, что BRICHOS участвует в сложном посттрансляционном
процессинге белков и функционирует как внутримолекулярный шаперонный домен,
который может связывать мотивы β-шпилек и предотвращать их самоагрегацию с об-
разованием амилоидных фибрилл (Tasiemski et al., 2014). Присутствие домена BRICHOS
может быть эволюционно обусловленной адаптацией пиявок, обеспечивающей кор-
ректное сворачивание их АМП в экстремальных условиях, например при недостатке
кислорода (гипоксии) и термических нагрузках.
Механизм действия
Основные физические свойства АМП - катионный заряд и значительная доля
гидрофобных остатков. Первое свойство способствует селективности отрицательно
заряженных микробных цитоплазматических мембран по отношению к цвиттери-
онным мембранам многоклеточных, тогда как второе способствует взаимодействию
с ацильными цепями жирных кислот (Lohner, 2001).
Многие линейные АМП не структурированы в водном растворе и требуют мем-
бранной среды для принятия стабильной амфипатической конформации. Хотя меха-
низм действия многих АМП включает в себя разные способы нарушения целостности
бактериальной цитоплазматической мембраны, стали известны и другие антимикроб-
ные механизмы, которые нацелены на ключевые клеточные процессы, включая синтез
ДНК и белка, укладку белка, ферментативную активность и синтез клеточной стенки
(Brogden, 2005; Nicolas, 2009). Действительно, катионные свойства АМП способствуют
взаимодействию с отрицательно заряженными фрагментами других биомолекул, таких
как липиды внешней мембраны, нуклеиновые кислоты и фосфорилированные белки.
У инфицированного животного может одновременно выделяться несколько изоформ
или структурно сходных АМП, которые действуют с помощью разных механизмов
для достижения общего синергетического эффекта (Mangoni, Shai, 2009). Кроме того,
некоторые АМП могут иметь несколько вариантов действия (стратегия множественных
попаданий), что повышает их эффективность и способствует уклонению от потенци-
альных механизмов резистентности.
Таким образом, АМП по механизму действия можно условно разделить на два
класса: мембраноактивные (membrane disruptor) и внемембраноактивные (non-membrane
disruptor) (Huerta-Cantillo, Navarro-García, 2016); и в том и другом случае изначальной
целью является взаимодействие с плазматической мембраной посредством электро-
статических зарядов.
Пептиды, разрушающие мембрану, составляют подавляющее большинство, и мно-
гие из них имеют α-спиральные структуры, которые непосредственно действуют на
уровне плазматической мембраны, изменяя проницаемость клеток или лизируя клетки
посредством образования пор. Мембраноактивные АМП можно подразделить на две
группы в зависимости от их биологической активности: (1) селективные, которые
активны в отношении бактерий, но неактивны в отношении клеток животного, и (2)
неселективные, которые обладают активностью в отношении обоих типов клеток.
Механизм действия α-спиральных АМП определяется следующими этапами
(по: Huerta-Cantillo, Navarro-García, 2016):
24
1. Электростатическое связывание АМП с фосфолипидами мембраны.
АМП располагаются на мембране так, чтобы их положительно-заряженные ами-
нокислоты спрягались с отрицательно-заряженными головками фосфолипидов. Это
позволяет АМП оставаться параллельно ориентированными на мембране при низкой
локальной концентрации пептида. В таком состоянии АМП остаются неактивными.
2. Когда локальная концентрация пептида увеличивается, у него возникает тенден-
ция принимать перпендикулярную ориентацию по отношению к мембране. В таком
положении пептид становится активным и внедряется в мембрану.
3. Наконец, введение пептидов изменяет проницаемость липидного бислоя, или
лизис клеток происходит путем образования поры бочкообразного типа или нарушения
структуры тороидальных пор.
АМП, не связанные с мембранами (внемембранные), используют разнообразные
механизмы действия, среди которых: связывание с нуклеиновыми кислотами (ДНК или
РНК), вмешательство в синтез нуклеиновых кислот, ингибирование синтеза белков,
ингибирование ферментативной активность, ингибирование синтеза клеточной стенки,
повреждение клеток в результате накопления пептидов внутри клетки, флокуляция
внутриклеточных компонентов, структурные изменение в перегородках и блокиро-
вание некоторых факторов вирулентности (Brogden, 2005; Nguyen et al., 2011), что
подавляет подвижность бактерии или снижает ее патогенность, тем самым позволяет
контролировать заражение.
Помимо своей прямой антимикробной активности, АМП могут выполнять функ-
цию защиты организма пиявки с помощью иммуномодулирующих механизмов (Zhang,
Gallo, 2016), таких как хемотаксическая активность, привлекающая иммунные клетки;
модуляция чувствительности клеток пиявки к лигандам толл-подобных рецепторов;
стимуляция ангиогенеза при регенерации повреждённых тканей, ликвидации очагов
воспаления, образовании рубца и других подобных процессах восстановления; моду-
ляция экспрессии противоспалительных цитокинов или хемокинов.
Особую роль АМП играют в качестве врожденных регуляторов в кишечнике (Muniz
et al., 2012). Кишечный эпителий подвергается воздействию множества патогенов,
поэтому эндогенные АМП необходимы здесь для защиты от чужеродных внедрений
и инфекций. Становится все более очевидным, что АМП формируют состав коммен-
сальной микробиоты и помогают поддерживать кишечный гомеостаз у пиявок и не
только (Tasiemski et al., 2015). Экспрессия АМП строго контролируется вовлечением
рецепторов распознавания образов, и их нарушение связано с аномальными реакциями
организма на инфекцию и воспалительные заболевания кишечника.
Механизм действия мацинов, как и других катионных АМП, включает повышение
проницаемости мембраны грамположительных бактерий, а также образование пор
(Boidin-Wichlacz et al., 2012). Благодаря структурным особенностям и двойному амфи-
патическому действию (два гидрофобных полушария, зажатых поясом положительных
зарядов), мацины способствуют агрегации бактерий, а затем проницают бактериальную
мембрану. В дополнение к антибактериальной активности нейромацин и теромацин
участвуют в регенерации нервных волокон (Jung et al., 2012; Schikorski et al., 2008).
У медицинской пиявки H. medicinalis теромацин выделяется в кровь, окружающую
нервную систему, а нейромацин продуцируется нервными клетками и накапливается
в пораженном участке центральной нервной системы (Tasiemski, Salzet, 2010), тогда
как теромацин птичьей пиявки T. tessulatum экспрессируется в крупных жировых
клетках и сразу же высвобождается в целомическую жидкость после инфекций или
повреждений центральной нервной системы (Jung et al., 2012; Tasiemski et al., 2004).
25
Применение АМП
Структурные и функциональные характеристики АМП, а также такие их свойства,
как низкая токсичность для эукариотических клеток, широкий спектр действия против
различных патогенных микроорганизмов и иммуномодулирующие эффекты делают
АМП ценными терапевтическими и профилактическими агентами (Dubin et al., 2005).
Несмотря на то, что остаются некоторые ограничения, контроль уровня АМП может
представлять собой важную парадигму для лечения широкого спектра заболеваний
человека и животных.
Косвенные функции АМП, одной из которых является их участие в формирова-
нии состава комменсальной микробиоты животных и человека, тоже интересны для
практического применения в медицине. Нарушение стабильности микробиома может
привести к серьезным последствиям для здоровья, включая ожирение, рецидивирующие
инфекции и таким заболеваниям, как синдром воспаленного кишечника и атопический
дерматит. Как оказалось, зачастую перечисленные симптомы клинически связаны
с дефектными антибактериальными механизмами, в частности с дефицитом дефензинов
(Zhang, Gallo, 2016). Избыточный синтез АМП, в свою очередь, может инициировать
воспалительные заболевания. Такие заболевания кожи, как псориаз и розацеа сопрово-
ждаются повышенным уровнем экспрессии АМП кателицидина (Zhang, Gallo, 2016).
Учитывая роль пептидов в качестве модуляторов врожденного иммунного ответа, АМП
могут быть потенциально пригодны для разработки иммуномодулирующих методов
лечения или для коррекции подобных нарушений.
Основной интерес, проявляемый к АМП, связан с перспективой их использования
в качестве кардинально новых противоинфекционных средств следующего поколения и
новых методов более избирательной борьбы с патогенами, что, несомненно, важно для
решения общечеловеческих проблем, связанных со снижением эффективности обыч-
ных антибиотиков из-за возросшей лекарственной устойчивости патогенных бактерий.
Механизм, с помощью которого действуют эти пептиды, очень затрудняет выработку
устойчивости бактерий, что открывает многообещающую перспективу применения
АМП в качестве более стойких терапевтических агентов. Важным преимуществом
АМП является отсутствие у микроорганизмов механизма наследственной передачи
устойчивости к ним; в отличие от традиционных антибиотиков, применение АМП
в лечебных целях не влияет на естественную микрофлору пациентов (Afacan et al.,
2012). Еще одним плюсом АМП является их способность распознавать определенные
типы плазматических мембран, и эта селективность позволяет им дифференцированно
распознавать нормальные клетки, клетки незлокачественной опухоли и клетки злокаче-
ственной опухоли, потому АМП могут быть использованы в лечении онкологических
заболеваний (Huerta-Cantillo, Navarro-García, 2016).
АМП соответствуют многим требованиям фармацевтической промышленности,
сельского хозяйства, аквакультуры и производства продуктов питания. Некоторые
АМП уже нашли свое применение. АМП бактерий (бактериоцины) используются для
ингибирования важных патогенов животных, людей и растений, в том числе энтеро-
токсиногенной E. coli, резистентных стафилококков и энтерококков, Agrobacterium
и Brenneria spp. (Yang et al., 2014). Например, бактериальный пептид низин широко
используется в качестве безопасного пищевого консерванта, для сохранения свежести
роз и лечения рыб. Дефенсины и кателицидины млекопитающих оказались активны
против вируса иммунодефицита человека (ВИЧ) и других венерических заболева-
26
ний (Brogden, 2005). АМП из кожи лягушки обладают спермицидной активностью
и могут найти применение в качестве негормональных противозачаточных средств
(Zairi et al., 2009). В растениеводстве на замену токсичных для человека и окружаю-
щей среды пестицидов приходят трансгенные растения, экспрессирующие антими-
кробные пептиды (Nawrot al., 2014). Манипулирование генами, кодирующими АМП
у крабов, креветок и мидий, позволяет получать пригодные для культивирования ор-
ганизмы, более устойчивые к болезням (Ponnappan et al., 2015).Что касается пиявок,
их антикоагулирующее действие было издревле известно и до сих пор используется
в гирудотерапии как в Европе, так и в Азии (Singh, 2010). В наши дни практический
интерес к пиявкам возобновился. Как оказалось, в процессе кровососания пиявки-
гематофаги выделяют не только гирудин, но и другие биологически активные вещества
для предотвращения коагуляции и гниения (Ding et al., 2019). Пептиды пиявок имеют
много важных преимуществ, наиболее специфичным из которых является способность
преодолевать иммунный ответ при восстановлении нервной системы (Boidin-Wichlacz
et al., 2012). К преимуществам фармацевтических разработок на основе АМП пиявок
относятся биохимическая совместимость с позвоночным хозяином, нетоксичность для
комменсальной микрофлоры, термостабильность, солеустойчивость и широкий спектр
антимикробной активности (Bruno et al., 2019). Несмотря на разнообразие жизненных
стратегий, имеющихся у пиявок (паразиты/непаразиты; специалисты/генералисты;
эндемики/космополиты; экстремофилы/нейтрофилы и т.д.), АМП исследованы только
у ограниченного числа гематофаговых видов, паразитирующих на позвоночных. Это
открывает широкую перспективу для поиска новых, возможно, уникальных АМП.
Благодарности
Автор выражает благодарность Орели Тазиемски и Франсуа Массолю (Институт
Пастера, Франция) за инициацию и поддержание интереса к данной теме.
Работа выполнена в рамках Государственного задания 0279-2021-0011 при финан-
совой поддержке РФФИ (грант № 17-29-05097_офи м).
Список литературы
Ливанов Н. А. 1905. Acanthobdella peledina Grube, 1851. Морфологическое исследование. Ученые записки
Казанского университета 72 (5-8): 1-266. [Livanow N. 1905. Acanthobdella peledina Grube, 1851.
Morphological Study. Uchenye Zapiski Kazanskogo Universiteta 72: 1-266. (in Russian)]
Afacan N.J., Yeung A.T., Pena O.M., Hancock R.E. 2012. Therapeutic potential of host defense pep-
tides in antibiotic-resistant infections. Current Pharmaceutical Design 18 (6): 807-819. https://doi.
org/10.2174/138161212799277617
Ageitos J.M., Sánchez-Pérez A., Calo-Mata P., Villa T.G. 2017. Antimicrobial peptides (AMPs): Ancient compounds
that represent novel weapons in the fight against bacteria. Biochemical Pharmacology 133 (6): 117-138.
Baskova I.P., Zavalova L.L., Basanova A.V., Sass A.V. 2001. Separation of monomerizing and lysozyme activi-
ties of destabilase from medicinal leech salivary gland secretion. Biochemistry 66: 1368-1373. https://doi.
org/10.1023/A:1013333829196
Beschin A., Bilej M., Brys L., Torreele E., Lucas R., Magez S., De Baetselier P., 1999. Convergent evolution of
Boidin-Wichlacz C., Vergote D., Slomianny C., Jouy N., Salzet M., Tasiemski A. 2012. Morphological and func-
tional characterization of leech circulating blood cells: role in immunity and neural repair. Cellular and
Molecular Life Science 69 (10): 1717-1731. DOI 10.1007/s00018-011-0897-x
Bowdish D.M.E., Hancock R.E.W. 2005. Anti-endotoxin properties of cationic host defence peptides and proteins.
Brogden K.A. 2005. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria? Nature Reviews
27
Bruno R., Maresca M., Canaan S., Cavalier J.F., Mabrouk K., Boidin-Wichlacz C., Olleik H., Zeppilli D., Brodin
P., Massol F., Jollivet D., Jung S., Tasiemski A. 2019. Worms’ antimicrobial peptides. Marine Drugs 17:
Bulet P., Stöcklin R. 2005. Insect antimicrobial peptides: structures, properties and gene regulation. Protein and
Burrell B.D., Sahley C.L., Muller K.J. 2003. Progressive recovery of learning during regeneration of a single synapse
Cho J.H., Park C.B., Yoon Y.G., Kim S.C. 1998. Lumbricin I, a novel proline-rich antimicrobial peptide from
the earthworm: Purification, cDNA cloning and molecular characterization. Biochimica et Biophysica Acta
Cooper E.L., Cossarizza A., Suzuki M.M., Salvioli S., Capri M., Quaglino D., Franceschi C. 1995. Autogeneic
but not allogeneic earthworm effector coelomocytes kill the mammalian tumor cell target K562. Cellular
Cooper E.L., Kauschke E., Cossarizza A. 2001. Annelid humoral immunity: cell lysis in earthworms. Advances
Cossarizza A., Cooper E.L., Quaglino D., Salvioli S., Kalachnikova G., Franceschi C. 1995. Mitochondrial mass
and membrane potential in coelomocytes from the earthworm Eisenia foetida: studies with fluorescent
probes in single intact cells. Biochemical and Biophysical Research Communications 214 (2): 503-510.
Davidson D.J., Currie A.J., Reid G.S.D., Bowdish D.M.E., MacDonald K.L., Ma R.C., Hancock R.E.W., Speert
D.P. 2004. The cationic antimicrobial peptide LL-37 modulates dendritic cell differentiation and dendritic
munol.172.2.1146
de Eguileor M., Grimaldi A., Tettamanti G., Valvassori R., Cooper E.L., Lanzavecchia G. 2000. Different types
tice.1999.0085
de Eguileor M., Tettamanti G., Grimaldi A., Congiu T., Ferrarese R., Perletti G., Valvassori R., Cooper E.L.,
Lanzavecchia G. 2002. Leeches: immune response, angiogenesis and biomedical applications. Current
Dhainaut A., Scaps P. 2001. Immune defense and biological responses induced by toxics in Annelida. Canadian
Ding A., Shi H., Guo Q., Liu F., Wang J., Cheng B., Wei W., Xu C. 2019. Gene cloning and expression of a partial
sequence of Hirudomacin, an antimicrobial protein that is increased in leech (Hirudo nipponica Whitman)
after a blood meal. Comparative Biochemistry and Physiology, Part B: Biochemistry and Molecular Biology
Dubin A., Mak P., Dubin G., Rzychon M., Stec-Niemczyk J., Wladyka B., Maziarka K., Chmiel D. 2005. New
html/3_2005/633.html
Hanusova R., Bilej M., Brys L., De-Baetselier P., Beschin A. 1999. Identification of a coelomic mitogenic fac-
2478(98)00111-4
Hoffmann J.A., Kafatos F.C., Janeway C.A.Jr., Ezekowitz R.A.B. 1999. Phylogenetic perspectives in innate im-
munity. Science 284: 1313-1318. DOI: 10.1126/science.284.5418.1313
Huerta-Cantillo J., Navarro-García F. 2016. Properties and design of antimicrobial peptides as potential tools against
com/pdfs/invdis/ir-2016/ir162d.pdf
Hultmark D., Engström Å., Andersson K., Steiner H., Bennich H., Boman H. 1983. Insect immunity. Attacins, a
family of antibacterial proteins from Hyalophora cecropia. The EMBO Journal 2: 571-576. https://doi.
org/10.1002/j.1460-2075.1983.tb01465.x
Jung S., Sönnichsen F.D., Hung C.-W., Tholey A., Boidin-Wichlacz C., Haeusgen W., Gelhaus C., Desel C., Pod-
schun R., Waetzig V., Tasiemski A., Leippe M., Grötzinger J. 2012. Macin family of antimicrobial proteins
combines antimicrobial and nerve repair activities. Journal of Biological Chemistry 287: 14246-14258.
doi: 10.1074/jbc.M111.336495
Kauschke E., Pagliara P., Stanbili L., Cooper E.L. 1997. Characterization of proteolytic activity in coelomic
fluid of Lumbricus terrestris (Annelida, Lumbricidae). Comparative Biochemistry and Physiology, Part B:
28
Kaygorodova I.A. 2012. A revised checklist of the Lake Baikal Hirudinida fauna. Lauterbornia 75: 49-62.
Kaygorodova I.A., Bolbat N.B, Bolbat A.V. 2020. Species delimitation through DNA barcoding of freshwater
leeches of the Glossiphonia genus (Hirudinea: Glossiphoniidae) from Eastern Siberia, Russia. Journal of
Kaygorodova I.A., Dzyuba E.V., Pronin N.M. 2012. Leech-like parasites (Clitellata, Acanthobdellida) infecting
native and endemic Eastern Siberian salmon fishes. The Scientific World Journal 2012: 652827. https://
doi.org/10.1100/2012/652827
Kaygorodova I.A., Sherbakov D. Yu. 2006. Molecular phylogenetic study of systematic position of Baika-
S1022795406120052
Kelley L.A., Mezulis S., Yates C.M., Wass M.N., Sternberg M.J.E. 2015. The Phyre2 web portal for protein
Lassegues M., Milochau A., Doignon F., Du Pasquier L., Valembois P. 1997. Sequence and expression of an
Eisenia-fetida-derived cDNA clone that encodes the 40-kDa fetidin antibacterial protein. European Journal
Lefebvre C., Cocquerelle C., Vandenbulcke F., Hot D., Huot L., Lemoine Y., Salzet M. 2004. Transcriptomic
analysis in the leech Theromyzon tessulatum: involvement of cystatin B in innate immunity. Biochemical
Lohner K. 2001. The role of membrane lipid composition in cell targeting of antimicrobial peptides. In: Lohner
K., (ed.) Development of Novel Antimicrobial Agents: Emerging Strategies. Wymondham, Norfolk, Horizon
Scientific Press, 149-165
Loker E.S., Adema C.M., Zhang S.M., Kepler T.B. 2004. Invertebrate immune systems - not homogeneous,
2896.2004.0117.x
Macagno E.R., Gaasterland T., Edsall L., Bafna V., Soares M.B., Scheetz T., Casavant T., Da Silva C., Wincker
P., Tasiemski A., Salzet M. 2010. Construction of a medicinal leech transcriptome database and its applica-
tion to the identification of leech homologs of neural and innate immune genes. BMC Genomics 11: 407.
Macke E., Tasiemski A., Callens M., Decaestecker E., Massol F. 2017. Life history and eco-evolutionary dynamics
Mangoni M.L., Shai Y. 2009. Temporins and their synergism against Gram-negative bacteria and in lipopolysac-
charide detoxification. Biochimica et Biophysica Acta (BBA) - Biomembranes 1788 (8): 1610-1619. https://
doi.org/10.1016/j.bbamem.2009.04.021
McDougall C., Hui J.H.L., Monteiro A., Takahashi T., Ferrier D.E.K. 2008. Annelids in evolutionary developmental
Milochau A., Lassegues M., Valembois P. 1997. Purification, characterization and activities of two hemolytic and
antibacterial proteins from coelomic fluid of the annelid Eisenia fetida andrei. Biochimica et Biophysica
S0167-4838(96)00160-4
Mookherjee N., Hancock R.E.W. 2007. Cationic host defence peptides: innate immune regulatory peptides as a
novel approach for treating infections. Cellular and Molecular Life Sciences 64 (7-8): 922-933. https://
doi.org/10.1007/s00018-007-6475-6
Muniz L.R., Knosp C., Yeretssian G. 2012. Intestinal antimicrobial peptides during homeostasis, infection, and
Nawrot R., Barylski J., Nowicki G., Broniarczyk J., Buchwald W., Goździcka-Józefiak A. 2014. Plant antimicrobial
peptides. Folia Microbiologica 59 (3): 181-196. DOI: 10.1007/s12223-013-0280-4
Nguyen L.T., Haney E.F., Vogel H.J. 2011. The expanding scope of antimicrobial peptide structures and their
Nicolas P. 2009. Multifunctional host defense peptides: intracellular targeting antimicrobial peptides. The FEBS
Nissen-Meyer J., Nes I.F. 1997. Ribosomally synthesized antimicrobial peptides: their function, structure, biogenesis,
Ovchinnikova T.V., Aleshina G.M., Balandin S.V., Krasnosdembskaya A.D., Markelov M.L., Frolova E.I., Leonova
Y.F., Tagaev A.A., Krasnodembsky E.G., Kokryakov V.N. 2004. Purification and primary structure of two
isoforms of arenicin, a novel antimicrobial peptide from marine polychaeta Arenicola marina. FEBS Letters
29
Panteleev P.V., Tsarev A.V., Bolosov I.A., Paramonov A.S., Marggraf M.B., Sychev S.V., Shenkarev Z.O., Ovchin-
nikova T.V..
2018. Novel Antimicrobial Peptides from the Arctic Polychaeta Nicomache minor Provide
New Molecular Insight into Biological Role of the BRICHOS Domain. Marine Drugs 16 (11): 401. https://
doi.org/10.3390/md16110401
Pasupuleti M., Schmidtchen A., Malmsten M. 2012. Antimicrobial peptides: key components of the innate immune
Perin J., Jolles P. 1972. The lysozyme from Nephthys hombergi (annelid). Biochimica et Biophysica Acta (BBA)
Pfeiffer I., Brenig B., Kutschera U. 2005. Molecular phylogeny of selected predaceous leeches with reference to
thbio.2005.05.002
Ponnappan N., Budagavi D.P, Yadav B.K., Chugh A. 2015. Membrane- active peptides from marine organisms-
antimicrobials, cell-penetrating peptides and Peptide toxins: applications and prospects. Probiotics and
Prochazkova P., Roubalova R., Dvorak J., Navarro Pacheco N.I., Bilej M. 2020. Pattern recognition receptors in
Quaglino D., Cooper E.L., Salvioli S., Capri M., Suzuki M.M., Ronchetti I.P., Franceschi C., Cossarizza A. 1996.
Earthworm coelomocytes in vitro: cellular features and “granuloma” formation during cytotoxic activity
against the mammalian tumor cell target K562. European Journal of Cell Biology 70 (3): 278-288.
Salzet M., Capron A., Stefano G. 2000. Molecular crosstalk in host-parasite relationships: schistosome- and leech-
Salzet M., Tasiemski A., Cooper E. 2006. Innate Immunity in Lophotrochozoans: The Annelids. Current Pharma-
Sawyer R. 1986. Leech biology and behavior, Vol. II. Feeding Biology, Ecology, and Systematics. Suffolk, Clar-
endon Press, Oxford, 793 p.
Schikorski D., Cuvillier-Hot V., Leippe M., Boidin-Wichlacz C., Slomianny C., Macagno E., Salzet M., Tasiemski
A. 2008. Microbial challenge promotes the regenerative process of the injured central nervous system of
the medicinal leech by inducing the synthesis of antimicrobial peptides in neurons and microglia. Journal
Silver A.C., Graf J. 2011. Innate and procured immunity inside the digestive tract of the medicinal leech. Inverte-
Singh A.P. 2010. Medicinal leech therapy (Hirudotherapy): a brief overview. Complementary Therapies in Clinical
Sket B., Trontelj P. 2008. Global diversity of leeches (Hirudinea) in freshwater. Hydrobioligia 595: 129-137.
Suzuki M.M., Cooper E.L. 1995. Allogeneic killing by earthworm effector cells. Natural Immunity 14 (1): 11-19.
Tasiemski A., Jung S., Boidin-Wichlacz C., Jollivet D., Cuvillier-Hot V., Pradillon F., Vetriani C., Hecht O., Sön-
nichsen F.D., Gelhaus C., Hung C.W., Tholey A., Leippe M., Grötzinger J., Gaill F. 2014. Characterization
and function of the first antibiotic isolated from a vent organism: the extremophile metazoan Alvinella
Tasiemski A., Massol F., Cuvillier-Hot V., Boidin-Wichlacz C., Roger E., Rodet F., Fournier I., Thomas, F.,
Salzet M. 2015. Reciprocal immune benefit based on complementary production of antibiotics by the
leech Hirudo verbana and its gut symbiont Aeromonas veronii. Scientific Reports 5: 17498. https://doi.
org/10.1038/srep17498
Tasiemski A., Salzet M. 2010. Leech immunity: from brain to peripheral responses. In: Söderhäll K. (ed.) Inver-
tebrate Immunity. Advances in Experimental Medicine and Biology. Boston, MA., Springer., Vol 708,
Tasiemski A., Vandenbulcke F., Mitta G., Lemoine J., Lefebvre C., Sautiere P.E., Salzet M. 2004. Molecular
characterization of two novel antibacterial peptides inducible upon bacterial challenge in an annelid, the
jbc.M312156200
Trontelj P., Sket B., Steinbrück G. 1999. Molecular phylogeny of leeches: Congruence of nuclear and mitochon-
drial rDNA data sets and the origin of bloodsucking. Journal of Zoological Systematics and Evolutionary
Tučková L., Rejnek J., Bilej M., Pospìšil R. 1991. Characterization of antigen-binding protein in earthworms
Lumbricus terrestris and Eisenia foetida. Developmental & Comparative Immunology 15 (4): 263-268.
30
Wiesner J., Vilcinskas A. 2010. Antimicrobial peptides: the ancient arm of the human immune system. Virulence,
Wu W.K., Wong C.C., Li Z.J., Zhang L., Xiang S.X., Cho C.H. 2010. Cathelicidins in inflammation and tissue
repair: Potential therapeutic applications for gastrointestinal disorders. Acta Pharmacologica Sinica 31 (9):
Yang S.C., Lin C.H., Sung C.T., Fang J.Y. 2014. Antibacterial activities of bacteriocins: application in foods and
Yeaman M.R., Yount N.Y. 2007. Unifying themes in host defence effector polypeptides. Nature Reviews Micro-
Zairi A, Tangy F., Bouassida K., Hani K. 2009. Dermaseptins and magainins: antimicrobial peptides from frogs’
skin-new sources for a promising spermicides microbicides-a mini review. BioMed Research International
Zasloff M. 2002. Antimicrobial peptides of multicellular organisms. Nature 415: 389-395. https://doi.
org/10.1038/415389a
cub.2015.11.017
Zhang M., Zhao J., Zheng J. 2014. Molecular understanding of a potential functional link between antimicrobial
The role of antimicrobial peptids
in the immunity of parasitic leeches (aNNELIDA, hIRUDINEA)
I. A. Kaygorodova
Keywords: parasitic leeches, immunity, antimicrobial peptides
Summary
Antimicrobial proteins and peptides (AMPs), essential components of the immune system, represent
a diverse class of natural molecules produced by all living organisms in response to pathogen attacks.
AMPs can possess a wide range of antibiotic activity against foreign and opportunistic bacteria, fungi,
and viruses. AMPs play an important role in the selection of colonizing bacterial symbionts, which
helps multicellular organisms to cope with certain environmental problems. AMPs are especially
important for invertebrates due to the absence of an adaptive immune system. Although many AMPs
have similar physical and chemical properties (common total length varying from 10 to 100 amino
acids, total positive charge, or high cysteine content), their immunomodulatory activity is specific for
each AMP type. The present review summarizes current state of knowledge on leech immunity, with
emphasis on the special role of AMPs, and indicates the wide variety of primary AMP structures,
which seems to correlate with a variety of life strategies and ecology of ectoparasites.
31