ПАРАЗИТОЛОГИЯ, 2021, том 55, № 1, с. 32-47.
УДК 636.093
МОЛЕКУЛЯРНАЯ ДИАГНОСТИКА ТЕЙЛЕРИОЗА
КРУПНОГО РОГАТОГО СКОТА
© 2021 г. С. А. Бурсаков*
Институт инновационных биотехнологий в животноводстве (ИИБЖ) -
филиал Федерального государственного бюджетного научного учреждения
«Федеральный исследовательский центр животноводства -
ВИЖ имени академика Л.К. Эрнста» (ФГБНУ ФИЦ ВИЖ им. Л.К. Эрнста),
ул. Костякова, д. 12, стр. 4, Москва, 127422 Россия
*e-mail: sergeymoscu@gmail.com
Поступила в редакцию 01.10.2020 г.
После доработки 30.10.2020 г.
Принята к печати 02.11.2020 г.
В данной работе представлены cовременные подходы для молекулярной диагностики Theileria
spp. Обнаружение и лечение тейлериоза - заболевания, вызываемого этими простейшими, явля-
ются необходимым инструментом для его контроля. Важность точной идентификации возбуди-
теля для эпидемиологических исследований и диагностических целей определяется тяжестью
заболевания и разной восприимчивостью к лекарственным препаратам. Эти работы должны
вестись с учетом видоспецифических свойств и широкого разнообразия видов Theileria, а так-
же особенностей их позвоночных хозяев и членистоногих векторов. Пополнение баз данных
сиквенсами новых Theileria является стимулом для создания ПЦР тест-систем, которые дают
возможность определять одновременно несколько видов и регистрировать коинфекцию. Совре-
менные средства контроля за выявлением и распространением заболевания не всегда позволяют
вовремя распознать его на ранних стадиях, что при высокой скоротечности болезни может при-
водить к потерям в животноводстве. Отсюда возникает интерес к быстрым и чувствительным
методам обнаружения на ранних стадиях развития заболевания.
Ключевые слова: Theileria, тейлериоз, крупный рогатый скот, молекулярная диагностика
DOI: 10.31857/S0031184721010038
Тейлериоз крупного рогатого скота (КРС) является трансмиссивным заболеванием,
вызываемым тейлериями - облигатными простейшими паразитами, относящимися
к типу Apicomplexa, порядку Piroplasmida, семейству Theileriidae, род Theileria. Вслед-
ствие потерь молочной и мясной продуктивности и гибели скота - это кровепаразитар-
ное заболевание может наносить значительный экономический ущерб животноводству.
Возбудители Theileria spp. специфичны для разных видов и поражают как диких,
так и домашних животных. Идентифицировано несколько видов Theileria spp., пара-
зитирующих у крупного рогатого скота (КРС): Theileria parva, T. annulata, T. buffeli/
orientalis, T. mutans, T. velifera, T. sergenti, T. taurotragi и T. orientalis. Наиболее пато-
32
генными являются T. parva и T. annulata, которые отличаются высокой летальностью
и индуцируют трансформацию инфицированных клеток лимфоцитов или макрофагов
/ моноцитов (Nene, 2016). Другие виды тейлерий не вызывают неконтролируемой
пролиферации инфицированных лейкоцитов, а вместо этого размножаются преиму-
щественно в инфицированных эритроцитах.
Наиболее патогенными возбудителями заболевания мелких жвачных животных,
имеющими экономическое значение, являются Theileria lestoquardi (T. hirci), которая
вызывает злокачественный тейлериоз овец, а также Theileria uilenbergi и Theileria
luwenshuni. Помимо пород КРС и мелкого рогатого скота, к этому заболеванию вос-
приимчивы также буйволы.
Источником инвазии являются больные животные и тейлерионосители. Состояние
носительства для пироплазмиды характеризуют как долгосрочное сохранение паразита
в его хозяине. Возможность передачи другим хозяевам через векторную инфекцию для
поддержания цикла передачи также является его неотъемлемой частью. Долгосрочная
устойчивость подразумевает, что паразит может поддерживаться и распространяться
в позвоночном хозяине, избегая иммунной системы. Считается, что после заражения
животные могут пожизненно оставаться носителями тейлерии (de Waal, 1992).
Тейлериоз выявлен во многих странах Западной Европы, Азии, Африки, в стра-
нах Средней Азии. Территория Российской Федерации считается благополучной по
тейлериозу, и соответственно данные по распространению этого заболевания у КРС
на территории РФ ограничены. Очаги распространения расположены в основном на
юге России. Однако вспышки тейлериоза фиксировали во многих регионах Россий-
ской Федерации, в Ростовской области, Дагестане, на Дальнем востоке, в Московской
области и др. (Самойловская и др., 2015; Bursakov, Kovalchuk, 2019). Поэтому оцен-
ка степени распространения и своевременная диагностика играют решающую роль
в предотвращении случаев заболеваемости, особенно в связи с увеличением и измене-
нием ареала распространения клещей, которые переносят, в частности, возбудителей
данной болезни.
Тейлерия на территории РФ передается различными видами клещей, в том чис-
ле иксодовыми клещами Dermacentor reticulatus, D. marginatus, Boophylus annulatus,
Hyalomma anatolicum, H. detritum, Haemaphysalis punctate и H. sulcate (Зубаринова и др.,
2017; Новак и др., 2019; Florin-Christensen et al., 2009), нападающими на животных во
всех активных фазах развития. Биотопами этих насекомых являются степные и пред-
горные целинные пастбища. Поскольку клещи перезимовывают в помещениях, то не
исключена возможность заболевания скота тейлериозом не только в пастбищный, но
и в стойловый период. Сезонность и динамика тейлериоза определяются видовым со-
ставом и биологическими особенностями переносчиков, а также погодными условиями.
Максимальное количество больных животных регистрируют обычно в июне-июле, что
связано с высокой активностью имаго клещей-переносчиков.
В связи с меняющимися условиями климата и повышением среднегодовой тем-
пературы на Земле ареал распространения клещей смещается ближе к северу, что
в свою очередь может ухудшать в этих регионах эпизоотологическую обстановку по
тейлериозу КРС (Tokarevich et al., 2017).
Описаны только 91 генотип и ~ 40 видов Theileria spp. среди ~6000 известных видов
Apicomplexa, составляющих лишь 0.1% от предполагаемого числа присутствующих на
Земле видов Apicomplexa (1.2-10 млн.) (Morrison, 2009). В связи с таким обширным
генетическим разнообразием Theileria spp. в природных популяциях необходима разра-
33
ботка специфичных анализов или зондов для географически разнообразных популяций
(Gubbels et al., 2000; Chaisi et al., 2013; Perera et al., 2015). Соответственно, для совер-
шенствования методов молекулярной диагностики с использованием универсальных
праймеров и/или зондов, совершенно необходимо пополнение базы данных Theileria
и Apicomplexa новыми видами.
Поэтому в данном обзоре представлены молекулярные методы, используемые
в практике идентификации тейлериоза.
Диагностика тейлериоза
Традиционный метод выявления возбудителей у инфицированных животных микро-
скопическое исследование мазков крови, окрашенных по Гимзе, по-прежнему является
самыми дешевым и быстрым методом, используемым для идентификации паразитов
Theileria. Метод подходит для выявления острых инфекций, но не для обнаружения
животных-носителей, у которых паразитемия может быть низкой, поскольку их чув-
ствительность и специфичность ограничены (Altay et al., 2008).
Однако, помимо прямого микроскопического исследования, тейлериоз может быть
диагностирован путем идентификации инфекционного возбудителя с помощью се-
рологических тестов с использованием флуоресцентных антител, культуры in vitro и
инокуляции животных, а также с помощью молекулярно-диагностических анализов на
базе нуклеиновых кислот (Mans, 2015; Lampereur et al., 2017; Sivajothi, Reddy, 2018;
Gebrekidan et al., 2020).
Серологические методы диагностики - реакция связывания комплимента (РСК),
реакция длительного связывания комплимента (РДСК), реакция иммунофлуоресценции
(РИФ) с антигеном, приготовленным из «гранатных тел» или эритроцитарных форм
тейлерий, - используют для ранней диагностики субклинических инфекций в эпиде-
миологических исследованиях и установления тейлерионосительства. Они помогают
обнаружить антитела к Theileria у выздоровевших животных или животных, прошед-
ших вакцинацию, используя антигены шизонта, приготовленные в культуре клеток
печени экспериментально зараженного животного (Burridge et al., 1974). Перекрестные
реакции генетически близких видов или ослабление специфических иммунных отве-
тов приводят к появлению ложноположительных и ложноотрицательных результатов,
уменьшающих использование непрямого стандартного метода флуоресцирующих анти-
тел (нМФА). Разработка антиген-специфических анализов не решает эту проблему,
так как близкородственные виды могут иметь аналогичные антигены. Тем не менее
лишенные высокой специфичности серологические анализы остаются важной состав-
ляющей в эпидемиологических исследованиях за счет своей экспрессности и простоты
(Li et al., 2020). Поэтому продолжают разрабатываться новые иммунологические ме-
тоды, предлагающие более быстрые, более чувствительные и более специфичные
варианты, чем традиционные методы, хотя прямая иммунологическая диагностика
паразитарных антигенов в ткани хозяина все еще отсутствует.
Молекулярная диагностика тейлериоза
Методы обнаружения Theileria spp. на основе идентификации нуклеиновых кислот и
их амплификации являются наиболее чувствительными, специфичными, надежными и
доступными в настоящее время. Эти методы быстры, свободны от иммунокомпетентно-
сти и позволяют различать морфологически сходных паразитов. Молекулярные методы
с улучшенной чувствительностью и специфичностью, например анализ гибридизации
34
ДНК, полимеразной цепной реакции (ПЦР) и ее модификаций, обеспечивают детекцию
инфекции в скрытой фазе заболевания. Количество таких диагностических анализов,
целью которых является выявление специфических генов и видов, экспоненциально
возрастает (Criado-Fornelio, 2007). Для большинства экономически важных Theileira
spp., таких как T. annulata, T. equi, T. lestoquardi, T. parva, T. uilenbergi и других,
менее опасных видов существует широкий спектр диагностических тестов,чему спо-
собствовало секвенирование геномов представителей ряда возбудителей: T. orientalis
Shintoku (Hayashida et al., 2012), T. equi WA (Kappmeyer et al., 2012), T. annulata Ankara
(Pain et al., 2005) и T. parva Muguga (Gardner et al., 2005) (данные геномов доступны
в банке данных пироплазм, который является частью Eukaryotic Pathogen Bioinformatic
Для обнаружения Theileria spp. у позвоночных и клещей-хозяев описано несколько
вариантов анализов ПЦР и ПЦР в реальном времени, которые более чувствительны,
чем микроскопический метод и в зависимости от мишени и размера гена могут позво-
лить выполнить идентификацию на уровне рода или вида. Тест-системы для Theileria
spp. на базе ДНК основаны на следующих методах: классическая, или традиционная
ПЦР с последующим электрофоретическим анализом агарозного геля (Bishop et al.,
1992; Pienaar et al., 2011; Wang et al., 2018), вложенная-PCR (Odongo et al., 2010), муль-
типлексная ПЦР (Kundave et al., 2018); ПЦР в реальном времени (Jeong et al., 2003;
Kim et al., 2008; Sibeko et al., 2008; Pienaar et al., 2011b, 2014); ПЦР-анализ в реальном
времени с использованием SYBR green (Pienaar et al., 2013); ПЦР-полиморфизм длин
рестрикционных фрагментов (ПЦР-ПДРФ) (Bishop et al., 1992; Geysen et al., 1999;
Heidarpour Bami et al., 2009; Zaeemi et al., 2011); ПЦР с последующим точечным
блоттингом, капиллярным или слот-блоттингом и гибридизацией с использованием
радиоизотопно-меченых зондов (Bishop et al., 1992; Allsopp et al., 1993; Collins et al.,
2002; Skilton et al., 2002) или хемилюминесценцией (гибридизация методом обрат-
ного блоттинга ПЦР-RLB) (Gubbels et al., 1999; Schnittger et al., 2004); петлевая изо-
термическая амплификация (Loop mediated isothermal amplification, LAMP) (Alhassan
et al., 2007; Thekisoe et al., 2010; Wang et al., 2010; Salih et al., 2012; El-Ashker et al.,
2015; Shirozu et al., 2020); анализы на основе резонансной передачи энергии Форстера
(Förster resonance energy transfer - FRET) (Chaisi et al., 2013; Perera et al., 2015; Yang
et al., 2014) и анализ кривых плавления с высоким разрешением (HRM-анализ, High
Resolution Melting) (Salim et al., 2013; Wang et al. 2020).
Молекулярные методы выявляют геномный материал паразитов (указывают на при-
сутствие их живых форм у животного в момент отбора проб) являются эффективным
инструментом наблюдения за здоровьем животных и выявления различных заболеваний.
Методы, начиная от традиционной ПЦР до вложенной-ПЦР и до ПЦР в реальном вре-
мени, позволяют улучшить чувствительность, достоверность количественной оценки и
повысить скорость обнаружения. При этом такие методы как RLB, анализы с исполь-
зованием резонансной передачи энергии пан-Форстера и анализ плавления с высоким
разрешением гарантируют выявление множества видов или генотипов одновременно.
Комплексные подходы для детектирования, например, нескольких видов Theileria
spp. или Babesia spp. одновременно в одном анализе (Allsop et al., 1993) интересны
тем, что позволяют обходиться без проведения независимых реакций ПЦР для каждого
возбудителя заболевания. Метод RLB, например, объединяет родоспецифичную ПЦР
с гибридизацией с мембраносвязанным видоспецифичным олигонуклеотидом для диф-
ференциального обнаружения известных видов Theileria spp. и Babesia spp. на основе
их различий в последовательностях гена 18S субъединицы рРНК (Gubbels et al., 1999).
35
ПЦР анализ на основе профилей в реальном времени имеет преимущество в том,
что изменение зон зонда может быть установлено по различиям в профилях плавления,
которые могут быть связаны с генотипическими или видовыми различиями. Кроме
того, ПЦР в реальном времени позволяет дать количественную оценку ДНК, указывая
долю каждого рода или вида в данном образце (Bott et al., 2009).
Метод петлевой изотермической амплификации LAMP для работы в изотермических
условиях (в диапазоне температур от 60 до 65 °C) и без использования специализиро-
ванного оборудования может быть применен в полевых условиях (Notomi et al., 2000).
Технология LAMP позволяет визуально обнаруживать продукты амплификации путем
добавления флуоресцентных красителей, таких как SYBR Green, и измерения мутности.
LAMP примерно в десять раз более чувствителен по сравнению с традиционной ПЦР.
Кроме того, реакцию можно проводить без необходимости выделения ДНК.
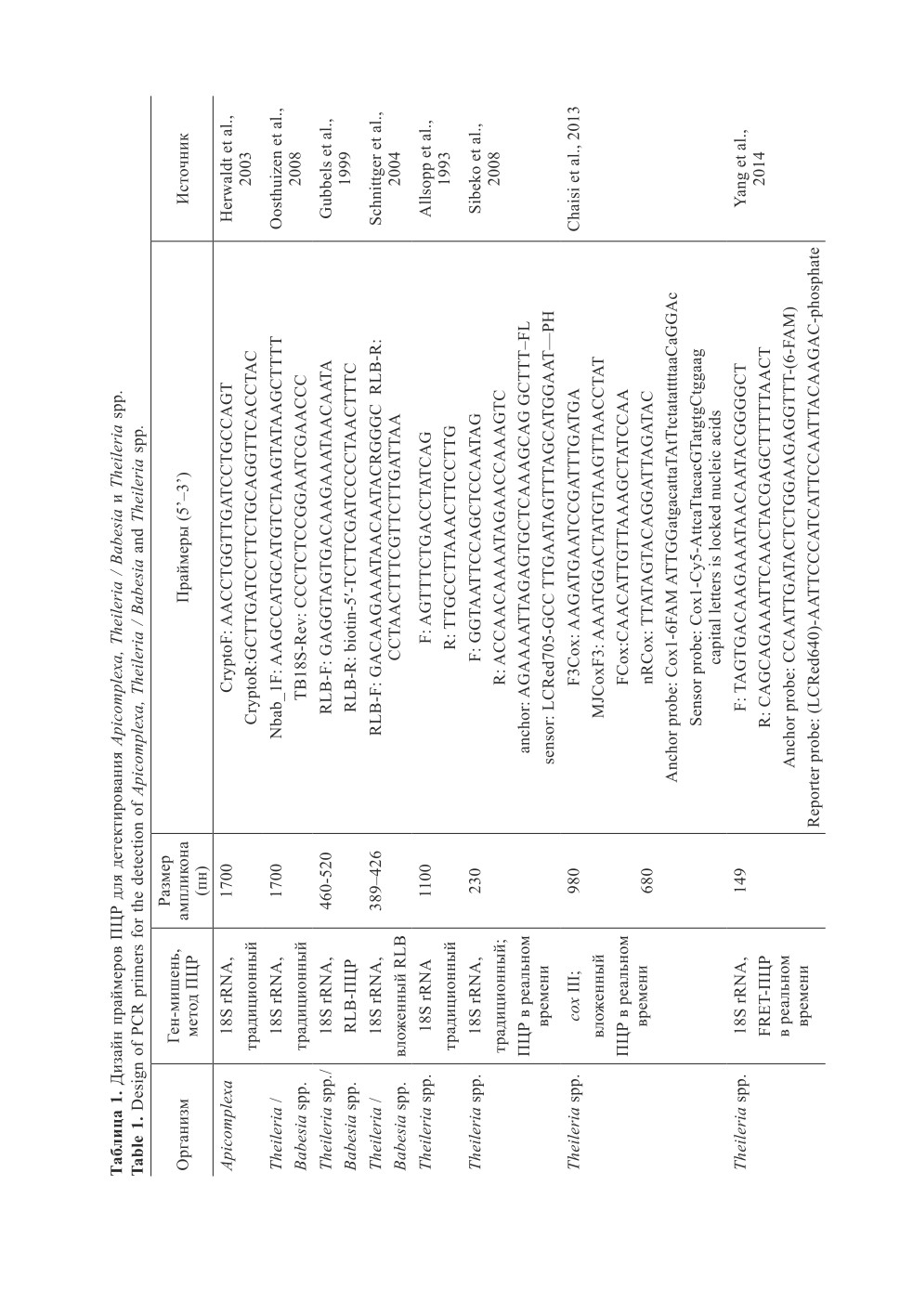
В табл. 1 приведены праймеры, использованные для определения и идентификации
Theileria spp., специфичных для рода и видов. Молекулярные мишени включают ген
18S rRNA, CoxIII, Tams1, ITS, GAPDH, ama1, hprt1, MPSP. Благодаря консерватив-
ной природе и повторяющемуся расположению в геноме, ген ядерной рибосомной
18S рРНК, обеспечивает достаточное количество матричной ДНК для ПЦР и часто
используются для идентификации видов (Chae et al., 1998; Katzer et al., 1998). Он яв-
ляется наиболее часто используемым геном-мишенью. Несмотря на высокую степень
межвидовой консервативности гена 18S рРНК Theileria spp., особенно при работе
с новыми организмами, его необходимо амплифицировать и секвенировать полностью
(Herwaldt et al. 2003), чтобы идентифицировать все генетические вариации.
Видоспецифичные молекулярные методы используются для диагностических це-
лей, а также при проведении эпидемиологических исследований распространения
конкретных видов Theileria spp. В случае подозрения на присутствие этих видов,
когда видоспецифические анализы не дают результатов либо пироплазма не может
быть идентифицирована, целесообразно проведение анализов, специфичных для всего
рода. Примером может служить диагностика T. annulata по гену Tams1, кодирующему
основной полипептид на поверхности мембраны пироплазмы на стадии мерозоита.
Из-за высокого уровня внутригенной вариабельности, праймеры на Tams1 могут не
обнаруживать все генотипы T. annulata, что может привести к недооценке распро-
страненности этого патогена (Kirvar et al., 2000; Katzer et al., 2006, Santos et al., 2013).
В таких случаях обычно используют полный анализ последовательности гена 18S рРНК.
ПЦР в реальном времени способствовала более широкому распространению ПЦР
из-за ее повышенной скорости, чувствительности, воспроизводимости и снижения
риска загрязнения. Примером может служить количественный анализ ПЦР в реаль-
ном времени на основе гена cox III с использованием анализа кривой плавления при
смешанных инфекциях (Chaisi et al., 2013), позволяющий обнаруживать и иденти-
фицировать одновременно многие виды Theileria (T. parva, T. taurotragi, T. buffeli,
T. mutans, T. velifera). Анализ Cox III специфичен для детекции инфекций T. parva
у КРС и буйволов и выявляет больше положительных образцов этих возбудителей,
чем анализ RLB и анализ 18S рРНК. Однако низкий уровень выявления гена cox III
объясняется наличием обширных межвидовых и внутривидовых вариаций в обла-
стях последовательностей присоединения зондов. Другим примером может служить
метод ПЦР в реальном времени, для диагностики и количественного определения
T. sergenti с использованием специфического праймера для гена 33 кДа (Jeong et al.,
2003). FRET-qPCR пан-Theileria позволяет обнаружить все известные Theileria spp.
жвачных животных в одной реакции (Yang et al., 2014).
36
Специфичность молекулярных исследований
Большинство молекулярных анализов зависит от праймеров и/или зондов, наце-
ленных на небольшие, консервативные области генов, характерных для всех членов
вида или рода. В случае с генами, кодирующими белки, вырожденный характер гене-
тического кода затрудняет разработку конкретных праймеров или зондов, снижая их
чувствительность по сравнению с более консервативными рибосомальными генами
(Pienaar et al., 2011a, 2013). Однако гены белков могут обеспечить бóльшую специфич-
ность за счет отдаленности ортологичных отношений (Odongo et al., 2010; Pienaar
et al., 2011a). В условиях ограниченной информации о разнообразии гена или ограни-
чения доступности общей информации о геноме, задача разработки конкретных мето-
дов анализа заключается в идентификации уникальных регионов в генах или геноме.
Примером этому могут служить праймеры RLB для одновременного обнаружения
Theileria и Babesia. Они нацелены на районы 18S рРНК, с заключенной между ними
областью гиперпеременной V4 и остаются на сегодняшний день характеристичными
для всех членов этих родов (Gubbels et al., 1999). Особо следует отметить, что этот
метод был разработан для оценки разнообразия 18S рРНК у домашних животных
и в дикой природе задолго до того, как стала доступна обширная геномная информация
для рода Theileria (Gubbels et al., 1999). Зонды, используемые в методе RLB, являются
видоспецифичными, основанными на последовательностях генов рибосомной РНК
(Allsopp et al., 1993; Bishop et al., 1995). Они могут обнаруживать всех членов вида,
согласно постулированию сохранности области гиперпеременной 18S в пределах видов.
Чувствительность ДНК-зондов значительно увеличивается благодаря ПЦР амплифика-
ции минимальных количеств ДНК возбудителя заболевания, присутствующих в крови
животных (Allsopp et al., 1989). Видоспецифичные ДНК-зонды были разработаны для
T. parva (Allsopp and Allsopp, 1988; Conrad et al., 1987; Morzaria et al., 1999), T. mutans
(Morzaria, 1989) и T. annulata (d’Oliveira et al., 1995).
Чувствительность молекулярных методов исследований
и диапазоны паразитемии
Большинство молекулярных анализов нацелено на обнаружение геномной ДНК
и, следовательно, их чувствительность зависит от эффективности ее извлечения,
т. е. выхода, количества копий генов в геноме, количестве паразитов (геномных копий)
на выборку клеток и уровня паразитемии (т.е. процента инфицированных эритроци-
тов). Образцами, наиболее подходящими для молекулярной детекции Theileria spp.
у позвоночных хозяев, являются кровь и селезенка. После отбора они должны быть
охлаждены до + 4 ° C. Однако, если образцы не используются в течение ближайших
72 часов, их следует хранить при -20 ° C. Образцы крови в полевых условиях можно
сушить на бумажных носителях (картах FTA), что упрощает транспортировку и долгое
хранение (Rahikainen et al., 2016).
Большинство молекулярных анализов, основанных на традиционной технологии
ПЦР или ПЦР в режиме реального времени, соответствует необходимому уровню
требований в отношении аналитической чувствительности (>400000 паразитов/литр
крови животного). Согласно естественному распределению паразитемии у животных-
носителей, эти анализы позволяют обнаруживать большинство инфицированных осо-
бей в эндемических условиях. Однако потенциал ложноотрицательных результатов
возможно оценить только в пределах биологической модели, когда паразит находится
40
внутри его позвоночного хозяина, т.е. паразитемии в переносчике, которое будет под-
держивать заражение вектора и последующую передачу (Mans et al., 2015).
Конкретный диапазон паразитемии вида может определять его практический предел
детектирования. Поскольку большинство видов Theileria spp. обычно имеют более
высокие диапазоны паразитемии в состоянии носительства (Mans et al., 2015), можно
сделать вывод, что анализы ПЦР в реальном времени должны позволять выявлять
большинство инфицированных животных в стаде. Однако, в случаях колебания па-
разитемии ниже пределов обнаружения, необходимо применение нескольких раундов
тестирования (Ueti et al., 2012).
Коинфекции
Наиболее сложными для диагностики представляются случаи, когда чувствитель-
ность анализа зависит от наличия смешанных инфекций. Действительно, клещи-
переносчики могут быть коинфицированы множеством разнообразных патогенов и
непатогенных симбионтов, которые могут мешать поддержанию и передаче патогенов
или могут способствовать их сохранению (Moutailler et al., 2016; Lempereur et al.,
2017). Количество сопутствующих инфекций КРС может варьировать от двух до ше-
сти или более различных патогенов, передаваемых клещами (Hailemariam et al., 2017;
Ringo et al., 2018), хотя большинство смешанных инфекций встречаются как двойные
инфекции (Hailemariam et al., 2017). Котрансмиссия нескольких патогенов может при-
вести к коинфекции, которая увеличивает тяжесть и продолжительность заболевания,
риски передачи (Vaumourin et al., 2015) или давать развитие атипичных симптомов,
что создает диагностические трудности (Moutailler et al., 2016).
В случае коинфекции чувствительность молекулярных методов, например метода
RLB, в значительной степени зависит от использования универсальных праймеров,
поскольку они в ходе ПЦР истощаются преобладающими видами, присутствующими
в образце, одновременно давая слабый сигнал от менее распространенной матрицы
(Pienaar et al., 2011a). Решением этой проблемы может быть разработка более специфич-
ных праймеров и соответствующих условий проведения ПЦР, уменьшающих описанное
выше явление, за счет небольшого снижения аналитической чувствительности, но
с повышением общей эффективности для полевых образцов (Pienaar et al., 2011b).
Для решения аналогичной проблемы, подавления чувствительности при исполь-
зовании универсальных праймеров для анализа cox III, была предложена стратегия
вложенного ПЦР (Chaisi et al., 2013), повышающего общую чувствительность (Schnittger
et al., 2004; Odongo et al., 2010; Ueti et al., 2012). Однако метод требует осторожности
в связи с проблемами лабораторного загрязнения или не достаточной специфичности
праймеров, что приводит к подавлению ПЦР наиболее доминирующими генотипами.
Заключение
Таким образом, несмотря на наличие обширных ресурсов для диагностики Theileria
spp., для их уверенной диагностики необходимо сочетание методов идентификации
возбудителя заболевания, применяемых на одном и том же образце, поскольку многие
из доступных анализов ограничены по специфичности и чувствительности. Поэтому
положительный диагноз в ряде случаев возможен только как результат по крайней мере
двух независимых методов или нескольких анализов. Лучшее понимание биологиче-
ских характеристик многих «новых» видов паразита, а также накопление информации
о новых сиквенсах в базах данных позволит в будущем улучшить диагностические
возможности, что положительно скажется на эпидемиологии болезни.
41
Благодарности
Исследования выполнены в рамках Государственного задания Минобрнауки России
№ 0445-2021-0016.
Список литературы
Зубаирова М.М., Газимагомедов М.Г., Атаев А.М., Абдулмагомедов С.Ш. 2017. Эпизоотология смешанных
инвазий пироплазмидов крупного рогатого скота в Терско-Сулакской низменности. Ветеринария
и кормление 5: 28-30. [Zubairova M.M., Gazimagomedov M.G., Ataev A.M., Abdulmagomedov S.Sh.
2017. The epizootology of mixed invasions of piroplasmosis of cattle in Terek-Sulak lowland. Veterinaria
i kormlenie 5: 28-30. (in Russian)]
Новак М.Д., Енгашев С.В., Филимонов Д.Н. 2019. Анаплазмоз и бабезиоз крупного рогатого скота в
Центральном районе Российской Федерации. Теория и практика борьбы с паразитарными болезнями.
20: 421-427. [Novak M.D., Engashev S.V., Filimonov D.N. Anaplasmosis and babesiosis of cattle in Central
region of Russian federation. Theory and Practice of Struggle Against Parasitic Diseases 20: 421-427. (in
Russian)] DOI: 10.31016/978-5-9902340-8-6.2019.20.421-427
Самойловская Н.А., Успенский А.В., Новосад Е.В., Гулюкин Е.А., Малышева Н.С., Буренок А.С., Орлова
И.И., Белоусова И.Н. 2015. Гемоспоридиозы сельскохозяйственных, домашних и диких животных на
территории российской федерации. Российский паразитологический журнал. 3: 37-44. [Samoylovskaya
N.A., Uspensky A.V., Novosad E.V., Gulyukin E.A., Malysheva N.S., Buryonok A.S., Orlova I.I., Belousova
I.N. Hemosporidosis of farm, domestic and wild animals on the territory of Russian federation. Russian
Journal of Parasitology 3: 37-44. (in Russian)] DOI:10.12737/13267
Alhassan A., Govind Y., Tam N.T., Thekisoe O.M.M., Yokoyama N., Inoue N., Igarashi I. 2007. Comparative
evaluation of the sensitivity of LAMP, PCR and in vitro culture methods for the diagnosis of equine piro-
Allsopp B.A., Allsopp M.T.E.P. 1988. Theileria parva: genomic DNA studies reveal intra-specific sequence diver-
Allsopp B.A., Baylis H.A., Allsoppi M.T.E.P., Cavalier-Smith T., Bishop R.P., Carrington D.M., Sohanpal B.,
Spooner, P. 1993. Discrimination between six species of Theileria using oligonucleotide probes which
S0031182000067263
Allsopp B., Carrington M., Baylis H., Sohal S., Dolan T., Iams K. 1989. Improved characterization of Theileria
parva isolates using the polymerase chain reaction and oligonucleotide probes. Molecular and Biochemical
Altay K., Aydin F.M., Dumanli N., Aktas M. 2008. Molecular detection of Theileria and Babesia infections in
Bishop R., Allsopp B., Spooner P., Sohanpal B., Morzaria S., Gobright E. 1995. Theileria: improved species
discrimination using oligonucleotides derived from large subunit ribosomal RNA sequences. Experimental
Bishop R., Sohanpal B., Kariuki D.P., Young A.S., Nene V., Baylis H., Allsopp B.A., Spooner P.R., Dolan T.T.,
Morzaria S.P. 1992. Detection of a carrier state in Theileria parva-infected cattle by the polymerase chain
Bott N.J., Campbell B.E., Beveridge I., Chilton N.B., Rees D., Hunt P.W., Gasser R.B. 2009. A combined mi-
croscopic-molecular method for the diagnosis of strongylid infections in sheep. International Journal for
Burridge M.J., Brown C.G.D., Kimber C.D. 1974. Theileria annulata: Cross-reactions between a cell culture
schizont antigen and antigens of East African species in the indirect fluorescent antibody test. Experimental
Bursakov S.A., Kovalchuk S.N. 2019. Co-infection with tick-borne disease agents in cattle in Russia. Ticks and
Chae J.-s., Lee J.-m., Kwon O.-d., Holman P.J., Waghela S.D., Wagnera G.G. 1998. Nucleotide sequence het-
erogeneity in the small subunit ribosomal RNA gene variable (V4) region among and within geographic
isolates of Theileria from cattle, elk and white-tailed deer. Veterinary Parasitology 75 (1): 41-52. https://
doi.org/10.1016/S0304-4017(97)00183-0
Chaisi M.E., Janssens M.E., Vermeiren L., Oosthuizen M.C., Collins N.E., Geysen D. 2013. Evaluation of a real-
time PCR test for the detection and discrimination of Theileria species in the African buffalo (Syncerus
42
Choi E.J., Kang S.W., Kweon C.H., Jeong W.S., Yoon Y.D., Song H.J. 1997. Rapid detection of Theileria sergenti
kjp.1997.35.2.111
Collins N.E., Allsopp M.T.E.P., Allsopp B.A. 2002. Molecular diagnosis of theileriosis and heartwater in bovines
in Africa. Transactions of the Royal Society of Tropical Medicine and Hygiene 96 (S1): S217-S224. https://
doi.org/10.1016/S0035-9203(02)90079-9
Conrad P.A., Stagg D.A., Grootenhuis J.G., Irvin A.D., Newson J., Njamunggeh R.E., Rossiter P.B., Young A.S.
1987. Isolation of Theileria parasites from African buffalo (Syncerus caffer) and characterization with anti-
Criado-Fornelio A. 2007. A review of nucleic acid-based diagnostic tests for Babesia and Theileria, with emphasis
Christensen/publication/6147199_Taking_advantage_of_the_polymorphism_of_the_MSA-2_family_for_Ba-
besia_bovis_strain_characterization/links/548df9710cf225bf66a5f7ae/Taking-advantage-of-the-polymor-
phism-of-the-MSA-2-family-for-Babesia-bovis-strain-characterization.pdf#page=39
de Waal D.T. 1992. Equine piroplasmosis: A review. British Veterinary Journal 148 (1): 6-14. https://doi.
org/10.1016/0007-1935(92)90061-5
d‘Oliveira C., van der Weide M., Habela M.A., Jacquiet P., Jongejan F. 1995. Detection of Theileria annulata in
blood samples of carrier cattle by PCR. Journal of Clinical Microbiology 33 (10): 2665-2669. https://jcm.
asm.org/content/jcm/33/10/2665.full.pdf
El-Ashker M., Hotzel H., Gwida M., El-Beskawy M., Silaghi C., Tomaso H. 2015. Molecular biological identifi-
cation of Babesia, Theileria, and Anaplasma species in cattle in Egypt using PCR assays, gene sequence
vetpar.2014.12.025
Florin-Christensen M., Schnittger L. 2009. Piroplasmids and ticks: a long-lasting intimate relationship. Frontiers
in Bioscience 14: 3064-3073. DOI: 10.2741/3435
Gardner M.J., Bishop R., Shah T., de Villiers E.P., Carlton J.M., Hall N., Ren Q., Paulsen I.T., Pain A., Berriman
M., Wilson R.J.M., Sato S., Ralph S.A., Mann D.J., Xiong Z., Shallom S.J., Weidman J., Jiang L., Lynn
J., Weaver B., Shoaibi A., Domingo A.R., Wasawo D., Crabtree J., Wortman J.R., Haas B., Angiuoli S.V.,
Creasy T.H., Lu C., Suh B., Silva J.C., Utterback T.R., Feldblyum T.V., Pertea M., Allen J., Nierman W.C.,
Taracha E.L.N., Salzberg S.L., White O.W., Fitzhugh H.A., Morzaria S., Venter J.C., Fraser C.M., Nene V.
2005. Genome sequence of Theileria parva, a bovine pathogen that transforms lymphocytes. Science 309
Gebrekidan H., Perera P.K., Ghafar A., Abbas T., Gasser R.B., Jabbar A. 2020. An appraisal of oriental theileriosis
and the Theileria orientalis complex, with an emphasis on diagnosis and genetic characterisation. Parasitol-
Geysen D., Bishop R., Skilton R., Dolan T.T., Morzaria S. 1999. Molecular epidemiology of Theileria parva
3156.1999.00447.x
Gotia H.T., Munro J.B., Knowles D.P., Daubenberger C.A., Bishop R.P., Silva J.C. 2016. Absolute quantification
of the host-to-parasite DNA ratio in Theileria parva-infected lymphocyte cell lines. PLoS ONE 11 (3):
Gubbels J.M., de Vos A.P., van der Weide M., Viseras J., Schouls L.M., de Vries E., Jongejan F. 1999. Simultane-
ous detection of bovine Theileria and Babesia species by reverse line blot hybridization. Journal of Clinical
Microbiology 37 (6): 1782-1789. DOI: 10.1128/JCM.37.6.1782-1789.1999
Gubbels M.J., Hong Y., van der Weide M., Qi B., Nijman I.J., Guangyuan L., Jongejan F. 2000. Molecular char-
acterisation of the Theileria buffeli/orientalis group. International Journal for Parasitology 30 (8): 943-952.
Hailemariam Z., Krücken J., Baumann M., Ahmed J.S., Clausen P.-H., Nijhof A.M. 2017. Molecular detection
of tick-borne pathogens in cattle from Southwestern Ethiopia. PLoS ONE 12(11): e0188248. https://doi.
org/10.1371/journal.pone.0188248
Hayashida K., Hara Y., Abe T., Yamasaki C., Toyoda A., Kosuge T., Suzuki Y., Sato Y., Kawashima S., Katayama
T., Wakaguri H., Inoue N., Homma K., Tada-Umezaki M., Yagi Y., Fujii Y., Habara T., Kanehisa M., Wata-
nabe H., Ito K., Gojobori T., Sugawara H., Imanishi T., Weir W., Gardner M., Pain A., Shiels B., Hattori
M., Nene V., Sugimoto C. 2012. Comparative genome analysis of three eukaryotic parasites with differing
abilities to transform leukocytes reveals key mediators of Theileria-induced leukocyte transformation. mBio
Heidarpour Bami M., Haddadzadeh H.R., Kazemi B., Khazraiinia P., Bandehpour M., Aktas M. 2009. Molecular
identification of ovine Theileria species by a new PCR-RFLP method. Veterinary Parasitology 161 (3-4):
43
Herwaldt B.L., Cacciò S., Gherlinzoni F., Aspöck H., Slemenda S.B., Piccaluga P., Martinelli G., Edelhofer R.,
Hollenstein U., Poletti G., Pampiglione S., Löschenberger K., Tura S., Pieniazek N.J. 2003. Molecular
characterization of a non-Babesia divergens organism causing zoonotic babesiosis in Europe. Emerging
Jeong W., Kweon C.H., Kang S.W., Paik S.G. 2003. Diagnosis and quantification of Theileria sergenti using Taq-
de Vos A.J., Playford M., Salim B., Kinyanjui P., Sugimoto C. 2011. Emergence of new types of Theileria
orientalis in Australian cattle and possible cause of theileriosis outbreaks. Parasites and Vectors 4: 22.
Kappmeyer L.S., Thiagarajan M., Herndon D.R., Ramsay J.D., Caler E., Djikeng A., Gillespie, J.J., Lau, A.OT,
Roalson, E.H., Silva J.C., Silva M.G., Suarez C.E., Ueti V.W., Nene V.M., Mealey R.H., Knowles D.P.,
Brayton K.A. 2012. Comparative genomic analysis and phylogenetic position of Theileria equi. BMC
Katzer F., McKellar S., Ben Miled L., D’Oliveira C., Shiels B. 1998. Selection for antigenic diversity of Tams1,
the major merozoite antigen of Theileria annulata. Annals of the New York Academy of Sciences 849 (1):
Katzer F., Ngugi D., Oura C., Bishop R.P., Taracha E.L.N., Walker A.R., McKeever D.J. 2006. Extensive genotypic
diversity in a recombining population of the apicomplexan parasite Theileria parva. Infection and Immunity
Kim C.M., Blanco L.B.C., Alhassan A., Iseki H., Yokoyama N., Xuan X., Igarashi I. 2008. Diagnostic real-time
PCR assay for the quantitative detection of Theileria equi from equine blood samples. Veterinary Parasitol-
Kirvar E., Ilhan T., Katzer F., Hooshmand-Rad P., Zweygarth E., Gerstenberg C., Phipps P., Brown C.G.D. 2000.
Detection of Theileria annulata in cattle and vector ticks by PCR using the Tams1 gene sequences. Para-
Kubota S., Sugimoto C., Kakuda T., Onuma M. 1996. Analysis of immunodominant piroplasm surface antigen
alleles in mixed populations of Theileria sergenti and T. buffeli. International Journal of Parasitology 26
Kundave V.R., Patel A.K., Patel P.V., Hasnani J.J., Joshi C.G. 2015. Detection of theileriosis in cattle and buf-
s12639-013-0386-2
Kundave V.R., Ram H., Banerjee P.S., Garg R., Mahendran K., Ravikuma G.V.P.P.S., Tiwari A.K. 2018. Develop-
ment of multiplex PCR assay for concurrent detection of tick borne haemoparasitic infections in bovines.
Lempereur L., Beck R., Fonseca I., Marques C., Duarte A., Santos M., Zúquete S., Gomes J., Walder G., Domingos
A., Antunes S., Baneth G., Silaghi C., Holman P., Zint A. 2017. Guidelines for the detection of Babesia and
Li Z., Liu J., Ma Q., Xu J., Wang J., Liu A., Li Y., Guan G., Luo J., Yin H. 2020. Development and evaluation
of a chemiluminescence immunoassay for detecting tropical theileriosis. Acta Tropica 202: 105245. https://
doi.org/10.1016/j.actatropica.2019.105245
Mans B.J., Pienaar R., Latif A.A. 2015. A review of Theileria diagnostics and epidemiology International Journal
Martin-Sanchez J., Viseras J., Adroher F.J., García-Fernández P. 1999. Nested polymerase chain reaction for detec-
tion of Theileria annulata and comparison with conventional diagnostic techniques: its use in epidemiology
Morrison D.A. 2009. Evolution of the Apicomplexa: where are we now? Trends in Parasitology 25 (8): 375-382.
Morzaria S.P. 1989. Identification of Theileria species and characterization of Theileria parva stocks. In: Dolan
T.T. (eds) Theileriosis in Eastern, Central and Southern Africa: Proceeding Workshop on East Coast Fever
Immunization, Lilongwe, Malawi, 20-22 September,1988. Nairobi, Kenya. ILRAD. 102-110.
Morzaria S.P., Katende J., Musoke A., Nene V., Skilton R., Bishop R. 1999. Development of sero-diagnostic and
molecular tools for the control of important tick-borne pathogens of cattle in Africa. Parassitologia 41
(S1): 73-80.
Moutailler S., Moro C.V., Vaumourin E., Michelet L., Tran F.H., Devillers E., Cosson J.-F., Gasqui P., Van V.T.,
Mavingui P., Vourc’h G., Vayssier-Taussat M. 2016. Co-infection of Ticks: The Rule Rather Than the Ex-
44
Nene V., Morrison W.I. 2016. Approaches to vaccination against Theileria parva and Theileria annulata. Parasite
Notomi T., Okayama H., Masubuchi H., Yonekawa T., Watanabe K., Amino N., Hase T. 2000. Loop-mediated
Odongo D.O., Sunter J.D., Kiara H.K., Skilton R.A., Bishop R.P. 2010. A nested PCR assay exhibits enhanced
sensitivity for detection of Theileria parva infections in bovine blood samples from carrier animals. Para-
Oosthuizen M.C., Zweygarth E., Collins N.E., Troskie M., Penzhorn B.L. 2008. Identification of a novel Babe-
sia sp. from a sable antelope (Hippotragus niger Harris, 1838). Journal of Clinical Microbiology 46 (7):
2247-2251. DOI: 10.1128/JCM.00167-08
Ota N., Mizuno D., Kuboki N., Igarashi I., Nakamura Y., Yamashina H., Hanzaike T., Fujii K., Onoe S., Hata H.,
Kondo S., Matsui S., Koga M., Matsumoto K., Inokuma H., Yokoyama N. 2009. Epidemiological survey of
Theileria orientalis infection in grazing cattle in the eastern part of Hokkaido, Japan. Journal of Veterinary
Pain A., Renauld H., Berriman M., Murphy L., Yeats C.A., Weir W., Kerhornou A., Aslett M., Bishop R., Bouchier
C., Cochet M., Coulson R.M.R., Cronin A., de Villiers E.P., Fraser A., Fosker N., Gardner M., Goble A.,
Griffiths-Jones S., Harris D.E., Katzer F., Larke N., Lord A., Maser P., McKellar S., Mooney P., Morton
F., Nene V., O’Neil S., Price C., Quail M.A., Rabbinowitsch E.1 Rawlings N.D., Rutter S., Saunders D.,
Seeger K., Shah T., Squares R., Squares S., Tivey A., Walker A.R., Woodward J., Dobbelaere D.A.E.,
Langsley G., Rajandream M.A., McKeever D., Shiels B., Tait A., Barrell B., Hall N. 2005. Genome of the
host-cell transforming parasite Theileria annulata compared with T. parva. Science. 309 (5731): 131-133.
Papli N.E., Landt O., Fleischer C., Koekemoer J.O., Mans B.J., Pienaar R., Josemans A., Zweygarth E., Potgieter
F., Latif A.A. 2011. Evaluation of a TaqMan real-time PCR for the detection of Theileria parva in buffalo
Perera P.K., Gasser R.B., Firestone S.M., Smith L., Roeber F., Jabbar A. 2015. Semiquantitative multiplexed
tandem PCR for the detection and differentiation of four Theileria orientalis genotypes in cattle. Journal
of Clinical Microbiology 53 (1): 79-87. DOI: 10.1128/JCM.02536-14
Pienaar R., Latif A.A., Thekisoe O.M.M., Mans B.J. 2013. Protein gene candidates for the qualitative molecular
detection of Theileria parva in African buffalo (Syncerus caffer) using the real-time SYBR green polymerase
chain reaction. Proceedings of the 1st Annual International Conference on Advances in Veterinary Science
Research (VETSCI2013), Singapore.
Pienaar R., Potgieter F.T., Latif A.A., Thekisoe O.M.M., Mans B.J. 2011a. Mixed Theileria infections in free-
ranging buffalo herds: implications for diagnosing Theileria parva infections in Cape buffalo (Syncerus
Pienaar R., Potgieter F.T., Latif A.A., Thekisoe O.M.M., Mans B.J. 2011b. The Hybrid II assay: a sensitive and
specific real-time hybridization assay for the diagnosis of Theileria parva infection in Cape buffalo (Syn-
Pienaar R., Potgieter F.T., Latif A.A., Thekisoe O.M.M., Mans B.J. 2014. Geographic distribution of Theileria sp.
(buffalo) and Theileria sp. (bougasvlei) in Cape buffalo (Syncerus caffer) in southern Africa: implications
Pulford D.J., Gias E, Bueno I.M., McFadden A.M.J. 2016. Developing high throughput quantitative PCR assays
for diagnosing Ikeda and other Theileria orientalis types common to New Zealand in bovine blood samples.
Rahikainen A.-L., Palo J.U., Leeuw W., Budowle B., Sajantila A. 2016. DNA quality and quantity from up to 16
years old post-mortem blood stored on FTA cards. Forensic Science International 261: 148-153. https://
doi.org/10.1016/j.forsciint.2016.02.014
Ringo A.E., Moumouni P.F.A., Lee S.-H., Liu M., Khamis Y.H., Gao Y., Guo H., Zheng W., Efstratiou A., Galon
E.M., Li J., Tiwananthagorn S., Inoue N., Suzuki H., Thekisoe O., Xuan X. 2018. Molecular detection and
characterization of tick-borne protozoan and rickettsial pathogens isolated from cattle on Pemba Island,
Salih D.A., Ali A.M., Liu Z., Bakheit M.A., Taha K.M., El Imam A.H., Kullmann B., El Hussein A.M., Ahmed
J.S. Seitzer U. 2012. Development of a loop-mediated isothermal amplification method for detection of
Salim B., Bakheit M.A., Sugimoto C. 2013. Rapid detection and identification of Theileria equi and Babesia
caballi by high-resolution melting (HRM) analysis. Parasitology Research 112 (11): 3883-3886. https://
doi.org/10.1007/s00436-013-3581-2
45
Santos M., Soares R., Costa P., Amaro A., Inácio J., Gomes J. 2013. Revisiting the Tams1-encoding gene as a
species-specific target for the molecular datection of Theileria annulata in bovine blood samples. Ticks and
Schnittger L., Yin H., Qi B., Gubbels M.J., Beyer D., Niemann S. 2004. Simultaneous detection and differentiation
of Theileria and Babesia parasites infecting small ruminants by reverse line blotting. Parasitology Research
Shirozu T., Badolo A., Soga A., Yoshimura A., Morishita Y.K., Koketsu M., Shirafuji R.U., Inokuma H., Yokoyama
N., Fukumoto S. 2020. Development and evaluation of a novel loop-mediated isothermal amplification
(LAMP) method targeting Theileria parasites infecting Yezo sika deer. Parasitology International 77: 102130.
Sibeko K.P., Oosthuizen M.C., Collins N.E., Geysen D., Rambritch N.E., Latif A.A., Groeneveld H.T., Potgieter
F.T., Coetzer J.A. 2008. Development and evaluation of a real-time polymerase chain reaction test for the
detection of Theileria parva infections in Cape buffalo (Syncerus caffer) and cattle. Veterinary Parasitol-
Parasitic Diseases in Sheep - A Review. International Journal of Livestock Research 8 (2): 14-24. https://
doi.org/10.5455/ijlr.20170922043628
Skilton R.A., Bishop R.P., Katende J.M., Mwaura S., Morzaria S.P. 2002. The persistence of Theileria parva infection
in cattle immunized using two stocks, which differ in their ability to induce a carrier state: analysis using
Thekisoe O.M., Rambritch N.E., Nakao R., Bazie R.S., Mbati P., Namangala B., Malele I., Skilton R.A., Jongejan
F., Sugimoto C., Kawazu S., Inoue N. 2010. Loop-mediated isothermal amplification (LAMP) assays for
detection of Theileria parva infections targeting the PIM and p150 genes. International Journal of Parasitol-
Tokarevich N., Tronin A., Gnativ B., Revich B., Blinova O., Evengard B. 2017. Impact of air temperature varia-
tion on the ixodid ticks habitat and tick-borne encephalitis incidence in the Russian Arctic: The case of
2423982.2017.1298882
Ueti M.W., Mealey R.H., Kappmeyer L.S., White S.N., Kumpula-McWhirter N., Pelzel A.M., Grause J.F., Bunn
T.O., Schwartz A., Traub-Dargatz J.L., Hendrickson A., Espy B., Guthrie A.J., Fowler W.K., Knowles D.P.
2012. Re-emergence of the apicomplexan Theileria equi in the United States: elimination of persistent
Vaumourin E., Vourc’h G., Gasqui P., and Vayssier-Taussat M. 2015. The importance of multiparasitism: examining
the consequences of co-infections for human and animal health. Parasites and Vectors 8 (1): 545. https://
doi.org/10.1186/s13071-015-1167-9
Wang J., Yang J., Gao S., Liu A., Rashid M., Li Y., Liu Z., Liu J., Liu G., Luo J., Guan G., Yin H. 2020. Rapid
detection and differentiation of Theileria annulata, T. orientalis and T. sinensis using high-resolution melt-
Wang J., Yang J., Liu J., Wang X., Xu J., Liu A., Li Y., Liu Z., Ren Q., Luo J., Guan G., Yin H. 2018. Molecular
detection and genetic diversity of Theileria orientalis in cattle in China. Parasitology Research 117 (12):
Wang L.X., He L., Fang R., Song Q.Q., Tu P., Jenkins A., Zhou Y.Q., Zhao J.L. 2010. Loop-mediated isothermal
amplification (LAMP) assay for detection of Theileria sergenti infection targeting the p33 gene. Veterinary
Yang Y., Mao Y., Kelly P., Yang Z., Luan L., Zhang J., Li J., El-Mahallawy H.S., Wang C. 2014. A pan-Theileria
FRET-qPCR survey for Theileria spp. in ruminants from nine provinces of China. Parasites and Vectors 7:
Zaeemi M., Haddadzadeh H., Khazraiinia P., Kazemi B., Bandehpour M. 2011. Identification of different Theileria
species (Theileria lestoquardi, Theileria ovis, and Theileria annulata) in naturally infected sheep using
Zhao H., Liu J., Li Y., Yang C., Zhao S., Liu J., Liu A., Liu G., Yin H., Guan G., Luo J. 2016. Validation of refer-
ence genes for quantitative real-time PCR in bovine PBMCs transformed and non-transformed by Theileria
annulata. Korean Journal of Parasitology 54 (1): 39-46. doi: 10.3347/kjp.2016.54.1.39
Zhou M., Cao S., Sevinc F., Sevinc M., Ceylan O., Moumouni P.F., Jira-pattharasate C., Liu M., Wang G., Iguchi
A., Vudriko P., Suzuki H., Xuan X. 2016. Molecular detection and genetic identification of Babesia bige-
mina, Theileria annulata, Theileria orientalis and Anaplasma marginale in Turkey. Ticks and Tick-Borne
46
MOLECULAR DIAGNOSTICS OF CATTLE THEILERIOSIS
S. A. Bursakov
Keywords: Theileria, theileriosis, cattle, molecular diagnostics
SUMMARY
Detection and treatment of theileriosis is an important tool for controlling this disease. Wide range
of Theileria spp. species, their species-specific characteristics, disease severity, and drug susceptibility
determine the importance of accurate identification of the pathogen for epidemiological research and
diagnostic purposes, taking into account the characteristics of their vertebrate hosts and arthropod vec-
tors. The presence of many varieties of Theileria is an incentive for the creation of PCR test systems
with an ability to identify different species, as well as to register coinfection. Modern methods of
control detection and spreading of the disease do not always allow recognizing early stages; this fact,
taking in account high transience of the disease, can contribute to losses in animal husbandry. Hence,
the development of rapid and sensitive detection methods in the early stages of the disease causes
interest. The present paper presents modern approaches to the molecular diagnostics of Theileria spp.
47