ПАРАЗИТОЛОГИЯ, 2021, том 55, № 4, с. 318-336.
УДК 595.771
ОПРЕДЕЛЕНИЕ АКТИВНОСТИ КАТАЛАЗЫ
У КРОВОСОСУЩИХ КОМАРОВ
С ИСПОЛЬЗОВАНИЕМ МОЛИБДАТА АММОНИЯ
И РЕАКЦИОННОЙ БУФЕРНОЙ СРЕДЫ НА ОСНОВЕ
3-(N-МОРФОЛИНО)ПРОПАНСУЛЬФОНОВОЙ КИСЛОТЫ
©2021 г. А. В. Разыграевa, b, *
aЗоологический институт РАН, Университетская наб., 1,
Санкт-Петербург, 199034 Россия
bСанкт-Петербургский государственный химико-фармацевтический университет
Министерства здравоохранения РФ,
проф. Попова, 4, С.-Петербург, 197376 Россия
*e-mail: a.v.razygraev@gmail.com
Поступила в редакцию 10.10.2020 г.
После доработки 21.01.2021 г.
Принята к печати 30.01.2021 г.
Метод, предложенный Peizer и Widelock в 1955 г., а затем в более простом виде - Королюком
и соавторами в 1988 г. для определения активности каталазы, адаптирован для определения ак-
тивности фермента в гомогенатах кровососущих комаров. Убыль концентрации H2O2 - субстрата
каталазы - оценивается по цветной реакции H2O2 с молибдатом аммония. Метод модифицирован
с использованием буферного раствора на основе MOPS (pH 7.4). Поглощение реакционной смеси
при 410 нм вследствие образования комплекса пероксида водорода и молибдата увеличивается
почти линейно при использовании возрастающих рабочих концентраций H2O2 в реакционной
смеси до значений около 8 мМ. Выбранная рабочая концентрация H2O2 составила 8.2 мМ,
время инкубации - 4 мин, температура инкубации - 25°С. При величинах активности каталазы
в реакционной смеси до 0.72 мМ H2O2 / мин скорость реакции распада H2O2 под действием
фермента почти не снижается за 4 мин инкубации. Скорость реакции пропорциональна содер-
жанию белка в реакционной смеси. Результаты определения активности каталазы настоящим
методом хорошо коррелируют с результатами, полученными при прямом измерении убыли H2O2
при 253 нм. Метод удобен для серийного определения активности фермента в индивидуальных
гомогенатах комаров. С применением данного метода показаны различия по величине каталазной
активности между некоторыми таксонами внутри сем. Culicidae.
318
Ключевые слова: метод, MOPS, пероксид водорода, фермент, антиоксидантная функция,
кровососущие комары, Culicidae
DOI: 10.31857/S0031184721040049
Каталаза, супероксиддисмутаза и глутатионпероксидаза - важные ферментатив-
ные компоненты антиоксидантной системы насекомых и других животных (Felton,
Summers, 1995). Супероксиддисмутаза катализирует превращение высокотоксичного
супероксидного радикала в менее токсичный пероксид водорода (H2O2), а каталаза
и глутатионпероксидаза обеспечивают детоксикацию H2O2 (Torres, 2002). Согласно
данным Sim и Denlinger (2011), у диапаузирующих взрослых самок кровососущих ко-
маров Culex pipiens L. отмечается повышенная экспрессия генов супероксиддисмутазы
(sod-2) и каталазы, что увеличивает продолжительность жизни этих самок, повышает
стрессоустойчивость и тем самым позволяет им пережить холодный период года. Бо-
лее того, увеличенная экспрессия каталазы предотвращает апоптоз клеток фолликулов
яичников у зимующих самок (Sim, Denlinger, 2011). Ввиду столь важной роли данный
фермент может оказаться перспективной мишенью при разработке методов регуляции
численности кровососущих комаров.
Для фундаментально-научного и прикладного исследования роли каталазы необхо-
димо использовать методы количественного определения ее активности. К настоящему
времени разработано немало методов определения активности этого фермента в разных
биологических образцах, и наиболее доступными из них остаются спектрофотоме-
трические методы. В ультрафиолетовом диапазоне длин волн каталазную активность
измеряют непосредственно по убыли концентрации пероксида водорода (Beers, Sizer,
1952), используя коэффициенты молярного поглощения H2O2 для разных длин волн
(Aebi, 1974, 1984; Razygraev, 2020). Однако более привлекательными и пригодными
для анализа широкого спектра неочищенных образцов, содержащих фермент, являются
методы, основанные на образовании окрашенных продуктов реакций. Поглощение
этих продуктов регистрируется в видимом диапазоне длин волн.
В 1870 г. Schönn обнаружил желтое окрашивание раствора при взаимодействии
пероксида водорода с молибдатом в кислой среде (Isaacs, 1922; Mellon, 1952), и
в первой половине 20 в. данная реакция стала использоваться, хотя и очень ограни-
ченно, для определения концентрации пероксида водорода (Isaacs, 1922). В середине
20 в. эту реакцию использовали для определения каталазной активности в культу-
рах Mycobacterium tuberculosis (Peizer, Widelock, 1955). В 1988 г. была опубликована
работа Королюка с соавторами (1988), в которой описывается применение реакции
пероксида водорода с молибдатом аммония для определения активности каталазы
в сыворотке крови и гомогенатах тканей, после чего метод стал широко применять-
ся. При ознакомлении с методом в оригинальной статье возникает, однако, немало
319
вопросов, в частности относительно стабильности рН реакционной среды. Улучшение
метода сразу после выхода статьи Королюка проводилось другими исследователями
(GÓth, 1991) вплоть до относительно недавнего времени (Hadwan, Abed, 2016) с ис-
пользованием слабощелочных фосфатных буферных растворов.
В настоящей работе была поставлена цель модифицировать метод определения
каталазной активности с использованием молибдата аммония для работы с гомогена-
тами кровососущих комаров и применить для этого широко используемую в биохи-
мии буферную среду на основе 3-(N-морфолино)пропансульфоновой кислоты (MOPS)
(Boveris et al., 1976; Wada et al., 2008; Al-Rabadi et al., 2009; Hoobler et al., 2013).
Исследование предусматривало решение неспецифических задач, связанных со
спектрофотометрическими свойствами самой реакции H2O2 и молибдата аммония и со
свойствами буферной среды, и специфических, связанных со свойствами конкретного
биоматериала, содержащего каталазную активность. В первой группе задач - оценка
зависимости поглощения окрашенного комплекса при 410 нм от концентрации H2O2,
величины сдвига рН при внесении растворителя биоматериала в MOPS-буфер, ста-
бильности поглощения окрашенного продукта при комнатной температуре. Во второй
группе задач - проверка линейности зависимости величины убыли поглощения при
410 нм от длительности реакции, катализируемой каталазой комаров, и от содержания
экстракта ткани комаров в реакционной смеси; оценка точности и воспроизводимости
метода; оценка вклада оптической плотности биоматериала в величину оптической
плотности опытных проб при 410 нм; сравнение результатов определения удельной
каталазной активности, полученных методом с использованием молибдата аммония
и MOPS-буфера и методом прямой регистрации убыли Н2О2 по поглощению в ультра-
фиолетовом диапазоне в фосфатном буфере.
МАТЕРИАЛ И МЕТОДИКА
Сбор и предварительная обработка материала
Взрослые самки кровососущих комаров Culex pipiens L., 1758 и Culiseta annulata
(Schrank, 1776) были собраны 22 марта 2020 г. в привходовых частях Саблин-
ских пещер (Тосненский р-н, Ленинградская обл.). Culex pipiens зимует в Саблин-
ских пещерах вместе с морфологически близким к нему видом Сx. torrentium, поэто-
му среди смеси двух видов выбирали самок, которых можно было обоснованно отнести
к Cx. pipiens. Для этого использовали морфометрический индекс r2/3/r3, по которому виды имеют
разные распределения. Этот индекс рассчитывается как соотношение между длиной «рукоятки»
радиальной жилки и длиной задней ветви «вилки» радиальной жилки, упирающейся в край
крыла. (Börstler et al., 2014). Морфометрический индекс r2/3/r3, усредненный по двум крыльям, у
выбранных самок составил 0.147-0.180, что является сильным свидетельством принадлежности
их к виду Cx. pipiens (Разыграев, Шулешко, 2018). В остальном определение видов комаров
320
(в том числе самцов, см. ниже) проводилось согласно определительным таблицам Гуцевича
с соавторами (1970) и Becker с соавторами (Becker et al., 2010).
Самцы собраны в Санкт-Петербурге и Ленинградской обл. с июня по октябрь 2019 г.
и с мая по июль 2020 г. из роев (Ochlerotatus communis (De Geer) 26.05 и 9.06.2020), с соцветий
Aegopodium podagraria L. (Culex territans Walker и Culiseta fumipennis (Stephens), 3.07.2020),
Tanacetum vulgare L. (Cx. pipiens L. и Сx. torrentium Martini, 6.08.2019), среди зарослей Phragmites
australis (Cav.) Trin. ex Steud. и других злаков (Coquillettidia richiardii (Ficalbi), 28.06.2019 и
6.07.2020), на обнажениях песчаника в привходовых частях пещер (Anopheles maculipennis s. l.,
6 и 15.10.2019) и использованы в настоящей работе только при сравнении двух методик опреде-
ления каталазной активности.
Комаров содержали в пластиковых контейнерах объемом 60-900 мл (в зависи-
мости от объема сборов) в течение 1 сут (1 самец A. maculipennis - в течение 2 сут)
при комнатной температуре. Доступность воды - ad libitum. Самцы также получа-
ли сахарозу ad libitum. Затем комаров замораживали при -10°C, переносили в -80°C,
хранили при этой температуре, размораживали и гомогенизировали каждого из
них 60 с в стеклянном гомогенизаторе в холодном 0.05 M K-Na-фосфатном буфере
(pH 7.9) в отношении 100 мкл буфера на 1 мг массы интактного комара. Непосредственно
перед гомогенизацией у самок отделяли крылья и ноги, а у самцов также головной отдел и
каудальную часть абдомена с 7-го сегмента (для последующего определения таксономической
принадлежности). Супернатант, полученный в результате центрифугирования при 1000 g (4°C,
6 мин), использовали как биоматериал для определения каталазной активности.
Определение ферментативной активности
Определение активности каталазы проводили в буферной среде на основе MOPS с добавле-
нием раствора пероксида водорода и с терминацией реакции добавлением молибдата аммония.
Буферный раствор на основе MOPS готовили следующим образом: разводили 210 мг MOPS
(“Acros Organics”, Бельгия) в 90 мл дистиллированной воды, доводили рН добавлением не-
скольких миллилитров 0.1 N NaOH (“Вектон”, Россия) до 7.40-7.42 и доводили объем раствора
до 100 мл. Готовили 4% раствор аммония молибденовокислого 4-водного («Вектон», Россия)
в дистиллированной воде (w/v) (3.77%, или 32.4 мМ (NH4)6Mo7O24) и раствор пероксида водорода
(«Вектон», Россия) с концентрацией 336.5 мМ (а также растворы H2O2 в других миллимоляр-
ных концентрациях), используя коэффициент молярного поглощения пероксида водорода при
250 нм, равный 26.4 М-1 см-1 (Razygraev, 2020).
Объем смеси, готовой для регистрации оптической плотности (после внесения всех реак-
тивов, включая молибдат аммония), составлял 1.22 мл, что значительно меньше, чем в методе
Королюка и др. (1988). На спектрофотометре Lambda 25 (PerkinElmer) при использовании данного
объема рекомендуется проводить измерения в «полумикрокювете» (semi-micro cell) (рабочий
объем больше или равен 1 мл, длина оптического пути равна 1 см), в которой использование
уменьшенного объема возможно за счет вогнутых боковых стенок с расстоянием между ними
321
4.5 мм. На спектрофотометре DU-65 (Beckman Coulter) возможно использование обычной кюветы,
квадратной в поперечном сечении, в которой расстояние между боковыми стенками равно длине
оптического пути (1 см); минимальный рабочий объем при этом составляет 1.1 мл. Если обычная
кювета используется при работе на спектрофотометре Lambda 25 (PerkinElmer), то рекоменду-
ется пропорциональное увеличение объемов всех вносимых реактивов (например, в 2 раза).
Длина волны, используемая при регистрации поглощения комплекса пероксида водорода
с молибдатом, составляла в настоящей работе 410 нм и была взята из работы Королюка и др.,
(1988). При данной длине волны, также как при 405 нм (GÓth, 1991), не наблюдается максимум
поглощения; величина поглощения комплекса увеличивается при уменьшении длины волны.
Максимум поглощения комплекса пероксида водорода и молибдата наблюдается при более
низких значениях длины волны, ниже 400 нм (GÓth, 1991; Hadwan, Abed, 2016), и его не ис-
пользовали в настоящей работе. Соотношение между конечными концентрациями молибдата
аммония и пероксида водорода, используемое в настоящей работе, близко к таковому в работе
Королюка и др. (1988).
При запуске ферментативной реакции и вплоть до добавления молибдата аммония
(до терминации реакции) инкубацию проводили при 25°С. К 790 мкл 0.01 М MOPS-буфера
(рН 7.40-7.42) добавляли 10 мкл биоматериала (либо фосфатного буфера, на котором готовили
гомогенат - для оценки реакции в отсутствие каталазы), преинкубировали смесь 6-8 мин при
25°С. Затем вносили 20 мкл 336.5 мМ раствора пероксида водорода и через 240 с (ровно 4 мин)
вносили 400 мкл раствора молибдата аммония. Через 10 мин пробы фотометрировали при
410 нм. За одну серию проводили реакцию в 8 пробах, внося каждый реагент в каждую сле-
дующую пробу через полминуты с тщательным перемешиванием в течение нескольких секунд.
(Если оборудование рассчитано на измерения в бóльшем общем объеме, чем 1.22 мл, то требуется
модификация методики путем пропорционального увеличения объемов вносимых реактивов
с сохранением соотношения между реактивами, например, 1580 мкл MOPS-буфера, 20 мкл
биоматериала, 40 мкл раствора пероксида водорода и 800 мкл раствора молибдата аммония.)
В предварительных опытах использовали также иные соотношения между объемами MOPS-
буфера и биоматериала или его растворителя (фосфатного буфера), а также различные концен-
трации пероксида водорода. При оценке линейности зависимости величины убыли поглощения
от длительности инкубации (постоянство скорости реакции) и от концентрации белка (про-
порциональность количеству вносимого биоматериала) использовали различную длительность
инкубации до внесения молибдата аммония и различные предварительные разведения биома-
териала фосфатным буфером.
Концентрацию белка в супернатанте гомогенатов (для последующего выражения удельной
ферментативной активности в виде скорости разложения H2O2 на 1 мг белка) определяли простым
турбидиметрическим методом (Vera, 1988; Чеснокова и др., 1997) в соответствии с описанием
в предыдущей статье автора (Razygraev, 2020); при этом биоматериал разбавляли в 12-30 раз
перед добавлением трихлоруксусной кислоты (для самок Cs. annulata и Cx. pipiens - разбавляли
только в 30 раз). Турбидиметрический метод был использован для единообразия с предыдущей
322
работой (Razygraev, 2020); чувствительность метода сопоставима с чувствительностью широко
используемых в биохимии методов Оливера Лоури и Мэриона Бредфорда (даже более высокая,
чем в данных методах) (Чеснокова и др., 1997), точность метода также высока при аккуратном
исполнении (Разыграев, 2007).
Результаты, полученные методом с использованием молибдата аммония и MOPS-буфера,
сравнивали с результатами, полученными при прямой регистрации убыли H2O2 при 253 нм
в фосфатном буфере. Второй метод аналогичен описанному ранее (Razygraev, 2020), за исключе-
нием используемой длины волны и начальной концентрации пероксида водорода в реакционной
смеси (30.94 мМ). Убыль концентрации H2O2 оценивали с применением коэффициента молярного
поглощения H2O2 при 253 нм, равного 22.3 М-1 см-1 (Разыграев и др., 2019).
Статистическая обработка
Коэффициенты регрессии и показатель линейности (R2) рассчитывали в программной среде
R (версия 3.6.2) (R Core Team, 2019) с использованием функции summary(lm(y~x)). Две выборки
комаров разных видов сравнивали критерием Манна-Уитни-Уилкоксона, повторные измерения,
выполненные на одной и той же выборке, сравнивали парным критерием Уилкоксона, а корре-
ляцию между результатами, полученными двумя методами определения каталазной активности,
оценивали с помощью коэффициента корреляции Пирсона. Точные p-значения высчитывали
в среде R.
РЕЗУЛЬТАТЫ
Стабильность рН реакционной среды
При добавлении 0.05 М К-Na-фосфатного буфера c pH 7.9 к 0.01 М MOPS-буферу
с рН 7.4 (7.420) в объемном соотношении 1:79 (что соответствует добавлению 10 мкл к
790 мкл) сдвиг рН был незначителен и составил 0.033-0.040 единицы (до 7.453-7.460).
При увеличении объема фосфатного буфера в общем объеме реакционной смеси
(35 мкл фосфатного буфера и 765 мкл MOPS-буфера) сдвиг рН был более существен-
ным и составил 0.12 единицы (с 7.43 до 7.55).
Связь между поглощением при 410 нм
и концентрацией пероксида водорода
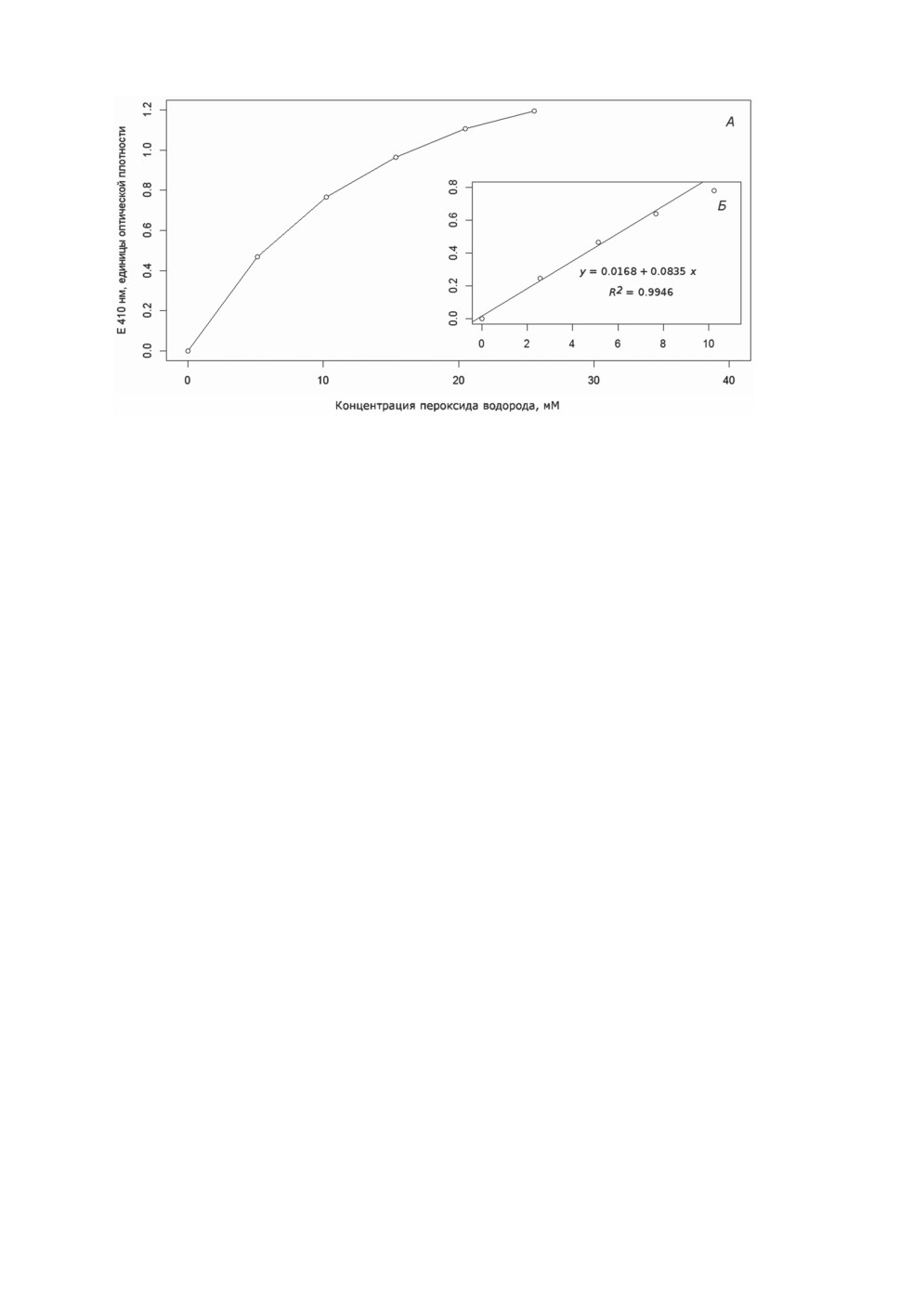
При проверке пропорциональности поглощения при 410 нм концентрации пероксида
водорода в используемой среде установлено, что значения поглощения порядка 0.800
и выше не пропорциональны концентрации H2O2 (рис. 1А). Установлено, что при
меньших значениях поглощения (между 0.600 и 0.700) и, соответственно, меньших
концентрациях пероксида водорода в реакционной смеси (порядка 8 мМ) зависимость
близка к линейной — R2 составляет 0.9946 (рис. 1Б). Для конкретной используемой
величины поглощения комплекса молибдата с пероксидом водорода, равной 0.684 (т. е.
находящейся в указанном диапазоне), рассчитано, что концентрация пероксида водо-
рода в реакционной смеси до добавления молибдата аммония составляет 8.207 мМ.
323
Рисунок 1. Зависимость поглощения продукта взаимодействия молибдата с пероксидом
водорода от концентрации последнего. В диапазоне высоких концентраций пероксида
водорода в реакционной смеси зависимость нелинейна (А); зависимость, близкая
к линейной, наблюдается в диапазоне низких концентраций пероксида водорода (Б).
Примечание. Состав смеси: 755 мкл 0.01 М MOPS-буфера (рН 7.40-7.42), 45 мкл 0.05 М
K-Na-фосфатного буфера (рН 7.9), 20 мкл раствора H2O2 разной концентрации и 400 мкл
раствора молибдата аммония. Измерения против пробы, в которой раствор H2O2 заменен
дистиллированной водой (20 мкл).
Figure 1. Values of absorbance at 410 nm obtained from various concentrations of hydrogen
peroxide in a reaction mixture. The nonlinear link is observed at high concentrations of hydrogen
peroxide (A). At low concentrations of hydrogen peroxide (B), the link is almost linear.
Note. The composition of a mixture was as follows: 0.755 ml of 0.01 M MOPS buffer
(pH 7.40-7.42), 0.045 ml of 0.05 M K-Na-phosphate buffer (рН 7.9), 0.02 ml of hydrogen
peroxide solution in various concentrations, and 0.4 ml of ammonium molybdate solution.
Пропорциональность расхода H2O2
содержанию биоматериала и длительности инкубации
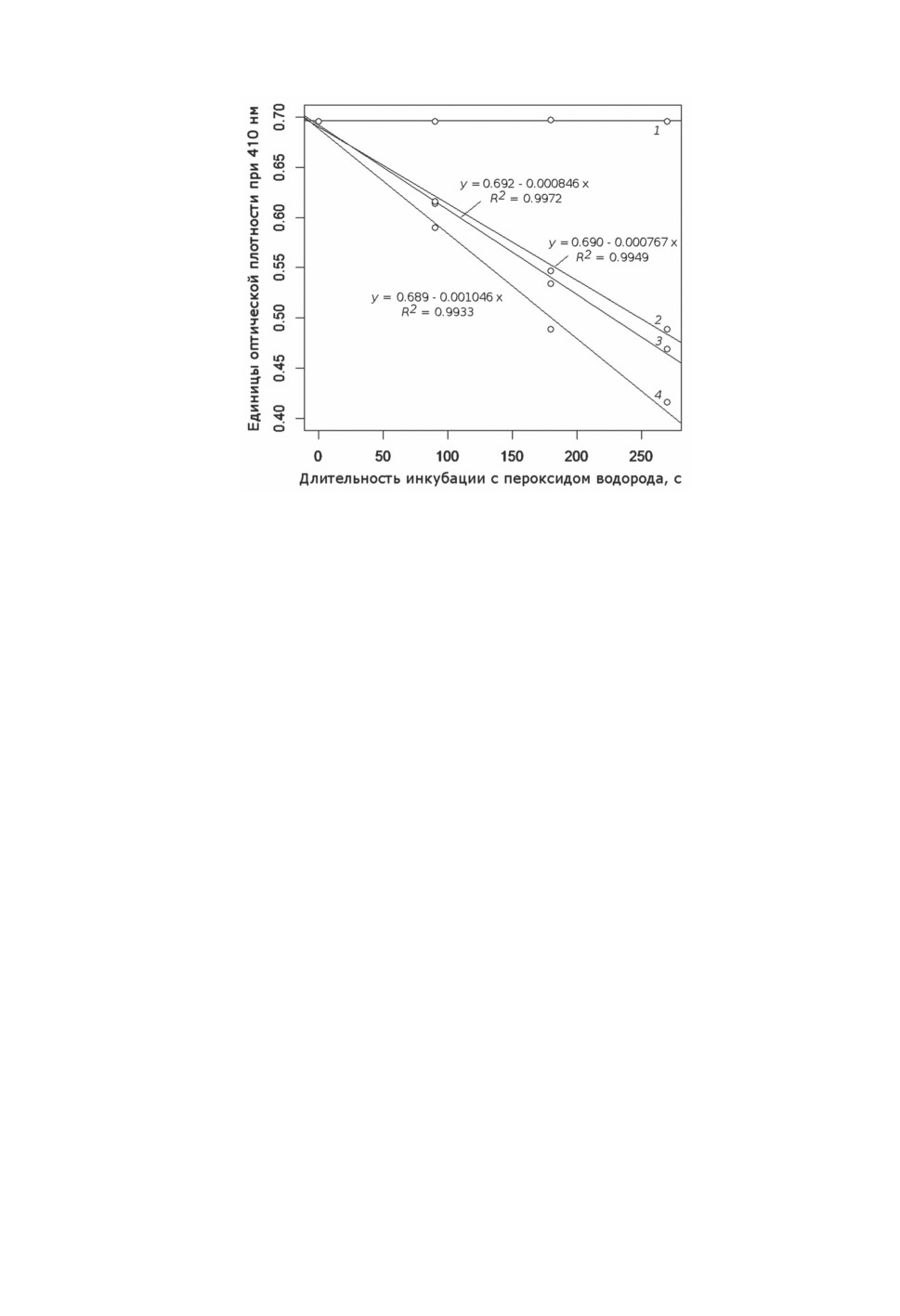
При невысоких величинах каталазной активности (при убыли величины поглоще-
ния на 0.00077-0.001 единицы при 410 нм за 1 с) сохраняется линейная связь между
длительностью инкубации и регистрируемой убылью поглощения при 410 нм вплоть
до значения длительности инкубации, равного 4.5 мин (270 с) (рис. 2).
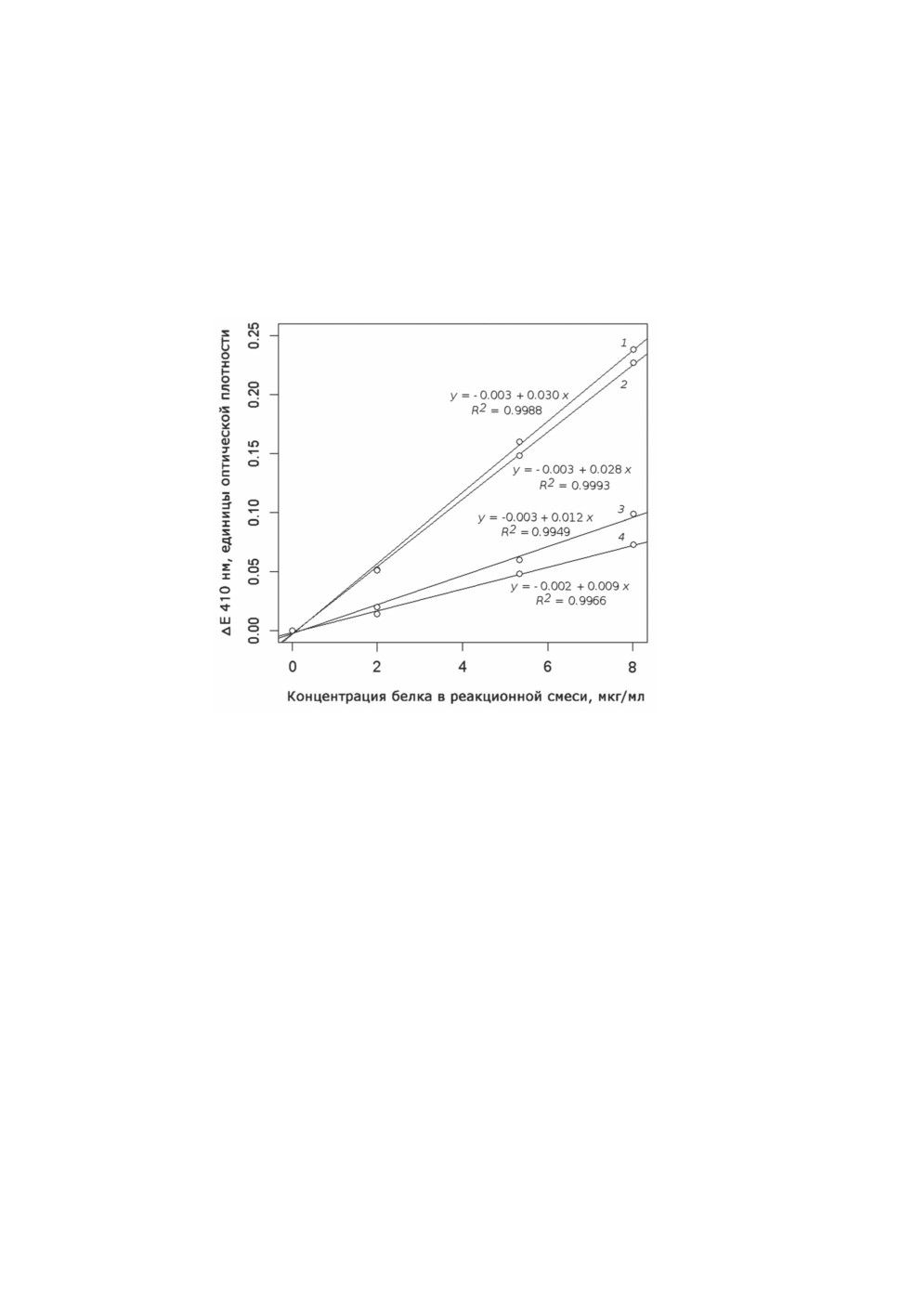
При концентрациях белка вплоть до 8 мкг на 1 мл реакционной смеси (т. е. после
внесения супернатанта гомогената и раствора пероксида водорода в реакционную
смесь) сохраняется линейный характер зависимости скорости убыли оптической плот-
ности при 410 нм от содержания биоматериала в реакционной смеси (при величинах
активности до 0.001 единицы оптической плотности за 1 с и длительности инкубации,
равной 4 мин) (рис. 3). Максимальная проверенная концентрация белка в супернатанте
гомогената, вносимого в реакционную смесь, таким образом, составляет около 650 мкг/
мл (8 мкг/мл × 82, т. е. с умножением на разведение 10 мкл вносимого супернатанта
реакционной смесью до 820 мкл).
324
Рисунок 2. Линейность зависимости поглощения при 410 нм после добавления молибдата
аммония в реакционную смесь от времени инкубации до добавления молибдата аммония.
Три представленные линии регрессии получены для гомогенатов трех разных самок Culiseta
annulata. Концентрации белка в реакционных смесях: 1 - 0 мкг/мл (внесение 10 мкл
фосфатного буфера вместо 10 мкл супернатанта гомогената), 2 - 6.44 мкг/мл (528 мкг/мл -
в супернатанте гомогената), 3 - 7.52 мкг/мл (617 мкг/мл - в супернатанте гомогената),
4 - 7.41 мкг/мл (608 мкг/мл - в супернатанте гомогената).
Figure 2. The linearity of the catalase-dependent decrease of H2O2 estimated by absorbance at
410 nm after adding ammonium molybdate. Three regression lines are obtained for three individual
females of Culiseta annulata. Concentrations of protein in reaction mixtures: 1 - 0 mg of protein
per ml (0.01 ml of phosphate buffer were added instead of 0.01 ml of homogenate supernatant),
2 - 0.00644 mg of protein per ml (0.528 mg per ml in a homogenate supernatant), 3 - 0.00752 mg
per ml (0.617 mg per ml in a homogenate supernatant), 4 - 0.00741 mg per ml (0.608 mg per ml
in a homogenate supernatant).
Точность, воспроизводимость результатов
Коэффициент вариации для трех измерений активности опытного образца, выпол-
ненных в одну серию (within-run precision), составил 0.348% для значений оптической
плотности и 0.67% для значений убыли оптической плотности (при этом коэффициент
вариации для пробы без фермента равен 0%). Средняя величина убыли при этом со-
ставляла 0.227 единицы оптической плотности за 4 мин. Коэффициент вариации для
трех измерений активности другого образца, выполненных в разных сериях (between-
run precision), в том числе в разные дни и с повторным циклом замораживания и
размораживания при -80°С (для двух из трех измерений), составил 1.29% (указано
для разности значений оптической плотности между пробой без фермента и опытной
пробой в одной серии). Средняя убыль при этом составляла 0.249 единицы оптической
плотности за 4 мин.
325
Устойчивость к циклам замораживания-размораживания
Повторное замораживание-размораживание гомогенатов незначительно влияет
на активность фермента (с тенденцией к повышению; p = 0.058 в тесте Уилкоксона
с поправкой на непрерывность, n=5). В большинстве случаев значения активности
практически идентичны: медиана усиления убыли оптической плотности за 4 мин
для проб после повторного замораживания-размораживания составила всего 1.0 %,
размах min-max составил 0.3-5.7 % при n=5.
Рисунок 3. Линейность зависимости величины расхода пероксида водорода, оцененной
по снижению поглощения при 410 нм в реакции с молибдатом аммония (ΔE 410 нм),
от концентрации белка в реакционной смеси.
Длительность инкубации с пероксидом водорода (т. е. до внесения раствора молибдата
аммония) составляла ровно 4 мин (240 с).
Условные обозначения: 1 и 2 - самки Culiseta annulata, 3 и 4 - самки Culex pipiens.
Figure 3. Proportionality of absorbance decrease at 410 nm (ΔE 410 nm) to protein
concentration in reaction mixture.
The duration of incubation was 4 min (240 s).
Designations: 1, 2 - females of Culiseta annulata: 3, 4 - females of Culex pipiens.
Влияние различий в рабочей концентрации субстрата
на активность фермента
При повышении начальной (рабочей) концентрации пероксида водорода в 1.217 ра-
за (с 8.097 до 9.854 мМ) и при соответствующем нелинейном увеличении начальной
оптической плотности в 1.16 раза скорость работы фермента увеличивается: убыль
оптической плотности при 410 нм усиливается в 1.029-1.085 раза (т. е. на 2.9-8.5 %)
(n=3).
326
Влияние оптической плотности образца
и раствора молибдата аммония на результат
Сам по себе супернатант гомогената формирует в смеси MOPS-буфера и молибдата
аммония небольшой уровень оптической плотности при 410 нм. При концентрациях
белка в реакционной смеси порядка 6-8 мкг/мл этот уровень составляет 0.012-0.017
единицы оптической плотности (в водном растворе без MOPS-буфера и молибдата
аммония он дает чуть более высокие значения, р = 0.03125, парный критерий Уилкок-
сона, n = 6). Приращение оптической плотности при 410 нм за счет реакции молиб-
дата аммония с материалом гомогената (т. е. не связанное с мутностью самой пробы)
в настоящем исследовании отмечено не было.
При измерении против дистиллированной воды холостой пробы, в которой го-
могенат заменен на фосфатный буфер, а пероксид водорода - на дистиллированную
воду, оптическая плотность смеси при 410 нм после внесения молибдата аммония
составляет 0.0190 ± 0.0029 (M ± SD, n=5).
Стабильность оптической плотности
комплекса пероксида водорода с молибдатом
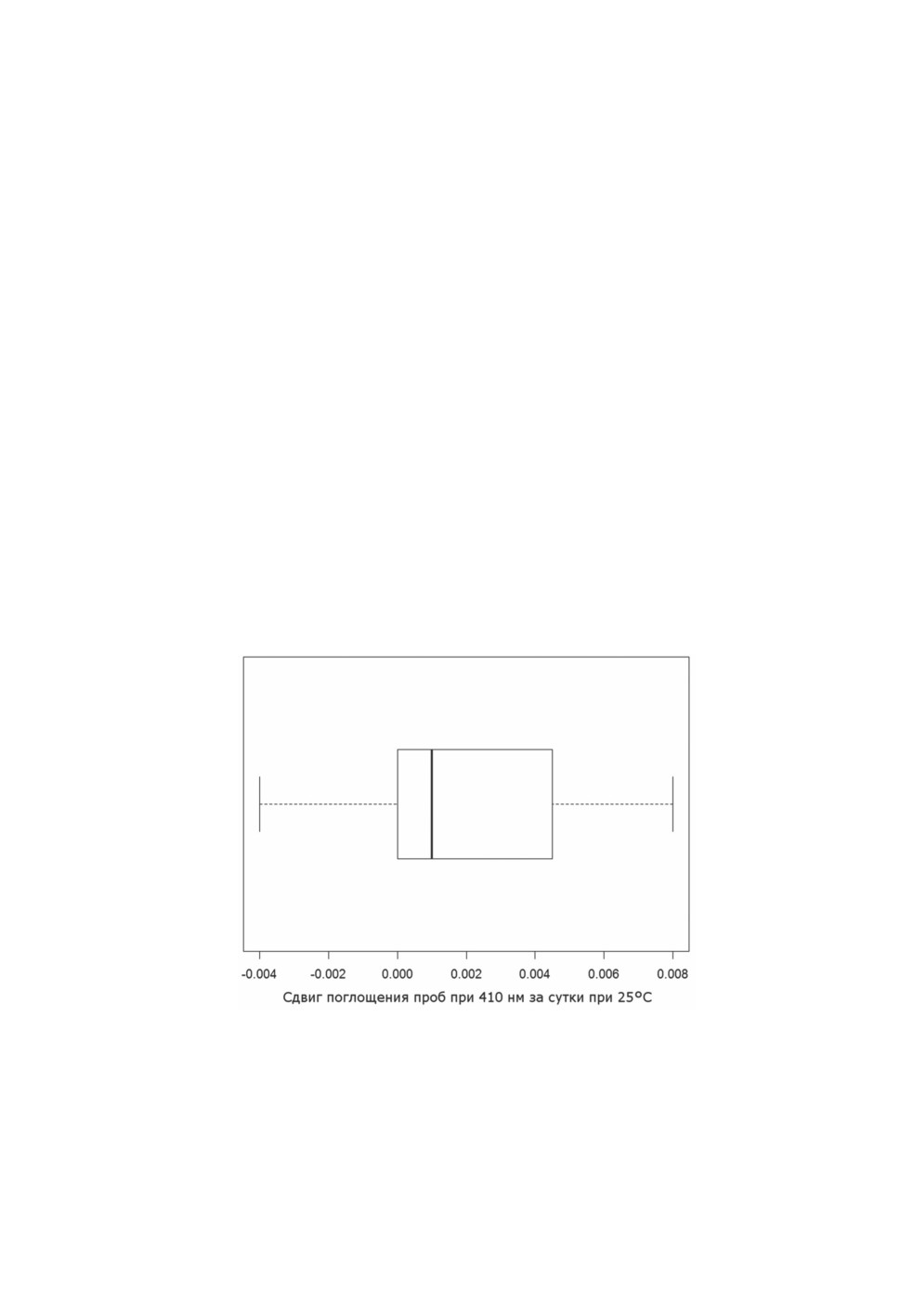
Выявлен несущественный, но статистически значимый сдвиг поглощения проб
при 410 нм за сутки при 25°С (рис. 4). Медиана составила 0.001 единицы оптической
плотности, размах min-max - -0.004-0.008 единицы (р = 0.046, парный критерий Уил-
коксона с поправкой на непрерывность, n=19).
Рисунок 4. Сдвиг поглощения проб при 410 нм за сутки при 25°С. Медиана (обозначена
жирной линией) составляет 0.001 единицы оптической плотности, размах min-max («усы») -
-0.004-0.008 единицы (р = 0.046, парный критерий Уилкоксона с поправкой
на непрерывность), n=19.
Figure 4. A shift of the absorbance at 410 nm during 1 day at 25 °С. Median value (designated
by a bold line) was 0.001, min-max range (“whiskers”) was -0.004-0.008 absorbance units
(р = 0.046, Wilcoxon signed rank test with continuity correction), n=19.
327
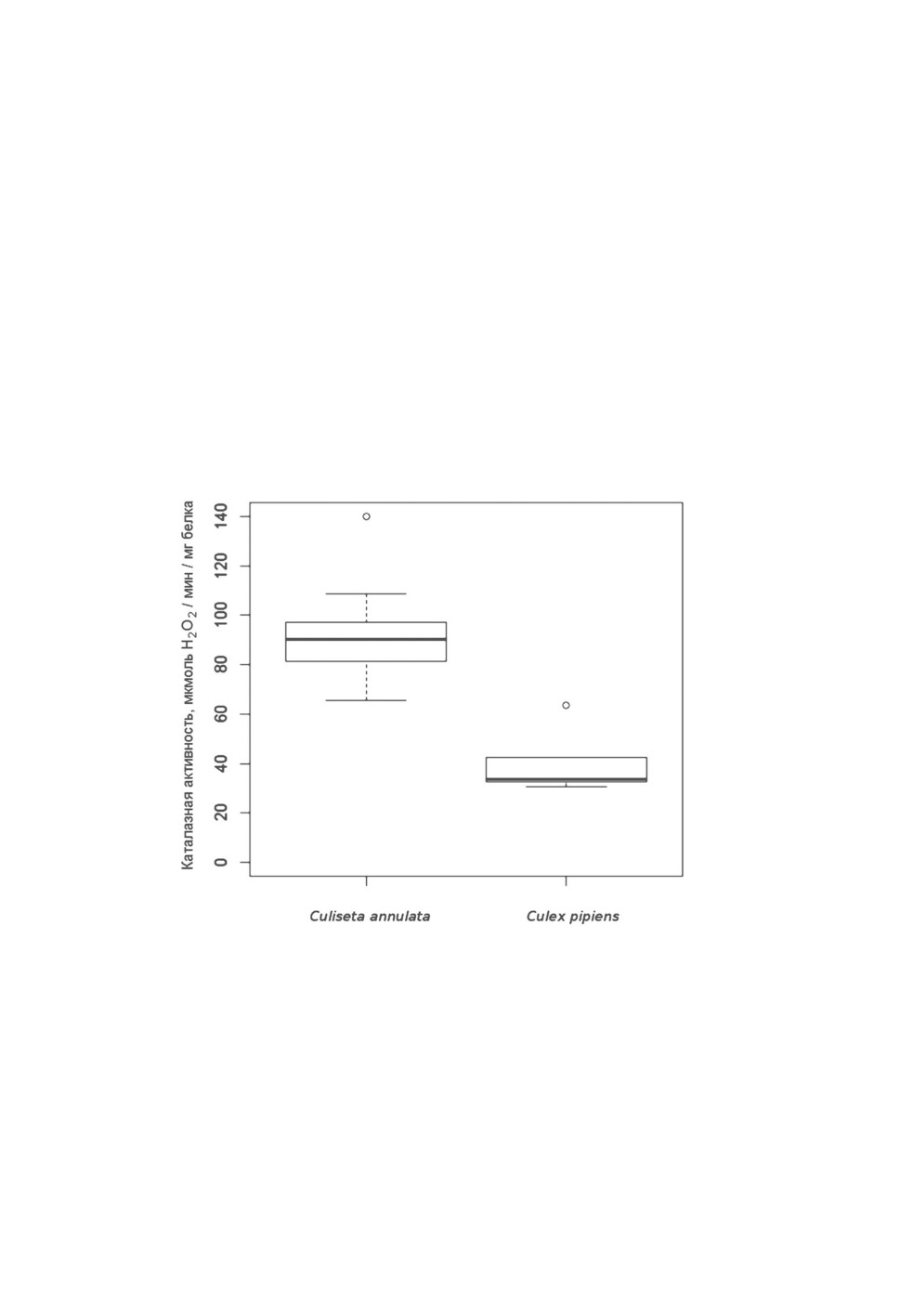
Сравнение каталазной активности у разных видов комаров сем. Culicidae;
сравнение результатов, полученных разными методами
Уже на этапе исследования зависимости скорости реакции от содержания белка
в реакционной смеси было замечено, что при одних и тех же концентрациях бел-
ка скорость реакции выше для Cs. annulata, чем для Cx. pipiens (рис. 3). Выборка
из самок Cx. pipiens была увеличена до n = 5, проведено статистическое сравнение
с 24 самками Cs. annulata. Из рис. 5 видно, что выборки самок Cs. annulata и Cx. pipiens,
собранных в марте 2020 г. в Саблинских пещерах, не перекрываются, и более высокие
величины каталазной активности характерны для Cs. annulata (р = 0.0000168, тест
Уилкоксона-Манна-Уитни).
Рисунок 5. Сравнение величин удельной активности каталазы у взрослых самок Culiseta
annulata (n=24) и Culex pipiens (n=5).
Жирной линией представлены медиана, верхняя и нижняя границы бокса -
3-й и 1-й квартили соответственно, «усы» - размах min-max, кружки - выбросы.
В статистическом сравнении р = 0.0000168 (критерий Уилкоксона-Манна-Уитни).
Figure 5. A comparison of specific catalase activity values in Culiseta annulata (n=24)
and Culex pipiens (n=5).
On the boxplot the median is designated by a bold line, the upper and the lower borders
on the box are 3rd and 1st quartiles, respectively, the “whiskers” are min-max range, the open
circles are outliers.
In statistical comparison p-value was 0.0000168 (Wilcoxon-Mann-Whitney test).
328
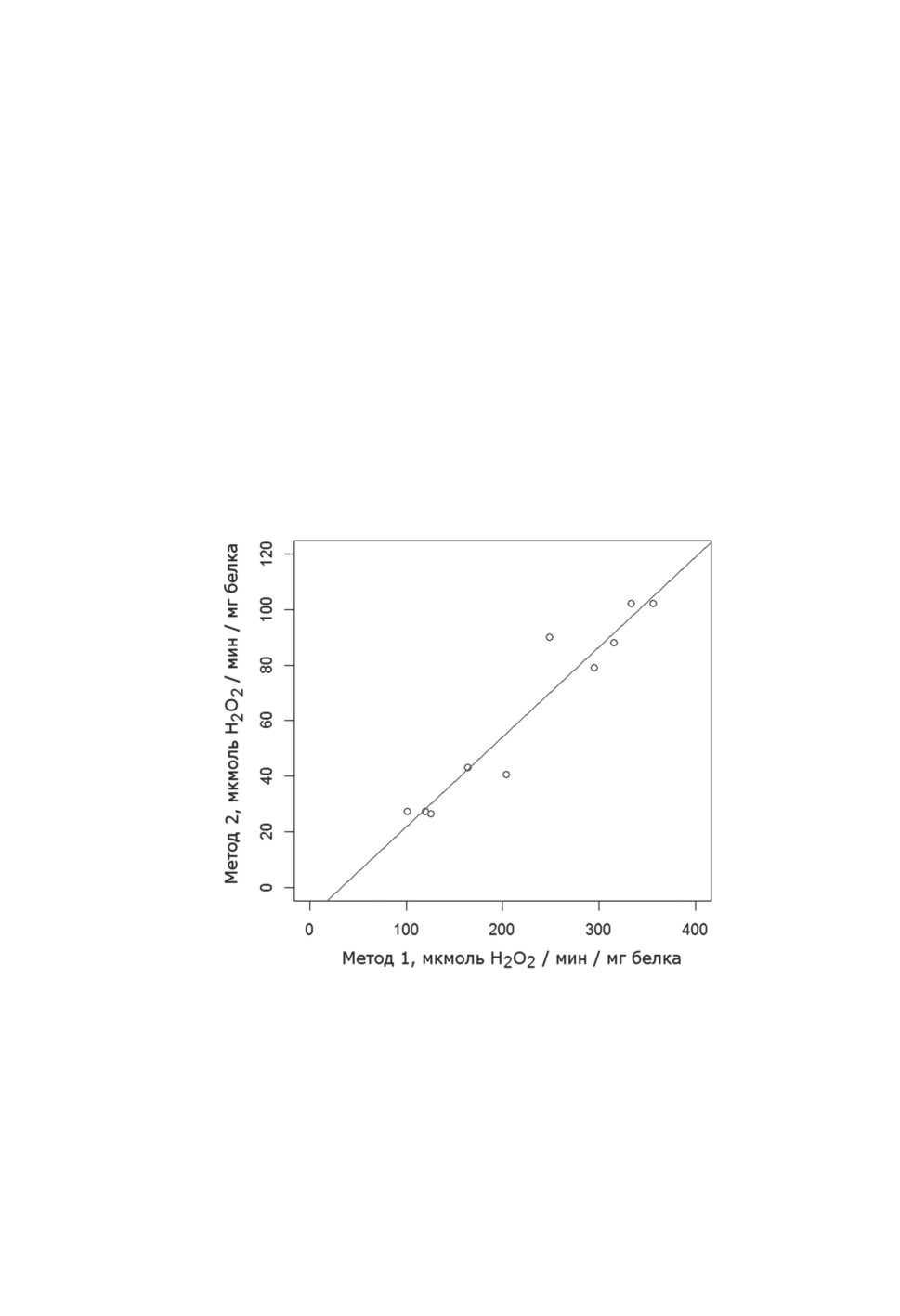
При сравнении результатов, полученных двумя методами определения каталаз-
ной активности - по снижению оптической плотности при 253 нм (прямая регистра-
ция убыли Н2О2) и по величине убыли поглощения при 410 нм (после реакции Н2О2
с молибдатом аммония) - выявлена достаточно тесная связь определяемых величин
удельной активности: коэффициент корреляции Пирсона составил 0.96 при n=10 (р =
0.000011) (рис. 6). При этом среди самых низких значений (в мкмоль Н2О2 / мин / мг
белка; метод прямого измерения при 253 нм / метод измерения при 410 нм после реак-
ции с молибдатом аммония) - величины каталазной активности у самцов Ochlerotatus
communis (163.82 / 43.29; 101.53 / 27.51) и Anopheles maculipennis s. l. (125.5 / 26.51;
119.75 / 27.38), среди высоких значений - величины каталазной активности у самцов
Coquillettidia richiardii (295.12 / 78.92; 248.56 / 90.17). Сравнение величин каталазной
активности у самцов разных таксонов внутри сем. Culicidae представляет собой от-
дельное исследование, проводимое автором, с дальнейшим увеличением выборок для
межвидовых статистических сравнений.
Рисунок 6. Результаты, полученные двумя методами определения каталазной активности
у кровососущих комаров: по снижению оптической плотности при 253 нм
(прямая регистрация убыли Н2О2) (метод 1) и по величине убыли поглощения
при 410 нм (после реакции Н2О2 с молибдатом аммония) (метод 2).
Примечание: коэффициент корреляции Пирсона равен 0.96 (р = 0.000011).
Figure 6. A positive correlation between results obtained by measurement of disappearing
of hydrogen peroxide at 253 nm (method 1) and by measurement at 410 nm after ammonium
molybdate reaction (method 2).
Note: Pearson's correlation coefficient was equal to 0.96 (p = 0.000011).
329
ОБСУЖДЕНИЕ
Стабильность рН реакционной среды
При добавлении 10 мкл буферного раствора с более высоким значением рН (7.9)
к 790 мкл 0.01 М MOPS-буфера (рН 7.4) буферную емкость реакционной среды
с используемой концентрацией MOPS можно считать приемлемой, т. к. сдвиг рН не-
существен. Значение рН реакционной смеси, исходя из результатов, в случае внесения
10 мкл следует уточнить как 7.45 (среднее между 7.4 и 7.5). Внесение исследуемого
раствора в 3.5 раза большего объема приводит к более существенному сдвигу рН.
Связь между поглощением при 410 нм
и концентрацией пероксида водорода
Принципиально важными для правильного расчета концентрации определяемого
вещества являются сведения о характере связи между его концентрацией и регистрируе-
мым поглощением. Весьма желательна работа в линейном участке кривой зависимости
поглощения от концентрации исследуемого субстрата или продукта ферментативной
реакции, что делает достаточно простыми последующие расчеты ферментативной
активности. Следовательно, исходя из результатов по зависимости поглощения при
410 нм от концентрации H2O2, приемлемой начальной концентрацией H2O2 следует
считать концентрацию около 8 мМ (в полностью сформированной реакционной смеси
до добавления молибдата аммония), поскольку именно до этого значения зависимость
поглощения при 410 нм от концентрации пероксида водорода может быть признана
линейной.
Пропорциональность величины расхода H2O2
содержанию биоматериала и длительности инкубации
Пропорциональность измеряемой убыли оптической плотности при 410 нм дли-
тельности инкубации (рис. 2) означает постоянство скорости реакции в течение ис-
пользуемого времени инкубации. Поскольку при высоких величинах активности (на-
пример, при скорости убыли, равной 0.00142 единицы поглощения за 1 с) скорость
реакции может оказаться сниженной к моменту окончания 4-минутной инкубации,
в этих случаях лучше предварительно разбавить образец или использовать более ко-
роткое время инкубации.
Пропорциональность измеряемой убыли оптической плотности при 410 нм содер-
жанию белка в реакционной смеси (рис. 3) означает возможность сравнения удельных
активностей, вычисленных для гомогенатов с различающейся концентрацией ткани
(в пределах проверенных концентраций белка).
Расчет ферментативной активности исходя из результатов
При величине поглощения комплекса молибдата с пероксидом водорода в вышео-
писанных условиях, равной 0.684, концентрация пероксида водорода в реакционной
330
смеси до добавления молибдата аммония составляет 8.207 мМ. Это и есть рабочая
концентрация пероксида водорода в реакционной смеси. Следовательно, в начале
реакции разложения пероксида водорода убыль на 0.001 единицы оптической плот-
ности при 410 нм соответствует убыли концентрации пероксида водорода на 12 мкМ
(8207 мкМ × 0.001 : 0.684). При этом убыли концентрации пероксида водорода в ре-
акционной смеси на 1 мМ в начале реакции соответствует снижение поглощения при
410 нм на 0.0833 единицы оптической плотности (0.684 × 1 мМ : 8.207 мМ). Именно
эти соотношения должны использоваться при оценке начальной скорости распада пе-
роксида водорода под действием каталазы в реакционной смеси. Например, снижение
поглощения при 410 нм на 0.240 единицы оптической плотности (с 0.684 до 0.444)
за 4 мин будет соответствовать начальной скорости реакции, равной 720 мкМ H2O2
в минуту (12 × 240 : 4), или 720 нмоль H2O2 в минуту на 1 мл реакционной смеси.
С использованием вышеприведенных коэффициентов этот же результат можно по-
лучить следующим образом: (0.240 : 0.0833) мМ : 4 мин (с дальнейшим умножением
на 1000 для перевода в мкМ).
Расчет удельной активности фермента выполняется делением начальной скорости
реакции на концентрацию белка в реакционной смеси. Для вышеприведенного при-
мера при концентрации белка в реакционной смеси, равной 8 мкг / мл, это означает
(720 нмоль H2O2 / мин / 1 мл) : (8 мкг белка / мл) = 90 нмоль H2O2 / мин / 1 мкг белка,
или 90 мкмоль H2O2 / мин / 1 мг белка.
Точность, воспроизводимость результатов,
устойчивость к циклам замораживания-размораживания
Исходя из того, что коэффициенты вариации для определений, выполненных в одну
серию и в разных сериях, имеют низкие значения, можно заключить, что метод доста-
точно точен и характеризуется хорошей воспроизводимостью. Незначительное по ве-
личине изменение величины ферментативной активности после цикла замораживания-
размораживания в целом свидетельствует в пользу высокой стабильности фермента
у кровососущих комаров.
Влияние различий в рабочей концентрации субстрата
на активность фермента
Усиление убыли оптической плотности при 410 нм вследствие работы фермента при
увеличении начальной концентрации пероксида водорода свидетельствует о том, что
в реакционной смеси каталаза кровососущих комаров не насыщена субстратом. Это
означает, что для сравнительных исследований разных образцов при использовании
метода должно соблюдаться условие равенства начальных (рабочих) концентраций
пероксида водорода в реакционных смесях. Невозможность насыщения фермента
субстратом является обычным и едва ли устранимым свойством методик определения
активности каталазы (Aebi, 1974, 1984).
331
Влияние оптической плотности образца
и раствора молибдата аммония на результат
Сам по себе супернатант гомогената формирует в смеси MOPS-буфера и молибдата
аммония небольшой уровень оптической плотности, очевидно, вследствие рассеяния
света взвешенными частицами. Данная величина незначительно влияет на результат
изменения оптической плотности за 4 мин при высоких значениях ферментативной
активности, но может заметно занизить результат при низких значениях активности
(вследствие завышения величины оптической плотности опытной пробы). Учесть это
можно проверкой оптической плотности смеси, в которую внесен супернатант гомогена-
та (10 мкл), но раствор пероксида водорода замещен дистиллированной водой (20 мкл).
Затем это значение вычитается из полученной оптической плотности опытной пробы.
Оптическую плотность самого гомогената можно учесть и другим способом -
пропуская время инкубации с пероксидом водорода (Tománková et al., 2006). Однако
в этом случае для точного измерения начальной оптической плотности необходимо
одновременно вносить в смесь растворы двух реактивов, т. е. пероксида водорода
и молибдата аммония, что требует определенных навыков. Пример того, как одно-
временно вносить два реактива в реакционную смесь, см. в работе Razygraev et al.
(2018, fig. 1, p. 590).
При измерении против дистиллированной воды в некоторых случаях имеет смысл
учитывать величину оптической плотности холостой пробы, в которой гомогенат заме-
нен на фосфатный буфер, а пероксид водорода - на дистиллированную воду. Например,
это имеет значение при оценке концентрации пероксида водорода в реакционной среде
по поглощению при 410 нм. Это не будет иметь значение при определении разницы
между контрольной и опытной пробами, не содержащей и содержащей гомогенат со-
ответственно (или, по альтернативной схеме, содержащими гомогенат, но имеющими
разную длительность инкубации с пероксидом, т. е. 0 и 240 с, соответственно). То есть
для оценки этой разницы измерять обе пробы можно как против дистиллированной
воды, так и против реакционной смеси с фосфатным буфером вместо гомогената и
с дистиллированной водой вместо пероксида водорода (результат после вычитания
будет один и тот же).
Стабильность оптической плотности
комплекса пероксида водорода с молибдатом
Сходство значений оптической плотности проб, фотометрируемых через 10 мин
и через сутки (после выдерживания тех же проб при 25°С), а в ряде случаев их пол-
ная или почти полная идентичность указывают на высокую стабильность комплекса
пероксида водорода с молибдатом, отмеченную ранее другими авторами (Королюк
и др., 1988). Высокая стабильность продукта реакции Н2О2 с молибдатом аммония
в принципе позволяет провести накопление окрашенных проб и фотометрирование
их в одну серию через больший временнóй диапазон, чем 10 мин. Тем не менее пере-
332
носить измерение на следующий день не рекомендуется ввиду небольшого, но всё
же статистически значимого сдвига оптической плотности при 410 нм за сутки при
комнатной температуре.
Сравнение каталазной активности у разных видов комаров сем. Culicidae;
сравнение результатов, полученных разными методами
Полученные в настоящем исследовании неперекрывающиеся результаты для самок
Cs. annulata и Cx. pipiens, собранных в марте 2020 г., с более высокими величинами
активности у Cs. annulata (рис. 5), полностью аналогичны результатам за март 2018 г.
из предыдущей работы автора (Razygraev, 2020), в которой каталазную активность
измеряли прямой регистрацией убыли Н2О2 при 250 нм с использованием более вы-
сокой рабочей концентрации субстрата. В результатах, приведенных в данной работе,
медианные значения активности для Cs. annulata и Cx. pipiens, как и в предыдущей
работе (Razygraev, 2020), различаются более чем в 2 раза. При использовании метода
из настоящей работы их значения (в мкмоль Н2О2 / мин / мг белка) равны 90.30 для
Cs. annulata и 33.69 для Cx. pipiens, тогда как в предыдущей работе (Razygraev, 2020)
медианы равны 301.30 и 111.66 соответственно.
При сравнении результатов, полученных двумя методами определения каталазной
активности (прямая регистрация убыли Н2О2 при 253 нм и оценка убыли Н2О2 по
поглощению при 410 нм после реакции с молибдатом аммония), высчитан высокий
коэффициент корреляции. Таким образом, оба метода дают пропорциональные друг
другу результаты. Как и следовало ожидать, результаты не идентичны, величины актив-
ности в среднем различаются в 3.84 раза (размах min-max составил 2.76-5.00 раз). При
этом рабочая концентрация пероксида водорода в двух методах различается примерно
во столько же раз, во сколько в среднем различается величина активности, а именно
в 3.77 раз (30.94 мМ / 8.207 мМ). Различаются также рН и состав буферных растворов.
Таким образом, с помощью представленной модификации метода определения
каталазной активности с использованием молибдата аммония и длины волны 410 нм
выявляются те же закономерности и соотношения в выборках кровососущих комаров,
что и при использовании методов, основанных на прямой регистрации убыли пероксида
водорода в ультрафиолетовом диапазоне длин волн.
В условиях ненасыщенности фермента субстратом для каждой выбранной рабо-
чей концентрации субстрата (в данном случае Н2О2) будут характерны свои значения
удельной активности. При этом на величину удельной активности могут влиять рН
среды и температура инкубации, не исключено также влияние состава буферной среды.
Настоящий метод дает более низкие значения удельной каталазной активности, чем
методы прямой регистрации убыли Н2О2 в ультрафиолетовом диапазоне. Причину этого
мы видим главным образом в использовании более низкой рабочей концентрации Н2О2,
пригодной для одноэтапного окрашивания проб добавлением молибдата аммония.
333
ЗАКЛЮЧЕНИЕ
Приемлемые буферные свойства среды на основе MOPS в низкой молярной кон-
центрации, значение рН, которое сходно с физиологическими значениями данного
параметра, отсутствие взаимодействий между MOPS и молибдатом аммония, регистри-
руемых спектрофотометрическими методами, и, как следствие, отсутствие нежелатель-
ных интерференций при фотометрическом определении концентрации H2O2 делают
данный метод пригодным для анализа каталазной активности. Каталазная активность
у кровососущих комаров при приемлемых разведениях гомогенатов проявляет близкий
к линейному характер зависимостей от длительности инкубации и от содержания бел-
ка, что позволяет применять простые расчеты удельной ферментативной активности.
Метод удобен для серийного и при этом достаточно точного определения каталазной
активности в нескольких образцах, хотя не позволяет вести непрерывную регистра-
цию хода реакции. Высокая стабильность растворов каталазы кровососущих комаров
предполагает, что они могут быть использованы в качестве стандартных образцов
при серийном определении активности каталазы в биомедицинских исследованиях.
БЛАГОДАРНОСТИ
Автор выражает признательность к.м.н. А.-П.С. Шурыгиной (НИИ гриппа, Санкт-
Петербург) за помощь при определении коэффициентов молярного поглощения пе-
роксида водорода в ультрафиолетовом диапазоне, а также коллегам (НИИ акушерства,
гинекологии и репродуктологии, Санкт-Петербург) за сотрудничество при решении
неспецифических задач в связи с параллельной апробацией метода на тканях лабора-
торных млекопитающих.
Работа частично поддержана Государственной темой «Разработка современных
основ систематики и филогенетики паразитических и кровососущих членистоногих»
(Гос. Регистрационный номер: АААА-А19-119020790133-6); сохраненные диагности-
чески значимые отделы комаров помещены в виде спиртового материала в коллекцию
Зоологического института РАН (ЗИН РАН, Санкт Петербург) (УФК ЗИН рег. № 2-2.20).
СПИСОК ЛИТЕРАТУРЫ
Гуцевич А.В., Мончадский А.С., Штакельберг А.А. 1970. Комары. Семейство Culicidae. Фауна СССР. На-
секомые двукрылые. Л., Наука. т. 3, вып. 4, 384 c. [Gutsevich, A.V., Monchadsky, A.S., and Stackelberg,
A.A. 1970. Fauna SSSR. Nasekomye dvukrylye. vol. 3, issue 4: Komary sem. Culicidae. Leningrad, Nauka,
384 pp. (in Russian)].
Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. 1988. Метод определения активности каталазы.
Лабораторное дело 1: 16-19. [Korolyuk M.A., Ivanova L.I., Maiorova I.G., Tokarev V.E. 1988. A method
for measuring catalase activity. Laboratornoe delo 1: 16-19. (in Russian)].
Разыграев А.В. 2007. Участие ферментов окислительного метаболизма моноаминов в гипоталамической регу-
ляции репродуктивной функции самок крыс. Автореф. дис. … канд. биол. наук. СПб., 25 с. [Razygraev
A.V. 2007. Involvement of monoamine-metabolizing enzymes in hypothalamic control of reproductive
function in female rats. Thesis for degree of candidate of sciences, Saint-Petersburg, 25 pp. (in Russian)].
Разыграев А.В., Петросян М.А., Базиян Е.В., Полянских Л.С. 2019. Исследование активности каталазы в
гетеротопиях в экспериментальной модели эндометриоза. Журнал акушерства и женских болезней
334
68 (6): 57-63. [Razygraev A.V., Petrosyan M.A., Baziyan E.V., Polyanskikh L.S. 2019. Activity of catalase
in surgically induced endometrial-like lesions in rats. Journal of obstetrics and women's diseases 68 (6):
Разыграев А.В., Шулешко Т.М. 2018. Использование фактора Байеса для определения видов Culex pipiens и
Culex torrentium (Diptera: Culicidae) по морфометрическим характеристикам крыла. Паразитология 52
(4): 304-314. [Razygraev A.V., Sulesco T.M. 2020. The use of the Bayes factor for identification of Culex
pipiens and C. torrentium (Diptera: Culicidae) based on morphometric wing characters. Entomological
Чеснокова Л.С., Войнова Н.Е., Комкова А.И., Лянгузов А.Ю. 1997. Методы количественного определения
белка. В кн.: Владимиров В.Г., Лызлова С.Н. (ред.). Ферменты и нуклеиновые кислоты. СПб., Из-
дательство С.-Петербургского ун-та, 5-25. [Chesnokova L.S., Voynova N.E., Komkova A.I., Lyanguzov
A.Y. 1997. Metody kolichestvennogo opredeleniia belka. In: Vladimirov V.G., Lyzlova S.N. (eds). Fermenty
i nukleinovye kisloty. St. Petersburg, St. Petersburg State Univ., 5-25 (in Russian)].
Aebi H. 1974. Catalase. In: Bergmeyer H.U., Gawehn K. (eds). Methods of enzymatic analysis. New York, Aca-
demic Press, vol. 2, 673-684.
6879(84)05016-3
Al-Rabadi G.J., Gilbert R.G., Gidley M.J. 2009. Effect of particle size on kinetics of starch digestion in milled
barley and sorghum grains by porcine alpha-amylase. Journal of Cereal Science 50 (2): 198-204. https://
doi.org/10.1016/j.jcs.2009.05.001
Becker N., Petric D., Zgomba M., Boase C., Madon M., Dahl C., Kaiser A. 2010. Mosquitoes and Their Сontrol.
Second Edition. Berlin, Heidelberg, Springer-Verlag, 608 pp.
Beers R.F., Sizer I.W. 1952. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by
catalase. Journal of Biological Chemistry 195 (1): 133-140.
Boveris A., Cadenas E., Stoppani A.O.M. 1976. Role of ubiquinone in the mitochondrial generation of hydrogen
Börstler J., Lühken R., Rudolf M., Steinke S., Melaun C., Becker S., Garms R., Krüger A. 2014. The use of mor-
phometric wing characters to discriminate female Culex pipiens and Culex torrentium. Journal of Vector
Felton G.W., Summers C.B. 1995. Antioxidant systems in insects. Archives of Insect Biochemistry and Physiology
GÓth L. 1991. A simple method for determination of serum catalase activity and revision of reference range. Clinica
Hadwan M.H., Abed H.N. 2016. Data supporting the spectrophotometric method for the estimation of catalase
Hoobler E.K., Rai G., Warrilow A.G., Perry S.C., Smyrniotis C.J., Jadhav A., Simeonov A., Parker J.E., Kelly
D.E., Maloney D.J., Kelly S.L., Holman T.R. 2013. Discovery of a novel dual fungal CYP51/human 5-li-
journal.pone.0065928
Isaacs M.L. 1922. A colorimetric determination of hydrogen peroxide. Journal of the American Chemical Society
44 (8): 1662-1663.
Mellon M.G. 1952. Fisher Award Address: A Century of Colorimetry. Analytical Chemistry 24 (6): 924-931.
Peizer L.R., Widelock D. 1955. A colorimetric test for measuring catalase activity of cultures of M. tuberculosis.
American Review of Tuberculosis and Pulmonary Diseases 71 (2): 305-313.
Razygraev A.V. 2020. A comparative study of catalase activity in Culiseta annulata (Schrank) and Culex pipiens L.
Razygraev A.V., Yushina A.D., Titovich I.A. 2018. Correction to: a method of measuring glutathione peroxidase
activity in murine brain: application in pharmacological experiment. Bulletin of experimental biology and
335
R Core Team 2019. R: A language and environment for statistical computing. Vienna, R Foundation for Statistical
Sim C., Denlinger D.L. 2011. Catalase and superoxide dismutase-2 enhance survival and protect ovaries during
overwintering diapause in the mosquito Culex pipiens. Journal of Insect Physiology 57 (5): 628-634. https://
doi.org/10.1016/j.jinsphys.2011.01.012
Tománková K., Luhová L., Petřivalský M., Peč P., Lebeda A. 2006. Biochemical aspects of reactive oxygen spe-
cies formation in the interaction between Lycopersicon spp. and Oidium neolycopersici. Physiological and
Torres W.H. 2002. Biología de las especies de oxígeno reactivas. Mensaje Bioquimico 26: 19-53.
Vera J.C. 1988. Measurement of microgram quantities of protein by a generally applicable turbidimetric procedure.
Wada J., Honda Y., Nagae M., Kato R., Wakatsuki S., Katayama T., Taniguchi H., Kumagai H., Kitaoka M., Yama-
moto K. 2008. 1, 2-α-L-Fucosynthase: a glycosynthase derived from an inverting α-glycosidase with an
A METHOD FOR MEASURING CATALASE ACTIVITY IN MOSQUITOES
BY USING AMMONIUM MOLYBDATE AND REACTION MEDIUM BUFFERED
WITH 3-(N-MORPHOLINO)PROPANESULFONIC ACID
A. V. Razygraev
Keywords: method, MOPS, hydrogen peroxide, enzyme, antioxidant function, Culiseta
annulata, Culex pipiens, Culicidae
SUMMARY
A method for measuring catalase activity, which was proposed by Peizer and Widelock
in 1955 and then, in simplified form, by Korolyuk and coauthors in 1988, was adapted
for measuring this activity in homogenates of mosquitoes. In this method, the decrease in
hydrogen peroxide concentration is measured by color reaction with ammonium molybdate.
In present modification, the method includes the use of the buffer based on MOPS (pH
7.4). Absorbance of yellow product at 410 nm is increased almost linearly with increase of
hydrogen peroxide concentration until approximately 8 mM, and linearity disappears with
further increase of hydrogen peroxide concentration. The initial concentration of hydrogen
peroxide in a reaction mixture, which was chosen for the method, was 8.2 mM, the dura-
tion of incubation was 4 min, the temperature of incubation was 25°С. At the activity value
less or equal to 0.72 mM H2O2 per min, the rate of decomposition of H2O2 under action
of catalase is almost constant during 4 min; the consumption of H2O2 is proportional to
concentration of protein of mosquito homogenate in reaction mixture. The results of mea-
suring specific catalase activity in mosquitoes by this method are in close correlation with
the results obtained by a direct measurement of hydrogen peroxide concentration decrease
in an ultraviolet range of wavelengths. The method is convenient for serial measurement of
catalase activity (up to 8 samples per series before the reaction termination by adding am-
monium molybdate). By applying this method, the differences in catalase activity between
some taxa in fam. Culicidae were revealed.
336