Журнал прикладной химии. 2019. Т. 92. Вып. 11
ОРГАНИЧЕСКИЙ СИНТЕЗ И ТЕХНОЛОГИЯ ОРГАНИЧЕСКИХ ПРОИЗВОДСТВ
УДК 66.092.097:547.563.4
КИСЛОТНОЕ РАЗЛОЖЕНИЕ ГИДРОПЕРОКСИДА пара-трет-БУТИЛКУМОЛА
ДО пара-трет-БУТИЛФЕНОЛА И АЦЕТОНА
© Е. М. Яркина, Е. А. Курганова*, А. С. Фролов, Г. Н. Кошель, Е. М. Денисова
Ярославский государственный технический университет,
150023, г. Ярославль, Московский пр., д. 88
* Е-mail: kurganovaea@ystu.ru
Поступила в Редакцию 22 января 2019 г.
После доработки 5 августа 2019 г.
Принята к публикации 20 августа 2019 г.
пара-трет-Бутилфенол — ценный продукт основного органического синтеза, который широко при-
меняется в различных отраслях промышленности. В работе исследованы закономерности процесса
кислотного разложения гидропероксида пара-трет-бутилкумола до пара-трет-бутилфенола и ацето-
на, которое является одной из ключевых стадий альтернативного метода получения пара-трет-бу-
тилфенола. Изучено влияние температуры, концентрации катализатора и начальной концентрации
гидропероксида пара-трет-бутилкумола на процесс его кислотного разложения. Выбраны условия,
обеспечивающие получение пара-трет-бутилфенола с выходом 92%. Составлена кинетическая модель
реакции кислотного разложения гидропероксида пара-трет-бутилкумола в присутствии концентри-
рованной серной кислоты, которая адекватно описывает экспериментальные данные и использована
для обоснования механизма реакции.
Ключевые слова: пара-трет-бутилкумол; гидропероксид пара-трет-бутилкумола; кислотное разло-
жение; пара-трет-бутилфенол; кинетическая модель
DOI: 10.1134/S0044461819110094
пара-трет-Бутилфенол является одним из основ-
В промышленности синтез пара-трет-бутилфе-
ных гомологов фенола, используемым в качестве по-
нола осуществляется алкилированием фенола изо-
лупродукта основного органического синтеза. Сфера
бутиленом в присутствии ионообменных смол типа
его применения постоянно расширяется, охватывая
КУ, а в последнее время с использованием макропо-
производство антиоксидантов, пестицидов, каучуков,
ристых сульфокатионитов типа Amberlyst при тем-
лаков, красок и в последнее время фармацевтиче-
пературе 100-110°С [3]. Недостатком этого метода
ских препаратов [1]. Перспективными направлениями
получения является низкая селективность (70-75%)
использования пара-трет-бутилфенола являются
образования пара-трет-бутилфенола, при этом на-
производство фенольной смолы 2402, применяемой
ряду с пара-трет-бутилфенолом образуются орто- и
в клееных изделиях из кожи, а также получение на
мета-изомеры трет-бутилфенола. Последние, как
его основе макроциклических соединений — каликс-
известно, имеют близкие с пара-трет-бутилфенолом
аренов [2].
температуры кипения, что существенно затрудняет
1427
1428
Яркина Е. М. и др.
выделение пара-трет-бутилфенола из реакционной
стадий: синтез пара-трет-бутилкумола алкилирова-
смеси с достаточно высокой степенью чистоты.
нием кумола трет-бутиловым спиртом, окисление
Решением данной проблемы может стать альтер-
пара-трет-бутилкумола до гидропероксида и по-
нативный метод получения пара-трет-бутилфенола
следующее кислотное разложение гидропероксида в
совместно с ацетоном, состоящий из трех основных
пара-трет-бутилфенол и ацетон по схеме
Ключевой стадией совместного получения па-
ком, конструкция которого практически полностью
ра-трет-бутилфенола и ацетона является кислотное
исключала унос реагентов. Смесь гидроперокси-
разложение гидропероксида пара-трет-бутилкумола.
да и ацетона нагревали до заданной температуры,
Несмотря на большой массив информации, каса-
которую поддерживали с помощью водяной бани.
ющейся закономерностей кислотного разложения
В момент достижения необходимой температуры в
гидропероксида втор-алкиларенов, в том числе и
реакционную массу при постоянном перемешива-
гидропероксида кумола [4], в фенол и карбонильные
нии добавляли расчетное количество 98% H2SO4.
соединения, аналогичные данные применительно
Через каждые 5 мин отбирали пробы (в количестве
к гидропероксиду пара-трет-бутилкумола в науч-
0.2-0.3 г) для анализа на содержание гидроперок-
но-технической литературе отсутствуют. Все выше-
сида. Определение гидропероксида пара-трет-бу-
изложенное определяет актуальность проведения
тилкумола проводили иодометрическим методом.
исследований, направленных на изучение закономер-
По окончании реакции продукты анализировали на
ностей реакции кислотного разложения гидроперок-
содержание пара-трет-бутилфенола и ацетона хро-
сида пара-трет-бутилкумола, основные результаты
матографическим методом. Хроматографический ана-
которых изложены в настоящей статье.
лиз проводили на хроматографе Хроматек-Кристалл
5000.2 с пламенно-ионизационным детектором.
Колонка капиллярная СК-5 длиной 30 м, диаметром
Экспериментальная часть
0.32 мм, заполнена смесью 5% фенила-95% диме-
Гидропероксид пара-трет-бутилкумола получен
тилполисилоксана. Расход газа-носителя — азота
аэробным окислением пара-трет-бутилкумола по
составлял 2 см3·мин-1. Программированный подъем
методике, описанной в работе [5]. Гидропероксид
температуры от 80 до 200°С проходил со скоростью
пара-трет-бутилкумола, выпавший в осадок при
8 град·мин-1. Для количественного анализа про-
охлаждении оксидата, отфильтровывали и сушили
дуктов кислотного разложения использовали метод
на воздухе при комнатной температуре. Полученный
внутреннего стандарта. пара-трет-Бутилфенол и
таким образом гидропероксид пара-трет-бутилку-
ацетон были выделены из продуктов реакции рек-
мола с содержанием основного вещества 98.5% имел
тификацией. На рис. 1 представлена хроматография
Тпл = 72°С. Структура гидропероксида пара-трет-бу-
продуктов кислотного разложении гидропероксида
тилкумола была подтверждена с помощью спектро-
пара-трет-бутилкумола.
скопии ЯМР 1Н. Спектр ЯМР 1Н (400 МГц), δ, м. д.
Синтезированный пара-трет-бутилфенол с содер-
(J, Гц): 1.35 м (9H, 3CH3t-Bu), 1.63 м (6H, 2CH3i-Pr),
жанием основного вещества 99.3% имел Тпл = 97.6°С.
7.28 с (1H, O-O-H), 7.42 м (4H, 4CHаром).
Структура полученного пара-трет-бутилфенола бы-
Кислотное разложение гидропероксида па-
ла подтверждена с помощью спектроскопии ЯМР 1Н.
ра-трет-бутилкумола проводили в среде ацетона в
Спектр ЯМР 1Н пара-трет-бутилфенола: 9.01 с (1H,
реакторе, снабженном мешалкой и пробоотборни-
ОН), 7.18 д (2H, бенз., 3J = 6.71), 6.68 д (2H, бенз.,
Кислотное разложение гидропероксида пара-трет-бутилкумола до пара-трет-бутилфенола и ацетона
1429
3J = 6.71); 1.2 м (9H, СН3). Спектр ЯМР 1Н записан с
использованием ЯМР-спектрометра Bruker DRX 400
(400.4 МГц). В качестве растворителя использована
смесь ДМСО-d6-CCl4, в качестве внутреннего этало-
на применялся тетраметилсилан.
Обсуждение результатов
Изучение влияния основных технологических
параметров на процесс кислотного разложения
гидропероксида пара-трет-бутилкумола до па-
ра-трет-бутилфенола и ацетона проводили в ин-
тервале температур 30-50°С в среде ацетона, при
этом начальная концентрация гидропероксида в нем
варьировалась от 0.026 до 0.132 моль·л-1. В качестве
катализатора реакции разложения была использована
концентрированная серная кислота, концентрация
которой изменялась от 0.3 до 1.5 мас% от загрузки
гидропероксида пара-трет-бутилкумола. За ходом
Рис. 1. Хроматограмма продуктов кислотного раз-
реакции кислотного разложения следили по расходу
ложения гидропероксида пара-трет-бутилкумола
при температуре 40°С, содержании катализатора 0.6
гидропероксида пара-трет-бутилкумола с использо-
мас% и начальной концентрации гидропероксида па-
ванием иодометрического титрования.
ра-трет-бутилкумола 30 мас%.
В этих условиях конверсия гидропероксида па-
ра-трет-бутилкумола достигает практически 100%, а
селективность образования пара-трет-бутилфенола
составляет приблизительно 90% (табл. 1).
Таблица 1
Влияние технологических параметров на процесс кислотного разложения гидропероксида
пара-трет-бутилкумола до пара-трет-бутилфенола и ацетона
Начальная
Концентрация
Начальная
Конверсия
Селективность
концентрация
катализатора
скорость
Температура,
Время,
гидропероксида
образования
гидропероксида
(H2SO4 конц.),
реакции
°С
мин
пара-трет-
пара-трет-
пара-трет-
мас% от загрузки
W0∙102,
бутилкумола, %
бутилфенола, %
бутилкумола, моль·л-1
гидропероксида
моль·л-1∙мин-1
0.065
30
35
0.28
84.6
87.1
40
0.6
1.03
99.0
88.3
35
50
15
2.31
98.7
89.5
0.065
40
0.3
55
0.53
98.7
89.7
0.6
55
1.02
100.0
89.4
0.9
20
1.56
98.7
87.9
1.5
15
2.64
99.3
87.3
0.026
0.26
97.1
89.6
0.065
40
0.6
35
0.96
99.3
89.3
0.132
1.91
95.0
91.0
1430
Яркина Е. М. и др.
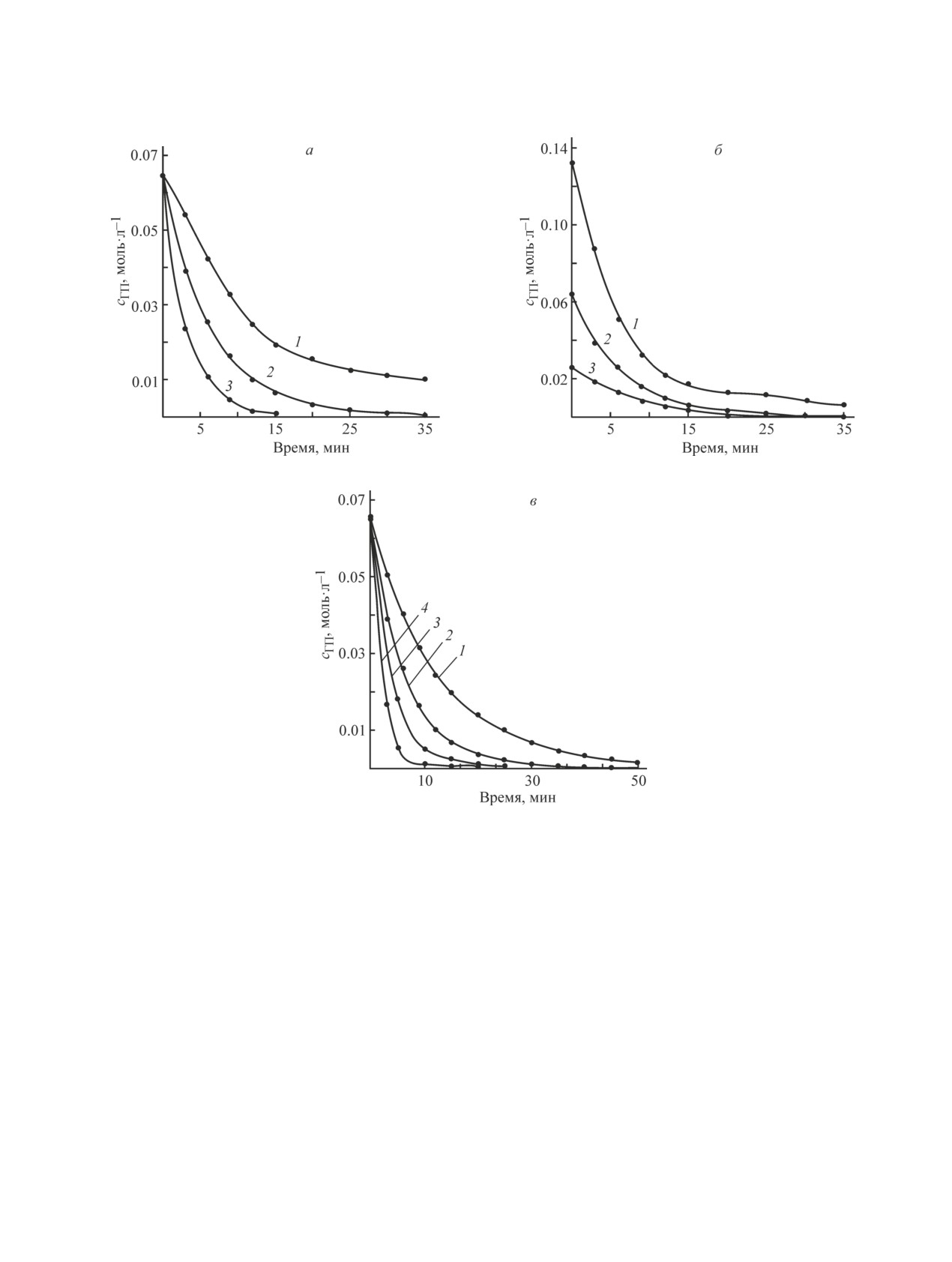
Рис. 2. Кинетические закономерности кислотного разложения гидропероксида пара-трет-бутилкумола при раз-
личных условиях.
а) Температура (°С): 1 — 30, 2 — 40, 3 — 50; концентрация катализатора 0.6 мас%.
б) Начальная концентрация гидропероксида (моль·л-1): 1 — 0.132, 2 — 0.065, 3 — 0.026; температура 40°С; концентрация
катализатора 0.6 мас%.
в) Концентрация катализатора (мас%): 1 — 0.3, 2 — 0.6, 3 — 0.9, 4 — 1.5; температура 40°С.
Кинетические кривые кислотного разложения
тельной к кинетической кривой в начальный момент
гидропероксида пара-трет-бутилкумола (рис. 2)
времени.
имеют сложный характер и не могут быть описаны
Исследования показали, что с увеличением тем-
ни одним уравнением для реакций простых типов.
пературы от 30 до 50°С наблюдается повышение на-
Изучение кинетики проводили по начальным ско-
чальной скорости реакции кислотного разложения
ростям W0, поскольку в начальный момент времени
гидропероксида пара-трет-бутилкумола примерно в
концентрация продуктов реакции мала и их влияние
8 раз. Наиболее предпочтительной температурой для
на скорость разложения незначительно. Начальные
проведения кислотного разложения гидропероксида
скорости определяли по тангенсу угла наклона каса-
пара-трет-бутилкумола является 40°С.
Кислотное разложение гидропероксида пара-трет-бутилкумола до пара-трет-бутилфенола и ацетона
1431
Таблица 2
Материальный баланс процесса кислотного разложения гидропероксида пара-трет-бутилкумола
с начальной концентрацией 0.132 моль·л-1 в ацетоне
Время реакции 45 мин, температура 40°С; концентрация катализатора 0.6 мас% от загрузки гидропероксида
Приход
Расход
Молярная масса,
Вещество
г·моль-1
г
мас%
г
мас%
Гидропероксид пара-трет-бутилкумола
208
23.70
30.00
0.00
0.29
Серная кислота
98
0.14
0.18
0.14
0.18
Ацетон
58
55.15
69.82
60.10
75.86
пара-трет-Бутилфенол
150
0.00
0.00
15.80
19.94
Побочные продукты
—
0.00
0.00
2.05
2.59
Потери
—
0.00
0.00
0.90
1.14
Всего
—
78.99
100.00
78.99
100.00
Установлено, что увеличение концентрации ката-
подтвердивший получение пара-трет-бутилфенола
лизатора с 0.3 до 1.5 мас% от загрузки гидроперок-
с выходом 92.8% при конверсии гидропероксида па-
сида приводит к повышению начальной скорости
ра-трет-бутилкумола 100% (табл. 2).
реакции в 5 раз, однако практически не оказывает
Для обоснования механизма была составлена ки-
влияния на выход пара-трет-бутилфенола.
нетическая модель процесса кислотного разложения
Важным фактором, оказывающим влияние на
гидропероксида пара-трет-бутилкумола, включаю-
процесс кислотного разложения, является началь-
щая стадии образования димера гидропероксида и
ная концентрация гидропероксида пара-трет-бу-
комплексов гидропероксида с пара-трет-бутилфе-
тилкумола. Из данных табл. 1 видно, что с изме-
нолом и ацетоном. Вероятность образования таких
нением начальной концентрации гидропероксида
комплексов и их большая реакционная способность
с 0.026 до 0.132 моль·л-1 наблюдается повышение
по сравнению с распадом индивидуального гидро-
начальной скорости реакции кислотного разложе-
пероксида доказана в большом числе работ [4, 6-9].
ния примерно в 7 раз. Наиболее предпочтительной
В ходе процесса сернокислотного разложения имеет
является начальная концентрация гидропероксида
место параллельное протекание реакций разложе-
пара-трет-бутилкумола 0.132 моль·л-1. Ввиду того
ния гидропероксида, его димеров и комплексов с
что процесс кислотного разложения гидропероксида
продуктами разложения. Реакция относится к слож-
пара-трет-бутилкумола протекает с выделением
ным процессам, для которых характерен одновре-
большого количества тепла, дальнейшее повышение
менно и автокатализ, и ингибирование продуктом
начальной концентрации гидропероксида является
реакции.
небезопасным.
Таким образом, кинетическая модель процесса
На основании полученных данных рекомендованы
разложения гидропероксида пара-трет-бутилкумола
следующие условия проведения процесса разложения
может быть представлена в следующем виде:
гидропероксида пара-трет-бутилкумола: продолжи-
тельность реакции 45 мин, температура 40°С, началь-
ГП + OHK1ГП…OH,
ная концентрация гидропероксида пара-трет-бу-
ГП + AK2ГП…A,
тилкумола в ацетоне 0.132 моль·л-1. В выбранных
условиях проведен балансовый опыт, по результатам
ГП + ГПK3ГП…ГП,
которого составлен материальный баланс кислотного
разложения гидропероксида пара-трет-бутилкумола,
H2SO4 + AK4H2SO4…A,
1432
Яркина Е. М. и др.
Таблица 3
Значения констант уравнения (7) кислотного разложения гидропероксида пара-трет-бутилкумола
при температуре 40°С
k1
k2
k3
k4
K4
а
b
n
л·моль-1·с-1
10.1
33.4
269.8
11.5
0.1
11.9
14.2
1
ГПH+k1OH + A,
сII = K2сГПсA,
(4)
IH+k2OH + A,
сIII = K3сГП2,
(5)
IIH+k3OH + A,
сIV = K4сКсA,
(6)
IIIH+k4OH + A,
где cК — текущая концентрация катализатора; c0К —
начальная концентрация катализатора; cΙ, cΙΙ, cΙΙΙ,
где K1, K2, K3, K4 — константы равновесия образо-
cΙV — текущие концентрации комплексов Ι, ΙΙ, ΙΙΙ, ΙV;
вания комплексов Ι-ΙΙΙ, ΙV; k1, k2, k3, k4 — константы
c0ГП — начальная концентрация гидропероксида; cГП,
скорости распада гидропероксида и комплексов Ι, ΙΙ,
cОН, cА — текущие концентрации гидропероксида,
ΙΙΙ; ГП — гидропероксид; ОН — пара-трет-бутил-
пара-трет-бутилфенола и ацетона.
фенол; А — ацетон.
Общая скорость реакции представляет собой
Ввиду малых величин констант равновесия об-
сумму скоростей разложения гидропероксида и его
разования комплексов I-III, что было установлено
комплексов с продуктами реакции, которые пропор-
ранее [6], можно допустить, что их концентрации
циональны концентрации катализатора в степени n
значительно меньше начальной концентрации гидро-
и соответственно концентрации гидропероксида и
пероксида, тогда уравнение материального баланса
указанных комплексов:
по гидропероксиду будет иметь вид
c0ГП = сГП + (сОН + сА)/2, сОН = сА,
(1)
с0К = сК + сIV,
(2)
где n — порядок реакции по катализатору.
сI = K1сГПсОН,
(3)
С учетом уравнений (1)-(6) окончательно имеем
(7)
реакции определялся графическим методом по тан-
где
генсу угла наклона логарифмической зависимости
Для решения дифференциального уравнения бы-
начальной скорости реакции от концентрации ката-
ли использованы численные методы, с помощью
лизатора.
которых получена зависимость сГП = f(τ) (рис. 3).
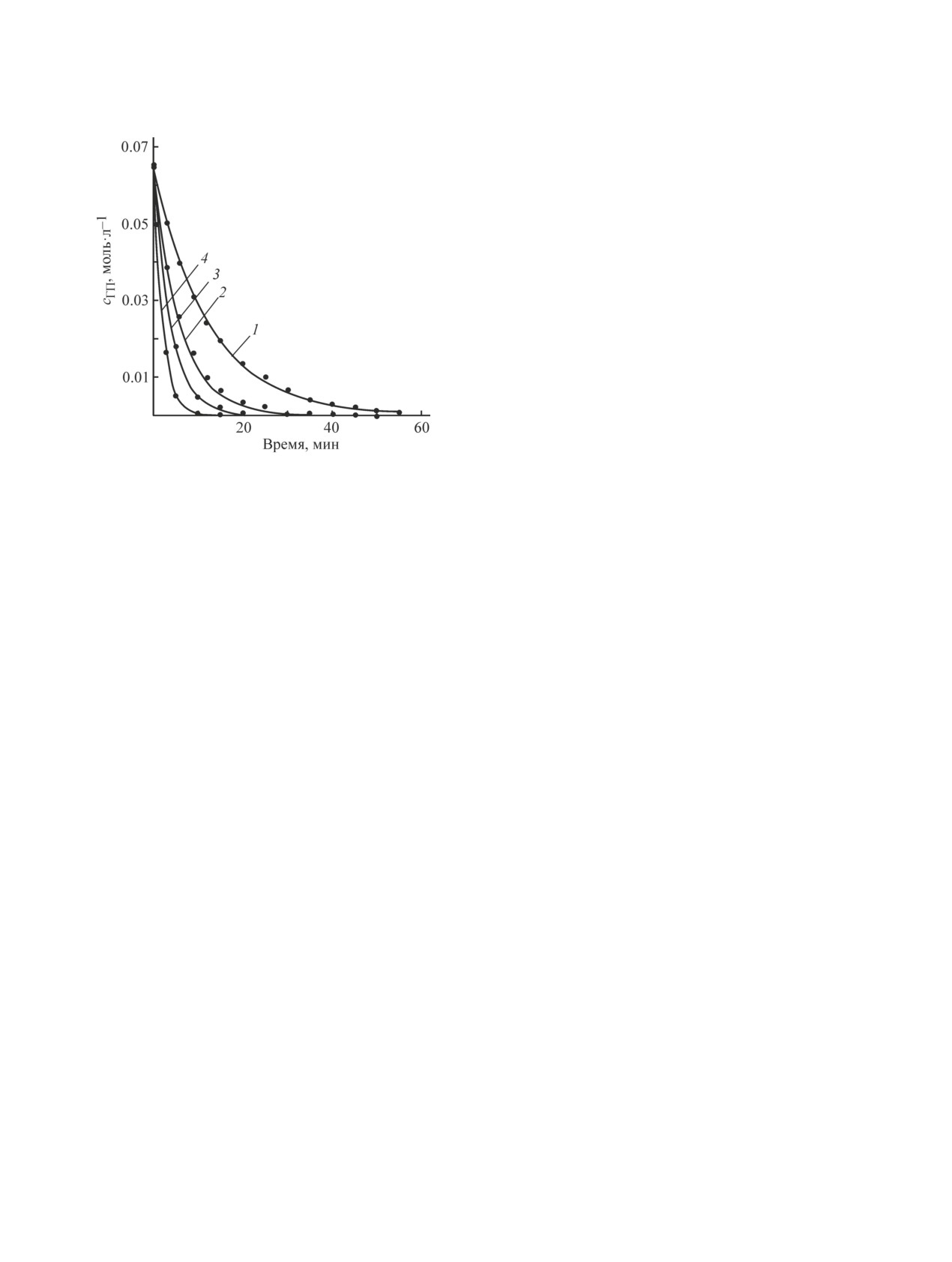
Из данных рис. 3 видно, что уравнение (7) адекват-
Константы скорости реакции кислотного разложе-
но описывает процесс кислотного разложения гидро-
ния гидропероксида пара-трет-бутилфенола пред-
пероксида пара-трет-бутилкумола. Достоверность
ставлены в табл. 3. Установлено, что реакция раз-
аппроксимации каждой кинетической кривой состав-
ложения гидропероксида пара-трет-бутилфенола
ляла R2 ≈ 0.99. Погрешность измерения констант не
имеет первый порядок по катализатору. Порядок
превышала ±4%.
Кислотное разложение гидропероксида пара-трет-бутилкумола до пара-трет-бутилфенола и ацетона
1433
Информация об авторах
Яркина Елизавета Михайловна, ORCID: https://
orcid.org/0000-0001-9719-3467
Курганова Екатерина Анатольевна, д.х.н., ORCID:
Фролов Александр Сергеевич, к.х.н., ORCID:
Кошель Георгий Николаевич, д.х.н., проф., ORCID:
Денисова Евгения Михайловна, ORCID: https://
orcid.org/0000-0003-3897-0347
Список литературы
[1] Saha M., Hossain M. K., Ashaduzzama M., Afroza S. T.,
Galib M., Sharif N. Alkylation of phenol with olefins
Рис. 3. Кинетические кривые реакции кислотного раз-
in the presence of sulphuric acid // Bangladesh J. Sci.
ложения гидропероксида пара-трет-бутилкумола при
различной концентрации катализатора.
org/10.3329/bjsir.v44i1.2722
Линия — расчетная зависимость по уравнению (7), точ-
[2] Atwood J. L., Barbour L. J., Thallapally P. K., Wir-
ки — экспериментальные.
Концентрация катализатора (H2SO4 конц.) (мас%): 1 — 0.3,
sig T. B. A crystalline organic substrate absorbs methane
2 — 0.6, 3 — 0.9, 4 — 1.5.
under STP conditions // Chem. Commun. 2005. P. 51-
53. DOI: 10.1039/B416752J
[3] Воронин И. О., Нестерова Т. Н., Стрельчик Б. С.,
Выводы
Журавский Е. А. Сравнение эффективности суль-
На основании проведенных исследований влияния
фокатионитов, применяемых в производстве
различных технологических параметров на процесс
пара-трет-бутилфенола, на основе кинетиче-
сернокислотного разложения гидропероксида па-
ского исследования переалкилирования в систе-
ра-трет-бутилкумола до пара-трет-бутифенола и
ме фенол-трет-бутилфенол // Кинетика и ката-
лиз. 2014. Т. 55. № 6. С. 723-729. DOI: 10.7868/
ацетона можно заключить, что оптимальными услови-
S045388111406015X [Voronin I. O., Nesterova T. N.,
ями проведения этой реакции являются температура
Zhuravskii E. A., Strelchik B. S. Efficiency of sulfonic
40°С, продолжительность реакции 45 мин, начальная
cation-exchange resins used in para-tert-butylphenol
концентрация гидропероксида пара-трет-бутилку-
production: A comparison based on the kinetics of
мола в ацетоне 0.132 моль·л-1 и концентрация серной
transalkylation in the phenol-tert-butylphenols system
кислоты 0.6 мас%. В данных условиях может быть по-
лучен пара-трет-бутилфенол с выходом более 90%.
org/10.1134/S0023158414060147].
Из результатов математического моделирова-
[4] Закошанский В. М. Фенол и ацетон: Анализ техноло-
ния можно сделать вывод о том, что образование
гий, кинетики и механизма основных реакций. СПб:
пара-трет-бутилфенола происходит главным об-
Химиздат, 2009. C. 149-189.
разом за счет распада комплекса гидропероксида па-
[5] Курганова Е. А., Дахнави Э. М., Кошель Г. Н.
ра-трет-бутилфенола и ацетона, о чем свидетель-
Окисление изопропилбензола до гидропероксида в
ствует высокое значение константы скорости распада
присутствии N-гидроксифталимида // Нефтехимия.
2017. Т. 57. № 2. С. 204-208. DOI: 10.7868/
этого комплекса (k3), что согласуется с выводами,
S0028242117020113 [Kurganova E. A., Koshel′ G. N.,
сделанными ранее при исследовании закономерно-
Dakhnavi E. M. Oxidation of isopropylbenzene to
стей кислотного разложения гидропероксида цикло-
hydroperoxide in the presence of N-hydroxyphthalimide
гексилбензола [6, 7], а также в работе [9].
// Petrol. Chem. 2017. V. 57. N 3. P. 262-266. https://
doi.org/10.1134/S0965544117020189].
[6] Кошель Г. Н., Глазырина И. И., Бычков Б. Н., Фар-
Конфликт интересов
беров Н. И. Кислотное разложение гидропереки-
Авторы заявляют об отсутствии конфликта инте-
си фенилциклогексана // ЖПХ. 1978. Т. 51. № 10.
ресов, требующего раскрытия в данной статье.
С. 2325-2329.
1434
Яркина Е. М. и др.
[7] Глазырина И. И., Шапиро Ю. Е., Кошель Г. Н.,
Шутова И. В. Изучение комплексообразования
org/10.1007/BF02068990
гидроперекиси фенилциклогексана с ацетони-
[9] Vodnár J., Fejes P., Varga K., Berger F. Decomposition
трилом, фенолом и циклогексаноном ЯМР-1Н-
of organic hydroperoxides on cation exchangers
спектроскопией // ЖОрХ. 1979. Т. 49. № 2. С. 444-
Kinetic pathway ofp-tert-butylcumene hydroperoxide
448.
decomposition // Appl. Catal. A: General. 1995.
[8] Vodnár J. Decomposition of organic hydroperoxides
on cation exchangers, III decomposition mechanism
860X(94)00212-6
of cumene hydroperoxide // React. Kinet. Catal.